Method Article
再生医療のための高保存ヒト無細胞皮膚マトリックスの調製のための脱細胞化
* これらの著者は同等に貢献しました
要約
脱細胞化したヒトの皮膚は、組織再生に適しています。脱細胞化の主な問題は、構造タンパク質、グリコサミノグリカン(GAG)、および成長因子の適切な含有量とともに、天然構造の保存です。提案された方法は、迅速かつ効果的な脱細胞化を可能にし、保存状態の良い天然の特徴を持つ脱細胞化した皮膚を作り出すことができます。
要約
細胞外マトリックス(ECM)は、多様な生理活性分子の含有量により、周囲の細胞の自己複製、増殖、生存、および分化をサポートするための生物物理学的および生化学的刺激を提供します。これらの特性により、ECMは最近、組織再生を促進するための生物学的足場の作成の有望な候補と見なされています。新たな研究では、脱細胞化したヒト組織は、その構造的および生化学的プロファイルにおいて天然のECMに類似しており、3次元(3D)構造と基本的な生体分子の含有量を保持できることが実証されています。したがって、脱細胞化ECMは、多くの臓器の組織リモデリング、修復、および機能再建を促進するために採用できます。適切な脱細胞化手順を選択することは、細胞にとって理想的な微小環境の特性を保持する無細胞組織を得るために重要です。
ここで説明するプロトコルは、再現性があり効果的な無細胞生物学的ECMを得るための脱細胞化法の詳細な段階的説明を提供します。形成外科手術を受けた患者の皮膚片を縮小し、ドデシル硫酸ナトリウム(SDS)、Triton X-100、および抗生物質の組み合わせを使用して脱細胞化しました。サンプルを介した溶液の定期的かつ均質な輸送を促進するために、サンプルは機械的損傷からの保護を確保するために、埋め込みカセットに封入されました。脱細胞化処置後、皮膚片の雪白色は、完全で成功した脱細胞化を示しました。さらに、脱細胞化したサンプルは、無傷で保存状態の良い構造を示しました。この結果は、提案された脱細胞化法が効果的で、迅速で、再現性があり、サンプルを構造上の損傷から保護したことを示唆しています。
概要
ECMは、細胞の足場として機能し、さまざまなコンポーネントによって維持される複雑な構造を通じて細胞を支え、心臓および心臓組織機能の機械的特性に関与する主要な要因の1つです1,2。ECMが組織リモデリングにおいて積極的な役割を果たすことを示唆する証拠が増えており、ECMが受動部品であるという従来の仮定は時代遅れになっている3,4,5,6。ECMの役割は、常在する細胞に生物物理学的および生化学的な手がかりを提供することです。これらのシグナルが多くの基本的な細胞挙動に影響を及ぼし、それらの収縮機能、増殖、移動、および分化電位に影響を与えることは十分に確立されています7,8,9。したがって、ECMは、治療支援ツールとして組織工学および再生医療でますます採用されています9,10,11,12,13。
ECMは、コラーゲン、エラスチン、フィブロネクチン、プロテオグリカン、ラミニンなどのいくつかのタンパク質とECM結合成長因子からなり、これらはすべて細胞の動員、遊走、分化などの再生メカニズム、ならびに細胞の整列と増殖に関与している14。組織の機械的特性は、臓器の生理病理学にも大きな関連性があります。実際、機械的特性の変化は、多くの場合、いくつかの疾患の発症と進化に関連しています。その理由は、ECMが改変されると、環境から来るシグナルが遺伝子やタンパク質の発現に変化を誘発し、機能障害につながるという事実にある15,16。
臓器修復のための再生治療は、現在、天然組織の洗練された微小環境を再現して、体が機能していない臓器を癒すことに焦点を当てています。多くの組織工学的アプローチが急速に進んでいるにもかかわらず、人工的な手順では、組織全体を複雑に正確に再現することはできません。合成材料は、細胞微小環境の機械的および生化学的特性をシミュレートするために適切に調整できるため、これまで主に使用されてきました。それにもかかわらず、天然組織内の多数の相互作用を模倣できないこと、それらを製造するための技術のコスト、およびそれらが天然組織17,18,19よりも自然で生体適合性が低いという事実など、それらには限界があります。さらに、それらの組成は、主にタンパク質と可溶性因子の点で、複製が非常に難しい天然のものとは大きく異なります20。
再生医療において、必要とする患者と臓器移植とのギャップを縮めるための最先端のアプローチは、脱細胞化細胞外マトリックス(d-ECM)でできた足場を作り、損傷した臓器を再生するための適切な細胞種を再形成することです。脱細胞化は、ECMがその天然細胞および遺伝物質から単離され、天然の生体模倣的な足場を生成するプロセスであり、患者に移植された免疫応答および拒絶反応を回避することができる21,22,23。このようにして得られたECMは、次に機能組織を産生するために再増殖することができます。d-ECMを開発する際の大きな課題は、その手法です。脱細胞化技術では、主な目標は天然のECM組成、剛性、および3D構造を維持することであり、すべての戦略には長所と短所の両方があります。組織から細胞内容物とDNAを除去するには、化学的または物理的薬剤、あるいはその両方の組み合わせを使用する必要があるため、各脱細胞化手順は、程度の差こそあれ、ECMの混乱を引き起こします。したがって、ECM 24,25,26 の損傷を最小限に抑えることが重要です。
ネイティブECMをin vitroで再構成するためのプラットフォームとして、ネイティブECMの利用が強く望まれます。この目的のために、いくつかの脱細胞化プロトコルが広範囲の組織に適用されている27、28、29、30。実際、脱細胞化研究とECM開発の初期段階から、動物とヒトの両方の動脈、大動脈弁、末梢神経などのいくつかの組織が脱細胞化されており、一部のd-ECMはまだ市販されており、組織置換または創傷治癒に使用されています31,32,33.最近、ヒトの皮膚は、その組成と機械的特性により、心臓前駆細胞(CPC)の再生能力を高め、心臓の収縮性に適応することができるため、心臓修復のための脱細胞化足場を製造するのに適した候補としても浮上しています34。この論文では、成人のヒト皮膚から脱細胞化スキャフォールドを作製するためのシンプルで迅速なプロトコルについて説明し、保存状態の良いアーキテクチャを持つd-ECMの開発を可能にします。
プロトコル
ヒト組織からの標本は、ヘルシンキ宣言の原則に従って収集され、大学病院「フェデリコ2世」のガイドラインを遵守しました。この研究に関与したすべての患者は、書面による同意書を提出しました。
1. 溶液の調製
- 1200 mLの1%脱細胞化溶液の調製
- メスシリンダー内で588 mLの二蒸留水を測定し、1 Lビーカーに移すことにより、600 mLの2% Triton X-100溶液を調製します。血清ピペットを使用して、12 mLのTriton X-100と攪拌棒をビーカーに加えます。ビーカーをマグネチックスターラーに置き、Triton X-100が完全に溶解するまで溶液を混合します。
- 動揺を止めてください。攪拌子レトリーバーを使用して攪拌棒を取り外します。室温で保存してください。
- メスシリンダー内で550 mLの再蒸留水を測定し、1 Lビーカーに移して、600 mLの2%SDS溶液を調製します。
- プラスチック製の計量ボートで12 gのSDS粉末を計量し、ステップ1.1.3で二重蒸留水が入ったビーカーに移します。
注意: ステップ1.1.4は化学フードの下で実行する必要があり、ユーザーは個人用保護具を着用する必要があります。 - 攪拌棒を追加し、ビーカーをマグネチックスターラーに置き、SDSが完全に溶解するまで溶液を混合します。
- 攪拌プロセスを停止します。攪拌子レトリーバーを使用して攪拌棒を取り外します。
- 溶液をメスシリンダーに移し、再蒸留水を加えて容量を600mLに調整します。
- ステップ1.1.1で調製した2%Triton X-100溶液を2Lシリンダーに注ぎます。
- ステップ1.1.3-1.1.7で調製した2%SDS溶液を同じ2Lシリンダーに注ぎ、総容量1200mLを得る。
- パラフィルムで覆い、反転して穏やかに混合し、均質な溶液を得る。
- 泡の形成を避けるために、漏斗を使用して混合溶液を2Lボトルに移します。溶液を+4°Cで保存します。
- 1xリン酸緩衝生理食塩水(PBS)の調製
- 0.1 gのリン酸カリウム一塩基性、0.1 gの塩化カリウム、4.0 gの塩化ナトリウム、および0.575 gのリン酸二塩基性ナトリウムを滅菌二重蒸留水に溶解して、500 mLの1xリン酸緩衝生理食塩水(PBS)を調製します。pH値(7.4)を確認してください。
- 使用するまで+4°Cで保管してください。
- 抗生物質溶液の調製
- プラスチック製の計量ボートで625μgのアムホテリシンBを計量します。
- ペニシリンとストレプトマイシン(ペン/連鎖球菌)の混合物8mLを15mLのチューブにピペットで移します。
- 秤量したアンホテリシンBをペン/連鎖球菌混合物に加え、ペニシリンとストレプトマイシン(ペン/連鎖球菌)混合物を加えて容量を10mLに調整します。チューブにキャップをし、アンホテリシンBを激しく振って溶かします。
2. 1日目 - 脱細胞化手順を開始します。
- 400mLの脱細胞化溶液を500mLのビーカーに注ぎます。
- 抗生物質溶液2.0mLを加えます。
3.皮膚サンプルの調製
- 腹部形成術を受ける患者の腹部からヒトの皮膚サンプルをプラスチックトレイで洗浄し、0.9%NaCl等張性生理液でシャックして逆さまにして、余分な血液やその他の体液を取り除きます。
- 細い鉗子で毛を取り除き、大きな手術用ハサミで脂肪を取り除きます。
- 皮膚サンプルを解剖ボードに置き、メスを使用して解剖し、解剖ボードの目盛りを基準にして3 cm x 2.5 cmの断片(長さ×幅)を取得し、組織の傷跡や汚れた部分や火傷した部分を避けます。
- 各フラグメントを包埋カセットに入れて閉じ、脱細胞化手順中にサンプルが漏れないように、すべてのカセットが適切にロックされていることを確認します。
- サンプルが入った包埋カセットを最大4つまで、脱細胞化溶液を入れたビーカーに入れます。攪拌棒を追加します。アルミホイルで覆い、サンプルと手順の開始時間を特定するためのすべての情報を上部に書き込みます。
- ビーカーをマグネチックスターラーに置き、150rpmの回転速度で攪拌を開始します。動揺を止めてください。ビーカーを覆っているアルミホイルをはがし、長い鉗子で埋め込みカセットを取り出します。
注:攪拌を止めた後、溶液の透明度を確認してください。細胞の破片の放出による曇りの程度に基づいて、攪拌の持続時間(8時間未満または8時間以上)を変更します。 - 各カセットを100mmの皿に入れます。ステップ3.5〜3.6を一晩繰り返して、脱細胞化溶液を交換します。
4. 2日目 - 皮膚サンプルの状態を確認します。
- 攪拌プロセスを停止します。ビーカーを覆っているアルミホイルをはがし、長い鉗子で埋め込みカセットを取り出します。
- 各カセットを100mmの皿に入れて開きます。サンプルの色を確認してください。
注:サンプルでは、ネイティブベージュから白雪姫への色の変化が示される場合があります。 - 残った毛を取り除き、真皮から表皮を剥がします。ステップ3.5-3.6を繰り返して脱細胞化溶液を交換します。
- 8時間後に攪拌を停止します。サンプルが真っ白になるまで、手順4.1〜4.2を繰り返します。脱細胞化手順を停止します。
注意: 洗剤の作用にさらされる時間は、必要に応じて延長できます。 - 500 mLのシリンダーで1x PBSを400 mL測定し、500 mLのビーカーに注ぎ、ペン連鎖球菌/アムホテリシンB混合物を2 mL加えます。.攪拌棒を追加します。
- 各ビーカーにサンプルを含む最大4つのカセットを1x PBS/抗生物質溶液と一緒に入れます。アルミホイルで覆い、手順3.5のように上部にすべての情報を書き込みます。
- ビーカーをマグネチックスターラーに置き、室温で一晩中150rpmの回転速度で攪拌を開始します。
5. 3日目 - サンプルの最終洗浄
- 動揺を止めてください。1x PBS溶液を400 mLの再蒸留水と交換します。攪拌棒を追加します。アルミホイルで覆い、手順3.5のようにすべての情報を上に書き込みます。
- ビーカーをマグネチックスターラーに置き、150rpmの回転速度で30分間攪拌を開始します。
- 攪拌プロセスを停止します。ビーカーを覆っているアルミホイルをはがし、長い鉗子で埋め込みカセットを取り出します。
- 脱細胞化した皮膚サンプルが入った各包埋カセットを100 mmのディッシュに入れます。カセットを開き、皮膚サンプルを実験室のワイプで軽くたたいて、皮膚サンプルをやさしく乾かします。
- 脱細胞化した各皮膚サンプルを、サンプルに関する情報を事前にタグ付けした計量ボートに入れます。ボートをアルミホイルで覆い、サンプルを識別するために上部にすべての情報を書き込みます。-80°Cで保存してください。
結果
このプロトコールの目的は、生体組織から皮膚のd-ECMサンプルを取得し、よく組織化された3D構造と生体分子の良好な保存含有量を維持することでした(図1)。この方法は、主にTriton X-100とSDSの2つの界面活性剤を組み合わせた溶液中でサンプルを絶えず攪拌することに基づいており、天然組織に特有の生物学的および構造的特徴を維持し、脱細胞化プロセス中の曝露時間を短縮します。受領後、サンプルを洗浄して手順の準備を行い、髪の毛や脂肪組織を含まない3 cm x 2.5 cmのきれいな皮膚片を取得しました(図2および図3)。埋め込みカセットを使用することで、組織破壊を最小限に抑えることができ(図3)、より無傷の構造を持つサンプルが得られます。脱細胞化した皮膚は、肉眼観察後に重大な機械的または化学的損傷の兆候を示さなかった。表皮は脱細胞化手順中に剥離し(図4A、B)、サンプルの色は、全天然組織に典型的なベージュ色から白雪姫に変わり、完全で成功した脱細胞化を示しました(図4C)。

図 1: プロトコルのワークフロー。この図の拡大版を表示するには、ここをクリックしてください。

図2:受領時の皮膚サンプル調製の代表的な画像。(B、C)解剖板に載せたサンプルの巨視的評価。(D-F)大型の手術用ハサミを使用して脂肪組織を切除します。この図の拡大版を表示するには、ここをクリックしてください。

図3:皮膚サンプルの解剖と埋め込みカセットへの配置(A)細い鉗子で脱毛した髪。(B-E)メスを使用して皮膚サンプルを解剖し、埋め込みカセットに収まる3 cm x 2.5 cmの断片を取得しました。(F、G)埋め込みカセットに入れられた皮膚の破片。この図の拡大版を表示するには、ここをクリックしてください。
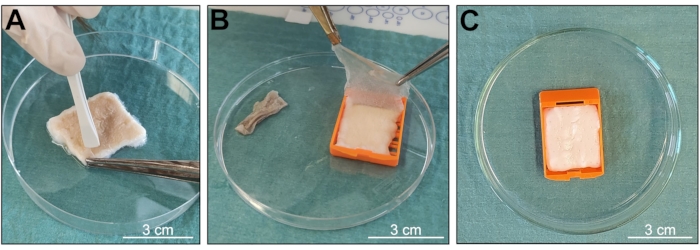
図4:脱細胞化中のサンプルの状態の確認。 (A、B)真皮からの表皮の剥離。(C)脱細胞化の発生を示すサンプルの色の変化。スケールバー= 3 cm. この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
上記のプロトコルは、以前に公開されたプロトコルと比較して最適化および改善されていますが、注意と精度が必要ないくつかの重要な手順を示しています。脱細胞化溶液の調製中は、洗剤の誤った希釈を防ぐために、泡の形成を回避する必要があります。これは、溶液を穏やかに注ぎ、シリンダーの内側に沿って流れるようにすることで対処できます。また、Triton X-100やSDSなどの界面活性剤を用いた脱細胞化では脂肪が除去されず、脂質残骸が効果に悪影響を及ぼす可能性があるため、手作業で試料から脂肪組織を採取する場合は注意が必要です。もう一つの重要なステップは、サンプルから表皮を除去することです。脱細胞化の間、表皮は徐々に皮膚表面から離れます。この段階では、完全に掃き出された場合にのみ鉗子で剥がすことが重要であり、したがって、引き裂かれたり細断されたりしてサンプル内に破片が閉じ込められるのを防ぎます。
このプロトコルは、2つの主要な戦略によってサンプルに対する脱細胞化の影響を減らすことに焦点を当てています:2つの洗剤を組み合わせて使用することによる手順への曝露時間の短縮28,35,36と、サンプルを埋め込みカセット37に包み込むことにより、サンプルを機械的損傷から保護すること.さらに、この手順は、ヒトやブタの心筋や血管など、皮膚以外のサンプルに適用した場合にも成功した結果をもたらしています。ここで説明するプロトコルの有効性の評価は、主にサンプルの巨視的観察によって行われ、ベージュから白雪姫への色の顕著な変化を示します。確かに、d-ECMの品質を評価するためには、細胞の破片や残留遺伝物質の除去、構造タンパク質や生体分子含有量の保存、機械的特性の保持など、他のいくつかの側面を評価する必要があります34,37,38。細胞の破片や遺伝物質の除去は、コンストラクトの免疫原性を低下させるために重要です。したがって、これらの成分を除去することの有効性を評価するためのいくつかの基準は、文献で十分に確立されています:d-ECMは、ECM乾燥重量1mgあたり50ng以下の二本鎖DNA(dsDNA)39を持たなければならず、核物質が顕微鏡で見えてはなりません。
これらの基準を満たすためには、巨視的データを裏付けるために、Di Meglioら38 で説明されているように、残留DNA含有量の評価とヘマトキシリンおよびエオシンによる染色を実施する必要があります。さらに、コラーゲン、フィブロネクチン、ラミニンなどの構造タンパク質を、グリコサミノグリカンや成長因子とともに検出することによるECM保存の評価も適切である34。最後に、d-ECMの機械的特性は、天然組織40のものと一致するべきである。この手順の有効性と実現可能性は、望ましい脱細胞組織を得ることが実証されていますが、この方法にはいくつかの制限があります。例えば、一度に数個のサンプル(ビーカーごとに4個)の脱細胞化が可能になるため、溶液のかなりの浪費につながります。一方では、埋め込みカセットの使用は、サンプルの保護と保存に役立ちます。一方、オペレーターはカセットに収まる小さなサイズのサンプルのみを脱細胞化する必要があります。別の制限は、得られたd-ECMの微生物汚染の可能性です。この手順には抗生物質の添加が含まれますが、使用前にd-ECMをUVで滅菌することを強くお勧めします。最後に、手順全体を通じて必要なインキュベーションを正確に計算し、時間を最適に管理するために整理する必要があります。
このプロトコルは、実験室で他のプロトコルをテストしているときに観察された欠点に対処するために開発されました。既存のプロトコルは、組織の適切な完全性を保証することなく、さまざまな程度の脱細胞化を許容し、したがって、必須の生体分子および機械的特性のかなりの損失を伴う41。脱細胞化後のECMの構造と組成の保存は基本的な側面であり、d-ECMは足場として機能し、一度再増殖すると、臓器内の細胞再生メカニズムをサポートします。脱細胞化プロセスを最適化することにより、ヒトの皮膚に由来する生物学的足場を再生医療に活用し、臓器移植を必要とするドナーと患者との間のギャップを最小限に抑えるのに役立ちます。さらに、ヒト人工多能性幹細胞由来細胞の細胞再細胞化法および応用の進歩は、適切な細胞型42,43の分布を改善し、再生プロセス44を可能にするであろう。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
何一つ
資料
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl isotonic Physiological solution | Sigma-Aldrich | S8776 | 0.9% in water |
| 1 L beaker | VWR | 511-0318 | Clean and autoclave before use |
| 10 mL serological pipet | Falcon | 357551 | Sterile, polystyrene |
| 100 mm plates | Falcon | 351029 | Treated, sterile cell culture dish |
| 15 mL sterile tubes | Falcon | 352097 | Centrifuge sterile tubes, polypropylene |
| 1 L graduated cylinder | VWR | 612-1524 | Clean and autoclave before use |
| 2 L bottle | VWR | 215-1596 | Clean and autoclave before use |
| 25 mL serological pipet | Falcon | 357525 | Sterile, polystyrene |
| 2 L graduated cylinder | VWR | 612-3072 | Clean and autoclave before use |
| 500 mL beaker | VWR | 511-0317 | Clean and autoclave before use |
| Amphotericin B | Sigma-Aldrich | Y0000005 | Powder |
| Dissecting board | VWR | 100498-398 | Made of high-density polyethylene. |
| Dissecting scalpel | VWR | 233-5526 | Sterile and disposable |
| Embedding cassettes | Diapath | 070191 | External dimensions: 40x26x7 mm (WxDxH) |
| Fine forceps | VWR | 232-1317 | Clean and autoclave before use |
| Funnel | VWR | 221-1861 | Clean and autoclave before use |
| Hexagonal weighing boats size M | Sigma-Aldrich | Z708585 | Hexagonal, polystyrene, 51 mm Bottom I.D., 64 mm Top I.D. |
| Hexagonal weighing boats size S | Sigma-Aldrich | Z708577 | Hexagonal, polystyrene, 25 mm Bottom I.D., 38 mm Top I.D. |
| Large surgical scissors | VWR | 233-1211 | Clean and autoclave before use |
| Long forceps | VWR | 232-0096 | Clean and autoclave before use |
| Penicillin and Streptomycin | Sigma-Aldrich | P4333-100ml | Stabilized, with 10.000 units penicillin and 10 mg streptomycin/mL, 0.1 μm filtered. Store at -20°C. The solution should be aliquoted into smaller working volumes to avoid repeated freeze/thaw cycles Solution. |
| Pipette gun | Eppendorf | 613-2795 | Eppendorf Easypet® 3 |
| Plastic tray | VWR | BELAH162620000 | Corrosion-proof polypropylene plastic tray |
| Potassium Chloride | Sigma-Aldrich | P9333 | Powder |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P5665 | Powder |
| Sodium Chloride | Sigma-Aldrich | S7653 | Powder |
| Sodium Dodecyl Sulfate | Sigma-Aldrich | 62862 | Powder |
| Sodium Phosphate Dibasic | Sigma-Aldrich | 94046 | Powder |
| Spatula | VWR | RSGA038.210 | Clean and autoclave before use |
| Spoon | VWR | 231-1314 | Clean and autoclave before use |
| Stir bar | VWR | 442-0362 | Clean and autoclave before use |
| Stir bar retriever | VWR | 89026-262 | Molded in pure, FDA-approved PTFE |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | Liquid |
参考文献
- Daley, W. P., Peters, S. B., Larsen, M. Extracellular matrix dynamics in development and regenerative medicine. Journal of Cell Science. 121 (3), 255-264 (2008).
- Lu, P., Takai, K., Weaver, V. M., Werb, Z. Extracellular matrix degradation and remodeling in development and disease. Cold Spring Harbor Perspectives in Biology. 3 (12), 005058(2011).
- Dobaczewski, M., Gonzalez-Quesada, C., Frangogiannis, N. G. The extracellular matrix as a modulator of the inflammatory and reparative response following myocardial infarction. Journal of Molecular and Cellular Cardiology. 48 (3), 504-511 (2010).
- Frangogiannis, N. G. Matricellular proteins in cardiac adaptation and disease. Physiological Reviews. 92 (2), 635-688 (2012).
- Etoh, T., et al. Myocardial and interstitial matrix metalloproteinase activity after acute myocardial infarction in pigs. American Journal of Physiology-Heart and Circulating Physiology. 281 (3), 987-994 (2001).
- Ma, Y., et al. Myofibroblasts and the extracellular matrix network in post-myocardial infarction cardiac remodeling. Pflügers Archiv: European Journal of Physiology. 466 (6), 1113-1127 (2014).
- Fong, A. H., et al. Three-dimensional adult cardiac extracellular matrix promotes maturation of human induced pluripotent stem cell-derived cardiomyocytes. Tissue Engineering. Part A. 22 (15-16), 1016-1025 (2016).
- Atance, J., Yost, M. J., Carver, W. Influence of the extracellular matrix on the regulation of cardiac fibroblast behavior by mechanical stretch. Journal of Cell Physiology. 200 (3), 377-386 (2004).
- Belviso, I., et al. The microenvironment of decellularized extracellular matrix from heart failure myocardium alters the balance between angiogenic and fibrotic signals from stromal primitive cells. International Journal of Molecular Sciences. 21 (21), 7903(2020).
- Badylak, S. F. Regenerative medicine and developmental biology: The role of the extracellular matrix. The Anatomical Record. 287 (1), 36-41 (2005).
- Volpato, F. Z., Führmann, T., Migliaresi, C., Hutmacher, D. W., Dalton, P. D. Using extracellular matrix for regenerative medicine in the spinal cord Using extracellular matrix for regenerative medicine in the spinal cord. Biomaterials. 34 (21), 4945-4955 (2013).
- Martino, M. M., et al. Extracellular matrix and growth factor engineering for controlled angiogenesis in regenerative medicine. Frontiers in Bioengineering and Biotechnology. 3, 45(2015).
- Hussey, G. S., Keane, T. J., Badylak, S. F. The extracellular matrix of the gastrointestinal tract: a regenerative medicine platform. Nature Reviews: Gastroenterology Hepathology. 14, 540-552 (2017).
- Sheng, Y., Fei, D., Leiiei, G., Xiaosong, G. Extracellular matrix scaffolds for tissue engineering and regenerative medicine. Current Stem Cell Research and Therapy. 12 (3), 233-246 (2017).
- Rozario, T., De Simone, D. W. The extracellular matrix in development and morphogenesis: A dynamic view. Developmental Biology. 341 (1), 126-140 (2010).
- Takawale, A., Sakamuri, S. S. V. P., Kassiri, Z. Extracellular matrix communication and turnover in cardiac physiology and pathology. Comprehensive Physiology. 5 (2), 687-719 (2015).
- Li, L., Zhao, Q., Kong, W. Extracellular matrix remodeling and cardiac fibrosis. Matrix Biology. 68-69, 490-506 (2018).
- DeQuach, J. A., et al. Simple and high yielding method for preparing tissue specific extracellular matrix coatings for cell culture. PLoS ONE. 5 (9), 13039(2010).
- Saldin, L. T., Cramer, M. C., Velankar, S. S., White, L. J., Badylak, S. F. Extracellular matrix hydrogels from decellularized tissue: Structure and function. Acta Biomaterialia. 49, 1-15 (2017).
- Tukmachev, D., et al. Injectable extracellular matrix hydrogels as scaffolds for spinal cord injury repair. Tissue Engineering. Part A. 22 (3-4), 306-317 (2016).
- Shoichet, M. S. Polymer scaffolds for biomaterials applications. Macromolecules. 43 (2), 581-591 (2010).
- Taylor, D. A., et al. Decellularized matrices in regenerative medicine. Acta Biomaterialia. 74, 74-89 (2018).
- Gilpin, A., Yang, Y. Decellularization strategies for regenerative medicine: From processing techniques to applications. BioMed Research International. 2017, 9831534(2017).
- Heath, D. E. A review of decellularized extracellular matrix biomaterials for regenerative engineering applications. Regenerative Engineering and Translational Medicine. 5 (2), 155-166 (2019).
- Hoshiba, T., et al. Decellularized extracellular matrix as an in vitro model to study the comprehensive roles of the ECM in stem cell differentiation. Stem Cell International. 2016, 6397820(2016).
- Keane, T. J., Swinehart, I. T., Badylak, S. F. Methods of tissue decellularization used for preparation of biologic scaffolds and in vivo relevance. Methods. 84, 5-34 (2015).
- Cerbotari, S., et al. Detergent decellularization of heart valves for tissue engineering: Toxicological effects of residual detergents on human endothelial cells. Artificial Organs. 34 (3), 206-210 (2010).
- Ott, H. C., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Uygun, B. E., et al. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nature Medicine. 16 (7), 814-820 (2010).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Calle, E. A., Petersen, T. H., Niklason, L. E. Procedure for lung engineering. Journal of Visualized Experiments. (49), e2651(2011).
- Zeltinger, J., Landeen, L. K., Alexander, H. G., Kidd, I. D., Sibanda, B. Development and Characterization of Tissue-Engineered Aortic Valves. Tissue engineering. Part A. 7 (1), 9-22 (2001).
- Dahl, S., et al. Decellularized native and engineered arterial scaffolds for transplantation. Cell Transplantation. 12 (6), 659-666 (2003).
- Belviso, I., et al. Decellularized human dermal matrix as a biological scaffold for cardiac repair and regeneration. Frontiers inTissue Engineering and Regenerative Medicine. 8, 229(2020).
- Greco, K. V., et al. Characterisation of porcine dermis scaffolds decellularised using a novel non-enzymatic method for biomedical applications. Journal of Biomaterials Applications. 30 (2), 239-253 (2015).
- Brouki, M. P., et al. Decellularization and preservation of human skin: A platform for tissue engineering and reconstructive surgery. Methods. 171, 62-67 (2020).
- Carbonaro, D., et al. A low-cost scalable 3D-printed sample-holder for agitation-based decellularization of biological tissues. Medical Engineering & Physics. 85, 7-15 (2020).
- Di Meglio, F., et al. Optimization of human myocardium decellularization method for the construction of implantable patches. Tissue Engineering. Part C Methods. 23 (9), 525-539 (2017).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Putame, G., et al. Compact and tunable stretch bioreactor advancing tissue engineering implementation. Application to engineered cardiac constructs. Medical Engineering & Physics. 84, 1-9 (2020).
- Parmaksiz, M., Dogan, A., Odabas, S., Elçin, A. E., Elçin, Y. M. Clinical applications of decellularized extracellular matrices for tissue engineering and regenerative medicine. Biomedical Materials. 11 (2), 022003(2016).
- Sacco, A. M., et al. Diversity of dermal fibroblasts as major determinant of variability in cell reprogramming. Journal of Cellular and Molecular Medicine. 23 (6), 4256-4268 (2019).
- Belviso, I., et al. Isolation of adult human dermal fibroblasts from abdominal skin and generation of induced pluripotent stem cells using a non-integrating method. Journal of Visualized Experiments: JoVE. (155), e60629(2020).
- Belviso, I., Di Meglio, F., Romano, V., Montagnani, S., Castaldo, C. Non-modified RNA-based reprogramming of human dermal fibroblasts into induced pluripotent stem cells. Methods in Molecular Biology. , (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved