Method Article
Descelularização para a Preparação de Matriz de Pele Acelular Humana Altamente Preservada para Medicina Regenerativa
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A pele humana descelularizada é adequada para a regeneração de tecidos. Uma questão importante da descelularização é a preservação da arquitetura nativa, juntamente com o conteúdo apropriado de proteínas estruturais, glicosaminoglicanos (GAGs) e fatores de crescimento. O método proposto permite uma descelularização rápida e eficaz, produzindo pele descelularizada com traços nativos bem preservados.
Resumo
A matriz extracelular (MEC) fornece estímulos biofísicos e bioquímicos para apoiar a auto-renovação, proliferação, sobrevivência e diferenciação das células circundantes devido ao seu conteúdo de diversas moléculas bioativas. Devido a essas características, a ECM tem sido recentemente considerada uma candidata promissora para a criação de scaffolds biológicos para impulsionar a regeneração tecidual. Estudos emergentes demonstraram que tecidos humanos descelularizados podem se assemelhar à ECM nativa em seus perfis estruturais e bioquímicos, preservando a arquitetura tridimensional (3D) e o conteúdo de moléculas biológicas fundamentais. Assim, a MEC descelularizada pode ser empregada para promover a remodelação tecidual, reparo e reconstrução funcional de muitos órgãos. A seleção do procedimento de descelularização adequado é crucial para obter tecidos acelulares que retenham as características do microambiente ideal para as células.
O protocolo descrito aqui fornece uma descrição detalhada passo a passo do método de descelularização para obter uma ECM biológica livre de células reprodutível e eficaz. Fragmentos de pele de pacientes submetidos à cirurgia plástica foram reduzidos e descelularizados usando uma combinação de dodecilsulfato de sódio (SDS), Triton X-100 e antibióticos. Para promover o transporte regular e homogêneo da solução através das amostras, elas foram fechadas em embutidos para garantir a proteção contra insultos mecânicos. Após o procedimento de descelularização, a cor branca como a neve dos fragmentos de pele indicou descelularização completa e bem-sucedida. Além disso, as amostras descelularizadas mostraram uma arquitetura intacta e bem preservada. Os resultados sugerem que o método de descelularização proposto foi eficaz, rápido e reprodutível e protegeu as amostras de danos arquitetônicos.
Introdução
A MEC serve como um andaime para as células, sustentando-as por meio de uma intrincada arquitetura mantida por diferentes componentes, e é um dos principais fatores responsáveis pelas propriedades mecânicas do coração e da função do tecido cardíaco 1,2. Evidências crescentes sugerem que a MEC desempenha um papel ativo na remodelação tecidual, tornando obsoleta a suposição convencional de que a MEC é um componente passivo 3,4,5,6. O papel da ECM é fornecer pistas biofísicas e bioquímicas para as células residentes. Está bem estabelecido que esses sinais podem influenciar muitos comportamentos celulares fundamentais, impactando sua função contrátil, proliferação, migração e potencial de diferenciação 7,8,9. Assim, a MEC está sendo cada vez mais empregada na engenharia de tecidos e na medicina regenerativa como ferramenta de suporte terapêutico 9,10,11,12,13.
A MEC consiste em várias proteínas, como colágeno, elastina, fibronectina, proteoglicano e laminina, juntamente com fatores de crescimento ligados à MEC, todos envolvidos em mecanismos de regeneração, como recrutamento, migração e diferenciação celular, bem como alinhamento e proliferação celular14. As propriedades mecânicas dos tecidos também têm grande relevância na fisiopatologia dos órgãos. De fato, mudanças nas propriedades mecânicas são frequentemente associadas ao aparecimento e à evolução de várias doenças. A razão reside no fato de que, quando a MEC é modificada, os sinais vindos do ambiente induzem alterações na expressão gênica e proteica, levando ao comprometimento funcional15,16.
As terapias regenerativas para reparo de órgãos estão atualmente focadas em replicar o sofisticado microambiente do tecido nativo para curar o órgão onde o corpo falha. Apesar do ritmo acelerado de muitas abordagens de engenharia de tecidos, os tecidos ainda não podem ser reproduzidos com precisão em sua totalidade e complexidade por procedimentos artificiais. Os materiais sintéticos têm sido amplamente empregados até agora, pois podem ser ajustados adequadamente para simular as propriedades mecânicas e bioquímicas do microambiente celular. No entanto, eles têm limites, como a incapacidade de mimetizar as inúmeras interações dentro do tecido nativo, o custo das tecnologias para produzi-los e o fato de serem menos naturais e biocompatíveis do que o tecido nativo 17,18,19. Além disso, sua composição, principalmente em termos de proteínas e fatores solúveis, difere muito da natural, que é extremamente difícil de replicar20.
A abordagem de ponta na medicina regenerativa para reduzir a lacuna entre os pacientes necessitados e os transplantes de órgãos é produzir andaimes feitos de matriz extracelular descelularizada (d-ECM) e repovoá-los com os tipos de células apropriados para regenerar os órgãos danificados. A descelularização é o processo no qual a MEC é isolada de suas células nativas e material genético para produzir um arcabouço natural e biomimético, capaz de evitar a resposta imune e a rejeição uma vez implantado nos pacientes 21,22,23. A ECM assim obtida pode então ser repovoada para produzir tecido funcional. O principal problema ao desenvolver um d-ECM é o método. Para qualquer técnica de descelularização, o objetivo principal continua sendo a preservação da composição, rigidez e estrutura 3D nativas do ECM, e todas as estratégias têm vantagens e desvantagens. Como a eliminação do conteúdo celular e do DNA do tecido requer o uso de agentes químicos ou físicos, ou a combinação de ambos, cada procedimento de descelularização causa, em diferentes graus, a ruptura da MEC. Portanto, é crucial minimizar os danos à ECM 24,25,26.
A utilização da ECM nativa como plataforma para a reconstituição da ECM nativa in vitro é altamente desejável. Para tanto, vários protocolos de descelularização têm sido aplicados a uma ampla gama de tecidos 27,28,29,30. De fato, desde os estágios iniciais da pesquisa de descelularização e desenvolvimento da MEC, vários tecidos, como artérias, válvulas aórticas e nervos periféricos de animais e humanos, foram descelularizados, e alguns d-ECMs ainda estão disponíveis comercialmente e são usados para substituição de tecidos ou cicatrização de feridas 31,32,33. Recentemente, a pele humana também emergiu como uma candidata adequada para a produção de scaffolds descelularizados para reparo cardíaco devido à sua composição e propriedades mecânicas, capazes de aumentar o potencial regenerativo das células progenitoras cardíacas (CPCs) e se adaptar à contratilidade cardíaca34. Este trabalho descreve um protocolo simples e rápido para produzir scaffolds descelularizados a partir de pele humana adulta, permitindo o desenvolvimento de um d-ECM com arquitetura bem preservada.
Protocolo
As amostras de tecido humano foram coletadas de acordo com os princípios da Declaração de Helsinque e observando as diretrizes do Hospital Universitário "Federico II". Todos os pacientes envolvidos neste estudo forneceram o termo de consentimento livre e esclarecido.
1. Preparação das soluções
- Preparação de 1200 mL de solução descelularizante a 1%
- Preparar 600 ml de solução Triton X-100 a 2% medindo 588 ml de água bidestilada num cilindro graduado e transferindo-a para um copo de 1 L. Com uma pipeta serológica, adicione 12 ml de Triton X-100 e uma barra de agitação ao copo. Colocar o copo num agitador magnético e misturar a solução até que o Triton X-100 esteja completamente dissolvido.
- Pare a agitação. Remova a barra de agitação usando um recuperador de barra de agitação. Armazene em temperatura ambiente.
- Preparar 600 ml de solução SDS a 2% medindo 550 ml de água bidestilada num cilindro graduado e transferindo-a para um copo de 1 L.
- Pesar 12 g de pó de FDS num recipiente de pesagem de plástico e transferi-lo para o copo que contém a água bidestilada no passo 1.1.3.
NOTA: A etapa 1.1.4 deve ser executada sob um capuz químico e o usuário deve usar equipamento de proteção individual. - Adicione uma barra de agitação, coloque o copo em um agitador magnético e misture a solução até que a SDS esteja completamente dissolvida.
- Pare o processo de agitação. Remova a barra de agitação usando um recuperador de barra de agitação.
- Transferir a solução para um cilindro graduado e ajustar o volume para 600 ml adicionando água bidestilada
- Despeje a solução Triton X-100 a 2% preparada na etapa 1.1.1 em um cilindro de 2 L.
- Despeje a solução SDS a 2% preparada nas etapas 1.1.3-1.1.7 no mesmo cilindro de 2 L para obter um volume total de 1200 mL.
- Cobrir com parafilme e misturar delicadamente por inversão para obter uma solução homogénea.
- Transfira a solução misturada para um frasco de 2 L usando um funil para evitar a formação de espuma. Conservar a solução a +4 °C.
- Preparação de 1x solução salina tamponada com fosfato (PBS)
- Prepare 500 mL de 1x solução salina tamponada com fosfato (PBS) dissolvendo 0,1 g de fosfato de potássio monobásico, 0,1 g de cloreto de potássio, 4,0 g de cloreto de sódio e 0,575 g de fosfato de sódio dibásico em água dupla destilada estéril. Verifique o valor do pH (7.4).
- Conservar a +4 °C até à utilização.
- Preparação da solução antibiótica
- Pesar 625 μg de anfotericina B num recipiente de pesagem de plástico.
- Pipete 8 mL de uma mistura de penicilina e estreptomicina (caneta / estreptococos) em um tubo de 15 mL.
- Adicione a anfotericina B pesada à mistura caneta / estreptococos e ajuste o volume para 10 mL adicionando a mistura de penicilina e estreptomicina (caneta / estreptococos). Tampe o tubo e dissolva a anfotericina B agitando vigorosamente.
2. Dia 1 - inicie o procedimento de descelularização.
- Despeje 400 mL da solução descelularizante em um béquer de 500 mL.
- Adicione 2,0 mL da solução antibiótica.
3. Preparação de amostras cutâneas
- Lave a amostra de pele humana do abdômen de pacientes submetidos à abdominoplastia em uma bandeja de plástico, dobrando-a e virando-a de cabeça para baixo em uma solução fisiológica isotônica de NaCl a 0,9% para remover o excesso de sangue e outros fluidos biológicos.
- Remova o cabelo usando uma pinça fina e a gordura usando uma tesoura cirúrgica grande.
- Colocar a amostra de pele na placa dissecadora e dissecá-la com bisturi, tendo como referência as graduações na placa dissecadora para obter fragmentos de 3 cm x 2,5 cm (comprimento por largura), evitando cicatrizes e áreas sujas ou queimadas do tecido.
- Coloque cada fragmento em um de embutimento, feche-o e certifique-se de que todos os estejam devidamente travados para evitar vazamento da amostra durante o procedimento de descelularização.
- Colocar um máximo de quatro de embutir com amostras num copo com a solução descelularizante. Adicione uma barra de agitação. Cubra com papel alumínio, escrevendo na parte superior todas as informações para identificar a amostra e a hora de início do procedimento.
- Colocar o copo sobre o agitador magnético e iniciar a agitação a uma velocidade de rotação de 150 rpm. Pare a agitação. Remova a folha de alumínio que cobre o béquer e retire os de embutir com uma pinça longa.
NOTA: Depois de parar a agitação, verifique a clareza da solução. Modifique a duração da agitação (menos ou mais de 8 horas) com base no grau de turvação devido à liberação de detritos celulares. - Coloque cada em um prato de 100 mm. Substitua a solução descelularizante repetindo as etapas 3.5-3.6 durante a noite.
4. Dia 2 - verifique o estado das amostras de pele.
- Pare o processo de agitação. Remova a folha de alumínio que cobre o béquer e retire os de embutir com uma pinça longa.
- Coloque cada em um prato de 100 mm e abra-o. Verifique a cor da amostra.
NOTA: As amostras podem mostrar uma mudança de cor do bege nativo para o branco como a neve. - Remova os pelos residuais e separe a epiderme da derme. Substitua a solução descelularizante repetindo as etapas 3.5-3.6.
- Pare a agitação após 8 h. Repita as etapas 4.1 a 4.2 até que a amostra pareça branca como a neve. Pare o procedimento de descelularização.
NOTA: O tempo de exposição à ação dos detergentes pode ser estendido, se necessário. - Meça 400 mL de 1x PBS em um cilindro de 500 mL, despeje em um béquer de 500 mL e adicione 2 mL da mistura de Pen Strep/Anfotericina B. Adicione uma barra de agitação.
- Colocar um máximo de quatro contendo as amostras em cada copo com a solução 1x PBS/antibióticos. Cubra com papel alumínio e escreva todas as informações na parte superior como na etapa 3.5.
- Colocar o copo num agitador magnético e iniciar a agitação a uma velocidade de rotação de 150 rpm durante a noite, à temperatura ambiente.
5. Dia 3 - uma lavagem final das amostras
- Pare a agitação. Substitua a solução 1x PBS por 400 mL de água bidestilada Adicione uma barra de agitação. Cubra com papel alumínio e escreva todas as informações no topo como na etapa 3.5.
- Colocar o copo num agitador magnético e iniciar a agitação a uma velocidade de rotação de 150 rpm durante 30 min.
- Pare o processo de agitação. Remova a folha de alumínio que cobre o béquer e retire os de embutir com uma pinça longa.
- Coloque cada de incorporação contendo a amostra de pele descelularizada em um prato de 100 mm. Abra os e seque suavemente as amostras de pele, esfregando-as em lenços umedecidos.
- Colocar cada amostra de pele descelularizada num recipiente de pesagem previamente marcado com as informações sobre a amostra. Cubra o barco com papel alumínio e escreva todas as informações na parte superior para identificar a amostra. Conservar a - 80 °C.
Resultados
O objetivo do protocolo foi obter uma amostra de d-ECM de pele de tecido biológico, mantendo uma estrutura 3D bem organizada e um conteúdo bem preservado de moléculas biológicas (Figura 1). Este método baseia-se principalmente na agitação constante das amostras em uma solução contendo a combinação de dois detergentes, Triton X-100 e SDS, preservando assim as características biológicas e estruturais típicas do tecido nativo e reduzindo o tempo de exposição durante o processo de descelularização. Após o recebimento, as amostras foram lavadas e preparadas para o procedimento, obtendo-se fragmentos de pele limpa de 3 cm x 2,5 cm, livre de cabelos ou tecido adiposo (Figura 2 e Figura 3). O uso de de embutimento permitiu a minimização da ruptura tecidual (Figura 3), resultando em amostras com uma arquitetura mais intacta. A pele descelularizada não apresentava sinais de danos mecânicos ou químicos significativos após observação macroscópica. A epiderme foi descolada durante o procedimento de descelularização (Figura 4A,B), e as amostras mudaram de cor de bege, típico de todo o tecido nativo, para branco como a neve, indicando descelularização completa e bem-sucedida (Figura 4C).

Figura 1: Fluxo de trabalho do protocolo. Clique aqui para ver uma versão maior desta figura.

Figura 2: Imagens representativas da preparação da amostra de pele após o recebimento. (A) Amostra recebida. (B, C) Avaliação macroscópica da amostra colocada em placa de dissecação. (D-F) Remoção do tecido adiposo com tesoura cirúrgica grande. Clique aqui para ver uma versão maior desta figura.

Figura 3: Dissecção e colocação de amostras de pele em de incorporação. (A) Cabelo removido por pinça fina. (BE) Amostras de pele dissecadas com bisturi para obter fragmentos de 3 cm x 2,5 cm para caber nos de inclusão. (F, G) Fragmento de pele colocado em de incorporação. Clique aqui para ver uma versão maior desta figura.
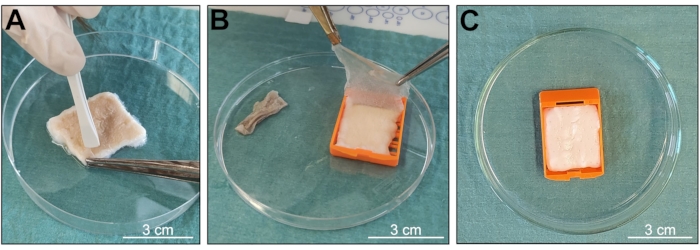
Figura 4: Verificando o estado da amostra durante a descelularização. (A, B) Descolamento da epiderme da derme. (C) Mudança de cor da amostra indicando a ocorrência de descelularização. Barras de escala = 3 cm. Clique aqui para ver uma versão maior desta figura.
Discussão
Embora o protocolo descrito acima tenha sido otimizado e aprimorado em comparação com os protocolos publicados anteriormente, ele apresenta algumas etapas críticas que precisam de atenção e precisão. A formação de espuma deve ser evitada durante a preparação da solução descelularizante para evitar a diluição incorreta dos detergentes. Isso pode ser resolvido despejando suavemente as soluções e fazendo-as fluir ao longo do lado interno do cilindro. Além disso, deve-se ter cuidado ao remover manualmente o tecido adiposo das amostras, pois a descelularização com detergentes, como Triton X-100 e SDS, não elimina a gordura, e os restos lipídicos podem afetar negativamente a eficácia do método. Outra etapa crítica é a remoção da epiderme das amostras. Durante a descelularização, a epiderme se desprende gradualmente da superfície da pele. Nesta fase, é fundamental retirá-lo com uma pinça apenas quando estiver completamente varrido, evitando rasgá-lo ou triturá-lo e causar o aprisionamento de detritos nas amostras.
Este protocolo se concentra na redução do impacto da descelularização nas amostras por meio de duas estratégias principais: a redução do tempo de exposição ao procedimento usando dois detergentes em combinação 28,35,36 e a proteção das amostras contra insultos mecânicos, encerrando-as em embutidos 37. Além disso, o procedimento produziu resultados bem-sucedidos quando aplicado a outras amostras além da pele, como miocárdio humano e suíno e vasos sanguíneos. A avaliação da eficácia do protocolo aqui descrito é feita principalmente por uma observação macroscópica das amostras, o que mostraria uma mudança notável na cor, de bege para branco como a neve. Certamente, alguns outros aspectos devem ser avaliados para avaliar a qualidade da d-ECM, como a remoção de detritos celulares e material genético residual, a preservação do conteúdo de proteínas estruturais e biomoléculas e a retenção de propriedades mecânicas, conforme descrito em outro artigo 34,37,38. A remoção de detritos celulares e material genético é crucial para reduzir a imunogenicidade do construto. Assim, alguns critérios para avaliar a eficácia da remoção desses componentes estão bem estabelecidos na literatura: a d-ECM não deve ter mais de 50 ng de DNA de fita dupla (dsDNA)39 por mg de peso seco da ECM, e nenhum material nuclear deve ser microscopicamente visível.
Para atender a esses critérios, deve-se realizar a avaliação do conteúdo de DNA residual e a coloração com hematoxilina e eosina, conforme descrito por Di Meglio et al.38 para apoiar os dados macroscópicos. Além disso, a avaliação da preservação da MEC pela detecção de proteínas estruturais, como colágeno, fibronectina e laminina, juntamente com glicosaminoglicanos e fatores de crescimento, também é apropriada34. Finalmente, as propriedades mecânicas da d-ECM devem corresponder às do tecido nativo40. Embora a eficácia e a viabilidade desse procedimento tenham sido demonstradas para a obtenção de tecido descelularizado desejável, o método apresenta algumas limitações. Por exemplo, permite a descelularização de apenas algumas amostras de cada vez (4 para cada copo), levando a um desperdício considerável de soluções. Por um lado, o uso de embutidos ajuda a proteger e preservar as amostras; por outro lado, obriga os operadores a descelularizar apenas amostras de tamanhos pequenos que cabem nos. Outra limitação é a possibilidade de contaminação microbiana do d-ECM obtido. Embora o procedimento envolva a adição de antibióticos, é altamente recomendável esterilizar o d-ECM por UV antes do uso. Finalmente, as incubações necessárias ao longo de todo o procedimento devem ser calculadas e organizadas com precisão para gerenciar o tempo de maneira ideal.
Este protocolo foi desenvolvido para abordar as desvantagens observadas durante o teste de outros protocolos em laboratório. Os protocolos existentes permitem um grau variável de descelularização sem garantir a integridade adequada do tecido, implicando uma perda considerável de moléculas biológicas essenciais e propriedades mecânicas41. A preservação da estrutura e composição da MEC após a descelularização são aspectos fundamentais, pois a d-MEC pode atuar como o andaime, que uma vez repovoado, suportará os mecanismos regenerativos celulares dentro do órgão. Ao otimizar o processo de descelularização, os andaimes biológicos derivados da pele humana podem ser utilizados na medicina regenerativa, ajudando a minimizar a lacuna entre doadores e pacientes que precisam de transplantes de órgãos. Além disso, os avanços nos métodos de recelularização e aplicações de células-tronco pluripotentes induzidas por humanos melhorarão a distribuição dos tipos de células adequadas 42,43 para permitir o processo de regeneração44.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Nenhum
Materiais
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl isotonic Physiological solution | Sigma-Aldrich | S8776 | 0.9% in water |
| 1 L beaker | VWR | 511-0318 | Clean and autoclave before use |
| 10 mL serological pipet | Falcon | 357551 | Sterile, polystyrene |
| 100 mm plates | Falcon | 351029 | Treated, sterile cell culture dish |
| 15 mL sterile tubes | Falcon | 352097 | Centrifuge sterile tubes, polypropylene |
| 1 L graduated cylinder | VWR | 612-1524 | Clean and autoclave before use |
| 2 L bottle | VWR | 215-1596 | Clean and autoclave before use |
| 25 mL serological pipet | Falcon | 357525 | Sterile, polystyrene |
| 2 L graduated cylinder | VWR | 612-3072 | Clean and autoclave before use |
| 500 mL beaker | VWR | 511-0317 | Clean and autoclave before use |
| Amphotericin B | Sigma-Aldrich | Y0000005 | Powder |
| Dissecting board | VWR | 100498-398 | Made of high-density polyethylene. |
| Dissecting scalpel | VWR | 233-5526 | Sterile and disposable |
| Embedding cassettes | Diapath | 070191 | External dimensions: 40x26x7 mm (WxDxH) |
| Fine forceps | VWR | 232-1317 | Clean and autoclave before use |
| Funnel | VWR | 221-1861 | Clean and autoclave before use |
| Hexagonal weighing boats size M | Sigma-Aldrich | Z708585 | Hexagonal, polystyrene, 51 mm Bottom I.D., 64 mm Top I.D. |
| Hexagonal weighing boats size S | Sigma-Aldrich | Z708577 | Hexagonal, polystyrene, 25 mm Bottom I.D., 38 mm Top I.D. |
| Large surgical scissors | VWR | 233-1211 | Clean and autoclave before use |
| Long forceps | VWR | 232-0096 | Clean and autoclave before use |
| Penicillin and Streptomycin | Sigma-Aldrich | P4333-100ml | Stabilized, with 10.000 units penicillin and 10 mg streptomycin/mL, 0.1 μm filtered. Store at -20°C. The solution should be aliquoted into smaller working volumes to avoid repeated freeze/thaw cycles Solution. |
| Pipette gun | Eppendorf | 613-2795 | Eppendorf Easypet® 3 |
| Plastic tray | VWR | BELAH162620000 | Corrosion-proof polypropylene plastic tray |
| Potassium Chloride | Sigma-Aldrich | P9333 | Powder |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P5665 | Powder |
| Sodium Chloride | Sigma-Aldrich | S7653 | Powder |
| Sodium Dodecyl Sulfate | Sigma-Aldrich | 62862 | Powder |
| Sodium Phosphate Dibasic | Sigma-Aldrich | 94046 | Powder |
| Spatula | VWR | RSGA038.210 | Clean and autoclave before use |
| Spoon | VWR | 231-1314 | Clean and autoclave before use |
| Stir bar | VWR | 442-0362 | Clean and autoclave before use |
| Stir bar retriever | VWR | 89026-262 | Molded in pure, FDA-approved PTFE |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | Liquid |
Referências
- Daley, W. P., Peters, S. B., Larsen, M. Extracellular matrix dynamics in development and regenerative medicine. Journal of Cell Science. 121 (3), 255-264 (2008).
- Lu, P., Takai, K., Weaver, V. M., Werb, Z. Extracellular matrix degradation and remodeling in development and disease. Cold Spring Harbor Perspectives in Biology. 3 (12), 005058(2011).
- Dobaczewski, M., Gonzalez-Quesada, C., Frangogiannis, N. G. The extracellular matrix as a modulator of the inflammatory and reparative response following myocardial infarction. Journal of Molecular and Cellular Cardiology. 48 (3), 504-511 (2010).
- Frangogiannis, N. G. Matricellular proteins in cardiac adaptation and disease. Physiological Reviews. 92 (2), 635-688 (2012).
- Etoh, T., et al. Myocardial and interstitial matrix metalloproteinase activity after acute myocardial infarction in pigs. American Journal of Physiology-Heart and Circulating Physiology. 281 (3), 987-994 (2001).
- Ma, Y., et al. Myofibroblasts and the extracellular matrix network in post-myocardial infarction cardiac remodeling. Pflügers Archiv: European Journal of Physiology. 466 (6), 1113-1127 (2014).
- Fong, A. H., et al. Three-dimensional adult cardiac extracellular matrix promotes maturation of human induced pluripotent stem cell-derived cardiomyocytes. Tissue Engineering. Part A. 22 (15-16), 1016-1025 (2016).
- Atance, J., Yost, M. J., Carver, W. Influence of the extracellular matrix on the regulation of cardiac fibroblast behavior by mechanical stretch. Journal of Cell Physiology. 200 (3), 377-386 (2004).
- Belviso, I., et al. The microenvironment of decellularized extracellular matrix from heart failure myocardium alters the balance between angiogenic and fibrotic signals from stromal primitive cells. International Journal of Molecular Sciences. 21 (21), 7903(2020).
- Badylak, S. F. Regenerative medicine and developmental biology: The role of the extracellular matrix. The Anatomical Record. 287 (1), 36-41 (2005).
- Volpato, F. Z., Führmann, T., Migliaresi, C., Hutmacher, D. W., Dalton, P. D. Using extracellular matrix for regenerative medicine in the spinal cord Using extracellular matrix for regenerative medicine in the spinal cord. Biomaterials. 34 (21), 4945-4955 (2013).
- Martino, M. M., et al. Extracellular matrix and growth factor engineering for controlled angiogenesis in regenerative medicine. Frontiers in Bioengineering and Biotechnology. 3, 45(2015).
- Hussey, G. S., Keane, T. J., Badylak, S. F. The extracellular matrix of the gastrointestinal tract: a regenerative medicine platform. Nature Reviews: Gastroenterology Hepathology. 14, 540-552 (2017).
- Sheng, Y., Fei, D., Leiiei, G., Xiaosong, G. Extracellular matrix scaffolds for tissue engineering and regenerative medicine. Current Stem Cell Research and Therapy. 12 (3), 233-246 (2017).
- Rozario, T., De Simone, D. W. The extracellular matrix in development and morphogenesis: A dynamic view. Developmental Biology. 341 (1), 126-140 (2010).
- Takawale, A., Sakamuri, S. S. V. P., Kassiri, Z. Extracellular matrix communication and turnover in cardiac physiology and pathology. Comprehensive Physiology. 5 (2), 687-719 (2015).
- Li, L., Zhao, Q., Kong, W. Extracellular matrix remodeling and cardiac fibrosis. Matrix Biology. 68-69, 490-506 (2018).
- DeQuach, J. A., et al. Simple and high yielding method for preparing tissue specific extracellular matrix coatings for cell culture. PLoS ONE. 5 (9), 13039(2010).
- Saldin, L. T., Cramer, M. C., Velankar, S. S., White, L. J., Badylak, S. F. Extracellular matrix hydrogels from decellularized tissue: Structure and function. Acta Biomaterialia. 49, 1-15 (2017).
- Tukmachev, D., et al. Injectable extracellular matrix hydrogels as scaffolds for spinal cord injury repair. Tissue Engineering. Part A. 22 (3-4), 306-317 (2016).
- Shoichet, M. S. Polymer scaffolds for biomaterials applications. Macromolecules. 43 (2), 581-591 (2010).
- Taylor, D. A., et al. Decellularized matrices in regenerative medicine. Acta Biomaterialia. 74, 74-89 (2018).
- Gilpin, A., Yang, Y. Decellularization strategies for regenerative medicine: From processing techniques to applications. BioMed Research International. 2017, 9831534(2017).
- Heath, D. E. A review of decellularized extracellular matrix biomaterials for regenerative engineering applications. Regenerative Engineering and Translational Medicine. 5 (2), 155-166 (2019).
- Hoshiba, T., et al. Decellularized extracellular matrix as an in vitro model to study the comprehensive roles of the ECM in stem cell differentiation. Stem Cell International. 2016, 6397820(2016).
- Keane, T. J., Swinehart, I. T., Badylak, S. F. Methods of tissue decellularization used for preparation of biologic scaffolds and in vivo relevance. Methods. 84, 5-34 (2015).
- Cerbotari, S., et al. Detergent decellularization of heart valves for tissue engineering: Toxicological effects of residual detergents on human endothelial cells. Artificial Organs. 34 (3), 206-210 (2010).
- Ott, H. C., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Uygun, B. E., et al. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nature Medicine. 16 (7), 814-820 (2010).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Calle, E. A., Petersen, T. H., Niklason, L. E. Procedure for lung engineering. Journal of Visualized Experiments. (49), e2651(2011).
- Zeltinger, J., Landeen, L. K., Alexander, H. G., Kidd, I. D., Sibanda, B. Development and Characterization of Tissue-Engineered Aortic Valves. Tissue engineering. Part A. 7 (1), 9-22 (2001).
- Dahl, S., et al. Decellularized native and engineered arterial scaffolds for transplantation. Cell Transplantation. 12 (6), 659-666 (2003).
- Belviso, I., et al. Decellularized human dermal matrix as a biological scaffold for cardiac repair and regeneration. Frontiers inTissue Engineering and Regenerative Medicine. 8, 229(2020).
- Greco, K. V., et al. Characterisation of porcine dermis scaffolds decellularised using a novel non-enzymatic method for biomedical applications. Journal of Biomaterials Applications. 30 (2), 239-253 (2015).
- Brouki, M. P., et al. Decellularization and preservation of human skin: A platform for tissue engineering and reconstructive surgery. Methods. 171, 62-67 (2020).
- Carbonaro, D., et al. A low-cost scalable 3D-printed sample-holder for agitation-based decellularization of biological tissues. Medical Engineering & Physics. 85, 7-15 (2020).
- Di Meglio, F., et al. Optimization of human myocardium decellularization method for the construction of implantable patches. Tissue Engineering. Part C Methods. 23 (9), 525-539 (2017).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Putame, G., et al. Compact and tunable stretch bioreactor advancing tissue engineering implementation. Application to engineered cardiac constructs. Medical Engineering & Physics. 84, 1-9 (2020).
- Parmaksiz, M., Dogan, A., Odabas, S., Elçin, A. E., Elçin, Y. M. Clinical applications of decellularized extracellular matrices for tissue engineering and regenerative medicine. Biomedical Materials. 11 (2), 022003(2016).
- Sacco, A. M., et al. Diversity of dermal fibroblasts as major determinant of variability in cell reprogramming. Journal of Cellular and Molecular Medicine. 23 (6), 4256-4268 (2019).
- Belviso, I., et al. Isolation of adult human dermal fibroblasts from abdominal skin and generation of induced pluripotent stem cells using a non-integrating method. Journal of Visualized Experiments: JoVE. (155), e60629(2020).
- Belviso, I., Di Meglio, F., Romano, V., Montagnani, S., Castaldo, C. Non-modified RNA-based reprogramming of human dermal fibroblasts into induced pluripotent stem cells. Methods in Molecular Biology. , (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados