Method Article
إزالة الخلايا لإعداد مصفوفة الجلد البشري اللاخلوي المحفوظة بدرجة عالية للطب التجديدي
* These authors contributed equally
In This Article
Summary
جلد الإنسان منزوع الخلايا مناسب لتجديد الأنسجة. تتمثل إحدى المشكلات الرئيسية لإزالة الخلايا في الحفاظ على البنية الأصلية ، جنبا إلى جنب مع المحتوى المناسب للبروتينات الهيكلية ، والجليكوزامينوجليكان (GAGs) ، وعوامل النمو. تسمح الطريقة المقترحة بإزالة الخلايا بسرعة وفعالية ، مما ينتج عنه جلد منزوع الخلايا مع ميزات أصلية محفوظة جيدا.
Abstract
توفر المصفوفة خارج الخلية (ECM) محفزات فيزيائية حيوية وكيميائية حيوية لدعم التجديد الذاتي للخلايا المحيطة وانتشارها وبقائها وتمايزها بسبب محتواها من الجزيئات النشطة بيولوجيا المتنوعة. نظرا لهذه الخصائص ، تم اعتبار ECM مؤخرا مرشحا واعدا لإنشاء سقالات بيولوجية لتعزيز تجديد الأنسجة. أظهرت الدراسات الناشئة أن الأنسجة البشرية منزوعة الخلايا يمكن أن تشبه ECM الأصلي في ملامحها الهيكلية والكيميائية الحيوية ، مما يحافظ على الهيكل ثلاثي الأبعاد (3D) ومحتوى الجزيئات البيولوجية الأساسية. وبالتالي ، يمكن استخدام ECM منزوع الخلايا لتعزيز إعادة تشكيل الأنسجة وإصلاحها وإعادة البناء الوظيفي للعديد من الأعضاء. يعد اختيار إجراء إزالة الخلايا المناسب أمرا بالغ الأهمية للحصول على أنسجة غير خلوية تحتفظ بخصائص البيئة المكروية المثالية للخلايا.
يوفر البروتوكول الموصوف هنا وصفا مفصلا خطوة بخطوة لطريقة إزالة الخلايا للحصول على ECM بيولوجي قابل للتكرار وفعال وخالي من الخلايا. تم تقليص شظايا الجلد من المرضى الذين خضعوا لجراحة تجميلية وإزالة الخلايا باستخدام مزيج من دودسيلسلفات الصوديوم (SDS) و Triton X-100 والمضادات الحيوية. لتعزيز النقل المنتظم والمتجانس للمحلول عبر العينات ، تم إحاطتها بأشرطة مدمجة لضمان الحماية من الإهانات الميكانيكية. بعد إجراء إزالة الخلايا ، أشار اللون الأبيض الثلجي لشظايا الجلد إلى إزالة الخلايا بشكل كامل وناجح. بالإضافة إلى ذلك ، أظهرت العينات منزوعة الخلايا بنية سليمة ومحفوظة جيدا. تشير النتائج إلى أن طريقة إزالة الخلايا المقترحة كانت فعالة وسريعة وقابلة للتكرار ومحمية من الأضرار المعمارية.
Introduction
يعمل ECM كسقالة للخلايا ، ويدعمها من خلال بنية معقدة تحتفظ بها مكونات مختلفة ، وهي أحد العوامل الرئيسية المسؤولة عن الخصائص الميكانيكية لوظيفة القلب وأنسجة القلب1،2. تشير الأدلة المتزايدة إلى أن ECM يلعب دورا نشطا في إعادة تشكيل الأنسجة ، مما يجعل الافتراض التقليدي بأن ECM هو مكون سلبي عفا عليه الزمن3،4،5،6. يتمثل دور ECM في توفير إشارات فيزيائية حيوية وكيميائية حيوية للخلايا المقيمة. من الثابت أن هذه الإشارات يمكن أن تؤثر على العديد من سلوكيات الخلايا الأساسية ، مما يؤثر على وظيفة الانقباض والانتشار والهجرة وإمكانية التمايز7،8،9. وبالتالي ، يتم استخدام ECM بشكل متزايد في هندسة الأنسجة والطب التجديدي كأداة دعم علاجية9،10،11،12،13.
يتكون ECM من العديد من البروتينات مثل الكولاجين والإيلاستين والفيبرونكتين والبروتيوغليكان واللامينين ، جنبا إلى جنب مع عوامل النمو المرتبطة ب ECM ، وكلها تشارك في آليات التجديد ، مثل تجنيد الخلايا والهجرة والتمايز ، بالإضافة إلى محاذاة الخلاياوتكاثرها 14. الخصائص الميكانيكية للأنسجة لها أيضا أهمية كبيرة في علم الأمراض الفيزيائية للأعضاء. في الواقع ، غالبا ما ترتبط التغييرات في الخواص الميكانيكية بظهور وتطور العديد من الأمراض. يكمن السبب في حقيقة أنه عندما يتم تعديل ECM ، فإن الإشارات القادمة من البيئة تؤدي إلى تغييرات في التعبير الجيني والبروتيني ، مما يؤدي إلى ضعف وظيفي15،16.
تركز العلاجات التجديدية لإصلاح الأعضاء حاليا على تكرار البيئة المكروية المتطورة للأنسجة الأصلية لشفاء العضو حيث يفشل الجسم. على الرغم من الوتيرة السريعة للعديد من مناهج هندسة الأنسجة ، إلا أنه لا يزال من غير الممكن إعادة إنتاج الأنسجة بدقة في مجملها وتعقيدها عن طريق الإجراءات الاصطناعية. تم استخدام المواد الاصطناعية إلى حد كبير حتى الآن ، حيث يمكن ضبطها بشكل مناسب لمحاكاة الخصائص الميكانيكية والكيميائية الحيوية للبيئة المكروية الخلوية. ومع ذلك ، فإن لديهم حدودا ، مثل عدم القدرة على تقليد التفاعلات العديدة داخل الأنسجة الأصلية ، وتكلفة تقنيات إنتاجها ، وحقيقة أنها أقل طبيعية ومتوافقة حيويا من الأنسجة الأصلية17،18،19. بالإضافة إلى ذلك ، فإن تكوينها ، في المقام الأول من حيث البروتينات والعوامل القابلة للذوبان ، يختلف اختلافا كبيرا عن التكوين الطبيعي ، والذي يصعب للغاية تكراره20.
يتمثل النهج المتطور في الطب التجديدي لتقليل الفجوة بين المرضى المحتاجين وعمليات زرع الأعضاء في إنتاج سقالات مصنوعة من مصفوفة خارج الخلية منزوعة الخلايا (d-ECM) وإعادة ملئها بأنواع الخلايا المناسبة لتجديد الأعضاء التالفة. إزالة الخلايا هي العملية التي يتم فيها عزل ECM عن خلاياها الأصلية ومادتها الوراثية لإنتاج سقالة طبيعية ومحاكاة حيوية ، قادرة على تجنب الاستجابة المناعية والرفض بمجرد زرعها في المرضى21،22،23. يمكن بعد ذلك إعادة ملء ECM الذي تم الحصول عليه بهذه الطريقة لإنتاج أنسجة وظيفية. المشكلة الرئيسية عند تطوير d-ECM هي الطريقة. بالنسبة لأي تقنية إزالة الخلايا ، يظل الهدف الأساسي هو الحفاظ على تكوين ECM الأصلي ، والصلابة ، والهيكل ثلاثي الأبعاد ، وجميع الاستراتيجيات لها مزايا وعيوب. نظرا لأن التخلص من المحتوى الخلوي والحمض النووي من الأنسجة يتطلب استخدام عوامل كيميائية أو فيزيائية ، أو الجمع بين الاثنين معا ، فإن كل إجراء إزالة الخلايا يسبب ، بدرجات مختلفة ، تعطيل ECM. وبالتالي ، من الأهمية بمكان تقليل الضرر الذي يلحق ب ECM24،25،26.
من المستحسن للغاية استخدام ECM الأصلي كمنصة لإعادة تشكيل ECM الأصلي في المختبر . لهذا الغرض ، تم تطبيق العديد من بروتوكولات إزالة الخلايا على مجموعة واسعة من الأنسجة27،28،29،30. في الواقع ، منذ المراحل الأولى من أبحاث إزالة الخلايا وتطوير ECM ، تم إزالة الخلايا من العديد من الأنسجة ، مثل الشرايين والصمامات الأبهرية والأعصاب الطرفية من كل من والبشر ، ولا تزال بعض d-ECMs متاحة تجاريا وتستخدم لاستبدال الأنسجة أو التئام الجروح31،32،33. في الآونة الأخيرة ، برز جلد الإنسان أيضا كمرشح مناسب لإنتاج سقالات منزوعة الخلايا لإصلاح القلب نظرا لتكوينه وخصائصه الميكانيكية القادرة على تعزيز القدرة التجديدية للخلايا السلفية للقلب (CPCs) والتكيف مع انقباض القلب34. تصف هذه الورقة بروتوكولا بسيطا وسريعا لإنتاج سقالات منزوعة الخلايا من جلد الإنسان البالغ ، مما يسمح بتطوير d-ECM مع بنية محفوظة جيدا.
Protocol
تم جمع العينات من الأنسجة البشرية وفقا لمبادئ إعلان هلسنكي ومراعاة إرشادات مستشفى الجامعة "فيديريكو الثاني". قدم جميع المرضى المشاركين في هذه الدراسة نماذج موافقة مكتوبة.
1. إعداد الحلول
- تحضير 1200 مل من محلول إزالة الخلايا 1٪
- قم بإعداد 600 مل من محلول Triton X-100 2٪ عن طريق قياس 588 مل من الماء المقطر المزدوج في أسطوانة متدرجة ونقله إلى دورق سعة 1 لتر. باستخدام ماصة مصلية ، أضف 12 مل من Triton X-100 وقضيب تقليب إلى الدورق ضع الدورق على محرك مغناطيسي واخلط المحلول حتى يذوب Triton X-100 تماما.
- أوقفوا التحريض. قم بإزالة شريط التقليب باستخدام شريط التقليب. يحفظ في درجة حرارة الغرفة.
- قم بإعداد 600 مل من محلول SDS بنسبة 2٪ عن طريق قياس 550 مل من الماء المقطر المزدوج في أسطوانة متدرجة ونقلها إلى دورق سعة 1 لتر.
- قم بوزن 12 جم من مسحوق SDS في قارب وزن بلاستيكي وانقله إلى الدورق الذي يحتوي على الماء المقطر المزدوج في الخطوة 1.1.3.
ملاحظة: يجب تنفيذ الخطوة 1.1.4 تحت غطاء كيميائي ، ويجب على المستخدم ارتداء معدات الحماية الشخصية. - أضف قضيب تقليب ، ضع الدورق على محرك مغناطيسي ، واخلط المحلول حتى يذوب SDS تماما.
- أوقفوا عملية التحريض. قم بإزالة شريط التقليب باستخدام شريط التقليب.
- انقل المحلول إلى أسطوانة متدرجة واضبط الحجم إلى 600 مل عن طريق إضافة الماء المقطر المزدوج.
- صب محلول 2٪ Triton X-100 المحضر في الخطوة 1.1.1 في أسطوانة سعة 2 لتر.
- صب محلول SDS بنسبة 2٪ المحضر في الخطوات 1.1.3-1.1.7 في نفس الأسطوانة سعة 2 لتر للحصول على حجم إجمالي قدره 1200 مل.
- غطيها بالبارافيلم واخلطيها برفق عن طريق الانعكاس للحصول على محلول متجانس.
- انقل المحلول المختلط إلى زجاجة سعة 2 لتر باستخدام قمع لتجنب تكون الرغوة. قم بتخزين المحلول عند +4 درجة مئوية.
- تحضير 1x محلول ملحي مخزن بالفوسفات (PBS)
- تحضير 500 مل من 1x محلول ملحي مخزن بالفوسفات (PBS) عن طريق إذابة 0.1 غرام من فوسفات البوتاسيوم أحادي القاعدة ، و 0.1 غرام من كلوريد البوتاسيوم ، و 4.0 غرام من كلوريد الصوديوم ، و 0.575 غرام من فوسفات الصوديوم ثنائي القاعدة في الماء المقطر المزدوج المعقم. تحقق من قيمة الأس الهيدروجيني (7.4).
- يحفظ في درجة حرارة +4 درجة مئوية حتى الاستخدام.
- تحضير محلول المضادات الحيوية
- تزن 625 ميكروغرام من الأمفوتريسين B في قارب وزن بلاستيكي.
- ماصة 8 مل من خليط البنسلين والستربتومايسين (القلم / البكتيريا) في أنبوب سعة 15 مل.
- أضف الأمفوتريسين B الموزون إلى خليط القلم / البكتيريا العقدية ، واضبط الحجم على 10 مل عن طريق إضافة خليط البنسلين والستربتومايسين (القلم / البكتيريا). قم بتغطية الأنبوب وإذابة الأمفوتريسين B عن طريق الرج بقوة.
2. اليوم 1 - ابدأ إجراء إزالة الخلايا.
- صب 400 مل من محلول إزالة الخلايا في دورق سعة 500 مل.
- أضف 2.0 مل من محلول المضادات الحيوية.
3. تحضير عينات الجلد
- اغسل عينة جلد الإنسان من بطن المرضى الذين يخضعون لعملية شد البطن في صينية بلاستيكية عن طريق تكديفها وقلبها رأسا على عقب في محلول فسيولوجي متساوي التوتر كلوريد الصوديوم 0.9٪ لإزالة الدم الزائد والسوائل البيولوجية الأخرى.
- قم بإزالة الشعر باستخدام ملقط ناعم ودهون باستخدام مقص جراحي كبير.
- ضع عينة الجلد على لوح التشريح وقم بتشريحها باستخدام مشرط ، مع التدرجات على لوح التشريح كمرجع للحصول على شظايا 3 سم × 2.5 سم (الطول بالعرض) ، وتجنب الندوب والمناطق المتسخة أو المحترقة من الأنسجة.
- ضع كل جزء في شريط تضمين ، وأغلقه ، وتأكد من قفل جميع الكاسيتات بشكل مناسب لتجنب تسرب العينة أثناء إجراء إزالة الخلايا.
- ضع أربعة أشرطة تضمين كحد أقصى مع عينات في دورق مع محلول إزالة الخلايا. أضف شريط التقليب. قم بتغطيتها بورق الألمنيوم ، واكتب في الأعلى جميع المعلومات لتحديد العينة ووقت بدء الإجراء.
- ضع الدورق على النمام المغناطيسي وابدأ التحريك بسرعة دوران تبلغ 150 دورة في الدقيقة. أوقفوا التحريض. قم بإزالة ورق الألمنيوم الذي يغطي الدورق وأخرج أشرطة التضمين بملقط طويل.
ملاحظة: بعد إيقاف التحريض ، تحقق من وضوح المحلول. قم بتعديل مدة التحريك (أقل أو أكثر من 8 ساعات) بناء على درجة التعتيم بسبب إطلاق الحطام الخلوي. - ضع كل كاسيت في طبق 100 مم. استبدل محلول إزالة الخلايا بتكرار الخطوات 3.5-3.6 بين عشية وضحاها.
4. اليوم 2 - تحقق من حالة عينات الجلد.
- أوقفوا عملية التحريض. قم بإزالة ورق الألمنيوم الذي يغطي الدورق وأخرج أشرطة التضمين بملقط طويل.
- ضع كل كاسيت في طبق 100 مم وافتحه. تحقق من لون العينة.
ملاحظة: قد تظهر العينات تغيرا في اللون من البيج الأصلي إلى البياض الثلجي. - إزالة الشعر المتبقي وفصل البشرة عن الأدمة. استبدل محلول إزالة الخلايا بتكرار الخطوات 3.5-3.6.
- توقف عن التحريض بعد 8 ساعات. كرر الخطوات 4.1-4.2 حتى تظهر العينة بيضاء الثلج. أوقف إجراء إزالة الخلايا.
ملاحظة: يمكن تمديد وقت التعرض لعمل المنظفات إذا لزم الأمر. - قم بقياس 400 مل من 1x PBS في أسطوانة سعة 500 مل ، واسكبها في دورق سعة 500 مل ، وأضف 2 مل من خليط Pen Strep / Amphotericin B. أضف شريط التقليب.
- ضع أربعة أشرطة كحد أقصى تحتوي على العينات في كل دورق بمحلول 1x PBS / المضادات الحيوية. قم بتغطيتها بورق الألمنيوم واكتب جميع المعلومات في الأعلى كما في الخطوة 3.5.
- ضع الدورق على محرك مغناطيسي وابدأ التحريك بسرعة دوران تبلغ 150 دورة في الدقيقة طوال الليل ، في درجة حرارة الغرفة.
5. اليوم 3 - غسل نهائي للعينات
- أوقفوا التحريض. استبدل محلول 1x PBS ب 400 مل من الماء المقطر المزدوج. أضف شريط التقليب. قم بتغطيتها بورق الألمنيوم واكتب جميع المعلومات في الأعلى كما في الخطوة 3.5.
- ضع الدورق على محرك مغناطيسي وابدأ التحريك بسرعة دوران تبلغ 150 دورة في الدقيقة لمدة 30 دقيقة.
- أوقفوا عملية التحريض. قم بإزالة ورق الألمنيوم الذي يغطي الدورق وأخرج أشرطة التضمين بملقط طويل.
- ضع كل علبة تضمين تحتوي على عينة الجلد منزوعة الخلايا في طبق 100 مم. افتح الكاسيت وجفف عينات الجلد برفق عن طريق وضعها على مناديل المختبر.
- ضع كل عينة من الجلد منزوع الخلايا في قارب وزن تم وضع علامة عليه مسبقا بمعلومات حول العينة. قم بتغطية القارب بورق الألمنيوم واكتب جميع المعلومات في الأعلى لتحديد العينة. يحفظ في درجة حرارة - 80 درجة مئوية.
النتائج
كان الهدف من البروتوكول هو الحصول على عينة d-ECM للجلد من الأنسجة البيولوجية ، والحفاظ على بنية ثلاثية الأبعاد جيدة التنظيم ومحتوى جيد الحفظ للجزيئات البيولوجية (الشكل 1). تعتمد هذه الطريقة بشكل أساسي على التقليب المستمر للعينات في محلول يحتوي على مزيج من منظفين ، Triton X-100 و SDS ، وبالتالي الحفاظ على السمات البيولوجية والهيكلية النموذجية للأنسجة الأصلية وتقليل وقت التعرض أثناء عملية إزالة الخلايا. عند الاستلام ، تم غسل العينات وإعدادها للإجراء ، والحصول على شظايا بشرة نظيفة مقاس 3 سم × 2.5 سم ، خالية من الشعر أو الأنسجة الدهنية (الشكل 2 والشكل 3). سمح استخدام أشرطة التضمين بتقليل اضطراب الأنسجة (الشكل 3) ، مما أدى إلى عينات ذات بنية أكثر سليمة. لم تظهر على الجلد منزوع الخلايا علامات تلف ميكانيكي أو كيميائي كبير بعد الملاحظة العيانية. تم فصل البشرة أثناء إجراء إزالة الخلايا (الشكل 4 أ ، ب) ، وتغيرت العينات في اللون من البيج ، النموذجي للأنسجة الأصلية بأكملها ، إلى بياض الثلج ، مما يشير إلى إزالة الخلايا الكاملة والناجحة (الشكل 4 ج).

الشكل 1: سير عمل البروتوكول. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: صور تمثيلية لإعداد عينة الجلد عند الاستلام. (أ) العينة الواردة. (ب ، ج) التقييم العياني للعينة الموضوعة على لوح التشريح. (D-F) إزالة الأنسجة الدهنية باستخدام مقص جراحي كبير. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تشريح عينة الجلد ووضعها في أشرطة التضمين. (أ) إزالة الشعر بواسطة ملقط دقيق. (ب - ه) تم تشريح عينات الجلد باستخدام مشرط للحصول على شظايا مقاس 3 سم × 2.5 سم لتلائم أشرطة التضمين. (F ، G) جزء من الجلد يوضع في كاسيت التضمين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
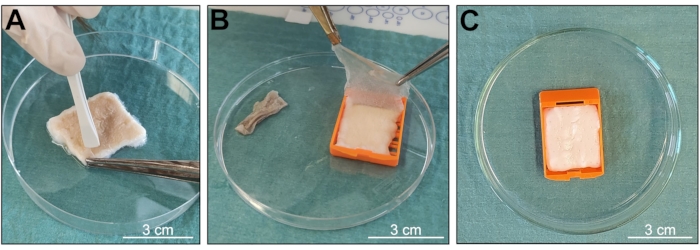
الشكل 4: التحقق من حالة العينة أثناء إزالة الخلايا. (أ ، ب) انفصال البشرة عن الأدمة. (ج) تغيير لون العينة الذي يشير إلى حدوث إزالة الخلايا. أشرطة المقياس = 3 سم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
على الرغم من أن البروتوكول الموصوف أعلاه قد تم تحسينه وتحسينه مقارنة بالبروتوكولات المنشورة سابقا ، إلا أنه يقدم بعض الخطوات الحاسمة التي تحتاج إلى الاهتمام والدقة. يجب تجنب تكوين الرغوة أثناء تحضير محلول إزالة الخلايا لمنع التخفيف غير الصحيح للمنظفات. يمكن معالجة ذلك عن طريق صب المحاليل برفق وجعلها تتدفق على طول الجانب الداخلي للأسطوانة. علاوة على ذلك ، يجب توخي الحذر عند إزالة الأنسجة الدهنية يدويا من العينات ، لأن إزالة الخلايا باستخدام المنظفات ، مثل Triton X-100 و SDS ، لا تقضي على الدهون ، ويمكن أن تؤثر البقايا الدهنية سلبا على فعالية الطريقة. خطوة أخرى حاسمة هي إزالة البشرة من العينات. أثناء إزالة الخلايا ، تنفصل البشرة تدريجيا عن سطح الجلد. في هذه المرحلة ، من الضروري تقشيرها بالملقط فقط عندما يتم جرفها بالكامل ، وبالتالي تجنب تمزيقها أو تقطيعها والتسبب في احتباس الحطام داخل العينات.
يركز هذا البروتوكول على تقليل تأثير إزالة الخلايا على العينات من خلال استراتيجيتين رئيسيتين: اختصار وقت التعرض للإجراء باستخدام منظفين معا28 ، 35 ، 36 وحماية العينات من الإهانات الميكانيكية عن طريق إحاطتها بأشرطة مدمجة37. علاوة على ذلك ، أسفر الإجراء عن نتائج ناجحة عند تطبيقه على عينات أخرى غير الجلد ، مثل عضلة القلب البشرية والخنازير والأوعية الدموية. يتم تقييم فعالية البروتوكول الموصوف هنا بشكل أساسي من خلال الملاحظة العيانية للعينات ، والتي من شأنها أن تظهر تغيرا ملحوظا في اللون ، من البيج إلى الثلج الأبيض. بالتأكيد ، يجب تقييم بعض الجوانب الأخرى لتقييم جودة d-ECM ، مثل إزالة الحطام الخلوي والمواد الوراثية المتبقية ، والحفاظ على البروتينات الهيكلية ومحتوى الجزيئات الحيوية ، والاحتفاظ بالخصائص الميكانيكية ، كما هو موضح في مكان آخر34،37،38. تعد إزالة الحطام الخلوي والمواد الوراثية أمرا بالغ الأهمية لتقليل مناعة البناء. ومن ثم ، فإن بعض معايير تقييم فعالية إزالة هذه المكونات راسخة في الأدبيات: يجب ألا يحتوي d-ECM على أكثر من 50 نانوغرام من الحمض النووي مزدوج الشريطة (dsDNA) 39 لكل مجم من الوزن الجاف ECM ، ويجب ألا تكون أي مادة نووية مرئية مجهريا.
لتلبية هذه المعايير ، يجب إجراء تقييم محتوى الحمض النووي المتبقي والتلوين بالهيماتوكسيلين واليوزين ، كما هو موضح من قبل Di Meglio et al.38 لدعم البيانات العيانية. علاوة على ذلك ، فإن تقييم الحفاظ على ECM عن طريق الكشف عن البروتينات الهيكلية ، مثل الكولاجين والفيبرونكتين واللامينين ، جنبا إلى جنب مع الجليكوزامينوجليكان وعوامل النمو ، مناسبأيضا 34. أخيرا ، يجب أن تتطابق الخصائص الميكانيكية ل d-ECM مع تلك الخاصة بالأنسجة الأصلية40. على الرغم من أن فعالية وجدوى هذا الإجراء قد أثبتت للحصول على أنسجة منزوعة الخلايا مرغوبة ، إلا أن الطريقة لها بعض القيود. على سبيل المثال ، يسمح بإزالة الخلايا من عدد قليل فقط من العينات في المرة الواحدة (4 لكل دورق ، مما يؤدي إلى إهدار كبير في المحاليل. من ناحية ، يساعد استخدام أشرطة التضمين على حماية العينات والحفاظ عليها ؛ من ناحية أخرى ، فإنه يجبر المشغلين على إزالة الخلايا فقط من العينات ذات الأحجام الصغيرة التي تتناسب مع الكاسيت. قيد آخر هو إمكانية التلوث الميكروبي ل d-ECM التي تم الحصول عليها. على الرغم من أن الإجراء يتضمن إضافة المضادات الحيوية ، إلا أنه يوصى بشدة بتعقيم d-ECM بالأشعة فوق البنفسجية قبل الاستخدام. أخيرا ، يجب حساب الحضانات المطلوبة طوال الإجراء بأكمله وتنظيمها بدقة لإدارة الوقت على النحو الأمثل.
تم تطوير هذا البروتوكول لمعالجة العيوب التي لوحظت أثناء اختبار البروتوكولات الأخرى في المختبر. تسمح البروتوكولات الحالية بدرجة متفاوتة من إزالة الخلايا دون ضمان السلامة الكافية للأنسجة ، مما ينطوي على خسارة كبيرة في الجزيئات البيولوجية الأساسية والخصائصالميكانيكية 41. يعد الحفاظ على بنية ECM وتكوينه بعد إزالة الخلايا من الجوانب الأساسية ، حيث قد يعمل d-ECM كسقالة ، بمجرد إعادة توطينها ، ستدعم آليات التجدد الخلوي داخل العضو. من خلال تحسين عملية إزالة الخلايا ، يمكن استخدام السقالات البيولوجية المشتقة من جلد الإنسان في الطب التجديدي ، مما يساعد على تقليل الفجوة بين المتبرعين والمرضى الذين يحتاجون إلى زراعة الأعضاء. بالإضافة إلى ذلك ، فإن التقدم في طرق إعادة الخلايا وتطبيقات الخلايا المشتقة من الخلايا الجذعية متعددة القدرات المستحثة البشرية ستعمل على تحسين توزيع أنواع الخلايا المناسبة42،43 لتمكين عملية التجديد44.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
اي
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl isotonic Physiological solution | Sigma-Aldrich | S8776 | 0.9% in water |
| 1 L beaker | VWR | 511-0318 | Clean and autoclave before use |
| 10 mL serological pipet | Falcon | 357551 | Sterile, polystyrene |
| 100 mm plates | Falcon | 351029 | Treated, sterile cell culture dish |
| 15 mL sterile tubes | Falcon | 352097 | Centrifuge sterile tubes, polypropylene |
| 1 L graduated cylinder | VWR | 612-1524 | Clean and autoclave before use |
| 2 L bottle | VWR | 215-1596 | Clean and autoclave before use |
| 25 mL serological pipet | Falcon | 357525 | Sterile, polystyrene |
| 2 L graduated cylinder | VWR | 612-3072 | Clean and autoclave before use |
| 500 mL beaker | VWR | 511-0317 | Clean and autoclave before use |
| Amphotericin B | Sigma-Aldrich | Y0000005 | Powder |
| Dissecting board | VWR | 100498-398 | Made of high-density polyethylene. |
| Dissecting scalpel | VWR | 233-5526 | Sterile and disposable |
| Embedding cassettes | Diapath | 070191 | External dimensions: 40x26x7 mm (WxDxH) |
| Fine forceps | VWR | 232-1317 | Clean and autoclave before use |
| Funnel | VWR | 221-1861 | Clean and autoclave before use |
| Hexagonal weighing boats size M | Sigma-Aldrich | Z708585 | Hexagonal, polystyrene, 51 mm Bottom I.D., 64 mm Top I.D. |
| Hexagonal weighing boats size S | Sigma-Aldrich | Z708577 | Hexagonal, polystyrene, 25 mm Bottom I.D., 38 mm Top I.D. |
| Large surgical scissors | VWR | 233-1211 | Clean and autoclave before use |
| Long forceps | VWR | 232-0096 | Clean and autoclave before use |
| Penicillin and Streptomycin | Sigma-Aldrich | P4333-100ml | Stabilized, with 10.000 units penicillin and 10 mg streptomycin/mL, 0.1 μm filtered. Store at -20°C. The solution should be aliquoted into smaller working volumes to avoid repeated freeze/thaw cycles Solution. |
| Pipette gun | Eppendorf | 613-2795 | Eppendorf Easypet® 3 |
| Plastic tray | VWR | BELAH162620000 | Corrosion-proof polypropylene plastic tray |
| Potassium Chloride | Sigma-Aldrich | P9333 | Powder |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P5665 | Powder |
| Sodium Chloride | Sigma-Aldrich | S7653 | Powder |
| Sodium Dodecyl Sulfate | Sigma-Aldrich | 62862 | Powder |
| Sodium Phosphate Dibasic | Sigma-Aldrich | 94046 | Powder |
| Spatula | VWR | RSGA038.210 | Clean and autoclave before use |
| Spoon | VWR | 231-1314 | Clean and autoclave before use |
| Stir bar | VWR | 442-0362 | Clean and autoclave before use |
| Stir bar retriever | VWR | 89026-262 | Molded in pure, FDA-approved PTFE |
| Triton X-100 | Sigma-Aldrich | 9002-93-1 | Liquid |
References
- Daley, W. P., Peters, S. B., Larsen, M. Extracellular matrix dynamics in development and regenerative medicine. Journal of Cell Science. 121 (3), 255-264 (2008).
- Lu, P., Takai, K., Weaver, V. M., Werb, Z. Extracellular matrix degradation and remodeling in development and disease. Cold Spring Harbor Perspectives in Biology. 3 (12), 005058(2011).
- Dobaczewski, M., Gonzalez-Quesada, C., Frangogiannis, N. G. The extracellular matrix as a modulator of the inflammatory and reparative response following myocardial infarction. Journal of Molecular and Cellular Cardiology. 48 (3), 504-511 (2010).
- Frangogiannis, N. G. Matricellular proteins in cardiac adaptation and disease. Physiological Reviews. 92 (2), 635-688 (2012).
- Etoh, T., et al. Myocardial and interstitial matrix metalloproteinase activity after acute myocardial infarction in pigs. American Journal of Physiology-Heart and Circulating Physiology. 281 (3), 987-994 (2001).
- Ma, Y., et al. Myofibroblasts and the extracellular matrix network in post-myocardial infarction cardiac remodeling. Pflügers Archiv: European Journal of Physiology. 466 (6), 1113-1127 (2014).
- Fong, A. H., et al. Three-dimensional adult cardiac extracellular matrix promotes maturation of human induced pluripotent stem cell-derived cardiomyocytes. Tissue Engineering. Part A. 22 (15-16), 1016-1025 (2016).
- Atance, J., Yost, M. J., Carver, W. Influence of the extracellular matrix on the regulation of cardiac fibroblast behavior by mechanical stretch. Journal of Cell Physiology. 200 (3), 377-386 (2004).
- Belviso, I., et al. The microenvironment of decellularized extracellular matrix from heart failure myocardium alters the balance between angiogenic and fibrotic signals from stromal primitive cells. International Journal of Molecular Sciences. 21 (21), 7903(2020).
- Badylak, S. F. Regenerative medicine and developmental biology: The role of the extracellular matrix. The Anatomical Record. 287 (1), 36-41 (2005).
- Volpato, F. Z., Führmann, T., Migliaresi, C., Hutmacher, D. W., Dalton, P. D. Using extracellular matrix for regenerative medicine in the spinal cord Using extracellular matrix for regenerative medicine in the spinal cord. Biomaterials. 34 (21), 4945-4955 (2013).
- Martino, M. M., et al. Extracellular matrix and growth factor engineering for controlled angiogenesis in regenerative medicine. Frontiers in Bioengineering and Biotechnology. 3, 45(2015).
- Hussey, G. S., Keane, T. J., Badylak, S. F. The extracellular matrix of the gastrointestinal tract: a regenerative medicine platform. Nature Reviews: Gastroenterology Hepathology. 14, 540-552 (2017).
- Sheng, Y., Fei, D., Leiiei, G., Xiaosong, G. Extracellular matrix scaffolds for tissue engineering and regenerative medicine. Current Stem Cell Research and Therapy. 12 (3), 233-246 (2017).
- Rozario, T., De Simone, D. W. The extracellular matrix in development and morphogenesis: A dynamic view. Developmental Biology. 341 (1), 126-140 (2010).
- Takawale, A., Sakamuri, S. S. V. P., Kassiri, Z. Extracellular matrix communication and turnover in cardiac physiology and pathology. Comprehensive Physiology. 5 (2), 687-719 (2015).
- Li, L., Zhao, Q., Kong, W. Extracellular matrix remodeling and cardiac fibrosis. Matrix Biology. 68-69, 490-506 (2018).
- DeQuach, J. A., et al. Simple and high yielding method for preparing tissue specific extracellular matrix coatings for cell culture. PLoS ONE. 5 (9), 13039(2010).
- Saldin, L. T., Cramer, M. C., Velankar, S. S., White, L. J., Badylak, S. F. Extracellular matrix hydrogels from decellularized tissue: Structure and function. Acta Biomaterialia. 49, 1-15 (2017).
- Tukmachev, D., et al. Injectable extracellular matrix hydrogels as scaffolds for spinal cord injury repair. Tissue Engineering. Part A. 22 (3-4), 306-317 (2016).
- Shoichet, M. S. Polymer scaffolds for biomaterials applications. Macromolecules. 43 (2), 581-591 (2010).
- Taylor, D. A., et al. Decellularized matrices in regenerative medicine. Acta Biomaterialia. 74, 74-89 (2018).
- Gilpin, A., Yang, Y. Decellularization strategies for regenerative medicine: From processing techniques to applications. BioMed Research International. 2017, 9831534(2017).
- Heath, D. E. A review of decellularized extracellular matrix biomaterials for regenerative engineering applications. Regenerative Engineering and Translational Medicine. 5 (2), 155-166 (2019).
- Hoshiba, T., et al. Decellularized extracellular matrix as an in vitro model to study the comprehensive roles of the ECM in stem cell differentiation. Stem Cell International. 2016, 6397820(2016).
- Keane, T. J., Swinehart, I. T., Badylak, S. F. Methods of tissue decellularization used for preparation of biologic scaffolds and in vivo relevance. Methods. 84, 5-34 (2015).
- Cerbotari, S., et al. Detergent decellularization of heart valves for tissue engineering: Toxicological effects of residual detergents on human endothelial cells. Artificial Organs. 34 (3), 206-210 (2010).
- Ott, H. C., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Uygun, B. E., et al. Organ reengineering through development of a transplantable recellularized liver graft using decellularized liver matrix. Nature Medicine. 16 (7), 814-820 (2010).
- Petersen, T. H., et al. Tissue-engineered lungs for in vivo implantation. Science. 329 (5991), 538-541 (2010).
- Calle, E. A., Petersen, T. H., Niklason, L. E. Procedure for lung engineering. Journal of Visualized Experiments. (49), e2651(2011).
- Zeltinger, J., Landeen, L. K., Alexander, H. G., Kidd, I. D., Sibanda, B. Development and Characterization of Tissue-Engineered Aortic Valves. Tissue engineering. Part A. 7 (1), 9-22 (2001).
- Dahl, S., et al. Decellularized native and engineered arterial scaffolds for transplantation. Cell Transplantation. 12 (6), 659-666 (2003).
- Belviso, I., et al. Decellularized human dermal matrix as a biological scaffold for cardiac repair and regeneration. Frontiers inTissue Engineering and Regenerative Medicine. 8, 229(2020).
- Greco, K. V., et al. Characterisation of porcine dermis scaffolds decellularised using a novel non-enzymatic method for biomedical applications. Journal of Biomaterials Applications. 30 (2), 239-253 (2015).
- Brouki, M. P., et al. Decellularization and preservation of human skin: A platform for tissue engineering and reconstructive surgery. Methods. 171, 62-67 (2020).
- Carbonaro, D., et al. A low-cost scalable 3D-printed sample-holder for agitation-based decellularization of biological tissues. Medical Engineering & Physics. 85, 7-15 (2020).
- Di Meglio, F., et al. Optimization of human myocardium decellularization method for the construction of implantable patches. Tissue Engineering. Part C Methods. 23 (9), 525-539 (2017).
- Crapo, P. M., Gilbert, T. W., Badylak, S. F. An overview of tissue and whole organ decellularization processes. Biomaterials. 32 (12), 3233-3243 (2011).
- Putame, G., et al. Compact and tunable stretch bioreactor advancing tissue engineering implementation. Application to engineered cardiac constructs. Medical Engineering & Physics. 84, 1-9 (2020).
- Parmaksiz, M., Dogan, A., Odabas, S., Elçin, A. E., Elçin, Y. M. Clinical applications of decellularized extracellular matrices for tissue engineering and regenerative medicine. Biomedical Materials. 11 (2), 022003(2016).
- Sacco, A. M., et al. Diversity of dermal fibroblasts as major determinant of variability in cell reprogramming. Journal of Cellular and Molecular Medicine. 23 (6), 4256-4268 (2019).
- Belviso, I., et al. Isolation of adult human dermal fibroblasts from abdominal skin and generation of induced pluripotent stem cells using a non-integrating method. Journal of Visualized Experiments: JoVE. (155), e60629(2020).
- Belviso, I., Di Meglio, F., Romano, V., Montagnani, S., Castaldo, C. Non-modified RNA-based reprogramming of human dermal fibroblasts into induced pluripotent stem cells. Methods in Molecular Biology. , (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved