Method Article
Лечение ишемии/реперфузионного повреждения с помощью нетеплового инфракрасного света и последующий анализ дифференцировки макрофагов
В этой статье
Резюме
Описано снижение реперфузионного повреждения при облучении с длиной волны 670 нм на мышиной модели ишемии и реперфузии путем наложения жгута. Это облучение с длиной волны 670 нм уменьшало воспалительную реакцию, уменьшало количество провоспалительных макрофагов и увеличивало защитные макрофаги.
Аннотация
Повреждение тканей и некроз в результате воспалительных процессов являются следствием ишемической реперфузионной травмы (ИРИ). В скелетных мышцах ишемия снижает аэробную энергетическую емкость мышечных клеток, что приводит к неблагоприятным биохимическим изменениям и воспалению. Цель данного исследования состоит в том, чтобы показать, что воздействие ближнего инфракрасного света (NIR) в период ишемии снижает IRI за счет уменьшения некроза и воспаления в дополнение к уменьшению провоспалительного M1 и увеличению защитных макрофагов M2. Мышам C57/Bl6 подвергалась односторонняя ишемия задних конечностей, индуцированная жгутом, в течение 3 ч с последующей реперфузией в течение 15 или 30 мин. Мыши были случайным образом распределены по 3 группам. Группе 1 была выполнена ИРИ с 30 мин реперфузией. Группе 2 была выполнена ИРИ с реперфузией 15 минут. Каждая группа состояла из мышей, на 50% не получавших БИК, и на 50% обработанных БИК мышей с экспозицией 50 мВт/см2 в течение 5 мин/1 ч после закрытия жгута. Группу 3 составляли фиктивные животные, которых обезболивали в течение 3 ч без ИРИ.
Лазерная допплеровская визуализация потока была проведена на всех мышах для подтверждения ишемии и реперфузии. Данные о потоке были выражены в виде соотношения ишемизированной конечности и контралатерального контроля. Мышей усыпляли после реперфузии, а также собирали квадрицепсы и икроножные мышцы. Проводили иммунопреципитацию и вестерн-блоттинг макрофагов-маркеров CD68 (M1) и CD206 (M2), которые нормализовали к экспрессии CD14. Экспрессия маркеров воспаления CXCL1 и CXCL5 была значительно снижена при использовании NIR в группе IRI. Значительное снижение CD68 и увеличение экспрессии CD206 наблюдалось у животных, получавших ИР и БИК. В группе ИРИ некроз тканей был снижен за счет БИК, что визуализировалось с помощью окрашивания 2,3,5-трифенилтетразолия хлорида (ТТС). Полученные данные свидетельствуют о том, что воздействие БИК снижает ИРИ и улучшает выживаемость тканей. NIR уменьшал воспаление, уменьшал провоспалительный M1 и увеличивал защитные макрофаги M2. Воздействие БИК уменьшало воспаление и усиливало регенерацию, что приводило к защите тканей после ишемии.
Введение
Ишемическое реперфузионное повреждение (ИРИ) является клинической проблемой, наблюдаемой после повреждения сосудов и длительного использования хирургических жгутов. Предыдущие исследования показали, что 60-90 мин – это верхний порог времени теплой ишемии, за пределами которого может произойти необратимое повреждение тканей. Больше, чем какой-либо другой фактор, ограничения по времени теплой ишемии ограничивают успех и спасение реимплантации дисваскулярных конечностей 1,2.
В скелетных мышцах ишемия снижает аэробную способность клеток, что приводит к острому воспалению и неблагоприятным биохимическим изменениям. Эти эффекты усугубляются реперфузией, которая стимулирует набор нейтрофилов и выработку свободных радикалов, еще больше повреждая скелетные мышцы. Это может произойти из-за окклюзии сосудов, будь то в результате травмы или преднамеренного использования жгута для предотвращения кровотечения. Некоторыми из ключевых медиаторов в этом процессе являются миелопероксидаза (МПО), фермент, экспрессируемый нейтрофилами, который является неотъемлемой частью функции дыхательного взрыва и производства свободныхрадикалов3, и хемокины, такие как CXCL1 и CXCL5, которые служат для рекрутирования нейтрофилов в места острого воспаления4.
Бедренная артерия не рассекалась, чтобы имитировать открытый жгут в экстренной ситуации. Этот подход также основан на воспроизводимости создания ишемии и реперфузии, а также на устойчивой безкровной области. Предыдущие исследования показали, что воздействие нетеплового инфракрасного (NIR) света с длиной волны 670 нм может увеличить сосудистую коллатерацию в ишемизированной задней конечности мыши с воздействием NIR в течение нескольких дней, смягчая эффекты IRI5. Кроме того, предыдущие исследования показали, что свет ближнего ИК-диапазона может индуцировать поляризацию макрофагов в провоспалительный (M1) или прозаживающий (M2) фенотип6.
Любое лечение, которое может свести к минимуму повреждение тканей и гибель клеток после гипоксии и реперфузии, будет полезным для увеличения успеха в спасении конечностей после сосудистых повреждений. Таким образом, общая цель состоит в том, чтобы улучшить IRI путем введения лечения светом 670 нм в качестве жизнеспособного варианта к другим методам лечения. Эта статья основана на гипотезе о том, что воздействие света ближнего ИК-диапазона в период ишемии уменьшает воспаление и некроз тканей за счет снижения секреции белков хемоаттрактанта и притока воспалительных клеток, побуждая макрофаги принимать фенотип M2.
протокол
Данное исследование проводилось в строгом соответствии с рекомендациями, содержащимися в Руководстве по уходу и использованию лабораторных животных Национальных институтов здравоохранения. Протокол был одобрен Комитетом по институциональному уходу за животными и их использованию (Протокол: AUA#1517). Все исследования с участием мышей проводились в соответствии с политикой PHS.
1. Наложение жгута
ПРИМЕЧАНИЕ: Жгут был наложен для индукции ишемии и получения бескровного операционного поля.
- Обезболить мышь C57/Bl6 изофлураном в индукционной камере в концентрации 3-5%.
- Извлекайте мышь из индукционной камеры, когда она не реагирует на защемление пальцев ног. Поместите мышь в носовой конус для продолжения анестезии со скоростью 1,5-2% на грелку с неотражающим ковриком под лазерным допплером (LDI).
- Наложите жгут вокруг левой задней конечности (рисунок 1).
ПРИМЕЧАНИЕ: Пока не закрывайте жгут. Сначала измерьте кровоток (см. раздел 2).
2. Измерение кровотока с помощью LDI
ПРИМЕЧАНИЕ: Измеряли кровоток для подтверждения правильной окклюзии и реперфузии, как описано ранее7.
- Поместите мышь под наркозом ниже LDI (26 см) на грелку с неотражающей поверхностью в положении лежа с вытянутыми лапами и лапами вверх.
- Для захвата изображений можно поместить мышь в область захвата лазера (16,1 см x 16,1 см).
- Настройте скорость сканирования лазера 4 мс/пиксель. Делайте снимки с помощью запатентованного программного обеспечения, нажав кнопку записи . Делайте снимки до, во время окклюзии и во время реперфузии, нажав на кнопку записи .
ПРИМЕЧАНИЕ: Изображения являются картографическими изображениями, связанными с потоком; красный – хороший кровоток; Синий цвет – это отсутствие кровотока. Подтвердите на изображении, что окклюзированная задняя конечность синего цвета. Точно так же проверьте изображение, чтобы убедиться, что ранее окклюзированная задняя конечность имеет красный цвет при реперфузии. Крайне важно иметь неотражающий коврик для LDI; В противном случае отражение повлияет на изображения.
- Настройте скорость сканирования лазера 4 мс/пиксель. Делайте снимки с помощью запатентованного программного обеспечения, нажав кнопку записи . Делайте снимки до, во время окклюзии и во время реперфузии, нажав на кнопку записи .
- Проанализируйте изображения с помощью предоставленного программного обеспечения, определив область интереса. Установите соотношение между ишемизированными и контрольными ногами.
3. Протокол ишемии и реперфузии
- Закройте жгут вокруг задней конечности мыши, находящейся под наркозом, на 3 часа.
ПРИМЕЧАНИЕ: Затягивание жгута создает ишемию, прерывая кровоток. - Открыть жгут через 3 ч после окклюзии; Раскройте и перфузируйте заднюю конечность в течение 15 или 30 минут.
4. Забор тканей
- Увеличьте анестезию до 5% изофлурана для глубокой анестезии мышей. Проведите пневмоторакс, вскрыв грудную полость острыми ножницами, чтобы обеспечить смерть. Сбор икроножных мышц и четырехглавой мышцы 8,9,10.
- Заморозьте собранную ткань в жидком азоте и храните при температуре -80 °C для дальнейшего анализа.
5. Заявка на NIR
ПРИМЕЧАНИЕ: NIR применяется для снижения воспаления и уменьшения реперфузионного повреждения.
- Применяйте NIR с длиной волны 670 нм с интенсивностью 100 мВт в течение 5 мин один раз в час во время окклюзии.
- Нацельтесь на заднюю конечность с помощью оптоволоконного источника света на расстоянии 2,5 см между задней конечностью и светом. Не подвергайте контралатеральную ногу воздействию ближнего ИК-диапазона (см. схему на рисунке 1 ).
- Светите ближним инфракрасным излучением в течение 5 минут в час в течение ишемического периода.
- Таким же образом оснастим фиктивную группу. Не закрывайте жгут и не накладывайте NIR на заднюю конечность.
ПРИМЕЧАНИЕ: Лампа ближнего ИК-диапазона оснащена радиатором. Температура не повышается в течение 5 мин от воздействия света11.
6. Некроз ТТС
ПРИМЕЧАНИЕ: Некроз тканей оценивается для визуализации уменьшения некроза в мышечной ткани.
- Свежие четырехглавые мышцы окрашивать TTC при температуре 37 °C в течение 20-30 мин в 1% TTC в 0,1 М фосфатном буфере, доведенном до pH 7,4.
- Наблюдайте за красной, окрашенной живой тканью на основании наличия формазанового осадка.
ПРИМЕЧАНИЕ: Красное окрашивание основано на снижении TTC ферментами дегидрогеназы в здоровых тканях. Некротическая ткань неокрашенная10. - Получение изображений окрашенных TTC срезов для анализа и измерение некротической области путем определения области интереса.
7. Западный анализ на хлортирозин
- Подвергните мышей протоколу ишемии/реперфузии (раздел 3).
- Соберите ткани (раздел 4) и изолируйте белок, как описано ранее12. Определите концентрацию белка с помощью анализа Брэдфорда13.
- Используйте общий лизат белка для проведения электрофореза и блоттинга на 3-хлортирозин, как описано ранее12.
- Проводят вестерн-блоттинг на лизаты икроножной мышцы.
- Добавьте в образцы буфер для проб Laemmli, содержащий 5% меркаптоэтанола, чтобы получить концентрацию общего белка 25 мкг в 40 мкл.
- Проведите испытания образцов на 4-15% геле с удлиненным содержанием трис-глицина (см. Таблицу материалов) при 50 мВ в течение 5 минут. Увеличьте напряжение до 100 мВ на 1 ч, пока не закончится фронт красителя.
- Инкубируйте гель в 1x трансферном буфере (25 мМ Трис, 190 мМ глицина, 20% метанола; при необходимости отрегулируйте pH до 8,3) в течение 10 минут.
- Соберите сэндвич для переноса (губка, фильтр, гель, целлюлозная мембрана, фильтр, губка). Поместите многоразовый пакет со льдом в передаточное устройство. Перенос на 30 минут в холодильную камеру при давлении 100 мА.
ПРИМЕЧАНИЕ: Убедитесь, что в переводном бутерброде нет пузырьков, клякса находится на катоде, а гель на аноде. - Промойте блотку и забейте ее в блокирующий буфер (см. Таблицу материалов) с 0,05% Tween в течение 30 минут при комнатной температуре. Промойте блот трис-буферным физиологическим раствором (TBS), содержащим 5% Tween, три раза в течение 5 минут каждый раз перед добавлением основного антитела.
- Инкубировать в течение ночи с первичными поликлональными антителами к 3-хлортирозину. Разведите антитела в блокирующем буфере с 0,05% Tween (1:1,000).
- Используйте конъюгированный с пероксидазой хрена (HRP) ослиный антимышиный IgG и HRP-антикозий IgG (разведение 1:10 000) в качестве вторичных антител.
- Визуализируйте полосы идентичности в блоттинге с помощью реагента с усиленной хемилюминесценцией (ECL) и системы визуализации.
- Смешайте компоненты в соответствии с протоколом производителя и инкубируйте их с блотом в течение 3 мин для связывания реагентов ECL с интересующими полосами.
- Визуализируйте блоттинг с помощью системы визуализации (см. Таблицу материалов). Используйте программное обеспечение для обработки изображений, такое как ImageJ, для измерения плотности и нормализации значений плотности интересующих каналов по отношению к контрольным каналам.
8. ИФА для CXCL1 и CXCL5
- Выделите общий белок из икроножных мышц, как описано ранее12.
- Оценивайте степень воспаления с помощью иммуноферментного анализа для CXCL1 и CXCL5, как описано ранее14 и в соответствии с инструкциями производителя.
9. Иммунопреципитация с последующим западным анализом
- Подвергните мышей протоколу ишемии/реперфузии (раздел 3).
- Соберите ткани (раздел 4) и изолируйте белок, как описано ранее12. Определите концентрацию белка с помощью анализа Брэдфорда13.
- Чтобы концентрировать макрофагальную фракцию общего белка лизата, проводят иммунопреципитацию для CD14, как описано ранее15.
- Используйте иммунопреципитат CD14 для проведения электрофореза и блоттинга на CD206 и CD68, как описано ранее12.
- Проведите вестерн-блоттинг на лизатах икроножной мышцы, как описано в разделе 7.
- Инкубируйте иммунопреципитаты в течение ночи с первичными поликлональными антителами к CD206 или CD68. Разведите антитела в соотношении 1:200 при ТБС.
- Используйте HRP-конъюгированный ослиный антимышиный IgG и HRP-антикозий IgG (разведение 1:10 000) в качестве вторичных антител.
- Нанесите реагент ECL на блоттинг после смешивания компонентов в соответствии с протоколом производителя и инкубируйте в течение 3 минут для визуализации интересующих полос. Визуализируйте блоттинг с помощью системы визуализации.
10. Статистический анализ
- Проведите статистический анализ данных внутри и между группами с анализом дисперсии (ANOVA) для повторных измерений с последующей модификацией t-критерия Стьюдента по Бонферрони, p ≤ 0,05.
- Экспрессируйте данные в виде среднего ± стандартной погрешности среднего (SEM) или среднего ± стандартного отклонения (SD).
Результаты
Измерения потока подтвердили ишемию и реперфузию
Размещение света в ближнем ИК-диапазоне и протокол эксперимента показаны на рисунке 1. Была разработана модель ишемии задних конечностей у мышей, которая была использована для оценки влияния воздействия NIR на IRI скелетных мышц. Как и ожидалось, лазерная допплеровская визуализация потока (рис. 2A) подтвердила, что жгут эффективен в индуцировании ишемии наряду с возвращением кровотока к исходному уровню как для задних конечностей, обработанных NIR (n = 6), так и без обработки светом (n = 6). Тепловизионное изображение (рис. 2A) также показало, что не было нагрева конечностей от светодиодных матриц, что позволяет предположить, что наблюдаемые эффекты были связаны с ближним инфракрасным светом, а не с тепловым нагревом.
Лечение NIR уменьшает инфаркт четырехглавой мышцы плеча
При грубом гистологическом оконтуривании скелетной мышечной ткани с окрашиванием ТТС (рис. 3А) показано достоверное <уменьшение количества некротической ткани в квадрицепсах, обработанных светом БИК (n = 3), после ИРИ по сравнению с квадрицепсами без воздействия БИК (n = 3, рис. 3Б).
Применение в БИК снижает экспрессию хлортирозина при икроножных мышцах
Вестерн-блоттинг аддуктов 3-хлортирозина (рис. 4) проводили в качестве суррогатного маркера присутствия острофазных нейтрофилов. Оно продемонстрировало достоверное снижение экспрессии аддуктоза хлортирозина в 2,9 раза (p < 0,05) в икроножной мышце, обработанной светом БИК, после ИРИ по сравнению с икроножной мышцей, не подвергшейся воздействию БИК.
Применение в ближнем ИК-диапазоне снижает экспрессию CXCL1 и CXCL5 при икроножных желудках
Для определения уровней экспрессии двух провоспалительных хемокинов CXCL1 (рис. 5A) и CXCL5 (рис. 5B) использовали ИФА. Лечение NIR значительно снижало экспрессию CXCL1 и CXCL5 после 15 минут реперфузии. Только уровень экспрессии CXCL5 был значительно снижен после 30 минут реперфузии.
Влияние лечения БИК на фенотип макрофагов при икроножных мышцах
Для понимания вклада макрофагов макрофагов в размножение воспаления проводили иммунопреципитацию на маркер макрофагов CD14 с последующим анализом вестерн-блоттинга на маркер М1 CD68 и маркер М2 CD206. Эти данные свидетельствуют о том, что лечение БИК снижало уровень экспрессии маркера воспалительных макрофагов М1 (Ишемия + БИК 5752 ± 154, Ишемия - БИК 6464 ± 213, Контроль 6524 ± 202) и повышало уровень экспрессии защитного маркера макрофагов М2 (Рисунок 6В), нормализованный до уровня экспрессии маркера общего макрофага (Ишемия + БИК 7378.68 ± 425, Ишемия - NIR 5853.67 ± 215, контроль 5542.53 ± 220).

Рисунок 1: Протокол эксперимента и положение волоконно-оптического источника света. Сокращения: LDI = лазерный доплеровский тепловизор; NIR = ближний инфракрасный диапазон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
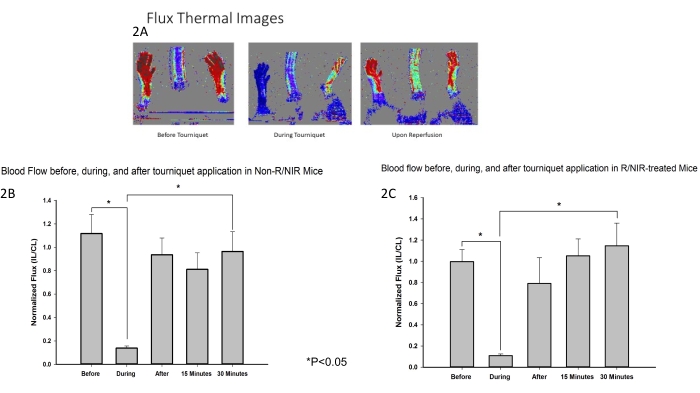
Рисунок 2: Измерения LDI подтвердили, что жгут эффективен в индуцировании ишемии. (A) Тепловые изображения потока демонстрируют прерывание кровотока и восстановление кровотока после реперфузии. Анализ изображений потока показывает прерывание кровотока во время ишемии и восстановление кровотока при реперфузии у мышей контрольной группы (B) и мышей, получавших R/NIR (C). Сокращения: LDI = лазерный доплеровский тепловизор; R = реперфузия; NIR = ближний инфракрасный свет. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
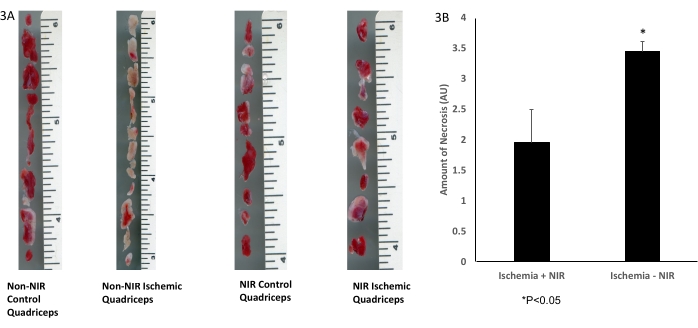
Рисунок 3: ТТС окрашивание скелетной мышечной ткани. (А) окрашивание ТТС; (В) анализ показывает значительное уменьшение инфарктированной скелетной мышечной ткани. Масштабная линейка (дюймы) отображает размер четырехглавой мышцы. *P ≤ 0,05. Сокращения: NIR = ближний инфракрасный; ТТС = 2,3,5-трифенилтетразолия хлорид. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: 3-Уровни экспрессии хлортирозина в скелетных мышцах после облучения NIR. Вестерн-блоттинг показал значительное снижение уровня экспрессии 3-хлортирозина в скелетных мышцах после облучения NIR. *P ≤ 0,05. Сокращения: NIR = ближний инфракрасный; IL = ишемическая конечность; CL = контралатеральная конечность. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
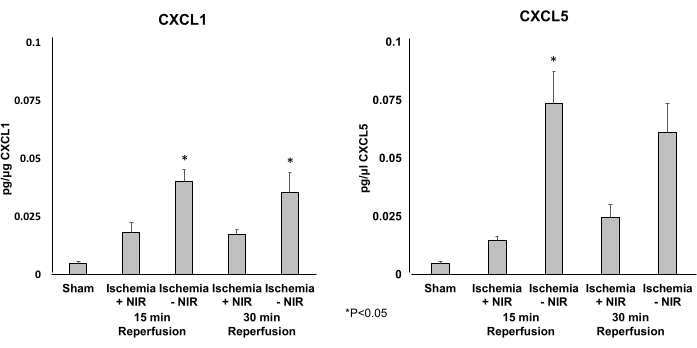
Рисунок 5: Уровни экспрессии CXCL1 и CXCL5, определенные с помощью ИФА. (A) Уровни экспрессии CXCL1 значительно снижаются через 15 минут реперфузии в группе NIR. Этот значительный эффект ослаб через 30 минут по сравнению с контролем без NIR. (B) Уровни экспрессии CXCL5 значительно снижаются через 15 и 30 минут реперфузии в группе света по сравнению с группой без света. *P ≤ 0,05. Сокращения: NIR = ближний инфракрасный; ИФА = иммуноферментный анализ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Уровни экспрессии M1 и M2 нормализованы до общего макрофагального маркера CD14, определенного с помощью иммунопреципитации с последующим вестерн-блоттингом. (A) Уровень экспрессии макрофагального маркера М1 CD68 нормализован до экспрессии макрофагального маркера CD14. Лечение светом значительно снижало уровень экспрессии провоспалительного маркера M1 CD68 по сравнению с лечением и контролем без света. (В) Уровень экспрессии защитного макрофагального маркера М2 CD206 нормализован к экспрессии макрофагального маркера CD14. Лечение светом значительно увеличивало экспрессию CD206 по сравнению с лечением и контролем без света. *P ≤ 0,05. Сокращение: NIR = ближний инфракрасный. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В этой статье описывается одно из первых исследований, посвященных уменьшению реперфузионного повреждения при лечении светом ближнего ИК-диапазона путем изменения воспалительной реакции в задней конечности. Ишемическая реперфузионная травма и лечение светом ближнего ИК-диапазона не являются чем-то новым. Другие исследования были сосредоточены на реперфузии ишемии под действием света ближнего ИК-диапазона. Лечение светом NIR успешно используется для уменьшения размера инфраакта миокарда и уменьшения повреждения почек после ишемического реперфузионного повреждения. Quirk et al. сообщили об уменьшении размера инфаркта миокарда и уменьшении реперфузии ишемии после применения NIR 16,17,18.
Наложение жгута имеет большое значение для остановки кровотечения после ранения или создания бескровного участка в клинических условиях во время хирургического вмешательства и в чрезвычайных ситуациях, в том числе на поле боя19. Наличие длительной ишемии с последующей реперфузией вызывает опасения по поводу реперфузионного повреждения.
Эти данные показывают, что фототерапия в виде применения светодиодного света с длиной волны 670 нм уменьшает реперфузионное повреждение за счет снижения воспалительной реакции и изменения макрофагов с воспалительного на противовоспалительный фенотип после наложения жгута. Экспрессия маркера воспаления, хлоротирозина, повышается после ишемической реперфузии, что подчеркивает травму (Рисунок 3). Хлортирозин является конечным продуктом окисления активности МПО. Yu et al. сообщили об увеличении экспрессии хлортирозина в качестве маркера воспаления в модели ишемической реперфузии мышиного инсульта20.
Кроме того, Souza et al. описали изменение фенотипа макрофагов через 24 ч после фотобиомодуляции с использованием клеточной линии макрофагов J774, заключив, что лечение NIR модулирует воспалительные фазы и улучшает восстановление тканей 6,21. В дополнение к рекрутингу макрофагов и различных других иммунных клеток, CXCL1 и CXCL5 оказывают значительное влияние хемоаттрактантов на нейтрофилы, которые непосредственно отвечают за IRI. MCP-1 не был включен в этот анализ, поскольку он является строго моноцитарным/макрофагальным хемоаттрактантом. CXCL1 и CXCL5 продуцируются различными клетками, включая макрофаги, нейтрофилы и эпителиальные клетки 4,22
Ограничением данного исследования является глубина проникновения света ближнего ИК-диапазона. Hu et al. описывают проникновение на 5 см в большинство тканей с использованием трупов и сравнение различных участков23. Подход данной работы заключался в определении поляризации макрофагов М1 и М2 на основе концентрации всех макрофагов методом иммунопреципитации с последующим вестерн-блоттингом для определения изменений вклада М1 и М2 в воспаление после лечения БИК. Иммунофлуоресценция, проточная цитометрия и целая панель маркеров поляризации макрофагов не проводились. Эти результаты показывают, что воспаление в условиях реперфузии/травмы было уменьшено с помощью лечения светом NIR, и предполагают возможное клиническое применение. Наиболее важными этапами в этом протоколе являются подтверждение окклюзии и применение света NIR один раз в час в течение 5 минут на протяжении всей ишемии.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Мы благодарим отделение ортопедической хирургии за финансирование данного исследования. Мы также благодарим Брайана Линдемера и Гранта Брукеля за их техническую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium | Sigma Aldrich | 17779-10X10ML-F | 1% solution |
| 4–15% Criterio TGX Stain-Free Protein Gel | BioRad | #5678084 | Tris-glycine extended gels |
| 4x Laemmli Sample Buffer - 1610747 | BioRad | 16110747 | |
| 670 nm light source | NIR Technologies | custom made | |
| BCA Protein Assay Kit | Thermo Fisher | 23227 | |
| BioRad ChemiDoc | Bio-Rad | Imaging system | |
| Bio-Rad | |||
| β-mercaptoethanol | BioRad | 1610710 | |
| CXCL1 ELISA | R&D Systems | DY453-05 | |
| CXCL5 ELISA | R&D Systems | DX000 | |
| Forane | Baxter | 1001936040 | isoflurane inhalant |
| goat anti-rabbit IgG-HRP | Santa Cruz Biotechnologies | sc-2004 | 1:10,000 dilution |
| Ice Accu ice pack | |||
| Laser doppler Imager | Moor | MOORLDI2-HIR | |
| monoclonal CD14 antibody | Santa Cruz Biotechnologies | sc-515785 | 1:200 dilution |
| monoclonal CD206 antibody | Santa Cruz Biotechnologies | sc-58986 | 1:200 dilution |
| monoclonal CD68 antibody | Santa Cruz Biotechnologies | sc-20060 | 1:200 dilution |
| Pierce Protein free (TBS) blocking buffer | blocking buffer | ||
| polyclonal Chlorotyrosine Antibody | Hycult | HP5002 | 1:1,000 dilution |
| Protein A/G PLUS-Agarose | Santa Cruz Biotechnologies | sc-2003 | |
| Super Signal West Femto | ThermoFisher | 34095 | enhanced chemiluminescence reagent |
Ссылки
- Drysch, M., et al. An optimized low-pressure tourniquet murine hind limb ischemia reperfusion model: Inducing acute ischemia reperfusion injury in C57BL/6 wild type mice. PLoS One. 14 (1), 0210961 (2019).
- Bonheur, J. A., Albadawi, H., Patton, G. M., Watkins, M. T. A noninvasive murine model of hind limb ischemia-reperfusion injury. Journal of Surgical Research. 116 (1), 55-63 (2004).
- Whiteman, M., Spencer, J. P. Loss of 3-chlorotyrosine by inflammatory oxidants: implications for the use of 3-chlorotyrosine as a bio-marker in vivo. Biochemical and Biophysical Research Communications. 371 (1), 50-53 (2008).
- Becker, S., Quay, J., Koren, H. S., Haskill, J. S. Constitutive and stimulated MCP-1, GRO alpha, beta, and gamma expression in human airway epithelium and bronchoalveolar macrophages. American Journal of Physiology. 266 (3), 278-286 (1994).
- Zaidi, M., et al. Transient repetitive exposure to low level light therapy enhances collateral blood vessel growth in the ischemic hindlimb of the tight skin mouse. Photochemistry and Photobiology. 89 (3), 709-713 (2013).
- Souza, N. H. C., et al. Photobiomodulation and different macrophages phenotypes during muscle tissue repair. Journal of Cellular and Molecular Medicine. 22 (10), 4922-4934 (2018).
- Tang, G. L., Kim, K. J. Laser doppler perfusion imaging in the mouse hindlimb. Journal of Visualized Experiments: JoVE. (170), e62012 (2021).
- Ionescu, A., Zahavi, E. E., Gradus, T., Ben-Yaakov, K., Perlson, E. Compartmental microfluidic system for studying muscle-neuron communication and neuromuscular junction maintenance. European Journal of Cell Biology. 95 (2), 69-88 (2016).
- Adamovich, Y., Ezagouri, S., Dandavate, V., Asher, G. Monitoring daytime differences in moderate intensity exercise capacity using treadmill test and muscle dissection. STAR Protocols. 2 (1), 100331 (2021).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), 2279 (2017).
- Keszler, A., Lindemer, B., Hogg, N., Weihrauch, D., Lohr, N. L. Wavelength-dependence of vasodilation and NO release from S-nitrosothiols and dinitrosyl iron complexes by far red/near infrared light. Archives of Biochemistry and Biophysics. 649, 47-52 (2018).
- Weihrauch, D., et al. Vasodilation of isolated vessels and the isolation of the extracellular matrix of tight-skin mice. Journal of Visualized Experiments: JoVE. (121), e55036 (2017).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Li, Z., Jiang, J., Gao, S. Potential of C-X-C motif chemokine ligand 1/8/10/12 as diagnostic and prognostic biomarkers in idiopathic pulmonary arterial hypertension. Clinical Respiratory Journal. , (2021).
- Weihrauch, D., et al. Intralipid increases nitric oxide release from human endothelial cells during oxidative stress. JPEN. Journal of Parenteral and Enteral Nutrition. 45 (2), 295-302 (2021).
- Liebert, A., Krause, A., Goonetilleke, N., Bicknell, B., Kiat, H. A role for photobiomodulation in the prevention of myocardial ischemic reperfusion injury: A systematic review and potential molecular mechanisms. Scientific Reports. 7, 42386 (2017).
- Asghari, A., Takhtfooladi, M. A., Hoseinzadeh, H. A. Effect of photobiomodulation on ischemia/reperfusion-induced renal damage in diabetic rats. Lasers in Medical Science. 31 (9), 1943-1948 (2016).
- Quirk, B. J., Sonowal, P., Jazayeri, M. A., Baker, J. E., Whelan, H. T. Cardioprotection from ischemia-reperfusion injury by near-infrared light in rats. Photomedicine and Laser Surgery. 32 (9), 505-511 (2014).
- Smith, E. R., Shapiro, G. L. Totally tourniquets. The facts & details about different types of tourniquets. JEMS: A Journal of Emergency Medical Services. 38 (11), 48-50 (2013).
- Yu, G., et al. Inhibition of myeloperoxidase oxidant production by N-acetyl lysyltyrosylcysteine amide reduces brain damage in a murine model of stroke. Journal of Neuroinflammation. 13 (1), 119 (2016).
- de Brito Sousa, K., et al. Differential expression of inflammatory and anti-inflammatory mediators by M1 and M2 macrophages after photobiomodulation with red or infrared lasers. Lasers in Medical Science. 35 (2), 337-343 (2020).
- Iida, N., Grotendorst, G. R. Cloning and sequencing of a new gro transcript from activated human monocytes: expression in leukocytes and wound tissue. Molecular and Cellular Biology. 10 (10), 5596-5599 (1990).
- Jani, S., Bergmann, S. R. Metabolic modulation of myocardial ischemia. Current Cardiology Reports. 8 (2), 123-130 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены