Method Article
Traitement par lumière infrarouge non thermique des lésions d’ischémie/reperfusion et analyse ultérieure de la différenciation des macrophages
Dans cet article
Résumé
Nous décrivons la réduction des lésions de reperfusion par irradiation à 670 nm dans un modèle murin d’ischémie et de reperfusion par mise en place d’un garrot. Cette irradiation de 670 nm a réduit la réponse inflammatoire, diminué le nombre de macrophages pro-inflammatoires et augmenté les macrophages protecteurs.
Résumé
Les lésions tissulaires et la nécrose dues aux processus inflammatoires sont une conséquence des lésions d’ischémie et de reperfusion (IRI). Dans le muscle squelettique, l’ischémie réduit la capacité énergétique aérobie des cellules musculaires, entraînant des altérations biochimiques défavorables et une inflammation. Le but de cette étude est de montrer que l’exposition à la lumière proche infrarouge (NIR) pendant une période d’ischémie réduit l’IRI en diminuant la nécrose et l’inflammation en plus de diminuer les macrophages pro-inflammatoires M1 et d’augmenter les macrophages protecteurs M2. Les souris C57/Bl6 ont subi une ischémie unilatérale des membres postérieurs induite par un garrot pendant 3 heures, suivie d’une reperfusion pendant 15 ou 30 minutes. Les souris ont été réparties au hasard en 3 groupes. Le groupe 1 a subi une IRI avec une reperfusion de 30 minutes. Le groupe 2 a subi une IRI avec une reperfusion de 15 minutes. Chaque groupe était composé de 50 % de souris sans NIR et de souris traitées à 50 % avec une exposition de 50 mW/cm2 pendant 5 min/1 h après la fermeture du garrot. Le groupe 3 était constitué d’animaux fictifs anesthésiés pendant 3 heures, en omettant l’IRI.
Une imagerie laser Doppler a été réalisée sur toutes les souris pour confirmer l’ischémie et la reperfusion. Les données de débit ont été exprimées en rapport entre le membre ischémique et le contrôle controlatéral. Les souris ont été euthanasiées après reperfusion, et les quadriceps et le gastrocnémien ont été récoltés. Une immunoprécipitation et un western blot des marqueurs macrophages CD68 (M1) et CD206 (M2) ont été réalisés et normalisés à l’expression de CD14. L’expression des marqueurs inflammatoires CXCL1 et CXCL5 a été significativement réduite par le NIR dans le groupe IRA. Une diminution significative de CD68 et une augmentation de l’expression de CD206 ont été observées chez les animaux recevant l’IR et le NIR. La nécrose tissulaire a été diminuée par le NIR dans le groupe IRI, comme le montre la coloration au chlorure de 2,3,5-triphényltétrazolium (TTC). Les résultats démontrent que l’exposition au NIR réduisait l’IRI et améliorait la survie des tissus. Le NIR a réduit l’inflammation, diminué les macrophages M1 pro-inflammatoires et augmenté les macrophages M2 protecteurs. L’exposition au proche infrarouge réduit l’inflammation et améliore la régénération, ce qui entraîne une protection des tissus après une ischémie.
Introduction
La lésion d’ischémie et de reperfusion (IRI) est un défi clinique observé à la suite de lésions vasculaires et de l’utilisation prolongée de garrots chirurgicaux. Des études antérieures ont montré que 60 à 90 minutes est le seuil supérieur pour le temps d’ischémie chaud, au-delà duquel des lésions tissulaires irréversibles peuvent survenir. Plus que tout autre facteur, les limites du temps d’ischémie chaude limitent le succès et le sauvetage de la réimplantation des membres dysvasculaires 1,2.
Dans le muscle squelettique, l’ischémie réduit la capacité aérobie des cellules, entraînant une inflammation aiguë et des altérations biochimiques défavorables. Ces effets sont aggravés par la reperfusion, qui stimule le recrutement des neutrophiles et la production de radicaux libres, endommageant davantage le muscle squelettique. Cela peut se produire à partir d’une occlusion vasculaire, qu’il s’agisse du résultat d’une blessure ou de l’utilisation intentionnelle d’un garrot pour prévenir une hémorragie. Certains des médiateurs clés de ce processus sont la myéloperoxydase (MPO), une enzyme exprimée par les neutrophiles qui fait partie intégrante de la fonction respiratoire et de la production de radicaux libres3, et les chimiokines telles que CXCL1 et CXCL5 qui servent à recruter des neutrophiles sur les sites d’inflammation aiguë4.
L’artère fémorale n’a pas été disséquée pour imiter un garrot ouvert en cas d’urgence. Cette approche est également basée sur la reproductibilité de la création d’une ischémie et d’une reperfusion ainsi que sur une zone exempte de sang constante. Des recherches antérieures ont démontré que l’exposition à la lumière infrarouge non thermique (NIR) d’une longueur d’onde de 670 nm peut augmenter la collatéralisation vasculaire dans un membre postérieur ischémique de souris exposé au NIR pendant des jours, atténuant ainsi les effets de l’IRI5. De plus, des recherches antérieures ont démontré que la lumière NIR peut induire la polarisation des macrophages en phénotypes6 pro-inflammatoires (M1) ou pro-cicatrisants (M2).
Tout traitement capable de minimiser les lésions tissulaires et la mort cellulaire après l’hypoxie et la reperfusion serait bénéfique pour augmenter le succès du sauvetage des membres après des lésions vasculaires. Par conséquent, l’objectif global est d’améliorer l’IRI en introduisant un traitement à la lumière de 670 nm comme une option viable à d’autres modalités de traitement. Cet article est basé sur l’hypothèse que l’exposition à la lumière NIR pendant une période d’ischémie diminue l’inflammation et la nécrose tissulaire en diminuant la sécrétion de protéines chimioattractantes et l’afflux de cellules inflammatoires en induisant les macrophages à prendre un phénotype M2.
Protocole
Cette étude a été réalisée dans le strict respect des recommandations du Guide pour le soin et l’utilisation des animaux de laboratoire des National Institutes of Health. Le protocole a été approuvé par le Comité institutionnel de soin et d’utilisation des animaux (Protocole : AUA#1517). Toutes les recherches impliquant des souris ont été menées conformément à la politique du PHS.
1. Placement du garrot
REMARQUE : Un garrot a été placé pour induire une ischémie et obtenir un champ chirurgical exempt de sang.
- Anesthésier une souris C57/Bl6 avec de l’isoflurane dans la chambre d’induction à une concentration de 3 à 5 %.
- Retirez la souris de la chambre d’induction lorsqu’elle ne répond pas aux pincements des orteils. Placez la souris dans un cône nasal pour une anesthésie continue à 1,5-2 % sur un coussin chauffant avec un tapis non réfléchissant sous un imageur laser Doppler (LDI).
- Placez le garrot autour de la patte arrière gauche (Figure 1).
REMARQUE : Ne fermez pas encore le garrot. Mesurez d’abord le débit sanguin (voir rubrique 2).
2. Mesure du débit sanguin par LDI
REMARQUE : Le débit sanguin a été mesuré pour confirmer une occlusion et une reperfusion correctes comme décrit précédemment7.
- Placez la souris anesthésiée sous l’ILD (26 cm) sur un coussin chauffant avec une surface non réfléchissante en position couchée, les pattes tendues et les pattes vers le haut.
- Capturez des images en plaçant la souris dans la zone de capture du laser (16,1 cm x 16,1 cm).
- Réglez le laser à une vitesse de balayage de 4 ms/pixel. Capturez des images avec le logiciel propriétaire en appuyant sur le bouton d’enregistrement . Prenez des images avant, pendant l’occlusion et pendant la reperfusion en cliquant sur le bouton d’enregistrement .
REMARQUE : Les images sont des images cartographiques liées au flux ; le rouge est une bonne circulation sanguine ; Le bleu n’est pas une circulation sanguine. Confirmez sur l’image que le membre postérieur occlus est bleu. De même, vérifiez l’image pour confirmer que le membre postérieur précédemment occlus est rouge lors de la reperfusion. Il est impératif d’avoir un tapis non réfléchissant pour l’ILD ; Sinon, la réflexion affectera les images.
- Réglez le laser à une vitesse de balayage de 4 ms/pixel. Capturez des images avec le logiciel propriétaire en appuyant sur le bouton d’enregistrement . Prenez des images avant, pendant l’occlusion et pendant la reperfusion en cliquant sur le bouton d’enregistrement .
- Analysez les images avec le logiciel fourni en définissant une région d’intérêt. Établir un rapport entre les jambes ischémiques et les jambes témoins.
3. Protocole d’ischémie et de reperfusion
- Fermez le garrot autour de la patte postérieure de la souris anesthésiée pendant 3 h.
REMARQUE : Le serrage du garrot crée une ischémie, interrompant la circulation sanguine. - Ouvrir le garrot après 3 h d’occlusion ; Ouvrez et perfuser la patte postérieure pendant 15 ou 30 min.
4. Prélèvement de tissus
- Augmentez l’anesthésie à 5 % d’isoflurane pour anesthésier en profondeur les souris. Effectuez un pneumothorax en ouvrant la cavité thoracique avec des ciseaux tranchants pour assurer la mort. Récoltez les gastrocnémiens et les muscles quadriceps 8,9,10.
- Congelez rapidement les tissus collectés dans de l’azote liquide et conservez-les à -80 °C pour une analyse plus approfondie.
5. Application du RIN
REMARQUE : Le NIR est appliqué pour réduire l’inflammation et réduire les lésions de reperfusion.
- Appliquer 670 nm NIR à une intensité de 100 mW pendant 5 min une fois par heure pendant l’occlusion.
- Ciblez le membre postérieur avec la source lumineuse à fibre optique à une distance de 2,5 cm entre le membre postérieur et la lumière. N’exposez pas la jambe controlatérale au proche infrarouge (voir la figure 1 pour la configuration).
- Faites briller la lumière NIR pendant 5 minutes par heure pendant toute la durée de la période ischémique.
- Instrumentez le groupe fictif de la même manière. Ne fermez pas le garrot et n’appliquez pas de NIR sur la patte arrière.
REMARQUE : La lumière NIR a un dissipateur thermique. La température n’augmente pas dans les 5 minutes suivant l’exposition à la lumière11.
6. Nécrose TTC
REMARQUE : La nécrose tissulaire est évaluée pour visualiser la réduction de la nécrose dans le tissu musculaire.
- Colorer les muscles quadriceps frais avec un TTC à 37 °C pendant 20 à 30 min dans un tampon phosphate de 1 % dans 0,1 M ajusté à pH 7,4.
- Observez des tissus vivants rouges et colorés en fonction de la présence d’un précipité de formazan.
REMARQUE : La coloration rouge est basée sur la réduction de la TTC par les enzymes déshydrogénases dans les tissus sains. Le tissu nécrotique n’est pas coloré10. - Capturez des images de coupes colorées par TTC pour analyse et mesurez la région nécrotique en définissant une région d’intérêt.
7. Analyse occidentale de la chlorotyrosine
- Soumettre les souris au protocole d’ischémie/reperfusion (section 3).
- Prélever les tissus (rubrique 4) et isoler les protéines comme décrit précédemment12. Déterminer la concentration en protéines à l’aide du test de Bradford13.
- Utilisez le lysat de protéines totales pour effectuer l’électrophorèse et le transfert pour la 3-chlorotyrosine comme décrit précédemment12.
- Effectuer un western blot sur les lysats des gastrocnémies.
- Ajouter aux échantillons un tampon d’échantillon Laemmli contenant 5 % de mercaptoéthanol pour obtenir une concentration de 25 μg de protéines totales dans 40 μL.
- Analysez les échantillons sur un gel prolongé de tris-glycine à 4-15 % (voir le tableau des matériaux) à 50 mV pendant 5 min. Augmentez la tension à 100 mV pendant 1 h jusqu’à ce que la face avant du colorant soit épuisée.
- Incuber le gel dans 1 tampon de transfert (25 mM de Tris, 190 mM de glycine, 20 % de méthanol ; ajuster le pH à 8,3 si nécessaire) pendant 10 min.
- Assemblez le sandwich de transfert (éponge, filtre, gel, membrane cellulosique, filtre, éponge). Placez un bloc réfrigérant réutilisable dans l’appareil de transfert. Transfert de 30 min dans la chambre froide à 100 mA.
REMARQUE : Assurez-vous qu’aucune bulle n’est piégée dans le sandwich de transfert, que le blot est sur la cathode et le gel sur l’anode. - Rincez le tampon et bloquez-le dans un tampon de blocage (voir le tableau des matériaux) avec 0,05 % de Tween pendant 30 min à température ambiante. Lavez le transfert avec une solution saline tamponnée au Tris (TBS) contenant 5 % de Tween trois fois pendant 5 minutes chacune avant d’ajouter l’anticorps primaire.
- Incuber pendant la nuit avec les anticorps polyclonaux primaires contre la 3-chlorotyrosine. Diluer les anticorps dans le tampon de blocage avec 0,05 % de Tween (1:1 000).
- Utilisez des IgG anti-souris conjuguées à la peroxydase de raifort (HRP) et des IgG anti-chèvres HRP (dilution 1:10 000) comme anticorps secondaires.
- Visualisez les bandes d’identité dans les transferts à l’aide d’un réactif de chimiluminescence améliorée (ECL) et d’un système d’imagerie.
- Mélanger les composants selon le protocole du fabricant et les incuber avec le blot pendant 3 min pour lier les réactifs ECL aux bandes d’intérêt.
- Imagez le transfert à l’aide d’un système d’imagerie (voir le Tableau des matériaux). Utilisez un logiciel d’imagerie tel qu’ImageJ pour mesurer la masse volumique et normaliser les valeurs de densité des bandes d’intérêt par rapport à celles des bandes de contrôle.
8. ELISA pour CXCL1 et CXCL5
- Isolez les protéines totales des muscles gastrocnémiens comme décrit précédemment12.
- Évaluer le degré d’inflammation par ELISA pour CXCL1 et CXCL5 comme décrit précédemment14 et conformément aux instructions du fabricant.
9. Immunoprécipitation suivie d’une analyse occidentale
- Soumettre les souris au protocole d’ischémie/reperfusion (rubrique 3).
- Prélever les tissus (section 4) et isoler les protéines comme décrit précédemment12. Déterminer la concentration en protéines à l’aide du test Bradford13.
- Pour concentrer la fraction macrophage du lysat protéique total, effectuez une immunoprécipitation pour CD14 comme décrit précédemment15.
- Utilisez l’immunoprécipité CD14 pour effectuer l’électrophorèse et le transfert pour CD206 et CD68 comme décrit précédemment12.
- Effectuer un western blot sur les lysats des gastrocnémies comme décrit dans la rubrique 7.
- Incuber les immunoprécipités pendant la nuit avec les anticorps polyclonaux primaires dirigés contre CD206 ou CD68. Diluer les anticorps au 1:200 dans le TBS.
- Utilisez des IgG anti-souris d’âne conjuguées à la HRP et des IgG anti-chèvre HRP (dilution 1:10 000) comme anticorps secondaires.
- Appliquez le réactif ECL sur le transfert après avoir mélangé les composants selon le protocole du fabricant et incubez pendant 3 min pour visualiser les bandes d’intérêt. Imagez la tache à l’aide d’un système d’imagerie.
10. Analyse statistique
- Effectuer une analyse statistique des données à l’intérieur et entre les groupes avec analyse de variance (ANOVA) pour les mesures répétées suivies de la modification de Bonferroni du test t de Student, p ≤ 0,05.
- Exprimer les données sous forme de moyenne ± d’erreur type de la moyenne (SEM) ou de moyenne ± d’écart-type (SD).
Résultats
Les mesures de débit ont confirmé l’ischémie et la reperfusion
Le placement de la lumière NIR et le protocole expérimental sont illustrés à la figure 1. Un modèle murin d’ischémie des membres postérieurs a été développé et utilisé pour évaluer l’effet de l’exposition au NIR sur l’IRI du muscle squelettique. Comme prévu, l’imagerie par flux laser Doppler (figure 2A) a vérifié que le garrot était efficace pour induire une ischémie ainsi qu’un retour du flux sanguin à un niveau proche de la ligne de base pour les membres postérieurs traités par NIR (n = 6) et non traités à la lumière (n = 6). L’imagerie thermique (figure 2A) a également démontré qu’il n’y avait pas d’échauffement des membres des réseaux de DEL, ce qui suggère que les effets observés étaient attribuables à la lumière NIR et non à l’échauffement thermique.
Le traitement NIR réduit l’infarctus du quadriceps
La délimitation histologique grossière du tissu musculaire squelettique avec coloration TTC (figure 3A) a montré une diminution significative de 1,5 fois (p < 0,05) de la quantité de tissu nécrotique dans les quadriceps traités à la lumière NIR (n = 3) après IRI par rapport aux quadriceps non exposés au NIR (n = 3, figure 3B).
L’application NIR réduit l’expression de la chlorotyrosine dans les gastrocnémies
L’analyse par transfert Western des adduits à la 3-chlorotyrosine (figure 4) a été effectuée comme marqueur de substitution de la présence de neutrophiles en phase aiguë. Il a démontré une diminution significative de 2,9 fois (p < 0,05) de l’expression de l’adduit à la chlorotyrosine chez le gastrocnémien traité à la lumière NIR après IRI par rapport au gastrocnémien non exposé au NIR.
L’application du NIR réduit l’expression de CXCL1 et CXCL5 dans les gastrocnémiens
Un test ELISA a été utilisé pour déterminer les niveaux d’expression des deux chimiokines pro-inflammatoires CXCL1 (figure 5A) et CXCL5 (figure 5B). Le traitement par proche infrarouge a réduit significativement l’expression de CXCL1 et CXCL5 après 15 min de reperfusion. Seul le niveau d’expression de CXCL5 a été significativement réduit après 30 min de reperfusion.
Effets du traitement NIR sur le phénotype des macrophages chez les gastrocnémiens
Une immunoprécipitation pour le marqueur de macrophage CD14 suivie d’une analyse par transfert Western pour le marqueur M1 CD68 et le marqueur M2 CD206 a été réalisée pour comprendre la contribution des macrophages M1 et M2 à la propagation de l’inflammation. Ces données montrent que le traitement par NIR réduisait le niveau d’expression du marqueur inflammatoire des macrophages M1 (Ischémie + NIR 5752 ± 154, Ischémie - NIR 6464 ± 213, Contrôle 6524 ± 202) (Figure 6A) et augmentait le niveau d’expression du marqueur protecteur des macrophages M2 (Figure 6B) normalisé au niveau d’expression du marqueur macrophage total (Ischémie + NIR 7378,68 ± 425, Ischémie - NIR 5853.67 ± 215, contrôle 5542.53 ± 220).

Figure 1 : Protocole expérimental et position de la source lumineuse à fibre optique. Abréviations : LDI = imageur laser Doppler ; NIR = proche infrarouge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
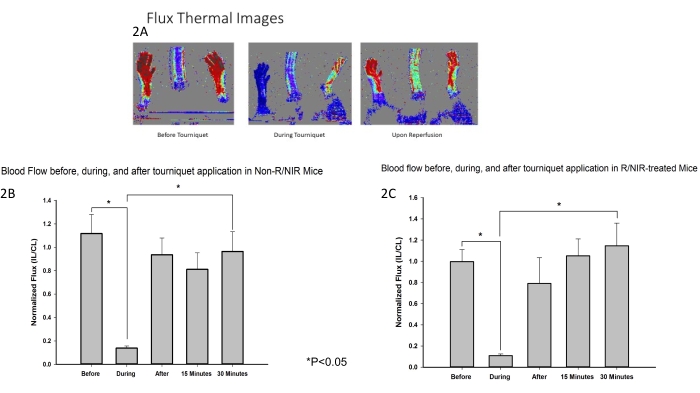
Figure 2 : Les mesures de l’ILD ont confirmé que le garrot était efficace pour induire une ischémie. (A) Les images thermiques du flux montrent l’interruption du flux sanguin et le rétablissement du flux sanguin lors de la reperfusion. L’analyse des images de flux montre l’interruption du flux sanguin lors de l’ischémie et la restauration du flux sanguin lors de la reperfusion chez les souris témoins (B) et R/NIR (C). Abréviations : LDI = imageur laser Doppler ; R = reperfusion ; NIR = lumière proche infrarouge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
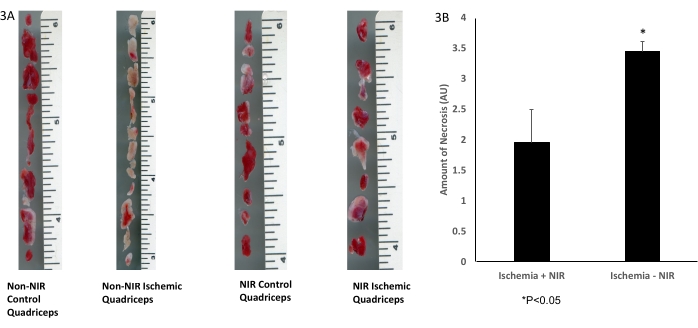
Figure 3 : Coloration TTC du tissu musculaire squelettique. (A) Coloration TTC ; (B) l’analyse montre une diminution significative du tissu musculaire squelettique infarctus. La barre d’échelle (pouces) représente la taille du muscle quadriceps. *P ≤ 0,05. Abréviations : NIR = proche infrarouge ; TTC = chlorure de 2,3,5-triphényltétrazolium. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Niveaux d’expression de la 3-chlorotyrosine dans le muscle squelettique après irradiation NIR. Analyse par transfert Western montrant une diminution significative des niveaux d’expression de la 3-chlorotyrosine dans le muscle squelettique après irradiation NIR. *P ≤ 0,05. Abréviations : NIR = proche infrarouge ; IL = membre ischémique ; CL = membre controlatéral. Veuillez cliquer ici pour voir une version agrandie de cette figure.
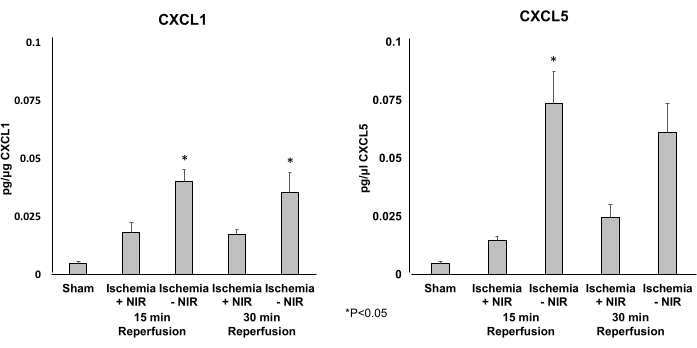
Figure 5 : Niveaux d’expression de CXCL1 et CXCL5 déterminés par ELISA. (A) Les niveaux d’expression de CXCL1 sont significativement diminués à 15 min de reperfusion dans le groupe NIR. Cet effet significatif s’est estompé après 30 minutes par rapport au témoin sans NIR. (B) Les niveaux d’expression de CXCL5 sont significativement diminués à 15 et 30 min de reperfusion dans le groupe léger par rapport au groupe sans lumière. *P ≤ 0,05. Abréviations : NIR = proche infrarouge ; ELISA = dosage immuno-enzymatique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Niveaux d’expression de M1 et M2 normalisés par rapport au marqueur de macrophage total CD14 déterminé par immunoprécipitation suivie d’une analyse par transfert de Western. (A) Niveau d’expression du marqueur macrophage M1 CD68 normalisé à l’expression du marqueur macrophage CD14. Le traitement par la lumière a réduit considérablement le niveau d’expression du marqueur pro-inflammatoire M1 CD68 par rapport au traitement sans lumière et au contrôle. (B) Niveau d’expression du marqueur protecteur des macrophages M2 CD206 normalisé à l’expression du marqueur des macrophages CD14. Le traitement par la lumière a augmenté l’expression de CD206 de manière significative par rapport au traitement sans lumière et au contrôle. *P ≤ 0,05. Abréviation : NIR = proche infrarouge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cet article décrit l’une des premières études à se concentrer sur la réduction des lésions de reperfusion par le traitement par lumière NIR en modifiant la réponse inflammatoire dans les membres postérieurs. Les lésions de reperfusion d’ischémie et le traitement par la lumière NIR ne sont pas tout à fait nouveaux. D’autres études se sont concentrées sur la reperfusion de l’ischémie par la lumière NIR. Le traitement par la lumière NIR a été utilisé avec succès dans la réduction de la taille de l’infract myocardique et la réduction des lésions rénales après une lésion de reperfusion d’ischémie. Quirk et al. ont signalé une réduction de la taille de l’infarctus du myocarde et une réduction de la reperfusion d’ischémie après l’application de NIR 16,17,18.
La mise en place d’un garrot est d’une grande importance pour arrêter les saignements après une blessure ou créer une zone sans sang dans un cadre clinique pendant une intervention chirurgicale et dans des situations d’urgence, y compris le champ de bataille19. Le fait d’avoir une ischémie prolongée suivie d’une reperfusion soulève la crainte d’une lésion de reperfusion.
Ces données montrent que la photothérapie sous la forme d’une application de lumière LED de 670 nm réduit les lésions de reperfusion en diminuant la réponse inflammatoire et fait passer les macrophages d’un phénotype inflammatoire à un phénotype anti-inflammatoire après la mise en place d’un garrot. L’expression du marqueur inflammatoire, la chlorotyrosine, est élevée après une reperfusion d’ischémie, mettant en évidence la lésion (Figure 3). La chlorotyrosine est un produit final d’oxydation de l’activité MPO. Yu et al. ont rapporté une augmentation de l’expression de la chlorotyrosine comme marqueur de l’inflammation dans un modèle de reperfusion d’ischémie de l’AVC20 murin.
De plus, Souza et al. ont décrit un changement de phénotype des macrophages 24 heures après la photobiomodulation à l’aide de la lignée cellulaire de macrophages J774, concluant que le traitement NIR module les phases inflammatoires et améliore la réparation tissulaire 6,21. En plus de recruter des macrophages et diverses autres cellules immunitaires, CXCL1 et CXCL5 ont des effets chimioattractants significatifs sur les neutrophiles, qui sont les plus directement responsables de l’IRI. Le MCP-1 n’a pas été inclus dans cette analyse, car il s’agit strictement d’un chimioattractant de monocytes et de macrophages. CXCL1 et CXCL5 sont produits par diverses cellules, notamment les macrophages, les neutrophiles et les cellules épithéliales 4,22
La limite de cette étude est la profondeur de pénétration de la lumière proche infrarouge. Hu et al. décrivent une pénétration de 5 cm dans la plupart des tissus en utilisant des cadavres et en comparant différentes zones23. L’approche de cet article consistait à déterminer la polarisation des macrophages M1 et M2 en fonction de la concentration de tous les macrophages par immunoprécipitation suivie d’une analyse par transfert Western pour déterminer les changements dans la contribution de M1 et M2 à l’inflammation après un traitement par NIR. L’immunofluorescence, la cytométrie en flux et un panel complet de marqueurs de polarisation des macrophages n’ont pas été réalisés. Ces résultats montrent que l’inflammation dans un contexte de reperfusion/blessure a été réduite par le traitement par lumière NIR et suggèrent une application clinique possible. Les étapes les plus critiques de ce protocole sont la confirmation de l’occlusion et l’application de la lumière NIR une fois par heure pendant 5 minutes pendant toute la durée de l’ischémie.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Nous remercions le Département de chirurgie orthopédique d’avoir financé cette étude. Nous remercions également Brian Lindemer et Grant Broeckel pour leur soutien technique.
matériels
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium | Sigma Aldrich | 17779-10X10ML-F | 1% solution |
| 4–15% Criterio TGX Stain-Free Protein Gel | BioRad | #5678084 | Tris-glycine extended gels |
| 4x Laemmli Sample Buffer - 1610747 | BioRad | 16110747 | |
| 670 nm light source | NIR Technologies | custom made | |
| BCA Protein Assay Kit | Thermo Fisher | 23227 | |
| BioRad ChemiDoc | Bio-Rad | Imaging system | |
| Bio-Rad | |||
| β-mercaptoethanol | BioRad | 1610710 | |
| CXCL1 ELISA | R&D Systems | DY453-05 | |
| CXCL5 ELISA | R&D Systems | DX000 | |
| Forane | Baxter | 1001936040 | isoflurane inhalant |
| goat anti-rabbit IgG-HRP | Santa Cruz Biotechnologies | sc-2004 | 1:10,000 dilution |
| Ice Accu ice pack | |||
| Laser doppler Imager | Moor | MOORLDI2-HIR | |
| monoclonal CD14 antibody | Santa Cruz Biotechnologies | sc-515785 | 1:200 dilution |
| monoclonal CD206 antibody | Santa Cruz Biotechnologies | sc-58986 | 1:200 dilution |
| monoclonal CD68 antibody | Santa Cruz Biotechnologies | sc-20060 | 1:200 dilution |
| Pierce Protein free (TBS) blocking buffer | blocking buffer | ||
| polyclonal Chlorotyrosine Antibody | Hycult | HP5002 | 1:1,000 dilution |
| Protein A/G PLUS-Agarose | Santa Cruz Biotechnologies | sc-2003 | |
| Super Signal West Femto | ThermoFisher | 34095 | enhanced chemiluminescence reagent |
Références
- Drysch, M., et al. An optimized low-pressure tourniquet murine hind limb ischemia reperfusion model: Inducing acute ischemia reperfusion injury in C57BL/6 wild type mice. PLoS One. 14 (1), 0210961(2019).
- Bonheur, J. A., Albadawi, H., Patton, G. M., Watkins, M. T. A noninvasive murine model of hind limb ischemia-reperfusion injury. Journal of Surgical Research. 116 (1), 55-63 (2004).
- Whiteman, M., Spencer, J. P. Loss of 3-chlorotyrosine by inflammatory oxidants: implications for the use of 3-chlorotyrosine as a bio-marker in vivo. Biochemical and Biophysical Research Communications. 371 (1), 50-53 (2008).
- Becker, S., Quay, J., Koren, H. S., Haskill, J. S. Constitutive and stimulated MCP-1, GRO alpha, beta, and gamma expression in human airway epithelium and bronchoalveolar macrophages. American Journal of Physiology. 266 (3), 278-286 (1994).
- Zaidi, M., et al. Transient repetitive exposure to low level light therapy enhances collateral blood vessel growth in the ischemic hindlimb of the tight skin mouse. Photochemistry and Photobiology. 89 (3), 709-713 (2013).
- Souza, N. H. C., et al. Photobiomodulation and different macrophages phenotypes during muscle tissue repair. Journal of Cellular and Molecular Medicine. 22 (10), 4922-4934 (2018).
- Tang, G. L., Kim, K. J. Laser doppler perfusion imaging in the mouse hindlimb. Journal of Visualized Experiments: JoVE. (170), e62012(2021).
- Ionescu, A., Zahavi, E. E., Gradus, T., Ben-Yaakov, K., Perlson, E. Compartmental microfluidic system for studying muscle-neuron communication and neuromuscular junction maintenance. European Journal of Cell Biology. 95 (2), 69-88 (2016).
- Adamovich, Y., Ezagouri, S., Dandavate, V., Asher, G. Monitoring daytime differences in moderate intensity exercise capacity using treadmill test and muscle dissection. STAR Protocols. 2 (1), 100331(2021).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), 2279(2017).
- Keszler, A., Lindemer, B., Hogg, N., Weihrauch, D., Lohr, N. L. Wavelength-dependence of vasodilation and NO release from S-nitrosothiols and dinitrosyl iron complexes by far red/near infrared light. Archives of Biochemistry and Biophysics. 649, 47-52 (2018).
- Weihrauch, D., et al. Vasodilation of isolated vessels and the isolation of the extracellular matrix of tight-skin mice. Journal of Visualized Experiments: JoVE. (121), e55036(2017).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Li, Z., Jiang, J., Gao, S. Potential of C-X-C motif chemokine ligand 1/8/10/12 as diagnostic and prognostic biomarkers in idiopathic pulmonary arterial hypertension. Clinical Respiratory Journal. , (2021).
- Weihrauch, D., et al. Intralipid increases nitric oxide release from human endothelial cells during oxidative stress. JPEN. Journal of Parenteral and Enteral Nutrition. 45 (2), 295-302 (2021).
- Liebert, A., Krause, A., Goonetilleke, N., Bicknell, B., Kiat, H. A role for photobiomodulation in the prevention of myocardial ischemic reperfusion injury: A systematic review and potential molecular mechanisms. Scientific Reports. 7, 42386(2017).
- Asghari, A., Takhtfooladi, M. A., Hoseinzadeh, H. A. Effect of photobiomodulation on ischemia/reperfusion-induced renal damage in diabetic rats. Lasers in Medical Science. 31 (9), 1943-1948 (2016).
- Quirk, B. J., Sonowal, P., Jazayeri, M. A., Baker, J. E., Whelan, H. T. Cardioprotection from ischemia-reperfusion injury by near-infrared light in rats. Photomedicine and Laser Surgery. 32 (9), 505-511 (2014).
- Smith, E. R., Shapiro, G. L. Totally tourniquets. The facts & details about different types of tourniquets. JEMS: A Journal of Emergency Medical Services. 38 (11), 48-50 (2013).
- Yu, G., et al. Inhibition of myeloperoxidase oxidant production by N-acetyl lysyltyrosylcysteine amide reduces brain damage in a murine model of stroke. Journal of Neuroinflammation. 13 (1), 119(2016).
- de Brito Sousa, K., et al. Differential expression of inflammatory and anti-inflammatory mediators by M1 and M2 macrophages after photobiomodulation with red or infrared lasers. Lasers in Medical Science. 35 (2), 337-343 (2020).
- Iida, N., Grotendorst, G. R. Cloning and sequencing of a new gro transcript from activated human monocytes: expression in leukocytes and wound tissue. Molecular and Cellular Biology. 10 (10), 5596-5599 (1990).
- Jani, S., Bergmann, S. R. Metabolic modulation of myocardial ischemia. Current Cardiology Reports. 8 (2), 123-130 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon