Method Article
טיפול באור אינפרא אדום לא תרמי בפגיעה באיסכמיה/רפרפוזיה וניתוח לאחר מכן של התמיינות מקרופאגים
In This Article
Summary
אנו מתארים את הפחתת הפגיעה ברפרפוזיה על ידי הקרנה של 670 ננומטר במודל עכבר של איסכמיה ורפרפוזיה על ידי מיקום חוסם עורקים. הקרנה זו של 670 ננומטר הפחיתה את התגובה הדלקתית, הפחיתה את מספר המקרופאגים הפרו-דלקתיים והגדילה את המקרופאגים המגנים.
Abstract
נזק לרקמות ונמק מתהליכים דלקתיים הם תוצאה של פגיעה חוזרת באיסכמיה (IRI). בשרירי השלד, איסכמיה מפחיתה את יכולת האנרגיה האירובית של תאי השריר, מה שמוביל לשינויים ביוכימיים שליליים ולדלקת. מטרת מחקר זה היא להראות כי חשיפה לאור קרוב לאינפרא אדום (NIR) במהלך תקופה של איסכמיה מפחיתה את IRI על ידי הפחתת נמק ודלקת בנוסף להפחתת M1 פרו-דלקתי והגברת מקרופאגים M2 מגנים. עכברי C57/Bl6 עברו איסכמיה חד צדדית הנגרמת על ידי חוסם עורקים בגפיים האחוריות במשך 3 שעות ואחריה רפרפוזיה למשך 15 או 30 דקות. עכברים חולקו באופן אקראי ל-3 קבוצות. קבוצה 1 עברה IRI עם 30 דקות רפרפוזיה. קבוצה 2 עברה IRI עם רפרפוזיה של 15 דקות. כל קבוצה כללה 50% עכברים ללא NIR ו-50% עכברים שטופלו ב-NIR עם חשיפה של 50 mW/cm2 למשך 5 דקות/שעה לאחר סגירת חוסם העורקים. קבוצה 3 הייתה חיות דמה שהורדמו במשך 3 שעות תוך השמטת IRI.
הדמיית זרימת דופלר בלייזר בוצעה על כל העכברים כדי לאשר איסכמיה ורפרפוזיה. נתוני הזרימה באו לידי ביטוי כיחס בין הגפה האיסכמית לבקרה הנגדית. העכברים הומתו לאחר רפרפוזיה, והארבע ראשי והגסטרוקנמיוס נקצרו. משקעים חיסוניים וכתם מערבי של סמני מקרופאגים CD68 (M1) ו-CD206 (M2) בוצעו ונורמלו לביטוי CD14. הביטוי של סמני הדלקת CXCL1 ו-CXCL5 הופחת משמעותית על ידי NIR בקבוצת ה-IRI. ירידה משמעותית ב-CD68 ועלייה בביטוי CD206 נצפתה בבעלי חיים שקיבלו IR ו-NIR. נמק רקמות הופחת על ידי NIR בקבוצת ה-IRI, כפי שניתן לראות על ידי צביעה של 2,3,5-triphenyltetrazolium chloride (TTC). הממצאים מראים כי חשיפה לקרינה בלתי מייננת הפחיתה את IRI ושיפרה את הישרדות הרקמות. NIR הפחית דלקת, הפחית M1 פרו-דלקתי והגדיל את המקרופאגים המגנים M2. חשיפה לקרינה בלתי מייננת הפחיתה את הדלקת והגבירה את ההתחדשות, מה שהוביל להגנה על הרקמות לאחר איסכמיה.
Introduction
פגיעת איסכמיה רפרפוזיה (IRI) היא אתגר קליני הנראה בעקבות פגיעות בכלי הדם ושימוש ממושך בחוסמי עורקים כירורגיים. מחקרים קודמים הראו כי 60-90 דקות הוא הסף העליון לזמן איסכמיה חם, שמעבר לו יכול להתרחש נזק בלתי הפיך לרקמות. יותר מכל גורם יחיד אחר, המגבלות של זמן איסכמיה חמה מגבילות את ההצלחה וההצלה של השתלה מחדש של גפיים דיסוסקולריות 1,2.
בשרירי השלד, איסכמיה מפחיתה את היכולת האירובית של התאים, מה שמוביל לדלקת חריפה ולשינויים ביוכימיים שליליים. השפעות אלו מחמירות על ידי רפרפוזיה, הממריץ את גיוס הנויטרופילים וייצור רדיקלים חופשיים, מה שפוגע עוד יותר בשריר השלד. זה יכול להתרחש מחסימת כלי דם, בין אם כתוצאה מפציעה ובין אם שימוש מכוון בחוסם עורקים למניעת דימום. חלק מהמתווכים העיקריים בתהליך זה הם מיאלופרוקסידאז (MPO), אנזים המתבטא על ידי נויטרופילים שהוא חלק בלתי נפרד מתפקוד פרץ הנשימה וייצור רדיקלים חופשיים3, וכימוקינים כגון CXCL1 ו-CXCL5 המשמשים לגיוס נויטרופילים לאתרים של דלקת חריפה4.
עורק הירך לא נותח כדי לחקות חוסם עורקים פתוח במקרה חירום. גישה זו מבוססת גם על יכולת השחזור של יצירת איסכמיה ורפרפוזיה כמו גם אזור עקבי ללא דם. מחקרים קודמים הראו כי חשיפה לאור אינפרא אדום לא תרמי (NIR) באורך גל של 670 ננומטר יכולה להגביר את הבטחונות של כלי הדם בגפה האחורית האיסכמית של עכבר עם חשיפה ל-NIR לאורך ימים, ולהפחית את ההשפעות של IRI5. בנוסף, מחקרים קודמים הראו שאור NIR יכול לגרום לקיטוב של מקרופאגים לפנוטיפים פרו-דלקתיים (M1) או פרו-ריפוי (M2)6.
כל טיפול שיכול למזער נזק לרקמות ומוות תאי בעקבות היפוקסיה ורפרפוזיה יועיל בהגברת ההצלחה של הצלת גפיים לאחר פגיעות בכלי הדם. לכן, המטרה הכוללת היא לשפר את IRI על ידי הכנסת טיפול באור 670 ננומטר כאופציה בת קיימא לשיטות טיפול אחרות. מאמר זה מבוסס על ההשערה שחשיפה לאור NIR במהלך תקופה של איסכמיה מפחיתה דלקת ונמק רקמות על ידי הפחתת הפרשת חלבונים כימואטרקנטיים וזרם של תאים דלקתיים על ידי גרימת מקרופאגים לקבל פנוטיפ M2.
Protocol
מחקר זה בוצע בהתאם להמלצות במדריך לטיפול ושימוש בחיות מעבדה של המכונים הלאומיים לבריאות. הפרוטוקול אושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (פרוטוקול: AUA#1517). כל המחקרים הכוללים עכברים נערכו בהתאם למדיניות PHS.
1. מיקום חוסמי עורקים
הערה: חוסם עורקים הונח כדי לגרום לאיסכמיה ולהשיג שדה כירורגי נטול דם.
- להרדים עכבר C57/Bl6 עם איזופלורן בתא האינדוקציה בריכוז של 3-5%.
- הסר את העכבר מתא האינדוקציה כאשר הוא אינו מגיב לצביטות בהונות. הנח את העכבר בקונוס אף להמשך הרדמה ב-1.5-2% על כרית חימום עם מחצלת לא רפלקטיבית מתחת להדמיית דופלר לייזר (LDI).
- הניחו את חוסם העורקים סביב הגפה האחורית השמאלית (איור 1).
הערה: אל תסגור את חוסם העורקים עדיין. מדוד תחילה את זרימת הדם (ראה סעיף 2).
2. מדידת זרימת דם על ידי LDI
הערה: זרימת הדם נמדדה כדי לאשר חסימה ועירוי תקינים כמתואר קודם לכן7.
- הנח את העכבר המורדם מתחת ל-LDI (26 ס"מ) על כרית חימום עם משטח לא מחזיר אור במצב נוטה עם רגליים וכפות מתוחות כלפי מעלה.
- צלם תמונות על-ידי הצבת העכבר בתוך אזור הצילום של הלייזר (16.1 ס"מ x 16.1 ס"מ).
- כוונן את הלייזר למהירות סריקה של 4 אלפיות השנייה לפיקסל. צלם תמונות עם התוכנה הקניינית על ידי לחיצה על כפתור ההקלטה . צלם תמונות לפני, במהלך החסימה ובמהלך הרפרפוזיה על ידי לחיצה על כפתור ההקלטה .
הערה: התמונות הן תמונות מפה הקשורות לזרימה; אדום הוא זרימת דם טובה; כחול הוא לא זרימת דם. ודא בתמונה שהגפה האחורית החסומה כחולה. באופן דומה, בדוק את התמונה כדי לאשר שהגפה האחורית שנחסמה בעבר אדומה ב-reperfusion. הכרחי שיהיה מחצלת לא רפלקטיבית עבור ה-LDI; אחרת, ההשתקפות תשפיע על התמונות.
- כוונן את הלייזר למהירות סריקה של 4 אלפיות השנייה לפיקסל. צלם תמונות עם התוכנה הקניינית על ידי לחיצה על כפתור ההקלטה . צלם תמונות לפני, במהלך החסימה ובמהלך הרפרפוזיה על ידי לחיצה על כפתור ההקלטה .
- נתח את התמונות עם התוכנה המסופקת על ידי הגדרת אזור עניין. קבע יחס בין הרגליים האיסכמיות לרגלי הבקרה.
3. פרוטוקול איסכמיה ורפרפוזיה
- סגור את חוסם העורקים סביב הגפה האחורית של העכבר המורדם למשך 3 שעות.
הערה: הידוק חוסם העורקים יוצר איסכמיה, קוטע את זרימת הדם. - פתח את חוסם העורקים לאחר 3 שעות של חסימה; פתח והחלחל את הגפה האחורית למשך 15 או 30 דקות.
4. קצירת רקמות
- הגדל את ההרדמה ל-5% איזופלורן כדי להרדים עמוק את העכברים. בצע פנאומוטורקס על ידי פתיחת חלל החזה במספריים חדים כדי להבטיח מוות. קציר את שרירי הגסטרוקנמי והארבע ראשי 8,9,10.
- הקפיאו את הרקמה שנאספה בחנקן נוזלי ואחסנו בטמפרטורה של -80 מעלות צלזיוס להמשך ניתוח.
5. יישום NIR
הערה: NIR מוחל כדי להוריד דלקת ולהפחית את פגיעת הרפרפוזיה.
- יש למרוח 670 ננומטר NIR בעוצמה של 100 mW למשך 5 דקות פעם בשעה במהלך החסימה.
- כוון את הגפה האחורית עם מקור האור של הסיבים האופטיים במרחק של 2.5 ס"מ בין הגפה האחורית לאור. אל תחשוף את הרגל הנגדית ל-NIR (ראה איור 1 להגדרה).
- האירו את אור ה-NIR למשך 5 דקות לשעה למשך התקופה האיסכמית.
- כלי את קבוצת הדמה באותו אופן. אין לסגור את חוסם העורקים או למרוח NIR על הגפה האחורית.
הערה: לנורת ה-NIR יש גוף קירור. הטמפרטורה אינה עולה תוך 5 דקות מחשיפה לאור11.
6. נמק TTC
הערה: נמק רקמות מוערך כדי לדמיין את הפחתת הנמק ברקמת השריר.
- מכתים שרירי ארבע ראשי טריים עם TTC ב-37 מעלות צלזיוס למשך 20-30 דקות ב-1% TTC במאגר פוספט 0.1 M מותאם ל-pH 7.4.
- התבונן ברקמה חיה אדומה ומוכתמת על סמך נוכחות של משקע פורמזן.
הערה: הצביעה האדומה מבוססת על הפחתת TTC על ידי אנזימי דהידרוגנאז ברקמה בריאה. רקמה נמקית אינה מוכתמת10. - צלם תמונות של פרוסות מוכתמות ב-TTC לניתוח ומדוד את האזור הנמק על ידי הגדרת אזור עניין.
7. ניתוח מערבי לכלורוטירוזין
- הכניסו עכברים לפרוטוקול איסכמיה/רפרפוזיה (סעיף 3).
- קצירת רקמות (סעיף 4) ובידוד חלבון כפי שתואר קודם לכן12. קבע את ריכוז החלבון על ידי מבחן ברדפורד13.
- השתמש בליזאט החלבון הכולל כדי לבצע אלקטרופורזה וכתם עבור 3-כלורוטירוזין כפי שתואר קודם לכן12.
- בצע כתם מערבי על ליזאטים של הגסטרוקנמי.
- הוסף לדגימות מאגר דגימת Laemmli המכיל 5% מרקפטואתנול כדי לקבל ריכוז של 25 מיקרוגרם של חלבון כולל ב-40 מיקרוליטר.
- הפעל את הדגימות על ג'ל מורחב של 4-15% טריס-גליצין (ראה טבלת החומרים) ב-50 mV למשך 5 דקות. הגדל את המתח ל-100 mV למשך שעה אחת עד שחזית הצבע נגמרת.
- דגרו את הג'ל במאגר העברה 1x (25 מ"מ טריס, 190 מ"מ גליצין, 20% מתנול; התאם את ה-pH ל-8.3 במידת הצורך) למשך 10 דקות.
- הרכיבו את כריך ההעברה (ספוג, פילטר, ג'ל, קרום תאית, פילטר, ספוג). הנח שקית קרח רב פעמית במנגנון ההעברה. מעבירים למשך 30 דקות בחדר הקירור בטמפרטורה של 100 מ"א.
הערה: ודא שלא נלכדות בועות בכריך ההעברה, הכתם נמצא על הקתודה והג'ל על האנודה. - שטפו את הכתם וחסמו אותו במאגר חוסם (ראה טבלת החומרים) עם 0.05% טווין למשך 30 דקות בטמפרטורת החדר. שטפו את הכתם עם תמיסת מלח Tris-buffered (TBS) המכילה 5% טווין שלוש פעמים במשך 5 דקות כל אחת לפני הוספת הנוגדן העיקרי.
- דגירה למשך הלילה עם הנוגדנים הפוליקלונליים העיקריים ל-3-כלורוטירוזין. לדלל את הנוגדנים במאגר חוסם עם 0.05% טווין (1:1,000).
- השתמש ב-IgG מצומד של חמור פרוקסידאז (HRP) נגד עכברים ו-IgG נגד עזים (דילול של 1:10,000) כנוגדנים משניים.
- דמיין רצועות זהות בכתמים באמצעות מגיב כימילומינסנציה משופר (ECL) ומערכת הדמיה.
- מערבבים רכיבים על סמך פרוטוקול היצרן ודוגרים אותם עם הכתם למשך 3 דקות כדי לקשור את ריאגנטים ECL לרצועות המעניינות.
- דמיין את הכתם עם מערכת הדמיה (ראה טבלת החומרים). השתמש בתוכנת הדמיה כגון ImageJ כדי למדוד את הצפיפות ולנרמל את ערכי הצפיפות של הרצועות המעניינות לאלו של רצועות הבקרה.
8. ELISA עבור CXCL1 ו-CXCL5
- בודד חלבון כולל משרירי הגסטרוקנמי כפי שתואר קודם לכן12.
- העריכו את מידת הדלקת על ידי ELISA עבור CXCL1 ו-CXCL5 כפי שתואר קודם לכן14 ובהתאם להוראות היצרן.
9. משקעים חיסוניים ואחריהם ניתוח מערבי
- הכניסו את העכברים לפרוטוקול איסכמיה/רפרפוזיה (סעיף 3).
- קצור את הרקמות (סעיף 4) ובודד חלבון כפי שתואר קודם לכן12. קבע את ריכוז החלבון על ידי מבחן ברדפורד13.
- כדי לרכז את חלק המקרופאגים של ליזאט החלבון הכולל, בצע משקעים חיסוניים עבור CD14 כפי שתואר קודם לכן15.
- השתמש ב-CD14 immunoprecipitate כדי לבצע אלקטרופורזה וכתם עבור CD206 ו-CD68 כפי שתואר קודם לכן12.
- בצע כתם מערבי על ליזאטים של הגסטרוקנמי כמתואר בסעיף 7.
- דגרו על המשקעים החיסוניים למשך הלילה עם הנוגדנים הפוליקלונליים העיקריים ל-CD206 או CD68. לדלל את הנוגדנים ביחס של 1:200 ב-TBS.
- השתמש ב-IgG מצומד חמור נגד עכבר וב-IgG נגד עזים (דילול 1:10,000) כנוגדנים משניים.
- מרחו מגיב ECL על הכתם לאחר ערבוב רכיבים על סמך פרוטוקול היצרן ודגרו למשך 3 דקות כדי לדמיין את הרצועות המעניינות. דמיין את הכתם באמצעות מערכת הדמיה.
10. ניתוח סטטיסטי
- בצע ניתוח סטטיסטי של נתונים בתוך ובין קבוצות עם ניתוח שונות (ANOVA) למדידות חוזרות ואחריו שינוי של Bonferroni במבחן t של הסטודנט, עמ' ≤ 0.05.
- בטא נתונים כממוצע ± שגיאת תקן של הממוצע (SEM) או ממוצע ± סטיית תקן (SD).
תוצאות
מדידות זרימה אישרו איסכמיה ורפרפוזיה
מיקום אור NIR ופרוטוקול הניסוי מתוארים באיור 1. מודל איסכמיה של הגפיים האחוריות של עכברים פותח והופעל כדי להעריך את ההשפעה של חשיפה ל-NIR על IRI של שרירי השלד. כצפוי, הדמיית שטף דופלר בלייזר (איור 2A) אימתה כי חוסם העורקים היה יעיל בהשראת איסכמיה יחד עם חזרה בזרימת הדם לכמעט קו הבסיס הן עבור הגפיים האחוריות שטופלו ב-NIR (n = 6) והן בגפיים האחוריות שטופלו באור (n = 6). הדמיה תרמית (איור 2A) הראתה גם שלא היה חימום של הגפיים ממערכי ה-LED, מה שמרמז על כך שההשפעות שנצפו מיוחסות לאור NIR ולא לחימום תרמי.
טיפול ב-NIR מפחית את אוטם הארבע ראשי
תיחום היסטולוגי גס של רקמת שריר השלד עם צביעת TTC (איור 3A) הראה ירידה משמעותית של פי 1.5 (p < 0.05) בכמות הרקמה הנמקית בשריר הארבע ראשי שטופל באור NIR (n = 3) לאחר IRI בהשוואה לארבע ראשי שלא נחשפו ל-NIR (n = 3, איור 3B).
יישום NIR מפחית את ביטוי הכלורוטירוזין בגסטרוקנמי
ניתוח כתמים מערביים של תוספות 3-כלורוטירוזין (איור 4) בוצע כסמן חלופי לנוכחות נויטרופילים בשלב חריף. הוא הדגים ירידה משמעותית של פי 2.9 (p < 0.05) בביטוי אדוקט כלורוטירוזין בגסטרוקנמיוס שטופל באור NIR לאחר IRI בהשוואה לגסטרוקנמיוס שאינו חשוף ל-NIR.
יישום NIR מפחית את הביטוי של CXCL1 ו-CXCL5 בגסטרוקנמי
נעשה שימוש ב-ELISA כדי לקבוע את רמות הביטוי של שני הכימוקינים הפרו-דלקתיים CXCL1 (איור 5A) ו-CXCL5 (איור 5B). טיפול ב-NIR הפחית את הביטוי של CXCL1 ו-CXCL5 באופן משמעותי לאחר 15 דקות של עירוי חוזר. רק רמת הביטוי של CXCL5 ירדה משמעותית לאחר 30 דקות של רפרפוזיה.
השפעות הטיפול ב-NIR על פנוטיפ מקרופאגים בגסטרוקנמי
משקעים חיסוניים עבור סמן המקרופאגים CD14 ואחריו ניתוח כתמים מערביים עבור סמן M1 CD68 וסמן M2 CD206 בוצעו כדי להבין את התרומה של מקרופאגים M1 ו-M2 להתפשטות הדלקת. נתונים אלה מראים כי טיפול ב-NIR הפחית את רמת הביטוי של סמן המקרופאגים הדלקתי M1 (איסכמיה + NIR 5752 ± 154, איסכמיה - NIR 6464 ± 213, Control 6524 ± 202) (איור 6A) והעלה את רמת הביטוי של סמן המקרופאגים המגן M2 (איור 6B) מנורמל לרמת הביטוי של סמן המקרופאגים הכולל (איסכמיה + NIR 7378.68 ± 425, איסכמיה - NIR 5853.67 ± 215, קונטרול 5542.53 ± 220).

איור 1: פרוטוקול ניסוי והמיקום של מקור האור בסיב האופטי. קיצורים: LDI = הדמיית דופלר לייזר; NIR = קרוב לאינפרא אדום. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
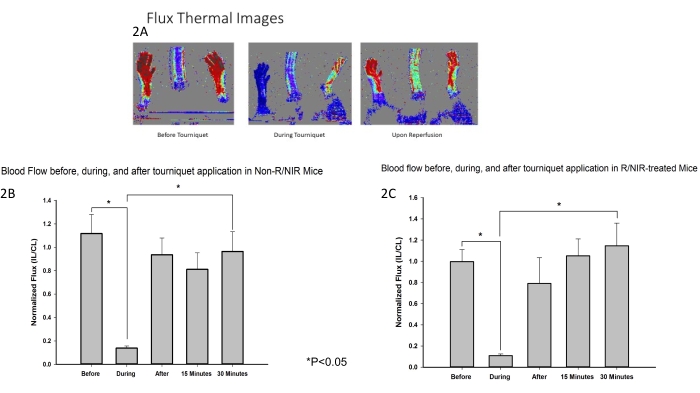
איור 2: מדידות LDI אישרו כי חוסם העורקים היה יעיל בגרימת איסכמיה. (A) שטף תמונות תרמיות מדגימות הפרעה בזרימת הדם ושיקום זרימת הדם עם עירוי מחדש. ניתוח תמונות שטף מראה הפרעה בזרימת הדם במהלך איסכמיה ושיקום זרימת הדם עם רפרפוזיה בעכברים שטופלו ב-R/NIR (C). קיצורים: LDI = הדמיית דופלר לייזר; R = רפרפוזיה; NIR = אור קרוב לאינפרא אדום. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
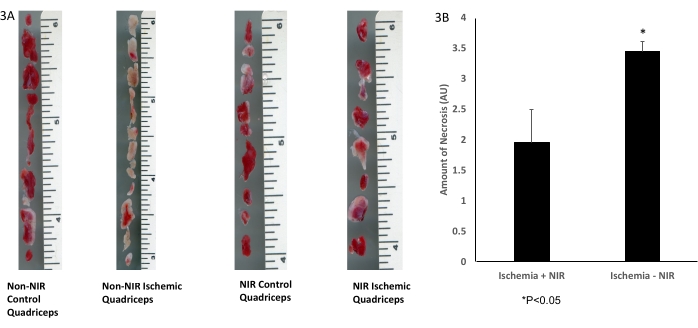
איור 3: צביעת TTC של רקמת שריר השלד. (א) צביעת TTC; (B) ניתוח מראה ירידה משמעותית ברקמת שריר השלד האוטם. סרגל הסולם (אינץ') מתאר את גודל שריר הארבע ראשי. *P ≤ 0.05. קיצורים: NIR = קרוב לאינפרא אדום; TTC = 2,3,5-טריפנילטטרזוליום כלוריד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: 3-רמות ביטוי כלורוטירוזין בשרירי השלד לאחר הקרנת NIR. ניתוח כתמים מערביים הראה ירידה משמעותית ברמות ביטוי 3-כלורוטירוזין בשרירי השלד לאחר הקרנת NIR. *P ≤ 0.05. קיצורים: NIR = קרוב לאינפרא אדום; IL = גפה איסכמית; CL = גפה נגדית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
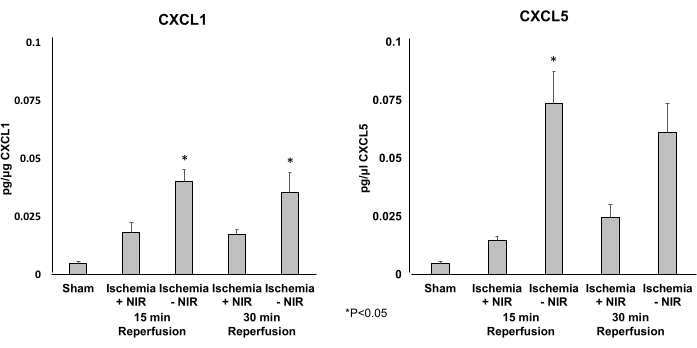
איור 5: רמות הביטוי של CXCL1 ו-CXCL5 שנקבעו על ידי ELISA. (A) רמות הביטוי של CXCL1 יורדות באופן משמעותי לאחר 15 דקות של רפרפוזיה בקבוצת ה-NIR. השפעה משמעותית זו דעכה לאחר 30 דקות בהשוואה לביקורת ללא NIR. (B) רמות הביטוי של CXCL5 יורדות באופן משמעותי לאחר 15 ו-30 דקות של זלוף בקבוצת האור בהשוואה לקבוצה ללא אור. *P ≤ 0.05. קיצורים: NIR = קרוב לאינפרא אדום; ELISA = בדיקת אימונוסורבנט מקושר לאנזים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: רמות הביטוי של M1 ו-M2 נורמלו לסמן המקרופאגים הכולל CD14 שנקבע על ידי משקעים חיסוניים ואחריו ניתוח כתמים מערביים. (A) רמת הביטוי של סמן המקרופאגים M1 CD68 מנורמלת לביטוי CD14 של סמן המקרופאגים. טיפול באור הפחית את רמת הביטוי של סמן M1 הפרו-דלקתי CD68 באופן משמעותי בהשוואה לטיפול ובקרה ללא אור. (B) רמת הביטוי של סמן המקרופאגים המגן M2 CD206 מנורמל לביטוי CD14 של סמן המקרופאגים. טיפול באור הגדיל את הביטוי של CD206 באופן משמעותי בהשוואה לטיפול וביקורת ללא אור. *P ≤ 0.05. קיצור: NIR = קרוב לאינפרא אדום. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
מאמר זה מתאר את אחד המחקרים הראשונים שהתמקדו בהפחתת פגיעת רפרפוזיה על ידי טיפול באור NIR על ידי שינוי התגובה הדלקתית בגפה האחורית. איסכמיה, פגיעת רפרפוזיה וטיפול באור NIR אינם חדשים לחלוטין. מחקרים אחרים התמקדו באיסכמיה על ידי אור NIR. טיפול באור NIR שימש בהצלחה בהפחתת גודל שבר שריר הלב והפחתת נזק כלייתי לאחר פגיעה באיסכמיה. Quirk et al. דיווחו על ירידה בגודל אוטם שריר הלב והפחתה של איסכמיה לאחר יישום NIR 16,17,18.
להצבת חוסם עורקים יש חשיבות רבה לעצירת דימום לאחר פציעה או ליצירת אזור נקי מדם בסביבה קלינית במהלך ניתוח ובמצבי חירום, כולל שדה הקרב19. איסכמיה ממושכת ואחריה רפרפוזיה מעלה את החשש לפגיעה ברפרפוזיה.
נתונים אלה מראים כי פוטותרפיה בצורה של יישום אור LED של 670 ננומטר מפחיתה את פגיעת הרפרפוזיה על ידי הורדת התגובה הדלקתית ומשנה מקרופאגים מפנוטיפ דלקתי לפנוטיפ אנטי דלקתי לאחר הנחת חוסם עורקים. הביטוי של הסמן הדלקתי, כלורוטירוזין, מוגבר לאחר איסכמיה רפרפוזיה, מה שמדגיש את הפגיעה (איור 3). כלורוטירוזין הוא תוצר סופי של חמצון של פעילות MPO. יו ועמיתיו דיווחו על עלייה בביטוי כלורוטירוזין כסמן לדלקת במודל איסכמיה של שבץ עכברי20.
יתר על כן, סוזה ועמיתיו תיארו שינוי פנוטיפ מקרופאגים 24 שעות לאחר פוטו-ביומודולציה באמצעות קו תאי המקרופאגים J774, והגיעו למסקנה שטיפול ב-NIR מווסת את השלבים הדלקתיים ומשפר את תיקון הרקמות 6,21. בנוסף לגיוס מקרופאגים ותאים חיסוניים שונים אחרים, ל-CXCL1 ו-CXCL5 יש השפעות כימותרפיות משמעותיות על נויטרופילים, האחראים הישירים ביותר ל-IRI. MCP-1 לא נכלל בניתוח זה מכיוון שהוא אך ורק מושך כימי מונוציטים/מקרופאגים. CXCL1 ו-CXCL5 מיוצרים על ידי תאים שונים, כולל מקרופאגים, נויטרופילים ותאי אפיתל 4,22
המגבלה של מחקר זה היא עומק החדירה של אור NIR. Hu et al. מתארים חדירה של 5 ס"מ ברוב הרקמות באמצעות גופות והשוואה בין אזורים שונים23. גישת מאמר זה הייתה לקבוע את הקיטוב של מקרופאגים M1 ו-M2 על סמך ריכוז כל המקרופאגים על ידי משקעים חיסוניים ואחריו ניתוח כתמים מערביים כדי לקבוע שינויים בתרומה של M1 ו-M2 לדלקת לאחר טיפול ב-NIR. אימונופלואורסצנטיות, ציטומטריית זרימה ופאנל שלם של סמני קיטוב מקרופאגים לא בוצעו. ממצאים אלה מראים כי דלקת במסגרת רפרפוזיה/פציעה הופחתה על ידי טיפול באור NIR ומציעים יישום קליני אפשרי. השלבים הקריטיים ביותר בפרוטוקול זה הם אישור החסימה והפעלת אור NIR פעם בשעה למשך 5 דקות לאורך כל משך האיסכמיה.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
אנו מודים למחלקה לכירורגיה אורתופדית על מימון מחקר זה. אנו מודים גם לבריאן לינדמר וגרנט ברוקל על תמיכתם הטכנית.
Materials
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium | Sigma Aldrich | 17779-10X10ML-F | 1% solution |
| 4–15% Criterio TGX Stain-Free Protein Gel | BioRad | #5678084 | Tris-glycine extended gels |
| 4x Laemmli Sample Buffer - 1610747 | BioRad | 16110747 | |
| 670 nm light source | NIR Technologies | custom made | |
| BCA Protein Assay Kit | Thermo Fisher | 23227 | |
| BioRad ChemiDoc | Bio-Rad | Imaging system | |
| Bio-Rad | |||
| β-mercaptoethanol | BioRad | 1610710 | |
| CXCL1 ELISA | R&D Systems | DY453-05 | |
| CXCL5 ELISA | R&D Systems | DX000 | |
| Forane | Baxter | 1001936040 | isoflurane inhalant |
| goat anti-rabbit IgG-HRP | Santa Cruz Biotechnologies | sc-2004 | 1:10,000 dilution |
| Ice Accu ice pack | |||
| Laser doppler Imager | Moor | MOORLDI2-HIR | |
| monoclonal CD14 antibody | Santa Cruz Biotechnologies | sc-515785 | 1:200 dilution |
| monoclonal CD206 antibody | Santa Cruz Biotechnologies | sc-58986 | 1:200 dilution |
| monoclonal CD68 antibody | Santa Cruz Biotechnologies | sc-20060 | 1:200 dilution |
| Pierce Protein free (TBS) blocking buffer | blocking buffer | ||
| polyclonal Chlorotyrosine Antibody | Hycult | HP5002 | 1:1,000 dilution |
| Protein A/G PLUS-Agarose | Santa Cruz Biotechnologies | sc-2003 | |
| Super Signal West Femto | ThermoFisher | 34095 | enhanced chemiluminescence reagent |
References
- Drysch, M., et al. An optimized low-pressure tourniquet murine hind limb ischemia reperfusion model: Inducing acute ischemia reperfusion injury in C57BL/6 wild type mice. PLoS One. 14 (1), 0210961(2019).
- Bonheur, J. A., Albadawi, H., Patton, G. M., Watkins, M. T. A noninvasive murine model of hind limb ischemia-reperfusion injury. Journal of Surgical Research. 116 (1), 55-63 (2004).
- Whiteman, M., Spencer, J. P. Loss of 3-chlorotyrosine by inflammatory oxidants: implications for the use of 3-chlorotyrosine as a bio-marker in vivo. Biochemical and Biophysical Research Communications. 371 (1), 50-53 (2008).
- Becker, S., Quay, J., Koren, H. S., Haskill, J. S. Constitutive and stimulated MCP-1, GRO alpha, beta, and gamma expression in human airway epithelium and bronchoalveolar macrophages. American Journal of Physiology. 266 (3), 278-286 (1994).
- Zaidi, M., et al. Transient repetitive exposure to low level light therapy enhances collateral blood vessel growth in the ischemic hindlimb of the tight skin mouse. Photochemistry and Photobiology. 89 (3), 709-713 (2013).
- Souza, N. H. C., et al. Photobiomodulation and different macrophages phenotypes during muscle tissue repair. Journal of Cellular and Molecular Medicine. 22 (10), 4922-4934 (2018).
- Tang, G. L., Kim, K. J. Laser doppler perfusion imaging in the mouse hindlimb. Journal of Visualized Experiments: JoVE. (170), e62012(2021).
- Ionescu, A., Zahavi, E. E., Gradus, T., Ben-Yaakov, K., Perlson, E. Compartmental microfluidic system for studying muscle-neuron communication and neuromuscular junction maintenance. European Journal of Cell Biology. 95 (2), 69-88 (2016).
- Adamovich, Y., Ezagouri, S., Dandavate, V., Asher, G. Monitoring daytime differences in moderate intensity exercise capacity using treadmill test and muscle dissection. STAR Protocols. 2 (1), 100331(2021).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), 2279(2017).
- Keszler, A., Lindemer, B., Hogg, N., Weihrauch, D., Lohr, N. L. Wavelength-dependence of vasodilation and NO release from S-nitrosothiols and dinitrosyl iron complexes by far red/near infrared light. Archives of Biochemistry and Biophysics. 649, 47-52 (2018).
- Weihrauch, D., et al. Vasodilation of isolated vessels and the isolation of the extracellular matrix of tight-skin mice. Journal of Visualized Experiments: JoVE. (121), e55036(2017).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Li, Z., Jiang, J., Gao, S. Potential of C-X-C motif chemokine ligand 1/8/10/12 as diagnostic and prognostic biomarkers in idiopathic pulmonary arterial hypertension. Clinical Respiratory Journal. , (2021).
- Weihrauch, D., et al. Intralipid increases nitric oxide release from human endothelial cells during oxidative stress. JPEN. Journal of Parenteral and Enteral Nutrition. 45 (2), 295-302 (2021).
- Liebert, A., Krause, A., Goonetilleke, N., Bicknell, B., Kiat, H. A role for photobiomodulation in the prevention of myocardial ischemic reperfusion injury: A systematic review and potential molecular mechanisms. Scientific Reports. 7, 42386(2017).
- Asghari, A., Takhtfooladi, M. A., Hoseinzadeh, H. A. Effect of photobiomodulation on ischemia/reperfusion-induced renal damage in diabetic rats. Lasers in Medical Science. 31 (9), 1943-1948 (2016).
- Quirk, B. J., Sonowal, P., Jazayeri, M. A., Baker, J. E., Whelan, H. T. Cardioprotection from ischemia-reperfusion injury by near-infrared light in rats. Photomedicine and Laser Surgery. 32 (9), 505-511 (2014).
- Smith, E. R., Shapiro, G. L. Totally tourniquets. The facts & details about different types of tourniquets. JEMS: A Journal of Emergency Medical Services. 38 (11), 48-50 (2013).
- Yu, G., et al. Inhibition of myeloperoxidase oxidant production by N-acetyl lysyltyrosylcysteine amide reduces brain damage in a murine model of stroke. Journal of Neuroinflammation. 13 (1), 119(2016).
- de Brito Sousa, K., et al. Differential expression of inflammatory and anti-inflammatory mediators by M1 and M2 macrophages after photobiomodulation with red or infrared lasers. Lasers in Medical Science. 35 (2), 337-343 (2020).
- Iida, N., Grotendorst, G. R. Cloning and sequencing of a new gro transcript from activated human monocytes: expression in leukocytes and wound tissue. Molecular and Cellular Biology. 10 (10), 5596-5599 (1990).
- Jani, S., Bergmann, S. R. Metabolic modulation of myocardial ischemia. Current Cardiology Reports. 8 (2), 123-130 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved