Method Article
Tratamiento con luz infrarroja no térmica de la lesión por isquemia/reperfusión y posterior análisis de la diferenciación de macrófagos
En este artículo
Resumen
Describimos la reducción de la lesión por reperfusión mediante irradiación a 670 nm en un modelo murino de isquemia y reperfusión mediante la colocación de torniquete. Esta irradiación de 670 nm redujo la respuesta inflamatoria, disminuyó el número de macrófagos proinflamatorios y aumentó los macrófagos protectores.
Resumen
El daño tisular y la necrosis por procesos inflamatorios son consecuencia de la lesión por isquemia-reperfusión (IRI). En el músculo esquelético, la isquemia reduce la capacidad energética aeróbica de las células musculares, lo que provoca alteraciones bioquímicas adversas e inflamación. El objetivo de este estudio es demostrar que la exposición a la luz infrarroja cercana (NIR) durante un período de isquemia reduce la IRI al disminuir la necrosis y la inflamación, además de disminuir los mármacos M1 proinflamatorios y aumentar los macrófagos M2 protectores. Los ratones C57/Bl6 se sometieron a isquemia de las extremidades posteriores inducida por torniquete unilateral durante 3 h seguida de reperfusión durante 15 o 30 min. Los ratones fueron asignados aleatoriamente a 3 grupos. Al grupo 1 se le realizó IRI con reperfusión de 30 min. El grupo 2 se sometió a IRI con una reperfusión de 15 min. Cada grupo consistió en un 50% de ratones tratados con NO-NIR y un 50% con NIR con una exposición de 50 mW/cm2 durante 5 min/1 h después del cierre del torniquete. En el grupo 3 se anestesiaron animales simulados durante 3 h omitiendo la IRI.
Se realizó un láser de flujo Doppler en todos los ratones para confirmar la isquemia y la reperfusión. Los datos de flujo se expresaron como la relación entre la extremidad isquémica y el control contralateral. Los ratones fueron sacrificados después de la reperfusión, y los cuádriceps y gastrocnemio fueron cosechados. Se realizó inmunoprecipitación y western blot de los marcadores de macrófagos CD68 (M1) y CD206 (M2) y se normalizó a la expresión de CD14. La expresión de los marcadores inflamatorios CXCL1 y CXCL5 se redujo significativamente con el NIR en el grupo IRI. Se observó una disminución significativa de CD68 y un aumento de la expresión de CD206 en los animales que recibieron IR y NIR. La necrosis tisular disminuyó por NIR en el grupo IRI, como se visualizó mediante la tinción con cloruro de 2,3,5-trifeniltetrazolio (TTC). Los hallazgos demuestran que la exposición a NIR redujo la IRI y mejoró la supervivencia de los tejidos. El NIR redujo la inflamación, disminuyó la M1 proinflamatoria y aumentó los macrófagos M2 protectores. La exposición a NIR redujo la inflamación y mejoró la regeneración, lo que condujo a la protección de los tejidos después de la isquemia.
Introducción
La lesión por isquemia-reperfusión (IRI) es un desafío clínico que se observa después de lesiones vasculares y el uso prolongado de torniquetes quirúrgicos. Estudios previos han demostrado que 60-90 min es el umbral superior para el tiempo de isquemia caliente, más allá del cual puede ocurrir un daño tisular irreversible. Más que cualquier otro factor, las limitaciones del tiempo de isquemia caliente limitan el éxito y el rescate de la reimplantación de las extremidades disvasculares 1,2.
En el músculo esquelético, la isquemia reduce la capacidad aeróbica de las células, lo que conduce a una inflamación aguda y alteraciones bioquímicas adversas. Estos efectos se ven agravados por la reperfusión, que estimula el reclutamiento de neutrófilos y la producción de radicales libres, dañando aún más el músculo esquelético. Esto puede ocurrir por oclusión vascular, ya sea como resultado de una lesión o el uso intencional de un torniquete para prevenir la hemorragia. Algunos de los mediadores clave en este proceso son la mieloperoxidasa (MPO), una enzima expresada por los neutrófilos que es integral para la función respiratoria y la producción de radicales libres3, y quimiocinas como CXCL1 y CXCL5 que sirven para reclutar neutrófilos a sitios de inflamación aguda4.
La arteria femoral no se diseccionó para imitar un torniquete abierto en caso de emergencia. Este enfoque también se basa en la reproducibilidad de la creación de isquemia y reperfusión, así como en un área libre de sangre consistente. Investigaciones anteriores han demostrado que la exposición a luz infrarroja no térmica (NIR) con una longitud de onda de 670 nm puede aumentar la colateralización vascular en una extremidad posterior isquémica de ratón con exposición a NIR durante días, mitigando los efectos de IRI5. Además, investigaciones anteriores han demostrado que la luz NIR puede inducir la polarización de los macrófagos en fenotipos proinflamatorios (M1) o procurritivos (M2)6.
Cualquier tratamiento que pueda minimizar el daño tisular y la muerte celular después de la hipoxia y la reperfusión sería beneficioso para aumentar el éxito del rescate de la extremidad después de las lesiones vasculares. Por lo tanto, el objetivo general es mejorar el IRI mediante la introducción del tratamiento con luz de 670 nm como una opción viable a otras modalidades de tratamiento. Este trabajo se basa en la hipótesis de que la exposición a la luz NIR durante un período de isquemia disminuye la inflamación y la necrosis tisular al disminuir la secreción de proteínas quimioatrayentes y la afluencia de células inflamatorias al inducir a los macrófagos a adquirir un fenotipo M2.
Protocolo
Este estudio se llevó a cabo en estricta conformidad con las recomendaciones de la Guía para el Cuidado y Uso de Animales de Laboratorio de los Institutos Nacionales de Salud. El protocolo fue aprobado por el Comité Institucional de Cuidado y Uso de Animales (Protocolo: AUA#1517). Todas las investigaciones con ratones se llevaron a cabo de conformidad con la política de PHS.
1. Colocación del torniquete
NOTA: Se colocó un torniquete para inducir la isquemia y lograr un campo quirúrgico libre de sangre.
- Anestesiar un ratón C57/Bl6 con isoflurano en la cámara de inducción a una concentración del 3-5%.
- Retire el ratón de la cámara de inducción cuando no responda a los pellizcos de los dedos de los pies. Coloque el ratón en un cono de nariz para una anestesia continua al 1,5-2% en una almohadilla térmica con una alfombrilla no reflectante debajo de un generador de imágenes láser Doppler (LDI).
- Coloque el torniquete alrededor de la extremidad posterior izquierda (Figura 1).
NOTA: No cierre el torniquete todavía. Mida primero el flujo sanguíneo (ver sección 2).
2. Medición del flujo sanguíneo por LDI
NOTA: Se midió el flujo sanguíneo para confirmar la oclusión y reperfusión adecuadas como se describió anteriormente7.
- Coloque el ratón anestesiado por debajo del LDI (26 cm) sobre una almohadilla térmica con una superficie no reflectante en posición prona con las piernas estiradas y las patas hacia arriba.
- Capture imágenes colocando el ratón dentro del área de captura del láser (16,1 cm x 16,1 cm).
- Ajuste el láser a una velocidad de escaneo de 4 ms/píxel. Capture imágenes con el software propietario pulsando el botón de grabación . Tome imágenes antes, durante la oclusión y durante la reperfusión haciendo clic en el botón de grabación .
NOTA: Las imágenes son imágenes de mapa relacionadas con el flujo; el rojo es un buen flujo sanguíneo; El azul no es flujo sanguíneo. Confirme en la imagen que la extremidad posterior ocluida es azul. Del mismo modo, revise la imagen para confirmar que la extremidad posterior previamente ocluida está roja en la reperfusión. Es imperativo tener una alfombrilla no reflectante para el LDI; de lo contrario, el reflejo afectará a las imágenes.
- Ajuste el láser a una velocidad de escaneo de 4 ms/píxel. Capture imágenes con el software propietario pulsando el botón de grabación . Tome imágenes antes, durante la oclusión y durante la reperfusión haciendo clic en el botón de grabación .
- Analice las imágenes con el software proporcionado definiendo una región de interés. Establecer una relación entre la pierna isquémica y la de control.
3. Protocolo de isquemia y reperfusión
- Cierre el torniquete alrededor de la extremidad posterior del ratón anestesiado durante 3 h.
NOTA: Apretar el torniquete crea isquemia, interrumpiendo el flujo sanguíneo. - Abra el torniquete después de 3 h de oclusión; Abrir y perfundir la extremidad posterior durante 15 o 30 min.
4. Recolección de tejidos
- Aumentar la anestesia al 5% de isoflurano para anestesiar profundamente a los ratones. Realizar un neumotórax abriendo la cavidad torácica con unas tijeras afiladas para asegurar la muerte. Coseche los músculos gastrocnemii y cuádriceps 8,9,10.
- Congele el tejido recogido en nitrógeno líquido y guárdelo a -80 °C para su posterior análisis.
5. Aplicación de NIR
NOTA: El NIR se aplica para disminuir la inflamación y reducir la lesión por reperfusión.
- Aplique 670 nm NIR a una intensidad de 100 mW durante 5 min una vez por hora durante la oclusión.
- Dirija la extremidad posterior con la fuente de luz de fibra óptica a una distancia de 2,5 cm entre la extremidad posterior y la luz. No exponga la pierna contralateral al NIR (consulte la Figura 1 para ver la configuración).
- Ilumine la luz NIR durante 5 minutos por hora durante el período isquémico.
- Instrumenta el grupo falso de la misma manera. No cierre el torniquete ni aplique NIR en la extremidad posterior.
NOTA: La luz NIR tiene un disipador de calor. La temperatura no aumenta dentro de los 5 minutos posteriores a la exposición a la luz11.
6. Necrosis TTC
NOTA: La necrosis tisular se evalúa para visualizar la reducción de la necrosis en el tejido muscular.
- Teñir los músculos frescos del cuádriceps con TTC a 37 °C durante 20-30 min en TTC al 1% en tampón de fosfato 0,1 M ajustado a pH 7,4.
- Observe tejido vivo rojo teñido en función de la presencia de un precipitado de formazano.
NOTA: La tinción roja se basa en la reducción de TTC por las enzimas deshidrogenasas en el tejido sano. El tejido necrótico no está teñido10. - Capture imágenes de cortes teñidos con TTC para su análisis y mida la región necrótica definiendo una región de interés.
7. Análisis occidental para la clorotirosina
- Someter a los ratones al protocolo de isquemia/reperfusión (sección 3).
- Recolectar tejidos (sección 4) y aislar la proteína como se describió anteriormente12. Determine la concentración de proteínas mediante el ensayo de Bradford13.
- Utilice el lisado de proteína total para realizar la electroforesis y la transferencia de 3-clorotirosina como se describió anteriormente12.
- Realizar un western blot sobre los lisados del gastrocnemio.
- Añada a las muestras un tampón de muestra Laemmli que contenga un 5% de mercaptoetanol para obtener una concentración de 25 μg de proteína total en 40 μL.
- Ejecute las muestras en un gel extendido de trisglicina al 4-15% (consulte la tabla de materiales) a 50 mV durante 5 minutos. Aumente el voltaje a 100 mV durante 1 h hasta que se agote el frente de tinte.
- Incubar el gel en 1x tampón de transferencia (25 mM de Tris, 190 mM de glicina, 20% de metanol; ajuste el pH a 8,3 si es necesario) durante 10 min.
- Montar el sándwich de transferencia (esponja, filtro, gel, membrana de celulosa, filtro, esponja). Coloque una bolsa de hielo reutilizable en el aparato de transferencia. Trasvasar durante 30 min en la cámara frigorífica a 100 mA.
NOTA: Asegúrese de que no queden burbujas atrapadas en el sándwich de transferencia, la mancha esté en el cátodo y el gel en el ánodo. - Enjuague la mancha y bloquéela en un tampón de bloqueo (consulte la Tabla de materiales) con 0.05% Tween durante 30 min a temperatura ambiente. Lave la mancha con solución salina tamponada con Tris (TBS) que contenga 5% de Tween tres veces durante 5 minutos cada una antes de agregar el anticuerpo primario.
- Incubar durante la noche con los anticuerpos policlonales primarios contra la 3-clorotirosina. Diluir los anticuerpos en tampón bloqueante con 0,05% Tween (1:1.000).
- Utilice la IgG anti-ratón conjugada con peroxidasa de rábano picante (HRP) y la IgG anti-cabra HRP (dilución 1:10.000) como anticuerpos secundarios.
- Visualice las bandas de identidad en las manchas utilizando un reactivo de quimioluminiscencia mejorada (ECL) y un sistema de imágenes.
- Mezcle los componentes según el protocolo del fabricante e incubelos con el blot durante 3 min para unir los reactivos ECL a las bandas de interés.
- Visualice la mancha con un sistema de imágenes (consulte la Tabla de materiales). Utilice software de generación de imágenes como ImageJ para medir la densidad y normalizar los valores de densidad de las bandas de interés con los de las bandas de control.
8. ELISA para CXCL1 y CXCL5
- Aísle la proteína total de los músculos gastrocnemios como se describió anteriormente12.
- Evalúe el grado de inflamación mediante ELISA para CXCL1 y CXCL5 como se describió anteriormente14 y de acuerdo con las instrucciones del fabricante.
9. Inmunoprecipitación seguida de análisis occidental
- Someter a los ratones al protocolo de isquemia/reperfusión (sección 3).
- Recolectar los tejidos (sección 4) y aislar la proteína como se describió anteriormente12. Determine la concentración de proteínas mediante el ensayo de Bradford13.
- Para concentrar la fracción de macrófagos del lisado total de proteínas, se realiza una inmunoprecipitación para CD14 como se ha descrito anteriormente15.
- Utilice el inmunoprecipitado CD14 para realizar electroforesis y transferencia para CD206 y CD68 como se describió anteriormente12.
- Realizar un western blot sobre los lisados del gastrocnemii como se describe en la sección 7.
- Incubar los inmunoprecipitados durante la noche con los anticuerpos policlonales primarios contra CD206 o CD68. Diluir los anticuerpos 1:200 en TBS.
- Utilice IgG anti-ratón conjugada con HRP y HRP-anti-cabra IgG (dilución 1:10.000) como anticuerpos secundarios.
- Aplique el reactivo ECL al blot después de mezclar los componentes según el protocolo del fabricante e incube durante 3 minutos para visualizar las bandas de interés. Tome una imagen de la mancha con un sistema de diagnóstico por imágenes.
10. Análisis estadístico
- Realizar análisis estadístico de datos dentro y entre grupos con análisis de varianza (ANOVA) para medidas repetidas seguidas de la modificación de Bonferroni de la prueba t de Student, p ≤ 0,05.
- Exprese los datos como media ± error estándar de la media (SEM) o media ± desviación estándar (DE).
Resultados
Las mediciones de flujo confirmaron isquemia y reperfusión
La ubicación de la luz NIR y el protocolo experimental se muestran en la Figura 1. Se desarrolló y empleó un modelo de isquemia murina de la extremidad posterior para evaluar el efecto de la exposición a NIR sobre la IRI del músculo esquelético. Como se esperaba, las imágenes de flujo Doppler láser (Figura 2A) verificaron que el torniquete fue efectivo para inducir isquemia junto con un retorno en el flujo sanguíneo casi al inicio tanto para las extremidades posteriores tratadas con NIR (n = 6) como para las no tratadas con luz (n = 6). Las imágenes térmicas (Figura 2A) también demostraron que no hubo calentamiento de las extremidades de las matrices de LED, lo que sugiere que los efectos observados fueron atribuibles a la luz NIR y no al calentamiento térmico.
El tratamiento NIR reduce el infarto de cuádriceps
La delineación histológica macroscópica del tejido del músculo esquelético con tinción TTC (Figura 3A) demostró una disminución significativa de 1,5 veces (p < 0,05) en la cantidad de tejido necrótico en los cuádriceps tratados con luz NIR (n = 3) después de IRI en comparación con los cuádriceps no expuestos a NIR (n = 3, Figura 3B).
La aplicación de NIR reduce la expresión de clorotirosina en el gastrocnemio
Se realizó un análisis de Western blot de los aductos de 3-clorotirosina (Figura 4) como marcador sustituto de la presencia de neutrófilos en fase aguda. Demostró una disminución significativa de 2,9 veces (p < 0,05) en la expresión de aductos de clorotirosina en el gastrocnemio tratado con luz NIR después de IRI en comparación con el gastrocnemio no expuesto a NIR.
La aplicación de NIR reduce la expresión de CXCL1 y CXCL5 en gastrocnemii
Se empleó un ELISA para determinar los niveles de expresión de las dos quimiocinas proinflamatorias CXCL1 (Figura 5A) y CXCL5 (Figura 5B). El tratamiento con NIR redujo significativamente la expresión de CXCL1 y CXCL5 después de 15 min de reperfusión. Solo el nivel de expresión de CXCL5 se redujo significativamente después de 30 min de reperfusión.
Efectos del tratamiento con NIR sobre el fenotipo de macrófagos en gastrocnemii
Se realizó inmunoprecipitación para el marcador de macrófagos CD14 seguida de análisis de Western blot para el marcador M1 CD68 y el marcador M2 CD206 para comprender la contribución de los macrófagos M1 y M2 a la propagación de la inflamación. Estos datos muestran que el tratamiento con NIR redujo el nivel de expresión del marcador inflamatorio de macrófagos M1 (Isquemia + NIR 5752 ± 154, Isquemia - NIR 6464 ± 213, Control 6524 ± 202) (Figura 6A) y aumentó el nivel de expresión del marcador protector de macrófagos M2 (Figura 6B) normalizado al nivel de expresión del marcador de macrófagos totales (Isquemia + NIR 7378.68 ± 425, Isquemia - NIR 5853.67 ± 215, Control 5542.53 ± 220).

Figura 1: Protocolo experimental y posición de la fuente de luz de fibra óptica. Abreviaturas: LDI = generador de imágenes láser Doppler; NIR = infrarrojo cercano. Haga clic aquí para ver una versión más grande de esta figura.
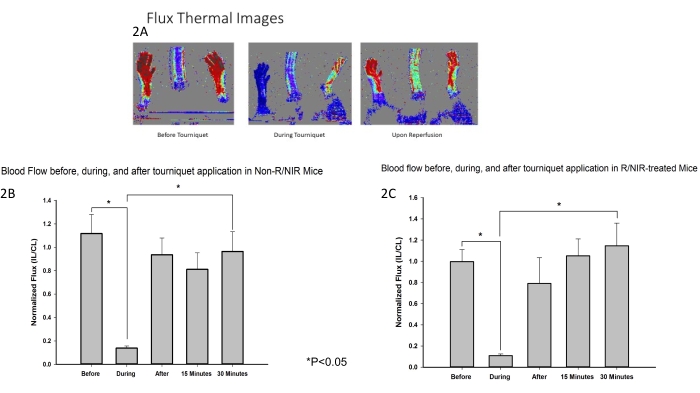
Figura 2: Las mediciones de LDI confirmaron que el torniquete fue eficaz para inducir isquemia. (A) Flujo Las imágenes térmicas demuestran la interrupción del flujo sanguíneo y la restauración del flujo sanguíneo tras la reperfusión. El análisis de las imágenes de flujo muestra la interrupción del flujo sanguíneo durante la isquemia y el restablecimiento del flujo sanguíneo tras la reperfusión en ratones control (B) y tratados con R/NIR (C). Abreviaturas: LDI = generador de imágenes láser Doppler; R = reperfusión; NIR = luz infrarroja cercana. Haga clic aquí para ver una versión más grande de esta figura.
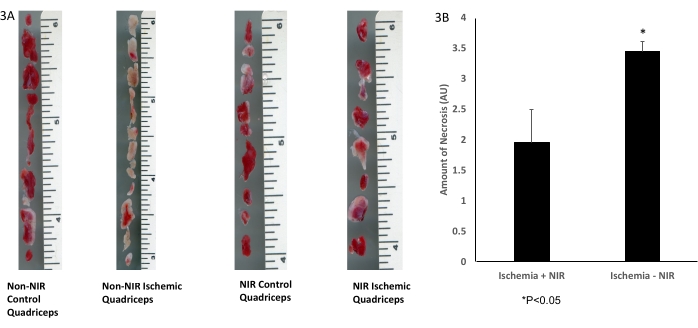
Figura 3: Tinción TTC del tejido del músculo esquelético. (A) tinción de TTC; (B) el análisis muestra una disminución significativa en el tejido muscular esquelético infartado. La barra de escala (pulgadas) representa el tamaño del músculo cuádriceps. *P ≤ 0,05. Abreviaturas: NIR = infrarrojo cercano; TTC = cloruro de 2,3,5-trifeniltetrazolio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Niveles de expresión de 3-clorotirosina en el músculo esquelético después de la irradiación NIR. Análisis de Western blot que muestra una disminución significativa en los niveles de expresión de 3-clorotirosina en el músculo esquelético después de la irradiación NIR. *P ≤ 0,05. Abreviaturas: NIR = infrarrojo cercano; IL = miembro isquémico; CL = extremidad contralateral. Haga clic aquí para ver una versión más grande de esta figura.
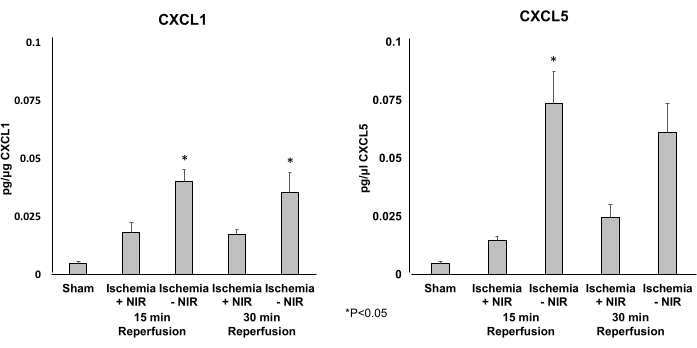
Figura 5: Niveles de expresión de CXCL1 y CXCL5 determinados por ELISA. (A) Los niveles de expresión de CXCL1 disminuyen significativamente a los 15 min de reperfusión en el grupo NIR. Este efecto significativo disminuyó después de 30 minutos en comparación con el control sin NIR. (B) Los niveles de expresión de CXCL5 disminuyen significativamente a los 15 y 30 minutos de reperfusión en el grupo de luz en comparación con el grupo sin luz. *P ≤ 0,05. Abreviaturas: NIR = infrarrojo cercano; ELISA = ensayo de inmunoabsorción ligado a enzimas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Niveles de expresión de M1 y M2 normalizados al marcador de macrófagos totales CD14 determinado por inmunoprecipitación seguida de análisis de Western blot. (A) Nivel de expresión del marcador de macrófagos M1 CD68 normalizado a la expresión del marcador de macrófagos CD14. El tratamiento con luz redujo significativamente el nivel de expresión del marcador proinflamatorio M1 CD68 en comparación con el tratamiento sin luz y el control. (B) Nivel de expresión del marcador protector de macrófagos M2 CD206 normalizado a la expresión del marcador de macrófagos CD14. El tratamiento con luz aumentó significativamente la expresión de CD206 en comparación con el tratamiento sin luz y el control. *P ≤ 0,05. Abreviatura: NIR = infrarrojo cercano. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este artículo describe uno de los primeros estudios que se centró en la reducción de la lesión por reperfusión mediante el tratamiento con luz NIR mediante el cambio de la respuesta inflamatoria en la extremidad posterior. La isquemia, la lesión por reperfusión y el tratamiento con luz NIR no son del todo novedosos. Otros estudios se centraron en la reperfusión de isquemia con luz NIR. El tratamiento con luz NIR se ha utilizado con éxito en la reducción del tamaño del infract miocárdico y la reducción del daño renal después de la lesión por isquemia-reperfusión. Quirk et al. reportaron una reducción en el tamaño del infarto de miocardio y una reducción de la reperfusión por isquemia después de la aplicación de NIR 16,17,18.
La colocación de un torniquete es de gran importancia para detener el sangrado después de una lesión o crear un área libre de sangre en un entorno clínico durante la cirugía y en situaciones de emergencia, incluido el campo de batalla19. Tener isquemia prolongada seguida de reperfusión plantea la preocupación de una lesión por reperfusión.
Estos datos muestran que la fototerapia en forma de una aplicación de luz LED de 670 nm reduce la lesión por reperfusión al disminuir la respuesta inflamatoria y cambia los macrófagos de un fenotipo inflamatorio a uno antiinflamatorio después de la colocación del torniquete. La expresión del marcador inflamatorio, clorotirosina, se eleva tras la reperfusión por isquemia, destacando la lesión (Figura 3). La clorotirosina es un producto final de oxidación de la actividad de MPO. Yu et al. informaron de un aumento en la expresión de clorotirosina como marcador de inflamación en un modelo de isquemia y reperfusión de ictus murino20.
Además, Souza et al. describieron un cambio en el fenotipo de los macrófagos 24 h después de la fotobiomodulación utilizando la línea celular de macrófagos J774, concluyendo que el tratamiento con NIR modula las fases inflamatorias y mejora la reparación tisular 6,21. Además de reclutar macrófagos y otras células inmunitarias, CXCL1 y CXCL5 tienen importantes efectos quimioatrayentes sobre los neutrófilos, que son los responsables más directos de la IRI. MCP-1 no se incluyó en este análisis ya que es estrictamente un quimioatrayente de monocitos/macrófagos. CXCL1 y CXCL5 son producidos por varias células, incluyendo macrófagos, neutrófilos y células epiteliales 4,22
La limitación de este estudio es la profundidad de penetración de la luz NIR. Hu et al. describen una penetración de 5 cm en la mayoría de los tejidos utilizando cadáveres y comparando diferentes áreas23. El enfoque de este trabajo fue determinar la polarización de los macrófagos M1 y M2 en función de la concentración de todos los macrófagos por inmunoprecipitación, seguido de un análisis de Western blot para determinar los cambios en la contribución de M1 y M2 a la inflamación después del tratamiento con NIR. No se realizó inmunofluorescencia, citometría de flujo ni un panel completo de marcadores de polarización de macrófagos. Estos hallazgos muestran que la inflamación en un entorno de reperfusión/lesión se redujo con el tratamiento con luz NIR y sugieren una posible aplicación clínica. Los pasos más críticos de este protocolo son la confirmación de la oclusión y la aplicación de luz NIR una vez por hora durante 5 min durante toda la duración de la isquemia.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Agradecemos al Departamento de Cirugía Ortopédica por financiar este estudio. También agradecemos a Brian Lindemer y Grant Broeckel por su apoyo técnico.
Materiales
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium | Sigma Aldrich | 17779-10X10ML-F | 1% solution |
| 4–15% Criterio TGX Stain-Free Protein Gel | BioRad | #5678084 | Tris-glycine extended gels |
| 4x Laemmli Sample Buffer - 1610747 | BioRad | 16110747 | |
| 670 nm light source | NIR Technologies | custom made | |
| BCA Protein Assay Kit | Thermo Fisher | 23227 | |
| BioRad ChemiDoc | Bio-Rad | Imaging system | |
| Bio-Rad | |||
| β-mercaptoethanol | BioRad | 1610710 | |
| CXCL1 ELISA | R&D Systems | DY453-05 | |
| CXCL5 ELISA | R&D Systems | DX000 | |
| Forane | Baxter | 1001936040 | isoflurane inhalant |
| goat anti-rabbit IgG-HRP | Santa Cruz Biotechnologies | sc-2004 | 1:10,000 dilution |
| Ice Accu ice pack | |||
| Laser doppler Imager | Moor | MOORLDI2-HIR | |
| monoclonal CD14 antibody | Santa Cruz Biotechnologies | sc-515785 | 1:200 dilution |
| monoclonal CD206 antibody | Santa Cruz Biotechnologies | sc-58986 | 1:200 dilution |
| monoclonal CD68 antibody | Santa Cruz Biotechnologies | sc-20060 | 1:200 dilution |
| Pierce Protein free (TBS) blocking buffer | blocking buffer | ||
| polyclonal Chlorotyrosine Antibody | Hycult | HP5002 | 1:1,000 dilution |
| Protein A/G PLUS-Agarose | Santa Cruz Biotechnologies | sc-2003 | |
| Super Signal West Femto | ThermoFisher | 34095 | enhanced chemiluminescence reagent |
Referencias
- Drysch, M., et al. An optimized low-pressure tourniquet murine hind limb ischemia reperfusion model: Inducing acute ischemia reperfusion injury in C57BL/6 wild type mice. PLoS One. 14 (1), 0210961(2019).
- Bonheur, J. A., Albadawi, H., Patton, G. M., Watkins, M. T. A noninvasive murine model of hind limb ischemia-reperfusion injury. Journal of Surgical Research. 116 (1), 55-63 (2004).
- Whiteman, M., Spencer, J. P. Loss of 3-chlorotyrosine by inflammatory oxidants: implications for the use of 3-chlorotyrosine as a bio-marker in vivo. Biochemical and Biophysical Research Communications. 371 (1), 50-53 (2008).
- Becker, S., Quay, J., Koren, H. S., Haskill, J. S. Constitutive and stimulated MCP-1, GRO alpha, beta, and gamma expression in human airway epithelium and bronchoalveolar macrophages. American Journal of Physiology. 266 (3), 278-286 (1994).
- Zaidi, M., et al. Transient repetitive exposure to low level light therapy enhances collateral blood vessel growth in the ischemic hindlimb of the tight skin mouse. Photochemistry and Photobiology. 89 (3), 709-713 (2013).
- Souza, N. H. C., et al. Photobiomodulation and different macrophages phenotypes during muscle tissue repair. Journal of Cellular and Molecular Medicine. 22 (10), 4922-4934 (2018).
- Tang, G. L., Kim, K. J. Laser doppler perfusion imaging in the mouse hindlimb. Journal of Visualized Experiments: JoVE. (170), e62012(2021).
- Ionescu, A., Zahavi, E. E., Gradus, T., Ben-Yaakov, K., Perlson, E. Compartmental microfluidic system for studying muscle-neuron communication and neuromuscular junction maintenance. European Journal of Cell Biology. 95 (2), 69-88 (2016).
- Adamovich, Y., Ezagouri, S., Dandavate, V., Asher, G. Monitoring daytime differences in moderate intensity exercise capacity using treadmill test and muscle dissection. STAR Protocols. 2 (1), 100331(2021).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), 2279(2017).
- Keszler, A., Lindemer, B., Hogg, N., Weihrauch, D., Lohr, N. L. Wavelength-dependence of vasodilation and NO release from S-nitrosothiols and dinitrosyl iron complexes by far red/near infrared light. Archives of Biochemistry and Biophysics. 649, 47-52 (2018).
- Weihrauch, D., et al. Vasodilation of isolated vessels and the isolation of the extracellular matrix of tight-skin mice. Journal of Visualized Experiments: JoVE. (121), e55036(2017).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Li, Z., Jiang, J., Gao, S. Potential of C-X-C motif chemokine ligand 1/8/10/12 as diagnostic and prognostic biomarkers in idiopathic pulmonary arterial hypertension. Clinical Respiratory Journal. , (2021).
- Weihrauch, D., et al. Intralipid increases nitric oxide release from human endothelial cells during oxidative stress. JPEN. Journal of Parenteral and Enteral Nutrition. 45 (2), 295-302 (2021).
- Liebert, A., Krause, A., Goonetilleke, N., Bicknell, B., Kiat, H. A role for photobiomodulation in the prevention of myocardial ischemic reperfusion injury: A systematic review and potential molecular mechanisms. Scientific Reports. 7, 42386(2017).
- Asghari, A., Takhtfooladi, M. A., Hoseinzadeh, H. A. Effect of photobiomodulation on ischemia/reperfusion-induced renal damage in diabetic rats. Lasers in Medical Science. 31 (9), 1943-1948 (2016).
- Quirk, B. J., Sonowal, P., Jazayeri, M. A., Baker, J. E., Whelan, H. T. Cardioprotection from ischemia-reperfusion injury by near-infrared light in rats. Photomedicine and Laser Surgery. 32 (9), 505-511 (2014).
- Smith, E. R., Shapiro, G. L. Totally tourniquets. The facts & details about different types of tourniquets. JEMS: A Journal of Emergency Medical Services. 38 (11), 48-50 (2013).
- Yu, G., et al. Inhibition of myeloperoxidase oxidant production by N-acetyl lysyltyrosylcysteine amide reduces brain damage in a murine model of stroke. Journal of Neuroinflammation. 13 (1), 119(2016).
- de Brito Sousa, K., et al. Differential expression of inflammatory and anti-inflammatory mediators by M1 and M2 macrophages after photobiomodulation with red or infrared lasers. Lasers in Medical Science. 35 (2), 337-343 (2020).
- Iida, N., Grotendorst, G. R. Cloning and sequencing of a new gro transcript from activated human monocytes: expression in leukocytes and wound tissue. Molecular and Cellular Biology. 10 (10), 5596-5599 (1990).
- Jani, S., Bergmann, S. R. Metabolic modulation of myocardial ischemia. Current Cardiology Reports. 8 (2), 123-130 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados