Method Article
Trattamento con luce infrarossa non termica del danno da ischemia/riperfusione e successiva analisi della differenziazione dei macrofagi
In questo articolo
Riepilogo
Descriviamo la riduzione del danno da riperfusione mediante irradiazione a 670 nm in un modello murino di ischemia e riperfusione mediante posizionamento del laccio emostatico. Questa irradiazione di 670 nm ha ridotto la risposta infiammatoria, diminuito il numero di macrofagi proinfiammatori e aumentato i macrofagi protettivi.
Abstract
Il danno tissutale e la necrosi da processi infiammatori sono una conseguenza del danno da ischemia e riperfusione (IRI). Nel muscolo scheletrico, l'ischemia riduce la capacità energetica aerobica delle cellule muscolari, portando ad alterazioni biochimiche avverse e infiammazione. L'obiettivo di questo studio è dimostrare che l'esposizione alla luce nel vicino infrarosso (NIR) durante un periodo di ischemia riduce l'IRI diminuendo la necrosi e l'infiammazione, oltre a diminuire l'M1 proinfiammatorio e aumentare i macrofagi M2 protettivi. I topi C57/Bl6 sono stati sottoposti a ischemia degli arti posteriori indotta da laccio emostatico unilaterale per 3 ore, seguita da riperfusione per 15 o 30 minuti. I topi sono stati assegnati in modo casuale a 3 gruppi. Il gruppo 1 è stato sottoposto a IRI con riperfusione di 30 minuti. Il gruppo 2 è stato sottoposto a IRI con una riperfusione di 15 minuti. Ogni gruppo era composto per il 50% da topi trattati con NO-NIR e per il 50% da topi trattati con NIR con esposizione di 50 mW/cm2 per 5 min/1 h dopo la chiusura del laccio emostatico. Il gruppo 3 era costituito da animali fittizi anestetizzati per 3 ore omettendo l'IRI.
L'imaging a flusso laser doppler è stato eseguito su tutti i topi per confermare l'ischemia e la riperfusione. I dati di flusso sono stati espressi come rapporto tra l'arto ischemico e il controllo controlaterale. I topi sono stati soppressi dopo la riperfusione e sono stati prelevati i quadricipiti e il gastrocnemio. L'immunoprecipitazione e il western blot dei marcatori macrofagici CD68 (M1) e CD206 (M2) sono stati eseguiti e normalizzati all'espressione di CD14. L'espressione dei marcatori infiammatori CXCL1 e CXCL5 è stata significativamente ridotta dalla NIR nel gruppo IRI. Una diminuzione significativa di CD68 e un aumento dell'espressione di CD206 sono stati osservati negli animali trattati con IR e NIR. La necrosi tissutale è stata ridotta dalla NIR nel gruppo IRI, come visualizzato dalla colorazione con 2,3,5-trifeniltetrazolio cloruro (TTC). I risultati dimostrano che l'esposizione alla NIR ha ridotto l'IRI e migliorato la sopravvivenza dei tessuti. La NIR ha ridotto l'infiammazione, diminuito l'M1 proinfiammatorio e aumentato i macrofagi M2 protettivi. L'esposizione alla NIR ha ridotto l'infiammazione e migliorato la rigenerazione, portando alla protezione dei tessuti dopo l'ischemia.
Introduzione
Il danno da ischemia e riperfusione (IRI) è una sfida clinica osservata in seguito a lesioni vascolari e all'uso prolungato di lacci emostatici chirurgici. Studi precedenti hanno dimostrato che 60-90 minuti è la soglia superiore per il tempo di ischemia calda, oltre il quale può verificarsi un danno tissutale irreversibile. Più di ogni altro singolo fattore, i limiti del tempo di ischemia calda limitano il successo e il salvataggio del reimpianto degli arti disvascolari 1,2.
Nel muscolo scheletrico, l'ischemia riduce la capacità aerobica delle cellule, portando a infiammazione acuta e alterazioni biochimiche avverse. Questi effetti sono aggravati dalla riperfusione, che stimola il reclutamento di neutrofili e la produzione di radicali liberi, danneggiando ulteriormente il muscolo scheletrico. Ciò può verificarsi dall'occlusione vascolare, sia a seguito di una lesione che dell'uso intenzionale di un laccio emostatico per prevenire l'emorragia. Alcuni dei mediatori chiave in questo processo sono la mieloperossidasi (MPO), un enzima espresso dai neutrofili che è parte integrante della funzione respiratoria e della produzione di radicali liberi3, e le chemochine come CXCL1 e CXCL5 che servono a reclutare i neutrofili nei siti di infiammazione acuta4.
L'arteria femorale non è stata sezionata per imitare un laccio emostatico aperto in caso di emergenza. Questo approccio si basa anche sulla riproducibilità della creazione di ischemia e riperfusione, nonché su un'area priva di sangue coerente. Ricerche precedenti hanno dimostrato che l'esposizione a luce infrarossa non termica (NIR) con una lunghezza d'onda di 670 nm può aumentare la collateralizzazione vascolare in un arto posteriore ischemico di topo con esposizione NIR per giorni, mitigando gli effetti di IRI5. Inoltre, ricerche precedenti hanno dimostrato che la luce NIR può indurre la polarizzazione dei macrofagi in fenotipi proinfiammatori (M1) o procicatrizzanti (M2)6.
Qualsiasi trattamento in grado di ridurre al minimo il danno tissutale e la morte cellulare a seguito di ipossia e riperfusione sarebbe utile per aumentare il successo del salvataggio degli arti a seguito di lesioni vascolari. Pertanto, l'obiettivo generale è quello di migliorare l'IRI introducendo il trattamento con luce a 670 nm come opzione praticabile per altre modalità di trattamento. Questo articolo si basa sull'ipotesi che l'esposizione alla luce NIR durante un periodo di ischemia diminuisca l'infiammazione e la necrosi tissutale diminuendo la secrezione di proteine chemioattrattive e l'afflusso di cellule infiammatorie inducendo i macrofagi ad assumere un fenotipo M2.
Protocollo
Questo studio è stato condotto in stretta conformità con le raccomandazioni della Guida per la cura e l'uso degli animali da laboratorio del National Institutes of Health. Il protocollo è stato approvato dal Comitato Istituzionale per la Cura e l'Uso degli Animali (Protocollo: AUA#1517). Tutte le ricerche sui topi sono state condotte in conformità con la politica PHS.
1. Posizionamento del laccio emostatico
NOTA: È stato posizionato un laccio emostatico per indurre l'ischemia e ottenere un campo chirurgico privo di sangue.
- Anestetizzare un topo C57/Bl6 con isoflurano nella camera di induzione a una concentrazione del 3-5%.
- Rimuovere il mouse dalla camera di induzione quando non risponde ai pizzicamenti delle dita. Posizionare il mouse in un cono nasale per un'anestesia continua all'1,5-2% su un termoforo con un tappetino non riflettente sotto un laser doppler imager (LDI).
- Posizionare il laccio emostatico attorno all'arto posteriore sinistro (Figura 1).
NOTA: Non chiudere ancora il laccio emostatico. Misurare prima il flusso sanguigno (vedere paragrafo 2).
2. Misurazione del flusso sanguigno mediante LDI
NOTA: Il flusso sanguigno è stato misurato per confermare la corretta occlusione e riperfusione come descritto in precedenza7.
- Posizionare il mouse anestetizzato sotto l'LDI (26 cm) su un termoforo con superficie non riflettente in posizione prona con le gambe tese e le zampe rivolte verso l'alto.
- Acquisisci immagini posizionando il mouse all'interno dell'area di acquisizione del laser (16,1 cm x 16,1 cm).
- Regolare il laser su una velocità di scansione di 4 ms/pixel. Cattura le immagini con il software proprietario premendo il pulsante di registrazione . Scatta immagini prima, durante l'occlusione e durante la riperfusione facendo clic sul pulsante di registrazione .
NOTA: le immagini sono immagini di mappe relative al flusso; il rosso è un buon flusso sanguigno; Il blu non è flusso sanguigno. Conferma nell'immagine che l'arto posteriore occluso è blu. Allo stesso modo, controlla l'immagine per confermare che l'arto posteriore precedentemente occluso è rosso alla riperfusione. È imperativo avere un tappetino non riflettente per l'LDI; In caso contrario, il riflesso influenzerà le immagini.
- Regolare il laser su una velocità di scansione di 4 ms/pixel. Cattura le immagini con il software proprietario premendo il pulsante di registrazione . Scatta immagini prima, durante l'occlusione e durante la riperfusione facendo clic sul pulsante di registrazione .
- Analizza le immagini con il software fornito definendo una regione di interesse. Stabilire un rapporto tra le gambe ischemiche e quelle di controllo.
3. Protocollo di ischemia e riperfusione
- Chiudere il laccio emostatico attorno all'arto posteriore del topo anestetizzato per 3 ore.
NOTA: Stringere il laccio emostatico crea ischemia, interrompendo il flusso sanguigno. - Aprire il laccio emostatico dopo 3 h di occlusione; Aprire e perfondere l'arto posteriore per 15 o 30 minuti.
4. Prelievo di tessuti
- Aumentare l'anestesia al 5% di isoflurano per anestetizzare profondamente i topi. Esegui uno pneumotorace aprendo la cavità toracica con forbici affilate per garantire la morte. Raccogliere i muscoli gastrocnemi e quadricipiti 8,9,10.
- Congelare il tessuto raccolto in azoto liquido e conservarlo a -80 °C per ulteriori analisi.
5. Applicazione NIR
NOTA: Il NIR viene applicato per ridurre l'infiammazione e ridurre il danno da riperfusione.
- Applicare 670 nm NIR a un'intensità di 100 mW per 5 minuti una volta all'ora durante l'occlusione.
- Puntare l'arto posteriore con la sorgente luminosa a fibre ottiche a una distanza di 2,5 cm tra l'arto posteriore e la luce. Non esporre la gamba controlaterale al NIR (vedere la Figura 1 per la configurazione).
- Illuminare la luce NIR per 5 minuti all'ora per tutta la durata del periodo ischemico.
- Strumentalizza il gruppo fittizio allo stesso modo. Non chiudere il laccio emostatico né applicare NIR sull'arto posteriore.
NOTA: La luce NIR è dotata di un dissipatore di calore. La temperatura non aumenta entro 5 minuti dall'esposizione alla luce11.
6. Necrosi TTC
NOTA: La necrosi tissutale viene valutata per visualizzare la riduzione della necrosi nel tessuto muscolare.
- Colorare i muscoli del quadricipite freschi con TTC a 37 °C per 20-30 minuti in TTC all'1% in tampone fosfato 0,1 M regolato a pH 7,4.
- Osservare il tessuto vivo rosso e colorato in base alla presenza di un precipitato di formazan.
NOTA: La colorazione rossa si basa sulla riduzione del TTC da parte degli enzimi deidrogenasi nei tessuti sani. Il tessuto necrotico non è colorato10. - Acquisisci immagini di fette colorate con TTC per l'analisi e misura la regione necrotica definendo una regione di interesse.
7. Analisi Western per la clorotirosina
- Sottoporre i topi al protocollo di ischemia/riperfusione (sezione 3).
- Raccogliere i tessuti (sezione 4) e isolare le proteine come descritto in precedenza12. Determinare la concentrazione proteica mediante il saggio di Bradford13.
- Utilizzare il lisato proteico totale per eseguire l'elettroforesi e il blot per la 3-clorotirosina come descritto in precedenza12.
- Eseguire un western blot sui lisati dei gastrocnemi.
- Aggiungere ai campioni il tampone campione Laemmli contenente il 5% di mercaptoetanolo per ottenere una concentrazione di 25 μg di proteine totali in 40 μl.
- Eseguire i campioni su un gel esteso di tris-glicina al 4-15% (vedere la Tabella dei materiali) a 50 mV per 5 minuti. Aumentare la tensione a 100 mV per 1 ora fino all'esaurimento del fronte del colorante.
- Incubare il gel in 1 tampone di trasferimento (25 mM di Tris, 190 mM di glicina, 20% di metanolo; regolare il pH a 8,3 se necessario) per 10 minuti.
- Assemblare il sandwich di trasferimento (spugna, filtro, gel, membrana di cellulosa, filtro, spugna). Inserire un impacco di ghiaccio riutilizzabile nell'apparecchio di trasferimento. Trasferimento per 30 minuti in cella frigorifera a 100 mA.
NOTA: Assicurarsi che non vi siano bolle intrappolate nel sandwich di trasferimento, che la macchia sia sul catodo e che il gel sia sull'anodo. - Sciacquare la macchia e bloccarla nel tampone bloccante (vedere la Tabella dei materiali) con Tween allo 0,05% per 30 minuti a temperatura ambiente. Lavare il blot con soluzione salina tamponata con Tris (TBS) contenente il 5% di Tween tre volte per 5 minuti ciascuna prima di aggiungere l'anticorpo primario.
- Incubare per una notte con gli anticorpi policlonali primari contro la 3-clorotirosina. Diluire gli anticorpi nel tampone bloccante con Tween allo 0,05% (1:1.000).
- Utilizzare come anticorpi secondari le IgG anti-topo coniugate con perossidasi di rafano (HRP) e le IgG anti-capra HRP-anti-capra (diluizione 1:10.000).
- Visualizzare le bande di identità nei blot utilizzando il reagente a chemiluminescenza potenziata (ECL) e un sistema di imaging.
- Miscelare i componenti in base al protocollo del produttore e incubarli con il blot per 3 minuti per legare i reagenti ECL alle bande di interesse.
- Visualizzare la macchia con un sistema di imaging (vedere la Tabella dei materiali). Utilizzare software di imaging come ImageJ per misurare la densità e normalizzare i valori di densità delle bande di interesse con quelli delle bande di controllo.
8. ELISA per CXCL1 e CXCL5
- Isolare le proteine totali dai muscoli gastrocnemii come descritto in precedenza12.
- Valutare il grado di infiammazione mediante ELISA per CXCL1 e CXCL5 come precedentemente descritto14 e secondo le istruzioni del produttore.
9. Immunoprecipitazione seguita da analisi western
- Sottoporre i topi al protocollo di ischemia/riperfusione (sezione 3).
- Raccogliere i tessuti (sezione 4) e isolare le proteine come descritto in precedenza12. Determinare la concentrazione proteica mediante il Bradford Assay13.
- Per concentrare la frazione macrofagica del lisato proteico totale, eseguire un'immunoprecipitazione per CD14 come descritto in precedenza15.
- Utilizzare l'immunoprecipitato CD14 per eseguire l'elettroforesi e il blot per CD206 e CD68 come descritto in precedenza12.
- Eseguire un western blot sui lisati dei gastrocnemi come descritto nel paragrafo 7.
- Incubare gli immunoprecipitati durante la notte con gli anticorpi policlonali primari contro CD206 o CD68. Diluire gli anticorpi 1:200 in TBS.
- Utilizzare le IgG anti-topo d'asino coniugate HRP e le IgG anti-capra HRP (diluizione 1:10.000) come anticorpi secondari.
- Applicare il reagente ECL al blot dopo aver miscelato i componenti in base al protocollo del produttore e incubare per 3 minuti per visualizzare le bande di interesse. Visualizzare la macchia utilizzando un sistema di imaging.
10. Analisi statistica
- Eseguire l'analisi statistica dei dati all'interno e tra i gruppi con analisi della varianza (ANOVA) per misure ripetute seguite dalla modifica di Bonferroni del t-test di Student, p ≤ 0,05.
- Esprimere i dati come media ± errore standard della media (SEM) o media ± deviazione standard (SD).
Risultati
Le misurazioni del flusso hanno confermato l'ischemia e la riperfusione
Il posizionamento della luce NIR e il protocollo sperimentale sono illustrati nella Figura 1. È stato sviluppato e utilizzato un modello murino di ischemia degli arti posteriori per valutare l'effetto dell'esposizione al NIR sull'IRI del muscolo scheletrico. Come previsto, l'imaging laser doppler a flusso (Figura 2A) ha verificato che il laccio emostatico era efficace nell'indurre l'ischemia insieme a un ritorno del flusso sanguigno vicino al basale sia per gli arti posteriori trattati con NIR (n = 6) che per quelli non trattati con luce (n = 6). L'imaging termico (Figura 2A) ha anche dimostrato che non c'era riscaldamento degli arti dagli array di LED, suggerendo che gli effetti osservati erano attribuibili alla luce NIR e non al riscaldamento termico.
Il trattamento NIR riduce l'infarto del quadricipite
La delineazione istologica macroscopica del tessuto muscolare scheletrico con colorazione TTC (Figura 3A) ha dimostrato una significativa diminuzione di 1,5 volte (p < 0,05) della quantità di tessuto necrotico nei quadricipiti trattati con luce NIR (n = 3) dopo IRI rispetto ai quadricipiti non esposti a NIR (n = 3, Figura 3B).
L'applicazione di NIR riduce l'espressione della clorotirosina nei gastrocnemii
L'analisi Western blot degli addotti della 3-clorotirosina (Figura 4) è stata eseguita come marcatore surrogato per la presenza di neutrofili in fase acuta. Ha dimostrato una significativa diminuzione di 2,9 volte (p < 0,05) dell'espressione dell'addotto della clorotirosina nel gastrocnemio trattato con luce NIR dopo IRI rispetto al gastrocnemio non esposto a NIR.
L'applicazione di NIR riduce l'espressione di CXCL1 e CXCL5 nei gastrocnemii
Un ELISA è stato utilizzato per determinare i livelli di espressione delle due chemochine proinfiammatorie CXCL1 (Figura 5A) e CXCL5 (Figura 5B). Il trattamento NIR ha ridotto significativamente l'espressione di CXCL1 e CXCL5 dopo 15 minuti di riperfusione. Solo il livello di espressione di CXCL5 è risultato significativamente ridotto dopo 30 minuti di riperfusione.
Effetti del trattamento NIR sul fenotipo dei macrofagi nei gastrocnemi
L'immunoprecipitazione per il marcatore macrofagico CD14 seguita dall'analisi western blot per il marcatore M1 CD68 e il marcatore M2 CD206 è stata eseguita per comprendere il contributo dei macrofagi M1 e M2 alla propagazione dell'infiammazione. Questi dati mostrano che il trattamento NIR ha ridotto il livello di espressione del marcatore infiammatorio dei macrofagi M1 (Ischemia + NIR 5752 ± 154, Ischemia - NIR 6464 ± 213, Controllo 6524 ± 202) (Figura 6A) e ha aumentato il livello di espressione del marcatore protettivo dei macrofagi M2 (Figura 6B) normalizzato al livello di espressione del marcatore dei macrofagi totali (Ischemia + NIR 7378.68 ± 425, Ischemia - NIR 5853.67 ± 215, Control 5542.53 ± 220).

Figura 1: Protocollo sperimentale e posizione della sorgente luminosa in fibra ottica. Abbreviazioni: LDI = laser doppler imager; NIR = vicino infrarosso. Clicca qui per visualizzare una versione più grande di questa figura.
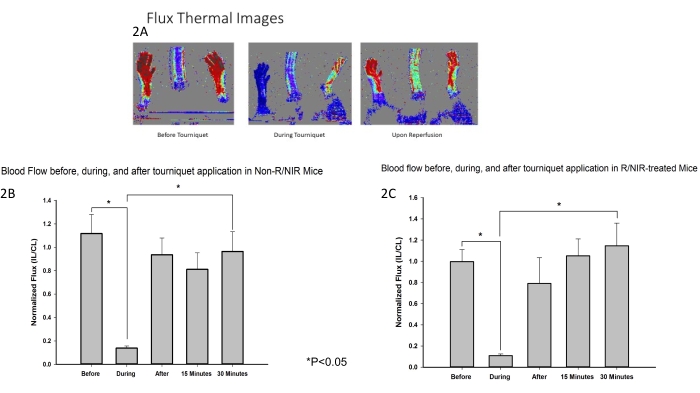
Figura 2: Le misurazioni LDI hanno confermato che il laccio emostatico era efficace nell'indurre l'ischemia. (A) Le immagini termiche del flusso dimostrano l'interruzione del flusso sanguigno e il ripristino del flusso sanguigno dopo la riperfusione. L'analisi delle immagini di flusso mostra l'interruzione del flusso sanguigno durante l'ischemia e il ripristino del flusso sanguigno dopo riperfusione nei topi di controllo (B) e trattati con R/NIR (C). Abbreviazioni: LDI = laser doppler imager; R = riperfusione; NIR = luce nel vicino infrarosso. Clicca qui per visualizzare una versione più grande di questa figura.
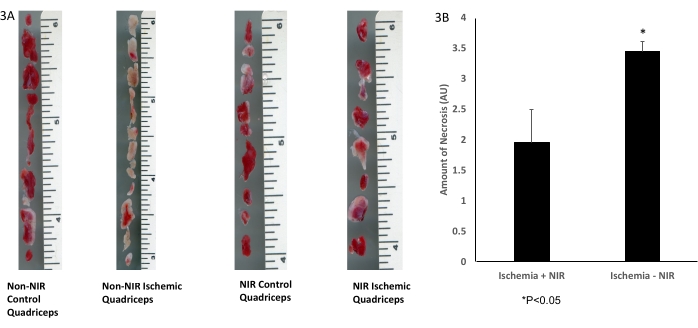
Figura 3: Colorazione TTC del tessuto muscolare scheletrico. (A) colorazione TTC; (B) l'analisi mostra una significativa diminuzione del tessuto muscolare scheletrico infartuato. La barra della scala (pollici) rappresenta la dimensione del muscolo quadricipite. *P ≤ 0,05. Abbreviazioni: NIR = vicino infrarosso; TTC = cloruro di 2,3,5-trifeniltetrazolio. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Livelli di espressione della 3-clorotirosina nel muscolo scheletrico dopo irradiazione NIR. L'analisi del western blot mostra una significativa diminuzione dei livelli di espressione della 3-clorotirosina nel muscolo scheletrico dopo irradiazione NIR. *P ≤ 0,05. Abbreviazioni: NIR = vicino infrarosso; IL = arto ischemico; CL = arto controlaterale. Clicca qui per visualizzare una versione più grande di questa figura.
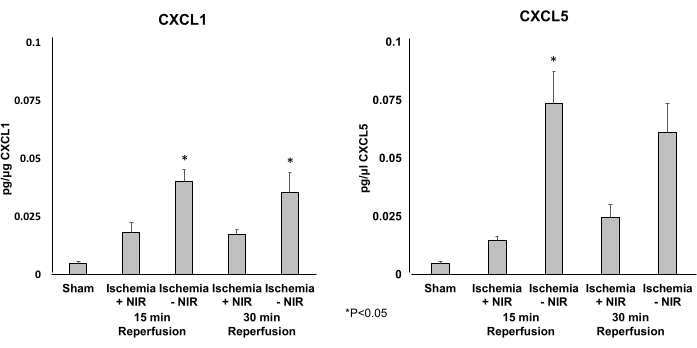
Figura 5: Livelli di espressione di CXCL1 e CXCL5 determinati mediante ELISA. (A) I livelli di espressione di CXCL1 sono significativamente diminuiti a 15 minuti di riperfusione nel gruppo NIR. Questo effetto significativo è diminuito dopo 30 minuti rispetto al controllo no-NIR. (B) I livelli di espressione di CXCL5 sono significativamente diminuiti a 15 e 30 minuti di riperfusione nel gruppo leggero rispetto al gruppo senza luce. *P ≤ 0,05. Abbreviazioni: NIR = vicino infrarosso; ELISA = saggio di immunoassorbimento enzimatico. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Livelli di espressione di M1 e M2 normalizzati al marcatore macrofagico totale CD14 determinato mediante immunoprecipitazione seguita da analisi western blot. (A) Livello di espressione del marcatore macrofagico M1 CD68 normalizzato all'espressione del marcatore macrofagico CD14. Il trattamento con luce ha ridotto significativamente il livello di espressione del marcatore proinfiammatorio M1 CD68 rispetto al trattamento senza luce e al controllo. (B) Livello di espressione del marcatore protettivo dei macrofagi M2 CD206 normalizzato all'espressione del marcatore macrofagico CD14. Il trattamento con luce ha aumentato significativamente l'espressione di CD206 rispetto al trattamento senza luce e al controllo. *P ≤ 0,05. Abbreviazione: NIR = vicino infrarosso. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo articolo descrive uno dei primi studi a concentrarsi sulla riduzione del danno da riperfusione mediante trattamento con luce NIR modificando la risposta infiammatoria nell'arto posteriore. Il danno da ischemia-riperfusione e il trattamento con luce NIR non sono del tutto nuovi. Altri studi si sono concentrati sulla riperfusione ischemica mediante luce NIR. Il trattamento con luce NIR è stato utilizzato con successo nella riduzione delle dimensioni dell'infract miocardico e nella riduzione del danno renale dopo il danno da riperfusione ischemica. Quirk et al. hanno riportato una riduzione delle dimensioni dell'infarto del miocardio e una riduzione della riperfusione ischemica dopo l'applicazione di NIR 16,17,18.
Il posizionamento di un laccio emostatico è di grande importanza per fermare l'emorragia dopo un infortunio o creare un'area priva di sangue in un ambiente clinico durante l'intervento chirurgico e in situazioni di emergenza, incluso il campo di battaglia19. Avere un'ischemia prolungata seguita da riperfusione solleva la preoccupazione di lesioni da riperfusione.
Questi dati mostrano che la fototerapia sotto forma di applicazione di luce LED a 670 nm riduce il danno da riperfusione abbassando la risposta infiammatoria e cambia i macrofagi da un fenotipo infiammatorio a uno antinfiammatorio dopo il posizionamento del laccio emostatico. L'espressione del marcatore infiammatorio, la clorotirosina, è elevata dopo la riperfusione ischemica, evidenziando la lesione (Figura 3). La clorotirosina è un prodotto finale dell'ossidazione dell'attività dell'MPO. Yu et al. hanno riportato un aumento dell'espressione della clorotirosina come marcatore di infiammazione in un modello di riperfusione ischemica di ictus murino20.
Inoltre, Souza et al. hanno descritto un cambiamento del fenotipo dei macrofagi 24 ore dopo la fotobiomodulazione utilizzando la linea cellulare di macrofagi J774, concludendo che il trattamento NIR modula le fasi infiammatorie e migliora la riparazione dei tessuti 6,21. Oltre a reclutare macrofagi e varie altre cellule immunitarie, CXCL1 e CXCL5 hanno significativi effetti chemioattrattivi sui neutrofili, che sono i più direttamente responsabili dell'IRI. MCP-1 non è stato incluso in questa analisi in quanto è strettamente un chemioattrattivo monocitario/macrofagico. CXCL1 e CXCL5 sono prodotti da varie cellule, tra cui macrofagi, neutrofili e cellule epiteliali 4,22
Il limite di questo studio è la profondità di penetrazione della luce NIR. Hu et al. descrivono la penetrazione di 5 cm nella maggior parte dei tessuti utilizzando cadaveri e confrontando diverse aree23. L'approccio di questo articolo è stato quello di determinare la polarizzazione dei macrofagi M1 e M2 in base alla concentrazione di tutti i macrofagi mediante immunoprecipitazione seguita dall'analisi western blot per determinare i cambiamenti nel contributo di M1 e M2 all'infiammazione dopo il trattamento NIR. L'immunofluorescenza, la citometria a flusso e un intero pannello di marcatori di polarizzazione dei macrofagi non sono stati eseguiti. Questi risultati mostrano che l'infiammazione in un contesto di riperfusione/lesione è stata ridotta dal trattamento con luce NIR e suggeriscono una possibile applicazione clinica. I passaggi più critici di questo protocollo sono la conferma dell'occlusione e l'applicazione della luce NIR una volta all'ora per 5 minuti per tutta la durata dell'ischemia.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Ringraziamo il Dipartimento di Chirurgia Ortopedica per aver finanziato questo studio. Ringraziamo anche Brian Lindemer e Grant Broeckel per il loro supporto tecnico.
Materiali
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium | Sigma Aldrich | 17779-10X10ML-F | 1% solution |
| 4–15% Criterio TGX Stain-Free Protein Gel | BioRad | #5678084 | Tris-glycine extended gels |
| 4x Laemmli Sample Buffer - 1610747 | BioRad | 16110747 | |
| 670 nm light source | NIR Technologies | custom made | |
| BCA Protein Assay Kit | Thermo Fisher | 23227 | |
| BioRad ChemiDoc | Bio-Rad | Imaging system | |
| Bio-Rad | |||
| β-mercaptoethanol | BioRad | 1610710 | |
| CXCL1 ELISA | R&D Systems | DY453-05 | |
| CXCL5 ELISA | R&D Systems | DX000 | |
| Forane | Baxter | 1001936040 | isoflurane inhalant |
| goat anti-rabbit IgG-HRP | Santa Cruz Biotechnologies | sc-2004 | 1:10,000 dilution |
| Ice Accu ice pack | |||
| Laser doppler Imager | Moor | MOORLDI2-HIR | |
| monoclonal CD14 antibody | Santa Cruz Biotechnologies | sc-515785 | 1:200 dilution |
| monoclonal CD206 antibody | Santa Cruz Biotechnologies | sc-58986 | 1:200 dilution |
| monoclonal CD68 antibody | Santa Cruz Biotechnologies | sc-20060 | 1:200 dilution |
| Pierce Protein free (TBS) blocking buffer | blocking buffer | ||
| polyclonal Chlorotyrosine Antibody | Hycult | HP5002 | 1:1,000 dilution |
| Protein A/G PLUS-Agarose | Santa Cruz Biotechnologies | sc-2003 | |
| Super Signal West Femto | ThermoFisher | 34095 | enhanced chemiluminescence reagent |
Riferimenti
- Drysch, M., et al. An optimized low-pressure tourniquet murine hind limb ischemia reperfusion model: Inducing acute ischemia reperfusion injury in C57BL/6 wild type mice. PLoS One. 14 (1), 0210961(2019).
- Bonheur, J. A., Albadawi, H., Patton, G. M., Watkins, M. T. A noninvasive murine model of hind limb ischemia-reperfusion injury. Journal of Surgical Research. 116 (1), 55-63 (2004).
- Whiteman, M., Spencer, J. P. Loss of 3-chlorotyrosine by inflammatory oxidants: implications for the use of 3-chlorotyrosine as a bio-marker in vivo. Biochemical and Biophysical Research Communications. 371 (1), 50-53 (2008).
- Becker, S., Quay, J., Koren, H. S., Haskill, J. S. Constitutive and stimulated MCP-1, GRO alpha, beta, and gamma expression in human airway epithelium and bronchoalveolar macrophages. American Journal of Physiology. 266 (3), 278-286 (1994).
- Zaidi, M., et al. Transient repetitive exposure to low level light therapy enhances collateral blood vessel growth in the ischemic hindlimb of the tight skin mouse. Photochemistry and Photobiology. 89 (3), 709-713 (2013).
- Souza, N. H. C., et al. Photobiomodulation and different macrophages phenotypes during muscle tissue repair. Journal of Cellular and Molecular Medicine. 22 (10), 4922-4934 (2018).
- Tang, G. L., Kim, K. J. Laser doppler perfusion imaging in the mouse hindlimb. Journal of Visualized Experiments: JoVE. (170), e62012(2021).
- Ionescu, A., Zahavi, E. E., Gradus, T., Ben-Yaakov, K., Perlson, E. Compartmental microfluidic system for studying muscle-neuron communication and neuromuscular junction maintenance. European Journal of Cell Biology. 95 (2), 69-88 (2016).
- Adamovich, Y., Ezagouri, S., Dandavate, V., Asher, G. Monitoring daytime differences in moderate intensity exercise capacity using treadmill test and muscle dissection. STAR Protocols. 2 (1), 100331(2021).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), 2279(2017).
- Keszler, A., Lindemer, B., Hogg, N., Weihrauch, D., Lohr, N. L. Wavelength-dependence of vasodilation and NO release from S-nitrosothiols and dinitrosyl iron complexes by far red/near infrared light. Archives of Biochemistry and Biophysics. 649, 47-52 (2018).
- Weihrauch, D., et al. Vasodilation of isolated vessels and the isolation of the extracellular matrix of tight-skin mice. Journal of Visualized Experiments: JoVE. (121), e55036(2017).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Li, Z., Jiang, J., Gao, S. Potential of C-X-C motif chemokine ligand 1/8/10/12 as diagnostic and prognostic biomarkers in idiopathic pulmonary arterial hypertension. Clinical Respiratory Journal. , (2021).
- Weihrauch, D., et al. Intralipid increases nitric oxide release from human endothelial cells during oxidative stress. JPEN. Journal of Parenteral and Enteral Nutrition. 45 (2), 295-302 (2021).
- Liebert, A., Krause, A., Goonetilleke, N., Bicknell, B., Kiat, H. A role for photobiomodulation in the prevention of myocardial ischemic reperfusion injury: A systematic review and potential molecular mechanisms. Scientific Reports. 7, 42386(2017).
- Asghari, A., Takhtfooladi, M. A., Hoseinzadeh, H. A. Effect of photobiomodulation on ischemia/reperfusion-induced renal damage in diabetic rats. Lasers in Medical Science. 31 (9), 1943-1948 (2016).
- Quirk, B. J., Sonowal, P., Jazayeri, M. A., Baker, J. E., Whelan, H. T. Cardioprotection from ischemia-reperfusion injury by near-infrared light in rats. Photomedicine and Laser Surgery. 32 (9), 505-511 (2014).
- Smith, E. R., Shapiro, G. L. Totally tourniquets. The facts & details about different types of tourniquets. JEMS: A Journal of Emergency Medical Services. 38 (11), 48-50 (2013).
- Yu, G., et al. Inhibition of myeloperoxidase oxidant production by N-acetyl lysyltyrosylcysteine amide reduces brain damage in a murine model of stroke. Journal of Neuroinflammation. 13 (1), 119(2016).
- de Brito Sousa, K., et al. Differential expression of inflammatory and anti-inflammatory mediators by M1 and M2 macrophages after photobiomodulation with red or infrared lasers. Lasers in Medical Science. 35 (2), 337-343 (2020).
- Iida, N., Grotendorst, G. R. Cloning and sequencing of a new gro transcript from activated human monocytes: expression in leukocytes and wound tissue. Molecular and Cellular Biology. 10 (10), 5596-5599 (1990).
- Jani, S., Bergmann, S. R. Metabolic modulation of myocardial ischemia. Current Cardiology Reports. 8 (2), 123-130 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon