Method Article
علاج ضوء الأشعة تحت الحمراء غير الحراري لإصابة نقص التروية / إعادة التروية والتحليل اللاحق لتمايز البلاعم
In This Article
Summary
نصف تقليل إصابة إعادة التروية بمقدار 670 نانومتر في نموذج فأر من نقص التروية وإعادة التروية عن طريق وضع العاصبة. قلل هذا التشعيع 670 نانومتر من الاستجابة الالتهابية ، وقلل من عدد البلاعم المسببة للالتهابات ، وزاد من الضامة الواقية.
Abstract
تلف الأنسجة والنخر الناتج عن العمليات الالتهابية هو نتيجة لإصابة نقص التروية (IRI). في العضلات الهيكلية ، يقلل نقص التروية من قدرة الطاقة الهوائية لخلايا العضلات ، مما يؤدي إلى تغيرات كيميائية حيوية ضارة والتهابات. الهدف من هذه الدراسة هو إظهار أن التعرض لضوء الأشعة تحت الحمراء القريبة (NIR) خلال فترة نقص التروية يقلل من IRI عن طريق تقليل النخر والالتهاب بالإضافة إلى تقليل M1 المسببة للالتهابات وزيادة البلاعم M2 الواقية. خضعت الفئران C57 / Bl6 لنقص تروية الأطراف الخلفية الناجم عن عاصبة أحادية الجانب لمدة 3 ساعات متبوعا بإعادة التروية لمدة 15 أو 30 دقيقة. تم تعيين الفئران بشكل عشوائي إلى 3 مجموعات. خضعت المجموعة 1 للضخ الداخلي لمدة 30 دقيقة. خضعت المجموعة 2 للريبري مع إعادة تروية لمدة 15 دقيقة. تألفت كل مجموعة من 50٪ من الفئران المعالجة بالأشعة تحت الحمراء و 50٪ من الفئران المعالجة بالأشعة تحت الحمراء مع تعرض 50 ميجاوات / سم2 لمدة 5 دقائق / 1 ساعة بعد إغلاق العاصبة. كانت المجموعة 3 عبارة عن زائفة تم تخديرها لمدة 3 ساعات مع حذف IRI.
تم إجراء تصوير تدفق دوبلر بالليزر على جميع الفئران لتأكيد نقص التروية وإعادة التروية. تم التعبير عن بيانات التدفق على أنها نسبة الطرف الإقفاري والتحكم المقابل. تم القتل الرحيم للفئران بعد إعادة التروية ، وتم حصاد عضلات الفخذ والمعدة تم إجراء الترسيب المناعي واللطخة الغربية لعلامات البلاعم CD68 (M1) و CD206 (M2) وتطبيعها إلى تعبير CD14. تم تقليل التعبير عن العلامات الالتهابية CXCL1 و CXCL5 بشكل كبير بواسطة NIR في مجموعة IRI. لوحظ انخفاض كبير في CD68 وزيادة في تعبير CD206 في التي تتلقى الأشعة تحت الحمراء والأشعة تحت الحمراء NIR. تم تقليل نخر الأنسجة بواسطة NIR في مجموعة IRI ، كما هو موضح من خلال تلطيخ 2،3،5-ثلاثي فينيلترازوليوم كلوريد (TTC). تظهر النتائج أن التعرض للأشعة تحت الحمراء يقلل من IRI ويحسن بقاء الأنسجة. قلل الأشعة تحت الحمراء من الالتهاب ، وخفض M1 المسببة للالتهابات ، وزاد من الضامة M2 الواقية. أدى التعرض للأشعة تحت الحمراء إلى تقليل الالتهاب وتحسين التجدد ، مما يؤدي إلى حماية الأنسجة بعد نقص التروية.
Introduction
إصابة نقص التروية (IRI) هي تحد سريري يظهر بعد إصابات الأوعية الدموية والاستخدام المطول للعاصبات الجراحية. أظهرت الدراسات السابقة أن 60-90 دقيقة هي العتبة العليا لوقت نقص التروية الدافئ ، والتي يمكن أن يحدث بعدها تلف الأنسجة الذي لا رجعة فيه. أكثر من أي عامل واحد آخر ، تحد قيود وقت نقص التروية الدافئ من نجاح وإنقاذ إعادة زرع الأطراف الوعائية1،2.
في العضلات الهيكلية ، يقلل نقص التروية من القدرة الهوائية للخلايا ، مما يؤدي إلى التهاب حاد وتغيرات كيميائية حيوية ضارة. تتفاقم هذه التأثيرات عن طريق إعادة التروية ، مما يحفز تجنيد العدلات وإنتاج الجذور الحرة ، مما يزيد من إتلاف العضلات الهيكلية. يمكن أن يحدث هذا من انسداد الأوعية الدموية ، سواء كان نتيجة الإصابة أو الاستخدام المتعمد للعاصبة لمنع النزيف. بعض الوسطاء الرئيسيين في هذه العملية هم مايلوبيروكسيداز (MPO) ، وهو إنزيم يتم التعبير عنه بواسطة العدلات وهو جزء لا يتجزأ من وظيفة انفجار الجهاز التنفسي وإنتاج الجذور الحرة3 ، والكيموكينات مثل CXCL1 و CXCL5 التي تعمل على تجنيد العدلات في مواقع الالتهاب الحاد4.
لم يتم تشريح الشريان الفخذي لتقليد عاصبة مفتوحة في حالات الطوارئ. يعتمد هذا النهج أيضا على قابلية تكرار خلق نقص التروية وإعادة التروية بالإضافة إلى منطقة خالية من الدم بشكل متسق. أظهرت الأبحاث السابقة أن التعرض لضوء الأشعة تحت الحمراء غير الحرارية (NIR) بطول موجي يبلغ 670 نانومتر يمكن أن يزيد من ضمانات الأوعية الدموية في الطرف الخلفي الإقفاري للفأر مع التعرض للأشعة تحت الحمراء على مدار أيام ، مما يخفف من آثار IRI5. بالإضافة إلى ذلك ، أظهرت الأبحاث السابقة أن ضوء الأشعة تحت الحمراء يمكن أن يحفز استقطاب البلاعم إما في الأنماط الظاهرية المسببة للالتهابات (M1) أو الشفاء (M2)6.
أي علاج يمكن أن يقلل من تلف الأنسجة والموت الخلوي بعد نقص الأكسجة وإعادة التروية سيكون مفيدا في زيادة نجاح إنقاذ الأطراف بعد إصابات الأوعية الدموية. لذلك ، فإن الهدف العام هو تحسين IRI من خلال إدخال معالجة الضوء 670 نانومتر كخيار قابل للتطبيق لطرق العلاج الأخرى. تستند هذه الورقة إلى الفرضية القائلة بأن التعرض لضوء الأشعة تحت الحمراء أثناء فترة نقص التروية يقلل من الالتهاب ونخر الأنسجة عن طريق تقليل إفراز البروتينات الجاذبة الكيميائية وتدفق الخلايا الالتهابية عن طريق تحفيز البلاعم على اتخاذ نمط ظاهري M2.
Protocol
أجريت هذه الدراسة بما يتفق بدقة مع التوصيات الواردة في دليل رعاية واستخدام المختبر التابع للمعاهد الوطنية للصحة. تمت الموافقة على البروتوكول من قبل اللجنة المؤسسية لرعاية واستخدامه (البروتوكول: AUA # 1517). أجريت جميع الأبحاث التي شملت الفئران وفقا لسياسة PHS.
1. وضع عاصبة
ملاحظة: تم وضع عاصبة للحث على نقص التروية وتحقيق مجال جراحي خال من الدم.
- تخدير فأر C57 / Bl6 باستخدام الأيزوفلوران في غرفة الحث بتركيز 3-5٪.
- قم بإزالة الماوس من حجرة الحث عندما لا يستجيب لقرصات أصابع القدم. ضع الفأر في مخروط الأنف لاستمرار التخدير بنسبة 1.5-2٪ على وسادة تسخين مع حصيرة غير عاكسة أسفل جهاز تصوير دوبلر بالليزر (LDI).
- ضع العاصبة حول الطرف الخلفي الأيسر (الشكل 1).
ملاحظة: لا تغلق العاصبة بعد. قم بقياس تدفق الدم أولا (انظر القسم 2).
2. قياس تدفق الدم بواسطة LDI
ملاحظة: تم قياس تدفق الدم لتأكيد الانسداد الصحيح وإعادة التروية كما هو موضحسابقا 7.
- ضع الفأر المخدر أسفل LDI (26 سم) على وسادة تسخين ذات سطح غير عاكس في وضع الانبطاح مع أرجل وأقدام مشدودة متجهة لأعلى.
- التقط الصور عن طريق وضع الماوس داخل منطقة التقاط الليزر (16.1 سم × 16.1 سم).
- اضبط الليزر على سرعة مسح 4 مللي ثانية / بكسل. التقط الصور باستخدام البرنامج الاحتكاري بالضغط على زر التسجيل . التقط الصور قبل وأثناء الانسداد وأثناء إعادة التروية بالنقر فوق زر التسجيل .
ملاحظة: الصور عبارة عن صور خريطة متعلقة بالتدفق. الأحمر هو تدفق الدم الجيد. الأزرق لا يتدفق الدم. تأكد في الصورة من أن الطرف الخلفي المغلق أزرق. وبالمثل ، تحقق من الصورة للتأكد من أن الطرف الخلفي المسدود سابقا أحمر عند إعادة التروية. من الضروري أن يكون لديك حصيرة غير عاكسة ل LDI. خلاف ذلك ، سيؤثر الانعكاس على الصور.
- اضبط الليزر على سرعة مسح 4 مللي ثانية / بكسل. التقط الصور باستخدام البرنامج الاحتكاري بالضغط على زر التسجيل . التقط الصور قبل وأثناء الانسداد وأثناء إعادة التروية بالنقر فوق زر التسجيل .
- قم بتحليل الصور باستخدام البرنامج المقدم من خلال تحديد منطقة الاهتمام. حدد نسبة بين الساقين الإقفارية والساقين الضابطة.
3. بروتوكول نقص التروية وإعادة التروية
- أغلق العاصبة حول الطرف الخلفي للفأر المخدر لمدة 3 ساعات.
ملاحظة: يؤدي شد العاصبة إلى نقص تروية ، مما يؤدي إلى مقاطعة تدفق الدم. - افتح العاصبة بعد 3 ساعات من الانسداد ؛ افتح الطرف الخلفي وقم بفتحه لمدة 15 أو 30 دقيقة.
4. حصاد الأنسجة
- زيادة التخدير إلى 5٪ الأيزوفلوران لتخدير الفئران بعمق. قم بإجراء استرواح الصدر عن طريق فتح تجويف الصدر بمقص حاد لضمان الموت. حصاد عضلات المعدة وعضلات الفخذ8،9،10.
- قم بتجميد الأنسجة المجمعة في النيتروجين السائل وتخزينها في درجة حرارة -80 درجة مئوية لمزيد من التحليل.
5. تطبيق NIR
ملاحظة: يتم تطبيق NIR لتقليل الالتهاب وتقليل إصابة إعادة التروية.
- ضع 670 نانومتر NIR بكثافة 100 ميجاوات لمدة 5 دقائق مرة واحدة في الساعة أثناء الانسداد.
- استهدف الطرف الخلفي بمصدر ضوء الألياف الضوئية على مسافة 2.5 سم بين الطرف الخلفي والضوء. لا تعرض الساق المقابلة للأشعة تحت الحمراء (انظر الشكل 1 للإعداد).
- قم بإضاءة ضوء NIR لمدة 5 دقائق في الساعة طوال فترة الإقفار.
- قم بأداة المجموعة الوهمية بنفس الطريقة. لا تغلق العاصبة أو تضع الأشعة تحت الحمراء على الطرف الخلفي.
ملاحظة: يحتوي ضوء NIR على مشتت حراري. لا ترتفع درجة الحرارة في غضون 5 دقائق من التعرض للضوء11.
6. نخر TTC
ملاحظة: يتم تقييم نخر الأنسجة لتصور انخفاض النخر في الأنسجة العضلية.
- تلطيخ عضلات الفخذ الطازجة باستخدام TTC عند 37 درجة مئوية لمدة 20-30 دقيقة في 1٪ TTC في محلول فوسفات 0.1 متر معدل إلى درجة الحموضة 7.4.
- راقب الأنسجة الحية الحمراء الملطخة بناء على وجود راسب فورمازان.
ملاحظة: يعتمد التلوين الأحمر على تقليل TTC بواسطة إنزيمات نازعة الهيدروجين في الأنسجة السليمة. الأنسجة النخرية غير ملوثة10. - التقط صورا للشرائح الملطخة ب TTC لتحليلها وقياس المنطقة النخرية من خلال تحديد منطقة الاهتمام.
7. التحليل الغربي للكلوروتيروزين
- إخضاع الفئران لبروتوكول نقص التروية/إعادة التروية (القسم 3).
- حصاد الأنسجة (القسم 4) وعزل البروتين كما هو موضحسابقا 12. حدد تركيز البروتين بواسطة اختبار برادفورد13.
- استخدم محللة البروتين الكلي لإجراء الرحلان الكهربائي وصمة عار ل 3-كلوروتيروزين كما هو موضحسابقا 12.
- قم بإجراء وصمة عار غربية على محللات المعدة.
- أضف مخزن عينة Laemmli الذي يحتوي على 5٪ mercaptoethanol إلى العينات للحصول على تركيز 25 ميكروغرام من البروتين الكلي في 40 ميكرولتر.
- قم بتشغيل العينات على 4-15٪ من هلام Tris-glycine الممتد (انظر جدول المواد) عند 50 مللي فولت لمدة 5 دقائق. قم بزيادة الجهد إلى 100 مللي فولت لمدة 1 ساعة حتى تنفد واجهة الصبغة.
- احتضان الجل في مخزن مؤقت للنقل 1x (25 ملي تريس ، 190 ملي جلايسين ، 20٪ ميثانول ؛ اضبط الرقم الهيدروجيني على 8.3 إذا لزم الأمر) لمدة 10 دقائق.
- قم بتجميع شطيرة النقل (إسفنجة ، فلتر ، جل ، غشاء السليلوز ، مرشح ، إسفنج). ضع كيس ثلج قابل لإعادة الاستخدام في جهاز النقل. نقل لمدة 30 دقيقة في غرفة التبريد عند 100 مللي أمبير.
ملاحظة: تأكد من عدم وجود فقاعات محاصرة في شطيرة النقل ، وأن اللطخة على الكاثود والهلام على الأنود. - اشطف اللطخة وقم بسدها في المخزن المؤقت (انظر جدول المواد) باستخدام 0.05٪ توين لمدة 30 دقيقة في درجة حرارة الغرفة. اغسل اللطخة بمحلول ملحي مخزن في تريس (TBS) الذي يحتوي على 5٪ Tween ثلاث مرات لمدة 5 دقائق لكل منها قبل إضافة الجسم المضاد الأساسي.
- احتضان بين عشية وضحاها مع الأجسام المضادة الأولية متعددة النسيلة ل 3-كلوروتيروزين. تمييع الأجسام المضادة في المخزن المؤقت المانع بنسبة 0.05٪ توين (1: 1,000).
- استخدم الحمار بيروكسيداز الفجل الحار (HRP) ، والحمار المضاد للفأر IgG ، و HRP-المضاد للماعز IgG (تخفيف 1: 10,000) كأجسام مضادة ثانوية.
- تصور نطاقات الهوية في البقع باستخدام كاشف التلألؤ الكيميائي المحسن (ECL) ونظام التصوير.
- امزج المكونات بناء على بروتوكول الشركة المصنعة واحتضانها باللطخة لمدة 3 دقائق لربط كواشف ECL بالعصابات ذات الاهتمام.
- صور اللطخة باستخدام نظام التصوير (انظر جدول المواد). استخدم برامج التصوير مثل ImageJ لقياس الكثافة وتطبيع قيم كثافة النطاقات ذات الأهمية لنطاقات التحكم.
8. ELISA ل CXCL1 و CXCL5
- عزل البروتين الكلي من عضلات المعدة كما هو موضحسابقا 12.
- قم بتقييم درجة الالتهاب بواسطة ELISA ل CXCL1 و CXCL5 كما هو موضح سابقا14 ووفقا لتعليمات الشركة المصنعة.
9. الترسيب المناعي متبوعا بالتحليل الغربي
- إخضاع الفئران لبروتوكول نقص التروية / إعادة التروية (القسم 3).
- احصد الأنسجة (القسم 4) وعزل البروتين كما هو موضح سابقا12. حدد تركيز البروتين بواسطة اختبار برادفورد13.
- لتركيز جزء البلاعم من محللة البروتين الكلي ، قم بإجراء ترسيب مناعي ل CD14 كما هو موضح سابقا15.
- استخدم الراسب المناعي CD14 لإجراء الرحلان الكهربائي ولطخة CD206 و CD68 كما هو موضح سابقا12.
- قم بإجراء لطخة غربية على محللات المعدة كما هو موضح في القسم 7.
- احتضان الرواسب المناعية بين عشية وضحاها باستخدام الأجسام المضادة الأولية متعددة النسيلة ل CD206 أو CD68. تمييع الأجسام المضادة 1: 200 في TBS.
- استخدم الحمار المترافق HRP المضاد للفأر IgG و HRP-مضاد للماعز IgG (تخفيف 1: 10,000) كأجسام مضادة ثانوية.
- قم بتطبيق كاشف ECL على اللطخة بعد خلط المكونات بناء على بروتوكول الشركة المصنعة واحتضانه لمدة 3 دقائق لتصور نطاقات الاهتمام. صور اللطخة باستخدام نظام التصوير.
10. التحليل الإحصائي
- إجراء تحليل إحصائي للبيانات داخل المجموعات وفيما بينها مع تحليل التباين (ANOVA) للمقاييس المتكررة متبوعا بتعديل Bonferroni لاختبار Student's t ، ص ≤ 0.05.
- عبر عن البيانات كمتوسط ± الخطأ المعياري للمتوسط (SEM) أو متوسط ± الانحراف المعياري (SD).
النتائج
أكدت قياسات التدفق نقص التروية وإعادة التروية
يتم تصوير وضع ضوء NIR والبروتوكول التجريبي في الشكل 1. تم تطوير نموذج نقص تروية الأطراف الخلفية للفئران واستخدامه لتقييم تأثير التعرض للأشعة تحت الحمراء على الأشعة تحت الحمراء على العضلات الهيكلية IRI. كما كان متوقعا ، تحقق تصوير تدفق دوبلر بالليزر (الشكل 2 أ) من أن العاصبة كانت فعالة في إحداث نقص التروية جنبا إلى جنب مع عودة تدفق الدم إلى خط الأساس القريب لكل من الأطراف الخلفية المعالجة بالأشعة تحت الحمراء (ن = 6) وغير المعالجة بالضوء (ن = 6). أظهر التصوير الحراري (الشكل 2 أ) أيضا أنه لم يكن هناك تسخين للأطراف من مصفوفات LED ، مما يشير إلى أن التأثيرات الملحوظة تعزى إلى ضوء NIR وليس التسخين الحراري.
يقلل علاج الأشعة تحت الحمراء القديرية من احتشاء عضلات الفخذ
أظهر التحديد النسيجي الإجمالي لأنسجة العضلات الهيكلية مع تلطيخ TTC (الشكل 3 أ) انخفاضا كبيرا بمقدار 1.5 ضعفا (ص < 0.05) في كمية الأنسجة الميتة في عضلات الفخذ المعالجة بالضوء بالأشعة تحت الحمراء (ن = 3) بعد IRI مقارنة بعضلات الفخذ غير المعرضة للأشعة تحت الحمراء (ن = 3 ، الشكل 3 ب).
يقلل تطبيق الأشعة تحت الحمراء من التعبير عن الكلورتيروزين في المعدة
تم إجراء تحليل اللطخة الغربية للمقاربات 3-كلوروتيروزين (الشكل 4) كعلامة بديلة لوجود عدلات المرحلة الحادة. أظهر انخفاضا معنويا بمقدار 2.9 ضعفا (ص < 0.05) في التعبير عن المقربة الكلورتيروزين في المعدة المعالجة بالضوء بعد IRI مقارنة بالمعدة غير المعرضة للأشعة تحت الحمراء (NIR).
يقلل تطبيق NIR من التعبير عن CXCL1 و CXCL5 في المعدة
تم استخدام ELISA لتحديد مستويات التعبير عن الكيموكينات المسببة للالتهابات CXCL1 (الشكل 5 أ) و CXCL5 (الشكل 5 ب). قلل علاج الأشعة تحت الحمراء من التعبير عن CXCL1 و CXCL5 بشكل ملحوظ بعد 15 دقيقة من إعادة التروية. تم تقليل مستوى التعبير عن CXCL5 فقط بشكل ملحوظ بعد 30 دقيقة من إعادة التروية.
آثار علاج الأشعة تحت الحمراء على النمط الظاهري للبلاعم في المعدة
تم إجراء الترسيب المناعي لعلامة البلاعم CD14 متبوعا بتحليل اللطخة الغربية لعلامة M1 CD68 و M2 علامة CD206 لفهم مساهمة البلاعم M1 و M2 في انتشار الالتهاب. تظهر هذه البيانات أن علاج الأشعة تحت الحمراء قلل من مستوى التعبير عن علامة البلاعم M1 الالتهابية (نقص تروية + NIR 5752 ± 154 ، نقص تروية - NIR 6464 ± 213 ، التحكم 6524 ± 202) (الشكل 6 أ) وزاد من مستوى التعبير عن علامة البلاعم الواقية M2 (الشكل 6 ب) التي تم تطبيعها إلى مستوى التعبير عن علامة البلاعم الكلية (نقص التروية + NIR 7378.68 ± 425 ، نقص التروية - NIR 5853.67 ± 215 ، التحكم 5542.53 ± 220).

الشكل 1: البروتوكول التجريبي وموضع مصدر ضوء الألياف البصرية. الاختصارات: LDI = تصوير دوبلر بالليزر. NIR = الأشعة تحت الحمراء القريبة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
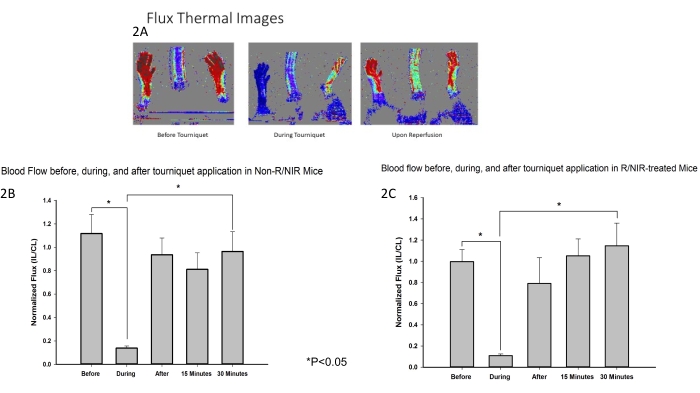
الشكل 2: أكدت قياسات LDI أن العاصبة كانت فعالة في إحداث نقص التروية. (أ) تظهر الصور الحرارية للتدفق انقطاع تدفق الدم واستعادة تدفق الدم عند إعادة التروية. يظهر تحليل صور التدفق انقطاع تدفق الدم أثناء نقص التروية واستعادة تدفق الدم عند إعادة التروية في الفئران المعالجة ب R / NIR (C) في السيطرة. الاختصارات: LDI = تصوير دوبلر بالليزر. R = إعادة التروية. NIR = ضوء الأشعة تحت الحمراء القريبة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
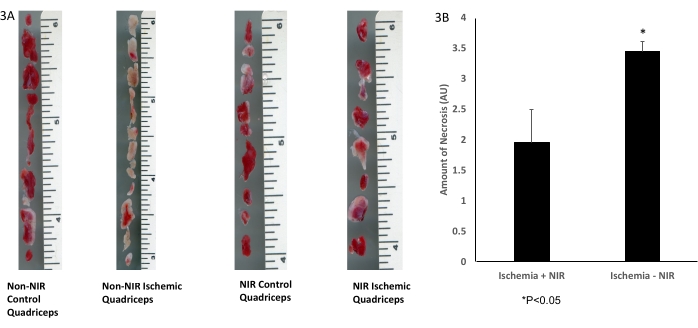
الشكل 3: تلطيخ TTC لأنسجة العضلات والهيكل العظمي. (أ) تلطيخ TTC؛ (ب) يظهر التحليل انخفاضا كبيرا في أنسجة العضلات والهيكل العظمي الاحتشية. يصور شريط المقياس (بوصة) حجم عضلة الفخذ. *ص ≤ 0.05. الاختصارات: NIR = الأشعة تحت الحمراء القريبة. TTC = 2،3،5-كلوريد ثلاثي فينيلترازوليوم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: 3-مستويات تعبير الكلوروتيروزين في العضلات الهيكلية بعد تشعيع الأشعة تحت الحمراء النيتروجين. يظهر تحليل اللطخة الغربية انخفاضا كبيرا في مستويات التعبير عن 3-كلوروتيروزين في العضلات الهيكلية بعد تشعيع الأشعة تحت الحمراء النيتروجينية. *ص ≤ 0.05. الاختصارات: NIR = الأشعة تحت الحمراء القريبة. IL = طرف إقفاري. CL = الطرف المقابل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
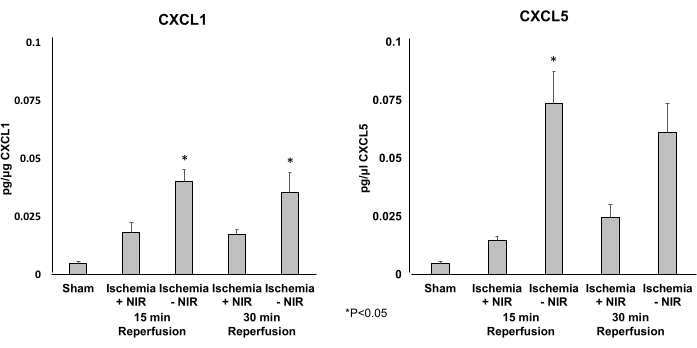
الشكل 5: مستويات التعبير عن CXCL1 و CXCL5 التي تحددها ELISA. (أ) تنخفض مستويات تعبير CXCL1 بشكل ملحوظ عند 15 دقيقة من إعادة التروية في مجموعة الأشعة تحت الحمراء القمراء. تضاءل هذا التأثير الكبير بعد 30 دقيقة عند مقارنته بالتحكم بدون الأشعة تحت الحمراء النيبالية. (ب) تنخفض مستويات تعبير CXCL5 بشكل ملحوظ عند 15 و 30 دقيقة من إعادة التروية في مجموعة الضوء مقارنة بالمجموعة الخالية من الضوء. *ص ≤ 0.05. الاختصارات: NIR = الأشعة تحت الحمراء القريبة. ELISA = مقايسة الممتز المناعي المرتبط بالإنزيم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: مستويات التعبير عن M1 و M2 تطبيعها إلى علامة البلاعم الكلية CD14 التي تحددها الترسيب المناعي متبوعا بتحليل اللطخة الغربية. (أ) مستوى التعبير عن علامة البلاعم M1 CD68 الذي تم تطويته إلى تعبير علامة البلاعم CD14. قلل العلاج بالضوء من مستوى التعبير عن علامة M1 المسببة للالتهابات CD68 بشكل ملحوظ عند مقارنته بالعلاج والتحكم بدون ضوء. (ب) مستوى التعبير عن علامة البلاعم الواقية M2 CD206 التي تم تطبيعها إلى تعبير علامة البلاعم CD14. زادت المعالجة بالضوء من التعبير عن CD206 بشكل ملحوظ مقارنة بالعلاج والتحكم بدون ضوء. *ص ≤ 0.05. اختصار: NIR = الأشعة تحت الحمراء القريبة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تصف هذه الورقة واحدة من أولى الدراسات التي ركزت على الحد من إصابة إعادة التروية عن طريق العلاج بضوء الأشعة تحت الحمراء عن طريق تغيير الاستجابة الالتهابية في الطرف الخلفي. إصابة نقص التروية والعلاج بضوء الأشعة تحت الحمراء ليست جديدة تماما. ركزت دراسات أخرى على إعادة تروية نقص التروية بواسطة ضوء الأشعة تحت الحمراء العدولى. تم استخدام العلاج بضوء الأشعة تحت الحمراء بنجاح في تقليل حجم انشقاق عضلة القلب وتقليل تلف الكلى بعد إصابة نقص التروية. Quirk et al. أبلغ عن انخفاض في حجم احتشاء عضلة القلب وتقليل إعادة تروية نقص التروية بعد تطبيق NIR16،17،18.
يعد وضع العاصبة ذا أهمية كبيرة لوقف النزيف بعد الإصابة أو إنشاء منطقة خالية من الدم في بيئة سريرية أثناء الجراحة وفي حالات الطوارئ ، بما في ذلك ساحة المعركة19. يثير نقص التروية لفترات طويلة متبوعا بإعادة التروية القلق من إصابة إعادة التروية.
تظهر هذه البيانات أن العلاج بالضوء في شكل تطبيق ضوء LED 670 نانومتر يقلل من إصابة إعادة التروية عن طريق تقليل الاستجابة الالتهابية وتغيير البلاعم من النمط الظاهري الالتهابي إلى النمط الظاهري المضاد للالتهابات بعد وضع العاصبة. يرتفع التعبير عن العلامة الالتهابية ، الكلوروتيروزين ، بعد إعادة تروية نقص التروية ، مما يسلط الضوء على الإصابة (الشكل 3). الكلوروتيروزين هو منتج نهائي للأكسدة لنشاط MPO. أبلغ Yu et al. عن زيادة في تعبير الكلوروتيروزين كعلامة على الالتهاب في نموذج إعادة تروية نقص التروية لسكتة دماغيةالفئران 20.
علاوة على ذلك ، سوزا وآخرون وصف تغيير النمط الظاهري للبلاعم بعد 24 ساعة من التعديل الحيوي الضوئي باستخدام خط خلية البلاعم J774 ، وخلصوا إلى أن علاج الأشعة تحت الحمراء ينظم المراحل الالتهابية ويحسن إصلاح الأنسجة6،21. بالإضافة إلى تجنيد البلاعم والعديد من الخلايا المناعية الأخرى ، فإن CXCL1 و CXCL5 لهما تأثيرات جاذبة كيميائية كبيرة على العدلات ، والتي هي المسؤولة بشكل مباشر عن النظم الداخلية الداخلية. لم يتم تضمين MCP-1 في هذا التحليل لأنه جاذب كيميائي أحادي / ضامة بشكل صارم. يتم إنتاج CXCL1 و CXCL5 بواسطة خلايا مختلفة ، بما في ذلك الضامة والعدلات والخلايا الظهارية4،22
حدود هذه الدراسة هي عمق اختراق ضوء NIR. يصف Hu et al. تغلغل 5 سم في معظم الأنسجة باستخدام الجثث ومقارنة المناطق المختلفة23. كان نهج هذه الورقة هو تحديد استقطاب البلاعم M1 و M2 بناء على تركيز جميع البلاعم عن طريق الترسيب المناعي متبوعا بتحليل اللطخة الغربية لتحديد التغيرات في مساهمة M1 و M2 في الالتهاب بعد علاج NIR. لم يتم إجراء التألق المناعي ، وقياس التدفق الخلوي ، ولوحة كاملة من علامات استقطاب البلاعم. تظهر هذه النتائج أن الالتهاب في بيئة إعادة التروية / الإصابة قد تم إنقاطه عن طريق العلاج بضوء الأشعة تحت الحمراء وتشير إلى تطبيق سريري محتمل. أهم الخطوات في هذا البروتوكول هي تأكيد الانسداد وتطبيق ضوء الأشعة تحت الحمراء مرة واحدة في الساعة لمدة 5 دقائق طوال مدة نقص التروية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
نشكر قسم جراحة العظام على تمويل هذه الدراسة. كما نشكر بريان ليندمر وغرانت بروكل على دعمهما الفني.
Materials
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium | Sigma Aldrich | 17779-10X10ML-F | 1% solution |
| 4–15% Criterio TGX Stain-Free Protein Gel | BioRad | #5678084 | Tris-glycine extended gels |
| 4x Laemmli Sample Buffer - 1610747 | BioRad | 16110747 | |
| 670 nm light source | NIR Technologies | custom made | |
| BCA Protein Assay Kit | Thermo Fisher | 23227 | |
| BioRad ChemiDoc | Bio-Rad | Imaging system | |
| Bio-Rad | |||
| β-mercaptoethanol | BioRad | 1610710 | |
| CXCL1 ELISA | R&D Systems | DY453-05 | |
| CXCL5 ELISA | R&D Systems | DX000 | |
| Forane | Baxter | 1001936040 | isoflurane inhalant |
| goat anti-rabbit IgG-HRP | Santa Cruz Biotechnologies | sc-2004 | 1:10,000 dilution |
| Ice Accu ice pack | |||
| Laser doppler Imager | Moor | MOORLDI2-HIR | |
| monoclonal CD14 antibody | Santa Cruz Biotechnologies | sc-515785 | 1:200 dilution |
| monoclonal CD206 antibody | Santa Cruz Biotechnologies | sc-58986 | 1:200 dilution |
| monoclonal CD68 antibody | Santa Cruz Biotechnologies | sc-20060 | 1:200 dilution |
| Pierce Protein free (TBS) blocking buffer | blocking buffer | ||
| polyclonal Chlorotyrosine Antibody | Hycult | HP5002 | 1:1,000 dilution |
| Protein A/G PLUS-Agarose | Santa Cruz Biotechnologies | sc-2003 | |
| Super Signal West Femto | ThermoFisher | 34095 | enhanced chemiluminescence reagent |
References
- Drysch, M., et al. An optimized low-pressure tourniquet murine hind limb ischemia reperfusion model: Inducing acute ischemia reperfusion injury in C57BL/6 wild type mice. PLoS One. 14 (1), 0210961(2019).
- Bonheur, J. A., Albadawi, H., Patton, G. M., Watkins, M. T. A noninvasive murine model of hind limb ischemia-reperfusion injury. Journal of Surgical Research. 116 (1), 55-63 (2004).
- Whiteman, M., Spencer, J. P. Loss of 3-chlorotyrosine by inflammatory oxidants: implications for the use of 3-chlorotyrosine as a bio-marker in vivo. Biochemical and Biophysical Research Communications. 371 (1), 50-53 (2008).
- Becker, S., Quay, J., Koren, H. S., Haskill, J. S. Constitutive and stimulated MCP-1, GRO alpha, beta, and gamma expression in human airway epithelium and bronchoalveolar macrophages. American Journal of Physiology. 266 (3), 278-286 (1994).
- Zaidi, M., et al. Transient repetitive exposure to low level light therapy enhances collateral blood vessel growth in the ischemic hindlimb of the tight skin mouse. Photochemistry and Photobiology. 89 (3), 709-713 (2013).
- Souza, N. H. C., et al. Photobiomodulation and different macrophages phenotypes during muscle tissue repair. Journal of Cellular and Molecular Medicine. 22 (10), 4922-4934 (2018).
- Tang, G. L., Kim, K. J. Laser doppler perfusion imaging in the mouse hindlimb. Journal of Visualized Experiments: JoVE. (170), e62012(2021).
- Ionescu, A., Zahavi, E. E., Gradus, T., Ben-Yaakov, K., Perlson, E. Compartmental microfluidic system for studying muscle-neuron communication and neuromuscular junction maintenance. European Journal of Cell Biology. 95 (2), 69-88 (2016).
- Adamovich, Y., Ezagouri, S., Dandavate, V., Asher, G. Monitoring daytime differences in moderate intensity exercise capacity using treadmill test and muscle dissection. STAR Protocols. 2 (1), 100331(2021).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protocol. 7 (10), 2279(2017).
- Keszler, A., Lindemer, B., Hogg, N., Weihrauch, D., Lohr, N. L. Wavelength-dependence of vasodilation and NO release from S-nitrosothiols and dinitrosyl iron complexes by far red/near infrared light. Archives of Biochemistry and Biophysics. 649, 47-52 (2018).
- Weihrauch, D., et al. Vasodilation of isolated vessels and the isolation of the extracellular matrix of tight-skin mice. Journal of Visualized Experiments: JoVE. (121), e55036(2017).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Li, Z., Jiang, J., Gao, S. Potential of C-X-C motif chemokine ligand 1/8/10/12 as diagnostic and prognostic biomarkers in idiopathic pulmonary arterial hypertension. Clinical Respiratory Journal. , (2021).
- Weihrauch, D., et al. Intralipid increases nitric oxide release from human endothelial cells during oxidative stress. JPEN. Journal of Parenteral and Enteral Nutrition. 45 (2), 295-302 (2021).
- Liebert, A., Krause, A., Goonetilleke, N., Bicknell, B., Kiat, H. A role for photobiomodulation in the prevention of myocardial ischemic reperfusion injury: A systematic review and potential molecular mechanisms. Scientific Reports. 7, 42386(2017).
- Asghari, A., Takhtfooladi, M. A., Hoseinzadeh, H. A. Effect of photobiomodulation on ischemia/reperfusion-induced renal damage in diabetic rats. Lasers in Medical Science. 31 (9), 1943-1948 (2016).
- Quirk, B. J., Sonowal, P., Jazayeri, M. A., Baker, J. E., Whelan, H. T. Cardioprotection from ischemia-reperfusion injury by near-infrared light in rats. Photomedicine and Laser Surgery. 32 (9), 505-511 (2014).
- Smith, E. R., Shapiro, G. L. Totally tourniquets. The facts & details about different types of tourniquets. JEMS: A Journal of Emergency Medical Services. 38 (11), 48-50 (2013).
- Yu, G., et al. Inhibition of myeloperoxidase oxidant production by N-acetyl lysyltyrosylcysteine amide reduces brain damage in a murine model of stroke. Journal of Neuroinflammation. 13 (1), 119(2016).
- de Brito Sousa, K., et al. Differential expression of inflammatory and anti-inflammatory mediators by M1 and M2 macrophages after photobiomodulation with red or infrared lasers. Lasers in Medical Science. 35 (2), 337-343 (2020).
- Iida, N., Grotendorst, G. R. Cloning and sequencing of a new gro transcript from activated human monocytes: expression in leukocytes and wound tissue. Molecular and Cellular Biology. 10 (10), 5596-5599 (1990).
- Jani, S., Bergmann, S. R. Metabolic modulation of myocardial ischemia. Current Cardiology Reports. 8 (2), 123-130 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved