Method Article
Стимуляция ниш стволовых клеток и регенерация тканей в коже мышей с помощью переключаемой протопорфирина IX-зависимой фотогенерации активных форм кислорода in situ
В этой статье
Резюме
Целью этого протокола является индуцирование транзиторной in vivo продукции нелетальных уровней активных форм кислорода (АФК) в коже мышей, что способствует дальнейшему развитию физиологических реакций в тканях.
Аннотация
В данной статье мы опишем протокол индуцирования переключаемой фотогенерации in vivo эндогенных активных форм кислорода (АФК) в коже мышей. Эта транзиторная продукция АФК in situ эффективно активирует пролиферацию клеток в нишах стволовых клеток и стимулирует регенерацию тканей, что сильно проявляется через ускорение процессов заживления ожогов и роста волосяных фолликулов. Протокол основан на регулируемом фотодинамическом лечении, которое обрабатывает ткань предшественниками эндогенного фотосенсибилизатора протопорфирина IX и далее облучает ткань красным светом при строго контролируемых физико-химических параметрах. В целом, этот протокол представляет собой интересный экспериментальный инструмент для анализа биологии АФК.
Введение
Активные формы кислорода (АФК) являются результатом химического восстановления молекулярного кислорода с образованием воды и включают синглетный кислород, супероксид-анион, перекись водорода и гидроксильный радикал 1,2,3. АФК имеют очень короткий срок службы из-за их чрезвычайно химически активной природы. У аэробных организмов АФК случайно образуются внутри клеток как основной побочный продукт аэробного дыхания (цепь переноса электронов) в митохондриях. Временное накопление высоких уровней АФК в клетке приводит к окислительному стрессу, который может спровоцировать необратимую инактивацию белков, липидов и сахаров и введение мутаций в молекулу ДНК 2,3,4,5. Постепенное накопление окислительных повреждений в клетках, тканях и целых организмах неуклонно возрастает с течением времени и связано с индукцией программ клеточной гибели, некоторыми патологиями и процессом старения 2,3,4,6.
Аэробные организмы неуклонно развивают эффективные молекулярные механизмы для борьбы с избыточным накоплением АФК в клетках и тканях. Эти механизмы включают членов семейства белков супероксиддисмутазы (СОД), которые катализируют радикальную дисмутацию супероксида в молекулярный кислород и перекись водорода, а также различные каталазы и пероксидазы, которые используют антиоксидантный пул (глутатион, НАДФН, пероксиредоксин, тиоредоксин 7,8) для катализа последующего превращения перекиси водорода в воду и молекулярный кислород.
Тем не менее, в нескольких отчетах подтверждается роль АФК в качестве ключевых компонентов молекулярных цепей, регулирующих важнейшие функции клеток, включая пролиферацию, дифференцировку и подвижность 2,3,4. Эта концепция также подтверждается первоначальной идентификацией и характеристикой специализированных механизмов, продуцирующих АФК в аэробных организмах, включая липоксигеназы, циклооксигеназы и НАДФН-оксидазы 9,10. В этом смысле АФК играют активную роль в развитии эмбрионов позвоночных 11,12,13, и ключевые роли этих молекул в регуляции специфических физиологических функций in vivo были описаны в различных экспериментальных системах, включая программу дифференцировки гемопоэтических предшественников у дрозофилы14, индукцию заживления у рыбок данио или регенерацию хвоста у головастиков Xenopus 15. У млекопитающих АФК участвуют в потенциале самообновления/дифференцировки нейральных стволовых клеток в нейросферной модели16 и в дерегуляции функции кишечных стволовых клеток во время инициации колоректального рака17. В коже передача сигналов АФК связана с эпидермальной дифференцировкой и регуляцией ниши стволовых клеток кожи и циклом роста волосяных фолликулов18,19.
С этой точки зрения, основным экспериментальным ограничением для определения физиологической роли АФК в биологических системах, как в нормальных, так и в патологических условиях, является отсутствие адекватных экспериментальных инструментов для индуцирования контролируемой продукции этих молекул в клетках и тканях, точно напоминающих их физиологическую продукцию в качестве вторичных сигнальных мессенджеров. В настоящее время большинство экспериментальных подходов предполагают введение экзогенных АФК, в основном в виде перекиси водорода. Недавно мы реализовали экспериментальный подход к включению транзиторной, нелетальной in vivo продукции эндогенных АФК в коже мышей, основанный на введении предшественников эндогенного фотосенсибилизатора протопорфирина IX (PpIX; например, аминолаэвулиновой кислоты или ее метилпроизводного метиламинолевулината) и последующем облучении образца красным светом для индуцирования in situ образования АФК из внутриклеточного молекулярного кислорода (рис. 1). Эта фотодинамическая процедура может быть эффективно использована для стимуляции резидентных ниш стволовых клеток, тем самым активируя регенеративные программы тканей19,20 и открывая путь для новых терапевтических методов в регенеративной медицине кожи. Здесь мы представляем подробное описание протокола, показывающее репрезентативные примеры стимуляции ниш стволовых клеток, измеряемой как увеличение количества долговременных клеток, удерживающих метку 5-бром-2'-дезоксиуридина (BrdU) в области выпуклости волосяного фолликула19,21, и последующей активации программ регенерации (ускорение роста волос и процессов заживления ожогов), индуцированных транзиторными, нелетальная продукция АФК в коже мышей линии C57Bl6.
протокол
Все процедуры по разведению мышей и экспериментам должны проводиться в соответствии с местным, национальным, международным законодательством и рекомендациями по экспериментам на животных.
1. Индукция роста волос, индукция ожога и идентификация долгосрочных BrdU LRC в эпителии кожи хвоста в целом
ПРИМЕЧАНИЕ: Используйте 10-дневных или 7-недельных мышей C57BL/6, предпочтительно однопометников, для экспериментального дизайна, описанного ниже. Во всех экспериментальных процедурах животные обезболиваются ингаляцией 3% изофлурана или эвтаназией при вывихе шейки матки, как показано.
- Индукция роста волос на задней коже мышей во второй фазе телогена (покоя) (около 50-го дня после рождения)
- Обезболивайте мышей ингаляцией 3% изофлурана. Подтвердить полную глубокую анестезию отсутствием педального рефлекса (сильное защемление пальца ноги). Побрейте два независимых участка кожи спины бок о бок у каждой мыши, используя машинку для стрижки волос и крем для депиляции (Таблица материалов). Используйте левую сторону для контроля и правую сторону для лечения.
ПРИМЕЧАНИЕ: Убедитесь, что после бритья кожа спины розоватая, а не серо-черная, что является показателем меланогенеза и вступления в фазу анагена (роста) у этой линии мышей. - Тщательно промойте PBS, чтобы удалить все остатки крема, и приступайте к индукции переходного in situ производства нелетальных уровней АФК, как описано в разделе 2.1.
- Регистрируйте рост волосяных фолликулов путем ежедневного получения изображений с высоким разрешением контрольных и обработанных участков кожи спины у каждого животного (например, с помощью HD-камеры, соединенной с 5−20-кратным бинокулярным объективом).
- Обезболивайте мышей ингаляцией 3% изофлурана. Подтвердить полную глубокую анестезию отсутствием педального рефлекса (сильное защемление пальца ноги). Побрейте два независимых участка кожи спины бок о бок у каждой мыши, используя машинку для стрижки волос и крем для депиляции (Таблица материалов). Используйте левую сторону для контроля и правую сторону для лечения.
- Индукция ожоговых поражений2-й степени на коже спины мышей во второй фазе телогена (покоя) (около 50-го дня после рождения)
- Обезболивайте мышей. Побрейте всю область кожи спины у каждой мыши с помощью машинки для стрижки волос и крема для депиляции и тщательно вымойте PBS, чтобы удалить все остатки крема.
ПРИМЕЧАНИЕ: Вводите in situ подкожные инъекции лидокаина 0,5% (2 мг/мл) в стерильном физиологическом растворе, не более 7 мг/мл, непосредственно перед процедурой сжигания. - Латунный брусок (1 см в сечении) разогреть до 95 °C, погрузив в кипящую воду, а затем нанести на центральную область дорсальной поверхности задней поверхности кожи каждой мыши на 5 с.
- Сразу после образования ожога животным внутрибрюшинно вводят 1 мл физиологического раствора (0,9% NaCl) на электрическое одеяло, чтобы предотвратить обезвоживание. Дайте животным восстановиться в течение 24 ч и приступайте к индукции переходного in situ производства нелетальных уровней АФК, как описано в разделе 2.3.
- Регистрируйте прогрессирование ожоговой раны путем ежедневного получения изображений с высоким разрешением контрольных и обработанных участков кожи спины у каждого животного (например, с помощью HD-камеры, соединенной с 5−20-кратным бинокулярным объективом).
- Обезболивайте мышей. Побрейте всю область кожи спины у каждой мыши с помощью машинки для стрижки волос и крема для депиляции и тщательно вымойте PBS, чтобы удалить все остатки крема.
- Генерация и идентификация долгосрочных BrdU LRC в эпителии кожи хвоста
- Вводить 10/14-дневным однопометникам внутрибрюшинно (без анестезии) один раз в день в течение 4 дней подряд 50 мг/кг массы тела BrdU, растворенного в PBS. После фазы мечения дайте мышам порасти в течение 50−60 дней перед любым лечением.
ПРИМЕЧАНИЕ: Используйте свежую иглу для каждой инъекции. - Действуйте, как описано в разделе 2.3, для индукции переходного in situ нелетального образования АФК в коже хвоста в разное время перед препарированием тканей целиком.
- Чтобы препарировать целые эпидермисы хвоста, усыпьте мышей при вывихе шейки матки и обрежьте хвосты хирургическими ножницами.
- С помощью скальпеля сделайте прямой продольный надрез вдоль всего хвоста и снимите всю кожу как единый кусок с позвоночника. Инкубируют очищенную кожу в 5 мМ ЭДТА в ПБС в пробирках по 5 мл в течение 4 ч при 37 °С и осторожно отделяют неповрежденные листы эпидермиса от дермы с помощью щипцов.
- Зафиксируйте ткань в 4% формальдегиде в PBS в течение не менее 72 ч при комнатной температуре (RT) и приступайте к выявлению BrdU с использованием соответствующих антител.
- Используйте флуоресцентную/конфокальную микроскопию для идентификации и количественной оценки LRC в каждом экспериментальном состоянии, включая контроль света и фотодинамическую обработку в разное время перед подготовкой целых тканей, как подробно описано ранее19,20.
ПРИМЕЧАНИЕ: Фиксированные эпидермальные листы можно хранить в PBS, содержащем 0,02% азида натрия, при 4 °C до трех месяцев. Фиксированные эпидермальные листы могут быть использованы для иммунолокализации необходимых белков после стандартных процедур гистологических срезов.
- Вводить 10/14-дневным однопометникам внутрибрюшинно (без анестезии) один раз в день в течение 4 дней подряд 50 мг/кг массы тела BrdU, растворенного в PBS. После фазы мечения дайте мышам порасти в течение 50−60 дней перед любым лечением.
2. Индукция транзиторной продукции нелетальных уровней АФК в коже мышей
ПРИМЕЧАНИЕ: Для индуцирования транзиторной продукции нелетальных уровней АФК в коже мышей будет использоваться фотодинамическая обработка с использованием предшественника эндогенного фотосенсибилизатора PpIX, в данном случае метил-аминолевулината (mALA), и красного света.
- Чтобы включить переходную продукцию АФК для индукции роста волос на коже спины, подготовьте животных, как указано в разделе 1.1.
- Нанесите ~25 мг мАЛК в форме крема для местного применения (Таблица материалов) на правую область, сохраняя левую сторону в качестве внутреннего контроля, избегая межиндивидуальных различий. Выдерживают 2,5 ч в темноте, излишки крема тщательно смывают ПБС. Чтобы подтвердить глубину анестезии, наблюдайте за животными каждые 10 минут до полного выздоровления.
ПРИМЕЧАНИЕ: Выработка PpIX в коже спины должна быть проверена in situ путем его красной флуоресценции при возбуждении синим светом (407 нм). - Обезболивайте животных.
- Облучают всю кожу спины адекватным источником красного света (Таблица материалов) в суммарной дозе 2,5−4 Дж/см2. Держите мышей на электрическом одеяле до их полного выздоровления и действуйте, как описано в шаге 1.1.3.
ПРИМЕЧАНИЕ: Интенсивность излучения должна регулироваться путем манипулирования расстоянием между источником света и тканью и измеряться с помощью измерителя энергии мощности (Таблица материалов). Эксперимент считается законченным, когда наблюдается полный рост шерсти в любом из независимых выбритых участков каждого животного. Вся процедура включает в себя всего одну фотообработку.
- Нанесите ~25 мг мАЛК в форме крема для местного применения (Таблица материалов) на правую область, сохраняя левую сторону в качестве внутреннего контроля, избегая межиндивидуальных различий. Выдерживают 2,5 ч в темноте, излишки крема тщательно смывают ПБС. Чтобы подтвердить глубину анестезии, наблюдайте за животными каждые 10 минут до полного выздоровления.
- Для включения транзиторной продукции АФК для заживления ожоговых повреждений2-й степени подготавливают животных, как указано в разделе 1.2.
- Нанесите ~25 мг мАЛК в виде крема для местного применения по всей обожженной поверхности, охватывая около 4 мм прилегающих тканей. Выдерживают 2,5 ч в темноте, излишки крема тщательно смывают ПБС. Чтобы подтвердить глубину анестезии, наблюдайте за животными каждые 10 минут до полного выздоровления.
- Обезболивайте животных.
- Облучают всю кожу спины адекватным источником красного света в общей дозе 2,5−4 Дж/см2. Держите мышей на электрическом одеяле до их полного выздоровления и действуйте, как описано в шаге 1.2.4.
ПРИМЕЧАНИЕ: Экспериментальная процедура для каждого животного считается завершенной, когда наблюдается полное заживление ожогов. Вся процедура включает в себя всего одну фотообработку.
- Чтобы включить транзиторную выработку АФК в коже хвоста, подготовьте мышей, как указано в разделе 1.3, нанесите ~25 мг мАЛК в виде крема для местного применения по всей области спинной ткани и действуйте, как описано в разделе 2.1 для кожи спины. За 24 ч, 48 ч или 72 ч до эвтаназии животного и дальнейшего извлечения кожи хвоста целиком проводить фотообработку и соответствующий контроль света.
ПРИМЕЧАНИЕ: Во всех экспериментальных проектах анализируйте АФК-зависимость процесса с помощью антиоксидантных поглотителей АФК (например, ежедневный посев 100 мг/кг массы тела N-ацетил-цистеина путем внутрибрюшинного введения раствора 20 мг/мл в PBS, pH 7,2, начиная за 5 дней до лечения мАЛК или, в качестве альтернативы, две дозы 100 мг/мл аскорбиновой кислоты в 50% этаноле, с интервалом в 30 мин, местно наносится на кожу в промежутке времени между процедурами мАЛК и облучением красным светом.
3. Обнаружение АФК в коже
- Оценка ex vivo продукции АФК в коже хвоста после фотодинамической обработки гидроэтидином
ПРИМЕЧАНИЕ: Гидроэтидин представляет собой нефлуоресцентную молекулу, которая реагирует специфически с АФК с образованием флуоресцентного красителя 2-гидрокситидия (hET).- Инкубируют целые шкурки хвоста, полученные в соответствии с разделом 1.3.3, в течение 3 ч при 37 °С в 5 мМ ЭДТА в растворе ПБС (контрольные образцы) или дополнительно содержащие 2 мМ мАЛК (образцы фотодинамической обработки).
- Во всех случаях добавляют гидроэтидин до конечной концентрации 3,2 мкМ из запаса 25 мг/мл в диметилсульфоксиде (ДМСО) и инкубируют в течение 1 ч в темноте при RT.
- Натяните образцы кожи хвоста на стеклянную поверхность кончиками пальцев и облучите красным светом 636 нм с флюенсом 10 Дж/см2 .
- Немедленно приступайте к отделению эпидермиса от дермы и фиксации эпидермальных листов, как описано в разделе 1.3.3.
- Оцените красное излучение hET под флуоресцентным/конфокальным микроскопом с использованием зеленого возбуждающего света, сделайте высококачественные изображения и приступайте к дальнейшему анализу.
ПРИМЕЧАНИЕ: Используйте hET-окрашивание образцов тканей при отсутствии фотодинамической обработки в качестве отрицательного контроля для hET-автоокисления.
- Выявление in vivo продукции АФК в коже спины после стимуляции роста волос и заживления ожогов с последующим фотодинамическим лечением
ПРИМЕЧАНИЕ: Этот этап выполняется с использованием диацетата 2′,7′-дихлордигидрофлуоресцеина (DHF-DA), клеточного нефлуоресцентного соединения, которое после расщепления внутриклеточными ферментами эстеразы специфически реагирует с АФК с образованием флуоресцентного красителя 2′,7′-дихлорфлуоресцеина (DCF).- Используйте животных, подготовленных для индукции роста волос (раздел 1.1) или заживления ожогов (раздел 1.2). Непосредственно перед процедурой местного применения крема с мАЛК (см. разделы 2.1 и 2.2) местно распределите 100 мкл 1 мг/мл 50% этанола DHF-DA на все целевые контрольные/обработанные участки кожи, дайте коже полностью впитать материал и приступайте к местному нанесению крема с мАЛК.
- Инкубируйте обработанных животных в течение 4 ч в темноте, тщательно смывайте с кожи крем для местного применения mALA с помощью PBS и наносите на кожу вторую дозу 100 мкл раствора DHF-DA. Чтобы подтвердить глубину анестезии, наблюдайте за животными каждые 10 минут до полного выздоровления.
- Инкубировать обработанных животных в течение 50 мин в темноте, обезболить и облучать всю кожу спины флюенсом от 2,5 до 4 Дж/см2 красного света 636 нм с помощью светодиодной лампы.
- Сразу после облучения оцените уровни АФК, образующиеся в коже, с помощью системы визуализации in vivo (таблица материалов). Настройте фильтр-бокс на возбуждение 445−490 нм и излучение 515−575 нм, сделайте снимки высокого качества и приступайте к дальнейшему анализу.
ПРИМЕЧАНИЕ: Используйте окрашивание образцов тканей DHF-DA при отсутствии фотодинамической обработки в качестве отрицательного контроля для автоокисления DHF-DA.
Результаты
Местное введение предшественника мАЛК в кожу спины и хвоста мыши приводит к значительному накоплению PpIX во всей ткани и, что заметно, в волосяном фолликуле, о чем свидетельствует красновато-розовая флуоресценция этого соединения при возбуждении синим светом (407 нм) (рис. 2A,C). Последующее облучение обработанной ткани красным светом (636 нм) с флюенсом 2,5−4 Дж/см2 способствует преходящей продукции АФК в ткани, особенно в области выпуклости волосяного фолликула (рис. 2, Б, Г).
Включение нелетальной продукции АФК в коже мышей in vivo способствует значительному увеличению количества ЦУР, классифицируемых как соматические стволовые клетки, в области выпуклости волосяного фолликула через два дня после фотообработки (рис. 3, левые панели). Примечательно, что увеличение числа ЦУР носит временный характер и восстанавливается до нормального уровня через 6 дней после лечения (рис. 3, правая панель). Поскольку эта область является одной из основных ниш стволовых клеток в коже мышей, транзиторная индукция клеточной пролиферации в этой области в основном отражает функциональную активацию выпуклой ниши и резидентных программ пролиферации и дифференцировки стволовых клеток22,23.
АФК-зависимая активация выпуклой ниши волосяного фолликула также связана с физиологическими реакциями кожи. Таким образом, преходящая выработка АФК заметно ускоряет процесс заживления кожи после ожога2-й степени (рис. 4, А, Б). Количественная оценка постепенного уменьшения поврежденного/покрытого струпом участка кожи демонстрирует устойчивость и статистическую значимость процесса ускорения заживления ран, индуцированного PpIX-зависимой транзиторной продукцией АФК в тканях (рис. 4C). Точно так же нелетальные уровни АФК сильно способствуют росту волос после бритья во время второго скоординированного телогена (Рисунок 5А), фазы, во время которой волосяной фолликул рефрактерен к ответу на стимулы роста22,23, что представляет собой адекватный способ оценки потенциала новых соединений и/или процессов для стимуляции роста волос. Примечательно, что использование антиоксидантных соединений, таких как аскорбиновая кислота (АК), приводит к статистически значимому сокращению числа животных, демонстрирующих ускоренный рост шерсти (рисунок 5B). Кроме того, выработка АФК в коже после фотообработки, количественно определяемая флуоресцентным излучением DHF в коже, также значительно снижается за счет антиоксидантных соединений (рис. 5C). Вместе эти результаты показывают, что выработка АФК после фотообработки на основе PpIX строго необходима для того, чтобы вызвать физиологическую реакцию в тканях.

Рисунок 1: Теоретические основы контролируемого включения эндогенного фотодинамического производства АФК in situ в клетках и тканях с использованием гемового биосинтетического пути. (А) Схематическое изображение основных фотохимических реакций, приводящих к возбуждению молекулярного кислорода при фотодинамической обработке. При поглощении света с соответствующим λ молекула фотосенсибилизатора (ФС) в основном состоянииS0 претерпевает переход в возбужденное синглетное состояниеS1. Поскольку любое возбужденное состояние энергетически менее предпочтительно, чем основное состояние, молекула возвращается кS0 через короткий промежуток времени. Большинство ФС обладают высокой квантовой эффективностью при переходе из S1 в триплетное состояниеT1, обычно характеризующееся относительно длительным временем жизни. Активированный ФС в возбужденном триплетном состоянии может вступать в реакцию с другими молекулами по двум различным путям. Фотохимическая реакция I типа представляет собой перенос электронов на соседние молекулы с образованием радикальных частиц; эти радикалы, вероятно, вступают в реакцию с молекулярным кислородом с образованием АФК, включая супероксид-анион (•O2-), перекись водорода (H2O2) и гидроксильный радикал (•OH). Фотохимическая реакция II типа представляет собой доминирующий процесс для большинства ФС, используемых в ФДТ. Во время этой реакции передача энергии (не электронов) молекулярному кислороду (конфигурация которого в основном состоянии представляет собой триплет, 3O 2) приводит к образованию нерадикального, но высокореакционноспособного синглетного кислорода (1O2). Фотопродукты, образующиеся во время этих реакций, запускают каскад биохимических событий, приводящих к окислительному стрессу, который в конечном итоге вызывает гибель клеток или потенциально может стимулировать их рост. (B) 5-аминолевулиновая кислота (АЛК) является естественным предшественником в пути биосинтеза гема, который включает как митохондриальные, так и цитозольные клеточные компартменты. Активность фермента АЛК-синтазы регулируется контролем отрицательной обратной связи, посредством которого свободный гем, конечный продукт этого пути, ингибирует синтез АЛК из глицина и сукцинила КоА. Введение экзогенной АЛК или ее производного метиламинолевулината (мАЛК) обходит регуляторную систему обратной связи, так что последующие метаболиты, особенно протопорфирин IX (PpIX), накапливаются в клетке, индуцируя фотосенсибилизацию. Ограничения скорости феррохелатазы, фермента-катализатора вставки железа в PpIX, способствуют накоплению этого эндогенного соединения PS. ПБГ = порфобилиноген. Эта цифра была изменена из Carrasco et al.19. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 2: Фотодинамическая обработка мАЛК и красным светом индуцирует преходящую продукцию АФК в коже. (А) Накопление эндогенного PpIX после топического лечения мАЛК в коже спины. Левая сторона у того же животного использовалась в качестве контроля. (B) Левая панель: PpIX-зависимое производство АФК (mALA+Light), контролируемое DHF-DA. Правая панель: анализ динамики относительной продукции АФК в коже спины; относительная интегральная плотность флуоресцентного излучения DHF-DA областей mALA+Light versus Light у каждого животного была количественно определена в разное время после облучения и нормализована, как описано в методике. Представлено среднее ± SE (n = 4 для каждого момента времени). (C) Локализация PpIX в коже хвоста (изображения флуоресцентной микроскопии). (D) Выработка АФК в коже хвоста после mALA+Light, выявленная с помощью hET, показывает повышенное и устойчивое накопление в области выпуклости волосяного фолликула. Показаны репрезентативные изображения конфокальной микроскопии (максимальные проекции). Масштабная линейка = 100 мкм. Эта цифра была изменена из Carrasco et al.19. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 3: Включение in situ продукции АФК в коже способствует значительному увеличению количества стволовых клеток в области выпуклости ниши волосяного фолликула. Слева панели: репрезентативные изображения конфокальной микроскопии (максимальные проекции), показывающие локализацию клеток, удерживающих метку BrdU (LRC) в цельных слоях кожи хвоста мыши, и явное увеличение LRC в области выпуклости волосяных фолликулов через 2 дня после фотообработки на основе PpIX. Правая панель: количественная оценка количества LRC в области выпячивания волосяного фолликула. Представлено среднее значение + SE (n = 4). Масштабная линейка = 50 мкм. Эта цифра была изменена из Carrasco et al.19. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 4: Включение in situ выработки АФК в коже ускоряет заживление ожогов. (A) Продукция PpIX, индуцированная мАЛК в областях, пострадавших от ожогов, у обработанных животных по сравнению с контрольными образцами. (B) Эволюция заживления ожогов у животных, обработанных mALA+Light, и контрольных животных. (C) Количественная оценка обожженных участков во времени (левая панель), показывающая ускоренное заживление ожогов у животных, получавших мALA+свет; представлено среднее значение + SE (n = 4) незажившего участка. Анализ площади под кривой (правая панель), демонстрирующий статистические различия между обеими кривыми временного хода (p ≤ 0,06). Эта цифра была изменена из Carrasco et al.19. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
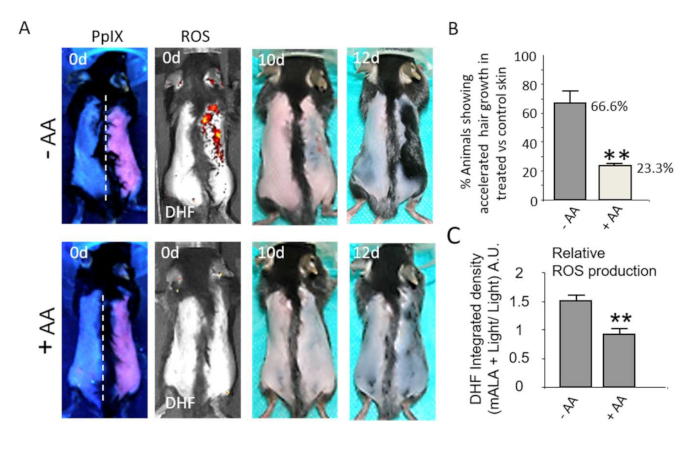
Рисунок 5: Включение in situ выработки АФК в коже стимулирует рост волос. (A) Верхний ряд: Индукция роста волос во время рефрактерной фазы телогена с помощью mALA+Light (правая сторона дорсальной кожи) по сравнению со световой контрольной областью (левая сторона). Нижний ряд: Как выработка АФК в коже, так и ускорение роста волос, вызванное mALA+Light, подавляются антиоксидантной терапией аскорбиновой кислотой (АК). (B) Количественная оценка процента животных, у которых наблюдался ускоренный рост волос в mALA-PT по сравнению с контрольной областью в отсутствие или в присутствии антиоксиданта AA (n = 4 в 3 независимых экспериментах). (C) Количественная оценка ингибирования продукции АФК в дорсальной коже, индуцированного АА во время mALA-PT (n = 4). Во всех случаях столбцы представляют собой среднее значение + SE. Эта цифра была изменена из Carrasco et al.19. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
В данной работе мы представляем методологию, которая позволяет осуществлять транзиторную активацию продукции эндогенных АФК in vivo в коже мышей с физиологическими эффектами. Методика основана на фотодинамической процедуре индуцирования контролируемой и локальной стимуляции эндогенного фотосенсибилизатора PpIX (рис. 1B). Этот экспериментальный подход является интересным инструментом для изучения биологии АФК in vivo экспериментальных систем, представляя собой значительный шаг вперед по сравнению с методологиями, использующими внешние источники АФК (обычно перекись водорода) и позволяющим контролировать и локально производить АФК в ткани/образце.
Учитывая, что предшественники на основе аминолевулината вводятся в избытке, чтобы способствовать накоплению PpIX внутри клеток, критическим шагом в этой методологии является установление адекватной дозы света, чтобы индуцировать транзиторную продукцию уровней АФК в тканях ниже порога повреждения, но демонстрирующих сильный стимулирующий эффект. В настоящее время не существует доступных технологий, позволяющих напрямую количественно определить точное количество любого типа АФК, которое вырабатывается в клетках и тканях. В нашей методологии до сих пор невозможно установить прямую корреляцию между данной дозой света, точным количеством производимых АФК и данным биологическим эффектом (например, гибелью клеток или пролиферацией клеток). По этой причине доза света (флюенс) для любой конкретной экспериментальной модели должна быть установлена исследователем эмпирически, используя качественные или полукачественные параметры выбора для каждой ситуации. В случае с кожей мыши мы выбираем легко измеримый переход между гибелью клеток и повреждением тканей и индукцией значительной и преходящей пролиферативной волны.
Методология, представленная здесь, доказала свою высокую эффективность в улучшении регенерации кожи в различных процессах, включая заживление ожогов и рост волосяных фолликулов. Эти наблюдения прокладывают путь к внедрению терапевтического применения этой технологии в клиниках для лечения случайных или хронических ожогов и ран или различных патологий кожи и, в частности, волосяного фолликула, связанного с дефектным функционированием стволовых клеток.
Раскрытие информации
Все коммерческие применения процедур, описанных в этой работе, защищены патентом CSIC-UAM (EP2932967A1), авторами которого являются EC, MIC и JE, и лицензированы Derma Innovate SL для коммерческого использования. JE и JJM являются консультантами в Derma Innovate SL.
Благодарности
Эта работа была поддержана грантами Министерства экономики и конкуренции (RTC-2014-2626-1 для JE) и Института Салуда Карлоса III (PI15/01458 для JE) Испании. ЕК получила поддержку гранта Atracción de Talento Investigador 2017-T2/BMD-5766 (Comunidad de Madrid и UAM).
Материалы
| Name | Company | Catalog Number | Comments |
| 2′,7′-Dichlorofluorescin diacetate | Sigma Aldrich | D6883-50MG | |
| 5'-bromo-2'-deoxiuridine | Sigma Aldrich | B5002-500MG | |
| Anti-Bromodeoxyuridine-Fluorescein | Roche | 11202693001 | |
| Depilatory cream (e.g., Veet) | Veet | ||
| Dihydroethidium | Sigma Aldrich | 37291-25MG | |
| In Vivo imaging system, e.g., IVIS Lumina 2 | Perkin Elmer | ||
| mALA in the form of topical cream, e.g.,METVIX Crema 160 mg/g | Galderma | ||
| Power energy meter (e.g., ThorLabs Model PM100D) | ThorLabs | ||
| Red light source, e.g., 636 nm Aktilite LED lamp | Photocure ASA |
Ссылки
- Blázquez-Castro, A. Direct 1O2 optical excitation: A tool for redox biology. Redox Biology. 13, 39-59 (2017).
- Valko, M., et al. Free radicals and antioxidants in normal physiological functions and human disease. The International Journal of Biochemistry & Cell Biology. 39 (1), 44-84 (2007).
- Sena, L. A., Chandel, N. S. Physiological Roles of Mitochondrial Reactive Oxygen Species. Molecular Cell. 48 (2), 158-167 (2012).
- Bartosz, G. Reactive oxygen species: Destroyers or messengers. Biochemical Pharmacology. 77 (8), 1303-1315 (2009).
- Brieger, K., Schiavone, S., Miller, J., Krause, K. Reactive oxygen species: from health to disease. Swiss Medical Weekly. 142, 13659(2012).
- Speakman, J. R., Selman, C. The free-radical damage theory: Accumulating evidence against a simple link of oxidative stress to ageing and lifespan. BioEssays. 33 (4), 255-259 (2011).
- Fernandez, V., Videla, L. A. Biochemical aspects of cellular antioxidant systems. Biological Research. 29 (2), 177-182 (1996).
- Matés, J. M., Sánchez-Jiménez, F. Antioxidant enzymes and their implications in pathophysiologic processes. Frontiers in Bioscience. 4, 339-345 (1999).
- Bedard, K., Krause, K. -H. The NOX Family of ROS-Generating NADPH Oxidases: Physiology and Pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Leto, T. L., Morand, S., Hurt, D., Ueyama, T. Targeting and Regulation of Reactive Oxygen Species Generation by Nox Family NADPH Oxidases. Antioxidants & Redox Signaling. 11 (10), 2607-2619 (2009).
- Hernández-García, D., Wood, C. D., Castro-Obregón, S., Covarrubias, L. Reactive oxygen species: A radical role in development. Free Radical Biology and Medicine. 49 (2), 130-143 (2010).
- Covarrubias, L., Hernández-García, D., Schnabel, D., Salas-Vidal, E., Castro-Obregón, S. Function of reactive oxygen species during animal development: Passive or active. Developmental Biology. 320 (1), 1-11 (2008).
- Timme-Laragy, A. R., Hahn, M. E., Hansen, J. M., Rastogi, A., Roy, M. A. Redox stress and signaling during vertebrate embryonic development: Regulation and responses. Seminars in Cell & Developmental Biology. 80, 17-28 (2018).
- Owusu-Ansah, E., Banerjee, U. Reactive oxygen species prime Drosophila haematopoietic progenitors for differentiation. Nature. 461 (7263), 537-541 (2009).
- Love, N. R., et al. Amputation-induced reactive oxygen species are required for successful Xenopus tadpole tail regeneration. Nature Cell Biology. 15 (2), 222-228 (2013).
- Le Belle, J. E., et al. Proliferative Neural Stem Cells Have High Endogenous ROS Levels that Regulate Self-Renewal and Neurogenesis in a PI3K/Akt-Dependant Manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Myant, K. B., et al. production and NF-κB activation triggered by RAC1 facilitate WNT-driven intestinal stem cell proliferation and colorectal cancer initiation. Cell Stem Cell. 12 (6), 761-773 (2013).
- Hamanaka, R. B., et al. Mitochondrial Reactive Oxygen Species Promote Epidermal Differentiation and Hair Follicle Development. Science Signaling. 6 (261), 8(2013).
- Carrasco, E., et al. Photoactivation of ROS Production in situ Transiently Activates Cell Proliferation in Mouse Skin and in the hair Follicle Stem Cell Niche Promoting Hair Growth and Wound Healing. Journal of Investigative Dermatology. 135 (11), 1-12 (2015).
- Carrasco, E., Blázquez-Castro, A., Calvo, M. I., Juarranz, Á, Espada, J. Switching on a transient endogenous ROS production in mammalian cells and tissues. Methods. , 109(2016).
- Braun, K. M., et al. Manipulation of stem cell proliferation and lineage commitment: visualisation of label-retaining cells in wholemounts of mouse epidermis. Development. 130 (21), 5241-5255 (2003).
- Hsu, Y. -C., Li, L., Fuchs, E. Emerging interactions between skin stem cells and their niches. Nature Medicine. 20 (8), 847-856 (2014).
- Plikus, M. V., et al. Epithelial stem cells and implications for wound repair. Seminars in Cell & Developmental Biology. 23 (9), 946-953 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены