Method Article
활성 산소 종의 전환 가능한 protoporphyrin IX 의존성 광생성에 의한 마우스 피부의 줄기 세포 틈새 및 조직 재생 자극 in situ
요약
이 프로토콜의 목적은 마우스 피부에서 치명적이지 않은 수준의 활성 산소 종(ROS)의 일시적인 생체 내 생산을 유도하여 조직의 생리적 반응을 더욱 촉진하는 것입니다.
초록
여기에서 우리는 마우스 피부에서 내인성 활성 산소 종(ROS)의 전환 가능한 생체 내 광생성을 유도하는 프로토콜을 설명합니다. ROS의 이러한 일시적인 현장 생산은 줄기 세포 틈새에서 세포 증식을 효율적으로 활성화하고 화상 치유 및 모낭 성장 과정의 가속화를 통해 강력하게 나타나는 조직 재생을 자극합니다. 이 프로토콜은 내인성 감광제인 프로토포르피린 IX의 전구체로 조직을 치료하고 엄격하게 제어되는 물리화학적 매개변수 하에서 조직에 적색광을 추가로 조사하는 조절 가능한 광역학 치료를 기반으로 합니다. 전반적으로 이 프로토콜은 ROS 생물학을 분석하는 흥미로운 실험 도구를 구성합니다.
서문
활성 산소종(ROS)은 분자 산소가 화학적으로 환원되어 물을 형성한 결과이며 일중항 산소, 슈퍼옥사이드 음이온, 과산화수소 및 하이드록실 라디칼 1,2,3을 포함합니다. ROS는 화학적 반응성이 매우 높기 때문에 수명이 매우 짧습니다. 호기성 유기체에서 ROS는 미토콘드리아에서 호기성 호흡(전자 수송 사슬)의 주요 누출 부산물로서 세포 내부에 부수적으로 형성됩니다. 세포에 높은 수준의 ROS가 일시적으로 축적되면 단백질, 지질 및 당의 돌이킬 수 없는 비활성화와 DNA 분자 2,3,4,5에 돌연변이가 도입될 수 있는 산화 스트레스 상태가 발생합니다. 세포, 조직 및 전체 유기체에서 산화적 손상의 점진적인 축적은 시간이 지남에 따라 꾸준히 증가하며 세포 사멸 프로그램의 유도, 여러 병리 및 노화 과정과 관련이 있다 2,3,4,6.
호기성 유기체는 세포와 조직의 과도한 ROS 축적을 해결하기 위해 효율적인 분자 메커니즘을 꾸준히 발전시켜 왔습니다. 이러한 메커니즘에는 슈퍼옥사이드 라디칼 분해를 분자 산소 및 과산화수소로 촉매하는 슈퍼옥사이드 디스뮤타제(SOD) 단백질 패밀리의 구성원과 항산화 풀(글루타티온, NADPH, 퍼옥시레독신, 티오레독신 7,8)을 사용하여 과산화수소가 물 및 분자 산소로 전환되는 것을 촉매하는 다양한 카탈라아제 및 과산화효소가 포함됩니다.
그러나 여러 보고서는 증식, 분화 및 이동성을 포함하여 중요한 세포 기능을 조절하는 분자 회로의 핵심 구성 요소로서 ROS의 역할을 지지합니다 2,3,4. 이 개념은 리폭시게나제, 사이클로옥시게나제 및 NADPH 산화효소 9,10을 포함한 호기성 유기체에서 전용 ROS 생성 메커니즘의 초기 식별 및 특성화에 의해 추가로 뒷받침됩니다. 이러한 의미에서 ROS는 척추동물 배아 발달 동안 적극적인 역할을 나타내며 11,12,13 특정 생체 내 생리학적 기능의 조절에서 이러한 분자의 핵심 역할은 초파리14의 조혈 전구체의 분화 프로그램, 제브라피쉬의 치유 유도 또는 제노푸스 올챙이 15의 꼬리 재생을 포함한 다양한 실험 시스템에서 보고되었습니다 . 포유류에서 ROS는 신경구 모델16에서 신경 줄기 세포의 자가 재생/분화 잠재력과 대장암 개시17 동안 장 줄기 세포 기능의 조절 완화에 관여했습니다. 피부에서, ROS 신호전달은 표피 분화 및 피부 줄기 세포 틈새 및 모낭 성장 주기의 조절과 관련이 있다18,19.
이러한 관점에서, 정상 또는 병리학적 조건 모두에서 생물학적 시스템에서 ROS의 생리학적 역할을 결정하기 위한 주요 실험적 한계는 세포와 조직에서 이러한 분자의 제어된 생산을 유도하기 위한 적절한 실험 도구가 부족하다는 것입니다. 현재 대부분의 실험적 접근법은 대부분 과산화수소 형태의 외인성 ROS를 투여하는 것입니다. 우리는 최근 내인성 광감작제 프로토포르피린 IX(PpIX; 예: 아미노라에불린산 또는 그 메틸 유도체 메틸아미노레불리네이트)의 전구체 투여를 기반으로 마우스 피부에서 내인성 ROS의 일시적이고 치명적이지 않은 생체 내 생산을 전환하고 세포 내 분자 산소로부터 ROS의 현장 형성을 유도하기 위해 샘플에 적색광을 추가로 조사하는 실험적 접근 방식을 구현했습니다(그림 1). 이러한 광역학 절차는 상주하는 줄기 세포 틈새를 자극하는 데 효율적으로 사용될 수 있으며, 따라서 조직(19,20)의 재생 프로그램을 활성화하고 피부 재생 의학에서 새로운 치료 양식을 위한 길을 열어줍니다. 여기에서는 모낭의 팽창 영역에서 장기 5-브로모-2'-데옥시유리딘(BrdU) 표지 유지 세포(LRC)의 수의 증가로 측정된 줄기 세포 틈새 자극의 대표적인 예를 보여주는 프로토콜에 대한 자세한 설명을 제시합니다19,21, 및 일시적인 현상에 의해 유도된 재생 프로그램의 후속 활성화(모발 성장 및 화상 치유 과정의 가속화), C57Bl6 마우스 균주의 피부에서 치명적이지 않은 ROS 생성.
프로토콜
모든 마우스 사육 및 실험 절차는 동물 실험에 관한 지역, 국가, 국제 법률 및 지침에 따라 수행되어야합니다.
1. 꼬리 피부 상피 wholemounts에 있는 모발 성장, 화상 유도 및 장기 BrdU LRCs의 동정의 유도
참고: 아래에 설명된 실험 설계를 위해 10일 또는 7주 된 C57BL/6 마우스, 가급적이면 새끼를 사용하십시오. 모든 실험 절차에서 동물은 표시된 대로 3% 이소플루란 흡입으로 마취되거나 자궁경부 탈구로 안락사됩니다.
- 두 번째 휴지기 (휴식) 단계 (출생 후 약 50 일)에서 마우스의 등 피부에서 모발 성장 유도
- 3 % isoflurane을 흡입하여 마우스를 마취하십시오. 페달 반사의 부족(단단한 발가락 꼬집음)으로 완전한 심부 마취를 확인합니다. 헤어 클리퍼와 제모 크림을 사용하여 각 단일 마우스에서 등 피부의 두 개의 독립적인 영역을 나란히 면도합니다(Table of Materials). 왼쪽은 대조군으로, 오른쪽은 치료에 사용하십시오.
참고: 면도 후 등 아래 피부가 분홍빛을 띠고 회색/검은색이 아닌지 확인하는데, 이는 이 마우스 균주에서 멜라닌 생성 및 성장기(성장) 단계로의 진입을 나타내는 지표입니다. - PBS로 철저히 세척하여 모든 크림 잔여물을 제거하고 섹션 2.1에 설명된 대로 치명적이지 않은 ROS 수준의 일시적인 현장 생산 유도를 진행합니다.
- 각 동물의 대조군 및 처리된 등 피부 부위의 고해상도 이미지를 매일 획득하여 모낭 성장을 기록합니다(예: 5-20x 쌍안경 렌즈에 연결된 HD 카메라 사용).
- 3 % isoflurane을 흡입하여 마우스를 마취하십시오. 페달 반사의 부족(단단한 발가락 꼬집음)으로 완전한 심부 마취를 확인합니다. 헤어 클리퍼와 제모 크림을 사용하여 각 단일 마우스에서 등 피부의 두 개의 독립적인 영역을 나란히 면도합니다(Table of Materials). 왼쪽은 대조군으로, 오른쪽은 치료에 사용하십시오.
- 두 번째 휴지기(휴식) 단계(출생 후 약 50일)에서 생쥐의 등 피부에서2도 화상 병변 유도
- 마우스를 마취하십시오. 머리 깎기와 제모 크림을 사용하여 각 단일 마우스의 등 피부 부위 전체를 면도하고 PBS로 철저히 씻어 크림 잔여물을 모두 제거합니다.
참고: 연소 절차 직전에 멸균 식염수에 리도카인 0.5%(2mg/ml)를 7mg/ml를 초과하지 않는 현장 피하 주사를 투여합니다. - 끓는 물에 담가 황동 막대(단면 1cm)를 95°C로 예열한 다음 각 마우스의 등쪽 피부 표면의 중앙 영역에 5초 동안 적용합니다.
- 화상 발생 직후, 탈수를 방지하기 위해 전기 담요에 생리 용액 (0.9 % NaCl) 1mL를 동물에게 복강 주사합니다. 동물이 24시간 동안 회복되도록 하고 섹션 2.3에 설명된 대로 치명적이지 않은 ROS 수준의 일시적인 현장 생산 유도를 진행합니다.
- 각 동물의 대조군 및 치료된 등 피부 부위의 고해상도 이미지를 매일 획득하여 화상 상처 진행을 기록합니다(예: 5-20x 쌍안경 렌즈에 연결된 HD 카메라 사용).
- 마우스를 마취하십시오. 머리 깎기와 제모 크림을 사용하여 각 단일 마우스의 등 피부 부위 전체를 면도하고 PBS로 철저히 씻어 크림 잔여물을 모두 제거합니다.
- 꼬리 피부 상피에서 장기 BrdU LRC의 생성 및 식별
- 10/14일 된 새끼를 PBS에 용해된 50mg/kg 체중 BrdU로 연속 4일 동안 하루에 한 번 복강내(마취 없음) 주사합니다. 라벨링 단계 후, 치료 전에 50-60 일 동안 마우스가 자랄 수 있도록하십시오.
알림: 주사할 때마다 새 바늘을 사용하십시오. - 조직 전체 마운트를 준비하기 전에 다른 시간에 꼬리 피부에서 일시적인 제자리 비치명적 ROS 생산 유도에 대해 섹션 2.3에 설명된 대로 진행합니다.
- 꼬리 표피의 전체 마운트를 준비하려면 자궁 경부 탈구로 생쥐를 안락사시키고 수술 용 가위로 꼬리를 자릅니다.
- 메스를 사용하여 꼬리 전체를 똑바로 세로 절개하고 척추에서 피부 전체를 한 조각으로 벗겨냅니다. 박리된 피부를 37°C에서 4시간 동안 5mL 튜브의 PBS 중 5mM EDTA로 인큐베이션하고 집게를 사용하여 진피에서 손상되지 않은 표피 시트를 조심스럽게 분리합니다.
- 실온(RT)에서 최소 72시간 동안 PBS의 4% 포름알데히드에 조직을 고정하고 적절한 항체를 사용하여 BrdU 검출을 진행합니다.
- 형광/공초점 현미경을 사용하여 앞서 자세히 설명한 바와 같이 조직 전체 마운트를 준비하기 전에 서로 다른 시간에 광 제어 및 광역학 처리를 포함하여 각 실험 조건에서 LRC를 식별하고 정량화합니다(앞서 자세히설명한 바와 같이).
참고: 고정 표피 시트는 0.02°C에서 4% 아지드화나트륨이 함유된 PBS에 최대 3개월 동안 보관할 수 있습니다. 고정된 표피 시트는 표준 조직학적 절편 절차에 따라 필요한 단백질의 면역국소화에 사용될 수 있습니다.
- 10/14일 된 새끼를 PBS에 용해된 50mg/kg 체중 BrdU로 연속 4일 동안 하루에 한 번 복강내(마취 없음) 주사합니다. 라벨링 단계 후, 치료 전에 50-60 일 동안 마우스가 자랄 수 있도록하십시오.
2. 마우스 피부에서 치명적이지 않은 ROS 수준의 일시적인 생산 유도
참고: 마우스 피부에서 치명적이지 않은 ROS 수준의 일시적인 생성을 유도하기 위해 내인성 광감작제 PpIX, 이 경우 메틸-아미노레불리네이트(mALA)의 전구체를 사용한 광역학 치료 및 적색광이 사용됩니다.
- 등 피부의 모발 성장 유도를 위해 일시적인 ROS 생산을 켜려면 섹션 1.1에 표시된 대로 동물을 준비합니다.
- ~25mg의 mALA를 오른쪽 부위에 국소 크림(재료 표) 형태로 바르고 왼쪽은 내부 대조군으로 유지하여 개인차를 피합니다. 어둠 속에서 2.5 시간 동안 배양하고 PBS로 여분의 크림을 완전히 씻어 내십시오. 마취 깊이를 확인하려면 완전히 회복 될 때까지 10 분마다 동물을 모니터링하십시오.
참고: 후면 피부에서 PpIX의 생성은 청색광(407nm) 여기 하에서 적색 형광으로 현장에서 테스트해야 합니다. - 동물을 마취하십시오.
- 2.5-4 J/cm2의 총 선량에 대해 적절한 적색 광원(재료 표)으로 등 피부 전체를 조사합니다. 마우스가 완전히 회복 될 때까지 전기 담요에 마우스를 보관하고 1.1.3 단계에 설명 된대로 진행하십시오.
알림: 광원과 조직 사이의 거리를 조작하여 방사 조도를 조정하고 전력 에너지 미터(재료 표)를 사용하여 측정해야 합니다. 실험은 각 동물의 독립적인 면도 부위 중 어느 하나에서 완전한 모발 성장이 관찰될 때 완료된 것으로 간주된다. 전체 절차에는 단 한 번의 사진 처리가 포함됩니다.
- ~25mg의 mALA를 오른쪽 부위에 국소 크림(재료 표) 형태로 바르고 왼쪽은 내부 대조군으로 유지하여 개인차를 피합니다. 어둠 속에서 2.5 시간 동안 배양하고 PBS로 여분의 크림을 완전히 씻어 내십시오. 마취 깊이를 확인하려면 완전히 회복 될 때까지 10 분마다 동물을 모니터링하십시오.
- 2도 화상 병변의 치유 개선을 위해 일시적인 ROS 생산을 켜려면 섹션 1.2에 표시된 대로 동물을 준비하십시오.
- 약 25mm의 인접 조직을 포함하는 화상 표면 전체에 국소 크림 형태로 ~4mg의 mALA를 바릅니다. 어둠 속에서 2.5 시간 동안 배양하고 PBS로 여분의 크림을 완전히 씻어 내십시오. 마취 깊이를 확인하려면 완전히 회복 될 때까지 10 분마다 동물을 모니터링하십시오.
- 동물을 마취하십시오.
- 2.5-4 J/cm2의 총 선량에 대해 적절한 적색 광원으로 등 피부 전체를 조사합니다. 마우스가 완전히 회복 될 때까지 전기 담요 위에 마우스를 보관하고 1.2.4 단계에 설명 된대로 진행하십시오.
참고: 각 동물에 대한 실험 절차는 완전한 화상 치유가 관찰되면 완료된 것으로 간주됩니다. 전체 절차에는 단 한 번의 사진 처리가 포함됩니다.
- 꼬리 피부에서 일시적인 ROS 생성을 켜려면 섹션 1.3에 표시된 대로 마우스를 준비하고 등쪽 조직 영역 전체에 국소 크림 형태로 ~25mg의 mALA를 바르고 등 피부에 대해 섹션 2.1에 설명된 대로 진행합니다. 동물 안락사 24시간, 48시간 또는 72시간 전에 사진 처리 및 해당 조명 제어를 수행하고 꼬리 피부 전체 마운트를 추가로 추출합니다.
참고: 모든 실험 설계에서 항산화제 ROS 제거제를 사용하여 공정의 ROS 의존성을 분석합니다(예: mALA 치료 5일 전부터 PBS, pH 7.2에 20mg/mL 용액을 복강내 주사하여 100mg/kg 체중 N-아세틸-시스테인을 매일 접종하거나 50% 에탄올에 100mg/mL 아스코르브산을 2회 투여합니다. 30분 간격으로, mALA 치료와 적색광 조사 사이의 시간 간격으로 피부에 국소적으로 도포).
3. 피부의 ROS 검출
- 하이드로에티딘을 이용한 광역학 치료 후 꼬리 피부에서 ROS 생산의 생체 외 평가
참고: 히드로에티딘은 ROS와 특이적으로 반응하여 형광 염료 2-하이드록시에티듐(hET)을 생성하는 비형광 분자입니다.- 섹션 1.3.3에 기재된 바와 같이 수득된 전체 꼬리 피부를 PBS 용액 (대조군 샘플) 중 5 mM EDTA 중에서 37°C에서 3시간 동안 또는 추가로 2 mM mALA (광역학 처리 샘플)를 함유하는 배양한다.
- 모든 경우에 디메틸 설폭사이드(DMSO)의 25mg/mL 스톡에서 최종 농도 3.2μM까지 하이드로에티딘을 추가하고 실온에서 암실에서 1시간 동안 배양합니다.
- 손가락 끝을 사용하여 유리 표면 위에 꼬리 피부 샘플을 늘리고 10J/cm2 플루언스에서 636nm 적색광을 조사합니다.
- 즉시 진행하여 진피에서 표피를 분리하고 섹션 1.3.3에 설명된 대로 표피 시트를 고정합니다.
- 녹색 여기광을 사용하여 형광/컨포칼 현미경으로 hET 적색 방출을 평가하고 고품질 이미지를 캡처하고 추가 분석을 진행합니다.
참고: 광역학 치료가 없는 상태에서 조직 샘플의 hET 염색을 hET 자가산화에 대한 음성 대조군으로 사용하십시오.
- 모발 성장 유도 및 화상 치유 후 광역학 치료 후 뒷피부에서 ROS 생성의 생체 내 검출
참고: 이 단계는 세포 내 에스테라제 효소에 의한 절단 후 ROS와 특이적으로 반응하여 2′,7′-디클로로플루오레세인(DCF) 형광 염료를 생성하는 세포 투과성 비형광 화합물인 2′,7′-디클로로디히드로플루오레세인 디아세테이트(DHF-DA)를 사용하여 수행됩니다.- 모발 성장 유도 (섹션 1.1) 또는 화상 치유 (섹션 1.2)를 위해 준비된 동물을 사용하십시오. 국소 mALA 크림 트리트먼트(섹션 2.1 및 2.2 참조) 직전에 모든 표적 대조군/처리된 피부 부위에 DHF-DA의 50% 에탄올에 1mg/mL 100μL를 국소적으로 분주하고 피부가 물질을 완전히 흡수하도록 하고 국소 mALA 크림 적용을 진행합니다.
- 처리된 동물을 어두운 곳에서 4시간 동안 배양하고 국소 mALA 크림을 PBS로 피부에서 완전히 씻어내고 DHF-DA 용액 100μL의 두 번째 용량을 피부에 분배합니다. 마취 깊이를 확인하려면 완전히 회복 될 때까지 10 분마다 동물을 모니터링하십시오.
- 처리된 동물을 어둠 속에서 50분 동안 배양하고, LED 램프를 사용하여 636nm 적색광의 2.5 내지 4 J/cm2 범위의 플루언스로 등 피부 전체를 마취시키고 조사한다.
- 방사선 조사 직후, 생체 내 이미징 시스템(Table of Materials)을 사용하여 피부에서 생성된 ROS 수준을 평가한다. 445-490 nm 여기 및 515-575 nm 방출에 대한 필터 박스를 설정하고 고품질 이미지를 캡처하고 추가 분석을 진행합니다.
참고: DHF-DA 자가산화에 대한 음성 대조군으로 광역학 치료가 없는 상태에서 조직 샘플의 DHF-DA 염색을 사용하십시오.
결과
마우스 등 및 꼬리 피부에 mALA 전구체를 국소 투여하면 청색광(407nm) 여기 하에서 이 화합물의 적분홍색 형광에 의해 입증된 바와 같이 전체 조직과 눈에 띄게 모낭에 PpIX가 상당히 축적됩니다(그림 2A, C). 2.5-4 J/cm2 의 플루언스에서 적색광(636nm)으로 처리된 조직을 연속적으로 조사하면 조직, 특히 모낭의 돌출 영역에서 ROS의 일시적인 생성이 촉진됩니다(그림 2B, D).
생체 내 마우스 피부에서 치명적이지 않은 ROS 생산을 켜면 사진 처리 이틀 후 모낭의 돌출 영역에서 체세포 줄기 세포로 분류되는 LRC 수의 상당한 증가가 촉진됩니다(그림 3, 왼쪽 패널). 특히, LRC 수의 증가는 일시적이며 치료 6일 후에 정상 수준으로 회복됩니다(그림 3, 오른쪽 패널). 이 영역은 마우스 피부의 주요 줄기 세포 틈새 중 하나이기 때문에, 이 영역에서 세포 증식의 일시적인 유도는 주로 팽창 틈새와 증식 및 분화의 상주 줄기 세포 프로그램의 기능적 활성화를 반영합니다22,23.
돌출된 모낭 틈새의 ROS 의존적 활성화는 피부의 생리적 반응과 더 관련이 있습니다. 따라서 일시적인 ROS 생성은2도 화상 후 피부 치유 과정을 현저하게 가속화합니다(그림 4A, B). 손상된/딱지 피부 영역의 점진적인 감소의 정량화는 조직에서 PpIX 의존성 일시적인 ROS 생성에 의해 유도된 상처 치유 촉진 과정의 견고성과 통계적 유의성을 보여줍니다(그림 4C). 같은 방식으로, 치명적이지 않은 ROS 수치는 모낭이 성장 자극에 반응하기 위해 불응하는 단계인 제2 배위 휴지기(그림 5A) 동안 면도 후 모발 성장을 강력하게 촉진하며, 이는 모발 성장을 자극하기 위한 새로운 화합물 및/또는 공정의 잠재력을 평가하는 적절한 방법을 구성합니다. 특히, 아스코르브산(AA)과 같은 항산화 화합물을 사용하면 모발 성장이 가속화되는 동물의 수가 통계적으로 유의하게 감소합니다(그림 5B). 또한, 피부에서 DHF의 형광 방출에 의해 정량화된 광치료 후 피부에서의 ROS 생성은 항산화 화합물에 의해 현저히 감소된다(도 5C). 함께, 이러한 결과는 PpIX 기반 사진 치료 후 ROS 생산이 조직에서 생리적 반응을 유도하기 위해 엄격하게 요구된다는 것을 보여줍니다.

그림 1: 헴 생합성 경로를 사용하여 세포 및 조직에서 ROS의 내인성 광역학 생산을 제어하기 위한 이론적 배경. (A) 광역학 처리 동안 분자 산소 여기를 초래하는 기본 광화학 반응의 개략도. 적절한 λ로 빛을 흡수하면 바닥 상태 S0 의 감광제 분자 (PS)가 여기 된 단일 항 상태 S1 로 전환됩니다. 임의의 여기 상태가 기저 상태보다 에너지적으로 덜 바람직하기 때문에, 분자는 짧은 시간 후에S0로 되돌아간다. 대부분의 PS는 S1에서 삼중항 상태T1으로의 전환에 대해 높은 양자 효율을 가지며, 일반적으로 상대적으로 긴 수명을 특징으로 한다. 여기 삼중항 상태에서 활성화된 PS는 두 가지 다른 경로를 통해 다른 분자와 반응할 수 있습니다. 유형 I 광화학 반응은 라디칼 종을 형성하기 위해 인접한 분자로 전자를 전달하는 것입니다. 이러한 라디칼은 분자 산소와 반응하여 슈퍼옥사이드 음이온(•O2-), 과산화수소(H2O2) 및 하이드록실 라디칼(•OH)을 포함한 ROS를 생성할 가능성이 높습니다. 유형 II 광화학 반응은 PDT에 사용되는 대부분의 PS에 대한 지배적인 과정을 나타냅니다. 이 반응 동안, 에너지 (전자가 아님)가 분자 산소 (바닥 상태의 구성이 삼중 항, 3O 2 임)로의 전달은 비 라디칼이지만 반응성이 높은 일중항 산소 (1O2)의 형성을 유도합니다. 이러한 반응 중에 형성된 광산물은 일련의 생화학적 사건을 유발하여 최종적으로 세포 사멸을 유발하거나 잠재적으로 세포 성장을 자극할 수 있는 산화 스트레스를 유발합니다. (B) 5-아미노레불린산(ALA)은 미토콘드리아 및 세포질 세포 구획을 모두 포함하는 헴 생합성 경로의 천연 전구체입니다. ALA 합성 효소 활성은 음성 피드백 제어에 의해 조절되며, 이 경로의 최종 산물인 유리 헴은 글리신과 석시닐 CoA에서 ALA의 합성을 억제합니다. 외인성 ALA 또는 그 유도체 메틸 아미노레불리네이트(mALA)의 투여는 조절 피드백 시스템을 우회하여 다운스트림 대사산물, 특히 프로토포르피린 IX(PpIX)가 세포에 축적되어 광감작을 유도합니다. PpIX에 철이 삽입되는 촉매 효소인 페로켈라타제의 속도 제한 특성은 이 내인성 PS 화합물의 축적을 촉진합니다. PBG = 포르포빌리노겐. 이 수치는 Carrasco et al.19에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: mALA와 적색광을 사용한 광역학 치료는 피부에서 일시적인 ROS 생성을 유도합니다. (A) 등 피부에서 mALA 주제 치료 후 내인성 PpIX의 축적. 동일한 동물의 좌측을 대조군으로 사용하였다. (B) 왼쪽 패널: DHF-DA에 의해 모니터링되는 PpIX 의존성 ROS(mALA+Light) 생산. 오른쪽 패널: 등 피부에서 상대적인 ROS 생성의 시간 경과 분석; 각 동물에서 mALA+빛 대 빛 영역의 DHF-DA 형광 방출의 상대적 통합 밀도는 조사 후 다른 시간에 정량화되고 방법론에 설명된 대로 정규화되었습니다. 평균 ± SE를 나타내었다(각 시점에 대해 n=4). (C) 꼬리 피부에서 PpIX의 국소화(형광 현미경 이미지). (D) hET에 의해 밝혀진 바와 같이 mALA+Light 후 꼬리 피부에서 ROS 생성은 모낭의 돌출 영역에서 증가하고 지속적인 축적을 보여줍니다. 대표적인 컨포칼 현미경 이미지(최대 투영)가 표시됩니다. 스케일 바 = 100 μm. 이 수치는 Carrasco et al.19에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 피부에서 현장 ROS 생성을 켜면 모낭 틈새의 돌출 영역에서 줄기 세포의 상당한 증가가 촉진됩니다. 왼쪽 패널: 마우스 꼬리 피부 전체 마운트에서 BrdU 표지 유지 세포(LRC)의 국소화와 PpIX 기반 광치료 2일 후 모낭의 돌출부 영역에서 LRC의 명백한 증가를 보여주는 대표적인 공초점 현미경 이미지(최대 투영). 오른쪽 패널: 모낭 돌출 부위의 LRC 수 정량화. 평균 + SE (n = 4)가 표시됩니다. 스케일 바 = 50 μm. 이 수치는 Carrasco et al.19에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 피부에서 현장 ROS 생성을 켜면 화상 치유가 가속화됩니다. (A) 대조군 샘플과 비교하여 처리된 동물의 화상 손상 부위에서 mALA에 의해 유도된 PpIX 생산. (B) mALA+Light 처리 및 대조 동물의 화상 치유 진화. (C) mALA+Light 처리된 동물에서 가속화된 화상 치유를 보여주는 화상 부위(왼쪽 패널)의 시간 경과 정량화; 치유되지 않은 영역의 평균 + SE(n = 4)가 표시됩니다. 두 시간 경과 곡선 간의 통계적 차이를 보여주는 곡선 아래 면적 분석(오른쪽 패널)(p ≤ 0.06). 이 수치는 Carrasco et al.19에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
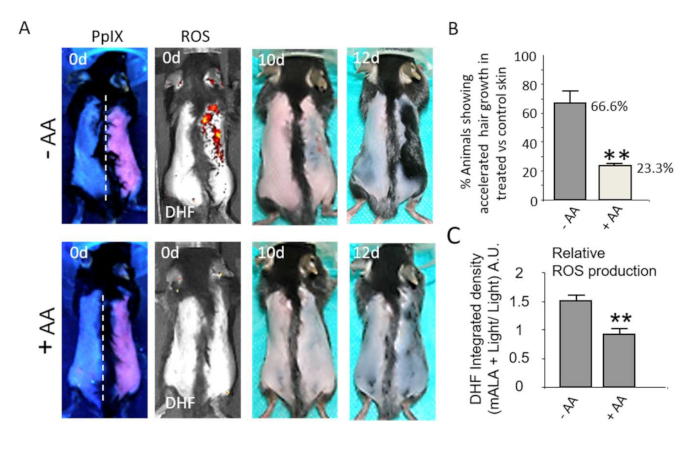
그림 5: 피부에서 현장 ROS 생성을 켜면 모발 성장이 촉진됩니다. (A) 윗줄: 불응성 휴지기 동안 mALA+Light(등쪽 피부 오른쪽)에 의한 발모 유도를 조명 조절 영역(왼쪽)과 비교한 결과. 맨 아래 줄: 아스코르브산(AA) 항산화 처리에 의해 피부의 ROS 생성과 mALA+Light에 의해 유도된 모발 성장 촉진이 모두 억제됩니다. (B) 항산화제 AA의 부재 또는 존재 하에 대조군 영역과 비교하여 mALA-PT에서 가속화된 모발 성장을 나타내는 동물의 %의 정량화(3개의 독립적인 실험에서 n=4). (C) mALA-PT 동안 AA에 의해 유도된 등쪽 피부에서 ROS 생산 억제의 정량화(n=4). 모든 경우에 막대는 평균 + SE를 나타냅니다. 이 수치는 Carrasco et al.19에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에서 우리는 생리학적 효과와 함께 마우스 피부에서 생체 내에서 내인성 ROS 생산의 일시적인 활성화를 허용하는 방법론을 제시합니다. 이 방법론은 내인성 광감작제 PpIX의 제어된 국소 자극을 유도하기 위한 광역학 절차를 기반으로 합니다(그림 1B). 이 실험적 접근 방식은 외부 ROS 소스(일반적으로 과산화수소)를 사용하고 조직/샘플에서 ROS의 제어된 국소 생산을 허용하는 방법론에 비해 상당한 발전을 구성하는 생체 내 실험 시스템에서 ROS 생물학을 연구하는 흥미로운 도구입니다.
아미노레불리네이트 기반 전구체가 세포 내 PpIX의 축적을 촉진하기 위해 과도하게 투여된다는 점을 감안할 때, 이 방법론의 중요한 단계는 손상 역치 미만이지만 강력한 자극 효과를 나타내는 조직에서 ROS 수준의 일시적인 생성을 유도하기 위해 적절한 광 용량을 설정하는 것입니다. 현재 세포와 조직에서 생성되는 모든 유형의 ROS의 정확한 양을 직접 정량화할 수 있는 기술은 없습니다. 우리의 방법론에서는 주어진 광량, 생성된 ROS의 정확한 양 및 주어진 생물학적 효과(예: 세포 사멸 또는 세포 증식) 사이의 직접적인 상관 관계를 확립하는 것이 여전히 불가능합니다. 이러한 이유로, 특정 실험 모델에 대한 광량(플루언스)은 연구자가 각 상황에 대해 선택한 정성적 또는 반정성적 매개변수를 사용하여 경험적으로 설정해야 합니다. 마우스 피부의 경우, 우리는 세포 사멸과 조직 손상 사이의 쉽게 측정 가능한 전이와 중요하고 일시적인 증식 파동의 유도를 선택합니다.
여기에 제시된 방법론은 화상 치유 및 모낭 성장을 포함한 다양한 과정에서 피부 재생 개선에 매우 효과적인 것으로 입증되었습니다. 이러한 관찰은 우발적 또는 만성 화상 및 상처의 치료 또는 피부, 특히 결함이 있는 줄기 세포 기능을 포함하는 모낭의 다른 병리를 치료하기 위해 클리닉에서 이 기술의 치료 적용을 구현하기 위한 길을 열어줍니다.
공개
이 작업에 설명된 절차의 모든 상업적 적용은 EC, MIC 및 JE가 저술하고 상업적 이용을 위해 Derma Innovate SL에 라이선스가 부여된 CSIC-UAM 특허(EP2932967A1)에 의해 보호됩니다. JE와 JJM은 Derma Innovate SL에서 자문 직책을 맡고 있습니다.
감사의 말
이 작업은 스페인의 Ministerio de Economía y Competitividad (RTC-2014-2626-1 to JE) 및 Instituto de Salud Carlos III (PI15 / 01458 to JE)의 보조금으로 지원되었습니다. EC는 Atracción de Talento Investigador 보조금 2017-T2 / BMD-5766 (Comunidad de Madrid 및 UAM)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 2′,7′-Dichlorofluorescin diacetate | Sigma Aldrich | D6883-50MG | |
| 5'-bromo-2'-deoxiuridine | Sigma Aldrich | B5002-500MG | |
| Anti-Bromodeoxyuridine-Fluorescein | Roche | 11202693001 | |
| Depilatory cream (e.g., Veet) | Veet | ||
| Dihydroethidium | Sigma Aldrich | 37291-25MG | |
| In Vivo imaging system, e.g., IVIS Lumina 2 | Perkin Elmer | ||
| mALA in the form of topical cream, e.g.,METVIX Crema 160 mg/g | Galderma | ||
| Power energy meter (e.g., ThorLabs Model PM100D) | ThorLabs | ||
| Red light source, e.g., 636 nm Aktilite LED lamp | Photocure ASA |
참고문헌
- Blázquez-Castro, A. Direct 1O2 optical excitation: A tool for redox biology. Redox Biology. 13, 39-59 (2017).
- Valko, M., et al. Free radicals and antioxidants in normal physiological functions and human disease. The International Journal of Biochemistry & Cell Biology. 39 (1), 44-84 (2007).
- Sena, L. A., Chandel, N. S. Physiological Roles of Mitochondrial Reactive Oxygen Species. Molecular Cell. 48 (2), 158-167 (2012).
- Bartosz, G. Reactive oxygen species: Destroyers or messengers. Biochemical Pharmacology. 77 (8), 1303-1315 (2009).
- Brieger, K., Schiavone, S., Miller, J., Krause, K. Reactive oxygen species: from health to disease. Swiss Medical Weekly. 142, 13659(2012).
- Speakman, J. R., Selman, C. The free-radical damage theory: Accumulating evidence against a simple link of oxidative stress to ageing and lifespan. BioEssays. 33 (4), 255-259 (2011).
- Fernandez, V., Videla, L. A. Biochemical aspects of cellular antioxidant systems. Biological Research. 29 (2), 177-182 (1996).
- Matés, J. M., Sánchez-Jiménez, F. Antioxidant enzymes and their implications in pathophysiologic processes. Frontiers in Bioscience. 4, 339-345 (1999).
- Bedard, K., Krause, K. -H. The NOX Family of ROS-Generating NADPH Oxidases: Physiology and Pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Leto, T. L., Morand, S., Hurt, D., Ueyama, T. Targeting and Regulation of Reactive Oxygen Species Generation by Nox Family NADPH Oxidases. Antioxidants & Redox Signaling. 11 (10), 2607-2619 (2009).
- Hernández-García, D., Wood, C. D., Castro-Obregón, S., Covarrubias, L. Reactive oxygen species: A radical role in development. Free Radical Biology and Medicine. 49 (2), 130-143 (2010).
- Covarrubias, L., Hernández-García, D., Schnabel, D., Salas-Vidal, E., Castro-Obregón, S. Function of reactive oxygen species during animal development: Passive or active. Developmental Biology. 320 (1), 1-11 (2008).
- Timme-Laragy, A. R., Hahn, M. E., Hansen, J. M., Rastogi, A., Roy, M. A. Redox stress and signaling during vertebrate embryonic development: Regulation and responses. Seminars in Cell & Developmental Biology. 80, 17-28 (2018).
- Owusu-Ansah, E., Banerjee, U. Reactive oxygen species prime Drosophila haematopoietic progenitors for differentiation. Nature. 461 (7263), 537-541 (2009).
- Love, N. R., et al. Amputation-induced reactive oxygen species are required for successful Xenopus tadpole tail regeneration. Nature Cell Biology. 15 (2), 222-228 (2013).
- Le Belle, J. E., et al. Proliferative Neural Stem Cells Have High Endogenous ROS Levels that Regulate Self-Renewal and Neurogenesis in a PI3K/Akt-Dependant Manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Myant, K. B., et al. production and NF-κB activation triggered by RAC1 facilitate WNT-driven intestinal stem cell proliferation and colorectal cancer initiation. Cell Stem Cell. 12 (6), 761-773 (2013).
- Hamanaka, R. B., et al. Mitochondrial Reactive Oxygen Species Promote Epidermal Differentiation and Hair Follicle Development. Science Signaling. 6 (261), 8(2013).
- Carrasco, E., et al. Photoactivation of ROS Production in situ Transiently Activates Cell Proliferation in Mouse Skin and in the hair Follicle Stem Cell Niche Promoting Hair Growth and Wound Healing. Journal of Investigative Dermatology. 135 (11), 1-12 (2015).
- Carrasco, E., Blázquez-Castro, A., Calvo, M. I., Juarranz, Á, Espada, J. Switching on a transient endogenous ROS production in mammalian cells and tissues. Methods. , 109(2016).
- Braun, K. M., et al. Manipulation of stem cell proliferation and lineage commitment: visualisation of label-retaining cells in wholemounts of mouse epidermis. Development. 130 (21), 5241-5255 (2003).
- Hsu, Y. -C., Li, L., Fuchs, E. Emerging interactions between skin stem cells and their niches. Nature Medicine. 20 (8), 847-856 (2014).
- Plikus, M. V., et al. Epithelial stem cells and implications for wound repair. Seminars in Cell & Developmental Biology. 23 (9), 946-953 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유