Method Article
切り替え可能なプロトポルフィリンIX依存性活性酸素種のin situ光生成によるマウス皮膚における幹細胞ニッチの刺激と組織再生
要約
このプロトコルの目的は、マウスの皮膚で非致死レベルの活性酸素種(ROS)の一時的なin vivo産生を誘導し、組織内の生理学的応答をさらに促進することです。
要約
ここでは、マウス皮膚において内因性活性酸素種(ROS)の切り替え可能なin vivo光生成を誘導するためのプロトコルについて述べる。この一過性のROSのin situ産生は、幹細胞ニッチにおける細胞増殖を効率的に活性化し、熱傷治癒および毛包成長プロセスの促進を通じて強く現れる組織再生を刺激する。このプロトコルは、内因性光増感剤プロトポルフィリンIXの前駆体で組織を処理し、さらに厳密に制御された物理化学的パラメータの下で組織に赤色光を照射する調節可能な光線力学治療に基づいています。全体として、このプロトコルは、ROS生物学を分析するための興味深い実験ツールを構成します。
概要
活性酸素種(ROS)は、分子状酸素を化学的に還元して水を形成した結果であり、一重項酸素、スーパーオキシドアニオン、過酸化水素、およびヒドロキシルラジカル1,2,3が含まれます。ROSは、その非常に化学的反応性のために非常に短い寿命を有する。好気性生物では、ミトコンドリアの好気性呼吸(電子伝達系)の主要な漏出性副産物として、ROSが細胞内に偶然形成されます。細胞内の高レベルのROSの一時的な蓄積は、タンパク質、脂質および糖の不可逆的な不活性化およびDNA分子における突然変異の導入を引き起こす可能性のある酸化ストレス状態をもたらす2,3,4,5。細胞、組織、および生物全体における酸化的損傷の漸進的な蓄積は、時間とともに着実に増加し、細胞死プログラムの誘導、いくつかの病状、および老化プロセスに関連しています2,3,4,6。
好気性生物は、細胞や組織における過剰なROS蓄積に対処するための効率的な分子機構を着実に進化させてきました。これらのメカニズムには、分子状酸素と過酸化水素へのスーパーオキシドラジカル変異を触媒するスーパーオキシドジスムターゼ(SOD)タンパク質ファミリーのメンバー、および抗酸化プールを使用するさまざまなカタラーゼとペルオキシダーゼ(グルタチオン、NADPH、ペルオキシレドキシン、チオレドキシン7,8)が含まれますその後の過酸化水素の水および分子状酸素への変換を触媒します。
しかし、いくつかの報告は、増殖、分化、移動性などの重要な細胞機能を調節する分子回路の重要な構成要素としてのROSの役割を支持しています2,3,4。この概念は、リポキシゲナーゼ、シクロオキシゲナーゼ、NADPHオキシダーゼなど、好気性生物における専用のROS産生メカニズムの初期同定と特性評価によってさらに裏付けられています9,10。この意味で、ROSは脊椎動物の胚発生中に積極的な役割を果たし11、12、13、ショウジョウバエの造血前駆細胞の分化プログラム14、ゼブラフィッシュの治癒誘導、アフリカツメガエルの尾の再生など、さまざまな実験系で報告されています15.哺乳類では、ROSはニューロスフェアモデルにおける神経幹細胞の自己複製/分化能16および結腸直腸癌開始時の腸幹細胞機能の調節解除に関与しています17。皮膚では、ROSシグナル伝達は表皮分化と皮膚幹細胞ニッチおよび毛包成長サイクルの調節に関連しています18,19。
この観点から、正常状態または病理学的状態の両方における生物学的システムにおけるROSの生理学的役割を決定するための主要な実験的制限は、細胞および組織におけるこれらの分子の制御された産生を誘導するための適切な実験ツールの欠如であり、それらの生理学的産生に正確に類似しています第二のシグナル伝達メッセンジャーとして。現在、ほとんどの実験的アプローチは、主に過酸化水素の形での外因性ROSの投与を含む。我々は最近、内因性光増感剤プロトポルフィリンIX(PpIX;例えば、アミノラエブリン酸またはそのメチル誘導体メチルアミノレブリン酸)の前駆体を投与し、さらに赤色光を試料に照射して細胞内分子状酸素からのROSのその場形成を誘導することに基づいて、マウス皮膚における内因性ROSの一過性の非致死性in vivo産生をオンにする実験的アプローチを実施した(図1).この光線力学的手順は、常在する幹細胞ニッチを刺激するために効率的に使用され得、したがって、組織の再生プログラムを活性化し19、20、皮膚再生医療における新しい治療モダリティへの道を開く。ここでは、毛包19,21のバルジ領域における長期の5-ブロモ-2'-デオキシウリジン(BrdU)標識保持細胞(LRC)の数の増加、およびその後の一過性によって誘発される再生プログラムの活性化(発毛および火傷治癒プロセスの加速)として測定される幹細胞ニッチの刺激の代表例を示すプロトコルの詳細な説明を提示します。 C57Bl6マウス系統の皮膚における非致死性ROS産生。
プロトコル
すべてのマウス飼育および実験手順は、動物実験に関する地域、国内、国際的な法律およびガイドラインに準拠して実施する必要があります。
1.発毛の誘導、熱傷の誘発、および尾部皮膚上皮全体における長期BrdU LRCの同定
注:以下に説明する実験計画には、10日齢または7週齢のC57BL / 6マウス、できれば同腹仔を使用してください。すべての実験手順において、動物は3%イソフルラン吸入によって麻酔されるか、示されているように頸部脱臼によって安楽死させられます。
- 第2休止期(生後約50日目)におけるマウスの背部皮膚における発毛の誘導
- 3%イソフルランを吸入してマウスに麻酔をかける。ペダル反射の欠如(しっかりとしたつま先をつまむ)によって完全な深部麻酔を確認します。バリカンと脱毛クリームを使用して、各マウスの背中の皮膚の2つの独立した横並びの領域を剃ります(材料表)。左側をコントロールに、右側を治療に使用します。
注:剃毛後、このマウス系統のメラニン形成と成長期(成長)期への参入の指標である灰色/黒ではなく、鉃毛後の背中の皮膚がピンクがかっていることを確認してください。 - PBSで完全に洗浄して、すべてのクリームの残りを取り除き、セクション2.1で説明されているように、非致死性ROSレベルの一過性のin situ産生の誘導に進みます。.
- 各動物の対照および治療された背中の皮膚領域の高解像度画像を毎日取得することにより、毛包の成長を記録します(たとえば、5〜20倍の双眼レンズに結合されたHDカメラを使用)。
- 3%イソフルランを吸入してマウスに麻酔をかける。ペダル反射の欠如(しっかりとしたつま先をつまむ)によって完全な深部麻酔を確認します。バリカンと脱毛クリームを使用して、各マウスの背中の皮膚の2つの独立した横並びの領域を剃ります(材料表)。左側をコントロールに、右側を治療に使用します。
- 第2休止期(休止期)におけるマウスの背部皮膚における2度 熱傷病変の誘導(生後約50日目)
- マウスに麻酔をかける。バリカンと脱毛クリームを使用して各マウスの背中の皮膚領域全体を剃り、PBSで完全に洗浄して、すべてのクリームの残りを取り除きます。
注:燃焼手順の直前に、滅菌生理食塩水中のリドカイン0.5%(2 mg / ml)の皮下注射を7 mg / mlを超えない状態で投与します。. - 真ちゅう製の棒(断面1 cm)を沸騰水に浸して95°Cに予熱し、各マウスの背側後皮表面の中央領域に5秒間塗布します。
- 熱傷発生直後に、脱水症を防ぐために、電気毛布に1 mLの生理溶液(0.9%NaCl)を腹腔内注射します。動物を24時間回復させ、セクション2.3で説明されているように、非致死性ROSレベルの一過性のin situ産生の誘導に進みます。
- 各動物の対照および治療された背中の皮膚領域の高解像度画像を毎日取得することにより、火傷の進行を記録します(たとえば、5〜20倍の双眼レンズに結合されたHDカメラを使用)。
- マウスに麻酔をかける。バリカンと脱毛クリームを使用して各マウスの背中の皮膚領域全体を剃り、PBSで完全に洗浄して、すべてのクリームの残りを取り除きます。
- 尾部皮膚上皮における長期BrdU LRCの生成と同定
- 10/14日齢の同腹仔に腹腔内注射(麻酔なし)1日1回、4日間連続して、50 mg / kg体重のBrdUをPBSに溶解します。.標識段階の後、治療の前にマウスを50〜60日間成長させます。
注意: 注射ごとに新しい針を使用してください。 - 組織ホールマウントの調製前のさまざまな時点での尾部皮膚における一過性のin situ非致死性ROS産生の誘導については、セクション2.3で説明されているように進めます。.
- 尾表皮のホールマウントを準備するには、頸部脱臼によってマウスを安楽死させ、外科用ハサミで尾を切り取ります。
- メスを使って尾に沿って縦方向にまっすぐに切開し、背骨から皮膚全体を一枚として剥がします。皮をむいた皮膚を5 mLチューブ中のPBS中の5 mM EDTAで37°Cで4時間インキュベートし、鉗子を使用して無傷の表皮シートを真皮から慎重に分離します。
- 組織をPBS中の4%ホルムアルデヒド中で室温(RT)で少なくとも72時間固定し、適切な抗体を使用してBrdU検出に進みます。
- 蛍光/共焦点顕微鏡を使用して、組織ホールマウントの調製前の異なる時間における光制御および光線力学処理を含む、各実験条件におけるLRCを同定および定量します(前述の詳細19,20)。
注意: 固定された表皮シートは、0.02%アジ化ナトリウムを含むPBSで4°Cで最大3か月間保存できます。固定表皮シートは、標準的な組織学的切片手順に従って、必要なタンパク質の免疫局在化に使用できます。
- 10/14日齢の同腹仔に腹腔内注射(麻酔なし)1日1回、4日間連続して、50 mg / kg体重のBrdUをPBSに溶解します。.標識段階の後、治療の前にマウスを50〜60日間成長させます。
2. マウス皮膚における非致死性ROSレベルの一過性産生の誘導
注:マウスの皮膚で非致死的なROSレベルの一時的な生成を誘発するために、内因性光増感剤PpIXの前駆体を使用した光線力学的治療、この場合はメチルアミノレブリン酸(mALA)、および赤色光が使用されます。
- 背中の皮膚の発毛を誘導するための一時的なROS産生をオンにするには、セクション1.1に示すように動物を準備します。
- 右部に~25mgのmALAを局所クリーム(材料表)の形で塗布し、左側を個人差のない内部統制として保ちます。暗所で2.5時間インキュベートし、余分なクリームをPBSで完全に洗い流します。麻酔の深さを確認するには、完全に回復するまで10分ごとに動物を監視します。
注:背中の皮膚でのPpIXの生成は、青色光(407 nm)励起下での赤色蛍光によってその場でテストする必要があります。 - 動物に麻酔をかけます。
- 背中の皮膚全体に適切な赤色光源(材料表)を照射し、総線量は2.5〜4 J / cm2です。完全に回復するまでマウスを電気毛布の上に置き、手順1.1.3の説明に従って続行します。
注意: 放射照度は、光源と組織の間の距離を操作して調整し、電力エネルギーメーター(材料表)を使用して測定する必要があります。実験は、各動物の独立した剃毛領域のいずれかで完全な発毛が観察されたときに終了したと見なされます。全体の手順はたった1回の写真治療を含みます。
- 右部に~25mgのmALAを局所クリーム(材料表)の形で塗布し、左側を個人差のない内部統制として保ちます。暗所で2.5時間インキュベートし、余分なクリームをPBSで完全に洗い流します。麻酔の深さを確認するには、完全に回復するまで10分ごとに動物を監視します。
- 2度の 熱傷病変の治癒改善のために一時的なROS産生をオンにするには、セクション1.2に示すように動物を準備します。
- ~25 mgのmALAを局所クリームの形で、約4 mmの隣接組織を含む火傷した表面に沿って塗布します。暗所で2.5時間インキュベートし、余分なクリームをPBSで完全に洗い流します。麻酔の深さを確認するには、完全に回復するまで10分ごとに動物を監視します。
- 動物に麻酔をかけます。
- 背中の皮膚全体に適切な赤色光源を照射し、総線量は2.5〜4 J / cm2です。完全に回復するまでマウスを電気毛布の上に置き、手順1.2.4の説明に従って続行します。
注:各動物の実験手順は、完全な火傷の治癒が観察されたときに終了したと見なされます。全体の手順はたった1回の写真治療を含みます。
- 尾部皮膚における一過性のROS産生をオンにするには、セクション1.3に示すようにマウスを準備し、背部組織領域全体に局所クリームの形で~25 mgのmALAを塗布し、背中の皮膚についてはセクション2.1の説明に従って進めます。動物の安楽死の24時間、48時間、または72時間前に写真処理と対応する光制御を実行し、尾の皮膚全体のマウントをさらに抽出します。
注:すべての実験デザインにおいて、抗酸化性ROSスカベンジャーを使用してプロセスのROS依存性をアッセイします(例:.、mALA治療の5日前からPBS、pH 7.2の20 mg / mL溶液の腹腔内注射による100 mg / kg体重のN-アセチルシステインの毎日の接種、または、代わりに、50%エタノール中の100 mg / mLアスコルビン酸の2回の投与、 30分間間隔をあけて、mALA処置と赤色光照射との間の時間間隔で皮膚に局所適用した)。
3.皮膚のROS検出
- ヒドロエチジンを用いた光線力学処理後の尾部皮膚におけるROS産生のEx-vivo評価
注:ヒドロエチジンは、ROSと特異的に反応して蛍光色素2-ヒドロキシエチジウム(hET)を生成する非蛍光分子です。- セクション1.3.3に記載されているように得られた尾の皮全体を、PBS溶液(対照サンプル)またはさらに2 mM mALA(光線力学的処理サンプル)を含む5 mM EDTA中で37°Cで3時間インキュベートします。
- いずれの場合も、ジメチルスルホキシド(DMSO)中の25 mg/mLストックからヒドロエチジンを最終濃度3.2 μMまで添加し、室温で暗所で1時間インキュベートします。
- 尾部皮膚サンプルを指先でガラス表面上に伸ばし、10 J/cm2 フルエンスで636 nmの赤色光を照射します。
- すぐに表皮を真皮から分離し、セクション1.3.3で説明されているように表皮シートを固定します。
- 緑色の励起光を用いて蛍光/共焦点顕微鏡でhETの赤色発光を評価し、高品質の画像を撮影して、さらなる分析を進めます。
注:hET自動酸化のネガティブコントロールとして、光線力学的治療がない場合の組織サンプルのhET染色を使用してください。
- 発毛誘導と熱傷治癒と光線力学治療後の背部皮膚におけるROS産生のin vivo検出
注:このステップは、細胞内エステラーゼ酵素による切断後、ROSと特異的に反応して2',7'-ジクロロフルオレセイン(DCF)蛍光色素を与える細胞透過性非蛍光化合物である2',7'-ジクロロジヒドロフルオレセインジアセテート(DHF-DA)を使用して実行されます。- 発毛の誘導(セクション1.1)または火傷の治癒(セクション1.2)のために準備された動物を使用してください。局所mALAクリーム治療(セクション2.1および2.2を参照)の直前に、すべてのターゲットコントロール/治療された皮膚領域にDHF-DAの50%エタノール中の1 mg / mLの100 μLを局所的に分注し、皮膚に材料を完全に吸収させ、局所mALAクリームの塗布を進めます。
- 処理した動物を暗所で4時間インキュベートし、局所mALAクリームをPBSで皮膚から完全に洗い流し、100μLのDHF-DA溶液の2回目の用量を皮膚に分注します。麻酔の深さを確認するには、完全に回復するまで10分ごとに動物を監視します。
- 処理した動物を暗所で50分間インキュベートし、麻酔をかけ、LEDランプを使用して636nmの赤色光の2.5〜4 J / cm2 の範囲のフルエンスを背中の皮膚全体に照射します。
- 照射直後、in vivoイメージングシステムを用いて皮膚に発生したROSレベルを評価します(材料表)。フィルターボックスを445-490 nm励起と515-575 nm発光に設定し、高品質の画像をキャプチャして、さらなる分析に進みます。
注:DHF-DA自動酸化のネガティブコントロールとして、光線力学的治療がない場合の組織サンプルのDHF-DA染色を使用してください。
結果
マウスの背中と尾の皮膚にmALA前駆体を局所投与すると、青色光(407 nm)励起下でのこの化合物の赤みがかったピンク色の蛍光によって示されるように、組織全体、そして顕著なことに毛包にPpIXが有意に蓄積されます(図2A、C)。その後、2.5−4 J/cm 2のフルエンスで赤色光(636 nm)を治療した組織に照射すると、組織、特に毛包のバルジ領域におけるROSの一時的な産生が促進されます(図2B、D)。
in vivoでマウスの皮膚で非致死性ROS産生をオンにすると、光治療の2日後に毛包のバルジ領域にある体性幹細胞に分類されるLRCの数が大幅に増加します(図3、左パネル)。特に、LRC数の増加は一過性であり、治療後6日で正常なレベルに戻ります(図3、右パネル)。この領域はマウス皮膚の主要な幹細胞ニッチの1つであるため、この領域での細胞増殖の一時的な誘導は、主にバルジニッチの機能的活性化と、増殖と分化の常在幹細胞プログラムの機能的活性化を反映しています22,23。
バルジ毛包ニッチのROS依存性活性化は、皮膚における生理学的応答とさらに関連している。したがって、一過性のROS産生は、2度の熱傷後の皮膚の治癒プロセスを著しく加速します(図4A、B)。損傷/かさぶたの皮膚領域の漸進的な減少の定量化は、組織におけるPpIX依存性一過性ROS産生によって誘発される創傷治癒促進プロセスの堅牢性と統計的有意性を示しています(図4C)。同様に、非致死性ROSレベルは、毛包が成長刺激に応答するために難治性である段階である第2協調休止期(図5A)の間に剃毛後の発毛を強く促進し22,23、発毛を刺激する新しい化合物および/またはプロセスの可能性を評価する適切な方法を構成する。特に、アスコルビン酸(AA)のような抗酸化化合物を使用すると、発毛の加速を示す動物の数が統計的に有意に減少します(図5B)。加えて、光治療後の皮膚におけるROS産生は、皮膚におけるDHFの蛍光発光によって定量化され、抗酸化化合物によっても有意に減少する(図5C)。まとめると、これらの結果は、PpIXベースの光処理後のROS産生が、組織における生理学的応答を誘導するために厳密に必要とされることを示している。

図1:ヘム生合成経路を用いた細胞および組織におけるROSの内因性光力学的産生の制御されたオンの理論的背景。(A)光線力学処理中に分子状酸素励起をもたらす基本的な光化学反応の模式図。適切なλで光を吸収すると、基底状態S0の光増感分子(PS)は励起一重項状態S1に遷移する。いずれの励起状態も基底状態よりもエネルギー的に好ましくないので、分子は短時間でS0に戻る。ほとんどのPSは、S1から三重項状態T1への遷移に対して高い量子効率を有し、一般に比較的長い寿命によって特徴付けられる。励起三重項状態の活性化PSは、2つの異なる経路を介して他の分子と反応することができる。タイプIの光化学反応は、ラジカル種を形成するために隣接する分子に電子を移動させることです。これらのラジカルは、分子状酸素と反応して、スーパーオキシドアニオン(•O 2-)、過酸化水素(H 2 O2)およびヒドロキシルラジカル(•OH)を含むROSを生成する可能性が高い。タイプIIの光化学反応は、PDTで使用されるほとんどのPSの主要なプロセスを表しています。この反応の間、分子状酸素(基底状態での立体配置は三重項、3O2である)へのエネルギー(電子ではない)の移動は、非ラジカルであるが反応性の高い一重項酸素(1O2)の形成を促進する。これらの反応中に形成された光産物は、生化学的事象のカスケードを引き起こし、最終的に細胞死を引き起こすか、または細胞増殖を刺激する可能性のある酸化ストレスをもたらします。(B)5-アミノレブリン酸(ALA)は、ミトコンドリアと細胞質の両方の細胞コンパートメントを含むヘム生合成経路の天然前駆体です。ALA合成酵素活性は、この経路の最終産物である遊離ヘムがグリシンおよびスクシニルCoAからのALAの合成を阻害する負のフィードバック制御によって調節されます。外因性ALAまたはその誘導体であるアミノレブリン酸メチル(mALA)の投与は、調節フィードバックシステムをバイパスするため、下流の代謝産物、特にプロトポルフィリンIX(PpIX)が細胞内に蓄積され、光増感を誘導します。フェロケラターゼの律速特性により、PpIXにおける鉄挿入の触媒酵素は、この内因性PS化合物の蓄積を促進する。PBG = ポルフォビリノーゲン。この図はCarrascoら19から修正されています。この図の拡大版を表示するには、ここをクリックしてください。

図2:mALAと赤色光による光線力学治療は、皮膚にROSの一時的な産生を誘発します。 (A)背中の皮膚におけるmALAトピック治療後の内因性PpIXの蓄積。同じ動物における左側を対照として用いた。(B)左パネル:DHF-DAによるPpIX依存性ROS(mALA+光)産生のモニタリング。右パネル:背中の皮膚における相対的なROS産生の経時変化分析。各動物におけるmALA+光対光領域のDHF-DA蛍光発光の相対積分濃度を照射後の異なる時間に定量化し、方法論に記載されているように正規化した。SE±平均を表わした(各時点についてn=4)。(C)尾部皮膚におけるPpIXの局在(蛍光顕微鏡画像)。(D)hETによって明らかにされたmALA+Light後の尾部皮膚におけるROS産生は、毛包のバルジ領域における増加した持続的な蓄積を示す。代表的な共焦点顕微鏡画像(最大投影)を示します。スケールバー = 100 μm。この図はCarrascoら19から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。

図3:皮膚におけるin situROS産生のスイッチオンは、毛包ニッチのバルジ領域の幹細胞の有意な増加を促進する。 左パネル:マウス尾部皮膚全体のマウントにおけるBrdU標識保持細胞(LRC)の局在と、PpIXベースの光処理の2日後の毛包のバルジ領域におけるLRCの明らかな増加を示す代表的な共焦点顕微鏡画像(最大投影)。右パネル:毛包バルジ領域におけるLRC数の定量化。平均+SE(n = 4)で表される。スケールバー = 50 μm。この図はCarrascoら19から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。

図4:皮膚でin situ ROS産生をオンにすると、火傷の治癒が促進されます。 (A)対照試料と比較した、処理動物の熱傷部位におけるmALAによって誘導されるPpIX産生。(B)mALA +光処理動物および対照動物における火傷治癒進化。(C)mALA +軽処理動物における熱傷治癒の加速を示す火傷領域の時間経過定量化(左パネル)。非治癒領域の平均+SE(n=4)が表される。曲線下面積分析(右パネル)は、両方の時間経過曲線間の統計的差異を示しています(p ≤ 0.06)。この図はCarrascoら19から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
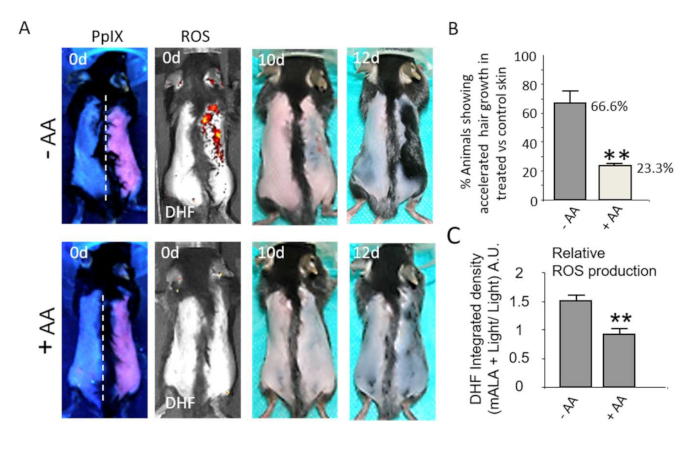
図5:皮膚でのin situROS産生のスイッチオンは、発毛を刺激します。 (A)上段:mALA+Lightによる難治性休止期(背部皮膚右側)と光制御領域(左側)の対比による発毛誘導。下段:皮膚でのROS産生とmALA+光による発毛促進の両方が、アスコルビン酸(AA)抗酸化作用によって抑制されます。(B)抗酸化剤AAの非存在下または存在下で対照領域と比較してmALA−PTにおいて加速された発毛を示す動物の割合の定量化(3回の独立した実験においてn=4)。(C)mALA-PT(n=4)中にAAによって誘導される背部皮膚におけるROS産生阻害の定量化。すべての場合において、バーは平均+ SEを表します。この図はCarrascoら19から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここでは、マウス皮膚における生体内の内因性ROS産生を一過性に活性化させ、生理的効果を発揮する方法論を提示する。この方法論は、内因性光増感剤PpIXの制御された局所刺激を誘導するための光力学的手順に基づいている(図1B)。この実験的アプローチは、in vivo実験システムでROS生物学を研究するための興味深いツールであり、外部ROS源(通常は過酸化水素)を使用し、組織/サンプルでのROSの制御された局所的な産生を可能にする方法論よりも大きな進歩を構成します。
アミノレブリン酸ベースの前駆体が細胞内のPpIXの蓄積を促進するために過剰に投与されることを考えると、この方法論の重要なステップは、損傷閾値を下回るが強い刺激効果を示す組織内のROSレベルの一時的な産生を誘発するための適切な光線量の確立である。現在、細胞や組織で産生されるあらゆる種類のROSの正確な量を直接定量する技術はありません。私たちの方法論では、所与の光線量、産生されるROSの正確な量、および所与の生物学的効果(例えば、細胞死または細胞増殖)との間の直接的な相関関係を確立することは依然として不可能である。このため、特定の実験モデルの光線量(フルエンス)は、各状況に選択した定性的または半定性的パラメータを使用して、研究者が経験的に確立する必要があります。マウスの皮膚の場合、細胞死と組織損傷の間の容易に測定可能な遷移と、有意で一時的な増殖波の誘導を選択します。
ここで紹介する方法論は、火傷の治癒や毛包の成長など、さまざまなプロセスでの皮膚再生の改善に非常に効果的であることが証明されています。これらの観察は、偶発的または慢性的な火傷および創傷の治療、または異なる病状の治療のための診療所におけるこの技術の治療的応用の実施への道を開く 皮膚、特に幹細胞機能の欠陥を伴う毛包の。
開示事項
この作業で説明されている手順のすべての商用アプリケーションは、EC、MIC、およびJEによって作成され、商業的利用のためにDerma Innovate SLにライセンス供与されたCSIC-UAM特許(EP2932967A1)によって保護されています。JEとJJMは、Derma Innovate SLのアドバイザリーポジションを持っています。
謝辞
この研究は、スペインの経済経済大臣(RTC-2014-2626-1からJE)およびサルドカルロスIII研究所(PI15/01458からJE)からの助成金によってサポートされています。ECは、Atracción de Talento Investigador grant 2017-T2/BMD-5766(Comunidad de Madrid and UAM)の支援を受けています。
資料
| Name | Company | Catalog Number | Comments |
| 2′,7′-Dichlorofluorescin diacetate | Sigma Aldrich | D6883-50MG | |
| 5'-bromo-2'-deoxiuridine | Sigma Aldrich | B5002-500MG | |
| Anti-Bromodeoxyuridine-Fluorescein | Roche | 11202693001 | |
| Depilatory cream (e.g., Veet) | Veet | ||
| Dihydroethidium | Sigma Aldrich | 37291-25MG | |
| In Vivo imaging system, e.g., IVIS Lumina 2 | Perkin Elmer | ||
| mALA in the form of topical cream, e.g.,METVIX Crema 160 mg/g | Galderma | ||
| Power energy meter (e.g., ThorLabs Model PM100D) | ThorLabs | ||
| Red light source, e.g., 636 nm Aktilite LED lamp | Photocure ASA |
参考文献
- Blázquez-Castro, A. Direct 1O2 optical excitation: A tool for redox biology. Redox Biology. 13, 39-59 (2017).
- Valko, M., et al. Free radicals and antioxidants in normal physiological functions and human disease. The International Journal of Biochemistry & Cell Biology. 39 (1), 44-84 (2007).
- Sena, L. A., Chandel, N. S. Physiological Roles of Mitochondrial Reactive Oxygen Species. Molecular Cell. 48 (2), 158-167 (2012).
- Bartosz, G. Reactive oxygen species: Destroyers or messengers. Biochemical Pharmacology. 77 (8), 1303-1315 (2009).
- Brieger, K., Schiavone, S., Miller, J., Krause, K. Reactive oxygen species: from health to disease. Swiss Medical Weekly. 142, 13659(2012).
- Speakman, J. R., Selman, C. The free-radical damage theory: Accumulating evidence against a simple link of oxidative stress to ageing and lifespan. BioEssays. 33 (4), 255-259 (2011).
- Fernandez, V., Videla, L. A. Biochemical aspects of cellular antioxidant systems. Biological Research. 29 (2), 177-182 (1996).
- Matés, J. M., Sánchez-Jiménez, F. Antioxidant enzymes and their implications in pathophysiologic processes. Frontiers in Bioscience. 4, 339-345 (1999).
- Bedard, K., Krause, K. -H. The NOX Family of ROS-Generating NADPH Oxidases: Physiology and Pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Leto, T. L., Morand, S., Hurt, D., Ueyama, T. Targeting and Regulation of Reactive Oxygen Species Generation by Nox Family NADPH Oxidases. Antioxidants & Redox Signaling. 11 (10), 2607-2619 (2009).
- Hernández-García, D., Wood, C. D., Castro-Obregón, S., Covarrubias, L. Reactive oxygen species: A radical role in development. Free Radical Biology and Medicine. 49 (2), 130-143 (2010).
- Covarrubias, L., Hernández-García, D., Schnabel, D., Salas-Vidal, E., Castro-Obregón, S. Function of reactive oxygen species during animal development: Passive or active. Developmental Biology. 320 (1), 1-11 (2008).
- Timme-Laragy, A. R., Hahn, M. E., Hansen, J. M., Rastogi, A., Roy, M. A. Redox stress and signaling during vertebrate embryonic development: Regulation and responses. Seminars in Cell & Developmental Biology. 80, 17-28 (2018).
- Owusu-Ansah, E., Banerjee, U. Reactive oxygen species prime Drosophila haematopoietic progenitors for differentiation. Nature. 461 (7263), 537-541 (2009).
- Love, N. R., et al. Amputation-induced reactive oxygen species are required for successful Xenopus tadpole tail regeneration. Nature Cell Biology. 15 (2), 222-228 (2013).
- Le Belle, J. E., et al. Proliferative Neural Stem Cells Have High Endogenous ROS Levels that Regulate Self-Renewal and Neurogenesis in a PI3K/Akt-Dependant Manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Myant, K. B., et al. production and NF-κB activation triggered by RAC1 facilitate WNT-driven intestinal stem cell proliferation and colorectal cancer initiation. Cell Stem Cell. 12 (6), 761-773 (2013).
- Hamanaka, R. B., et al. Mitochondrial Reactive Oxygen Species Promote Epidermal Differentiation and Hair Follicle Development. Science Signaling. 6 (261), 8(2013).
- Carrasco, E., et al. Photoactivation of ROS Production in situ Transiently Activates Cell Proliferation in Mouse Skin and in the hair Follicle Stem Cell Niche Promoting Hair Growth and Wound Healing. Journal of Investigative Dermatology. 135 (11), 1-12 (2015).
- Carrasco, E., Blázquez-Castro, A., Calvo, M. I., Juarranz, Á, Espada, J. Switching on a transient endogenous ROS production in mammalian cells and tissues. Methods. , 109(2016).
- Braun, K. M., et al. Manipulation of stem cell proliferation and lineage commitment: visualisation of label-retaining cells in wholemounts of mouse epidermis. Development. 130 (21), 5241-5255 (2003).
- Hsu, Y. -C., Li, L., Fuchs, E. Emerging interactions between skin stem cells and their niches. Nature Medicine. 20 (8), 847-856 (2014).
- Plikus, M. V., et al. Epithelial stem cells and implications for wound repair. Seminars in Cell & Developmental Biology. 23 (9), 946-953 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved