Method Article
Estimulación de nichos de células madre y regeneración de tejidos en piel de ratón mediante fotogeneración in situ dependiente de protoporfirina IX conmutable de especies reactivas de oxígeno
En este artículo
Resumen
El objetivo de este protocolo es inducir la producción transitoria in vivo de niveles no letales de especies reactivas de oxígeno (ROS) en la piel del ratón, promoviendo aún más las respuestas fisiológicas en el tejido.
Resumen
Aquí, describimos un protocolo para inducir la fotogeneración conmutable in vivo de especies endógenas reactivas de oxígeno (ROS) en la piel del ratón. Esta producción transitoria de ROS in situ activa eficientemente la proliferación celular en nichos de células madre y estimula la regeneración de tejidos, como se manifiesta fuertemente a través de la aceleración de los procesos de curación de quemaduras y crecimiento del folículo piloso. El protocolo se basa en un tratamiento fotodinámico regulable que trata el tejido con precursores del fotosensibilizador endógeno protoporfirina IX y posteriormente irradia el tejido con luz roja bajo parámetros fisicoquímicos estrictamente controlados. En general, este protocolo constituye una herramienta experimental interesante para analizar la biología de las ROS.
Introducción
Las especies reactivas de oxígeno (ROS) son el resultado de la reducción química del oxígeno molecular para formar agua, e incluyen oxígeno singlete, anión superóxido, peróxido de hidrógeno y el radical hidroxilo 1,2,3. Las ROS tienen una vida útil muy corta debido a su naturaleza extremadamente reactiva químicamente. En los organismos aeróbicos, las ROS se forman incidentalmente dentro de las células como un subproducto permeable importante de la respiración aeróbica (cadena de transporte de electrones) en las mitocondrias. La acumulación transitoria de altos niveles de ROS en la célula da lugar a una condición de estrés oxidativo que puede provocar la inactivación irreversible de proteínas, lípidos y azúcares y la introducción de mutaciones en la molécula de ADN 2,3,4,5. La acumulación gradual de daño oxidativo en células, tejidos y organismos enteros aumenta constantemente con el tiempo y se ha asociado con la inducción de programas de muerte celular, diversas patologías y el proceso de envejecimiento 2,3,4,6.
Los organismos aeróbicos han desarrollado constantemente mecanismos moleculares eficientes para hacer frente a la acumulación excesiva de ROS en células y tejidos. Estos mecanismos incluyen miembros de la familia de proteínas superóxido dismutasa (SOD), que catalizan la dismutación de radicales superóxido en oxígeno molecular y peróxido de hidrógeno, así como diferentes catalasas y peroxidasas que utilizan el grupo de antioxidantes (glutatión, NADPH, peroxirredoxina, tiorredoxina 7,8) para catalizar la posterior conversión del peróxido de hidrógeno en agua y oxígeno molecular.
Sin embargo, varios informes apoyan el papel de las ROS como componentes clave de los circuitos moleculares que regulan las funciones celulares críticas, incluyendo la proliferación, la diferenciación y la movilidad 2,3,4. Este concepto se ve respaldado por la identificación y caracterización inicial de mecanismos específicos de producción de ROS en organismos aeróbicos, incluidas las lipoxigenasas, las ciclooxigenasas y las NADPH oxidasas 9,10. En este sentido, las ROS exhiben un papel activo durante el desarrollo embrionario de vertebrados 11,12,13 y se han reportado roles clave para estas moléculas en la regulación de funciones fisiológicas específicas in vivo en diferentes sistemas experimentales, incluyendo el programa de diferenciación de progenitores hematopoyéticos en Drosophila14, la inducción de la cicatrización en el pez cebra o la regeneración de la cola en renacuajos de Xenopus 15. En mamíferos, las ROS han estado implicadas en el potencial de autorrenovación/diferenciación de las células madre neurales en un modelo de neurosfera16 y en la desregulación de la función de las células madre intestinales durante el inicio del cáncer colorrectal17. En la piel, la señalización de ROS se ha asociado con la diferenciación epidérmica y la regulación del nicho de células madre de la piel y el ciclo de crecimiento del folículo piloso18,19.
En esta perspectiva, una limitación experimental importante para determinar el papel fisiológico de las ROS en los sistemas biológicos, tanto en condiciones normales como patológicas, es la falta de herramientas experimentales adecuadas para inducir la producción controlada de estas moléculas en células y tejidos, asemejándose con precisión a su producción fisiológica como segundos mensajeros de señalización. En la actualidad, la mayoría de los enfoques experimentales implican la administración de ROS exógenas, principalmente en forma de peróxido de hidrógeno. Recientemente hemos implementado un enfoque experimental para activar una producción in vivo transitoria y no letal de ROS endógenas en la piel del ratón, basada en la administración de precursores del fotosensibilizador endógeno protoporfirina IX (PpIX; por ejemplo, ácido aminolaevulínico o su derivado metilo metilaminolevulinato) y una mayor irradiación de la muestra con luz roja para inducir la formación in situ de ROS a partir de oxígeno molecular intracelular (Figura 1). Este procedimiento fotodinámico puede ser utilizado eficientemente para estimular nichos de células madre residentes, activando así los programas regenerativos del tejido19,20 y abriendo el camino a nuevas modalidades terapéuticas en medicina regenerativa de la piel. Aquí, presentamos una descripción detallada del protocolo, mostrando ejemplos representativos de estimulación de nichos de células madre, medida como un aumento en el número de células retenedoras de la etiqueta 5-bromo-2'-desoxiuridina (BrdU) a largo plazo (LRC) en la región abultada del folículo piloso19,21, y la posterior activación de programas de regeneración (aceleración del crecimiento del cabello y procesos de cicatrización de quemaduras) inducidos por procesos transitorios, Producción de ROS no letales en la piel de la cepa de ratón C57Bl6.
Protocolo
Todos los procedimientos de cría y experimentación de ratones deben llevarse a cabo de conformidad con la legislación local, nacional e internacional y las directrices sobre experimentación animal.
1. Inducción del crecimiento del cabello, inducción de quemaduras e identificación de LRC BrdU a largo plazo en el epitelio de la piel de la cola
NOTA: Utilice ratones C57BL/6 de 10 o 7 semanas de edad, preferiblemente compañeros de camada, para los diseños experimentales que se describen a continuación. En todos los procedimientos experimentales, los animales serán anestesiados por inhalación de isoflurano al 3% o eutanasiados por luxación cervical según se indique.
- Inducción del crecimiento del pelo en la piel posterior de ratones en la segunda fase telógena (reposo) (alrededor del día 50 después del parto)
- Anestesiar ratones con inhalación de isoflurano al 3%. Confirmar la anestesia profunda completa por falta de reflejo pedal (pellizco firme del dedo del pie). Afeitar dos regiones independientes una al lado de la otra de la piel de la espalda en cada ratón utilizando cortapelos y crema depilatoria (Tabla de materiales). Use el lado izquierdo para el control y el lado derecho para el tratamiento.
NOTA: Compruebe que, después del afeitado, la piel subyacente del dorso es rosada y no gris/negra, un indicador de melanogénesis y entrada en la fase anágena (crecimiento) en esta cepa de ratón. - Lavar a fondo con PBS para eliminar todos los restos de crema y proceder a la inducción de la producción in situ transitoria de niveles de ROS no letales como se describe en la sección 2.1.
- Registre el crecimiento del folículo piloso a través de la adquisición diaria de imágenes de alta resolución de las áreas de control y de la piel de la espalda tratada en cada animal (por ejemplo, utilizando una cámara HD acoplada a una lente binocular de 5−20x).
- Anestesiar ratones con inhalación de isoflurano al 3%. Confirmar la anestesia profunda completa por falta de reflejo pedal (pellizco firme del dedo del pie). Afeitar dos regiones independientes una al lado de la otra de la piel de la espalda en cada ratón utilizando cortapelos y crema depilatoria (Tabla de materiales). Use el lado izquierdo para el control y el lado derecho para el tratamiento.
- Inducción de lesiones por quemaduras de2º grado en la piel posterior de ratones en la segunda fase telógena (reposo) (alrededor del día 50 después del parto)
- Anestesiar ratones. Afeitar toda la región de la piel de la espalda en cada ratón con un cortapelos y crema depilatoria y lavar bien con PBS para eliminar todos los restos de crema.
NOTA: Administrar inyecciones subcutáneas in situ de lidocaína al 0,5% (2 mg/ml) en solución salina estéril, que no exceda los 7 mg/ml, justo antes del procedimiento de quema. - Precalentar una barra de latón (1 cm de sección transversal) a 95 °C sumergiéndola en agua hirviendo y luego aplicarla en la región central de la superficie dorsal de la piel dorsal de cada ratón durante 5 s.
- Inmediatamente después de la generación de la quemadura, inyectar intraperitonealmente a los animales 1 ml de solución fisiológica (NaCl al 0,9%) en una manta eléctrica para evitar la deshidratación. Dejar que los animales se recuperen durante 24 h y proceder a la inducción de la producción in situ transitoria de niveles no letales de ROS como se describe en la sección 2.3.
- Registre la progresión de la herida por quemadura mediante la adquisición diaria de imágenes de alta resolución de las áreas de control y de la piel de la espalda tratada en cada animal (p. ej., utilizando una cámara HD acoplada a una lente binocular de 5−20x).
- Anestesiar ratones. Afeitar toda la región de la piel de la espalda en cada ratón con un cortapelos y crema depilatoria y lavar bien con PBS para eliminar todos los restos de crema.
- Generación e identificación de LRCs BrdU a largo plazo en el epitelio de la piel de la cola
- Inyectar a los compañeros de camada de 10/14 días de edad por vía intraperitoneal (sin anestesia) una vez al día durante 4 días consecutivos con 50 mg/kg de BrdU de peso corporal disueltos en PBS. Después de la fase de etiquetado, deje que los ratones crezcan durante 50-60 días antes de cualquier tratamiento.
NOTA: Use una aguja nueva para cada inyección. - Proceda como se describe en la sección 2.3 para la inducción de la producción transitoria in situ de ROS no letales en la piel de la cola en diferentes momentos antes de la preparación de los tejidos enteros.
- Para preparar montes enteros de epidermis de la cola, eutanasia a los ratones por dislocación cervical y cortar las colas con tijeras quirúrgicas.
- Use un bisturí para hacer una incisión longitudinal recta a lo largo de la cola y pele toda la piel como una sola pieza de la columna vertebral. Incubar la piel pelada en 5 mM de EDTA en PBS en tubos de 5 mL durante 4 h a 37 °C y separar cuidadosamente las láminas intactas de la epidermis de la dermis con unas pinzas.
- Fijar el tejido en formaldehído al 4% en PBS durante al menos 72 h a temperatura ambiente (RT) y proceder a la detección de BrdU utilizando los anticuerpos adecuados.
- Utilizar microscopía de fluorescencia/confocal para identificar y cuantificar las LRC en cada condición experimental, incluyendo controles de luz y tratamientos fotodinámicos en diferentes momentos antes de la preparación de los tejidos enteros, como se describió previamente en detalle19,20.
NOTA: Las láminas epidérmicas fijas pueden almacenarse en PBS que contengan azida sódica al 0,02% a 4 °C durante un máximo de tres meses. Las láminas epidérmicas fijas se pueden utilizar para la inmunolocalización de las proteínas requeridas siguiendo los procedimientos estándar de cortes histológicos.
- Inyectar a los compañeros de camada de 10/14 días de edad por vía intraperitoneal (sin anestesia) una vez al día durante 4 días consecutivos con 50 mg/kg de BrdU de peso corporal disueltos en PBS. Después de la fase de etiquetado, deje que los ratones crezcan durante 50-60 días antes de cualquier tratamiento.
2. Inducción de la producción transitoria de niveles no letales de ROS en la piel del ratón
NOTA: Para inducir la producción transitoria de niveles no letales de ROS en la piel del ratón, se utilizará un tratamiento fotodinámico utilizando un precursor del fotosensibilizador endógeno PpIX, en este caso, metil-aminolevulinato (mALA), y luz roja.
- Para activar la producción transitoria de ROS para la inducción del crecimiento del pelo en la piel dorsal, prepare a los animales como se indica en la sección 1.1.
- Aplicar ~25 mg de mALA en forma de crema tópica (Tabla de Materiales) en la región derecha, manteniendo el lado izquierdo como control interno evitando diferencias interindividuales. Incubar durante 2,5 h en la oscuridad, lavar bien el exceso de crema con PBS. Para confirmar la profundidad de la anestesia, monitoree a los animales cada 10 minutos hasta que se recuperen por completo.
NOTA: La producción de PpIX en la piel posterior debe probarse in situ mediante su fluorescencia roja bajo excitación con luz azul (407 nm). - Anestesiar a los animales.
- Irradiar toda la piel de la espalda con una fuente adecuada de luz roja (Tabla de materiales) para una dosis total de 2,5−4 J/cm2. Mantenga a los ratones en una manta eléctrica hasta su completa recuperación y proceda como se describe en el paso 1.1.3.
NOTA: La irradiancia debe ajustarse manipulando la distancia entre la fuente de luz y el tejido y medirse con un medidor de energía de potencia (Tabla de materiales). El experimento se considera finalizado cuando se observa un crecimiento completo del pelo en cualquiera de las regiones afeitadas independientes de cada animal. Todo el procedimiento implica un solo fototratamiento.
- Aplicar ~25 mg de mALA en forma de crema tópica (Tabla de Materiales) en la región derecha, manteniendo el lado izquierdo como control interno evitando diferencias interindividuales. Incubar durante 2,5 h en la oscuridad, lavar bien el exceso de crema con PBS. Para confirmar la profundidad de la anestesia, monitoree a los animales cada 10 minutos hasta que se recuperen por completo.
- Para activar la producción transitoria de ROS para mejorar la cicatrización de las lesiones por quemaduras de2º grado, prepare a los animales como se indica en la sección 1.2.
- Aplique ~ 25 mg de mALA en forma de crema tópica a lo largo de la superficie quemada, abarcando aproximadamente 4 mm de tejido adyacente. Incubar durante 2,5 h en la oscuridad, lavar bien el exceso de crema con PBS. Para confirmar la profundidad de la anestesia, monitoree a los animales cada 10 minutos hasta que se recuperen por completo.
- Anestesiar a los animales.
- Irradiar toda la piel de la espalda con una fuente adecuada de luz roja para una dosis total de 2,5−4 J/cm2. Mantenga a los ratones sobre una manta eléctrica hasta su completa recuperación y proceda como se describe en el paso 1.2.4.
NOTA: El procedimiento experimental para cada animal se considera finalizado cuando se observa la cicatrización completa de la quemadura. Todo el procedimiento implica un solo fototratamiento.
- Para activar la producción transitoria de ROS en la piel de la cola, prepare ratones como se indica en la sección 1.3, aplique ~25 mg de mALA en forma de crema tópica a lo largo de toda la zona del tejido dorsal y proceda como se describe en la sección 2.1 para la piel de la espalda. Realizar tratamientos fotográficos y controles de luz correspondientes 24 h, 48 h o 72 h antes de la eutanasia animal y la posterior extracción de la piel de la cola de las monturas enteras.
NOTA: En todos los diseños experimentales, ensayar la dependencia de ROS del proceso mediante el uso de eliminadores antioxidantes de ROS (p. ej., inoculación diaria de 100 mg/kg de N-acetilcisteína de peso corporal mediante inyección intraperitoneal de una solución de 20 mg/ml en PBS, pH 7,2, a partir de 5 días antes de los tratamientos con mALA o, alternativamente, dos dosis de 100 mg/ml de ácido ascórbico en etanol al 50%, espaciado 30 min, aplicado tópicamente sobre la piel en el intervalo de tiempo entre los tratamientos con mALA y la irradiación con luz roja).
3. Detección de ROS en la piel
- Evaluación ex vivo de la producción de ROS en la piel de la cola después del tratamiento fotodinámico con hidroetidina
NOTA: La hidroetidina es una molécula no fluorescente que reacciona específicamente con ROS para producir colorante fluorescente 2-hidroxietidio (hET).- Incubar las pieles enteras de la cola, obtenidas como se describe en la sección 1.3.3, durante 3 h a 37 °C en 5 mM de EDTA en solución de PBS (muestras de control) o conteniendo adicionalmente 2 mM mALA (muestras de tratamiento fotodinámico).
- En todos los casos, añadir hidroetidina hasta una concentración final de 3,2 μM a partir de un stock de 25 mg/ml en dimetilsulfóxido (DMSO) e incubar durante 1 h en la oscuridad a RT.
- Estire las muestras de piel de la cola sobre una superficie de vidrio con las yemas de los dedos e irradie con luz roja de 636 nm a una fluencia de 10 J/cm2 .
- Proceda inmediatamente a separar la epidermis de la dermis y a fijar las láminas epidérmicas como se describe en la sección 1.3.3.
- Evalúe la emisión de rojo hET bajo un microscopio de fluorescencia/confocal utilizando luz verde excitante, capture imágenes de alta calidad y proceda con un análisis adicional.
NOTA: Utilice la tinción con hET de muestras de tejido en ausencia de tratamiento fotodinámico como control negativo de la autooxidación de hET.
- Detección in vivo de la producción de ROS en la piel de la espalda después de la inducción del crecimiento del cabello y la cicatrización de quemaduras seguida de un tratamiento fotodinámico
NOTA: Este paso se realiza utilizando diacetato de 2′,7′-diclorodihidrofluoresceína (DHF-DA), un compuesto no fluorescente permeable de células que, después de la escisión por enzimas esterasas intracelulares, reacciona específicamente con ROS dando el colorante fluorescente 2′,7′-diclorofluoresceína (DCF).- Utilice animales preparados para la inducción del crecimiento del cabello (sección 1.1) o la cicatrización de quemaduras (sección 1.2). Justo antes de los tratamientos tópicos con mALA en crema (ver secciones 2.1 y 2.2), dispensar tópicamente 100 μl de 1 mg/ml en etanol al 50% de DHF-DA en todas las zonas de control o tratadas de la piel objetivo, dejar que la piel absorba completamente el material y continuar con la aplicación tópica de mALA crema.
- Incubar a los animales tratados durante 4 h en la oscuridad, lavar bien la crema tópica de mALA de la piel con PBS y dispensar una segunda dosis de 100 μL de solución de DHF-DA sobre la piel. Para confirmar la profundidad de la anestesia, monitoree a los animales cada 10 minutos hasta que se recuperen por completo.
- Incubar a los animales tratados durante 50 min en la oscuridad, anestesiar e irradiar toda la piel del dorso con una fluencia que oscile entre 2,5 y 4 J/cm2 de luz roja de 636 nm utilizando una lámpara LED.
- Inmediatamente después de la irradiación, evaluar los niveles de ROS generados en la piel utilizando un sistema de imagen in vivo (Tabla de Materiales). Configure la caja de filtro para una excitación de 445−490 nm y una emisión de 515−575 nm, capture imágenes de alta calidad y proceda con un análisis adicional.
NOTA: Utilice la tinción de DHF-DA de muestras de tejido en ausencia de tratamiento fotodinámico como control negativo para la autooxidación de DHF-DA.
Resultados
La administración tópica del precursor mALA en la piel de la espalda y la cola del ratón da lugar a una acumulación significativa de PpIX en todo el tejido y, notablemente, en el folículo piloso, como lo demuestra la fluorescencia de color rosa rojizo de este compuesto bajo excitación con luz azul (407 nm) (Figura 2A,C). La irradiación posterior del tejido tratado con luz roja (636 nm) a una fluencia de 2,5−4 J/cm2 promueve la producción transitoria de ROS en el tejido, particularmente en la región abultada del folículo piloso (Figura 2B,D).
La activación de la producción no letal de ROS en la piel de ratón in vivo promueve un aumento significativo en el número de LRC, categorizadas como células madre somáticas, en la región abultada del folículo piloso dos días después de los fototratamientos (Figura 3, paneles izquierdos). Cabe destacar que el aumento en el número de LRC es transitorio, restableciendo a niveles normales 6 días después de los tratamientos (Figura 3, panel derecho). Como esta región es uno de los principales nichos de células madre en la piel del ratón, una inducción transitoria de la proliferación celular en esta región refleja principalmente la activación funcional del nicho del bulbo y de los programas de proliferación y diferenciación de las células madre residentes22,23.
La activación dependiente de ROS del nicho del folículo piloso abultado se asocia además con respuestas fisiológicas en la piel. Por lo tanto, la producción transitoria de ROS acelera notablemente el proceso de curación de la piel después de una quemadura de2º grado (Figura 4A, B). La cuantificación de la reducción gradual del área de la piel dañada/costrosa demuestra la robustez y la importancia estadística del proceso de aceleración de la cicatrización de heridas inducido por la producción transitoria de ROS dependiente de PpIX en el tejido (Figura 4C). De la misma manera, los niveles de ROS no letales promueven fuertemente el crecimiento del cabello después del afeitado durante el segundo telógeno coordinado (Figura 5A), fase durante la cual el folículo piloso es refractario para responder a los estímulos de crecimiento22,23, constituyendo una forma adecuada de evaluar el potencial de nuevos compuestos y/o procesos para estimular el crecimiento del cabello. En particular, el uso de compuestos antioxidantes como el ácido ascórbico (AA) da como resultado una reducción estadísticamente significativa en el número de animales que muestran un crecimiento acelerado del pelo (Figura 5B). Además, la producción de ROS en la piel después de los fototratamientos, cuantificada por la emisión fluorescente de DHF en la piel, también se reduce significativamente gracias a los compuestos antioxidantes (Figura 5C). En conjunto, estos resultados demuestran que la producción de ROS después de los fototratamientos basados en PpIX es estrictamente necesaria para inducir una respuesta fisiológica en el tejido.

Figura 1: Antecedentes teóricos para la activación controlada de la producción fotodinámica endógena de ROS in situ en células y tejidos utilizando la vía biosintética hemo. (A) Representación esquemática de las reacciones fotoquímicas básicas que dan lugar a la excitación molecular del oxígeno durante los tratamientos fotodinámicos. Tras la absorción de la luz con el λ apropiado, una molécula fotosensibilizadora (PS) en el estado fundamental S0 experimenta una transición a un estado singlete excitado S1. Dado que cualquier estado excitado es energéticamente menos preferible que el estado fundamental, la molécula vuelve a S0 después de un corto período de tiempo. La mayoría de los PS tienen una alta eficiencia cuántica para la transición de S 1 al estado triplete T1, generalmente caracterizado por una vida útil relativamente larga. La PS activada en el estado de triplete excitado puede reaccionar con otras moléculas a través de dos vías diferentes. Una reacción fotoquímica de tipo I es la transferencia de electrones a moléculas adyacentes para formar especies radicales; es probable que estos radicales reaccionen con el oxígeno molecular para producir ROS, incluido el anión superóxido (•O2-), el peróxido de hidrógeno (H2O2) y el radical hidroxilo (•OH). Una reacción fotoquímica de tipo II representa el proceso dominante para la mayoría de los PS empleados en PDT. Durante esta reacción, la transferencia de energía (no electrones) al oxígeno molecular (cuya configuración en el estado fundamental es el triplete, 3O 2) impulsa la formación del oxígeno singlete no radical pero altamente reactivo (1O2). Los fotoproductos formados durante estas reacciones desencadenan una cascada de eventos bioquímicos que dan lugar a un estrés oxidativo que finalmente provoca la muerte celular o que potencialmente puede estimular el crecimiento celular. (B) El ácido 5-aminolevulínico (ALA) es un precursor natural en la vía biosintética del hemo, que involucra los compartimentos celulares mitocondriales y citosólicos. La actividad de la enzima ALA sintasa está regulada por un control de retroalimentación negativa mediante el cual el hemo libre, el producto final de esta vía, inhibe la síntesis de ALA a partir de glicina y succinil CoA. La administración de ALA exógeno o su derivado metil aminolevulinato (mALA) elude el sistema de retroalimentación reguladora, de modo que los metabolitos posteriores, especialmente la protoporfirina IX (PpIX), se acumulan en la célula induciendo la fotosensibilización. Las características limitantes de la velocidad de la ferroquelatasa, enzima catalizadora de la inserción de hierro en PpIX, promueven la acumulación de este compuesto endógeno de PS. PBG = porfobilinógeno. Esta figura ha sido modificada a partir de Carrasco et al.19. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: El tratamiento fotodinámico con mALA y luz roja induce la producción transitoria de ROS en la piel. (A) Acumulación de PpIX endógeno después del tratamiento tópico de mALA en la piel de la espalda. El lado izquierdo en el mismo animal se utilizó como control. (B) Panel izquierdo: Producción de ROS dependiente de PpIX (mALA+Light) monitoreada por DHF-DA. Panel derecho: análisis de la evolución temporal de la producción relativa de ROS en la piel dorsal; la densidad relativa integrada de la emisión fluorescente de DHF-DA de las regiones mALA+Luz frente a la Luz en cada animal se cuantificó en diferentes momentos después de la irradiación y se normalizó como se describe en la metodología. Se representó la media ± SE (n = 4 para cada punto de tiempo). (C) Localización de PpIX en la piel de la cola (imágenes de microscopía de fluorescencia). (D) Producción de ROS en la piel de la cola después de mALA+Light según lo revelado por hET que muestra una acumulación aumentada y sostenida en la región abultada del folículo piloso. Se muestran imágenes representativas de microscopía confocal (proyecciones máximas). Barra de escala = 100 μm. Esta figura ha sido modificada a partir de Carrasco et al.19. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: La activación de la producción de ROS in situ en la piel promueve un aumento significativo de células madre en la región abultada del nicho del folículo piloso. Paneles izquierdos: imágenes representativas de microscopía confocal (proyecciones máximas) que muestran la localización de las células retenedoras de la etiqueta BrdU (LRC) en montajes enteros de piel de cola de ratón y el evidente aumento de LRC en la región abultada de los folículos pilosos 2 días después de los fototratamientos basados en PpIX. Panel derecho: cuantificación del número de LRC en la región del abultamiento del folículo piloso. Se representa la media + SE (n = 4). Barra de escala = 50 μm. Esta figura ha sido modificada a partir de Carrasco et al.19. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: La activación de la producción de ROS in situ en la piel acelera la cicatrización de las quemaduras. (A) Producción de PpIX inducida por mALA en regiones lesionadas por quemaduras en animales tratados en comparación con muestras de control. (B) Evolución de la curación de quemaduras en animales tratados con mALA+Light y control. (C) Cuantificación de la evolución temporal de las zonas quemadas (panel izquierdo) que muestra una cicatrización acelerada de las quemaduras en animales tratados con mALA+Light; se representa la media + SE (n = 4) del área no cicatrizada. Análisis de área bajo la curva (panel derecho) que demuestra diferencias estadísticas entre ambas curvas de curso temporal (p ≤ 0,06). Esta figura ha sido modificada a partir de Carrasco et al.19. Haga clic aquí para ver una versión más grande de esta figura.
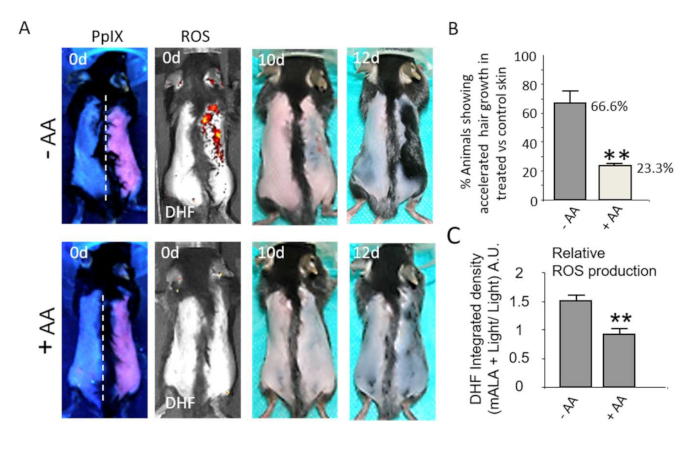
Figura 5: La activación de la producción de ROS in situ en la piel estimula el crecimiento del vello. (A) Fila superior: Inducción del crecimiento del cabello durante la fase telógena refractaria por mALA + Luz (lado derecho de la piel dorsal) en comparación con la región de control de luz (lado izquierdo). Fila inferior: Tanto la producción de ROS en la piel como la aceleración del crecimiento del cabello inducida por mALA+Light son inhibidas por el tratamiento antioxidante con ácido ascórbico (AA). (B) Cuantificación del % de animales que muestran un crecimiento acelerado del pelo en mALA-PT en comparación con la región de control en ausencia o presencia del antioxidante AA (n = 4 en 3 experimentos independientes). (C) Cuantificación de la inhibición de la producción de ROS en la piel dorsal inducida por AA durante mALA-PT (n = 4). En todos los casos, las barras representan la media + SE. Esta figura ha sido modificada a partir de Carrasco et al.19. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí, presentamos una metodología que permite una activación transitoria de la producción endógena de ROS in vivo en la piel del ratón con efectos fisiológicos. La metodología se basa en un procedimiento fotodinámico para inducir una estimulación controlada y local del fotosensibilizador endógeno PpIX (Figura 1B). Este enfoque experimental es una herramienta interesante para estudiar la biología de las ROS en sistemas experimentales in vivo, constituyendo un avance significativo sobre las metodologías que utilizan fuentes externas de ROS (generalmente peróxido de hidrógeno) y permitiendo la producción controlada y local de ROS en el tejido/muestra.
Dado que los precursores a base de aminolevulinato se administran en exceso para promover la acumulación de PpIX dentro de las células, un paso crítico en esta metodología es el establecimiento de una dosis de luz adecuada para inducir la producción transitoria de niveles de ROS en el tejido por debajo del umbral de daño, pero mostrando un fuerte efecto estimulante. Actualmente no existen tecnologías disponibles para cuantificar directamente la cantidad exacta de cualquier tipo de ROS que se produce en células y tejidos. En nuestra metodología, todavía no es posible establecer una correlación directa entre una dosis de luz dada, la cantidad exacta de ROS producida y un efecto biológico dado (por ejemplo, muerte celular o proliferación celular). Por esta razón, la dosis de luz (fluencia) para cualquier modelo experimental en particular debe ser establecida empíricamente por el investigador utilizando parámetros cualitativos o semicualitativos de elección para cada situación. En el caso de la piel de ratón, elegimos una transición fácilmente medible entre la muerte celular y el daño tisular y la inducción de una onda proliferativa significativa y transitoria.
La metodología aquí presentada ha demostrado ser muy eficaz en la mejora de la regeneración de la piel en diferentes procesos, incluyendo la cicatrización de quemaduras y el crecimiento del folículo piloso. Estas observaciones allanan el camino para la implementación de aplicaciones terapéuticas de esta tecnología en clínicas para el tratamiento de quemaduras y heridas incidentales o crónicas o para diferentes patologías de la piel y, particularmente, del folículo piloso que impliquen un funcionamiento defectuoso de las células madre.
Divulgaciones
Todas las aplicaciones comerciales de los procedimientos descritos en este trabajo están protegidas por una patente (EP2932967A1) del CSIC-UAM firmada por EC, MIC y JE y licenciada a Derma Innovate SL para su explotación comercial. JE y JJM tienen un puesto de asesor en Derma Innovate SL.
Agradecimientos
Este trabajo ha sido financiado por subvenciones del Ministerio de Economía y Competitividad (RTC-2014-2626-1 a JE) y del Instituto de Salud Carlos III (PI15/01458 a JE) de España. EC ha contado con el apoyo de la beca Atracción de Talento Investigador 2017-T2/BMD-5766 (Comunidad de Madrid y UAM).
Materiales
| Name | Company | Catalog Number | Comments |
| 2′,7′-Dichlorofluorescin diacetate | Sigma Aldrich | D6883-50MG | |
| 5'-bromo-2'-deoxiuridine | Sigma Aldrich | B5002-500MG | |
| Anti-Bromodeoxyuridine-Fluorescein | Roche | 11202693001 | |
| Depilatory cream (e.g., Veet) | Veet | ||
| Dihydroethidium | Sigma Aldrich | 37291-25MG | |
| In Vivo imaging system, e.g., IVIS Lumina 2 | Perkin Elmer | ||
| mALA in the form of topical cream, e.g.,METVIX Crema 160 mg/g | Galderma | ||
| Power energy meter (e.g., ThorLabs Model PM100D) | ThorLabs | ||
| Red light source, e.g., 636 nm Aktilite LED lamp | Photocure ASA |
Referencias
- Blázquez-Castro, A. Direct 1O2 optical excitation: A tool for redox biology. Redox Biology. 13, 39-59 (2017).
- Valko, M., et al. Free radicals and antioxidants in normal physiological functions and human disease. The International Journal of Biochemistry & Cell Biology. 39 (1), 44-84 (2007).
- Sena, L. A., Chandel, N. S. Physiological Roles of Mitochondrial Reactive Oxygen Species. Molecular Cell. 48 (2), 158-167 (2012).
- Bartosz, G. Reactive oxygen species: Destroyers or messengers. Biochemical Pharmacology. 77 (8), 1303-1315 (2009).
- Brieger, K., Schiavone, S., Miller, J., Krause, K. Reactive oxygen species: from health to disease. Swiss Medical Weekly. 142, 13659(2012).
- Speakman, J. R., Selman, C. The free-radical damage theory: Accumulating evidence against a simple link of oxidative stress to ageing and lifespan. BioEssays. 33 (4), 255-259 (2011).
- Fernandez, V., Videla, L. A. Biochemical aspects of cellular antioxidant systems. Biological Research. 29 (2), 177-182 (1996).
- Matés, J. M., Sánchez-Jiménez, F. Antioxidant enzymes and their implications in pathophysiologic processes. Frontiers in Bioscience. 4, 339-345 (1999).
- Bedard, K., Krause, K. -H. The NOX Family of ROS-Generating NADPH Oxidases: Physiology and Pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Leto, T. L., Morand, S., Hurt, D., Ueyama, T. Targeting and Regulation of Reactive Oxygen Species Generation by Nox Family NADPH Oxidases. Antioxidants & Redox Signaling. 11 (10), 2607-2619 (2009).
- Hernández-García, D., Wood, C. D., Castro-Obregón, S., Covarrubias, L. Reactive oxygen species: A radical role in development. Free Radical Biology and Medicine. 49 (2), 130-143 (2010).
- Covarrubias, L., Hernández-García, D., Schnabel, D., Salas-Vidal, E., Castro-Obregón, S. Function of reactive oxygen species during animal development: Passive or active. Developmental Biology. 320 (1), 1-11 (2008).
- Timme-Laragy, A. R., Hahn, M. E., Hansen, J. M., Rastogi, A., Roy, M. A. Redox stress and signaling during vertebrate embryonic development: Regulation and responses. Seminars in Cell & Developmental Biology. 80, 17-28 (2018).
- Owusu-Ansah, E., Banerjee, U. Reactive oxygen species prime Drosophila haematopoietic progenitors for differentiation. Nature. 461 (7263), 537-541 (2009).
- Love, N. R., et al. Amputation-induced reactive oxygen species are required for successful Xenopus tadpole tail regeneration. Nature Cell Biology. 15 (2), 222-228 (2013).
- Le Belle, J. E., et al. Proliferative Neural Stem Cells Have High Endogenous ROS Levels that Regulate Self-Renewal and Neurogenesis in a PI3K/Akt-Dependant Manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Myant, K. B., et al. production and NF-κB activation triggered by RAC1 facilitate WNT-driven intestinal stem cell proliferation and colorectal cancer initiation. Cell Stem Cell. 12 (6), 761-773 (2013).
- Hamanaka, R. B., et al. Mitochondrial Reactive Oxygen Species Promote Epidermal Differentiation and Hair Follicle Development. Science Signaling. 6 (261), 8(2013).
- Carrasco, E., et al. Photoactivation of ROS Production in situ Transiently Activates Cell Proliferation in Mouse Skin and in the hair Follicle Stem Cell Niche Promoting Hair Growth and Wound Healing. Journal of Investigative Dermatology. 135 (11), 1-12 (2015).
- Carrasco, E., Blázquez-Castro, A., Calvo, M. I., Juarranz, Á, Espada, J. Switching on a transient endogenous ROS production in mammalian cells and tissues. Methods. , 109(2016).
- Braun, K. M., et al. Manipulation of stem cell proliferation and lineage commitment: visualisation of label-retaining cells in wholemounts of mouse epidermis. Development. 130 (21), 5241-5255 (2003).
- Hsu, Y. -C., Li, L., Fuchs, E. Emerging interactions between skin stem cells and their niches. Nature Medicine. 20 (8), 847-856 (2014).
- Plikus, M. V., et al. Epithelial stem cells and implications for wound repair. Seminars in Cell & Developmental Biology. 23 (9), 946-953 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados