Method Article
Estimulação de nichos de células-tronco e regeneração tecidual em pele de camundongo por fotogeração dependente de protoporfirina IX comutável de espécies reativas de oxigênio in situ
Neste Artigo
Resumo
O objetivo deste protocolo é induzir a produção transitória in vivo de níveis não letais de espécies reativas de oxigênio (EROs) na pele de camundongos, promovendo ainda mais respostas fisiológicas no tecido.
Resumo
Aqui, descrevemos um protocolo para induzir fotogeração in vivo comutável de espécies reativas endógenas de oxigênio (ROS) em pele de camundongos. Essa produção transitória de ERO in situ ativa eficientemente a proliferação celular em nichos de células-tronco e estimula a regeneração tecidual, fortemente manifestada através da aceleração dos processos de cicatrização de queimaduras e crescimento de folículos pilosos. O protocolo é baseado em um tratamento fotodinâmico regulável que trata o tecido com precursores do fotossensibilizador endógeno protoporfirina IX e irradia o tecido com luz vermelha sob parâmetros físico-químicos rigorosamente controlados. De modo geral, este protocolo constitui uma ferramenta experimental interessante para analisar a biologia das EROs.
Introdução
As espécies reativas de oxigênio (EROs) são o resultado da redução química do oxigênio molecular para formar água, e incluem o oxigênio singlete, o ânion superóxido, o peróxido de hidrogênio e o radical hidroxila 1,2,3. As ROS têm uma vida útil muito curta devido à sua natureza extremamente química reativa. Em organismos aeróbios, as ERO são formadas incidentalmente no interior das células como um importante subproduto da respiração aeróbica (cadeia de transporte de elétrons) nas mitocôndrias. O acúmulo transitório de altos níveis de ERO na célula resulta em uma condição de estresse oxidativo que pode provocar a inativação irreversível de proteínas, lipídios e açúcares e a introdução de mutações na molécula de DNA 2,3,4,5. O acúmulo gradual de dano oxidativo em células, tecidos e organismos inteiros aumenta progressivamente com o tempo e tem sido associado à indução de programas de morte celular, diversas patologias e ao processo de envelhecimento 2,3,4,6.
Os organismos aeróbios têm desenvolvido constantemente mecanismos moleculares eficientes para combater o acúmulo excessivo de ERO em células e tecidos. Esses mecanismos incluem membros da família de proteínas superóxido dismutase (SOD), que catalisam a dismutação do radical superóxido em oxigênio molecular e peróxido de hidrogênio, bem como diferentes catalases e peroxidases que utilizam o pool antioxidante (glutationa, NADPH, peroxirredoxina, tiorredoxina 7,8) para catalisar a subsequente conversão de peróxido de hidrogênio em água e oxigênio molecular.
No entanto, vários relatos suportam o papel das ROS como componentes-chave de circuitos moleculares que regulam funções celulares críticas, incluindo proliferação, diferenciação emobilidade2,3,4. Esse conceito é ainda apoiado pela identificação e caracterização inicial de mecanismos dedicados produtores de ERO em organismos aeróbios, incluindo lipoxigenases ciclooxigenases e NADPH oxidases 9,10. Nesse sentido, as ERO exibem um papel ativo durante o desenvolvimento embrionário de vertebrados 11,12,13 e papéis fundamentais para essas moléculas na regulação de funções fisiológicas específicas in vivo têm sido relatados em diferentes sistemas experimentais, incluindo o programa de diferenciação de progenitores hematopoéticos em Drosophila14, indução de cura em zebrafish ou regeneração da cauda em girinos de Xenopus 15. Em mamíferos, as ROS têm sido envolvidas no potencial de auto-renovação/diferenciação de células-tronco neurais em um modelo de neuroesfera16 e na desregulação da função das células-tronco intestinais durante o início do câncer colorretal17. Na pele, a sinalização das ERO tem sido associada à diferenciação epidérmica e à regulação do nicho de células-tronco cutâneas e do ciclo de crescimento dos folículos pilosos18,19.
Nessa perspectiva, uma grande limitação experimental para determinar os papéis fisiológicos das ROS em sistemas biológicos, tanto em condições normais quanto patológicas, é a falta de ferramentas experimentais adequadas para induzir a produção controlada dessas moléculas em células e tecidos, assemelhando-se com precisão à sua produção fisiológica como mensageiros de segunda sinalização. Atualmente, a maioria das abordagens experimentais envolve a administração de ERO exógenas, principalmente na forma de peróxido de hidrogênio. Recentemente, implementamos uma abordagem experimental para ativar uma produção in vivo transitória e não letal de ROS endógenas na pele de camundongos, baseada na administração de precursores do fotossensibilizador endógeno protoporfirina IX (PpIX; por exemplo, ácido aminolaevulínico ou seu derivado metílico metilaminolevulinato) e posterior irradiação da amostra com luz vermelha para induzir a formação in situ de ROS a partir de oxigênio molecular intracelular (Figura 1). Esse procedimento fotodinâmico pode ser eficientemente utilizado para estimular nichos de células-tronco residentes, ativando os programas regenerativos do tecido19,20 e abrindo caminho para novas modalidades terapêuticas na medicina regenerativa da pele. Aqui, apresentamos uma descrição detalhada do protocolo, mostrando exemplos representativos de estimulação de nichos de células-tronco, medida como um aumento no número de células de retenção de marcação (LRCs) de 5-bromo-2'-desoxiuridina (BrdU) a longo prazo na região do abaulamento do folículo piloso19,21, e subsequente ativação de programas de regeneração (aceleração do crescimento do cabelo e processos de cicatrização de queimaduras) induzidos por produção não letal de ERO na pele da linhagem C57Bl6 de camundongos.
Protocolo
Todos os procedimentos de criação e experimentação de camundongos devem ser conduzidos em conformidade com a legislação local, nacional, internacional e diretrizes sobre experimentação animal.
1. Indução do crescimento de pelos, indução de queimaduras e identificação de LRCs de BrdU a longo prazo no epitélio da pele da cauda íntegra
NOTA: Utilizar camundongos C57BL/6 com 10 dias ou 7 semanas de idade, preferencialmente ninhadas, para os planejamentos experimentais descritos abaixo. Em todos os procedimentos experimentais, os animais serão anestesiados por inalação de isoflurano a 3% ou eutanasiados por luxação cervical conforme indicado.
- Indução do crescimento de pelos na pele posterior de camundongos na segunda fase telógena (repouso) (cerca de 50 dias pós-natal)
- Anestesiar camundongos com inalação de isoflurano a 3%. Confirme a anestesia profunda completa pela falta de um reflexo pedal (pinça firme do dedo do pé). Faça a barba de duas regiões independentes lado a lado da pele posterior em cada mouse usando cortadores de cabelo e creme depilatório (Tabela de Materiais). Use o lado esquerdo para o controle e o lado direito para o tratamento.
NOTA: Verifique se, após o barbear, a pele subjacente do dorso está rósea e não acinzentada/preta, um indicador de melanogênese e entrada na fase anágena (crescente) nesta cepa de camundongo. - Lavar cuidadosamente com PBS para remover todos os restos de creme e proceder à indução da produção transitória in situ de níveis não letais de ROS, conforme descrito na secção 2.1.
- Registre o crescimento do folículo piloso através da aquisição diária de imagens de alta resolução das áreas de controle e da pele das costas tratadas em cada animal (por exemplo, usando uma câmera HD acoplada a uma lente binocular de 5 a 20x).
- Anestesiar camundongos com inalação de isoflurano a 3%. Confirme a anestesia profunda completa pela falta de um reflexo pedal (pinça firme do dedo do pé). Faça a barba de duas regiões independentes lado a lado da pele posterior em cada mouse usando cortadores de cabelo e creme depilatório (Tabela de Materiais). Use o lado esquerdo para o controle e o lado direito para o tratamento.
- Indução de lesões de queimadura de2º grau na pele posterior de camundongos na segunda fase telógena (repouso) (cerca de 50 dias pós-natal)
- Anestesiar camundongos. Faça a barba em toda a região da pele das costas em cada rato usando cortadores de cabelo e creme depilatório e lave bem com PBS para remover todos os restos de creme.
OBS: Administrar injeções subcutâneas in situ de lidocaína a 0,5% (2 mg/ml) em soro fisiológico estéril, não excedendo 7 mg/ml, imediatamente antes do procedimento de queimadura. - Pré-aqueça uma barra de latão (1 cm em secção transversal) a 95 °C imergindo em água fervente e, em seguida, aplique na região central da superfície dorsal da pele dorsal de cada rato durante 5 s.
- Logo após a geração da queimadura, injetar intraperitonealmente os animais com 1 mL de solução fisiológica (NaCl a 0,9%) em manta elétrica para evitar a desidratação. Deixar que os animais se recuperem durante 24 h e proceder à indução da produção transitória in situ de níveis não letais de ROS, conforme descrito no ponto 2.3.
- Registre a progressão da ferida por queimadura por meio da aquisição diária de imagens de alta resolução das áreas de pele das costas controladas e tratadas em cada animal (por exemplo, usando uma câmera HD acoplada a uma lente binocular de 5 a 20 vezes).
- Anestesiar camundongos. Faça a barba em toda a região da pele das costas em cada rato usando cortadores de cabelo e creme depilatório e lave bem com PBS para remover todos os restos de creme.
- Geração e identificação de LRCs de BrdU de longa duração no epitélio cutâneo da cauda
- Injetar ninhadas de 10/14 dias por via intraperitoneal (sem anestesia) uma vez por dia durante 4 dias consecutivos com 50 mg/kg de peso corporal BrdU dissolvido em PBS. Após a fase de marcação, permita que os ratos cresçam durante 50 a 60 dias antes de qualquer tratamento.
NOTA: Use uma agulha nova para cada injeção. - Proceder como descrito na secção 2.3 para a indução da produção transitória de ROS não letais in situ na pele da cauda em diferentes momentos antes da preparação de montagens inteiras de tecido.
- Para preparar montagens inteiras da epiderme da cauda, eutanasie camundongos por deslocamento cervical e prenda a cauda com tesoura cirúrgica.
- Use um bisturi para fazer uma incisão longitudinal reta ao longo de toda a cauda e descasque toda a pele como uma única peça da espinha dorsal. Incubar a pele descascada em EDTA 5 mM em PBS em tubos de 5 mL por 4 h a 37 °C e separar cuidadosamente as folhas intactas da epiderme da derme usando pinças.
- Fixar o tecido em formaldeído a 4% em PBS por pelo menos 72 h à temperatura ambiente (TR) e proceder à detecção de BrdU usando anticorpos apropriados.
- Utilizar fluorescência/microscopia confocal para identificar e quantificar LRCs em cada condição experimental, incluindo controles de luz e tratamentos fotodinâmicos em diferentes momentos antes da preparação dos tecidos inteiros, como descrito anteriormente em detalhes19,20.
NOTA: As folhas epidérmicas fixas podem ser armazenadas em PBS contendo azida sódica a 0,02% a 4 °C por até três meses. Lâminas epidérmicas fixas podem ser usadas para imunolocalização das proteínas necessárias seguindo procedimentos de cortes histológicos padrão.
- Injetar ninhadas de 10/14 dias por via intraperitoneal (sem anestesia) uma vez por dia durante 4 dias consecutivos com 50 mg/kg de peso corporal BrdU dissolvido em PBS. Após a fase de marcação, permita que os ratos cresçam durante 50 a 60 dias antes de qualquer tratamento.
2. Indução da produção transitória de níveis não letais de ROS na pele de camundongos
OBS: Para induzir a produção transitória de níveis não letais de ROS na pele de camundongos, será utilizado um tratamento fotodinâmico utilizando um precursor do fotossensibilizador endógeno PpIX, no caso, metil-aminolevulinato (mALA), e luz vermelha.
- Para activar a produção transitória de ROS para a indução do crescimento de pelos na pele posterior, prepare os animais conforme indicado no ponto 1.1.
- Aplicar ~25 mg de mALA na forma de creme tópico (Tabela de Materiais) na região direita, mantendo o lado esquerdo como controle interno evitando diferenças interindividuais. Incubar por 2,5 h no escuro, lavar bem o excesso de creme com PBS. Para confirmar a profundidade da anestesia, monitorar os animais a cada 10 minutos até a recuperação total.
NOTA: A produção de PpIX na pele posterior deve ser testada in situ pela sua fluorescência vermelha sob excitação de luz azul (407 nm). - Anestesiar os animais.
- Irradiar toda a pele do dorso com uma fonte de luz vermelha adequada (Tabela de Materiais) para uma dose total de 2,5−4 J/cm2. Manter os ratinhos numa manta eléctrica até à sua recuperação completa e proceder como descrito no passo 1.1.3.
NOTA: A irradiância deve ser ajustada manipulando-se a distância entre a fonte de luz e o tecido e medida usando um medidor de energia de potência (Tabela de Materiais). O experimento é considerado terminado quando o crescimento total de pelos é observado em qualquer uma das regiões independentes raspadas de cada animal. Todo o procedimento envolve apenas um único tratamento fotográfico.
- Aplicar ~25 mg de mALA na forma de creme tópico (Tabela de Materiais) na região direita, mantendo o lado esquerdo como controle interno evitando diferenças interindividuais. Incubar por 2,5 h no escuro, lavar bem o excesso de creme com PBS. Para confirmar a profundidade da anestesia, monitorar os animais a cada 10 minutos até a recuperação total.
- Para ativar a produção transitória de ROS para melhorar a cicatrização de lesões de queimadura de2º grau, prepare os animais conforme indicado na seção 1.2.
- Aplicar ~25 mg de mALA na forma de creme tópico em toda a superfície queimada, abrangendo cerca de 4 mm de tecido adjacente. Incubar por 2,5 h no escuro, lavar bem o excesso de creme com PBS. Para confirmar a profundidade da anestesia, monitorar os animais a cada 10 minutos até a recuperação total.
- Anestesiar os animais.
- Irradiar toda a pele do dorso com uma fonte de luz vermelha adequada para uma dose total de 2,5−4 J/cm2. Manter os ratinhos sobre uma manta eléctrica até à sua recuperação completa e proceder como descrito no passo 1.2.4.
OBS: O procedimento experimental para cada animal é considerado concluído quando se observa a cicatrização completa da queimadura. Todo o procedimento envolve apenas um único tratamento fotográfico.
- Para ativar a produção transitória de ROS na pele da cauda, prepare ratinhos conforme indicado na secção 1.3, aplique ~25 mg de mALA sob a forma de creme tópico ao longo de toda a área do tecido dorsal e proceda como descrito na secção 2.1 para a pele posterior. Realizar tratamentos fotográficos e controles de luz correspondentes 24 h, 48 h ou 72 h antes da eutanásia do animal e posterior extração de montagens inteiras da pele da cauda.
NOTA: Em todos os delineamentos experimentais, testar a dependência de ROS do processo usando removedores de ROS antioxidantes (por exemplo, inoculação diária de 100 mg/kg de peso corporal de N-acetil-cisteína por injeção intraperitoneal de uma solução de 20 mg/mL em PBS, pH 7,2, começando 5 dias antes dos tratamentos com mALA ou, alternativamente, duas doses de 100 mg/mL de ácido ascórbico em etanol a 50%, espaçado 30 min, aplicado topicamente sobre a pele no intervalo de tempo entre os tratamentos com mALA e a irradiação com luz vermelha).
3. Detecção de ERO na pele
- Avaliação ex vivo da produção de ERO na pele da cauda após tratamento fotodinâmico com hidroetidina
NOTA: A hidroetidina é uma molécula não fluorescente que reage especificamente com ROS para produzir o corante fluorescente 2-hidroxietídio (hET).- Incubar peles inteiras da cauda, obtidas como descrito no ponto 1.3.3, durante 3 h a 37 °C em EDTA 5 mM em solução PBS (amostras de controlo) ou adicionalmente contendo 2 mM mALA (amostras de tratamento fotodinâmico).
- Em todos os casos, adicionar hidroetidina a uma concentração final de 3,2 μM a partir de um estoque de 25 mg/mL em dimetilsulfóxido (DMSO) e incubar por 1 h no escuro em TR.
- Esticar as amostras de pele da cauda sobre uma superfície de vidro usando as pontas dos dedos e irradiar com luz vermelha de 636 nm a uma fluência de 10 J/cm2 .
- Proceder imediatamente à separação da epiderme da derme e à fixação das lâminas epidérmicas conforme descrito no ponto 1.3.3.
- Avalie a emissão vermelha de hET sob um microscópio de fluorescência/confocal usando luz verde excitante, capture imagens de alta qualidade e prossiga com análises adicionais.
NOTA: Usar a coloração hET de amostras de tecido na ausência de tratamento fotodinâmico como um controle negativo para a auto-oxidação de hET.
- Detecção in vivo da produção de ERO na pele posterior após indução do crescimento do cabelo e cicatrização de queimaduras seguida de tratamento fotodinâmico
NOTA: Esta etapa é realizada usando diacetato de 2',7'-diclorodihidrofluoresceína (DHF-DA), um composto não fluorescente persignificado celular que, após clivagem por enzimas esterases intracelulares, reage especificamente com ROS dando o corante fluorescente 2′,7′-diclorofluoresceína (DCF).- Utilizar animais preparados para a indução do crescimento de pelos (secção 1.1) ou para a cicatrização de queimaduras (secção 1.2). Imediatamente antes dos tratamentos tópicos com creme de mALA (ver secções 2.1 e 2.2), dispense topicamente 100 μL de 1 mg/ml em etanol a 50% de DHF-DA em todas as áreas de pele alvo de controlo/tratadas, deixe a pele absorver totalmente o material e prossiga com a aplicação tópica de creme de mALA.
- Incubar os animais tratados durante 4 h no escuro, lavar bem o creme mALA tópico da pele com PBS e dispensar uma segunda dose de 100 μL de solução de DHF-DA na pele. Para confirmar a profundidade da anestesia, monitorar os animais a cada 10 minutos até a recuperação total.
- Incubar os animais tratados por 50 min no escuro, anestesiar e irradiar toda a pele do dorso com uma fluência variando de 2,5 a 4 J/cm2 de luz vermelha de 636 nm usando uma lâmpada LED.
- Imediatamente após a irradiação, avaliar os níveis de ROS gerados na pele usando um sistema de imagem in vivo (Tabela de Materiais). Ajuste a caixa de filtro para excitação de 445−490 nm e emissão de 515−575 nm, capture imagens de alta qualidade e prossiga com análises adicionais.
NOTA: Utilizar a coloração DHF-DA de amostras de tecido na ausência de tratamento fotodinâmico como controle negativo para a auto-oxidação de DHF-DA.
Resultados
A administração tópica do precursor mALA na pele do dorso e da cauda de camundongos resulta em acúmulo significativo de PpIX em todo o tecido e, visivelmente, no folículo piloso, como demonstrado pela fluorescência vermelho-rósea desse composto sob excitação à luz azul (407 nm) (Figura 2A,C). A irradiação subsequente do tecido tratado com luz vermelha (636 nm) a uma fluência de 2,5−4 J/cm2 promove a produção transitória de ERO no tecido, particularmente na região do abaulamento do folículo piloso (Figura 2B,D).
A ativação da produção de ERO não letais na pele de camundongos in vivo promove um aumento significativo no número de LRCs, categorizadas como células-tronco somáticas, na região do abaulamento do folículo piloso dois dias após os fototratamentos (Figura 3, painéis à esquerda). Notadamente, o aumento do número de LRCs é transitório, retornando aos níveis normais 6 dias após os tratamentos (Figura 3, painel direito). Como essa região é um dos principais nichos de células-tronco na pele de camundongos, uma indução transitória de proliferação celular nessa região reflete principalmente a ativação funcional do nicho do bojo e dos programas de proliferação e diferenciação de células-tronco residentes22,23.
A ativação dependente de ROS do nicho do folículo piloso protuberante está ainda associada a respostas fisiológicas na pele. Assim, a produção transitória de ERO acelera notavelmente o processo de cicatrização da pele após uma queimadura de2º grau (Figura 4A,B). A quantificação da redução gradual da área da pele lesada/crosta demonstra a robustez e a significância estatística do processo de aceleração da cicatrização induzido pela produção transitória de ERO dependente de PpIX no tecido (Figura 4C). Da mesma forma, os níveis não letais de ERO promovem fortemente o crescimento dos cabelos após o tricotomia durante o segundo telógeno coordenado (Figura 5A), fase em que o folículo piloso é refratário para responder aos estímulos de crescimento22,23, constituindo uma maneira adequada de avaliar o potencial de novos compostos e/ou processos para estimular o crescimento capilar. Notavelmente, o uso de compostos antioxidantes como o ácido ascórbico (AA) resulta em uma redução estatisticamente significativa no número de animais com crescimento acelerado de pelos (Figura 5B). Além disso, a produção de ERO na pele após fototratamentos, quantificada pela emissão fluorescente de FHD na pele, também é significativamente reduzida por compostos antioxidantes (Figura 5C). Em conjunto, esses resultados demonstram que a produção de ERO após fototratamentos à base de PpIX é estritamente necessária para induzir uma resposta fisiológica no tecido.

Figura 1: Fundamentação teórica para o acionamento controlado da produção fotodinâmica endógena de ROS in situ em células e tecidos utilizando a via biossintética do heme. (A) Representação esquemática das reações fotoquímicas básicas que resultam em excitação molecular de oxigênio durante tratamentos fotodinâmicos. Após a absorção da luz com o λ apropriado, uma molécula fotossensibilizadora (PS) no estado fundamental S0 sofre uma transição para um estado singlete excitado S1. Como qualquer estado excitado é energeticamente menos preferível do que o estado fundamental, a molécula retorna a S0 após um curto período de tempo. A maioria dos PS tem uma alta eficiência quântica para a transição de S 1 para o estado triplete T1, geralmente caracterizada por uma vida útil relativamente longa. O PS ativado no estado triplete excitado pode reagir com outras moléculas através de duas vias diferentes. Uma reação fotoquímica do tipo I é a transferência de elétrons para moléculas adjacentes para formar espécies de radicais; é provável que estes radicais reajam com oxigénio molecular para produzir ROS, incluindo ânion superóxido (•O 2-), peróxido de hidrogénio (H 2 O2) e radical hidroxila (•OH). A reação fotoquímica tipo II representa o processo dominante para a maioria dos PS empregados na TFD. Durante esta reação, a transferência de energia (não elétrons) para o oxigênio molecular (cuja configuração no estado fundamental é o tripleto, 3O 2) impulsiona a formação do oxigênio singlete não radical, mas altamente reativo (1O2). Os fotoprodutos formados durante essas reações desencadeiam uma cascata de eventos bioquímicos resultando em um estresse oxidativo que finalmente causa morte celular ou que pode potencialmente estimular o crescimento celular. (B) O ácido 5-aminolevulínico (ALA) é um precursor natural da via biossintética do heme, que envolve compartimentos celulares mitocondriais e citosólicos. A atividade da enzima ALA sintase é regulada por um controle de feedback negativo pelo qual o heme livre, o produto final desta via, inibe a síntese de ALA a partir de glicina e succinil CoA. A administração de ALA exógeno ou seu derivado aminolevulinato de metila (mALA) ignora o sistema de feedback regulatório, de modo que metabólitos a jusante, especialmente protoporfirina IX (PpIX), são acumulados na célula induzindo a fotossensibilização. As características limitantes da taxa de ferroquelatase, enzima catalisadora da inserção de ferro em PpIX, promovem o acúmulo deste composto PS endógeno. PBG = porfobilinogênio. Esse valor foi modificado de Carrasco et al.19. Clique aqui para ver uma versão maior desta figura.

Figura 2: O tratamento fotodinâmico com mALA e luz vermelha induz a produção transitória de ERO na pele. (A) Acúmulo de PpIX endógeno após tratamento tópico com mALA na pele do dorso. O lado esquerdo do mesmo animal foi utilizado como controle. (B) Painel esquerdo: Produção de ROS dependente de PpIX (mALA+Light) monitorada por DHF-DA. Painel direito: análise temporal-curso da produção relativa de ERO na pele dorsal; a densidade relativa integrada da emissão fluorescente de FHD-DA das regiões mALA+Luz versus Luz em cada animal foi quantificada em diferentes tempos após a irradiação e normalizada conforme descrito na metodologia. A média ± AE foi representada (n = 4 para cada momento). (C) Localização da PpIX na pele da cauda (imagens de microscopia de fluorescência). (D) Produção de ERO na pele da cauda após mALA+Light revelada pelo hET mostrando um acúmulo aumentado e sustentado na região da protuberância do folículo piloso. Imagens representativas de microscopia confocal (projeções máximas) são mostradas. Barra de escala = 100 μm. Esse valor foi modificado de Carrasco et al.19. Clique aqui para ver uma versão maior desta figura.

Figura 3: A ativação da produção in situ de ERO na pele promove um aumento significativo de células-tronco na região do abaulamento do nicho do folículo piloso. Painéis esquerdos: imagens representativas de microscopia confocal (projeções máximas) mostrando a localização de células retentoras de BrdU (LRC) em montagens inteiras da pele da cauda de camundongos e o evidente aumento de LRC na região do abaulamento dos folículos pilosos 2 dias após fototratamentos à base de PpIX. Painel direito: quantificação do número de LRC na região do abaulamento do folículo piloso. A média + EP (n = 4) está representada. Barra de escala = 50 μm. Esse valor foi modificado de Carrasco et al.19. Clique aqui para ver uma versão maior desta figura.

Figura 4: Ativar a produção de ERO in situ na pele acelera a cicatrização de queimaduras. (A) Produção de PpIX induzida por mALA em regiões queimadas em animais tratados em comparação com amostras controle. (B) Evolução da cicatrização de queimaduras em animais tratados com mALA+Light e controle. (C) Quantificação tempo-curso das áreas queimadas (painel esquerdo) mostrando cicatrização acelerada em animais tratados com mALA+Light; a média + EP (n = 4) da área não cicatrizada é representada. Análise de área sob a curva (painel direito) demonstrando diferenças estatísticas entre as duas curvas tempo-curso (p ≤ 0,06). Esse valor foi modificado de Carrasco et al.19. Clique aqui para ver uma versão maior desta figura.
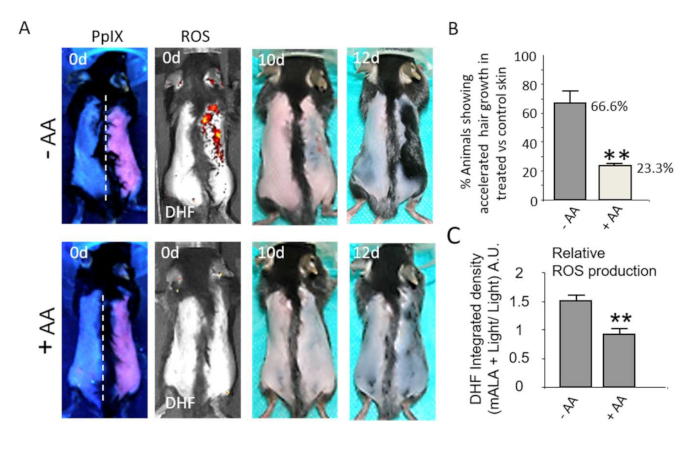
Figura 5: Ativar a produção in situ de ROS na pele estimula o crescimento do cabelo. (A) Linha superior: indução do crescimento de pelos durante a fase telógena refratária por mALA+Light (lado direito da pele dorsal) em comparação com a região controle de luz (lado esquerdo). Linha inferior: Tanto a produção de ROS na pele quanto a aceleração do crescimento do cabelo induzida pelo mALA+Light são inibidas pelo tratamento antioxidante com ácido ascórbico (AA). (B) Quantificação da % de animais com crescimento acelerado de pelos em mALA-PT em relação à região controle na ausência ou presença do antioxidante AA (n = 4 em 3 experimentos independentes). (C) Quantificação da inibição da produção de ERO na pele dorsal induzida por AA durante mALA-PT (n = 4). Em todos os casos, as barras representam média + EP. Esse valor foi modificado de Carrasco et al.19. Clique aqui para ver uma versão maior desta figura.
Discussão
Aqui, apresentamos uma metodologia que permite uma ativação transitória da produção endógena de ERO in vivo em pele de camundongo com efeitos fisiológicos. A metodologia baseia-se em um procedimento fotodinâmico para induzir uma estimulação local e controlada do fotossensibilizador endógeno PpIX (Figura 1B). Esta abordagem experimental é uma ferramenta interessante para estudar a biologia de ROS em sistemas experimentais in vivo, constituindo um avanço significativo sobre metodologias que utilizam fontes externas de ROS (geralmente peróxido de hidrogênio) e permitindo a produção controlada e local de ROS no tecido/amostra.
Dado que precursores à base de aminolevulinato são administrados em excesso para promover o acúmulo de PpIX dentro das células, uma etapa crítica nessa metodologia é o estabelecimento de uma dose de luz adequada para induzir a produção transitória de níveis de ERO no tecido abaixo do limiar de dano, mas mostrando um forte efeito estimulatório. Atualmente não existem tecnologias disponíveis para quantificar diretamente a quantidade exata de qualquer tipo de ERO que é produzido em células e tecidos. Em nossa metodologia, ainda não é possível estabelecer uma correlação direta entre uma dada dose de luz, a quantidade exata de ERO produzida e um dado efeito biológico (por exemplo, morte celular ou proliferação celular). Por essa razão, a dose de luz (fluência) para qualquer modelo experimental em particular deve ser estabelecida empiricamente pelo pesquisador utilizando parâmetros qualitativos ou semiqualitativos de escolha para cada situação. No caso da pele de camundongo, optamos por uma transição facilmente mensurável entre morte celular e dano tecidual e a indução de uma onda proliferativa significativa e transitória.
A metodologia aqui apresentada mostrou-se muito eficaz na melhora da regeneração da pele em diferentes processos, incluindo a cicatrização de queimaduras e o crescimento de folículos pilosos. Essas observações abrem caminho para a implementação de aplicações terapêuticas dessa tecnologia em clínicas para o tratamento de queimaduras e feridas incidentais ou crônicas ou para diferentes patologias da pele e, particularmente, do folículo piloso envolvendo um funcionamento defeituoso das células-tronco.
Divulgações
Todas as aplicações comerciais dos procedimentos descritos neste trabalho estão protegidas por uma patente CSIC-UAM (EP2932967A1) de autoria da EC, MIC e JE e licenciada à Derma Innovate SL para exploração comercial. JE e JJM têm uma posição consultiva na Derma Innovate SL.
Agradecimentos
Este trabalho foi apoiado por subsídios do Ministerio de Economía y Competitividad (RTC-2014-2626-1 para JE) e Instituto de Salud Carlos III (PI15/01458 para JE) da Espanha. A EC foi apoiada pela bolsa Atracción de Talento Investigador 2017-T2/BMD-5766 (Comunidade de Madrid e UAM).
Materiais
| Name | Company | Catalog Number | Comments |
| 2′,7′-Dichlorofluorescin diacetate | Sigma Aldrich | D6883-50MG | |
| 5'-bromo-2'-deoxiuridine | Sigma Aldrich | B5002-500MG | |
| Anti-Bromodeoxyuridine-Fluorescein | Roche | 11202693001 | |
| Depilatory cream (e.g., Veet) | Veet | ||
| Dihydroethidium | Sigma Aldrich | 37291-25MG | |
| In Vivo imaging system, e.g., IVIS Lumina 2 | Perkin Elmer | ||
| mALA in the form of topical cream, e.g.,METVIX Crema 160 mg/g | Galderma | ||
| Power energy meter (e.g., ThorLabs Model PM100D) | ThorLabs | ||
| Red light source, e.g., 636 nm Aktilite LED lamp | Photocure ASA |
Referências
- Blázquez-Castro, A. Direct 1O2 optical excitation: A tool for redox biology. Redox Biology. 13, 39-59 (2017).
- Valko, M., et al. Free radicals and antioxidants in normal physiological functions and human disease. The International Journal of Biochemistry & Cell Biology. 39 (1), 44-84 (2007).
- Sena, L. A., Chandel, N. S. Physiological Roles of Mitochondrial Reactive Oxygen Species. Molecular Cell. 48 (2), 158-167 (2012).
- Bartosz, G. Reactive oxygen species: Destroyers or messengers. Biochemical Pharmacology. 77 (8), 1303-1315 (2009).
- Brieger, K., Schiavone, S., Miller, J., Krause, K. Reactive oxygen species: from health to disease. Swiss Medical Weekly. 142, 13659(2012).
- Speakman, J. R., Selman, C. The free-radical damage theory: Accumulating evidence against a simple link of oxidative stress to ageing and lifespan. BioEssays. 33 (4), 255-259 (2011).
- Fernandez, V., Videla, L. A. Biochemical aspects of cellular antioxidant systems. Biological Research. 29 (2), 177-182 (1996).
- Matés, J. M., Sánchez-Jiménez, F. Antioxidant enzymes and their implications in pathophysiologic processes. Frontiers in Bioscience. 4, 339-345 (1999).
- Bedard, K., Krause, K. -H. The NOX Family of ROS-Generating NADPH Oxidases: Physiology and Pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Leto, T. L., Morand, S., Hurt, D., Ueyama, T. Targeting and Regulation of Reactive Oxygen Species Generation by Nox Family NADPH Oxidases. Antioxidants & Redox Signaling. 11 (10), 2607-2619 (2009).
- Hernández-García, D., Wood, C. D., Castro-Obregón, S., Covarrubias, L. Reactive oxygen species: A radical role in development. Free Radical Biology and Medicine. 49 (2), 130-143 (2010).
- Covarrubias, L., Hernández-García, D., Schnabel, D., Salas-Vidal, E., Castro-Obregón, S. Function of reactive oxygen species during animal development: Passive or active. Developmental Biology. 320 (1), 1-11 (2008).
- Timme-Laragy, A. R., Hahn, M. E., Hansen, J. M., Rastogi, A., Roy, M. A. Redox stress and signaling during vertebrate embryonic development: Regulation and responses. Seminars in Cell & Developmental Biology. 80, 17-28 (2018).
- Owusu-Ansah, E., Banerjee, U. Reactive oxygen species prime Drosophila haematopoietic progenitors for differentiation. Nature. 461 (7263), 537-541 (2009).
- Love, N. R., et al. Amputation-induced reactive oxygen species are required for successful Xenopus tadpole tail regeneration. Nature Cell Biology. 15 (2), 222-228 (2013).
- Le Belle, J. E., et al. Proliferative Neural Stem Cells Have High Endogenous ROS Levels that Regulate Self-Renewal and Neurogenesis in a PI3K/Akt-Dependant Manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Myant, K. B., et al. production and NF-κB activation triggered by RAC1 facilitate WNT-driven intestinal stem cell proliferation and colorectal cancer initiation. Cell Stem Cell. 12 (6), 761-773 (2013).
- Hamanaka, R. B., et al. Mitochondrial Reactive Oxygen Species Promote Epidermal Differentiation and Hair Follicle Development. Science Signaling. 6 (261), 8(2013).
- Carrasco, E., et al. Photoactivation of ROS Production in situ Transiently Activates Cell Proliferation in Mouse Skin and in the hair Follicle Stem Cell Niche Promoting Hair Growth and Wound Healing. Journal of Investigative Dermatology. 135 (11), 1-12 (2015).
- Carrasco, E., Blázquez-Castro, A., Calvo, M. I., Juarranz, Á, Espada, J. Switching on a transient endogenous ROS production in mammalian cells and tissues. Methods. , 109(2016).
- Braun, K. M., et al. Manipulation of stem cell proliferation and lineage commitment: visualisation of label-retaining cells in wholemounts of mouse epidermis. Development. 130 (21), 5241-5255 (2003).
- Hsu, Y. -C., Li, L., Fuchs, E. Emerging interactions between skin stem cells and their niches. Nature Medicine. 20 (8), 847-856 (2014).
- Plikus, M. V., et al. Epithelial stem cells and implications for wound repair. Seminars in Cell & Developmental Biology. 23 (9), 946-953 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados