Method Article
マウスにおける急性腎障害に対する両側腎虚血再灌流モデル
要約
虚血再灌流障害(IRI)モデルは、急性腎障害(AKI)の発症のさまざまな段階、特にAKIから慢性腎臓病(CKD)への進行中に使用できます。ここでは、マウスにおける経腹的アプローチによるIRIモデル開発の手順、血管クリップを介して腎椎弓根をクランプして虚血性損傷を誘発する手順について説明します。
要約
急性腎障害(AKI)は、腎機能が急速に低下し、持続的な腎機能障害が徐々に進行し、ネフロンが不可逆的に失われ、その不適応な修復により慢性腎臓病(CKD)に進行することと定義されています。近年、体積減少、敗血症、腎毒性、筋損傷、大外傷など多様な病因でAKIの発症率が増加傾向にあり、虚血再灌流障害(IRI)がほとんどのエピソードを占めています。マウスにおけるIRIモデルの開発は、腎椎弓根の外科的クランプによって誘発され、AKIの前臨床モデルに強力で制御可能なツールを提供します。重要なのは、IRIモデルはAKI開発のさまざまな段階、特にAKIからCKDへのプロセスで展開されることです。IRIモデルは多くの研究室で広く実践されていますが、このモデルの結果には依然として一連の変数が影響しています。ここでは、研究者がAKIの発生とAKIからCKDへの進行における根本的な病因を調査するための再現性と信頼性の高い方法を提供するためのIRIモデル開発の手順について説明します。
概要
急性腎障害 (AKI) は、罹患率と死亡率が有意な重篤な臨床症候群であり、48 時間以内に血清クレアチニンが 0.3 mg/dL (26.5 μM/L) ≥増加するか、血清クレアチニンが 7 日以内にベースラインの 1.5 倍に増加する≥、または6 時間で尿量が 0.5 mL/kg/h < 1、2,3.何十年にもわたる研究にもかかわらず、AKIの効果的な治療法は腎臓の損傷を軽減したり、腎臓の回復を促進したりするためのものがなく、AKI患者のかなりの割合が慢性腎臓病(CKD)に進行しています4,5,6。複雑な分子と経路は、AKIとその進行に部分的に関与しているため、前臨床モデルは、効率的な治療法の開発のためにこれらの複雑さを解明するための強力なツールを提供します。
臨床的には、虚血再灌流障害(IRI)損傷は、心臓および肝臓の手術、循環ショック、体積の枯渇、敗血症、腎血管の閉塞または閉塞、腎臓移植など、さまざまな状態におけるAKIの主な原因です7。IRI-AKIマウスモデルは1960年代から使用されています。このモデルは、虚血につながるマウスの非外傷性クランプによる腎椎弓根の外科的クランプと、クランプを取り外すことによる腎血流の再灌流によって開発されました。IRI-AKIモデルは、通常、腎尿細管細胞死と進行性の腎組織損傷を特徴としています。IRIは、いくつかの理由から、AKIの病因と治療介入に使用される最も一般的なモデルの1つです:(1)外科的手順のシンプルさと安全性は、IRI-AKIモデル8の生存率と成功率を向上させます。(2)虚血はヒトAKIの主要な病因であるため、IRI-AKIモデルは臨床AKIイベント9の評価に適しています。(3) IRIモデルは、AKIのさまざまな段階で腎障害と組織病理学の変化を示す可能性があり、これはAKIからCKD10への進行の研究にも適用できます。実験デザインに応じて、IRI誘発AKIモデルには、両側IRI、無傷の対側腎臓を持つ片側IRI、および同時対側腎摘出術を伴う片側IRIが含まれます。特に、両側IRIモデルは、両方の腎臓が血液供給の影響を受けているため、AKIのヒトの病理学的状態により関連性が高いと考えられています11。IRIモデルは、腎移植後、心臓バイパス術、腎血管手術後、または腎温存手術後、および低血圧9の設定における腎血流の減少の影響をシミュレートするために適用できます。ここでは、研究者が虚血誘発性AKIの根本的な病因を調査するための一貫した信頼性の高い方法を提供するための、二国間IRIモデルの手順について説明します。
プロトコル
8週齢、体重25gの雄C57BL/6Jマウスを用いて、両側性虚血再灌流によるAKIモデルを確立しました。以前の研究によると、IRI手術12,13では、体温を約36.5°C〜37°Cに維持し、腎虚血の持続時間は30分です。各グループごとに合計6匹のマウスが必要であり、偽操作マウスが対照として機能しました。本研究の動物実験は、動物の福祉を保護するために、浙江大学の動物管理委員会(IACUC)によって承認されています。すべての動物研究手順は、浙江大学の倫理ガイドラインと原則に従って行われました。
1. 術前準備
- すべての手術器具を高圧滅菌します。
- 7.6 mLの滅菌生理食塩水に2 mLのケタミンと0.4 mLのキシラジンを加えて麻酔薬溶液を準備します。.腹腔内注射により、ケタミン(80 mg / kg)とキシラジン(16 mg / kg)の混合物でマウスに麻酔をかけます。つま先のピンチ反射を使用して麻酔薬の深さを評価します。
- 麻酔をかけたマウスをホメオサームブランケットの上に置き、気道が遮られないようにします。体温を36.5〜37°Cの範囲に保ちます。
- 麻酔下での乾燥を防ぐために、マウスの目を1%塩酸テトラサイクリン眼軟膏で覆います。
- バリカンで腹部の髪を剃り、手術部位の皮膚をポビドンヨード溶液で3回洗浄します。
2. 手術
- 皮膚と筋肉の層を介して手術用ハサミで腹部中央部を約1〜1.5cm切開し、スプレッダーで腹腔を開きます。
- 後腹膜脂肪を動かし、綿棒で腸や他の臓器をオフサイドに押して腎臓を露出させます。腎臓は後腹膜腔にあり、脊椎の外側約0.5cm、13番目の 肋骨の下にあります。
- 細い先のとがった鉗子で腎椎弓根を解剖して、筋膜と脂肪組織を分離して除去し、左の腎椎弓根を露出させます。
- 保持鉗子を使用して血管クリップで腎椎弓根を固定し、血管の損傷ができるだけ軽微であることを確認します。不完全な腎虚血につながる可能性のある余分な腎洞脂肪のクランプは避けてください。.
- 腎臓虚血の持続時間を設定します、30分間のクランプから始めます。成功した虚血の特徴は、腎臓が数分以内に赤から濃い紫色に徐々に変化することです。
- 腎臓を後腹膜腔に移動します。反対側で手順を繰り返して、右の腎椎弓根を露出させてクランプします。
- 両側の虚血時間を別々に記録して、両方の腎臓が虚血の正確な期間を受け取るようにします。切開部を再度開き、虚血期間の終了時に血管クリップを放します。
- 腎臓を後腹膜腔に置換し、Vicryl 4-0縫合糸で筋肉と皮膚を層ごとに縫合します。
注:外科的処置は無菌条件下で行う必要があります。手術台と器具は、必要に応じて手術中に75%エタノールで清掃してください。
3. 術後のケア
- 腹腔内注射により0.5〜1mLの温冷生理食塩水を投与し、体液の損失を補います。
- マウスが十分な意識を取り戻すまで、注意を払って胸骨の横臥を維持します。マウスを完全に意識を得るまでマウスをホメオサームブランケットの上に置いてから、ケージに戻ります。完全に回復するまで、マウスを他の動物の会社に戻さないでください。
- 術後の痛みを軽減するために、最初の3日間はブプレノルフィン0.05-0.10 mg / kgを最初の3日間は12時間ごとに投与します。.手術用マウスを毎日監視します。
4. モデル評価
- ヘマトキシリン-エオシン(HE)染色
- IRI後1、3、7、または14日目に腹腔内注射により、ペントバルビタールナトリウムを使用して動物を安楽死させます。
- 新鮮な腎臓組織を4%パラホルムアルデヒド(PFA)で一晩固定し、75%エタノールで4°Cで保存します。
- 脱水して包埋した後、得られたサンプルを8μmの厚さにカットして染色します。
- キシレンで組織切片を脱ろうし、エタノールの濃度を減らして再水和します。
- 組織切片をヘマトキシリンとエオシンで染色します。
- エタノールとキシレンの濃度を上げて組織切片を脱水します。
- 腎機能アッセイ
- 麻酔後、眼球採血法を用いて血液サンプルを採取します。
- 血液サンプルを12000 x g で10分間遠心分離し、血清を分離します。
- 腎機能を監視するための自動ドライケミストリーアナライザーで血清クレアチニンと血中尿素窒素(BUN)を測定します。
- リアルタイムPCR (RT-PCR)
- クイックRNA抽出キットを使用して腎臓組織から全RNAを抽出し、逆転写酵素ミックスキットでcDNAを合成します。SYBR Green Premix Kitを使用してRT-PCRを実施し、RT-PCR装置で実行します。ここで使用されたプライマー配列は、14より前に報告されました:KIM1フォワード、5'-GCTGCTACTGCTCCTTGTGA-3';逆5'-GGAAGGCAACCACGCTTAGA-3';NGALフォワード、5'-GGCCAGTTCACTCTGGGAAA-3;逆5'-TGGCGAACTGGTTGTAGTCC-3';GAPDH フォワード、5'-GGTGAAGGTCGGTGTGAACG-3';逆5'-CTCGCTCCTGGAAGATGGTG-3'。
結果
手術中の腎臓の状態
成功した虚血の特徴は、腎臓が1〜2分以内に赤から濃い紫色に徐々に変化することであり、成功した再灌流は、腎臓が1〜2分以内に濃い紫色から赤に徐々に変化するという特徴があります。
手術後の腎臓の組織学
HEおよび過ヨウ素酸シッフ(PAS)染色は、急性腎障害を確認する直接的な方法です。虚血再灌流損傷モデルでは、主要な損傷部位は近位尿細管のS3セグメントです。腎尿細管損傷の典型的な症状には、重度の尿細管の拡張と混乱、ブラシ境界の喪失、破片の脱落、および細胞アポトーシスが含まれます。管状の損傷は、盲検化された方法で損傷した尿細管の割合によっても採点されます:スコア0、損傷なし。スコア1、<25%の損傷した尿細管。スコア2、25%-50%の損傷した尿細管。スコア3、50%-75%の損傷した尿細管。スコア4、>75%の損傷した尿細管。虚血誘発性AKIにおける腎尿細管の特徴的な病理学的変化と尿細管損傷スコアの上昇を確認しました(図1A-B)。
手術後の腎臓の機能
腎機能の低下は、自動ドライケミストリーアナライザーによって検出された血清クレアチニンおよびBUNレベルの上昇によって評価できます(図1C-D)。
手術後の尿細管の損傷
好中球ゼラチナーゼ関連リポカリン(NGAL)および腎障害分子-1(KIM1)は、AKI15の早期同定のために腎尿細管機能障害を評価するための確立された感度の高いバイオマーカーです。実際、虚血誘発性AKIでは、初期の尿細管損傷マーカーNGALとKIM1の発現が上昇することが観察されました(図1E)。
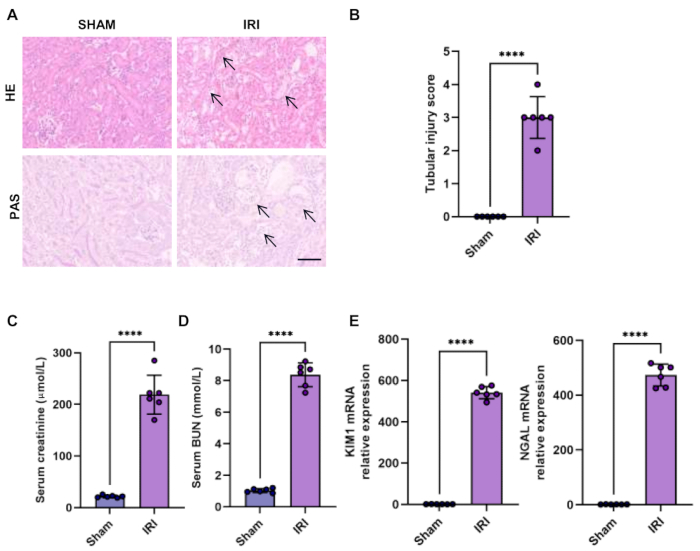
図1:両側IRIモデルにおける腎臓の組織学と機能。 (A-B)腎切片のヘマトキシリン-エオシン染色(HE)および過ヨウ素酸-シッフ染色(PAS)は、両側IRIモデル(スケールバー、100μm)および尿細管損傷スコアの定量化で腎障害を示しました。矢印は、管状ブラシの境界の喪失、管状の拡張と破壊、上皮細胞の平坦化、および管状上皮細胞の脱落を示しています。(C-D)偽マウスおよび両側IRIマウスの血清クレアチニンおよびBUNレベル。(E) 偽および両側IRIマウスの腎臓におけるKIM1およびNGALの相対発現のRT-qPCR解析。データは平均SD±として提示され、統計分析はスチューデントのt検定を用いて行われた。P < 0.0001 です。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この論文では、腎臓IRIモデルの詳細な手順を提供し、その後、それがAKIおよびAKIからCKDへの進行のための堅牢なモデルであることを強調しました。さらに、腎臓の組織学と機能を含む、腎障害の2つの主要な基準の影響を示します。
外科的処置におけるいくつかの重要なポイントは、再現性と信頼性のあるモデルのために強調する必要があります。腹部手術では、手術に伴う外傷を最小限に抑えるために、腎臓を露出させるために正中線切開が推奨されます。後腹膜脂肪のために腎椎弓根を完全に解剖するのは難しいので、腎臓を介して腎臓を前後に鉗子のペアで脂肪から腎椎弓根を剥がします。さらに、外科的プロセスの安定性を維持し、処置中に血管クランプに摩耗があるかどうかに注意を払うために、同じ血管クランプを適用することをお勧めします。さらに、生理食塩水の補給によりマウスの脱水症状を防ぐことも重要です。これは、手術中の腎障害の原因となる体液の損失によるものです。
IRIの外科的処置では、いくつかの重要なトラブルシューティング方法を強調する必要があります。まず、腎臓とその茎を分離しながら腎出血をトラブルシューティングすることは困難です。出血の大部分は、にじみ点を適切に圧縮することで制御できますが、出血量が0.5mL>と出血性ショックを引き起こす可能性があります。.この場合、マウスを安楽死させ、研究から除外します。第二に、腎臓の不完全な虚血は注意を払うべき別の側面です。第一に、腎椎弓根の不完全な分離は、虚血性損傷の軽減につながります。腎椎弓根が完全に分離されていない場合、血管クランプは不完全な閉塞を引き起こす可能性があり、オペレーターは血管クランプを変更して腎臓の完全な虚血を確認できます。手順中に同じ血管クランプを使用し、摩耗したクランプを更新することをお勧めします。第三に、血管クランプ除去後の腎再灌流障害は、血管病変または血栓形成によるものである可能性があり、そのようなマウスを安楽死させ、研究から除外します。
IRIモデルでは、いくつかの重要な変数が腎障害の重症度に影響を与えます。虚血時間と体温は、腎障害の主な決定要因です。以前の研究で報告されているように、管状損傷は、両側性腎虚血が25〜30分間続いた後、進行性であることがわかっています。管状損傷は、虚血持続時間が2分ごとに増加すると著しく悪化し、虚血持続時間が60分を超えると急性尿細管壊死を引き起こす可能性があります16。さらに、深部体温はIRIモデルの結果に大きく影響します。当然のことながら、体温が高いマウス(36-37°C)はより顕著な影響を及ぼしますが、虚血中に低温(33-35°C)のマウスでは明らかな変化は観察されていません8,17。AKIの重症度に対する体温の影響は、代謝に関連しています:(1)体温の上昇は、虚血中の細胞膜の損傷と細胞内エネルギー貯蔵の減少をもたらします。(2)体温が高くなると、イノシンとヒポキサンチンのレベルが増加すると、再灌流時にフリーラジカルの産生が増加します18,19。虚血の持続時間と体温に加えて、マウスの系統、年齢、性別、体重、脱水状態、麻酔、手術時間など、AKIの一貫したIRIモデルにはいくつかの要因を考慮に入れる必要があります20,21。上記の変動因子は、実験設定で一貫していると見なす必要があります。
現在の IRI-AKI モデルにはいくつかの制限があります。まず、虚血性AKIの一貫した信頼性の高いモデルを確立するには、十分に訓練された熟練したオペレーターが不可欠であり、技術的な問題には体系的な外科的トレーニングを活用する必要があります。さらに、マウスIRIモデルの組織学的分析における腎障害の重症度は、ヒトAKIではめったに観察されません22。このモデルをヒトのAKIの状態に一致させるためには、さらなる探求が必要です。さらに、マウス系統は、IRIモデルにおけるAKIに対する感受性にも影響します。個々のマウス系統のIRI-AKI条件を確立することが重要です。
結論として、二国間IRI-AKIモデルは、病原性調査と治療アプローチのための相対的で一貫したモデルです。特に、このIRIモデルの移転性を確保するために、外科的処置におけるいくつかの重要なポイントが提供されています。最後に、虚血時間と体温が主な決定要因であることを強調し、IRIモデル内の変動に影響を与えるいくつかの追加要因についても言及します。
開示事項
著者は、利益相反を宣言しません。
謝辞
今回の研究への協力に対して、参加者の皆様に感謝いたします。この研究は、中国浙江省自然科学財団(LZ22H050001)からの資金提供と、Weiqiang Linへの高レベル革新的健康人材の育成のための浙江省プログラムによって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Animal hair clipper | FEIYUBIO | 19-7002 | |
| 1-ml syringes | Longreen | SR60061 | |
| Ethanol | Macklin | E885996 | |
| Gauze | FEIYUBIO | 19-5022 | |
| Homeothermic monitor system | Warmmate | 40 x 50 | |
| Needle holder | DKBT | CZQ-00160 | |
| Spreader | RWD | R22029-03 | |
| Sterile saline | Biosharp | BL158A | |
| Tissue scissors | DKBT | DC-YKJ1002 | |
| Tissue tweezers | DKBT | DK079904 | |
| Vascular clip | Fine Science Tools | 18055-02 | |
| Vicryl suture | Shanghai Jinhuan | 4 -0 |
参考文献
- Al-Jaghbeer, M., Dealmeida, D., Bilderback, A., Ambrosino, R., Kellum, J. A. Clinical decision support for in-hospital AKI. J Am Soc Nephrol. 29 (2), 654-660 (2018).
- Kellum, J. A., Lameire, N. KDIGO AKI Guideline Work Group. Diagnosis, evaluation, and management of acute kidney injury: a KDIGO summary (Part 1). Crit Care. 17 (1), 204 (2013).
- Zhang, C., et al. The Hippo pathway and its correlation with acute kidney injury. Zool Res. 43 (5), 897-910 (2022).
- He, L., et al. AKI on CKD: heightened injury, suppressed repair, and the underlying mechanisms. Kidney Int. 92 (5), 1071-1083 (2017).
- Sato, Y., Takahashi, M., Yanagita, M. Pathophysiology of AKI to CKD progression. Semin Nephrol. 40 (2), 206-215 (2020).
- Wang, Z., Zhang, C. From AKI to CKD: Maladaptive repair and the underlying mechanisms. Int J Mol Sci. 23 (18), 10880 (2022).
- Hoste, E. A. J., et al. Global epidemiology and outcomes of acute kidney injury. Nat Rev Nephrol. 14 (10), 607-625 (2018).
- Wei, Q., Dong, Z. Mouse model of ischemic acute kidney injury: technical notes and tricks. Am J Physiol Renal Physiol. 303 (11), F1487-F1494 (2012).
- Skrypnyk, N. I., Siskind, L. J., Faubel, S., de Caestecker, M. P. Bridging translation for acute kidney injury with better preclinical modeling of human disease. Am J Physiol Renal Physiol. 310 (10), F972-F984 (2016).
- Ferenbach, D. A., Bonventre, J. V. Mechanisms of maladaptive repair after AKI leading to accelerated kidney ageing and CKD. Nat Rev Nephrol. 11 (5), 264-276 (2015).
- Zhang, J., et al. A two-stage bilateral ischemia-reperfusion injury-induced AKI to CKD transition model in mice. Am J Physiol Renal Physiol. 319 (2), F304-F311 (2020).
- Hukriede, N. A., et al. Experimental models of acute kidney injury for translational research. Nat Rev Nephrol. 18 (5), 277-293 (2022).
- Bao, Y., Yuan, Y., Chen, J., Lin, W. Kidney disease models: tools to identify mechanisms and potential therapeutic targets. Zool Res. 39 (2), 72-86 (2018).
- Bao, Y., et al. DNA demethylase Tet2 suppresses cisplatin-induced acute kidney injury. Cell Death Discov. 7, 167 (2021).
- Rossiter, A., La, A., Koyner, J. L., Forni, L. G. New biomarkers in acute kidney injury. Crit Rev Clin Lab Sci. 5, 1-22 (2023).
- Hesketh, E. E., et al. Renal ischemia reperfusion injury: a mouse model of injury and regeneration. J Vis Exp. (88), e51816 (2014).
- Zager, R. A., Altschuld, R. Body temperature: an important determinant of severity of ischemic renal injury. Am J Physiol. 251, F87-F93 (1986).
- Delbridge, M. S., Shrestha, B. M., Raftery, A. T., El Nahas, A. M., Haylor, J. L. The effect of body temperature in a rat model of renal ischemia-reperfusion injury. Transplant Proc. 39 (10), 2983-2985 (2007).
- Le Clef, N., Verhulst, A., D'Haese, P. C., Vervaet, B. A. Unilateral renal ischemia-reperfusion as a robust model for acute to chronic kidney injury in mice. PLoS One. 11 (3), 0152153 (2016).
- Tannenbaum, C., Ellis, R. P., Eyssel, F., Zou, J., Schiebinger, L. Sex and gender analysis improves science and engineering. Nature. 575, 137-146 (2019).
- Lee, H. T., Ota-Setlik, A., Fu, Y., Nasr, S. H., Emala, C. W. Differential protective effects of volatile anesthetics against renal ischemia-reperfusion injury in vivo. Anesthesiology. 101 (6), 1313-1324 (2004).
- Heyman, S. N., Rosen, S., Rosenberger, C. Animal models of renal dysfunction: acute kidney injury. Expert Opin Drug Discov. 4 (6), 629-641 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved