Method Article
Bilaterales renales Ischämie-Reperfusionsmodell für akutes Nierenversagen bei Mäusen
In diesem Artikel
Zusammenfassung
Das Ischämie-Reperfusions-Schädigungsmodell (IRI) kann in verschiedenen Stadien der Entwicklung einer akuten Nierenschädigung (AKI) eingesetzt werden, insbesondere während des Fortschreitens der AKI bis zur chronischen Nierenerkrankung (CKD). Hier beschreiben wir das Verfahren zur Entwicklung von IRI-Modellen bei Mäusen über einen transabdominalen Zugang, bei dem Nierenstiele über einen Gefäßclip eingeklemmt werden, um eine ischämische Verletzung zu induzieren.
Zusammenfassung
Akutes Nierenversagen (AKI) ist definiert als ein rascher Rückgang der Nierenfunktion, bei dem eine anhaltende Nierenfunktionsstörung aufgrund des irreversiblen Verlusts von Nephronen und ihrer maladaptiven Reparatur allmählich zu einer chronischen Nierenerkrankung (CKD) fortschreitet. In den letzten Jahren hat die Inzidenz von AKI in Bezug auf verschiedene Ätiologien zugenommen, darunter Volumenmangel, Sepsis, Nephrotoxizität, Muskelverletzungen und schwere Traumata, bei denen Ischämie-Reperfusionsschäden (IRI) für die meisten Episoden verantwortlich sind. Die Entwicklung des IRI-Modells bei Mäusen wird durch chirurgisches Abklemmen der Nierenstiele induziert, was leistungsfähige und kontrollierbare Werkzeuge für präklinische Modelle von AKI bietet. Wichtig ist, dass das IRI-Modell in verschiedenen Phasen der AKI-Entwicklung eingesetzt wird, insbesondere in den Prozessen von AKI bis CKD. Obwohl das IRI-Modell in vielen Laboratorien weit verbreitet ist, beeinflussen eine Reihe von Variablen immer noch die Ergebnisse dieses Modells. Hier beschreiben wir das Verfahren der IRI-Modellentwicklung, um Forschern eine wiederholbare und zuverlässige Methode zur Verfügung zu stellen, um die zugrunde liegende Pathogenese bei der Entwicklung von AKI und die Progression von AKI zu CKD zu untersuchen.
Einleitung
Akutes Nierenversagen (AKI) ist ein schweres klinisches Syndrom mit signifikanter Morbidität und Mortalität, definiert als ein Anstieg des Serumkreatinins um ≥ 0,3 mg/dl (26,5 μM/l) innerhalb von 48 h oder ein Anstieg des Serumkreatinins auf das 1,5-fache des Ausgangswerts innerhalb von 7 Tagen auf das ≥ oder das Urinvolumen < 0,5 ml/kg/h für 6 h1, 2,3. Trotz jahrzehntelanger Forschung fehlt es an einer wirksamen Therapie für AKI, um Nierenschäden zu lindern oder die Genesung der Nieren zu beschleunigen, und ein beträchtlicher Teil der AKI-Patienten entwickelt sich zu einer chronischen Nierenerkrankung (CKD)4,5,6. Komplexe Moleküle und Signalwege sind teilweise an der AKI und ihrer Progression beteiligt, so dass präklinische Modelle leistungsstarke Werkzeuge bieten, um diese Komplexitäten für die Entwicklung effizienter therapeutischer Modalitäten zu entschlüsseln.
Klinisch gesehen ist eine Ischämie-Reperfusionsverletzung (IRI) die Hauptursache für AKI bei verschiedenen Erkrankungen, darunter Herz- und Leberoperationen, Kreislaufschock, Volumenmangel, Sepsis, Nierengefäßverschluss oder -obstruktion, Nierentransplantation und so weiter7. Das Mausmodell IRI-AKI ist seit den 1960er Jahren im Einsatz. Dieses Modell wurde durch chirurgisches Einklemmen der Nierenstiele mit nicht-traumatischen Klemmen bei Mäusen entwickelt, was zu einer Ischämie führte, und gefolgt von einer Reperfusion des renalen Blutflusses durch Entfernen der Klammern. Das IRI-AKI-Modell ist typischerweise durch den renalen tubulären Zelltod und eine fortschreitende Schädigung des Nierengewebes gekennzeichnet. Das IRI ist aus mehreren Gründen eines der gebräuchlichsten Modelle für die Pathogenese und therapeutische Intervention bei AKI: (1) Die Einfachheit und Sicherheit des chirurgischen Eingriffs verbessert die Überlebensrate und Erfolgsrate des IRI-AKI-Modells8; (2) Da Ischämie eine wichtige Ätiologie bei humanen AKI ist, wird das IRI-AKI-Modell besser zur Beurteilung des klinischen AKI-Ereignissesverwendet 9; (3) Das IRI-Modell könnte Veränderungen der Nierenschädigung und der Histopathologie in verschiedenen Stadien der AKI darstellen, was auch auf die Untersuchung der Progression von AKI zu CKD10 anwendbar ist. Abhängig vom Versuchsdesign umfassen IRI-induzierte AKI-Modelle eine bilaterale IRI, eine unilaterale IRI mit intakter kontralateraler Niere und eine unilaterale IRI mit gleichzeitiger kontralateraler Nephrektomie. Bemerkenswert ist, dass das bilaterale IRI-Modell als relevanter für die pathologischen Zustände der AKI beim Menschen angesehen wird, da beide Nieren von der Blutversorgung betroffen sind11. Das IRI-Modell ist anwendbar, um die Auswirkungen eines verminderten Nierenblutflusses nach Nierentransplantation, Herzbypass, Nierengefäß- oder nephronsparender Operation sowie bei Hypotoniezu simulieren 9. Hier beschreiben wir das Verfahren für ein bilaterales IRI-Modell, um Forschern eine konsistente und zuverlässige Methode zur Verfügung zu stellen, um die zugrunde liegende Pathogenese bei Ischämie-induzierter AKI zu untersuchen.
Protokoll
Männliche C57BL/6J-Mäuse im Alter von 8 Wochen und mit einem Gewicht von 25 g wurden verwendet, um das AKI-Modell durch bilaterale Ischämie-Reperfusion zu etablieren. Wie in früheren Studien halten wir die Körpertemperatur bei etwa 36,5 °C bis 37 °C, und die Dauer der Nierenischämie beträgt 30 Minuten in der IRI-Operation12,13. Insgesamt wurden 6 Mäuse für jede Gruppe benötigt, und scheinoperierte Mäuse dienten als Kontrollen. Die Tierversuche in dieser Studie wurden vom Institutional Animal Care and Use Committee (IACUC) der Universität Zhejiang genehmigt, um das Wohlergehen der Tiere zu schützen. Alle Tierversuche wurden nach den ethischen Richtlinien und Prinzipien der Zhejiang Universität durchgeführt.
1. Präoperative Vorbereitung
- Hochdrucksterilisation aller chirurgischen Instrumente.
- Bereiten Sie die Anästhesielösung vor, indem Sie 2 ml Ketamin und 0,4 ml Xylazin in 7,6 ml sterile Kochsalzlösung hinzufügen. Betäuben Sie die Maus mit einer Mischung aus Ketamin (80 mg/kg) und Xylazin (16 mg/kg) durch intraperitoneale Injektion. Beurteilen Sie die Narkosetiefe mit dem Zehenkneifreflex.
- Legen Sie die betäubte Maus auf die homöotherme Decke, um sicherzustellen, dass ihre Atemwege frei bleiben. Halten Sie die Körpertemperatur im Bereich von 36,5-37 °C.
- Decken Sie die Augen der Maus mit 1 % Tetracyclinhydrochlorid-Augensalbe ab, um Trockenheit unter Narkose zu verhindern.
- Rasieren Sie die Haare des Bauches mit einem Haarschneider und reinigen Sie die Haut des Operationsbereichs 3x mit einer Povidon-Jod-Lösung.
2. Chirurgie
- Machen Sie mit einer chirurgischen Schere einen mittleren Schnitt des Bauches ca. 1-1,5 cm über die Haut- und Muskelschicht und öffnen Sie die Bauchhöhle mit einem Spreizer.
- Legen Sie die Niere frei, indem Sie das retroperitoneale Fett bewegen und den Darm und andere Organe mit einem Wattestäbchen ins Abseits schieben. Die Niere befindet sich im retroperitonealen Raum, etwa 0,5 cm lateral der Wirbelsäule und unterhalb der 13. Rippe.
- Präparieren Sie den Nierenstiel mit einer feinen spitzen Pinzette, um die Faszien und das Fettgewebe zu trennen und zu entfernen und die linken Nierenstiele freizulegen.
- Klemmen Sie die Nierenstiele mit einem Gefäßclip mit einer Haltezange fest und sorgen Sie dafür, dass die Gefäßschädigung so gering wie möglich ist. Vermeiden Sie das Einklemmen von überflüssigem Nierensinusfett, das zu einer unvollständigen renalen Ischämie führen kann.
- Stellen Sie die Dauer der Nierenischämie ein, beginnend mit dem Klemmen für 30 Minuten. Charakteristisch für eine erfolgreiche Ischämie ist, dass sich die Niere innerhalb weniger Minuten allmählich von rot zu dunkelviolett verfärbt.
- Bewegen Sie die Niere in den retroperitonealen Raum. Wiederholen Sie den Vorgang auf der kontralateralen Seite, um die rechten Nierenstiele freizulegen und zu klemmen.
- Notieren Sie die Ischämiezeit auf jeder Seite separat, um sicherzustellen, dass beide Nieren die genaue Dauer der Ischämie erhalten. Öffnen Sie den Schnitt wieder und lösen Sie den Gefäßclip am Ende der Ischämiedauer.
- Setzen Sie die Niere in den retroperitonealen Raum ein und nähen Sie dann den Muskel und die Haut Schicht für Schicht mit dem Vicryl 4-0-Nahtmaterial.
HINWEIS: Die chirurgischen Eingriffe sollten unter sterilen Bedingungen durchgeführt werden. Reinigen Sie den Operationstisch und die Instrumente während der Operation bei Bedarf mit 75%igem Ethanol.
3. Nachsorge
- Verabreichen Sie 0,5-1 ml warme und sterile Kochsalzlösung durch intraperitoneale Injektion, um den Flüssigkeitsverlust auszugleichen.
- Halten Sie das Brustbein mit Aufmerksamkeit aufrecht, bis die Maus wieder ausreichend Bewusstsein erlangt hat. Lege die Maus auf die homöotherme Decke, bis sie bei vollem Bewusstsein ist, und kehre dann in ihren Käfig zurück. Geben Sie die Maus nicht an andere Tiere zurück, bis sie vollständig genesen ist.
- Geben Sie Buprenorphin 0,05-0,10 mg/kg alle 12 Stunden für die ersten 3 Tage, um postoperative Schmerzen zu lindern. Überwachen Sie die chirurgischen Mäuse jeden Tag.
4. Modell-Bewertung
- Hämatoxylin-Eosin (HE)-Färbung
- Euthanasieren Sie Tiere mit Pentobarbital-Natrium durch intraperitoneale Injektion an den Tagen 1, 3, 7 oder 14 nach der IRI.
- Frisches Nierengewebe über Nacht mit 4 % Paraformaldehyd (PFA) fixieren und in 75 % Ethanol bei 4 °C lagern.
- Nach dem Dehydrieren und Einbetten werden die erhaltenen Proben für die Färbung in eine Dicke von 8 μm geschnitten.
- Entwachse die Gewebeabschnitte in Xylol und rehydriere sie dann mit abnehmenden Ethanolkonzentrationen.
- Färben Sie die Gewebeschnitte mit Hämatoxylin und Eosin.
- Dehydrieren Sie die Gewebeabschnitte, indem Sie die Konzentrationen von Ethanol und Xylol erhöhen.
- Nierenfunktionstest
- Entnehmen Sie Blutproben mit der Methode der Augapfelblutentnahme nach der Anästhesie.
- Zentrifugieren Sie Blutproben bei 12000 x g für 10 Minuten, um das Serum zu trennen.
- Bestimmen Sie das Serumkreatinin und den Blutharnstoffstickstoff (BUN) mit dem automatischen trockenchemischen Analysator zur Überwachung der Nierenfunktion.
- Echtzeit-PCR (RT-PCR)
- Extrahieren Sie Gesamt-RNA aus Nierengewebe mit einem schnellen RNA-Extraktionskit und synthetisieren Sie dann cDNA mit einem Reverse-Transkriptase-Mix-Kit. Führen Sie die RT-PCR mit dem SYBR Green Premix Kit durch und führen Sie sie auf dem RT-PCR-Gerät aus. Die hier verwendeten Primersequenzen wurden vor14 berichtet: KIM1 forward, 5'-GCTGCTACTGCTCCTTGTGA-3'; rückwärts 5'-GGAAGGCAACCACGCTTAGA-3'; NGAL nach vorne, 5'-GGCCAGTTCACTCTGGGAAA-3; rückwärts 5'- TGGCGAACTGGTTGTAGTCC-3'; GAPDH nach vorne, 5'-GGTGAAGGTCGGTGTGAACG-3'; rückwärts 5'-CTCGCTCCTGGAAGATGGTG-3'.
Ergebnisse
Zustand der Niere während der Operation
Charakteristisch für eine erfolgreiche Ischämie ist, dass sich die Niere innerhalb von 1-2 Minuten allmählich von rot zu dunkelviolett ändert, und eine erfolgreiche Reperfusion zeichnet sich dadurch aus, dass sich die Niere innerhalb von 1-2 Minuten allmählich von tiefviolett zu rot ändert.
Histologie der Niere nach der Operation
HE und periodische saure Schiff (PAS)-Färbung sind die direkten Methoden zur Überprüfung einer akuten Nierenschädigung. Im Ischämie-Reperfusions-Verletzungsmodell ist die dominante verletzte Stelle das S3-Segment der proximalen Tubuli. Zu den klassischen Manifestationen einer tubulären Nierenschädigung gehören eine schwere tubuläre Dilatation und Störung, der Verlust des Bürstenrands, abgestoßene Trümmer und die Zellapoptose. Die Röhrenschädigung wird auch durch den Prozentsatz der geschädigten Tubuli in verblindeter Weise bewertet: Punktzahl 0, keine Beschädigung; Punktzahl 1, <25 % geschädigte Tubuli; Punktzahl 2, 25%-50% geschädigte Tubuli; Punktzahl 3, 50%-75% geschädigte Tubuli; Punktzahl 4, >75 % geschädigte Tubuli. Wir bestätigten die charakteristischen pathologischen Veränderungen des renalen tubulären und des erhöhten tubulären Verletzungsscores bei Ischämie-induzierter AKI (Abbildung 1A-B).
Funktion der Niere nach der Operation
Eine Verschlechterung der Nierenfunktion kann durch erhöhte Serumkreatinin- und BUN-Spiegel beurteilt werden, die mit einem automatischen trockenchemischen Analysator nachgewiesen wurden (Abbildung 1C-D).
Verletzung des Nierentubuli nach der Operation
Neutrophile Gelatinase-assoziierte Lipocalin (NGAL) und Nierenverletzungsmolekül-1 (KIM1) sind gut etablierte und empfindliche Biomarker zur Bewertung der renalen tubulären Dysfunktion für die Früherkennung von AKI15. Tatsächlich haben wir beobachtet, dass die Expression der frühen tubulären Verletzungsmarker NGAL und KIM1 bei Ischämie-induzierter AKI erhöht war (Abbildung 1 E).
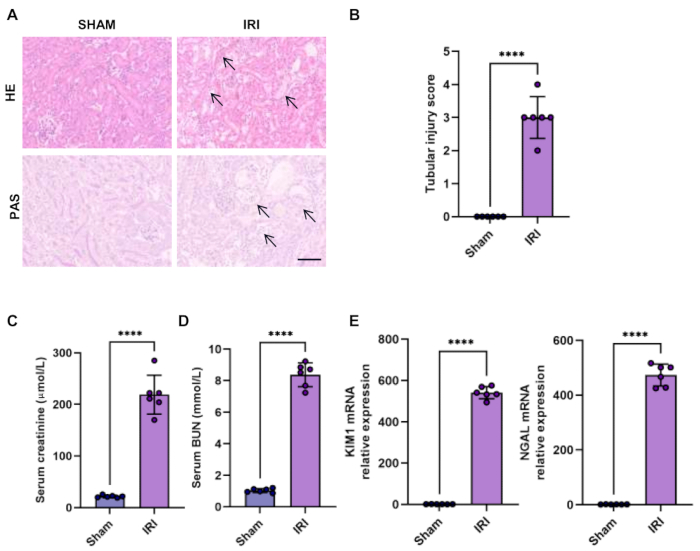
Abbildung 1: Histologie und Funktion der Niere im bilateralen IRI-Modell. (A-B) Die Hämatoxylin-Eosin-Färbung (HE) und die periodische Säure-Schiff-Färbung (PAS) von Nierenschnitten zeigten eine Nierenschädigung im bilateralen IRI-Modell (Skalenbalken, 100 μm) und bei der Quantifizierung des tubulären Verletzungs-Scores. Die Pfeile zeigen den Verlust des tubulären Bürstenrands, die tubuläre Dilatation und Sprengung, abgeflachte Epithelzellen und das Abschälen von tubulären Epithelzellen. (C-D) Serumkreatinin- und BUN-Spiegel von Schein- und bilateralen IRI-Mäusen. (E) RT-qPCR-Analyse der relativen Expression von KIM1 und NGAL in der Niere von Schein- und bilateralen IRI-Mäusen. Die Daten wurden als mittlere ± SD dargestellt. Die statistische Analyse wurde mit dem Student's t-Test durchgeführt. P < 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In diesem Artikel haben wir ein detailliertes Verfahren zum renalen IRI-Modell vorgestellt und anschließend hervorgehoben, dass es sich um ein robustes Modell für die Progression von AKI und AKI zu CKD handelt. Darüber hinaus zeigen wir die Auswirkungen der beiden Hauptkriterien der Nierenschädigung, einschließlich der Nierenhistologie und -funktion.
Mehrere wichtige Punkte bei chirurgischen Eingriffen müssen hervorgehoben werden, um ein wiederholbares und zuverlässiges Modell zu erhalten. Bei Bauchoperationen wird ein Mittellinienschnitt empfohlen, um die Niere freizulegen und das mit der Operation verbundene Trauma zu minimieren. Es ist schwierig, den Nierenstiel aufgrund des retroperitonealen Fettes vollständig zu präparieren, daher schälen Sie den Nierenstiel mit einer Pinzette über die Niere hin und her vom Fett. Darüber hinaus wird empfohlen, die gleiche Gefäßklemme anzulegen, um die Stabilität des chirurgischen Prozesses zu erhalten und darauf zu achten, ob die Gefäßklemme während des Eingriffs verschleißt. Darüber hinaus ist es auch wichtig, eine Dehydrierung von Mäusen durch eine Kochsalzlösung zu verhindern, da der Flüssigkeitsverlust zu Nierenschäden während der Operation beitragen würde.
Bei den chirurgischen Eingriffen der IRI müssen mehrere wichtige Methoden zur Fehlerbehebung hervorgehoben werden. Erstens ist es schwierig, Nierenblutungen zu beheben, während die Niere und ihr Stiel getrennt werden. Der größte Teil der Blutung konnte durch eine angemessene Kompression des Sickerpunkts kontrolliert werden, während ein Blutungsvolumen > 0,5 ml einen hämorrhagischen Schock auslösen kann. In diesem Fall euthanasieren Sie die Maus und schließen Sie sie von der Forschung aus. Zweitens ist die inkomplette Ischämie der Niere ein weiterer Aspekt, auf den man achten sollte. Erstens würde eine unvollständige Trennung des Nierenstiels zu einer geringeren ischämischen Schädigung führen. Wenn der Nierenstiel nicht vollständig isoliert ist, kann die Gefäßklemme zu einem unvollständigen Verschluss führen, und der Bediener könnte die Gefäßklemme wechseln, um eine vollständige Ischämie der Niere zu bestätigen. Es wird empfohlen, während des Eingriffs dieselbe Gefäßklemme zu verwenden und die abgenutzte Klemme zu erneuern. Drittens kann eine renale Reperfusionsstörung nach Entfernung der Gefäßklemme auf vaskuläre Läsionen oder die Bildung von Blutgerinnseln zurückzuführen sein, solche Mäuse einschläfern und von der Forschung ausschließen.
Mehrere kritische Variablen beeinflussen den Schweregrad der Nierenschädigung im IRI-Modell. Ischämie, Zeitpunkt und Körpertemperatur sind die Hauptdeterminanten von Nierenschäden. Wie in früheren Studien berichtet, wurde festgestellt, dass die tubuläre Schädigung nach einer bilateralen Nierenischämie für 25-30 Minuten progredient hat. Die tubuläre Schädigung verschlimmert sich erheblich, wenn die ischämische Dauer alle 2 Minuten zunimmt, und eine ischämische Dauer von mehr als 60 Minuten kann zu einer akuten tubulären Nekrose führen16. Darüber hinaus hat die Körperkerntemperatur einen erheblichen Einfluss auf das Ergebnis im IRI-Modell. Es überrascht nicht, dass Mäuse mit höheren Körpertemperaturen (36-37 °C) einen ausgeprägteren Effekt haben, während bei Mäusen mit niedrigeren Temperaturen (33-35 °C) während der Ischämie keine offensichtlichen Veränderungen beobachtet wurden 8,17. Der Einfluss der Körpertemperatur auf den Schweregrad der AKI hängt mit dem Stoffwechsel zusammen: (1) Eine Erhöhung der Körpertemperatur führt zu einer Schädigung der Zellmembranen und einer Abnahme der intrazellulären Energiespeicher während der Ischämie; (2) Eine Erhöhung des Inosin- und Hypoxanthinspiegels mit höherer Körpertemperatur führt zu einer erhöhten Produktion von freien Radikalen bei der Reperfusion18,19. Neben der Dauer der Ischämie und der Körpertemperatur sollten für ein konsistentes IRI-Modell der AKI mehrere Faktoren berücksichtigt werden, wie z. B. Mausstamm, Alter, Geschlecht, Körpergewicht, Dehydrationsstatus, Anästhesie, Operationszeit und so weiter20,21. Die oben genannten variablen Faktoren sollten im Versuchsaufbau als konsistent betrachtet werden.
Es gibt einige Einschränkungen beim aktuellen IRI-AKI-Modell. Erstens ist ein gut ausgebildeter und geschickter Bediener unerlässlich, um ein konsistentes und zuverlässiges Modell der ischämischen AKI zu etablieren, und bei technischen Fragen sollte eine systematische chirurgische Schulung durchgeführt werden. Darüber hinaus wird der Schweregrad der Nierenschädigung in der histologischen Analyse im IRI-Modell der Maus bei humanen AKI22 selten beobachtet; Weitere Untersuchungen dieses Modells sind erforderlich, um dem Zustand des menschlichen AKI gerecht zu werden. Darüber hinaus beeinflusst der Mausstamm auch die Anfälligkeit für AKI im IRI-Modell; Es ist wichtig, IRI-AKI-Bedingungen für einzelne Mauslinien festzulegen.
Zusammenfassend lässt sich sagen, dass das bilaterale IRI-AKI-Modell ein relatives und konsistentes Modell für pathogene Untersuchungen und Therapieansätze ist. Insbesondere werden mehrere kritische Punkte bei chirurgischen Eingriffen bereitgestellt, um die Übertragbarkeit dieses IRI-Modells zu gewährleisten. Schließlich heben wir hervor, dass die Ischämiezeit und die Körpertemperatur die Hauptdeterminanten sind, und wir erwähnen auch einige zusätzliche Faktoren, die die Variation innerhalb des IRI-Modells beeinflussen.
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Wir bedanken uns bei allen Teilnehmenden für die Mitarbeit an der aktuellen Studie. Diese Studie wurde durch die Finanzierung der Zhejiang Provincial Natural Science Foundation of China (LZ22H050001) und des Programms der Provinz Zhejiang für die Kultivierung hochrangiger innovativer Gesundheitstalente für Weiqiang Lin unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Animal hair clipper | FEIYUBIO | 19-7002 | |
| 1-ml syringes | Longreen | SR60061 | |
| Ethanol | Macklin | E885996 | |
| Gauze | FEIYUBIO | 19-5022 | |
| Homeothermic monitor system | Warmmate | 40 x 50 | |
| Needle holder | DKBT | CZQ-00160 | |
| Spreader | RWD | R22029-03 | |
| Sterile saline | Biosharp | BL158A | |
| Tissue scissors | DKBT | DC-YKJ1002 | |
| Tissue tweezers | DKBT | DK079904 | |
| Vascular clip | Fine Science Tools | 18055-02 | |
| Vicryl suture | Shanghai Jinhuan | 4 -0 |
Referenzen
- Al-Jaghbeer, M., Dealmeida, D., Bilderback, A., Ambrosino, R., Kellum, J. A. Clinical decision support for in-hospital AKI. J Am Soc Nephrol. 29 (2), 654-660 (2018).
- Kellum, J. A., Lameire, N. KDIGO AKI Guideline Work Group. Diagnosis, evaluation, and management of acute kidney injury: a KDIGO summary (Part 1). Crit Care. 17 (1), 204(2013).
- Zhang, C., et al. The Hippo pathway and its correlation with acute kidney injury. Zool Res. 43 (5), 897-910 (2022).
- He, L., et al. AKI on CKD: heightened injury, suppressed repair, and the underlying mechanisms. Kidney Int. 92 (5), 1071-1083 (2017).
- Sato, Y., Takahashi, M., Yanagita, M. Pathophysiology of AKI to CKD progression. Semin Nephrol. 40 (2), 206-215 (2020).
- Wang, Z., Zhang, C. From AKI to CKD: Maladaptive repair and the underlying mechanisms. Int J Mol Sci. 23 (18), 10880(2022).
- Hoste, E. A. J., et al. Global epidemiology and outcomes of acute kidney injury. Nat Rev Nephrol. 14 (10), 607-625 (2018).
- Wei, Q., Dong, Z. Mouse model of ischemic acute kidney injury: technical notes and tricks. Am J Physiol Renal Physiol. 303 (11), F1487-F1494 (2012).
- Skrypnyk, N. I., Siskind, L. J., Faubel, S., de Caestecker, M. P. Bridging translation for acute kidney injury with better preclinical modeling of human disease. Am J Physiol Renal Physiol. 310 (10), F972-F984 (2016).
- Ferenbach, D. A., Bonventre, J. V. Mechanisms of maladaptive repair after AKI leading to accelerated kidney ageing and CKD. Nat Rev Nephrol. 11 (5), 264-276 (2015).
- Zhang, J., et al. A two-stage bilateral ischemia-reperfusion injury-induced AKI to CKD transition model in mice. Am J Physiol Renal Physiol. 319 (2), F304-F311 (2020).
- Hukriede, N. A., et al. Experimental models of acute kidney injury for translational research. Nat Rev Nephrol. 18 (5), 277-293 (2022).
- Bao, Y., Yuan, Y., Chen, J., Lin, W. Kidney disease models: tools to identify mechanisms and potential therapeutic targets. Zool Res. 39 (2), 72-86 (2018).
- Bao, Y., et al. DNA demethylase Tet2 suppresses cisplatin-induced acute kidney injury. Cell Death Discov. 7, 167(2021).
- Rossiter, A., La, A., Koyner, J. L., Forni, L. G. New biomarkers in acute kidney injury. Crit Rev Clin Lab Sci. 5, 1-22 (2023).
- Hesketh, E. E., et al. Renal ischemia reperfusion injury: a mouse model of injury and regeneration. J Vis Exp. (88), e51816(2014).
- Zager, R. A., Altschuld, R. Body temperature: an important determinant of severity of ischemic renal injury. Am J Physiol. 251, F87-F93 (1986).
- Delbridge, M. S., Shrestha, B. M., Raftery, A. T., El Nahas, A. M., Haylor, J. L. The effect of body temperature in a rat model of renal ischemia-reperfusion injury. Transplant Proc. 39 (10), 2983-2985 (2007).
- Le Clef, N., Verhulst, A., D'Haese, P. C., Vervaet, B. A. Unilateral renal ischemia-reperfusion as a robust model for acute to chronic kidney injury in mice. PLoS One. 11 (3), 0152153(2016).
- Tannenbaum, C., Ellis, R. P., Eyssel, F., Zou, J., Schiebinger, L. Sex and gender analysis improves science and engineering. Nature. 575, 137-146 (2019).
- Lee, H. T., Ota-Setlik, A., Fu, Y., Nasr, S. H., Emala, C. W. Differential protective effects of volatile anesthetics against renal ischemia-reperfusion injury in vivo. Anesthesiology. 101 (6), 1313-1324 (2004).
- Heyman, S. N., Rosen, S., Rosenberger, C. Animal models of renal dysfunction: acute kidney injury. Expert Opin Drug Discov. 4 (6), 629-641 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten