Method Article
小鼠急性肾损伤的双侧肾缺血再灌注模型
摘要
缺血再灌注损伤 (IRI) 模型可用于急性肾损伤 (AKI) 发展的不同阶段,尤其是在 AKI 到慢性肾脏病 (CKD) 进展期间。在这里,我们描述了通过经腹入路在小鼠中开发 IRI 模型的程序,通过血管夹夹住肾蒂以诱导缺血性损伤。
摘要
急性肾损伤 (AKI) 定义为肾功能迅速下降,其中由于肾单位不可逆的丢失及其适应不良的修复,持续性肾功能障碍逐渐发展为慢性肾病 (CKD)。近年来,AKI 的发病率一直在增加,涉及多种病因,包括血容量不足、脓毒症、肾毒性、肌肉损伤和严重创伤,其中缺血再灌注损伤 (IRI) 占大多数发作。小鼠 IRI 模型的开发是通过手术夹闭肾蒂诱导的,这为 AKI 的临床前模型提供了强大且可控的工具。重要的是,IRI 模型部署在 AKI 开发的不同阶段,尤其是在 AKI 到 CKD 的过程中。尽管 IRI 模型在许多实验室中得到广泛应用,但一系列变量仍然影响着该模型的结果。在这里,我们描述了 IRI 模型开发的过程,为研究人员提供了一种可重复且可靠的方法来探索 AKI 发展和 AKI 进展为 CKD 的潜在发病机制。
引言
急性肾损伤 (AKI) 是一种严重的临床综合征,具有显着的发病率和死亡率,定义为 48 小时内血清肌酐增加 ≥ 0.3 mg/dL (26.5 μM/L) 或血清肌酐增加至 7 天内基线的 1.5 倍≥,或尿量< 0.5 mL/kg/h 持续 6 小时1,2,3.尽管进行了数十年的研究,但缺乏有效的 AKI 疗法来减轻肾脏损伤或加速肾脏恢复,并且相当一部分 AKI 患者会发展为慢性肾脏病 (CKD)4,5,6。复杂的分子和通路部分参与 AKI 及其进展,因此临床前模型提供了强大的工具来解开这些复杂性,以开发有效的治疗方式。
临床上,缺血再灌注损伤 (IRI) 损伤是各种情况下 AKI 的主要原因,包括心脏和肝脏手术、循环休克、血容量不足、败血症、肾血管闭塞或阻塞、肾移植等7。IRI-AKI 小鼠模型自 1960 年代以来一直在使用;该模型是通过对导致缺血的小鼠使用非创伤性夹闭肾蒂手术夹闭,然后通过移除夹子对肾血流进行再灌注而开发的。IRI-AKI 模型的典型特征是肾小管细胞死亡和进行性肾组织损伤。IRI 是 AKI 发病机制和治疗干预最常用的模型之一,原因如下:(1) 手术过程的简单性和安全性提高了 IRI-AKI 模型的存活率和成功率8;(2) 由于缺血是人类 AKI 的主要病因,因此 IRI-AKI 模型更适合用于评估临床 AKI 事件9;(3) IRI 模型可以呈现 AKI 不同阶段的肾损伤和组织病理学变化,也适用于研究从 AKI 到 CKD10 的进展。根据实验设计,IRI 诱导的 AKI 模型包括双侧 IRI、对侧肾脏完整的单侧 IRI 和同时对侧肾切除术的单侧 IRI。值得注意的是,双侧 IRI 模型被认为与 AKI 的人类病理状况更相关,因为两个肾脏都受到血液供应的影响11。IRI 模型适用于模拟肾移植、心脏搭桥、肾血管或保留肾单位手术后肾血流量减少的影响,以及在低血压的情况下9。在这里,我们描述了双侧 IRI 模型的程序,为研究人员提供了一种一致且可靠的方法来探索缺血诱导的 AKI 的潜在发病机制。
研究方案
使用 8 周龄、体重 25 g 的雄性 C57BL/6J 小鼠通过双侧缺血再灌注建立 AKI 模型。根据以前的研究,我们将体温保持在 36.5 °C-37 °C 左右,IRI 手术中肾缺血持续时间为 30 分钟12,13。每组共需要 6 只小鼠,假手术小鼠作为对照。本研究中的动物实验已获得浙江大学机构动物护理和使用委员会 (IACUC) 的批准,以保护动物的福利。所有动物研究程序均按照浙江大学的伦理准则和原则进行。
1. 术前准备
- 对所有手术器械进行高压灭菌。
- 通过在 7.6 mL 无菌盐水中加入 2 mL 氯胺酮和 0.4 mL 甲苯噻嗪来制备麻醉溶液。通过腹膜内注射用氯胺酮 (80 mg/kg) 和甲苯噻嗪 (16 mg/kg) 的混合物麻醉小鼠。使用脚趾捏反射评估麻醉深度。
- 将麻醉的小鼠放在恒温毯上,以确保其气道保持畅通无阻。将体温保持在 36.5-37 °C 范围内。
- 用 1% 盐酸四环素眼膏覆盖小鼠的眼睛,以防止麻醉时干燥。
- 用理发器剃掉腹部的毛发,并用聚维酮碘溶液清洁手术区域的皮肤 3 次。
2. 手术
- 用手术剪刀通过皮肤和肌肉层切开约 1-1.5 厘米的腹部正中切口,然后用扩张器打开腹腔。
- 通过移动腹膜后脂肪并用棉签将肠道和其他器官推到越位位置来暴露肾脏。肾脏位于腹膜后间隙,脊柱外侧约 0.5 cm,第 13 根肋骨下方。
- 用细尖镊子解剖肾蒂,以分离和去除筋膜和脂肪组织,并暴露左肾蒂。
- 使用固定镊子用血管夹夹住肾蒂,并确保血管损伤尽可能小。避免夹夹多余的肾窦脂肪,这可能导致不完全性肾缺血。
- 设置肾缺血持续时间,从夹紧 30 分钟开始。成功缺血的特点是肾脏在几分钟内逐渐从红色变为深紫色。
- 将肾脏移至腹膜后间隙。在对侧重复该过程,以暴露并夹住右肾蒂。
- 分别记录每一侧的缺血时间,以确保两个肾脏都能接收到确切的缺血持续时间。在缺血持续时间结束时重新打开切口并松开血管夹。
- 将肾脏置换到腹膜后间隙,然后用 Vijol 4-0 缝合线逐层缝合肌肉和皮肤。
注意:外科手术应在无菌条件下进行。手术过程中需要时用 75% 乙醇清洁手术台和器械。
3. 术后护理
- 通过腹膜内注射给予 0.5-1 mL 温热无菌盐水以补偿液体损失。
- 保持胸骨卧姿,直到小鼠恢复足够的意识。将鼠标放在恒温毯上,直到它完全清醒,然后回到笼子里。在完全恢复之前,不要将老鼠归还给其他动物。
- 前 3 天每 12 小时给予丁丙诺啡 0.05-0.10 mg/kg,以减轻术后疼痛。每天监测手术小鼠。
4. 模型评估
- 苏木精-伊红 (HE) 染色
- 在 IRI 后第 1 天、第 3 天、第 7 天或第 14 天通过腹膜内注射使用戊巴比妥钠对动物实施安乐死。
- 用 4% 多聚甲醛 (PFA) 固定新鲜的肾组织过夜,并在 4 °C 下储存在 75% 乙醇中。
- 脱水包埋后,将获得的样品切成 8 μm 厚进行染色。
- 在二甲苯中脱蜡组织切片,然后用浓度降低的乙醇再水化。
- 用苏木精和伊红对组织切片进行染色。
- 通过增加乙醇和二甲苯的浓度使组织切片脱水。
- 肾功能检测
- 麻醉后使用眼球采血方法采集血样。
- 将血液样品以 12000 x g 离心 10 分钟以分离血清。
- 通过自动干化学分析仪测定血清肌酐和血尿素氮 (BUN),以监测肾功能。
- 实时荧光定量 PCR (RT-PCR)
- 使用快速 RNA 提取试剂盒从肾组织中提取总 RNA,然后用逆转录酶混合物试剂盒合成 cDNA。使用 SYBR Green Premix 试剂盒进行 RT-PCR,并在 RT-PCR 仪器上运行。此处使用的引物序列在14 日之前报道:KIM1 向前,5'-GCTGCTACTGCTCCTTGTGA-3';反向 5'-GGAAGGCAACCACGCTTAGA-3';NGAL 前锋,5'-GGCCAGTTCACTCTGGGAAA-3;反向 5'- TGGCGAACTGGTTGTAGTCC-3';GAPDH 正向,5'-GGTGAAGGTCGGTGTGAACG-3';反向 5'-CTCGCTCCTGGAAGATGGTG-3'。
结果
手术期间的肾脏状态
成功缺血的特点是肾脏在 1-2 min内逐渐由红色变为深紫色,成功再灌注的特点是肾脏在 1-2 min内逐渐由深紫色变为红色。
手术后肾脏的组织学
HE 和过碘酸希夫 (PAS) 染色是验证急性肾损伤的直接方法。在缺血再灌注损伤模型中,主要受伤部位是近端肾小管的 S3 段。肾小管损伤的典型表现包括严重的肾小管扩张和破坏、刷状边缘缺失、碎屑脱落和细胞凋亡。肾小管损伤也以盲法方式通过受损小管的百分比进行评分:得分 0,无损伤;评分 1,<25% 的小管受损;评分 2,25%-50% 的小管受损;评分 3,50%-75% 的小管受损;评分 4,>75% 的小管受损。我们证实了缺血诱导的 AKI 中肾小管损伤和肾小管损伤评分升高的特征性病理变化 (图 1A-B)。
手术后肾脏的功能
肾功能下降可以通过血清肌酐和 BUN 水平升高来评估,这些水平是通过自动干化学分析仪检测到的(图 1C-D)。
手术后肾小管损伤
中性粒细胞明胶酶相关脂质运载蛋白 (NGAL) 和肾损伤分子 1 (KIM1) 是评估肾小管功能障碍以早期识别 AKI15 的成熟且敏感的生物标志物。事实上,我们观察到早期肾小管损伤标志物 NGAL 和 KIM1 的表达在缺血诱导的 AKI 中升高(图 1 E)。
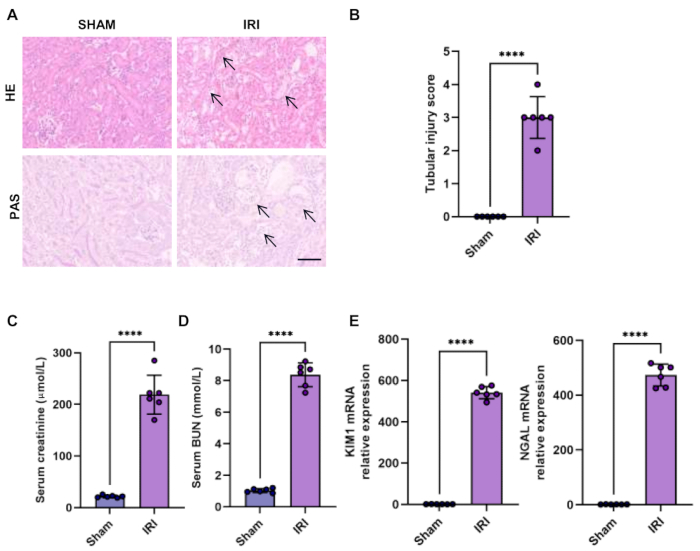
图 1:双侧 IRI 模型中肾脏的组织学和功能。 (A-B)肾切片的苏木精-曙红染色 (HE) 和高碘酸-希夫染色 (PAS) 显示双侧 IRI 模型 (比例尺,100 μm) 中的肾损伤和肾小管损伤评分的量化。箭头显示肾小管刷状边界缺失、肾小管扩张和破坏、上皮细胞扁平和肾小管上皮细胞脱落。(C-D)假小鼠和双侧 IRI 小鼠的血清肌酐和 BUN 水平。(E) KIM1 和 NGAL 在假小鼠和双侧 IRI 小鼠肾脏中相对表达的 RT-qPCR 分析。数据以平均值± SD 表示。使用 Student t 检验进行统计分析。P < 0.0001。 请单击此处查看此图的较大版本。
讨论
在本文中,我们提供了肾脏 IRI 模型的详细程序,随后强调它是 AKI 和 AKI 进展为 CKD 的稳健模型。此外,我们还展示了肾损伤的两个主要标准的影响,包括肾脏组织学和功能。
要获得可重复且可靠的模型,需要强调外科手术中的几个关键点。对于腹部手术,建议在中线切口处露出肾脏,以尽量减少与手术相关的创伤。由于腹膜后脂肪,很难完全解剖肾蒂,因此,用一对镊子通过肾脏来回将肾蒂从脂肪中剥离。此外,建议使用相同的血管夹,以保持手术过程的稳定性,并注意手术过程中血管夹是否有磨损。此外,通过补充生理盐水来防止小鼠脱水也很重要,因为液体流失会导致手术过程中的肾损伤。
在 IRI 的外科手术中需要强调几种重要的故障排除方法。首先,在分离肾脏和椎弓根的同时,很难解决肾出血。大多数出血可以通过充分压迫渗出点来控制,而出血量> 0.5 mL 可能会诱发出血性休克。在这种情况下,对小鼠实施安乐死并将其排除在研究之外。其次,肾脏不完全缺血是另一个需要注意的方面。首先,肾蒂分离不完全会导致较小的缺血性损伤。如果肾蒂没有完全隔离,血管夹可能会导致不完全闭塞,作者可以更换血管夹以确认肾脏完全缺血。建议在手术过程中使用相同的血管夹并更新磨损的夹。第三,血管夹移除后肾再灌注障碍可能是由于血管病变或血凝块形成,对此类小鼠实施安乐死并将此类小鼠排除在研究之外。
在 IRI 模型中,几个关键变量会影响肾损伤的严重程度。缺血时间和体温是肾损伤的主要决定因素。正如以前的研究报道的那样,已发现双侧肾缺血 25-30 分钟后肾小管损伤进行性。随着缺血持续时间每 2 分钟增加,肾小管损伤显着加重,缺血持续时间超过 60 分钟可能导致急性肾小管坏死16。此外,核心体温会显著影响 IRI 模型的结果。不出所料,体温较高 (36-37 °C) 的小鼠具有更明显的效果,而在缺血期间温度较低 (33-35 °C) 的小鼠中没有观察到明显变化 8,17。体温对 AKI 严重程度的影响与代谢有关:(1) 体温升高导致缺血期间细胞膜损伤和细胞内能量储存减少;(2) 随着体温升高,肌苷和次黄嘌呤水平增加,再灌注时自由基的产生增加18,19。除了缺血的持续时间和体温外,为了建立一致的 AKI IRI 模型,还应考虑几个因素,例如小鼠品系、年龄、性别、体重、脱水状态、麻醉、手术时间等20,21。上述可变因素在实验设置中应被视为一致。
当前的 IRI-AKI 模型存在一些限制。首先,训练有素且技术娴熟的作者对于建立一致且可靠的缺血性 AKI 模型至关重要,并且应利用系统的外科培训来解决技术问题。此外,在小鼠 IRI 模型中组织学分析中肾损伤的严重程度在人 AKI22 中很少观察到;需要进一步探索该模型以匹配人类 AKI 的状态。此外,小鼠品系还会影响 IRI 模型中对 AKI 的易感性;为单个小鼠细胞系建立 IRI-AKI 条件很重要。
总之,双侧 IRI-AKI 模型是病原学研究和治疗方法的相对且一致的模型。值得注意的是,提供了外科手术中的几个关键点以确保该 IRI 模型的可转移性。最后,我们强调缺血时间和体温是主要决定因素,我们还提到了一些影响 IRI 模型内变化的其他因素。
披露声明
作者声明没有利益冲突。
致谢
我们感谢所有参与者在当前研究中的合作。本研究得到了浙江省自然科学基金 (LZ22H050001) 和浙江省高层次创新健康人才培养计划对林伟强的资助。
材料
| Name | Company | Catalog Number | Comments |
| Animal hair clipper | FEIYUBIO | 19-7002 | |
| 1-ml syringes | Longreen | SR60061 | |
| Ethanol | Macklin | E885996 | |
| Gauze | FEIYUBIO | 19-5022 | |
| Homeothermic monitor system | Warmmate | 40 x 50 | |
| Needle holder | DKBT | CZQ-00160 | |
| Spreader | RWD | R22029-03 | |
| Sterile saline | Biosharp | BL158A | |
| Tissue scissors | DKBT | DC-YKJ1002 | |
| Tissue tweezers | DKBT | DK079904 | |
| Vascular clip | Fine Science Tools | 18055-02 | |
| Vicryl suture | Shanghai Jinhuan | 4 -0 |
参考文献
- Al-Jaghbeer, M., Dealmeida, D., Bilderback, A., Ambrosino, R., Kellum, J. A. Clinical decision support for in-hospital AKI. J Am Soc Nephrol. 29 (2), 654-660 (2018).
- Kellum, J. A., Lameire, N. KDIGO AKI Guideline Work Group. Diagnosis, evaluation, and management of acute kidney injury: a KDIGO summary (Part 1). Crit Care. 17 (1), 204 (2013).
- Zhang, C., et al. The Hippo pathway and its correlation with acute kidney injury. Zool Res. 43 (5), 897-910 (2022).
- He, L., et al. AKI on CKD: heightened injury, suppressed repair, and the underlying mechanisms. Kidney Int. 92 (5), 1071-1083 (2017).
- Sato, Y., Takahashi, M., Yanagita, M. Pathophysiology of AKI to CKD progression. Semin Nephrol. 40 (2), 206-215 (2020).
- Wang, Z., Zhang, C. From AKI to CKD: Maladaptive repair and the underlying mechanisms. Int J Mol Sci. 23 (18), 10880 (2022).
- Hoste, E. A. J., et al. Global epidemiology and outcomes of acute kidney injury. Nat Rev Nephrol. 14 (10), 607-625 (2018).
- Wei, Q., Dong, Z. Mouse model of ischemic acute kidney injury: technical notes and tricks. Am J Physiol Renal Physiol. 303 (11), F1487-F1494 (2012).
- Skrypnyk, N. I., Siskind, L. J., Faubel, S., de Caestecker, M. P. Bridging translation for acute kidney injury with better preclinical modeling of human disease. Am J Physiol Renal Physiol. 310 (10), F972-F984 (2016).
- Ferenbach, D. A., Bonventre, J. V. Mechanisms of maladaptive repair after AKI leading to accelerated kidney ageing and CKD. Nat Rev Nephrol. 11 (5), 264-276 (2015).
- Zhang, J., et al. A two-stage bilateral ischemia-reperfusion injury-induced AKI to CKD transition model in mice. Am J Physiol Renal Physiol. 319 (2), F304-F311 (2020).
- Hukriede, N. A., et al. Experimental models of acute kidney injury for translational research. Nat Rev Nephrol. 18 (5), 277-293 (2022).
- Bao, Y., Yuan, Y., Chen, J., Lin, W. Kidney disease models: tools to identify mechanisms and potential therapeutic targets. Zool Res. 39 (2), 72-86 (2018).
- Bao, Y., et al. DNA demethylase Tet2 suppresses cisplatin-induced acute kidney injury. Cell Death Discov. 7, 167 (2021).
- Rossiter, A., La, A., Koyner, J. L., Forni, L. G. New biomarkers in acute kidney injury. Crit Rev Clin Lab Sci. 5, 1-22 (2023).
- Hesketh, E. E., et al. Renal ischemia reperfusion injury: a mouse model of injury and regeneration. J Vis Exp. (88), e51816 (2014).
- Zager, R. A., Altschuld, R. Body temperature: an important determinant of severity of ischemic renal injury. Am J Physiol. 251, F87-F93 (1986).
- Delbridge, M. S., Shrestha, B. M., Raftery, A. T., El Nahas, A. M., Haylor, J. L. The effect of body temperature in a rat model of renal ischemia-reperfusion injury. Transplant Proc. 39 (10), 2983-2985 (2007).
- Le Clef, N., Verhulst, A., D'Haese, P. C., Vervaet, B. A. Unilateral renal ischemia-reperfusion as a robust model for acute to chronic kidney injury in mice. PLoS One. 11 (3), 0152153 (2016).
- Tannenbaum, C., Ellis, R. P., Eyssel, F., Zou, J., Schiebinger, L. Sex and gender analysis improves science and engineering. Nature. 575, 137-146 (2019).
- Lee, H. T., Ota-Setlik, A., Fu, Y., Nasr, S. H., Emala, C. W. Differential protective effects of volatile anesthetics against renal ischemia-reperfusion injury in vivo. Anesthesiology. 101 (6), 1313-1324 (2004).
- Heyman, S. N., Rosen, S., Rosenberger, C. Animal models of renal dysfunction: acute kidney injury. Expert Opin Drug Discov. 4 (6), 629-641 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。