Method Article
Modelo de isquemia-reperfusión renal bilateral para la lesión renal aguda en ratones
En este artículo
Resumen
El modelo de lesión por isquemia-reperfusión (IRI) se puede utilizar en diferentes etapas del desarrollo de la lesión renal aguda (IRA), especialmente durante la progresión de la LRA a la enfermedad renal crónica (ERC). Aquí, describimos el procedimiento para el desarrollo del modelo IRI en ratones a través de un abordaje transabdominal, pinzando pedículos renales a través de un clip vascular para inducir lesión isquémica.
Resumen
La lesión renal aguda (IRA) se define como un rápido deterioro de la función renal, en el que la disfunción renal persistente progresa gradualmente a enfermedad renal crónica (ERC) debido a la pérdida irreversible de nefronas y su reparación desadaptativa. En los últimos años, la incidencia de LRA ha ido en aumento en diversas etiologías, incluyendo la depleción de volumen, la sepsis, la nefrotoxicidad, la lesión muscular y el traumatismo mayor, en el que la lesión por isquemia-reperfusión (IRI) representa la mayoría de los episodios. El desarrollo del modelo IRI en ratones es inducido por el pinzamiento quirúrgico de los pedículos renales, lo que proporciona herramientas potentes y controlables para los modelos preclínicos de LRA. Es importante destacar que el modelo IRI se despliega en diferentes etapas del desarrollo de AKI, especialmente en los procesos de AKI a CKD. A pesar de que el modelo IRI está ampliamente practicado en muchos laboratorios, una serie de variables siguen influyendo en los resultados de este modelo. Aquí, describimos el procedimiento de desarrollo del modelo IRI para proporcionar un método repetible y confiable para que los investigadores exploren la patogénesis subyacente en el desarrollo de LRA y la progresión de LRA a ERC.
Introducción
La lesión renal aguda (IRA) es un síndrome clínico grave con una morbilidad y mortalidad significativas, definida como un aumento de la creatinina sérica de ≥ 0,3 mg/dl (26,5 μM/l) en 48 h o un aumento de la creatinina sérica hasta ≥ 1,5 veces el basal en un plazo de 7 días, o un volumen de orina < 0,5 mL/kg/h durante 6 h1, 2,3. A pesar de décadas de investigación, no existe una terapia eficaz para la LRA que alivie el daño renal o acelere la recuperación renal, y una proporción considerable de pacientes con LRA progresa a enfermedad renal crónica (ERC)4,5,6. Las moléculas y vías complejas están implicadas en parte en la LRA y en su progresión, por lo que los modelos preclínicos proporcionan herramientas poderosas para desentrañar estas complejidades para el desarrollo de modalidades terapéuticas eficientes.
Clínicamente, la lesión por isquemia-reperfusión (IRI) es la principal causa de LRA en diversas afecciones, incluyendo cirugías cardíacas y hepáticas, shock circulatorio, depleción de volumen, sepsis, oclusión u obstrucción vascular renal, trasplante renal,etc. 7. El modelo de ratón IRI-AKI ha estado en uso desde la década de 1960; Este modelo se desarrolló mediante pinzamiento quirúrgico de los pedículos renales con pinzamientos no traumáticos en ratones que condujeron a isquemia y seguido de reperfusión del flujo sanguíneo renal mediante la eliminación de los pinzamientos. El modelo IRI-LRA se caracteriza típicamente por muerte de células tubulares renales y daño progresivo del tejido renal. El IRI es uno de los modelos más utilizados para la patogenia y la intervención terapéutica en la LRA por varias razones: (1) La simplicidad y seguridad del procedimiento quirúrgico mejoran la tasa de supervivencia y la tasa de éxito del modelo IRI-LRA8; (2) Dado que la isquemia es una etiología importante en la LRA humana, el modelo IRI-LRA se utiliza mejor para evaluar el evento clínico de LRA9; (3) El modelo IRI podría presentar lesión renal y cambios histopatológicos en diferentes estadios de la LRA, lo que también es aplicable al estudio de la progresión de LRA a ERC10. Dependiendo del diseño experimental, los modelos de LRA inducida por IRI incluyen IRI bilateral, IRI unilateral con riñón contralateral intacto e IRI unilateral con nefrectomía contralateral simultánea. En particular, el modelo de IRI bilateral se considera más relevante para las condiciones patológicas humanas de LRA porque ambos riñones han sido afectados por el suministro de sangre11. El modelo IRI es aplicable para simular los efectos de la reducción del flujo sanguíneo renal después de un trasplante renal, un bypass cardíaco, una cirugía renal vascular o conservadora de nefronas, así como en el contexto de la hipotensión9. Aquí, describimos el procedimiento para un modelo de IRI bilateral para proporcionar un método consistente y confiable para que los investigadores exploren la patogénesis subyacente en la LRA inducida por isquemia.
Protocolo
Se utilizaron ratones machos C57BL/6J de 8 semanas de edad y 25 g de peso para establecer el modelo de LRA mediante isquemia-reperfusión bilateral. De acuerdo con estudios previos, mantenemos la temperatura corporal en torno a 36,5 °C-37 °C, y la duración de la isquemia renal es de 30 min en la cirugía IRI12,13. Se necesitaron un total de 6 ratones para cada grupo, y los ratones operados simuladamente sirvieron como controles. Los experimentos con animales en este estudio han sido aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Zhejiang para proteger el bienestar de los animales. Todos los procedimientos de investigación con animales se llevaron a cabo siguiendo las directrices y principios éticos de la Universidad de Zhejiang.
1. Preparación preoperatoria
- Esterilizar a alta presión todo el instrumental quirúrgico.
- Prepare la solución anestésica añadiendo 2 mL de ketamina y 0,4 mL de xilacina en 7,6 mL de solución salina estéril. Anestesiar al ratón con una mezcla de ketamina (80 mg/kg) y xilacina (16 mg/kg) mediante inyección intraperitoneal. Evalúe la profundidad anestésica usando el reflejo de pellizco de los dedos del pie.
- Coloque el ratón anestesiado sobre la manta homeotérmica para asegurarse de que sus vías respiratorias permanezcan sin obstrucciones. Mantenga la temperatura corporal en el rango de 36,5-37 °C.
- Cubra los ojos del ratón con ungüento ocular de clorhidrato de tetraciclina al 1% para evitar la sequedad mientras está bajo anestesia.
- Afeitar el vello del abdomen con una cortadora de pelo y limpiar la piel de la zona quirúrgica con una solución de povidona yodada para 3x.
2. Cirugía
- Realice una incisión en la mediana abdominal de aproximadamente 1-1,5 cm con unas tijeras quirúrgicas a través de la capa de piel y músculo y abra la cavidad abdominal con un separador.
- Exponga el riñón moviendo la grasa retroperitoneal y empujando los intestinos y otros órganos hacia el fuera de juego con un hisopo de algodón. El riñón se encuentra en el espacio retroperitoneal, alrededor de 0,5 cm lateral a la columna vertebral, y por debajo de la13ª costilla.
- Diseccionar el pedículo renal con pinzas finas y puntiagudas para separar y eliminar la fascia y el tejido adiposo y exponer los pedículos renales izquierdos.
- Pinzar los pedículos renales con una pinza vascular con pinzas de sujeción y asegurarse de que el daño vascular sea lo menor posible. Evite pinzar la grasa redundante del seno renal, que puede provocar isquemia renal incompleta.
- Establezca la duración de la isquemia renal, comenzando con el pinzamiento durante 30 min. La característica de la isquemia exitosa es que el riñón cambia gradualmente de rojo a púrpura oscuro en unos pocos minutos.
- Mover el riñón hacia el espacio retroperitoneal. Repita el procedimiento en el lado contralateral para exponer y sujetar los pedículos renales derechos.
- Registre el tiempo de isquemia en cada lado por separado para asegurarse de que ambos riñones reciban la duración exacta de la isquemia. Vuelva a abrir la incisión y suelte el clip vascular al final de la duración de la isquemia.
- Reemplace el riñón en el espacio retroperitoneal y luego suture el músculo y la piel capa por capa con la sutura Vicryl 4-0.
NOTA: Los procedimientos quirúrgicos deben realizarse en condiciones estériles. Limpie la mesa quirúrgica y los instrumentos con etanol al 75% durante la operación cuando sea necesario.
3. Cuidados postoperatorios
- Administrar 0,5-1 mL de suero fisiológico tibio y estéril mediante inyección intraperitoneal para compensar la pérdida de líquido.
- Mantenga la decúbito esternal con atención hasta que el ratón haya recuperado la conciencia suficiente. Coloque al ratón en la manta homeotérmica hasta que recupere la plena conciencia, luego regrese a su jaula. No devuelva el ratón a la compañía de otros animales hasta que esté completamente recuperado.
- Administre buprenorfina 0,05-0,10 mg/kg cada 12 h durante los 3 primeros días para aliviar el dolor postquirúrgico. Monitoree los ratones quirúrgicos todos los días.
4. Evaluación del modelo
- Tinción con hematoxilina-eosina (HE)
- Eutanasiar a los animales con pentobarbital sódico por inyección intraperitoneal en los días 1, 3, 7 o 14 después de la IRI.
- Fije los tejidos renales frescos con paraformaldehído (PFA) al 4% durante la noche y almacene en etanol al 75% a 4 °C.
- Después de la deshidratación y la inclusión, corte las muestras obtenidas en un espesor de 8 μm para teñirlas.
- Desparafinar las secciones de tejido en xileno y luego rehidratar con concentraciones decrecientes de etanol.
- Teñir las secciones de tejido con hematoxilina y eosina.
- Deshidratar las secciones de tejido aumentando las concentraciones de etanol y xileno.
- Ensayo de función renal
- Recoja muestras de sangre utilizando el método de recolección de sangre del globo ocular después de la anestesia.
- Centrifugar las muestras de sangre a 12000 x g durante 10 min para separar el suero.
- Determine la creatinina sérica y el nitrógeno ureico en sangre (BUN) mediante el analizador automático de química seca para controlar la función renal.
- PCR en tiempo real (RT-PCR)
- Extraiga el ARN total de los tejidos renales utilizando un kit de extracción rápida de ARN y, a continuación, sintetice el ADNc con un kit de mezcla de transcriptasa inversa. Realice RT-PCR con el kit de premezcla verde SYBR y ejecútelo en el instrumento RT-PCR. Las secuencias de cebadores utilizadas aquí se informaron antes de14: KIM1 adelante, 5'-GCTGCTACTGCTCCTTGTGA-3'; reverso 5'-GGAAGGCAACCACGCTTAGA-3'; NGAL delantero, 5'-GGCCAGTTCACTCTGGGAAA-3; reverso 5'- TGGCGAACTGGTTGTAGTCC-3'; GAPDH delantero, 5'-GGTGAAGGTCGGTGTGAACG-3'; reverso 5'-CTCGCTCCTGGAAGATGGTG-3'.
Resultados
Estado del riñón durante la cirugía
La característica de la isquemia exitosa es que el riñón cambia gradualmente de rojo a púrpura oscuro en 1-2 minutos, y la reperfusión exitosa se caracteriza por el cambio gradual del riñón de púrpura oscuro a rojo en 1-2 minutos.
Histología del riñón después de la cirugía
La HE y la tinción de Schiff con ácido peryódico (PAS) son las formas directas de verificar la lesión renal aguda. En el modelo de lesión por isquemia-reperfusión, el sitio lesionado dominante es el segmento S3 de los túbulos proximales. Las manifestaciones clásicas del daño tubular renal incluyen dilatación y disrupción tubular grave, pérdida del borde en cepillo, restos desprendidos y apoptosis celular. El daño tubular también se puntúa por el porcentaje de túbulos dañados de forma cegada: puntuación 0, sin daño; puntuación 1, <25% túbulos dañados; puntuación 2, 25%-50% túbulos dañados; puntuación 3, 50%-75% túbulos dañados; Puntuación 4, >75% túbulos dañados. Confirmamos los cambios patológicos característicos de la lesión tubular renal y la puntuación elevada de la lesión tubular en la LRA inducida por isquemia (Figura 1A-B).
Función del riñón después de la cirugía
La disminución de la función renal puede evaluarse mediante niveles elevados de creatinina sérica y BUN, que se detectaron mediante un analizador automático de química seca (Figura 1C-D).
Lesión del túbulo renal después de la cirugía
La lipocalina asociada a gelatinasa de neutrófilos (NGAL) y la molécula de lesión renal-1 (KIM1) son biomarcadores bien establecidos y sensibles para evaluar la disfunción tubular renal para la identificación temprana de LRA15. De hecho, observamos que la expresión de los marcadores de lesión tubular temprana NGAL y KIM1 estaba elevada en la LRA inducida por isquemia (Figura 1 E).
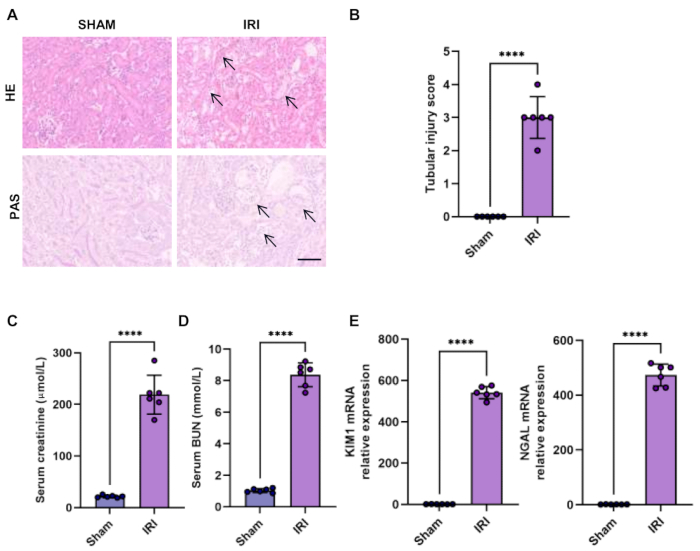
Figura 1: Histología y función del riñón en el modelo IRI bilateral. (A-B) La tinción de hematoxilina-eosina (HE) y la tinción de ácido peryódico-Schiff (PAS) de secciones renales mostraron lesión renal en el modelo IRI bilateral (barras de escala, 100 μm) y cuantificación de la puntuación de lesión tubular. Las flechas muestran pérdida del borde tubular en cepillo, dilatación y disrupción tubular, células epiteliales aplanadas y desprendimiento de células epiteliales tubulares. (C-D) Creatinina sérica y nivel de BUN de ratón simulado e IRI bilateral. (E) Análisis RT-qPCR de la expresión relativa de KIM1 y NGAL en el riñón de ratón IRI simulado y bilateral. Los datos se presentaron como media ± DE. El análisis estadístico se realizó mediante la prueba t de Student. P < 0,0001. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este trabajo hemos realizado un procedimiento detallado sobre el modelo de IRI renal, destacando posteriormente que es un modelo robusto para la progresión de LRA e LRA a ERC. Además, demostramos el impacto de los dos criterios principales de la lesión renal, incluida la histología y la función renal.
Es necesario enfatizar varios puntos clave en los procedimientos quirúrgicos para un modelo repetible y confiable. Para la cirugía abdominal, se recomienda una incisión en la línea media para exponer el riñón y minimizar el trauma asociado con la cirugía. Es difícil diseccionar el pedículo renal por completo debido a la grasa retroperitoneal, por lo tanto, pegue el pedículo renal de la grasa con un par de pinzas a través del riñón hacia adelante y hacia atrás. Además, se recomienda aplicar la misma pinza vascular para mantener la estabilidad del proceso quirúrgico y prestar atención a si hay desgaste en la pinza vascular durante el procedimiento. Además, también es importante prevenir la deshidratación de los ratones mediante la administración de suplementos salinos, debido a la pérdida de líquidos que contribuiría a la lesión renal durante la cirugía.
Es necesario enfatizar varios métodos importantes de resolución de problemas en los procedimientos quirúrgicos de IRI. En primer lugar, es difícil solucionar el problema de la hemorragia renal mientras se separa el riñón y su pedículo. La mayor parte del sangrado podría controlarse comprimiendo adecuadamente el punto de supuración, mientras que el volumen de sangrado > 0,5 mL puede inducir un shock hemorrágico. En este caso, eutanasia y excluir al ratón de la investigación. En segundo lugar, la isquemia incompleta del riñón es otro aspecto al que hay que prestar atención. En primer lugar, la separación incompleta del pedículo renal conduciría a una lesión isquémica menor. Si el pedículo renal no está completamente aislado, el pinzamiento vascular puede causar una oclusión incompleta, y el operador puede cambiar el pinzamiento vascular para confirmar la isquemia completa del riñón. Se recomienda utilizar la misma pinza vascular durante el procedimiento y renovar la pinza desgastada. En tercer lugar, el trastorno de reperfusión renal después de la extracción del pinzamiento vascular puede deberse a lesiones vasculares o a la formación de coágulos de sangre, por lo que se debe aplicar la eutanasia y excluir a estos ratones de la investigación.
Varias variables críticas influyen en la gravedad de la lesión renal en el modelo IRI. La isquemia, el tiempo y la temperatura corporal son los principales determinantes de la lesión renal. Como se informó en estudios previos, se ha encontrado que la lesión tubular es progresiva después de la isquemia renal bilateral durante 25-30 min. La lesión tubular se agrava significativamente ya que la duración isquémica aumenta cada 2 min, y una duración isquémica de más de 60 min puede resultar en necrosis tubular aguda16. Además, la temperatura corporal central tiene un impacto significativo en el resultado en el modelo IRI. Como era de esperar, los ratones con temperaturas corporales más altas (36-37 °C) tienen un efecto más pronunciado, mientras que no se han observado cambios evidentes en ratones con temperaturas más bajas (33-35 °C) durante la isquemia 8,17. El efecto de la temperatura corporal sobre la gravedad de la LRA está relacionado con el metabolismo: (1) el aumento de la temperatura corporal provoca el daño de las membranas celulares y la disminución de las reservas de energía intracelular durante la isquemia; (2) El aumento de los niveles de inosina e hipoxantina con una temperatura corporal más alta produce un aumento de la producción de radicales libres en la reperfusión18,19. Además de la duración de la isquemia y la temperatura corporal, se deben tener en cuenta varios factores para un modelo IRI consistente de LRA, como la cepa del ratón, la edad, el sexo, el peso corporal, el estado de deshidratación, la anestesia, el tiempo quirúrgico, etc.20,21. Los factores variables anteriores deben considerarse consistentes en la configuración experimental.
Existen algunas limitaciones en el modelo actual de IRI-AKI. En primer lugar, un operador bien entrenado y hábil es esencial para establecer un modelo consistente y confiable de LRA isquémica, y se debe utilizar la capacitación quirúrgica sistemática para los problemas técnicos. Además, la gravedad de la lesión renal en el análisis histológico en el modelo IRI de ratón rara vez se observa en la LRAhumana 22; Es necesario seguir explorando este modelo para que coincida con el estado de la LRA humana. Además, la cepa del ratón también afecta a la susceptibilidad a la LRA en el modelo IRI; es importante establecer condiciones IRI-AKI para líneas de ratón individuales.
En conclusión, el modelo bilateral de IRI-LRA es un modelo relativo y consistente para la investigación patogénica y los enfoques terapéuticos. En particular, se proporcionan varios puntos críticos en los procedimientos quirúrgicos para garantizar la transferibilidad de este modelo IRI. Por último, destacamos que el tiempo de isquemia y la temperatura corporal son los principales determinantes, y también mencionamos algunos factores adicionales que influyen en la variación dentro del modelo IRI.
Divulgaciones
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Expresamos nuestro agradecimiento a todos los participantes por su colaboración en el presente estudio. Este estudio contó con el apoyo financiero de la Fundación Provincial de Ciencias Naturales de Zhejiang de China (LZ22H050001) y el programa provincial de Zhejiang para el cultivo de talentos innovadores de alto nivel en salud para Weiqiang Lin.
Materiales
| Name | Company | Catalog Number | Comments |
| Animal hair clipper | FEIYUBIO | 19-7002 | |
| 1-ml syringes | Longreen | SR60061 | |
| Ethanol | Macklin | E885996 | |
| Gauze | FEIYUBIO | 19-5022 | |
| Homeothermic monitor system | Warmmate | 40 x 50 | |
| Needle holder | DKBT | CZQ-00160 | |
| Spreader | RWD | R22029-03 | |
| Sterile saline | Biosharp | BL158A | |
| Tissue scissors | DKBT | DC-YKJ1002 | |
| Tissue tweezers | DKBT | DK079904 | |
| Vascular clip | Fine Science Tools | 18055-02 | |
| Vicryl suture | Shanghai Jinhuan | 4 -0 |
Referencias
- Al-Jaghbeer, M., Dealmeida, D., Bilderback, A., Ambrosino, R., Kellum, J. A. Clinical decision support for in-hospital AKI. J Am Soc Nephrol. 29 (2), 654-660 (2018).
- Kellum, J. A., Lameire, N. KDIGO AKI Guideline Work Group. Diagnosis, evaluation, and management of acute kidney injury: a KDIGO summary (Part 1). Crit Care. 17 (1), 204 (2013).
- Zhang, C., et al. The Hippo pathway and its correlation with acute kidney injury. Zool Res. 43 (5), 897-910 (2022).
- He, L., et al. AKI on CKD: heightened injury, suppressed repair, and the underlying mechanisms. Kidney Int. 92 (5), 1071-1083 (2017).
- Sato, Y., Takahashi, M., Yanagita, M. Pathophysiology of AKI to CKD progression. Semin Nephrol. 40 (2), 206-215 (2020).
- Wang, Z., Zhang, C. From AKI to CKD: Maladaptive repair and the underlying mechanisms. Int J Mol Sci. 23 (18), 10880 (2022).
- Hoste, E. A. J., et al. Global epidemiology and outcomes of acute kidney injury. Nat Rev Nephrol. 14 (10), 607-625 (2018).
- Wei, Q., Dong, Z. Mouse model of ischemic acute kidney injury: technical notes and tricks. Am J Physiol Renal Physiol. 303 (11), F1487-F1494 (2012).
- Skrypnyk, N. I., Siskind, L. J., Faubel, S., de Caestecker, M. P. Bridging translation for acute kidney injury with better preclinical modeling of human disease. Am J Physiol Renal Physiol. 310 (10), F972-F984 (2016).
- Ferenbach, D. A., Bonventre, J. V. Mechanisms of maladaptive repair after AKI leading to accelerated kidney ageing and CKD. Nat Rev Nephrol. 11 (5), 264-276 (2015).
- Zhang, J., et al. A two-stage bilateral ischemia-reperfusion injury-induced AKI to CKD transition model in mice. Am J Physiol Renal Physiol. 319 (2), F304-F311 (2020).
- Hukriede, N. A., et al. Experimental models of acute kidney injury for translational research. Nat Rev Nephrol. 18 (5), 277-293 (2022).
- Bao, Y., Yuan, Y., Chen, J., Lin, W. Kidney disease models: tools to identify mechanisms and potential therapeutic targets. Zool Res. 39 (2), 72-86 (2018).
- Bao, Y., et al. DNA demethylase Tet2 suppresses cisplatin-induced acute kidney injury. Cell Death Discov. 7, 167 (2021).
- Rossiter, A., La, A., Koyner, J. L., Forni, L. G. New biomarkers in acute kidney injury. Crit Rev Clin Lab Sci. 5, 1-22 (2023).
- Hesketh, E. E., et al. Renal ischemia reperfusion injury: a mouse model of injury and regeneration. J Vis Exp. (88), e51816 (2014).
- Zager, R. A., Altschuld, R. Body temperature: an important determinant of severity of ischemic renal injury. Am J Physiol. 251, F87-F93 (1986).
- Delbridge, M. S., Shrestha, B. M., Raftery, A. T., El Nahas, A. M., Haylor, J. L. The effect of body temperature in a rat model of renal ischemia-reperfusion injury. Transplant Proc. 39 (10), 2983-2985 (2007).
- Le Clef, N., Verhulst, A., D'Haese, P. C., Vervaet, B. A. Unilateral renal ischemia-reperfusion as a robust model for acute to chronic kidney injury in mice. PLoS One. 11 (3), 0152153 (2016).
- Tannenbaum, C., Ellis, R. P., Eyssel, F., Zou, J., Schiebinger, L. Sex and gender analysis improves science and engineering. Nature. 575, 137-146 (2019).
- Lee, H. T., Ota-Setlik, A., Fu, Y., Nasr, S. H., Emala, C. W. Differential protective effects of volatile anesthetics against renal ischemia-reperfusion injury in vivo. Anesthesiology. 101 (6), 1313-1324 (2004).
- Heyman, S. N., Rosen, S., Rosenberger, C. Animal models of renal dysfunction: acute kidney injury. Expert Opin Drug Discov. 4 (6), 629-641 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados