Method Article
高分子電解質多層テンプレートを用いたアストロサイトおよび神経膠芽腫細胞の直接接触共培養
要約
このプロトコルは、高分子電解質多層膜(PEM)上のマイクロコンタクト印刷を利用して、U87またはA172 GBM細胞および初代アストロサイトをパターン化する、パターン化された直接接触神経膠腫-星状細胞共培養について説明します。
要約
多形性膠芽腫(GBM)は、最も豊富で致命的な悪性脳腫瘍です。2020年と2021年に米国では13,000人以上の症例が予測されています。GBM腫瘍は、ほとんどの場合、星状細胞から発生し、その侵襲性を特徴とし、多くの場合、健康な組織を腫瘍組織に動員します。アストロサイトと膠芽腫細胞との間のコミュニケーションを理解することは、腫瘍の進行を分子的に理解するために不可欠です。このプロトコルは、層ごとのアセンブリと微小毛細管現象駆動のパターニングを使用して、GBMに対するアストロサイトの接触媒介効果を調査するための新しいパターン化された共培養方法を示しています。利点には、タンパク質を含まない細胞培養環境と、パターン寸法によって決定される細胞相互作用の正確な制御が含まれます。この技術は、神経膠腫腫瘍における神経膠腫と星状細胞との間の細胞相互作用を模倣するための、用途が広く、経済的で、再現性のあるプロトコルを提供します。このモデルはさらに、アストロサイトとの物理的接触または非接触媒介可溶性補因子コミュニケーションによるGBM分子生物学の変化を解き明かすために使用できます。
概要
多形性膠芽腫(GBM)は、米国で最も多産で致命的な脳腫瘍であり、生存期間の中央値は約15か月です1。GBM患者のうち、診断後5年以上生存しているのは7%未満です1,2。10年後には、その数字は1%未満に低下します1,2。他の種類のがんでは、ここ数十年で生存率が著しく改善されていますが、GBM患者の成功には及ばない。治療的介入を成功させるには、適切なin situモデルを利用して、GBM腫瘍の生物学をより徹底的に理解する必要があります。この理解は、GBM 患者の臨床転帰を改善する上で非常に重要です。
脳には多種多様な種類の細胞が含まれており、それぞれが特定のニッチを埋めて生物の機能と生存を促進します。ニューロン以外にも、アストロサイト、オリゴデンドロサイト、ミクログリアなど、さまざまなグリア細胞があります。特にアストロサイトは、移動促進性可溶性因子の分泌を通じてGBM腫瘍の成長と浸潤に関与しています3。さらに、アストロサイトを介した神経膠腫細胞の移動と浸潤の原動力が物理的接触であるという報告もあります4,5。しかし、この変化を駆動する分子基盤は、ほとんどわかっていません。
腫瘍の成長に対するアストロサイトの接触媒介性の影響を研究するために、このプロトコルでは、in vitro細胞パターニングのための再現性のあるタンパク質フリー法の開発について報告しています。この方法では、高分子電解質多層膜(PEM)を体系的に組み立てて、均一なタンパク質フリー表面を形成します。PEMは、ポリ(ジアリルメチルアンモニウムクロリド)(PDAC)とスルホン化ポリ(ステレン)(SPS)をそれぞれ含むポリカチオン-ポリアニオン系を使用して構築されます。これらのポリマーは、PDAC 6,7,8,9,10 よりも細胞の SPS への優先的な接着を報告した以前の研究に基づいて選択されました。これらのPEM表面では、このプロトコルはマイクロキャピラリーフォースリソグラフィーを利用して、初代アストロサイトとGBM細胞のパターン化された共培養モデルをエンジニアリングします。
ここで提示する技術は、表面パターニングの制御を通じて特定の細胞間相互作用の精密なエンジニアリングを可能にし、それにより細胞コミュニケーションの再現性の高い研究をサポートします。さらに、このプラットフォームに固有の生体模倣表面は、異なる細胞タイプ間のコミュニケーションのメカニズム理解を深めるために重要な、直接的な細胞間コミュニケーションの研究を容易にします。さらに、この方法は低コストであり、細胞コミュニケーションを探求するための in vitro 研究を行う上で大きな利点となります。具体的には、このプロトコルは、PDAC(+)を介したSPS(-)上のGBMの差動結合を利用して、GBM細胞株と初代アストロサイトのパターン化された共培養を作成します。
プロトコル
この研究は、国立衛生研究所の実験動物のケアと使用に関するガイドの推奨事項に厳密に従って実施されました。この議定書は、ネブラスカ大学リンカーン校の動物実験倫理委員会によって承認されました(プロジェクトID:1046)。初代星状細胞は、UNLのIACUCプロトコル1046に準拠し、わずかな変更を加えたプロトコルに従って、1〜3日齢のSprague-Dawleyラットの子ラットから調製されました7,11。
1. 事前準備
- このプロトコルを開始する前に、目的のジオメトリのマスターパターンを取得してください。
注:このプロトコルでは、標準的なフォトリソグラフィー技術を使用して調製された市販のシリコンウェーハが使用されます。推奨される開始パターンは100〜200μmのラインです。 - バッファーとメディアを準備します。
- プレートをコーティングするためのポリ(ジアリルメチルアンモニウムクロリド)(PDAC)およびスルホン化ポリ(ステレン)(SPS)ポリマー溶液を準備します。
- PDACコーティング溶液は、ddH2O中に0.3 wt.% PDACおよび0.1 M NaClです。
- SPSコーティング溶液は、ddH2O中に30 μM SPSと0.1 M NaClです。
注:6枚の6ウェルプレートをコーティングするには、1 LのPDACコーティング溶液と1 LのSPSコーティング溶液で十分です。溶液は2〜5回再利用できます。ソリューションが曇った場合は交換してください。
- 必要に応じて、標準的な細胞培養培地を調製します。
- 典型的なアストロサイトおよびGBM培地は、それぞれ、ダルベッコの改変イーグル培地(DMEM)中の10%ウシ胎児血清(FBS)および1%ペニシリン-ストレプトマイシンである。
- プレートをコーティングするためのポリ(ジアリルメチルアンモニウムクロリド)(PDAC)およびスルホン化ポリ(ステレン)(SPS)ポリマー溶液を準備します。
- 細胞を取得、調製、または解凍します。
注:このプロトコルは、1〜3日の新生児ラットおよびU87MGまたはA172-MG神経膠腫細胞から単離された初代ラット星状細胞について説明されています。このプロトコールは、ポリマー表面上の目的の細胞株の差次的付着を確認した後、類似の細胞株に拡大することができます。- 染色中の細胞損失のため、0日目には最低200,000個のGBM細胞を使用し、1日目には400,000個の生きた初代ラットアストロサイトをウェルあたり6ウェルプレートで使用します。異なるサイズのウェルまたはプレートを使用する場合は、セル番号を調整します。
注:このプロトコルには、Wilsonおよび同僚12によって説明されたように調製された継代2〜4からの初代アストロサイトが推奨される。神経膠腫細胞を市販に入手した( 資料表参照)。
- 染色中の細胞損失のため、0日目には最低200,000個のGBM細胞を使用し、1日目には400,000個の生きた初代ラットアストロサイトをウェルあたり6ウェルプレートで使用します。異なるサイズのウェルまたはプレートを使用する場合は、セル番号を調整します。
2. ポリジメチルシロキサン(PDMS)スタンプ成形
- 使い捨て容器に、PDMSプレポリマー12部(重量部)と硬化剤1部(重量部)を計量します。混合物全体が泡で満たされるまで、2〜4分間激しく混合します。
注:100mmシャーレ1枚には26gの混合物で十分です。 - フルオロシランをフルオロシランデシケーターに入れます。ポリマー混合物を入れた使い捨て容器をデシケーターに入れて、20分間脱気します。
注:これにより、混合物から泡が立ち上ります。20分経っても大きな気泡が残っている場合は、さらに時間がかかる場合があります。 - 事前にパターン化された構造マスターをペトリ皿に入れます。PDMS混合物を事前にパターン化された構造マスターの上のペトリ皿にゆっくりと注ぎ、マスターを完全に覆うようにします。PDMS層の最適な深さは、厚さが約2〜3mmです。
注意: 混合物をゆっくりと注ぐことによって気泡を作らないようにしてください。シリコンマスターがペトリ皿に平らに横たわっていることを確認します。 - すべての気泡が除去されるまで、ペトリ皿をフルオロシランデシケーターに入れておきます。ペトリ皿を60°Cのオーブンで1時間硬化させます。60°Cが利用できない場合は、ペトリ皿を37°Cで一晩硬化させます。
- 鋭利なメスを使って、マスターの周りを均一に優しく切ります。
注意: メスを使用するときは注意してください。露出したブレードを放置しないでください。メスは鋭いです。怪我を防ぐために、適切な安全対策を講じてください。 - ピンセットでスタンプをはがし、まな板などの切断面に置きます。メスを使用して、スタンプを6ウェルプレートに収まるほど小さいサイズ(約2.5cm×2.5cm)にカットします。
3. 高分子電解質多層膜(PEM)の構築
注:このプロトコルでは、加圧酸素ボンベとガス混合アクセサリが取り付けられたプラズマコーティングについて説明します( 材料の表を参照)。組織培養ポリスチレン(TCPS)表面を均一にプラズマ洗浄する方法は、いずれの方法も適しています。異なるプラズマ洗浄方法を使用する場合、ユーザーと強度を最適化する必要がある場合があります。
- 6ウェルプレートを7分間プラズマクリーニングします。
- ドアの前面にある三方弁を右に回して、空気の放出によるシューという音が聞こえるまでチャンバーをブリードします。圧力測定値が1800mTorrを超えたら、三方弁を垂直位置に戻します。
- ドアを開けて、6ウェルプレートをチャンバーに入れます。ドアを閉め、真空ポンプをオンにします。圧力が約100mTorrで安定するまでチャンバーを排気します。
注意: チャンバーが排気されている間、酸素タンクが開いており、酸素の出力圧力が10psiであることを確認してください。 - 三方弁を左に開いて、ラインを酸素入力ホースに合わせます。圧力が400〜450mTorrの間で安定するまで、酸素ガスをチャンバーに排出します。
注意: 流量計の入力圧力が10mmであることを確認し、必要に応じて調整します。 - RF電源をオンにします。プラズマが形成されるのを待ち(~15秒)、タイマーを7分間開始します。
- 7分後、RF電源をオフにし、三方弁を垂直位置に戻します。チャンバーを150mTorrまで排気させます。
- 真空ポンプをオフにして、圧力が1500mTorrに上昇するのを待ちます。エアリリースからのシューという音が聞こえるまで、三方弁を右に回してチャンバーをベントします。圧力測定値が1800mTorrを超えたら、三方弁を垂直位置に戻し、ドアを開けてサンプルを取り出します。
- プラズマコーティングプレートを室温浴に次のように配置します:PDAC20分、DI水5分、DI水5分、SPS20分、DI水5分、DI水5分。プレート表面全体が水没していることを確認します。
注:オプションで、自動スライドステイナーを使用してアクティブ時間を短縮できます。可能であれば、穏やかに攪拌してください。. - 前の手順を合計 10 回繰り返します。プレートを風乾させます。
注:乾燥させたプレートは、使用前に最大数週間室温で保存できます。
4. キャピラリーにおけるマイクロモールディング による PEMパターニング
- PDMSスタンプを穏やかなラボソープで洗い、続いてDI水で洗います。エアコンプレッサーを使用してスタンプを乾燥させ、未使用の6ウェルプレートの蓋などの平らな可動面に置きます。
オプション:スタンプは風乾することもできます。スタンプは、乾燥中に覆われ、ほこりから保護する必要があります。 - ステップ3で説明したように、スタンプを1分間プラズマコーティングします。すぐにプラズマクリーナーからスタンプを取り外し、準備した6ウェルプレートに伏せて置きます。
- 10 μLのPDAC溶液をスタンプの下端に沿ってピペットで固定し、ポリマーをスタンプの長さに沿って着実に分注します。ポリマーをスタンプの側面に追加し、ラインパターンから開口部を設けて、毛細管現象が起こるようにします。
- 各スタンプの上に350gの重りを20秒間置き、パターンを強化します。スタンプをプレートに20分間置く。
- プレートをDI水に浸し、線柄の方向にスタンプを剥がします。プレートをDI水で各5分間2回洗浄します。
- スタンプを石鹸と純水で洗い、エアコンプレッサーで乾かします。プレートを風乾させます。
- 細胞培養の準備ができたら、使用直前にクラスIIバイオセーフティフードでUV光の下でプレートを最低8時間滅菌します。推奨される最小総UV-C線量は、265nmで400mJ / cm2 です。パターンを視覚化する場合は、UV滅菌ステップをスキップして、ステップ5を実行してください。細胞培養の準備ができたら、UV滅菌後にステップ6を実行します。
5. カルボキシフルオレセイン(CFSE)によるプレスパターンの可視化
注:この手順を実行してスタンプパターンを視覚化するか、この手順をスキップして細胞培養用のパターンを準備します。一度パターンを染色すると、細胞培養には使用できません。スタンピングに十分な信頼性が得られれば、そのパターンを細胞培養に使用することができます。カルボキシフルオレセインは光感受性です。暗闇の中で染色して輸送します。
- 乾燥させたスタンプパターンをCFSEパターン染色溶液(0.1 μM CFSE、0.1 M NaOH)に60〜90分間置く。スタンプされたパターンをDI H2Oで5分間2回洗浄します。
注:スライドガラスを使用する場合は、スライド全体を染色溶液が入った50mLチューブに入れます。ウェルプレートを使用する場合は、パターン全体を覆うのに十分な染色液を添加してください。 - 適切な蛍光顕微鏡を使用してパターンを視覚化します。
- 蛍光灯をつけて、10分間ウォームアップします。パターンはCFSEで染色されるため、干渉ブルーフィルター(IB)を使用してグリーンパターンを視覚化します。パターンを表示し、写真を撮ります。
6. 膠芽腫細胞をカルボキシフルオレセインで染色し、播種する
注:すべての細胞培養作業は、適切なクラスIIバイオセーフティキャビネットで行う必要があります。
- 0.25%トリプシン-EDTAで細胞を培養表面から剥離し、200 x g で4°Cで4分間遠心分離し、上清を除去します。
- 血清を含まない細胞培養培地1mL(DMEMおよび1%ペニシリン-ストレプトマイシン)に細胞を再懸濁し、200 x g で4分間4°Cで遠心分離し、上清を除去します。
- 細胞を1 mLのPBSに再懸濁し、滅菌済みの1.5 mLチューブに移します。10 μg/mL CFSE を 10 μL 加え、ピペッティングで上下させてすぐに完全に混合します。室温で10分間インキュベートし、15 mLの滅菌チューブに移します。
- 最低1 mLの細胞培養培地(ステップ1.2.2.1を参照)を加えて、CFSE色素反応をクエンチします。400 x g で4°Cで10分間遠心分離し、上清を除去します。細胞を5 mLの細胞培養培地に再懸濁し、新鮮な15 mLの滅菌チューブに移します。
- 400 x g で5分間、4°Cで遠心分離し、上清を除去し、細胞を5 mLの細胞培養培地に再懸濁します。
- 前の洗浄手順を2回繰り返します。
- ステップ4のパターン化した6ウェル組織培養プレートに染色した神経膠腫細胞(100細胞/mm2 または100,000細胞/ウェル)にアストロサイト培養培地を播種します。インキュベーター(37°C、5%CO2)で細胞を24時間培養した後、ステップ7で染色したアストロサイトを加えます。
7. PKH26による初代アストロサイトの染色と播種
注:すべての細胞培養作業は、適切なクラスIIバイオセーフティキャビネットで行う必要があります。
- 0.25%トリプシン-EDTAで細胞を培養表面から剥離し、200 x g で4°Cで4分間遠心分離し、上清を除去します。
- 血清を含まない細胞培養培地1mL(DMEMおよび1%ペニシリン-ストレプトマイシン)に細胞を再懸濁し、200 x g で4分間4°Cで遠心分離し、上清を除去します。
- PKH26キットの室温希釈剤C0.5 mLに細胞ペレットを再懸濁することにより、2x細胞懸濁液を調製します。
- 滅菌済みの1.5 mLチューブに2 μLのPKH26を0.5 mLの希釈剤Cに加えて、2倍色素溶液(4 x 10-6 M)を調製します。使用直前に染料溶液を準備してください。
- 2x細胞懸濁液を2x色素溶液に加え、すぐにピペッティングで上下に混合します。
- 細胞懸濁液を1〜5分間インキュベートします。
注:染色はすぐに起こり、希釈剤Cは細胞に有害です。インキュベーションが長いからといって、染色が良くなるわけではありません。 - 細胞培養培地を5倍以上加え、1分間インキュベートして余分な色素を結合させることで、染色を急冷します。
- 200 x g で4°Cで10分間遠心分離し、上清を慎重に取り除きます。細胞を5 mLの細胞培養培地に再懸濁し、新しい滅菌15 mLチューブに移します。
- 200 x gで5分間、4°Cで遠心分離し、上清を取り除き、5 mLのPBSに再懸濁します。
- 200 x g で5分間、4°Cで遠心分離し、上清を除去し、5 mLの細胞培養培地に再懸濁します。
- 手順7.9と7.10を繰り返して、合計3回の洗浄を行います。
- 染色したアストロサイト(200細胞/mm2 または200,000細胞/ウェル)にアストロサイト培地(ステップ1.2.2.1を参照)を、ステップ6の神経膠腫細胞をあらかじめ播種したパターン化した6ウェル組織培養プレートに播種します。37°C、5%CO2 インキュベーターで細胞を培養し、実験を行います。
8. パターン化された単一培養および共培養の蛍光イメージング
- 蛍光灯をつけて、10分間ウォームアップします。
- 細胞培養物をインキュベーターから取り出し、蛍光イメージングが可能な倒立顕微鏡のステージに置きます。
- 適切なフィルターを挿入または取り付けます。イメージングする細胞がCFSEで染色されている場合は、干渉青色フィルター(IB)を使用して緑色の細胞を視覚化します。イメージングする細胞がPKH26で染色されている場合は、ローダミンフィルターを使用して赤色細胞を視覚化します。
- 標本を見て写真を撮ります。
注:現在、フローサイトメトリーを使用して細胞を分離し、接触媒介型コミュニケーションの生物学的影響を解析することができます。
結果
ここでのプロトコルは、神経膠腫細胞と星状細胞の直接接触パターン共培養のエンジニアリングについて説明しています。このプラットフォームは、多形性膠芽腫(GBM)の進行におけるアストロサイトと神経膠腫細胞間のコミュニケーションにおける直接接触の役割を研究するための生体模倣多細胞モデルを提供します。図1は、上記で概説した段階的な表面修飾と細胞導入のスキームを示しています。ステップ1は、10二重層のPDAC / SPSの自己組織化PEMコーティングと、共培養のための所望の空間パターンのPDMSスタンプでコーティングされた培養プラットフォーム(ガラスカバースリップ、組織培養プレートなど)を取得することです。PDAC/SPSの10の二重層は、線維芽細胞、ニューロン、および乳がん細胞の空間制御に有用な均一なPEMコーティングを提供するために、Kidambiらによって以前に確立された6,7,8。シリコンマスターから形成されたPDMSスタンプは、腫瘍の進行における特定のコミュニケーション方法の重要性を探るために物理的な接触を必要とするものを含む、さまざまなパターンを適用してさまざまな細胞相互作用を研究するための汎用性の高い再利用可能なツールを提供します。

図1:PEMとキャピラリーでのマイクロモールディングを使用して、神経膠腫細胞と小脳星状細胞のパターン化された共培養プラットフォームを作成するための概略図の概要。 (A)PDMSプレポリマーと硬化剤を12:1で混合し、所望のナノ機能を持つシリコンウェーハに注ぎ、標準的なフォトリソグラフィー技術を使用して商業的に調製します(1)。(B)細胞培養基質を酸素プラズマで処理して負に帯電させます(2)。基質をポリ(ジアリジメチルアンモニウムクロリド)(PDAC)に20分間連続して浸漬し、脱イオン(DI)H2Oに5分間、DIH2Oを5分間、ポリ(スチレンスルホン酸)(SPS)に20分間、DIH2Oを5分間、およびDIH2Oを5分間連続して浸漬します。この6回の入浴を10回繰り返します。これは、手動で行うことも、プログラム可能なディップコーター(3)を使用して行うこともできます。(C)基板には、PDACとSPSの10個の安定な二重層があります。PDMSスタンプ( Aから)を使用可能なサイズに切断し、酸素プラズマで処理し、6ウェルプレート(4)に(パターン面を下にして)配置します。(D)ピペットを使用して、PDMSスタンプの端に沿って~10μLのPDACを分注します(赤で示されています)(5)。スタンプの端全体に沿ってゆっくりと着実に動くことで、均一なカバレッジが保証されます。パターンは、荷電した色素(6)を使用して検証することも、細胞培養用に調製することもできます。(E)パターン化された基板表面は、一晩でUV滅菌されます。(F)神経膠腫細胞をCFSEで染色し、パターン化された基質に播種します。神経膠腫細胞は、基質上のパターン内のSPS表面に付着するために1〜2日与えられます。(G)初代小脳アストロサイトをPKH26で染色し、パターン化された基質に埋め戻します。画像と分析は、4日目に共培養が成熟したら取得できます。BioRender.com で作成 この図の拡大版を表示するには、ここをクリックしてください。
このプラットフォームでは、さまざまなパターンを利用できます。 図2 は、カルボキシフルオレセインで視覚化されたマイクロパターンを示しており、毛細血管のマイクロモールディングを使用して達成される形状とサイズの多様性を示しています。例えば、細胞の不均一な物理的相互作用は、パターンのPDACとSPSの間の界面でのみ発生します。したがって、 図2 の左下隅にある正方形のパターンは、パターンの空間的構成を制御する能力を示しており、これはさらに、これらのパターン内の細胞配置に基づく特定の細胞間相互作用の制御にまで拡張することができます。これらのパターンにおける共培養の比較は、可溶性因子と非直接的なコミュニケーションとは対照的に、パラクリンシグナル伝達による直接的なコミュニケーションの全体的な影響をより正確に調査することを可能にするだろう13。さらに、このプラットフォームにより、研究者は、GBM腫瘍の成長のさまざまな段階と腫瘍内の位置を模倣する不均一な細胞相互作用の数を制御するためのパターンを設計して、 in vivo 観察14を最適に模倣することができます。

図2:カルボキシフルオレセインで染色された異なるパターンのPEM。 PEMにより、研究者は表面状態(化学的性質、形状、サイズ)を調整して培養を最適化できます。スケールバー 500 μm. この図の拡大版を表示するには、ここをクリックしてください。
図3 は、パターン化されたPDAC/SPS表面のSPS領域に選択的に結合した神経膠腫細胞の24時間後の単一培養を示しています。代表的な画像は、A172とU87が特定の領域に選択的に接着し、アストロサイトの埋め戻しのためのスペースを残す能力を示しています。U87MG細胞株は、浸潤性で腫瘍形成性の高い神経膠腫細胞株であるため、神経膠芽腫の研究に一般的に使用されています。A172は、浸潤性で腫瘍形成性のない神経膠芽腫細胞株としてもこの研究に選ばれました。これらの細胞株には違いがありますが、パターン化されたPDAC/SPS表面に導入されると、利用可能なパターンに従って空間的に分布し、同様の振る舞いをするように見えます。これは、膠芽腫15のさまざまな病期の研究におけるこのプラットフォームの多様性を強調しています。神経膠腫細胞はアストロサイトに比べて比較的速い接着速度と増殖速度を持っているため、アストロサイトの培養物への導入は神経膠腫播種1日後に行われます。これは、神経膠腫がアストロサイトの付着に特化した領域に過剰増殖するのを防ぐためです。
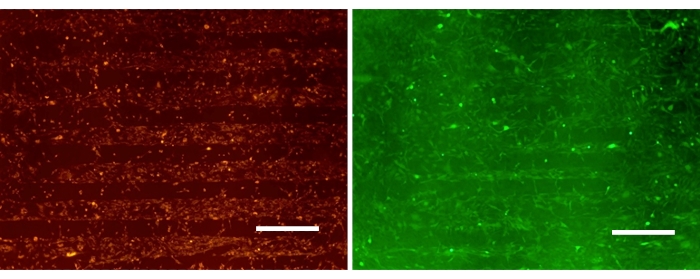
図3:PEMパターン表面にカルボキシフルオレセイン(緑)とPKH26(赤)で染色したパターン化された神経膠腫単培養。 スケールバー:500μm. この図の拡大版を表示するには、ここをクリックしてください。
図4は、アストロサイト播種4日後に採取した成熟共培養の代表格です。アストロサイトは高密度で播種され、神経膠腫が占有していない空間に完全に付着します。アストロサイトを添加した後、培養物を分析の4日前に成熟させる。成熟時間(共培養の1〜4日目)により、神経膠腫細胞は付着する領域を埋め、神経膠腫細胞が確立されている領域に付着しようとした可能性のある星状細胞を窒息させることができます。さらに、成熟期は、アストロサイトと神経膠腫細胞の細胞間相互作用をin vivoおよびin vitroで媒介すると一般的に見られるギャップ結合などの物理的相互作用の確立を可能にする16,17,18。

図4:共培養4日目の蛍光画像 (A)U87神経膠腫細胞と共培養したアストロサイト、(B)共培養4日目にA172神経膠腫細胞と共培養したアストロサイトは、これらのPEM表面の選択的能力を示しています。スケールバー:500μm. この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
再現性のあるパターン化された共培養物の正常なアセンブリを保証するための重要なステップには、1)キャピラリーでのマイクロモールディングによる表面のパターン化の成功、2)染色された細胞の洗浄の成功、および3)「成熟培養」ウィンドウでの共培養の分析が含まれます。まず、キャピラリーでのマイクロモールディングによるパターンの再現が成功することは、相互作用の再現性にとって重要であり、これがパターン化された共培養をランダムな共培養と区別するものです。この再現性を確保するためには、ユーザーが練習を通じてパターニングのスキルを身に付けるか、パターンを正確に再現できる自動化システムを取得することが重要です。さらに、PDMSスタンプは再利用可能ですが、スタンプの繰り返しの変更と使用により、時間の経過とともにパターンの完全性が損なわれる可能性があります。したがって、顕微鏡でパターンの完全性を定期的にテストするか、カルボキシフルオレセインでパターンを視覚化することをお勧めします。次に、PKH26およびカルボキシフルオレセインで染色した細胞の洗浄を成功させることは、最初に方法を確立し、さまざまな細胞タイプを追跡する際に、細胞タイプの分化に重要です。さらに、洗浄の失敗による交差染色は、フローサイトメトリー を介して 共培養から細胞を分離する将来の能力を阻害する可能性があります。このプロトコルには、フローサイトメトリー装置用に最適化された洗浄ステップと、共培養物の正常な作成が含まれます。ただし、ユーザーが共培養中に一貫して汚れのクロスオーバーを見つける場合は、洗浄ステップの数を増やす必要がある場合があります。最後に、成熟した培養物を分析するための時間枠は限られており、神経膠腫細胞は最終的にパターンを満たし、パターンのアストロサイトが豊富な領域に浸潤し始めます。したがって、結果の再現性を確保するために、一貫した時間間隔で共培養を分析することをお勧めします。
ユーザーが遭遇する可能性のある問題には、CFSE の飽和に関する問題が含まれます。画像が蛍光で飽和している場合は、パターン染色時間を60〜90分から30〜60分に短縮します。問題が解決しない場合は、0.1 M NaOH中の染色濃度を0.075 μMに下げます。あるいは、画像に蛍光が示されない場合は、まず顕微鏡の設定とプリズムがそれぞれ492 nmと517 nmの励起波長と発光波長に適していることを確認し(つまり、干渉ブルーフィルター(IB))、100 msから10,000 msの露光時間の範囲を確認します。それでも蛍光が発せられない場合は、パターン染色時間を60〜90分から90〜120分に増やします。問題が解決しない場合は、0.1 M NaOH中の染色濃度を0.15 μMに増やします。CFSEで視覚化されたパターンでユーザーが遭遇する可能性のあるその他の問題は、望ましい鮮明な形状ではなく、エッジがぼやけたり、ぼやけたりすることです。これは、PDMSスタンプが過剰に使用されていることの兆候である可能性があります。この場合、シリコンマスターウェーハを使用して新しいPDMSスタンプを作成します。画像がぼやけたりぼやけたりする場合は、CFSE染色液が汚染されている兆候である可能性もあり、この場合は新しいCFSE染色液を調製します。
このシステムには、特定の固有の制限があります。第一に、それは二次元モノカルチャーであり、これは高スループットの予備研究6,7,8に有用であり、現在利用可能な相互作用モデルに匹敵するが、三次元インビボ組織19の理想的な模倣には及ばない。さらに、この共培養モデルでは物理的相互作用が最適化されますが、このシステムの静的な性質により、可溶性因子を介した相互作用は完全に排除されるわけではありません。放出された可溶性因子の分析は、細胞応答を理解するための洞察に富んでいる可能性があるため、静的培地は利点となり得る20。純粋に物理的な相互作用を理解するには、可溶性因子による相互作用を最小限に抑える必要がありますが、これは、頻繁な培地交換と因子拡散のための大容量の培地を維持することで達成できます。
開示事項
著者は、利益相反を宣言しません。
謝辞
この研究は、NIH助成金1R01AA027189-01A1(S.K.宛)、P20 GM104320(Nebraska Center for the Prevention of Obesity Diseases Pilot Grant to S.K.宛)、P20 GM113126(Nebraska Center for Integrated Biomolecular Communication-Project Leader S.K.宛)の全部または一部によって支援されました。UNL研究開発局生物医学シード助成金およびネブラスカ研究イニシアチブ-システム助成金(SKへ)。K.M.S.は、トレーニング助成金であるT32GM107001を通じて資金提供を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Fisher Scientific | 25200056 | |
| 15 ml Nunc Conical Sterile Polypropylene Centrifuge Tubes | Fisher Scientific | 12-565-268 | |
| 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester | Millipore Sigma | Cat#21888 | |
| 50 ml Nunc Conical Sterile Polypropylene Centrifuge Tubes | Fisher Scientific | 12-565-270 | |
| A172-MG GBM cell line | ATCC | CRL-1620 | |
| Bright-Line Hemacytometer | Sigma | Z359629 | Or other suitable cell counting device |
| Cell Incubator | N/A | N/A | |
| Cooled tabletop centrifuge for 15 mL tubes | N/A | N/A | |
| Dulbecco's Modified Eagle Medium (DMEM) | MP Biomedicals | ICN 1033120 | |
| Expanded Plasma Cleaner | Plasma Harrick | PDC-001-HP | With attached pressurized oxygen tank and PlasmaFlo Gas Mixer (PDC-FMG) accessory |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11550H | |
| Fluorosilane | Sigma Aldrich | 667420 | Full chemical name: 1H,1H,2H,2H-Perfluorooctyltriethoxysilane |
| Inverted Tabletop Microscope | N/A | N/A | Microscope capable of fluorescent imaging with λex = 551 nm; λem 567 nm [e.g. Rhodamine filter] (PKH26 dye) and λex 492 nm; λem 517 nm [e.g. interference blue filter (IB)] (CFSE dye) |
| NaCl | Sigma Aldrich | S7653 | |
| NaOH | Sigma Aldrich | 567530 | |
| Penicillin-Streptomicen | Fisher Scientific | 15140122 | |
| PKH26 Red Fluorescent Cell Linker Mini Kit | Millipore Sigma | Cat#MINI26-1KT | |
| Poly(diallyldimethylammonium chloride) solution (PDAC) | Sigma Aldrich | 409014 | 20 wt. % in H2O |
| Poly(sodium 4-styrenesulfonate) (SPS) | Sigma Aldrich | 243051 | average MW ~70,000 |
| Primary Astrocytes, isolated from Srague Dawley rats | Charles River | Crl:SD | Rats from Charles River; Lab isolated Cells |
| Scalpel | N/A | N/A | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sylgard 184 Silicone Elastomer Kit | Dow Chemical | Cat#2646340 | |
| Trypan Blue Stain | Fisher Scientific | 15-250-061 | |
| TryplE | Fisher Scientific | Gibco TrypLE | |
| U87-MG GBM cell line | ATCC | HTB-14 | |
| Vacuum Desiccator | N/A | N/A |
参考文献
- Ostrom, Q. T., et al. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the United States in 2012-2016. Neuro Oncology. 21, 1 (2019).
- Ostrom, Q. T., et al. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the United States in 2010-2014. Neuro Oncology. 19, 1-88 (2017).
- Roos, A., Ding, Z., Loftus, J. C., Tran, N. L. Molecular and microenvironmental determinants of glioma stem-like cell survival and invasion. Frontiers in Oncology. 7, 120 (2017).
- Rath, B. H., Fair, J. M., Jamal, M., Camphausen, K., Tofilon, P. J. Astrocytes enhance the invasion potential of glioblastoma stem-like cells. PLoS One. 8 (1), 54752 (2013).
- Le, D. M., et al. Exploitation of astrocytes by glioma cells to facilitate invasiveness: a mechanism involving matrix metalloproteinase-2 and the urokinase-type plasminogen activator-plasmin cascade. The Journal of Neuroscience. 23 (10), 4034-4043 (2003).
- Daverey, A., Brown, K. M., Kidambi, S. Breast cancer/stromal cells coculture on polyelectrolyte films emulates tumor stages and miRNA profiles of clinical samples. Langmuir. 31 (36), 9991-10001 (2015).
- Kidambi, S., Lee, I., Chan, C. Primary neuron/astrocyte co-culture on polyelectrolyte multilayer films: A template for studying astrocyte-mediated oxidative stress in neurons. Advanced Functional Materials. 18 (2), 294-301 (2008).
- Kidambi, S., et al. Patterned co-culture of primary hepatocytes and fibroblasts using polyelectrolyte multilayer templates. Macromolecular Bioscience. 7 (3), 344-353 (2007).
- Kidambi, S., Lee, I., Chan, C. Controlling primary hepatocyte adhesion and spreading on protein-free polyelectrolyte multilayer films. Journal of the American Chemical Society. 126 (50), 16286-16287 (2004).
- Mohammed, J. S., DeCoster, M. A., McShane, M. J. Micropatterning of nanoengineered surfaces to study neuronal cell attachment in vitro. Biomacromolecules. 5 (5), 1745-1755 (2004).
- Beaudoin, G. M., et al. Culturing pyramidal neurons from the early postnatal mouse hippocampus and cortex. Nature Protocols. 7 (9), 1741-1754 (2012).
- Wilson, C. L., Hayward, S. L., Kidambi, S. Astrogliosis in a dish: substrate stiffness induces astrogliosis in primary rat astrocytes. Rsc Advances. 6 (41), 34447-34457 (2016).
- Bogdanowicz, D. R., Lu, H. H. Studying cell-cell communication in co-culture. Biotechnololgy Journal. 8 (4), 395-396 (2013).
- Chen, W., et al. Glioma cells escaped from cytotoxicity of temozolomide and vincristine by communicating with human astrocytes. Medical Oncology. 32 (3), 43 (2015).
- Belot, N., et al. Molecular characterization of cell substratum attachments in human glial tumors relates to prognostic features. Glia. 36 (3), 375-390 (2001).
- Sin, W. C., et al. Astrocytes promote glioma invasion via the gap junction protein connexin43. Oncogene. 35 (12), 1504-1516 (2016).
- Sin, W. C., Crespin, S., Mesnil, M. Opposing roles of connexin43 in glioma progression. Biochimica et Biophysica Acta. 1818 (8), 2058-2067 (2012).
- Oliveira, R., et al. Contribution of gap junctional communication between tumor cells and astroglia to the invasion of the brain parenchyma by human glioblastomas. BMC Cell Biology. 6 (1), 7 (2005).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology (Bethesda). 32 (4), 266-277 (2017).
- Rape, A., Ananthanarayanan, B., Kumar, S. Engineering strategies to mimic the glioblastoma microenvironment). Advanced Drug Delivery Reviews. 79-80, 172-183 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved