Method Article
Direktkontakt-Co-Kultur von Astrozyten und Glioblastomzellen, die mit Polyelektrolyt-Multilayer-Templates strukturiert wurden
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine gemusterte Gliom-Astrozyten-Kokultur mit direktem Kontakt, bei der Mikrokontaktdruck auf Polyelektrolyt-Multischichten (PEMs) verwendet wird, um U87- oder A172-GBM-Zellen und primäre Astrozyten zu strukturieren.
Zusammenfassung
Das Glioblastoma Multiforme (GBM) ist der häufigste und tödlichste bösartige Hirntumor. In den Vereinigten Staaten werden in den Jahren 2020 und 2021 mehr als 13.000 Fälle prognostiziert. GBM-Tumoren entstehen am häufigsten aus Astrozyten und zeichnen sich durch ihre invasive Natur aus, bei der oft gesundes Gewebe in das Tumorgewebe rekrutiert wird. Das Verständnis der Kommunikation zwischen Astrozyten und Glioblastomzellen ist für das molekulare Verständnis der Tumorprogression von entscheidender Bedeutung. Dieses Protokoll demonstriert eine neuartige gemusterte Co-Kultur-Methode zur Untersuchung der kontaktvermittelten Effekte von Astrozyten auf GBM unter Verwendung von Schicht-für-Schicht-Assemblierung und Mikrokapillarkraft-getriebener Strukturierung. Zu den Vorteilen gehören eine proteinfreie Zellkulturumgebung und eine präzise Kontrolle der zellulären Interaktion, die durch die Abmessungen des Musters vorgegeben wird. Diese Technik bietet ein vielseitiges, wirtschaftliches und reproduzierbares Protokoll zur Nachahmung der zellulären Interaktion zwischen Gliomen und Astrozyten in Gliomtumoren. Dieses Modell kann weiterhin verwendet werden, um Veränderungen in der GBM-Molekularbiologie aufgrund des physikalischen Kontakts mit Astrozyten oder der berührungslosen Kommunikation mit löslichen Cofaktoren zu entschlüsseln.
Einleitung
Das Glioblastoma Multiforme (GBM) ist mit einer medianen Überlebenszeit von etwa 15 Monaten der häufigste und tödlichste Hirntumor in den Vereinigten Staaten1. Weniger als 7 % der GBM-Patienten überleben mehr als 5 Jahre nach der Diagnose 1,2. Nach 10 Jahren sinkt diese Zahl auf weniger als 1 %1,2. Obwohl andere Krebsarten in den letzten Jahrzehnten das Überleben deutlich verbessert haben, bleibt der Erfolg von GBM-Patienten hinter den Erwartungen zurück. Um erfolgreiche therapeutische Interventionen zu entwickeln, muss ein geeignetes in situ-Modell verwendet werden, um ein tieferes Verständnis der GBM-Tumorbiologie zu entwickeln. Dieses Verständnis ist entscheidend für die Verbesserung der klinischen Ergebnisse für GBM-Patienten.
Das Gehirn enthält eine große Vielfalt an Zelltypen, von denen jeder bestimmte Nischen füllt, um die Funktion und das Überleben des Organismus zu fördern. Neben Neuronen gibt es eine Vielzahl von Gliazellen, darunter Astrozyten, Oligodendrozyten und Mikroglia. Insbesondere Astrozyten wurden durch die Sekretion von pro-migratorischen löslichen Faktoren mit dem Wachstum und der Invasion von GBM-Tumoren in Verbindung gebracht3. Darüber hinaus gibt es einige Berichte, dass physischer Kontakt die treibende Kraft für die Migration und Invasion von Astrozyten-vermittelten Gliomzellen ist 4,5. Die molekularen Grundlagen, die diesen Wandel antreiben, sind jedoch weitgehend unbekannt.
Um die kontaktvermittelten Effekte von Astrozyten auf das Tumorwachstum zu untersuchen, wird in diesem Protokoll über die Entwicklung einer reproduzierbaren, proteinfreien Methode zur in vitro Zellmusterung berichtet. Bei dieser Methode werden Polyelektrolyt-Multischichten (PEMs) systematisch zu einer einheitlichen proteinfreien Oberfläche zusammengefügt. PEMs werden unter Verwendung eines Polykationen-Polyanionen-Systems hergestellt, das Poly(diallylmethylammoniumchlorid) (PDAC) bzw. sulfoniertes Poly(steren) (SPS) umfasst. Diese Polymere wurden auf der Grundlage früherer Studien ausgewählt, die über eine bevorzugte Bindung von Zellen an SPS gegenüber PDACberichteten 6,7,8,9,10. Auf diesen PEM-Oberflächen verwendet dieses Protokoll die Mikrokapillarkraftlithographie, um gemusterte Co-Kulturmodelle von primären Astrozyten und GBM-Zellen zu entwickeln.
Die hierin vorgestellten Techniken ermöglichen die präzise Gestaltung spezifischer Zell-Zell-Wechselwirkungen durch die Kontrolle der Oberflächenstrukturierung, wodurch die hochgradig reproduzierbare Untersuchung der zellulären Kommunikation unterstützt wird. Darüber hinaus ermöglicht die biomimetische Oberfläche dieser Plattform die Untersuchung der direkten Zell-Zell-Kommunikation, die für die Vertiefung des mechanistischen Verständnisses der Kommunikation zwischen verschiedenen Zelltypen von entscheidender Bedeutung ist. Darüber hinaus ist die Methode kostengünstig und bietet einen erheblichen Vorteil für die Durchführung von In-vitro-Studien zur Erforschung der zellulären Kommunikation. Insbesondere nutzt dieses Protokoll die differentielle Bindung von GBM an SPS (-) über PDAC (+), um gemusterte Co-Kulturen von GBM-Zelllinien und primären Astrozyten zu erzeugen.
Protokoll
Diese Studie wurde in strikter Übereinstimmung mit den Empfehlungen im Leitfaden für die Pflege und Verwendung von Labortieren der National Institutes of Health durchgeführt. Das Protokoll wurde vom Committee on the Ethics of Animal Experiments der University of Nebraska-Lincoln genehmigt (Projekt-ID: 1046). Primäre Astrozyten wurden von 1-3 Tage alten Sprague-Dawley-Rattenbabys in Übereinstimmung mit dem IACUC-Protokoll 1046 der UNL und gemäß dem Protokoll mitleichten Modifikationen 7,11 hergestellt.
1. Vorbereitungen
- Rufen Sie ein Master-Muster der gewünschten Geometrie ab, bevor Sie mit diesem Protokoll beginnen.
HINWEIS: In diesem Protokoll werden kommerziell erhältliche Siliziumwafer verwendet, die mit Standard-Photolithographietechniken hergestellt wurden. Das empfohlene Ausgangsmuster sind 100-200 μm Linien. - Bereiten Sie Puffer und Medien vor.
- Bereiten Sie Poly(diallylmethylammoniumchlorid) (PDAC) und sulfonierte Poly(steren) (SPS)-Polymerlösungen vor, um die Platten zu beschichten.
- Die PDAC-Beschichtungslösung besteht aus 0,3 Gew.-% PDAC und 0,1 M NaCl in ddH2O.
- Die SPS-Beschichtungslösung besteht aus 30 μM SPS und 0,1 M NaCl in ddH2O.
HINWEIS: 1 l PDAC-Beschichtungslösung und 1 l SPS-Beschichtungslösung reichen aus, um sechs 6-Well-Platten zu beschichten. Lösungen können 2-5 Mal wiederverwendet werden. Tauschen Sie die Lösungen aus, wenn sie trüb werden.
- Bereiten Sie bei Bedarf Standard-Zellkulturmedien vor.
- Typische Astrozyten- und GBM-Medien sind 10 % fötales Rinderserum (FBS) bzw. 1 % Penicillin-Streptomycin in Dulbeccos modifiziertem Eagle-Medium (DMEM).
- Bereiten Sie Poly(diallylmethylammoniumchlorid) (PDAC) und sulfonierte Poly(steren) (SPS)-Polymerlösungen vor, um die Platten zu beschichten.
- Gewinnen, vorbereiten oder auftauen Zellen.
HINWEIS: Dieses Protokoll wird für primäre Ratten-Astrozyten beschrieben, die aus 1-3 Tage alten neugeborenen Ratten und U87MG- oder A172-MG-Gliomzellen isoliert wurden. Dieses Protokoll kann auf ähnliche Zelllinien ausgeweitet werden, nachdem die differentielle Bindung von Zelllinien von Interesse auf Polymeroberflächen bestätigt wurde.- Aufgrund von Zellverlust während der Färbung sollten mindestens 200.000 GBM-Zellen an Tag 0 und 400.000 lebende primäre Ratten-Astrozyten an Tag 1 pro Well in einer 6-Well-Platte verwendet werden. Passen Sie die Zellnummern an, wenn Sie eine andere Vertiefungsgröße oder Platte verwenden.
HINWEIS: Für dieses Protokoll werden primäre Astrozyten aus den Passagen 2-4 empfohlen, die wie von Wilson und Mitarbeitern12 beschrieben vorbereitet wurden. Gliomzellen wurden kommerziell gewonnen (siehe Materialtabelle).
- Aufgrund von Zellverlust während der Färbung sollten mindestens 200.000 GBM-Zellen an Tag 0 und 400.000 lebende primäre Ratten-Astrozyten an Tag 1 pro Well in einer 6-Well-Platte verwendet werden. Passen Sie die Zellnummern an, wenn Sie eine andere Vertiefungsgröße oder Platte verwenden.
2. Stanzformen von Polydimethylsiloxan (PDMS)
- Wiegen Sie in einem Einwegbehälter 12 Teile (nach Gewicht) PDMS-Prepolymer und 1 Teil (nach Gewicht) Härter. 2-4 Minuten kräftig mixen, bis die gesamte Mischung mit Blasen gefüllt ist.
HINWEIS: 26 g der Mischung reichen für eine 100 mm Petrischale. - Geben Sie Fluorsilan in den Fluorsilan-Exsikkator. Stellen Sie den Einwegbehälter mit der Polymermischung in den Exsikkator, um ihn 20 Minuten lang zu entgasen.
HINWEIS: Dadurch können Blasen aus der Mischung aufsteigen. Es kann mehr Zeit benötigt werden, wenn nach 20 Minuten immer noch große Blasen vorhanden sind. - Legen Sie den vorgemusterten Strukturmaster in eine Petrischale. Gießen Sie die PDMS-Mischung langsam in die Petrischale über dem vorgemusterten Strukturmaster, wobei Sie darauf achten, dass der Master vollständig bedeckt ist. Die optimale Tiefe der PDMS-Schicht beträgt ca. 2-3 mm Dicke.
HINWEIS: Vermeiden Sie die Bildung von Luftblasen, indem Sie die Mischung langsam einfüllen. Stellen Sie sicher, dass der Silikonmaster flach in der Petrischale liegt. - Bewahren Sie die Petrischale im Fluorsilkan-Exsikkator auf, bis alle Blasen entfernt sind. Die Petrischale im Backofen bei 60 °C 1 h aushärten. Wenn 60 °C nicht zur Verfügung stehen, härten Sie die Petrischale über Nacht bei 37 °C aus.
- Schneiden Sie mit einem scharfen Skalpell gleichmäßig und sanft um den Master herum.
VORSICHT: Seien Sie vorsichtig, wenn Sie ein Skalpell verwenden. Lassen Sie die freiliegende Klinge niemals unbeaufsichtigt. Skalpelle sind scharf. Treffen Sie geeignete Sicherheitsvorkehrungen, um Verletzungen zu vermeiden. - Entfernen Sie den Stempel mit einer Pinzette und legen Sie ihn auf eine Schneidefläche, z. B. ein Schneidebrett. Schneiden Sie die Stempel mit einem Skalpell so klein aus, dass sie in 6-Well-Platten (ca. 2,5 cm x 2,5 cm) passen.
3. Aufbau von Polyelektrolyt-Multilayern (PEMs)
HINWEIS: Dieses Protokoll beschreibt die Plasmabeschichtung mit einem angeschlossenen Sauerstoffdruckbehälter und Gasmischzubehör (siehe Materialtabelle). Jede Methode zur gleichmäßigen Plasmareinigung der Oberfläche aus Gewebekulturpolystyrol (TCPS) ist geeignet. Zeit und Intensität müssen möglicherweise vom Benutzer optimiert werden, wenn eine andere Plasmareinigungsmethode verwendet wird.
- Reinigen Sie eine 6-Well-Platte 7 Minuten lang mit Plasma.
- Entlüften Sie die Kammer, indem Sie das Dreiwegeventil an der Vorderseite der Tür nach rechts drehen, bis das Zischen des Luftaustritts zu hören ist. Drehen Sie das Dreiwegeventil wieder in die vertikale Position, sobald der Druckwert über 1800 mTorr liegt.
- Öffnen Sie die Tür und setzen Sie die 6-Well-Platte in die Kammer ein. Schließen Sie die Tür und schalten Sie die Vakuumpumpe ein. Die Kammer wird evakuiert, bis der Druck bei etwa 100 mTorr stabil ist.
HINWEIS: Vergewissern Sie sich, dass der Sauerstofftank geöffnet ist und der Ausgangsdruck des Sauerstoffs 10 psi beträgt, während die Kammer evakuiert wird. - Öffnen Sie das Dreiwegeventil nach links, um die Leitung mit dem Sauerstoffzufuhrschlauch auszurichten. Lassen Sie das Sauerstoffgas in die Kammer entweichen, bis sich der Druck zwischen 400 und 450 mTorr stabilisiert hat.
HINWEIS: Vergewissern Sie sich, dass der Eingangsdruck am Durchflussmesser 10 mm beträgt, und passen Sie ihn bei Bedarf an. - Schalten Sie die HF-Stromversorgung ein. Warten Sie, bis sich das Plasma gebildet hat (~15 s), und starten Sie dann den Timer für 7 Minuten.
- Schalten Sie nach 7 Minuten die HF-Stromversorgung aus und drehen Sie das Dreiwegeventil wieder in seine vertikale Position. Lassen Sie die Kammer auf 150 mTorr evakuieren.
- Schalten Sie die Vakuumpumpe aus und warten Sie, bis der Druck auf 1500 mTorr ansteigt. Entlüften Sie die Kammer, indem Sie das Dreiwegeventil nach rechts drehen, bis das Zischen des Luftauslasses zu hören ist. Wenn der Druckwert über 1800 mTorr liegt, drehen Sie das Dreiwegeventil wieder in seine vertikale Position, öffnen Sie die Tür und entnehmen Sie die Probe.
- Legen Sie plasmabeschichtete Platten wie folgt in Bäder mit Raumtemperatur: PDAC für 20 min, DI-Wasser für 5 min, DI-Wasser für 5 min, SPS für 20 min, DI-Wasser für 5 min und DI-Wasser für 5 min. Stellen Sie sicher, dass die gesamte Plattenoberfläche untergetaucht ist.
HINWEIS: Optional kann ein automatisierter Objektträgerfärbeer verwendet werden, um die aktive Zeit zu verkürzen. Falls verfügbar, leichtes Rühren verwenden. - Wiederholen Sie den vorherigen Schritt insgesamt 10 Mal. Lassen Sie die Platten an der Luft trocknen.
HINWEIS: Die getrockneten Platten können vor der Verwendung bis zu mehreren Wochen bei Raumtemperatur gelagert werden.
4. PEM-Strukturierung durch Mikrospritzen in Kapillaren
- Waschen Sie die PDMS-Stempel mit milder Laborseife, gefolgt von DI-Wasser. Trocknen Sie die Stempel mit einem Luftkompressor und legen Sie sie auf eine ebene, bewegliche Fläche, z. B. einen unbenutzten 6-Well-Plattendeckel.
OPTIONAL: Die Stempel können auch luftgetrocknet werden. Die Stempel müssen abgedeckt und während des Trocknens vor Staub geschützt werden. - Beschichten Sie die Stempel, wie in Schritt 3 beschrieben, 1 Minute lang mit Plasma. Entfernen Sie umgehend die Stempel aus dem Plasmareiniger und legen Sie sie mit der Vorderseite nach unten auf die vorbereiteten 6-Well-Platten.
- Pipettieren Sie 10 μl PDAC-Lösung entlang der Unterkante des Stempels und dosieren Sie das Polymer gleichmäßig über die gesamte Länge des Stempels. Stellen Sie sicher, dass Sie das Polymer an der Seite des Stempels mit Öffnungen aus den Linienmustern hinzufügen, damit die Kapillarwirkung stattfinden kann.
- Lege ein 350 g schweres Gewicht für 20 s auf jeden Stempel, um das Muster zu verstärken. Lassen Sie die Stempel 20 Minuten auf den Platten ruhen.
- Tauchen Sie die Platte in DI-Wasser und ziehen Sie die Stempel in Richtung der Linienmuster ab. Waschen Sie den Teller zweimal für jeweils 5 min in DI-Wasser.
- Waschen Sie die Stempel mit Seife und DI-Wasser und trocknen Sie sie mit einem Luftkompressor. Lassen Sie die Platte an der Luft trocknen.
- Wenn die Platten für die Zellkultur bereit sind, sterilisieren Sie sie unmittelbar vor der Verwendung mindestens 8 Stunden lang unter UV-Licht in einer Biosicherheitshaube der Klasse II. Die empfohlene minimale UV-C-Gesamtdosis beträgt 400 mJ/cm2 bei 265 nm. Wenn Sie Muster visualisieren, überspringen Sie den Schritt der UV-Sterilisation und führen Sie Schritt 5 aus. Wenn Sie für die Zellkultur bereit sind, führen Sie Schritt 6 nach der UV-Sterilisation durch.
5. Visualisierung von Stanzmustern mit Carboxyfluorescein (CFSE)
HINWEIS: Führen Sie dieses Verfahren aus, um gestanzte Muster zu visualisieren, oder überspringen Sie diesen Schritt und bereiten Sie stattdessen Muster für die Zellkultur vor. Sobald die Muster gefärbt sind, können sie nicht mehr für die Zellkultur verwendet werden. Sobald genügend Vertrauen in die Prägung gewonnen ist, können die Muster für die Zellkultur verwendet werden. Carboxyfluorescein ist lichtempfindlich. Färben und Transportieren im Dunkeln.
- Getrocknete, gestanzte Modelle für 60-90 min in CFSE-Musterfärbelösung (0,1 μM CFSE in 0,1 M NaOH) legen. Die gestanzten Muster zweimal 5 min in DI H2O waschen.
HINWEIS: Wenn Sie Objektträger aus Glas verwenden, legen Sie den gesamten Objektträger in ein 50-ml-Röhrchen, das die Färbelösung enthält. Wenn Sie Vertiefungsplatten verwenden, fügen Sie genügend Färbelösung hinzu, um das gesamte Muster zu bedecken. - Visualisieren Sie Muster mit einem geeigneten Fluoreszenzmikroskop.
- Schalten Sie die Leuchtstofflampe ein, damit sie sich 10 Minuten lang aufwärmen kann. Da Muster mit CFSE gefärbt sind, verwenden Sie den Interferenzblaufilter (IB), um die grünen Muster zu visualisieren. Sehen Sie sich die Muster an und machen Sie Fotos.
6. Färben und Aussäen von Glioblastomzellen mit Carboxyfluorescein
HINWEIS: Alle Zellkulturarbeiten sollten in einer geeigneten Biosicherheitswerkbank der Klasse II durchgeführt werden.
- Die Zellen mit 0,25 % Trypsin-EDTA von der Kulturoberfläche lösen, bei 200 x g für 4 min bei 4 °C zentrifugieren und den Überstand entfernen.
- Resuspendieren Sie die Zellen in 1 ml Zellkulturmedium ohne Serum (DMEM und 1 % Penicillin-Streptomycin), zentrifugieren Sie bei 200 x g für 4 min bei 4 °C und entfernen Sie den Überstand.
- Resuspendieren Sie die Zellen in 1 ml PBS und überführen Sie sie in ein steriles 1,5-ml-Röhrchen. Fügen Sie 10 μl 10 μg/ml CFSE hinzu und mischen Sie sofort gründlich, indem Sie auf und ab pipettieren. 10 Minuten bei Raumtemperatur inkubieren und in ein steriles 15-ml-Röhrchen überführen.
- Mindestens 1 ml Zellkulturmedium (siehe Schritt 1.2.2.1) zugeben, um die CFSE-Farbstoffreaktion abzuschrecken. Bei 400 x g für 10 min bei 4 °C zentrifugieren und den Überstand entfernen. Resuspendieren Sie die Zellen in 5 ml Zellkulturmedium und geben Sie sie in ein frisches steriles 15-ml-Röhrchen.
- Zentrifugieren Sie bei 400 x g für 5 min bei 4 °C, entfernen Sie den Überstand und resuspendieren Sie die Zellen in 5 ml Zellkulturmedium.
- Wiederholen Sie den vorherigen Waschschritt zweimal.
- Aussaat der gefärbten Gliomzellen (100 Zellen/mm,2 oder 100.000 Zellen/Well) in der gemusterten 6-Well-Gewebekulturplatte aus Schritt 4 mit Astrozyten-Kulturmedien. Kultivieren Sie die Zellen in einem Inkubator (37 °C, 5 % CO2) für 24 h, bevor Sie in Schritt 7 gefärbte Astrozyten hinzufügen.
7. Färben und Aussäen von primären Astrozyten mit PKH26
HINWEIS: Alle Zellkulturarbeiten sollten in einer geeigneten Biosicherheitswerkbank der Klasse II durchgeführt werden.
- Die Zellen mit 0,25 % Trypsin-EDTA von der Kulturoberfläche lösen, bei 200 x g für 4 min bei 4 °C zentrifugieren und den Überstand entfernen.
- Resuspendieren Sie die Zellen in 1 ml Zellkulturmedium ohne Serum (DMEM und 1 % Penicillin-Streptomycin), zentrifugieren Sie bei 200 x g für 4 min bei 4 °C und entfernen Sie den Überstand.
- Bereiten Sie eine 2x Zellsuspension vor, indem Sie das Zellpellet in 0,5 ml Diluent C bei Raumtemperatur aus dem PKH26-Kit resuspendieren.
- Bereiten Sie eine 2x Farbstofflösung (4 x 10-6 M) vor, indem Sie 2 μl PKH26 zu 0,5 mL Diluent C in einem sterilen 1,5 mL Röhrchen hinzufügen. Bereiten Sie die Färbelösung direkt vor Gebrauch vor.
- 2x Zellsuspension in 2x Farbstofflösung geben und sofort durch Auf- und Abpipettieren mischen.
- Inkubieren Sie die Zellsuspension für 1-5 Minuten.
HINWEIS: Die Färbung erfolgt schnell und Verdünnungsmittel C ist schädlich für die Zellen. Eine längere Inkubation bedeutet nicht eine bessere Färbung. - Quenden Sie die Färbung ab, indem Sie mindestens das 5-fache Volumen des Zellkulturmediums hinzufügen und 1 Minute lang inkubieren, um den überschüssigen Farbstoff zu binden.
- Bei 200 x g 10 min bei 4 °C zentrifugieren und den Überstand vorsichtig entfernen. Resuspendieren Sie die Zellen in 5 ml Zellkulturmedium und überführen Sie sie in ein neues steriles 15-ml-Röhrchen.
- Bei 200 x g für 5 min bei 4 °C zentrifugieren, den Überstand entfernen und in 5 mL PBS resuspendieren.
- Bei 200 x g für 5 min bei 4 °C zentrifugieren, den Überstand entfernen und in 5 mL Zellkulturmedium resuspendieren.
- Wiederholen Sie die Schritte 7.9 und 7.10 für insgesamt drei Wäschen.
- Die gefärbten Astrozyten (200 Zellen/mm,2 oder 200.000 Zellen/Well) werden mit Astrozytenmedium (siehe Schritt 1.2.2.1) in die gemusterte 6-Well-Gewebekulturplatte ausgesät, die mit Gliomzellen aus Schritt 6 besiedelt ist. Kultivieren Sie die Zellen in einem 37 °C, 5% CO2 -Inkubator für die Zeit, in der die Experimente durchgeführt werden.
8. Fluoreszenzbildgebung von gemusterten Monokulturen und Cokulturen
- Schalten Sie die Leuchtstofflampe ein, damit sie sich 10 Minuten lang aufwärmen kann.
- Nehmen Sie die Zellkultur aus dem Inkubator und stellen Sie sie auf den Tisch eines inversen Mikroskops, das Fluoreszenzbildgebung ermöglicht.
- Setzen Sie den entsprechenden Filter ein oder setzen Sie ihn auf. Wenn die abzubildenden Zellen mit CFSE gefärbt sind, verwenden Sie den Interferenzblaufilter (IB), um die grünen Zellen sichtbar zu machen. Wenn die abzubildenden Zellen mit PKH26 gefärbt sind, verwenden Sie einen Rhodaminfilter, um die roten Blutkörperchen sichtbar zu machen.
- Betrachten Sie das Exemplar und machen Sie Fotos.
HINWEIS: Die Zellen können nun mittels Durchflusszytometrie getrennt werden, um die biologischen Auswirkungen der kontaktvermittelten Kommunikation zu analysieren.
Ergebnisse
Das Protokoll beschreibt hier die Entwicklung der direkten Kontaktmuster-Co-Kultur von Gliomzellen und Astrozyten. Diese Plattform bietet ein biomimetisches multizelluläres Modell, um die Rolle des direkten Kontakts in der Kommunikation zwischen Astrozyten und Gliomzellen bei der Progression des Glioblastoma multiforme (GBM) zu untersuchen. Abbildung 1 zeigt ein Schema der oben beschriebenen schrittweisen Oberflächenmodifikation und zellulären Einführung. Der erste Schritt besteht darin, eine Kulturplattform (Deckglas aus Glas, Gewebekulturplatte usw.) zu erhalten, die mit einer selbstorganisierten PEM-Beschichtung aus PDAC/SPS in 10 Doppelschichten und einem PDMS-Stempel des gewünschten räumlichen Musters für die Co-Kultur beschichtet ist. Zehn Doppelschichten von PDAC/SPS wurden zuvor von Kidambi et al. etabliert, um eine einheitliche PEM-Beschichtung bereitzustellen, die für die räumliche Kontrolle von Fibroblasten, Neuronen und Brustkrebszellen nützlich ist 6,7,8. Der PDMS-Stempel, der aus einem Silizium-Master gebildet wird, bietet ein vielseitiges, wiederverwendbares Werkzeug für die Anwendung einer Vielzahl von Mustern zur Untersuchung verschiedener zellulärer Interaktionen, einschließlich solcher, die physischen Kontakt erfordern, um die Bedeutung spezifischer Kommunikationsmethoden für die Tumorprogression zu untersuchen.

Abbildung 1: Schematische Übersicht für den Einsatz von PEMs und Mikrospritzung in Kapillaren, um eine gemusterte Co-Kulturplattform von Gliomzellen und Kleinhirn-Astrozyten zu schaffen. (A) PDMS-Präpolymer und Härter werden 12:1 gemischt und über Siliziumwafer mit den gewünschten Nanomerkmalen gegossen, die kommerziell unter Verwendung von Standard-Photolithographietechniken hergestellt werden (1). (B) Das Zellkultursubstrat wird mit Sauerstoffplasma behandelt, um negativ geladen zu werden (2). Das Substrat wird nacheinander 20 min lang in Poly(diallydimethylammoniumchlorid) (PDAC), 5 min lang in deionisiertes (DI) H2O, 5 min DI H2O, 2 min Poly(styrolsulfonat) (SPS) 20 min, 5 min lang DI H2O und 5 min lang DI H2O getaucht. Dieser Vorgang von sechs Bädern wird 10 Mal wiederholt. Dies kann manuell oder mit Hilfe eines programmierbaren Tauchlackierers (3) erfolgen. (C) Das Substrat hat nun 10 stabile Doppelschichten aus PDAC und SPS. Die PDMS-Stempel (von A) werden auf brauchbare Größen zerschnitten, mit Sauerstoffplasma behandelt und (mit der Musterseite nach unten) auf 6-Well-Platten (4) gelegt. (D) Eine Pipette wird verwendet, um ~10 μl PDAC entlang der Kante des PDMS-Stempels abzugeben, der in Rot dargestellt ist (5). Eine langsame und gleichmäßige Bewegung entlang der gesamten Kante des Stempels sorgt für eine gleichmäßige Abdeckung. Die Muster können mit geladenen Farbstoffen (6) verifiziert oder für die Zellkultur vorbereitet werden. (E) Gemusterte Substratoberflächen werden über Nacht UV-sterilisiert. (F) Gliomzellen werden mit CFSE gefärbt und auf das gemusterte Substrat ausgesät. Den Gliomzellen werden 1-2 Tage Zeit gegeben, um sich an SPS-Oberflächen innerhalb der Muster auf dem Substrat zu heften. (G) Primäre Kleinhirn-Astrozyten werden mit PKH26 gefärbt und auf das gemusterte Substrat verfüllt. Bilder und Analysen können aufgenommen werden, sobald die Co-Kultur an Tag 4 reif ist. Erstellt mit BioRender.com Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Auf dieser Plattform können verschiedene Muster verwendet werden. Abbildung 2 zeigt mit Carboxyfluorescein visualisierte Mikromuster, die die Vielseitigkeit von Form und Größe demonstrieren, die durch den Einsatz von Mikrospritzungen in den Kapillaren erreicht wird. So findet eine heterogene physikalische Interaktion von Zellen nur an der Grenzfläche zwischen PDAC und SPS der Muster statt. Daher demonstriert das quadratische Muster in der unteren linken Ecke von Abbildung 2 die Fähigkeit, die räumliche Organisation der Muster zu steuern, die weiter erweitert werden kann, um die spezifische Zell-Zell-Interaktion basierend auf den Zellplatzierungen innerhalb dieser Muster zu steuern. Ein Vergleich von Kokulturen in diesen Mustern würde es ermöglichen, den Gesamteinfluss der direkten Kommunikation im Gegensatz zu löslichen Faktoren und der nicht-direkten Kommunikation durch parakrine Signalgebung mit größerer Präzision zu untersuchen13. Darüber hinaus ermöglicht diese Plattform dem Forscher, Muster zur Kontrolle der Anzahl heterogener zellulärer Interaktionen zu entwerfen, die die verschiedenen Stadien des GBM-Tumorwachstums und die Positionen innerhalb des Tumors nachahmen, um In-vivo-Beobachtungen optimal nachzuahmen14.

Abbildung 2: PEMs mit unterschiedlichen Mustern, die mit Carboxyfluorescein gefärbt sind. PEMs ermöglichen es dem Untersucher, die Oberflächenbedingungen (Chemie, Form und Größe) anzupassen, um die Kultur zu optimieren. Maßstabsleiste 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 3 zeigt Monokulturen von Gliomzellen, die nach 24 h selektiv an die SPS-Regionen in der gemusterten PDAC/SPS-Oberfläche gebunden sind. Die repräsentativen Bilder zeigen die Fähigkeit von A172 und U87, selektiv an bestimmte Regionen zu adhäsieren und so Platz für die Verfüllung von Astrozyten zu lassen. Die U87MG-Zelllinie wird häufig für Glioblastom-Studien verwendet, da es sich um eine invasive, hochgradig tumorigene Gliom-Zelllinie handelt. A172 wurde auch für diese Studie als invasive, nicht-tumorigene Glioblastom-Zelllinie ausgewählt. Trotz der Unterschiede in diesen Zelllinien scheinen sie sich ähnlich zu verhalten, wenn sie auf die gemusterte PDAC/SPS-Oberfläche eingeführt werden, da sie räumlich gemäß dem verfügbaren Muster verteilt sind. Dies unterstreicht die Vielseitigkeit dieser Plattform bei der Untersuchung verschiedener Stadien des Glioblastoms15. Da Gliomzellen im Vergleich zu den Astrozyten eine relativ schnelle Anheftungs- und Wachstumsrate aufweisen, erfolgt die Einführung der Astrozyten in die Kultur einen Tag nach der Gliomaussaat. Dies soll das Überwachsen von Gliomen in Regionen verhindern, die speziell für die Astrozytenbindung bestimmt sind.
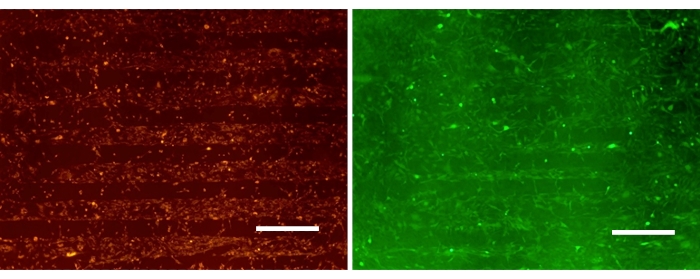
Abbildung 3: Gemusterte Gliom-Monokulturen, gefärbt mit Carboxyfluorescein (grün) und PKH26 (rot) auf PEM-gemusterten Oberflächen. Maßstab: 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 4 ist repräsentativ für die reife Co-Kultur, die 4 Tage nach der Astrozytenaussaat entnommen wurde. Die Astrozyten werden mit einer hohen Dichte ausgesät, um eine vollständige Anheftung in dem Raum zu gewährleisten, der nicht vom Gliom eingenommen wird. Nach der Zugabe von Astrozyten wird die Kultur 4 Tage vor der Analyse reifen gelassen. Die Reifungszeit (Tag 1-4 der Co-Kultur) ermöglicht es den Gliomzellen, die Regionen, an die sie sich anheften, zu füllen und Astrozyten herauszuwürgen, die möglicherweise versucht haben, sich in den Regionen anzuheften, in denen die Gliomzellen etabliert sind. Darüber hinaus ermöglicht die Reifezeit die Etablierung physikalischer Interaktionen, wie z. B. Gap Junctions, die häufig als Vermittlung der zellulären Interaktion von Astrozyten und Gliomzellen in vivo und in vitro angesehen werden 16,17,18.

Abbildung 4: Fluoreszierende Bilder am Tag 4 der Co-Kultur. (A) Astrozyten, die mit U87-Gliomzellen kokultiviert wurden, und (B) Astrozyten, die an Tag 4 der Co-Kultur mit A172-Gliomzellen kokultiviert wurden, was die selektive Fähigkeit dieser PEM-Oberflächen zeigt. Maßstab: 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Zu den entscheidenden Schritten, um den erfolgreichen Aufbau einer reproduzierbaren gemusterten Co-Kultur zu gewährleisten, gehören: 1) die erfolgreiche Strukturierung der Oberfläche durch Mikrospritzen in Kapillaren, 2) das erfolgreiche Waschen der gefärbten Zellen und 3) die Analyse der Co-Kultur im Fenster der "reifen Kultur". Erstens ist die erfolgreiche Reproduktion von Mustern mit Mikroformung in Kapillaren entscheidend für die Reproduzierbarkeit der Interaktion, da dies die gemusterte Co-Kultur von der zufälligen Co-Kultur unterscheidet. Um diese Reproduzierbarkeit zu gewährleisten, ist es wichtig, dass der Benutzer die Fähigkeit der Musterung durch Übung entwickelt oder ein automatisiertes System erhält, das Muster präzise nachbilden kann. Obwohl die PDMS-Stempel wiederverwendbar sind, kann die wiederholte Änderung und Verwendung des Stempels die Integrität des Musters im Laufe der Zeit beeinträchtigen. Daher wird empfohlen, die Integrität des Musters regelmäßig mit einem Mikroskop zu testen oder Muster mit Carboxyfluorescein zu visualisieren. Zweitens ist das erfolgreiche Waschen von Zellen, die mit PKH26 und Carboxyfluorescein gefärbt wurden, entscheidend für die Differenzierung der Zelltypen bei der ersten Etablierung der Methode und der Verfolgung der verschiedenen Zelltypen. Darüber hinaus kann eine Kreuzfärbung aufgrund eines erfolglosen Waschens die zukünftige Fähigkeit beeinträchtigen, Zellen mittels Durchflusszytometrie von der Co-Kultur zu trennen. Dieses Protokoll umfasst Waschschritte, die für die Durchflusszytometriegeräte optimiert sind, und die erfolgreiche Erstellung der Co-Kultur; Es kann jedoch erforderlich sein, die Anzahl der Waschschritte zu erhöhen, wenn der Benutzer während der Co-Kultur immer wieder Fleckenüberschneidungen feststellt. Schließlich ist das Zeitfenster für die Analyse einer reifen Kultur begrenzt, da die Gliomzellen schließlich das Muster füllen und beginnen, in astrozytenreiche Regionen des Musters einzudringen. Daher ist es ratsam, die Co-Kultur in gleichbleibenden Zeitabständen zu analysieren, um die Reproduzierbarkeit der Ergebnisse zu gewährleisten.
Zu den möglichen Problemen, auf die Benutzer stoßen könnten, gehören Probleme mit der CFSE-Sättigung. Wenn die Bilder mit Fluoreszenz gesättigt sind, reduzieren Sie die Färbezeit des Musters von 60-90 min auf 30-60 min. Wenn das Problem weiterhin besteht, verringern Sie die Fleckenkonzentration auf 0,075 μM in 0,1 M NaOH. Wenn die Bilder keine Fluoreszenz zeigen, bestätigen Sie zunächst, dass die Mikroskopeinstellungen und das Prisma für Anregungs- und Emissionswellenlängen von 492 nm bzw. 517 nm geeignet sind (d. h. Interferenzblaufilter (IB)) und überprüfen Sie einen Bereich von Belichtungszeiten von 100 ms bis 10.000 ms. Wenn immer noch keine Fluoreszenz vorhanden ist, erhöhen Sie die Färbezeit des Musters von 60-90 min auf 90-120 min. Wenn das Problem weiterhin besteht, erhöhen Sie die Fleckenkonzentration auf 0,15 μM in 0,1 M NaOH. Weitere Probleme, auf die Benutzer bei CFSE-visualisierten Mustern stoßen können, sind verschwommene oder unscharfe Kanten anstelle der gewünschten gestochen scharfen Geometrien, was ein Zeichen für übermäßig verwendete PDMS-Stempel sein kann. Erstellen Sie in diesem Fall neue PDMS-Stempel mit den Silizium-Master-Wafern. Verschwommene oder unscharfe Bilder können ebenfalls ein Zeichen für eine kontaminierte CFSE-Färbelösung sein und in diesem Fall eine neue CFSE-Färbelösung herstellen.
Dieses System hat gewisse inhärente Einschränkungen. Erstens handelt es sich um eine zweidimensionale Monokultur, die zwar für Vorstudien mit hohem Durchsatz 6,7,8 nützlich und mit den derzeit verfügbaren Interaktionsmodellen vergleichbar ist, aber nicht an die ideale Mimikry des dreidimensionalen in vivo Gewebesheranreicht 19. Darüber hinaus wird die physikalische Interaktion in diesem Co-Kultur-Modell optimiert, aber die Interaktion durch lösliche Faktoren ist aufgrund der statischen Natur dieses Systems nicht vollständig ausgeschlossen. Das statische Medium kann von Vorteil sein, da die Analyse freigesetzter löslicher Faktoren für das Verständnis der zellulären Reaktion aufschlussreich sein kann20. Das Verständnis der rein physikalischen Wechselwirkung erfordert eine minimierte Wechselwirkung durch lösliche Faktoren, die durch häufigen Medienwechsel und die Aufrechterhaltung eines großen Medienvolumens für die Faktordiffusion erreicht werden kann.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Diese Arbeit wurde ganz oder teilweise durch die NIH-Zuschüsse 1R01AA027189-01A1 (an S.K.), P20 GM104320 (an das Nebraska Center for the Prevention of Obesity Diseases Pilot Grant an S.K.), P20 GM113126 (an das Nebraska Center for Integrated Biomolecular Communication-Projektleiter S.K.); UNL Office of Research and Development Biomedical Seed Grant und Nebraska Research Initiative-Systems Grant (an S.K.). K.M.S. wurde durch T32GM107001, ein Ausbildungsstipendium, finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Fisher Scientific | 25200056 | |
| 15 ml Nunc Conical Sterile Polypropylene Centrifuge Tubes | Fisher Scientific | 12-565-268 | |
| 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester | Millipore Sigma | Cat#21888 | |
| 50 ml Nunc Conical Sterile Polypropylene Centrifuge Tubes | Fisher Scientific | 12-565-270 | |
| A172-MG GBM cell line | ATCC | CRL-1620 | |
| Bright-Line Hemacytometer | Sigma | Z359629 | Or other suitable cell counting device |
| Cell Incubator | N/A | N/A | |
| Cooled tabletop centrifuge for 15 mL tubes | N/A | N/A | |
| Dulbecco's Modified Eagle Medium (DMEM) | MP Biomedicals | ICN 1033120 | |
| Expanded Plasma Cleaner | Plasma Harrick | PDC-001-HP | With attached pressurized oxygen tank and PlasmaFlo Gas Mixer (PDC-FMG) accessory |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11550H | |
| Fluorosilane | Sigma Aldrich | 667420 | Full chemical name: 1H,1H,2H,2H-Perfluorooctyltriethoxysilane |
| Inverted Tabletop Microscope | N/A | N/A | Microscope capable of fluorescent imaging with λex = 551 nm; λem 567 nm [e.g. Rhodamine filter] (PKH26 dye) and λex 492 nm; λem 517 nm [e.g. interference blue filter (IB)] (CFSE dye) |
| NaCl | Sigma Aldrich | S7653 | |
| NaOH | Sigma Aldrich | 567530 | |
| Penicillin-Streptomicen | Fisher Scientific | 15140122 | |
| PKH26 Red Fluorescent Cell Linker Mini Kit | Millipore Sigma | Cat#MINI26-1KT | |
| Poly(diallyldimethylammonium chloride) solution (PDAC) | Sigma Aldrich | 409014 | 20 wt. % in H2O |
| Poly(sodium 4-styrenesulfonate) (SPS) | Sigma Aldrich | 243051 | average MW ~70,000 |
| Primary Astrocytes, isolated from Srague Dawley rats | Charles River | Crl:SD | Rats from Charles River; Lab isolated Cells |
| Scalpel | N/A | N/A | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sylgard 184 Silicone Elastomer Kit | Dow Chemical | Cat#2646340 | |
| Trypan Blue Stain | Fisher Scientific | 15-250-061 | |
| TryplE | Fisher Scientific | Gibco TrypLE | |
| U87-MG GBM cell line | ATCC | HTB-14 | |
| Vacuum Desiccator | N/A | N/A |
Referenzen
- Ostrom, Q. T., et al. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the United States in 2012-2016. Neuro Oncology. 21, suppl_5 1(2019).
- Ostrom, Q. T., et al. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the United States in 2010-2014. Neuro Oncology. 19, suppl_5 1-88 (2017).
- Roos, A., Ding, Z., Loftus, J. C., Tran, N. L. Molecular and microenvironmental determinants of glioma stem-like cell survival and invasion. Frontiers in Oncology. 7, 120(2017).
- Rath, B. H., Fair, J. M., Jamal, M., Camphausen, K., Tofilon, P. J. Astrocytes enhance the invasion potential of glioblastoma stem-like cells. PLoS One. 8 (1), 54752(2013).
- Le, D. M., et al. Exploitation of astrocytes by glioma cells to facilitate invasiveness: a mechanism involving matrix metalloproteinase-2 and the urokinase-type plasminogen activator-plasmin cascade. The Journal of Neuroscience. 23 (10), 4034-4043 (2003).
- Daverey, A., Brown, K. M., Kidambi, S. Breast cancer/stromal cells coculture on polyelectrolyte films emulates tumor stages and miRNA profiles of clinical samples. Langmuir. 31 (36), 9991-10001 (2015).
- Kidambi, S., Lee, I., Chan, C. Primary neuron/astrocyte co-culture on polyelectrolyte multilayer films: A template for studying astrocyte-mediated oxidative stress in neurons. Advanced Functional Materials. 18 (2), 294-301 (2008).
- Kidambi, S., et al. Patterned co-culture of primary hepatocytes and fibroblasts using polyelectrolyte multilayer templates. Macromolecular Bioscience. 7 (3), 344-353 (2007).
- Kidambi, S., Lee, I., Chan, C. Controlling primary hepatocyte adhesion and spreading on protein-free polyelectrolyte multilayer films. Journal of the American Chemical Society. 126 (50), 16286-16287 (2004).
- Mohammed, J. S., DeCoster, M. A., McShane, M. J. Micropatterning of nanoengineered surfaces to study neuronal cell attachment in vitro. Biomacromolecules. 5 (5), 1745-1755 (2004).
- Beaudoin, G. M., et al. Culturing pyramidal neurons from the early postnatal mouse hippocampus and cortex. Nature Protocols. 7 (9), 1741-1754 (2012).
- Wilson, C. L., Hayward, S. L., Kidambi, S. Astrogliosis in a dish: substrate stiffness induces astrogliosis in primary rat astrocytes. Rsc Advances. 6 (41), 34447-34457 (2016).
- Bogdanowicz, D. R., Lu, H. H. Studying cell-cell communication in co-culture. Biotechnololgy Journal. 8 (4), 395-396 (2013).
- Chen, W., et al. Glioma cells escaped from cytotoxicity of temozolomide and vincristine by communicating with human astrocytes. Medical Oncology. 32 (3), 43(2015).
- Belot, N., et al. Molecular characterization of cell substratum attachments in human glial tumors relates to prognostic features. Glia. 36 (3), 375-390 (2001).
- Sin, W. C., et al. Astrocytes promote glioma invasion via the gap junction protein connexin43. Oncogene. 35 (12), 1504-1516 (2016).
- Sin, W. C., Crespin, S., Mesnil, M. Opposing roles of connexin43 in glioma progression. Biochimica et Biophysica Acta. 1818 (8), 2058-2067 (2012).
- Oliveira, R., et al. Contribution of gap junctional communication between tumor cells and astroglia to the invasion of the brain parenchyma by human glioblastomas. BMC Cell Biology. 6 (1), 7(2005).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology (Bethesda). 32 (4), 266-277 (2017).
- Rape, A., Ananthanarayanan, B., Kumar, S. Engineering strategies to mimic the glioblastoma microenvironment). Advanced Drug Delivery Reviews. 79-80, 172-183 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten