Method Article
使用聚电解质多层模板模式化的星形胶质细胞和胶质母细胞瘤细胞的直接接触共培养
摘要
该方案描述了一种图案化的直接接触神经胶质瘤-星形胶质细胞共培养,利用聚电解质多层 (PEM) 上的微接触印刷来图案化 U87 或 A172 GBM 细胞和原代星形胶质细胞。
摘要
多形性胶质母细胞瘤 (GBM) 是最丰富和最致命的恶性脑癌。预计 13,000 年和 2020 年美国将有超过 2021 例病例。GBM 肿瘤最常起源于星形胶质细胞,其特征是其侵袭性,经常将健康组织募集到肿瘤组织中。了解星形胶质细胞和胶质母细胞瘤细胞之间的通讯对于分子理解肿瘤进展至关重要。该方案展示了一种新的模式化共培养方法,用于研究星形胶质细胞对 GBM 的接触介导的影响,该方法采用逐层组装和微毛细管力驱动的模式化。其优点包括无蛋白细胞培养环境和对由模式尺寸决定的细胞相互作用的精确控制。该技术提供了一种多功能、经济、可重复的方案,用于模拟神经胶质瘤肿瘤中神经胶质瘤和星形胶质细胞之间的细胞相互作用。该模型可以进一步用于梳理由于与星形胶质细胞的物理接触或非接触介导的可溶性辅因子通讯而导致的 GBM 分子生物学变化。
引言
多形性胶质母细胞瘤 (GBM) 是美国最多产和最致命的脑癌,中位生存时间约为 15 个月1。不到 7% 的 GBM 患者在诊断后存活超过 5 年 1,2。到 10 年时,这个数字下降到不到 1%1,2。尽管近几十年来其他癌症类型在生存率方面取得了显着改善,但 GBM 患者的成功并不理想。为了开发成功的治疗干预措施,必须使用适当的原位模型来更全面地了解 GBM 肿瘤生物学。这种理解对于改善 GBM 患者的临床结果至关重要。
大脑包含多种细胞类型,每种细胞类型都填充特定的生态位,以促进生物体的功能和生存。除了神经元,还有多种神经胶质细胞,包括星形胶质细胞、少突胶质细胞和小胶质细胞。特别是星形胶质细胞,通过分泌促迁移可溶性因子与 GBM 肿瘤的生长和侵袭有关3。此外,有一些报道称,身体接触是星形胶质细胞介导的神经胶质瘤细胞迁移和侵袭的驱动力 4,5。然而,驱动这种变化的分子基础在很大程度上仍然未知。
为了研究星形胶质细胞接触介导的对肿瘤生长的影响,该方案报告了用于体外细胞模式的可重复、无蛋白方法的开发。在这种方法中,聚电解质多层 (PEM) 被系统地组装以形成均匀的无蛋白质表面。PEM 使用聚阳离子-聚阴离子系统构建,该系统分别包含聚(二烯丙基甲基氯化铵)(PDAC) 和磺化聚(苯乙烯)(SPS)。这些聚合物是根据以前的研究选择的,这些研究报告了细胞优先附着在 SPS 上,而不是 PDAC 6,7,8,9,10。在这些 PEM 表面上,该方案利用微毛细管力光刻技术来设计原代星形胶质细胞和 GBM 细胞的图案化共培养模型。
本文提出的技术允许通过控制表面图案来精确设计特定的细胞间相互作用,从而支持细胞通讯的高度可重复研究。此外,该平台固有的仿生表面有助于研究直接的细胞间通讯,这对于加深对不同细胞类型之间通讯的机制理解至关重要。除此之外,该方法成本低,为进行 体外 研究以探索细胞通讯提供了显着优势。具体来说,该方案利用 GBM 在 SPS (-) 上通过 PDAC (+) 的差异附着来创建 GBM 细胞系和原代星形胶质细胞的模式化共培养物。
研究方案
这项研究严格按照美国国立卫生研究院《实验动物护理和使用指南》中的建议进行。该协议得到了内布拉斯加大学林肯分校动物实验伦理委员会的批准(项目ID:1046)。根据 UNL 的 IACUC 方案 1046 和稍作修改的方案,从 1-3 日龄的 Sprague-Dawley 大鼠幼崽制备原代星形胶质细胞 7,11。
1. 准备工作
- 在开始此协议之前,获取所需几何图形的主模式。
注:本协议中使用使用标准光刻技术制备的市售硅晶片。推荐的起始模式为 100-200 μm 线。 - 准备缓冲液和培养基。
- 准备聚(二烯丙基甲基氯化铵)(PDAC)和磺化聚(甾烯)(SPS)聚合物溶液以涂覆板。
- PDAC 涂层溶液为 0.3 wt. % PDAC 和 0.1 M NaCl 的 ddH2O 溶液。
- SPS 涂层溶液为 30 μM SPS 和 0.1 M NaCl 的 ddH2O 溶液。
注:1 L PDAC 涂层溶液和 1 L SPS 涂层溶液足以包被 6 个 6 孔板。溶液可以重复使用 2-5 次。当溶液变得浑浊时更换它们。
- 如果需要,准备标准细胞培养基。
- 典型的星形胶质细胞和 GBM 培养基分别是 Dulbecco 改良 Eagle 培养基 (DMEM) 中的 10% 胎牛血清 (FBS) 和 1% 青霉素-链霉素。
- 准备聚(二烯丙基甲基氯化铵)(PDAC)和磺化聚(甾烯)(SPS)聚合物溶液以涂覆板。
- 获取、准备或解冻细胞。
注意:该方案适用于从 1-3 天新生大鼠和 U87MG 或 A172-MG 神经胶质瘤细胞中分离的原代大鼠星形胶质细胞。在确认感兴趣的细胞系在聚合物表面上的差异附着后,该方案可以扩展到类似的细胞系。- 由于染色过程中的细胞损失,在 6 孔板中每孔至少使用 200,000 个 GBM 细胞,第 1 天至少使用 400,000 个活的原代大鼠星形胶质细胞。如果使用不同大小的孔或板,请调整细胞数量。
注意:推荐使用 Wilson 及其同事12 描述制备的来自第 2-4 代的原代星形胶质细胞用于该方案。神经胶质瘤细胞是市售的(参见 材料表)。
- 由于染色过程中的细胞损失,在 6 孔板中每孔至少使用 200,000 个 GBM 细胞,第 1 天至少使用 400,000 个活的原代大鼠星形胶质细胞。如果使用不同大小的孔或板,请调整细胞数量。
2. 聚二甲基硅氧烷 (PDMS) 冲压成型
- 在一次性容器中,称取 12 份 (按重量计) 的 PDMS 预聚物和 1 份 (按重量计) 的固化剂。剧烈混合 2-4 分钟,直到整个混合物充满气泡。
注意:26 克混合物足以用于一个 100 mm 培养皿。 - 将氟硅烷放入氟硅烷干燥器中。将装有聚合物混合物的一次性容器放入干燥器中脱气 20 分钟。
注意:这允许气泡从混合物中升出。如果 20 分钟后仍然存在大气泡,则可能需要更多时间。 - 将预先图案化的结构母版放入培养皿中。将 PDMS 混合物缓慢倒入培养皿中,在预先图案化的结构母版上,确保完全覆盖母版。PDMS 层的最佳深度约为 2-3 mm 厚。
注意:缓慢倒入混合物,避免产生气泡。确保硅胶母版平躺在培养皿中。 - 将培养皿放在氟硅烷干燥器中,直到去除所有气泡。将培养皿在60°C的烘箱中固化1小时。如果没有 60 °C,则在 37 °C 下将培养皿固化过夜。
- 使用锋利的手术刀,均匀而轻柔地切开母版周围。
注意: 使用手术刀时要小心。切勿让裸露的刀片无人看管。手术刀很锋利。采取适当的安全预防措施以防止受伤。 - 用镊子去除邮票并将其放在砧板等切割面上。使用手术刀将邮票切成足够小的尺寸,以适合 6 孔板(约 2.5 cm x 2.5 cm)。
3. 构建聚电解质多层膜 (PEM)
注意:该协议描述了带有附加加压氧气罐和气体混合附件的等离子涂层(参见 材料表)。任何对组织培养聚苯乙烯 (TCPS) 表面进行均匀等离子清洗的方法都是合适的。当使用不同的等离子清洗方法时,用户可能需要优化时间和强度。
- 对 6 孔板进行等离子清洁 7 分钟。
- 将门前部的三通阀向右转动,直到听到空气释放发出的嘶嘶声,对腔室进行排气。一旦压力读数高于 1800 mTorr,将三通阀转回垂直位置。
- 打开门,将 6 孔板放入腔室中。关上门并打开真空泵。抽空腔室,直到压力稳定在 100 mTorr 左右。
注意: 在腔室抽真空时,确认氧气罐已打开,氧气的输出压力为 10 psi。 - 向左打开三通阀,使管路与氧气输入软管对齐。让氧气排入腔室,直到压力稳定在 400 至 450 mTorr 之间。
注意: 确认流量计上的输入压力为 10 mm,并根据需要进行调整。 - 打开 RF 电源。等待等离子体形成 (~15 s),然后启动计时器 7 分钟。
- 7 分钟后,关闭射频电源并将三通阀转回其垂直位置。让腔室抽真空至 150 mTorr。
- 关闭真空泵,等待压力上升到 1500 mTorr。向右转动三通阀,对腔室进行通风,直到听到空气释放的嘶嘶声。当压力读数高于 1800 mTorr 时,将三通阀转回垂直位置,打开门并取出样品。
- 将等离子体涂层板置于室温浴中,如下所示:PDAC 20 分钟,去离子水 5 分钟,去离子水 5 分钟,SPS 20 分钟,去离子水 5 分钟,去离子水 5 分钟。确保整个板表面被浸没。
注:或者,可以使用自动玻片染色机来减少活性时间。如果可用,请温和地搅动。 - 重复上一步总共 10 次。让板风干。
注意:干燥的板可以在使用前在室温下储存长达数周。
4. 通过在毛细管中进行微成型 的 PEM 图案化
- 用温和的实验室肥皂清洗 PDMS 印章,然后用去离子水清洗。使用空气压缩机干燥印章,并将它们放在平坦、可移动的表面上,例如未使用的 6 孔板盖。
可选:邮票也可以风干。邮票在干燥时必须被覆盖并防止灰尘进入。 - 如步骤 3 中所述,对邮票进行等离子涂层 1 分钟。立即从等离子清洁器中取出印记,并将它们面朝下放在准备好的 6 孔板上。
- 沿邮票的底部边缘吸取 10 μL PDAC 溶液,沿邮票的长度稳定分配聚合物。确保将聚合物添加到印章的侧面,从线条图案中开出开口,以允许毛细管作用发生。
- 将 350 克的重物放在每个邮票的顶部 20 秒,以帮助强化图案。让邮票在盘子上放置 20 分钟。
- 将印版浸入去离子水中,然后沿线型方向剥下邮票。用去离子水洗涤板两次,每次 5 分钟。
- 用肥皂和去离子水清洗邮票,然后用空气压缩机干燥。让板风干。
- 如果准备好进行细胞培养,请在使用前立即在 II 级生物安全罩中在紫外线下对板消毒至少 8 小时。最小推荐总 UV-C 剂量为 400 mJ/cm 2,265 nm。如果可视化图案,请跳过紫外线灭菌步骤,并执行步骤 5。如果准备好进行细胞培养,请在紫外线灭菌后执行步骤 6。
5. 使用羧基荧光素 (CFSE) 可视化冲压模型
注:执行此程序以可视化冲压模式,或跳过此步骤,改为准备用于细胞培养的模式。图案染色后,就不能用于细胞培养。一旦对冲压有足够的信心,这些图案就可以用于细胞培养。羧基荧光素对光敏感。在黑暗中染色和运输。
- 将干燥的冲压图案置于 CFSE 图案染色溶液(0.1 μM CFSE 在 0.1 M NaOH 中)中 60-90 分钟。在 DI H2O 中洗涤压印模型 5 分钟两次。
注:如果使用载玻片,请将整个载玻片放入含有染色溶液的 50 mL 试管中。如果使用孔板,请添加足够的染色溶液以覆盖整个图案。 - 使用合适的荧光显微镜观察图案。
- 打开荧光灯,让它预热 10 分钟。由于图案使用 CFSE 染色,因此请使用干涉蓝色滤光片 (IB) 来可视化绿色图案。查看图案并拍照。
6. 用羧基荧光素对胶质母细胞瘤细胞进行染色和接种
注:所有细胞培养工作均应在合适的 II 级生物安全柜中进行。
- 用 0.25% 胰蛋白酶-EDTA 从培养表面分离细胞,在 4°C 下以 200 x g 离心 4 分钟,然后去除上清液。
- 将细胞重悬于 1 mL 无血清的细胞培养基(DMEM 和 1% 青霉素-链霉素)中,在 4 °C 下以 200 x g 离心 4 分钟,并去除上清液。
- 将细胞重悬于 1 mL PBS 中,并转移到无菌 1.5 mL 试管中。加入 10 μL 10 μg/mL CFSE,立即上下吹打彻底混匀。在室温下孵育 10 分钟,然后转移到 15 mL 无菌管中。
- 加入至少 1 mL 的细胞培养基(参见步骤 1.2.2.1)以淬灭 CFSE 染料反应。在 4 °C 下以 400 x g 离心 10 分钟,然后除去上清液。将细胞重悬于 5 mL 细胞培养基中,并转移至新鲜的 15 mL 无菌管中。
- 在 4 °C 下以 400 x g 离心 5 分钟,去除上清液,并将细胞重悬于 5 mL 细胞培养基中。
- 重复上一个洗涤步骤两次。
- 用星形胶质细胞培养基将染色的神经胶质瘤细胞(100 个细胞/mm2 或 100,000 个细胞/孔)接种在步骤 4 的图案化 6 孔组织培养板中。在培养箱(37°C,5% CO2 )中培养细胞 24 小时,然后在步骤 7 中加入染色的星形胶质细胞。
7. 用 PKH26 对原代星形胶质细胞进行染色和接种
注:所有细胞培养工作均应在合适的 II 级生物安全柜中进行。
- 用 0.25% 胰蛋白酶-EDTA 从培养表面分离细胞,在 4°C 下以 200 x g 离心 4 分钟,然后去除上清液。
- 将细胞重悬于 1 mL 无血清的细胞培养基(DMEM 和 1% 青霉素-链霉素)中,在 4 °C 下以 200 x g 离心 4 分钟,并去除上清液。
- 通过将细胞沉淀重悬于 PKH26 试剂盒中的 0.5 mL 室温稀释剂 C 中来制备 2x 细胞悬液。
- 通过在无菌 1.5 mL 试管中加入 2 μL PKH26 到 0.5 mL 稀释剂 C 中,制备 2x 染料溶液 (4 x 10-6 M)。使用前准备染料溶液。
- 将 2x 细胞悬液添加到 2x 染料溶液中,并立即通过上下吹打混合。
- 将细胞悬液孵育 1-5 分钟。
注:染色发生得很快,稀释剂 C 对细胞有害。更长的孵育时间并不意味着染色效果更好。 - 通过加入至少 5 倍体积的细胞培养基并孵育 1 分钟以结合过量的染料来淬灭染色。
- 在 4 °C 下以 200 x g 离心 10 分钟,然后小心去除上清液。将细胞重悬于 5 mL 细胞培养基中,并转移至新的无菌 15 mL 试管中。
- 在 4 °C 下以 200 x g 离心 5 分钟,去除上清液并重悬于 5 mL PBS 中。
- 在 4 °C 下以 200 x g 离心 5 分钟,去除上清液并重悬于 5 mL 细胞培养基中。
- 重复步骤 7.9 和 7.10,总共洗涤 3 次。
- 在预先接种有步骤 6 中神经胶质瘤细胞的图案化 6 孔组织培养板中,用星形胶质细胞培养基(200 个细胞/mm 2 或 200,000 个细胞/孔)接种染色的星形胶质细胞(200 个细胞/mm2 或 200,000 个细胞/孔)。在37°C,5%CO2 培养箱中培养细胞进行实验的时间。
8. 图案化单一培养和共培养的荧光成像
- 打开荧光灯,让它预热 10 分钟。
- 从培养箱中取出细胞培养物,并将其放在能够进行荧光成像的倒置显微镜的载物台上。
- 插入或连接适当的过滤器。如果正在成像的细胞用 CFSE 染色,请使用干涉蓝色滤光片 (IB) 来可视化绿色细胞。如果被成像的细胞用 PKH26 染色,请使用罗丹明滤光片观察红细胞。
- 查看标本并拍照。
注:现在可以使用流式细胞术分离细胞,以分析接触介导通讯的生物学效应。
结果
这里的协议描述了神经胶质瘤细胞和星形胶质细胞的直接接触模式共培养的工程。该平台提供了一个仿生多细胞模型,用于研究直接接触在星形胶质细胞和神经胶质瘤细胞之间通讯中多形性胶质母细胞瘤 (GBM) 进展中的作用。图 1 提供了上述逐步表面改性和细胞引入的方案。第一步是获得一个培养平台(玻璃盖玻片、组织培养板等),该平台涂有 10 个双层的 PDAC/SPS 自组装 PEM 涂层和用于共培养所需空间模式的 PDMS 印章。Kidambi 等人之前建立了 10 个 PDAC/SPS 双层,以提供均匀的 PEM 涂层,可用于成纤维细胞、神经元和乳腺癌细胞的空间控制 6,7,8。由硅母版形成的 PDMS 印记提供了一种多功能、可重复使用的工具,用于应用各种模式来研究各种细胞相互作用,包括需要物理接触的细胞相互作用,以探索特定通讯方法在肿瘤进展中的重要性。

图 1:在毛细管中使用 PEM 和微成型来创建胶质瘤细胞和小脑星形胶质细胞的图案化共培养平台的示意图概述。 (A) PDMS 预聚物和固化剂以 12:1 的比例混合,并浇注在具有所需纳米特征的硅晶片上,使用标准光刻技术进行商业制备 (1)。(B) 用氧血浆处理细胞培养底物,使其带负电荷 (2)。将底物依次浸入聚(二甲基氯化铵)(PDAC)中 20 分钟,去离子 (DI) H2O 5 分钟,DI H2O 5 分钟,聚(苯乙烯磺酸盐)(SPS) 20 分钟,DI H2O 5 分钟,DI H 2 O 5 分钟,DI H2O 5 分钟。这个 6 个浴池的过程重复 10 次。这可以手动完成,也可以在可编程浸涂机 (3) 的帮助下完成。(C) 基材现在有 10 个稳定的 PDAC 和 SPS 双层。将 PDMS 印模(来自 A)切成可用尺寸,用氧等离子体处理,并放置在 6 孔板 (4) 上(图案面朝下)。(D) 使用移液器沿 PDMS 印记边缘分配 ~10 μL PDAC,如红色 (5) 所示。沿着邮票的整个边缘缓慢而稳定地移动将确保均匀覆盖。可以使用电荷染料 (6) 验证模式,也可以制备用于细胞培养。(E) 图案化的基材表面经过紫外线消毒过夜。(F) 用 CFSE 对神经胶质瘤细胞进行染色,并接种到图案化的底物上。给神经胶质瘤细胞 1-2 天以附着在基质图案内的 SPS 表面。(G) 原代小脑星形胶质细胞用 PKH26 染色并回填到图案化的底物上。一旦共培养物在第 4 天成熟,就可以进行图像和分析。使用 BioRender.com 创建 请单击此处查看此图的较大版本。
该平台可以使用各种模式。 图 2 显示了用羧基荧光素可视化的微图案,展示了通过在毛细管中使用微成型实现的形状和尺寸的多功能性。例如,细胞的异质物理相互作用只会发生在模式的 PDAC 和 SPS 之间的界面上。因此, 图 2 左下角的方形图案展示了控制图案空间组织的能力,这可以进一步扩展到根据这些图案中的细胞位置控制特定的细胞间相互作用。比较这些模式中的共培养物将允许通过旁分泌信号更精确地研究直接交流的整体影响,而不是可溶性因子和非直接交流的整体影响13。此外,该平台允许研究人员设计模式来控制模拟 GBM 肿瘤生长各个阶段和肿瘤内位置的异质细胞相互作用的数量,以最佳方式模拟 体内 观察14。

图 2:用羧基荧光素染色的不同图案的 PEM。 PEM 允许研究人员调整表面条件(化学、形状和大小)以优化培养。比例尺 500 μm。 请单击此处查看此图的较大版本。
图 3 显示了 24 小时后选择性附着在图案化 PDAC/SPS 表面中 SPS 区域的神经胶质瘤细胞的单一培养物。代表性图像证明了 A172 和 U87 选择性粘附于特定区域的能力,为星形胶质细胞的回填留出空间。U87MG 细胞系通常用于胶质母细胞瘤研究,因为它是一种侵袭性、高致瘤性神经胶质瘤细胞系。本研究还选择 A172 作为侵袭性、非致瘤性胶质母细胞瘤细胞系。尽管这些细胞系存在差异,但当它们被引入到图案化的 PDAC/SPS 表面时,它们的行为似乎相似,根据可用的模式在空间上分布。这突出了该平台在研究胶质母细胞瘤15 不同阶段方面的多功能性。由于与星形胶质细胞相比,神经胶质瘤细胞具有相对较快的附着和生长速率,因此在神经胶质瘤接种后一天将星形胶质细胞引入培养物中。这是为了防止神经胶质瘤过度生长到专门用于星形胶质细胞附着的区域。
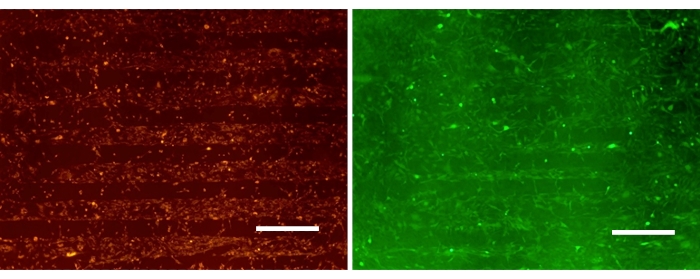
图 3:在 PEM 图案表面上用羧基荧光素(绿色)和 PKH26(红色)染色的图案状神经胶质瘤单一培养物。 比例尺:500 μm。 请点击此处查看此图的较大版本。
图 4 代表了星形胶质细胞接种后 4 天进行的成熟共培养物。星形胶质细胞以高密度接种,以确保完全附着在神经胶质瘤未占据的空间中。加入星形胶质细胞后,让培养物在分析前 4 天成熟。成熟时间(共培养的第 1-4 天)允许神经胶质瘤细胞填充它们附着的区域,并扼杀可能试图附着在神经胶质瘤细胞建立区域的星形胶质细胞。此外,成熟期允许建立物理相互作用,例如间隙连接,这通常被看到用于介导体内和体外星形胶质细胞和神经胶质瘤细胞的细胞相互作用 16,17,18。

图 4:共培养第 4 天的荧光图像。 (A) 与 U87 神经胶质瘤细胞共培养的星形胶质细胞和 (B) 共培养第 4 天与 A172 神经胶质瘤细胞共培养的星形胶质细胞,证明了这些 PEM 表面的选择性。比例尺:500 μm。 请点击此处查看此图的较大版本。
讨论
确保成功组装可重复的图案化共培养的关键步骤包括:1) 通过在毛细管中通过微成型成功形成表面图案化,2) 成功洗涤染色细胞,以及 3) 在“成熟培养”窗口中分析共培养。首先,在毛细管中通过微成型成功复制模式对于相互作用的可重复性至关重要,因为这是模式化共培养与随机共培养的不同之处。为了确保这种可重复性,用户必须通过练习来培养图案化技能,或者获得可以精确再现图案的自动化系统。此外,尽管 PDMS 邮票是可重复使用的,但邮票的反复修改和使用可能会随着时间的推移而磨损图案的完整性。因此,建议定期用显微镜测试图案完整性或用羧基荧光素观察图案。其次,在首次建立方法和跟踪不同的细胞类型时,成功洗涤用 PKH26 和羧基荧光素染色的细胞对于细胞类型的分化至关重要。此外,由于洗涤不成功而导致的交叉染色可能会抑制未来通过流式细胞术 将 细胞从共培养物中分离出来的能力。该方案包括针对流式细胞术设备优化的洗涤步骤和成功创建共培养物;但是,如果用户在共培养过程中始终发现污渍交叉,则可能需要增加洗涤步骤的数量。最后,分析成熟培养物的时间窗口是有限的,因为神经胶质瘤细胞最终将填充模式并开始侵入模式中富含星形胶质细胞的区域。因此,建议以一致的时间间隔分析共培养物,以确保结果的可重复性。
用户可能遇到的潜在问题包括 CFSE 饱和度问题。如果图像被荧光饱和,请将图案染色时间从 60-90 分钟减少到 30-60 分钟。如果问题仍然存在,请将 0.1 M NaOH 中的染色浓度降低至 0.075 μM。或者,如果图像没有显示荧光,请首先确认显微镜设置和棱镜分别适用于 492 nm 和 517 nm 的激发和发射波长(即干涉蓝色滤光片 (IB)),并检查从 100 毫秒到 10,000 毫秒的曝光时间范围。如果仍然没有荧光,将图案染色时间从 60-90 分钟增加到 90-120 分钟。如果问题仍然存在,请在 0.1 M NaOH 中将染色浓度增加到 0.15 μM。用户在使用 CFSE 可视化图案时可能遇到的其他问题是边缘模糊或模糊,而不是所需的清晰几何形状,这可能是 PDMS 印记过度使用的迹象。在这种情况下,请使用硅主晶片制作新的 PDMS 标记。模糊或模糊的图像也可能是 CFSE 染色溶液受污染的迹象,在这种情况下,请准备新的 CFSE 染色溶液。
这个系统确实有一些固有的局限性。首先,它是一种二维单一培养,虽然对高通量初步研究有用 6,7,8 并且与目前可用的相互作用模型相当,但达不到三维体内组织的理想模拟19。此外,在这种共培养模型中,物理相互作用得到了优化,但由于该系统的静态性质,通过可溶性因子的相互作用并未完全消除。静态培养基可能是一个优势,因为分析释放的可溶性因子可能有助于了解细胞反应20。理解纯物理相互作用需要通过可溶性因子最小化相互作用,这可以通过频繁更换介质和保持较大的介质体积进行因子扩散来实现。
披露声明
作者声明没有利益冲突。
致谢
这项工作全部或部分得到了 NIH 赠款 1R01AA027189-01A1(给 SK)、P20 GM104320(给内布拉斯加州预防肥胖疾病中心试点赠款给 SK)、P20 GM113126(给内布拉斯加州综合生物分子通讯中心 - 项目负责人 SK);UNL 研究与发展办公室生物医学种子赠款和内布拉斯加州研究计划-系统赠款(给 S.K.)。KMS 是通过培训补助金 T32GM107001 资助的。
材料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Fisher Scientific | 25200056 | |
| 15 ml Nunc Conical Sterile Polypropylene Centrifuge Tubes | Fisher Scientific | 12-565-268 | |
| 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester | Millipore Sigma | Cat#21888 | |
| 50 ml Nunc Conical Sterile Polypropylene Centrifuge Tubes | Fisher Scientific | 12-565-270 | |
| A172-MG GBM cell line | ATCC | CRL-1620 | |
| Bright-Line Hemacytometer | Sigma | Z359629 | Or other suitable cell counting device |
| Cell Incubator | N/A | N/A | |
| Cooled tabletop centrifuge for 15 mL tubes | N/A | N/A | |
| Dulbecco's Modified Eagle Medium (DMEM) | MP Biomedicals | ICN 1033120 | |
| Expanded Plasma Cleaner | Plasma Harrick | PDC-001-HP | With attached pressurized oxygen tank and PlasmaFlo Gas Mixer (PDC-FMG) accessory |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11550H | |
| Fluorosilane | Sigma Aldrich | 667420 | Full chemical name: 1H,1H,2H,2H-Perfluorooctyltriethoxysilane |
| Inverted Tabletop Microscope | N/A | N/A | Microscope capable of fluorescent imaging with λex = 551 nm; λem 567 nm [e.g. Rhodamine filter] (PKH26 dye) and λex 492 nm; λem 517 nm [e.g. interference blue filter (IB)] (CFSE dye) |
| NaCl | Sigma Aldrich | S7653 | |
| NaOH | Sigma Aldrich | 567530 | |
| Penicillin-Streptomicen | Fisher Scientific | 15140122 | |
| PKH26 Red Fluorescent Cell Linker Mini Kit | Millipore Sigma | Cat#MINI26-1KT | |
| Poly(diallyldimethylammonium chloride) solution (PDAC) | Sigma Aldrich | 409014 | 20 wt. % in H2O |
| Poly(sodium 4-styrenesulfonate) (SPS) | Sigma Aldrich | 243051 | average MW ~70,000 |
| Primary Astrocytes, isolated from Srague Dawley rats | Charles River | Crl:SD | Rats from Charles River; Lab isolated Cells |
| Scalpel | N/A | N/A | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sylgard 184 Silicone Elastomer Kit | Dow Chemical | Cat#2646340 | |
| Trypan Blue Stain | Fisher Scientific | 15-250-061 | |
| TryplE | Fisher Scientific | Gibco TrypLE | |
| U87-MG GBM cell line | ATCC | HTB-14 | |
| Vacuum Desiccator | N/A | N/A |
参考文献
- Ostrom, Q. T., et al. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the United States in 2012-2016. Neuro Oncology. 21, suppl_5 1(2019).
- Ostrom, Q. T., et al. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the United States in 2010-2014. Neuro Oncology. 19, suppl_5 1-88 (2017).
- Roos, A., Ding, Z., Loftus, J. C., Tran, N. L. Molecular and microenvironmental determinants of glioma stem-like cell survival and invasion. Frontiers in Oncology. 7, 120(2017).
- Rath, B. H., Fair, J. M., Jamal, M., Camphausen, K., Tofilon, P. J. Astrocytes enhance the invasion potential of glioblastoma stem-like cells. PLoS One. 8 (1), 54752(2013).
- Le, D. M., et al. Exploitation of astrocytes by glioma cells to facilitate invasiveness: a mechanism involving matrix metalloproteinase-2 and the urokinase-type plasminogen activator-plasmin cascade. The Journal of Neuroscience. 23 (10), 4034-4043 (2003).
- Daverey, A., Brown, K. M., Kidambi, S. Breast cancer/stromal cells coculture on polyelectrolyte films emulates tumor stages and miRNA profiles of clinical samples. Langmuir. 31 (36), 9991-10001 (2015).
- Kidambi, S., Lee, I., Chan, C. Primary neuron/astrocyte co-culture on polyelectrolyte multilayer films: A template for studying astrocyte-mediated oxidative stress in neurons. Advanced Functional Materials. 18 (2), 294-301 (2008).
- Kidambi, S., et al. Patterned co-culture of primary hepatocytes and fibroblasts using polyelectrolyte multilayer templates. Macromolecular Bioscience. 7 (3), 344-353 (2007).
- Kidambi, S., Lee, I., Chan, C. Controlling primary hepatocyte adhesion and spreading on protein-free polyelectrolyte multilayer films. Journal of the American Chemical Society. 126 (50), 16286-16287 (2004).
- Mohammed, J. S., DeCoster, M. A., McShane, M. J. Micropatterning of nanoengineered surfaces to study neuronal cell attachment in vitro. Biomacromolecules. 5 (5), 1745-1755 (2004).
- Beaudoin, G. M., et al. Culturing pyramidal neurons from the early postnatal mouse hippocampus and cortex. Nature Protocols. 7 (9), 1741-1754 (2012).
- Wilson, C. L., Hayward, S. L., Kidambi, S. Astrogliosis in a dish: substrate stiffness induces astrogliosis in primary rat astrocytes. Rsc Advances. 6 (41), 34447-34457 (2016).
- Bogdanowicz, D. R., Lu, H. H. Studying cell-cell communication in co-culture. Biotechnololgy Journal. 8 (4), 395-396 (2013).
- Chen, W., et al. Glioma cells escaped from cytotoxicity of temozolomide and vincristine by communicating with human astrocytes. Medical Oncology. 32 (3), 43(2015).
- Belot, N., et al. Molecular characterization of cell substratum attachments in human glial tumors relates to prognostic features. Glia. 36 (3), 375-390 (2001).
- Sin, W. C., et al. Astrocytes promote glioma invasion via the gap junction protein connexin43. Oncogene. 35 (12), 1504-1516 (2016).
- Sin, W. C., Crespin, S., Mesnil, M. Opposing roles of connexin43 in glioma progression. Biochimica et Biophysica Acta. 1818 (8), 2058-2067 (2012).
- Oliveira, R., et al. Contribution of gap junctional communication between tumor cells and astroglia to the invasion of the brain parenchyma by human glioblastomas. BMC Cell Biology. 6 (1), 7(2005).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology (Bethesda). 32 (4), 266-277 (2017).
- Rape, A., Ananthanarayanan, B., Kumar, S. Engineering strategies to mimic the glioblastoma microenvironment). Advanced Drug Delivery Reviews. 79-80, 172-183 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。