Method Article
תרבית משותפת במגע ישיר של אסטרוציטים ותאי גליובלסטומה בדוגמת תבניות רב-שכבתיות של פוליאלקטרוליטים
In This Article
Summary
פרוטוקול זה מתאר תרבית משותפת של מגע ישיר עם גליומה-אסטרוציטים המשתמשת בהדפסת מיקרו-מגע על רב-שכבות פוליאלקטרוליטים (PEMs) כדי לדפוס תאי U87 או A172 GBM ואסטרוציטים ראשוניים.
Abstract
גליובלסטומה מולטיפורמה (GBM) היא סרטן המוח הממאיר הנפוץ והקטלני ביותר. ישנם יותר מ-13,000 מקרים צפויים בארצות הברית בשנים 2020 ו-2021. גידולי GBM נובעים לרוב מאסטרוציטים ומאופיינים באופי הפולשני שלהם, ולעתים קרובות מגייסים רקמות בריאות לרקמת הגידול. הבנת התקשורת בין אסטרוציטים לתאי גליובלסטומה חיונית להבנה מולקולרית של התקדמות הגידול. פרוטוקול זה מדגים שיטת קו-תרבית חדשה לחקירת השפעות מתווכות מגע של אסטרוציטים על GBM תוך שימוש בהרכבה שכבה אחר שכבה ודפוס מונע כוח מיקרו-נימי. היתרונות כוללים סביבת תרבית תאים נטולת חלבון ובקרה מדויקת על האינטראקציה התאית המוכתבת על ידי ממדי התבנית. טכניקה זו מספקת פרוטוקול רב-תכליתי, חסכוני וניתן לשחזור לחיקוי אינטראקציה תאית בין גליומה לאסטרוציטים בגידולי גליומה. ניתן להשתמש במודל זה כדי להפריד בין שינויים בביולוגיה המולקולרית של GBM עקב מגע פיזי עם אסטרוציטים או עם תקשורת קופקטור מסיס ללא מגע.
Introduction
גליובלסטומה מולטיפורמה (GBM) הוא סרטן המוח הפורה והקטלני ביותר בארצות הברית עם זמן הישרדות חציוני של כ-15חודשים. פחות מ-7% מחולי GBM שורדים יותר מ-5 שנים לאחר האבחנה 1,2. ב-10 שנים, הנתון הזה יורד לפחות מ-1%1,2. למרות שסוגי סרטן אחרים השיגו שיפורים ניכרים בהישרדות בעשורים האחרונים, הצלחתם של חולי GBM נופלת. כדי לפתח התערבויות טיפוליות מוצלחות, יש להשתמש במודל מתאים באתרו כדי לפתח הבנה מעמיקה יותר של הביולוגיה של גידול GBM. הבנה זו חיונית לשיפור התוצאות הקליניות עבור חולי GBM.
המוח מכיל מגוון גדול של סוגי תאים שכל אחד מהם ממלא נישות ספציפיות כדי לקדם את תפקוד האורגניזם והישרדותו. בנוסף לתאי עצב, ישנם מגוון תאי גליה, כולל אסטרוציטים, אוליגודנדרוציטים ומיקרוגליה. אסטרוציטים, במיוחד, היו מעורבים בצמיחה ופלישה של גידול GBM באמצעות הפרשת גורמים מסיסים פרו-נדידה3. יתר על כן, ישנם כמה דיווחים שמגע פיזי הוא הכוח המניע של נדידת תאי גליומה בתיווך אסטרוציטיםופלישה 4,5. עם זאת, הבסיס המולקולרי המניע את השינוי הזה נותר ברובו לא ידוע.
על מנת לחקור את ההשפעות המתווכות במגע של אסטרוציטים על צמיחת הגידול, פרוטוקול זה מדווח על פיתוח שיטה ניתנת לשחזור ונטולת חלבון לדפוס תאים במבחנה. בשיטה זו, רב-שכבות פוליאלקטרוליטים (PEMs) מורכבות באופן שיטתי ליצירת משטח אחיד נטול חלבון. PEMs בנויים באמצעות מערכת פוליקיון-פוליאניון הכוללת פולי (דיאלמתילאמוניום כלוריד) (PDAC) ופולי סולפונטי (סטרן) (SPS), בהתאמה. פולימרים אלה נבחרו על סמך מחקרים קודמים שדיווחו על הצמדה מועדפת של תאים ל-SPS על פני PDAC 6,7,8,9,10. על משטחי PEM אלה, פרוטוקול זה משתמש בליתוגרפיה של כוח מיקרו-נימי כדי להנדס מודלים של תרבית משותפת של אסטרוציטים ראשוניים ותאי GBM.
הטכניקות המוצגות כאן מאפשרות הנדסה מדויקת של אינטראקציות תא-תא ספציפיות באמצעות בקרה על דפוסי פני השטח, ובכך תומכות בחקירה הניתנת לשחזור של תקשורת סלולרית. יתר על כן, המשטח הביומימטי הטמון בפלטפורמה זו מאפשר לחקור תקשורת ישירה בין תא לתא שהיא חיונית להעמקת ההבנה המכאניסטית של התקשורת בין סוגי תאים שונים. מעבר לכך, השיטה זולה ומעניקה יתרון משמעותי לביצוע מחקרי מבחנה לחקר התקשורת התאית. באופן ספציפי, פרוטוקול זה מנצל התקשרות דיפרנציאלית של GBM ב-SPS (-) על PDAC (+) כדי ליצור תרביות משותפות דפוסיות של קווי תאי GBM ואסטרוציטים ראשוניים.
Protocol
מחקר זה בוצע בהתאם להמלצות במדריך לטיפול ושימוש בחיות מעבדה של המכונים הלאומיים לבריאות. הפרוטוקול אושר על ידי הוועדה לאתיקה של ניסויים בבעלי חיים של אוניברסיטת נברסקה-לינקולן (מזהה פרויקט: 1046). אסטרוציטים ראשוניים הוכנו מגורי חולדות Sprague-Dawley בני 1-3 ימים בהתאם לפרוטוקול IACUC 1046 של UNL ובהתאם לפרוטוקול עם שינויים קלים 7,11.
1. הכנות
- השג תבנית אב של הגיאומטריה הרצויה לפני שתתחיל בפרוטוקול זה.
הערה: פרוסות סיליקון זמינות מסחרית שהוכנו בטכניקות פוטוליתוגרפיה סטנדרטיות משמשות בפרוטוקול זה. דפוס ההתחלה המומלץ הוא קווים של 100-200 מיקרומטר. - הכן מאגרים ומדיה.
- הכן תמיסות פולימר פולי (דיאלמתילאמוניום כלוריד) (PDAC) ופולי (סטרן) סולפונטי (SPS) לציפוי צלחות.
- תמיסת ציפוי PDAC היא 0.3 wt. % PDAC ו-0.1 M NaCl ב-ddH2O.
- תמיסת ציפוי SPS היא 30 מיקרומטר SPS ו-0.1 M NaCl ב-ddH2O.
הערה: 1 ליטר של תמיסת ציפוי PDAC ו-1 ליטר של תמיסת ציפוי SPS מספיקים לציפוי שש צלחות 6 בארות. ניתן לעשות שימוש חוזר בתמיסות 2-5 פעמים. החלף את הפתרונות כאשר הם הופכים לעכורים.
- הכן מדיה סטנדרטית לתרבית תאים, במידת הצורך.
- אסטרוציטים ו-GBM טיפוסיים הם, בהתאמה, 10% סרום בקר עוברי (FBS) ו-1% פניצילין-סטרפטומיצין במדיום הנשר המותאם של דולבקו (DMEM).
- הכן תמיסות פולימר פולי (דיאלמתילאמוניום כלוריד) (PDAC) ופולי (סטרן) סולפונטי (SPS) לציפוי צלחות.
- השגה, הכנה או הפשרה של תאים.
הערה: פרוטוקול זה מתואר עבור אסטרוציטים ראשוניים של חולדות שבודדו מחולדות יילודים של 1-3 ימים ותאי גליומה U87MG או A172-MG. ניתן להרחיב פרוטוקול זה לקווי תאים דומים לאחר אישור הצמדה דיפרנציאלית של קווי תאים מעניינים על משטחי פולימר.- עקב אובדן תאים במהלך הצביעה, השתמש במינימום של 200,000 תאי GBM ביום 0 וב-400,000 אסטרוציטים ראשוניים חיים של חולדות ביום הראשון לבאר בצלחת של 6 בארות. התאם את מספרי התאים אם אתה משתמש בבאר או בצלחת בגודל שונה.
הערה: אסטרוציטים ראשוניים מקטעים 2-4 שהוכנו כפי שתוארו על ידי וילסון ועמיתיו12 מומלצים לפרוטוקול זה. תאי גליומה הושגו באופן מסחרי (ראה טבלת חומרים).
- עקב אובדן תאים במהלך הצביעה, השתמש במינימום של 200,000 תאי GBM ביום 0 וב-400,000 אסטרוציטים ראשוניים חיים של חולדות ביום הראשון לבאר בצלחת של 6 בארות. התאם את מספרי התאים אם אתה משתמש בבאר או בצלחת בגודל שונה.
2. יציקת חותמת פולידימתילסילוקסן (PDMS).
- במיכל חד פעמי, שקלו 12 חלקים (לפי משקל) של PDMS pre-polymer וחלק אחד (לפי משקל) של חומר ריפוי. מערבבים במרץ במשך 2-4 דקות עד שכל התערובת מתמלאת בבועות.
הערה: 26 גרם מהתערובת מספיקים לצלחת פטרי אחת של 100 מ"מ. - הנח פלואורוסילן לתוך מייבש הפלואורוסילן. מניחים את המיכל החד פעמי עם תערובת הפולימר לתוך החומר היבש להסרת גז למשך 20 דקות.
הערה: זה מאפשר לבועות לעלות מהתערובת. ייתכן שיהיה צורך בזמן נוסף אם בועות גדולות עדיין קיימות לאחר 20 דקות. - הניחו את מאסטר המבנה המעוצב מראש בצלחת פטרי. יוצקים את תערובת ה-PDMS לאט לתוך צלחת הפטרי מעל מאסטר המבנה המעוצב מראש, ומבטיחים לכסות לחלוטין את המאסטר. העומק האופטימלי של שכבת ה-PDMS הוא בעובי של כ-2-3 מ"מ.
הערה: הימנע מיצירת בועות אוויר על ידי מזיגה איטית של התערובת. ודא שמאסטר הסיליקון מונח שטוח בצלחת הפטרי. - שמור את צלחת הפטרי במייבש הפלואורוסילן עד להסרת כל הבועות. מרפאים את צלחת הפטרי בתנור בחום של 60 מעלות למשך שעה. אם אין 60 מעלות צלזיוס, מרפאים את צלחת הפטרי ב-37 מעלות צלזיוס למשך הלילה.
- בעזרת אזמל חד, חותכים באופן שווה ובעדינות סביב המאסטר.
אזהרה: יש לנקוט משנה זהירות בעת שימוש באזמל. לעולם אל תשאיר את הלהב החשוף ללא השגחה. אזמל חד. השתמש באמצעי זהירות מתאימים כדי למנוע פציעה. - הסר את החותמת באמצעות פינצטה והנח אותה על משטח חיתוך כגון קרש חיתוך. בעזרת אזמל חותכים את החותמות לגודל קטן מספיק כדי להתאים לצלחות של 6 בארות (כ -2.5 ס"מ על 2.5 ס"מ).
3. בניית פוליאלקטרוליטים רב שכבתיים (PEMs)
הערה: פרוטוקול זה מתאר ציפוי פלזמה עם מיכל חמצן בלחץ מחובר ואביזר ערבוב גז (ראה טבלת חומרים). כל שיטה לניקוי פלזמה שווה של משטח הפוליסטירן של תרבית הרקמה (TCPS) מתאימה. ייתכן שיהיה צורך לבצע אופטימיזציה של הזמן והעוצמה על ידי המשתמש בעת שימוש בשיטת ניקוי פלזמה אחרת.
- נקה פלזמה צלחת 6 בארות למשך 7 דקות.
- דמם את החדר על ידי סיבוב השסתום התלת-כיווני בחזית הדלת ימינה עד שניתן יהיה לשמוע את השריקה משחרור האוויר. סובב את השסתום התלת-כיווני בחזרה למצב אנכי ברגע שקריאת הלחץ היא מעל 1800 mTorr.
- פתח את הדלת והכנס את צלחת 6 הבארות לתא. סגור את הדלת והפעל את משאבת הוואקום. פנה את החדר עד שהלחץ יציב סביב 100 mTorr.
הערה: בזמן שהתא מתפנה, ודא שמיכל החמצן פתוח, ולחץ המוצא של החמצן הוא 10 psi. - פתח את השסתום התלת-כיווני שמאלה כדי ליישר את הקו עם צינור כניסת החמצן. אפשר לגז החמצן לדמם לתוך התא עד שהלחץ מתייצב בין 400 ל-450 mTorr.
הערה: ודא שלחץ הכניסה על מד הזרימה הוא 10 מ"מ והתאם במידת הצורך. - הפעל את מתח ה-RF. המתן להיווצרות הפלזמה (~15 שניות), ולאחר מכן הפעל את הטיימר למשך 7 דקות.
- לאחר 7 דקות, כבה את מתח ה-RF וסובב את השסתום התלת-כיווני בחזרה למקומו האנכי. אפשר לתא להתפנות ל-150 mTorr.
- כבה את משאבת הוואקום והמתן עד שהלחץ יעלה ל-1500 mTorr. אוורור את החדר על ידי סיבוב השסתום התלת-כיווני ימינה עד שניתן יהיה לשמוע את השריקה משחרור האוויר. כאשר קריאת הלחץ היא מעל 1800 mTorr, סובב את השסתום התלת-כיווני בחזרה למקומו האנכי, פתח את הדלת ואחזר את הדגימה.
- הנח צלחות מצופות פלזמה באמבטיות בטמפרטורת החדר באופן הבא: PDAC למשך 20 דקות, מי DI למשך 5 דקות, מי DI למשך 5 דקות, SPS למשך 20 דקות, מי DI למשך 5 דקות ומי DI למשך 5 דקות. ודא שכל משטח הצלחת שקוע.
הערה: לחלופין, ניתן להשתמש במכתים שקופיות אוטומטי כדי להפחית את זמן הפעילות. יש להשתמש בערבול עדין, אם זמין. - חזור על השלב הקודם בסך הכל 10 פעמים. הניחו לצלחות להתייבש באוויר.
הערה: ניתן לאחסן את הצלחות המיובשות בטמפרטורת החדר עד מספר שבועות לפני השימוש.
4. דפוס PEM באמצעות מיקרו-דפוס בנימים
- שטפו את חותמות ה-PDMS עם סבון מעבדה עדין ואחריו מי DI. יבש את החותמות באמצעות מדחס אוויר והנח אותן על משטח שטוח וניתן להזזה כגון מכסה צלחת 6 בארות שאינו בשימוש.
אופציונלי: ניתן גם לייבש את החותמות באוויר. יש לכסות את החותמות ולהגן עליהן מפני אבק בזמן הייבוש. - ציפוי פלזמה את החותמות, כמתואר בשלב 3, למשך דקה אחת. הסר מיד את החותמות ממנקה הפלזמה והנח אותן עם הפנים כלפי מטה על צלחות 6 הבארות המוכנות.
- פיפטה 10 מיקרוליטר של תמיסת PDAC לאורך הקצה התחתון של החותמת, ומפזרת את הפולימר בהתמדה לאורך החותמת. הקפד להוסיף את הפולימר לצד החותמת עם פתחים מתבניות הקו כדי לאפשר פעולה נימית.
- הניחו משקל של 350 גרם על גבי כל חותמת למשך 20 שניות כדי לעזור לאכוף את התבנית. הניחו לחותמות לנוח על הצלחות למשך 20 דקות.
- טובלים את הצלחת במי DI ומקלפים את החותמות לכיוון דפוסי הקווים. שטפו את הצלחת פעמיים במשך 5 דקות כל אחת במי DI.
- שוטפים את ה-amps עם סבון ומי DI ומייבשים עם מדחס אוויר. הניחו לצלחת להתייבש באוויר.
- אם הם מוכנים לתרבית תאים, יש לעקר את הצלחות תחת אור UV בקולט אדים מסוג II למשך 8 שעות לפחות מיד לפני השימוש. מינון ה-UV-C הכולל המינימלי המומלץ הוא 400 mJ/cm2 ב-265 ננומטר. אם אתה מדמיין דפוסים, דלג על שלב עיקור UV ובצע את שלב 5. אם מוכן לתרבית תאים, בצע את שלב 6 לאחר עיקור UV.
5. הדמיית דפוסים מוטבעים עם carboxyfluorescein (CFSE)
הערה: בצע הליך זה כדי לדמיין דפוסים מוטבעים או דלג על שלב זה ובמקום זאת הכן תבניות לתרבית תאים. ברגע שהתבניות מוכתמות, לא ניתן להשתמש בהן לתרבית תאים. לאחר שנרכש ביטחון מספיק בהטבעה, ניתן להשתמש בתבניות לתרבית תאים. קרבוקסיפלואורסצאין רגיש לאור. כתמים והובלה בחושך.
- הנח דפוסים מיובשים ומוטבעים בתמיסת צביעת דפוס CFSE (0.1 מיקרומטר CFSE ב-0.1 M NaOH) למשך 60-90 דקות. שטפו דפוסים מוטבעים במשך 5 דקות ב-DI H2O פעמיים.
הערה: אם אתה משתמש בשקופיות זכוכית, הנח את כל השקופית לתוך צינור של 50 מ"ל המכיל את תמיסת הצביעה. אם משתמשים בצלחות באר, הוסף מספיק תמיסת מכתים כדי לכסות את כל התבנית. - דמיין דפוסים באמצעות מיקרוסקופ פלואורסצנטי מתאים.
- הפעל את נורת הפלורסנט כדי לאפשר לה להתחמם למשך 10 דקות. מאחר שדפוסים מוכתמים ב-CFSE, השתמש במסנן הכחול של ההפרעות (IB) כדי להמחיש את הדפוסים הירוקים. הצג את הדפוסים וצלם תמונות.
6. צביעה וזריעה של תאי גליובלסטומה עם קרבוקסיפלואורסצאין
הערה: יש לבצע את כל עבודות תרבית התאים בארון בטיחות ביולוגית Class II מתאים.
- נתק את התאים משטח התרבית עם 0.25% טריפסין-EDTA, צנטריפוגה ב-200 x גרם למשך 4 דקות ב-4 מעלות צלזיוס, והסר את הסופרנטנט.
- השעו מחדש את התאים ב-1 מ"ל של מצע תרבית תאים ללא סרום (DMEM ו-1% פניצילין-סטרפטומיצין), צנטריפוגה ב-200 x גרם למשך 4 דקות ב-4 מעלות צלזיוס, והסר את הסופרנטנט.
- השעו מחדש את התאים ב-1 מ"ל של PBS והעבירו לצינור סטרילי של 1.5 מ"ל. מוסיפים 10 מיקרוליטר של 10 מיקרוגרם/מ"ל CFSE ומערבבים מיד היטב על ידי פיפטינג למעלה ולמטה. דוגרים בטמפרטורת החדר למשך 10 דקות ומעבירים לצינור סטרילי של 15 מ"ל.
- הוסף מינימום של 1 מ"ל של מדיום תרבית תאים (ראה שלב 1.2.2.1) כדי להרוות את תגובת הצבע CFSE. צנטריפוגה ב-400 x גרם למשך 10 דקות ב-4 מעלות צלזיוס והסר את הסופרנטנט. השעו מחדש את התאים במדיום תרבית תאים של 5 מ"ל והעבירו לצינור סטרילי טרי של 15 מ"ל.
- צנטריפוגה ב-400 x גרם למשך 5 דקות ב-4 מעלות צלזיוס, הסר את הסופרנטנט והשהה מחדש את התאים ב-5 מ"ל של מדיום תרבית תאים.
- חזור על שלב הכביסה הקודם פעמיים.
- זרעו את תאי הגליומה המוכתמים (100 תאים/מ"מ2 או 100,000 תאים/באר) בצלחת תרבית רקמה מעוצבת של 6 בארות משלב 4 עם מצע תרבית אסטרוציטים. תרבו את התאים באינקובטור (37 מעלות צלזיוס, 5% CO2) במשך 24 שעות לפני הוספת אסטרוציטים מוכתמים בשלב 7.
7. צביעה וזריעה של אסטרוציטים ראשוניים עם PKH26
הערה: יש לבצע את כל עבודת תרבית התאים בארון בטיחות ביולוגית Class II מתאים.
- נתק את התאים משטח התרבית עם 0.25% טריפסין-EDTA, צנטריפוגה ב-200 x גרם למשך 4 דקות ב-4 מעלות צלזיוס, והסר את הסופרנטנט.
- השעו מחדש את התאים ב-1 מ"ל של מצע תרבית תאים ללא סרום (DMEM ו-1% פניצילין-סטרפטומיצין), צנטריפוגה ב-200 x גרם למשך 4 דקות ב-4 מעלות צלזיוס, והסר את הסופרנטנט.
- הכן תרחיף תאים פי 2 על ידי השעיית גלולת התא ב-0.5 מ"ל של מדלל C בטמפרטורת החדר מערכת PKH26.
- הכן תמיסת צבע פי 2 (4 x 10-6 מ') על ידי הוספת 2 מיקרוליטר של PKH26 ל-0.5 מ"ל של מדלל C בצינור סטרילי של 1.5 מ"ל. הכן את תמיסת הצבע ממש לפני השימוש.
- הוסף תרחיף תאים 2x לתמיסת צבע 2x וערבב מיד על ידי פיפטינג למעלה ולמטה.
- דגרו את תרחיף התאים למשך 1-5 דקות.
הערה: הצביעה מתרחשת במהירות, ומדלל C מזיק לתאים. דגירה ארוכה יותר לא אומרת צביעה טובה יותר. - הרוו את הצביעה על ידי הוספת נפח מינימלי פי 5 של מדיום תרבית התאים ודגירה למשך דקה אחת כדי לקשור את עודפי הצבע.
- צנטריפוגה ב-200 x גרם למשך 10 דקות ב-4 מעלות צלזיוס והסר בזהירות את הסופרנטנט. השעו מחדש את התאים ב-5 מ"ל של מצע תרבית תאים והעבירו לצינור סטרילי חדש של 15 מ"ל.
- צנטריפוגה ב-200 x גרם למשך 5 דקות ב-4 מעלות צלזיוס, הסר את הסופרנטנט והשהה מחדש ב-5 מ"ל PBS.
- צנטריפוגה ב-200 x גרם למשך 5 דקות ב-4 מעלות צלזיוס, הסר את הסופרנטנט והשהה מחדש ב-5 מ"ל של אמצעי תרבית תאים.
- חזור על שלבים 7.9 ו- 7.10 בסך הכל שלוש כביסות.
- זרעו את האסטרוציטים המוכתמים (200 תאים/מ"מ2 או 200,000 תאים/באר) במצע אסטרוציטים (ראה שלב 1.2.2.1) בצלחת תרבית רקמה מעוצבת בת 6 בארות שנזרעה מראש עם תאי גליומה משלב 6. תרבית התאים בחממת CO2 של 37 מעלות צלזיוס, 5% למשך זמן ביצוע הניסויים.
8. הדמיה פלואורסצנטית של מונו-תרבית מעוצבת וקו-תרבית
- הפעל את נורת הפלורסנט כדי לאפשר לה להתחמם למשך 10 דקות.
- הסר את תרבית התאים מהחממה והניח אותה על הבמה של מיקרוסקופ הפוך המסוגל להדמיה פלואורסצנטית.
- הכנס או חבר את המסנן המתאים. אם התאים המצולמים מוכתמים ב-CFSE, השתמש במסנן הכחול של ההפרעות (IB) כדי לדמיין את התאים הירוקים. אם התאים המצולמים מוכתמים ב-PKH26, השתמש במסנן רודמין כדי לדמיין את התאים האדומים.
- צפו בדגימה וצלמו תמונות.
הערה: כעת ניתן להפריד את התאים באמצעות זרימה ציטומטרית כדי לנתח את ההשפעות הביולוגיות של תקשורת מתווכת מגע.
תוצאות
הפרוטוקול כאן מתאר את ההנדסה של תרבית משותפת בתבנית מגע ישיר של תאי גליומה ואסטרוציטים. פלטפורמה זו מספקת מודל רב-תאי ביומימטי לחקר תפקידו של מגע ישיר בתקשורת בין אסטרוציטים לתאי גליומה בהתקדמות גליובלסטומה מולטיפורמה (GBM). איור 1 מספק סכימה של שינוי פני השטח שלב אחר שלב והקדמה סלולרית שתוארו לעיל. שלב ראשון הוא השגת פלטפורמת תרבית (כיסוי זכוכית, צלחת תרבית רקמות וכו') המצופה בציפוי PEM בהרכבה עצמית של PDAC/SPS ב-10 שכבות דו-שכבתיות וחותמת PDMS של התבנית המרחבית הרצויה לתרבית המשותפת. עשר שכבות דו-שכבתיות של PDAC/SPS הוקמו בעבר על ידי Kidambi et al. כדי לספק ציפוי PEM אחיד שימושי לבקרה מרחבית של פיברובלסטים, נוירונים ותאי סרטן השד 6,7,8. חותמת ה-PDMS שנוצרה ממאסטר סיליקון מספקת כלי רב תכליתי לשימוש חוזר ליישום מגוון דפוסים לחקר אינטראקציות תאיות שונות, כולל אלה הדורשות מגע פיזי כדי לחקור את החשיבות של שיטות תקשורת ספציפיות בהתקדמות הגידול.

איור 1: סקירה סכמטית עבור שימוש ב-PEMs ומיקרו-יציקה בנימים ליצירת פלטפורמת תרבית משותפת מעוצבת של תאי גליומה ואסטרוציטים במוח הקטן. (A) קדם-פולימר וחומר ריפוי PDMS מעורבבים ביחס של 12:1 ונשפכים על פרוסות סיליקון עם תכונות ננו-רצויות, שהוכנו באופן מסחרי באמצעות טכניקות פוטוליתוגרפיה סטנדרטיות (1). (B) מצע תרבית תאים מטופל בפלזמת חמצן כדי להפוך למטען שלילי (2). המצע טובל ברצף בפולי (דיאלדימתילאמוניום כלוריד) (PDAC) למשך 20 דקות, נטול יונים (DI) H2O למשך 5 דקות, DI H2O למשך 5 דקות, פולי (סטירן סולפונט) (SPS) למשך 20 דקות, DI H2O למשך 5 דקות ו- DI H2O למשך 5 דקות. תהליך זה של שש אמבטיות חוזר על עצמו 10 פעמים. ניתן לעשות זאת באופן ידני או בעזרת ציפוי טבילה הניתן לתכנות (3). (C) למצע יש כעת 10 שכבות דו-שכבתיות יציבות של PDAC ו-SPS. חותמות ה-PDMS ( מ-A) נחתכות לגדלים שמישים, מטופלות בפלזמת חמצן ומונחות (כשצד התבנית פונה כלפי מטה) על צלחות של 6 בארות (4). (D) פיפטה משמשת לחלוקת ~10 מיקרוליטר של PDAC לאורך הקצה של חותמת ה-PDMS, שמוצגת באדום (5). תנועה איטית ויציבה לאורך כל קצה החותמת תבטיח כיסוי אחיד. ניתן לאמת דפוסים באמצעות צבעים טעונים (6) או להכין אותם לתרבית תאים. (E) משטחי מצע מעוצבים עוברים עיקור UV בן לילה. (F) תאי גליומה מוכתמים ב-CFSE ונזרעים על המצע המעוצב. לתאי הגליומה ניתנים 1-2 ימים להיצמד למשטחי SPS בתוך התבניות על המצע. (G) אסטרוציטים ראשוניים של המוח הקטן מוכתמים ב-PKH26 וממולאים מחדש על המצע המעוצב. ניתן לצלם תמונות וניתוח ברגע שהתרבות המשותפת מבשילה ביום הרביעי. נוצר באמצעות BioRender.com אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
ניתן להשתמש בדפוסים שונים בפלטפורמה זו. איור 2 מציג דפוסי מיקרו המוצגים עם קרבוקסיפלואורסצאין המדגימים את הרבגוניות של הצורה והגודל המושגת על ידי שימוש במיקרו-דפוס בנימים. לדוגמה, אינטראקציה פיזית הטרוגנית של תאים תתרחש רק בממשק בין PDAC ו-SPS של הדפוסים. לכן, התבנית הריבועית בפינה השמאלית התחתונה של איור 2 מדגימה את היכולת לשלוט בארגון המרחבי של התבניות, שניתן להרחיב עוד יותר לשליטה באינטראקציה הספציפית בין תא לתא בהתבסס על מיקומי התאים בתוך דפוסים אלה. השוואה של תרבויות משותפות בדפוסים אלה תאפשר לחקור את ההשפעה הכוללת של תקשורת ישירה בניגוד לגורמים מסיסים ותקשורת לא ישירה, באמצעות איתות פרקריני, בדיוק רב יותר13. יתר על כן, פלטפורמה זו מאפשרת לחוקר לתכנן דפוסים לשליטה במספר האינטראקציות התאיות ההטרוגניות המחקות את השלבים השונים של צמיחת גידול GBM ומיקומים בתוך הגידול כדי לחקות בצורה אופטימלית תצפיות in vivo 14.

איור 2: PEMs עם דפוסים שונים מוכתמים בקרבוקסי-פלואורסצאין. PEMs מאפשרים לחוקר להתאים את תנאי פני השטח (כימיה, צורה וגודל) כדי לייעל את התרבית. סרגל קנה מידה 500 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור 3 מציג מונוקולטורות של תאי גליומה המחוברים באופן סלקטיבי לאזורי SPS במשטח PDAC/SPS המעוצב לאחר 24 שעות. התמונות המייצגות מדגימות את היכולת של A172 ו-U87 להיצמד באופן סלקטיבי לאזורים ספציפיים ולהשאיר מקום למילוי חוזר של אסטרוציטים. קו התאים U87MG משמש בדרך כלל למחקרי גליובלסטומה מכיוון שהוא קו תאי גליומה פולשני וגידולי מאוד. A172 נבחר גם למחקר זה כקו תאי גליובלסטומה פולשני ולא גידולי. למרות ההבדלים בקווי התאים הללו, נראה שהם מתנהגים באופן דומה כאשר הם מוכנסים על פני השטח המעוצב של PDAC/SPS, ומופצים מרחבית בהתאם לדפוס הזמין. זה מדגיש את הרבגוניות של פלטפורמה זו בחקר שלבים מגוונים של גליובלסטומה15. מכיוון שלתאי גליומה יש קצב התקשרות וגדילה מהיר יחסית בהשוואה לאסטרוציטים, החדרת אסטרוציטים לתרבית מתבצעת יום אחד לאחר זריעת הגליומה. זאת כדי למנוע צמיחת יתר של גליומה לאזורים המיועדים במיוחד לחיבור אסטרוציטים.
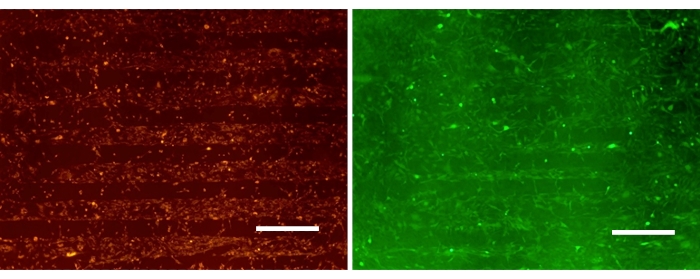
איור 3: מונו-תרביות גליומה מעוצבות מוכתמות בקרבוקסיפלואורסצאין (ירוק) ו-PKH26 (אדום) על משטחים בדוגמת PEM. סרגל קנה מידה: 500 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור 4 מייצג את התרבות המשותפת הבוגרת שנלקחה 4 ימים אחרי זריעת האסטרוציטים. אסטרוציטים נזרעים בצפיפות גבוהה כדי להבטיח חיבור מלא בחלל שאינו תפוס על ידי גליומה. לאחר הוספת אסטרוציטים, מותר לתרבית להתבגר 4 ימים לפני הניתוח. זמן ההתבגרות (יום 1-4 של תרבית משותפת) מאפשר לתאי הגליומה למלא את האזורים שאליהם הם נקשרים ולחנוק אסטרוציטים שאולי ניסו להיצמד לאזורים שבהם נוצרו תאי הגליומה. יתר על כן, תקופת ההתבגרות מאפשרת ביסוס אינטראקציה פיזית, כגון צמתים מרווחים, אשר בדרך כלל נראים כמתווכים אינטראקציה תאית של אסטרוציטים ותאי גליומה in vivo ו-in vitro 16,17,18.

איור 4: תמונות פלואורסצנטיות ביום הרביעי של תרבית משותפת. (A) אסטרוציטים שעברו תרבית משותפת עם תאי גליומה U87 ו-(B) אסטרוציטים שעברו תרבית משותפת עם תאי גליומה A172 ביום הרביעי של תרבית משותפת, מה שמדגים את היכולת הסלקטיבית של משטחי PEM אלה. סרגל קנה מידה: 500 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
צעדים קריטיים להבטחת הרכבה מוצלחת של קו-תרבית דפוסית הניתנת לשחזור כוללים: 1) דפוס מוצלח של פני השטח על ידי מיקרו-יציקה בנימים, 2) שטיפה מוצלחת של תאים מוכתמים, ו-3) ניתוח התרבות המשותפת בחלון "התרבית הבוגרת". ראשית, שכפול מוצלח של דפוסים עם מיקרו-יציקה בנימים הוא קריטי לשחזור האינטראקציה מכיוון שזה מה שמבדיל את התרבות המשותפת הדפוסית מתרבות משותפת אקראית. כדי להבטיח שחזור זה, חשוב שהמשתמש יפתח את מיומנות הדפוס באמצעות תרגול או ישיג מערכת אוטומטית שיכולה לשחזר דפוסים במדויק. יתר על כן, למרות שחותמות ה-PDMS ניתנות לשימוש חוזר, השינוי החוזר והשימוש בחותמת עלולים לשחוק את שלמות הדוגמה לאורך זמן. לכן, מומלץ לבדוק מעת לעת את תקינות הדפוס במיקרוסקופ או לדמיין דפוסים עם carboxyfluorescein. שנית, שטיפה מוצלחת של תאים מוכתמים ב-PKH26 ו-carboxyfluorescein היא חיונית להתמיינות סוגי התאים בעת קביעת השיטה לראשונה ומעקב אחר סוגי התאים השונים. יתר על כן, צביעה צולבת עקב שטיפה לא מוצלחת עלולה לעכב את היכולת העתידית להפריד תאים מהתרבות המשותפת באמצעות ציטומטריית זרימה. פרוטוקול זה כולל שלבי שטיפה המותאמים לציוד ציטומטריית הזרימה ויצירה מוצלחת של התרבות המשותפת; עם זאת, ייתכן שיהיה צורך להגדיל את מספר שלבי הכביסה אם המשתמש מוצא באופן עקבי הצלבת כתמים במהלך תרבית משותפת. לבסוף, חלון הזמן לניתוח תרבית בוגרת מוגבל מכיוון שתאי הגליומה בסופו של דבר ימלאו את התבנית ויתחילו לפלוש לאזורים עשירים באסטרוציטים של התבנית. לכן, מומלץ לנתח את התרבות המשותפת במרווחי זמן עקביים כדי להבטיח שחזור של התוצאות.
בעיות פוטנציאליות שמשתמשים עלולים להיתקל בהן כוללות בעיות ברוויה של CFSE. אם התמונות רוויות בקרינה, צמצם את זמן צביעת הדפוס מ-60-90 דקות ל-30-60 דקות. אם הבעיה נמשכת, הפחת את ריכוז הכתם ל-0.075 מיקרומטר ב-0.1 M NaOH. לחלופין, אם התמונות אינן מראות פלואורסצנטיות, ודא תחילה שהגדרות המיקרוסקופ והמנסרה מתאימות לאורכי גל עירור ופליטה של 492 ננומטר ו-517 ננומטר, בהתאמה (כלומר, מסנן כחול הפרעות (IB)) ובדוק טווח של זמני חשיפה מ-100 אלפיות השנייה עד 10,000 אלפיות השנייה. אם עדיין אין פלואורסצנטיות, הגדל את זמן צביעת הדפוס מ-60-90 דקות ל-90-120 דקות. אם הבעיה נמשכת, הגדל את ריכוז הכתם ל-0.15 מיקרומטר ב-0.1 M NaOH. בעיות נוספות שמשתמשים עלולים להיתקל בהן עם דפוסים חזותיים של CFSE הן קצוות מטושטשים או מטושטשים במקום גיאומטריות חדות רצויות, מה שיכול להיות סימן לחותמות PDMS בשימוש יתר. במקרה זה, צור חותמות PDMS חדשות באמצעות פרוסות מאסטר הסיליקון. תמונות מטושטשות או מטושטשות יכולות להיות גם סימן לתמיסת צביעת CFSE מזוהמת, ובמקרה זה, הכינו תמיסת צביעה חדשה של CFSE.
למערכת זו יש מגבלות מובנות מסוימות. ראשית, זוהי מונוקולטורה דו-ממדית שלמרות שהיא שימושית למחקרים ראשוניים בעלי תפוקה גבוהה 6,7,8 וניתנת להשוואה למודלים הקיימים כיום של אינטראקציה נופלת מהחיקוי האידיאלי של רקמת ה-in vivo התלת מימדית19. יתר על כן, אינטראקציה פיזית מותאמת במודל קו-תרבית זה, אך אינטראקציה באמצעות גורמים מסיסים אינה מתבטלת לחלוטין בשל האופי הסטטי של מערכת זו. המדיה הסטטית יכולה להוות יתרון מכיוון שניתוח של גורמים מסיסים המשתחררים עשוי להיות תובנה להבנת התגובה התאית20. הבנת האינטראקציה הפיזית גרידא דורשת אינטראקציה ממוזערת באמצעות גורמים מסיסים, שניתן להשיג באמצעות החלפת מדיה תכופה ושמירה על נפח מדיה גדול להפצת גורמים.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
עבודה זו נתמכה, כולה או חלקה, על ידי מענקי NIH 1R01AA027189-01A1 (ל-S.K.), P20 GM104320 (למענק פיילוט של מרכז נברסקה למניעת מחלות השמנת יתר ל-S.K.), P20 GM113126 (למרכז נברסקה לתקשורת ביו-מולקולרית משולבת - מוביל פרויקט S.K.); מענק זרעים ביו-רפואיים של משרד המחקר והפיתוח של UNL ומענק יוזמת המחקר של נברסקה (ל-S.K.). ק.מ.ס. מומן באמצעות T32GM107001, מענק הכשרה.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Fisher Scientific | 25200056 | |
| 15 ml Nunc Conical Sterile Polypropylene Centrifuge Tubes | Fisher Scientific | 12-565-268 | |
| 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester | Millipore Sigma | Cat#21888 | |
| 50 ml Nunc Conical Sterile Polypropylene Centrifuge Tubes | Fisher Scientific | 12-565-270 | |
| A172-MG GBM cell line | ATCC | CRL-1620 | |
| Bright-Line Hemacytometer | Sigma | Z359629 | Or other suitable cell counting device |
| Cell Incubator | N/A | N/A | |
| Cooled tabletop centrifuge for 15 mL tubes | N/A | N/A | |
| Dulbecco's Modified Eagle Medium (DMEM) | MP Biomedicals | ICN 1033120 | |
| Expanded Plasma Cleaner | Plasma Harrick | PDC-001-HP | With attached pressurized oxygen tank and PlasmaFlo Gas Mixer (PDC-FMG) accessory |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11550H | |
| Fluorosilane | Sigma Aldrich | 667420 | Full chemical name: 1H,1H,2H,2H-Perfluorooctyltriethoxysilane |
| Inverted Tabletop Microscope | N/A | N/A | Microscope capable of fluorescent imaging with λex = 551 nm; λem 567 nm [e.g. Rhodamine filter] (PKH26 dye) and λex 492 nm; λem 517 nm [e.g. interference blue filter (IB)] (CFSE dye) |
| NaCl | Sigma Aldrich | S7653 | |
| NaOH | Sigma Aldrich | 567530 | |
| Penicillin-Streptomicen | Fisher Scientific | 15140122 | |
| PKH26 Red Fluorescent Cell Linker Mini Kit | Millipore Sigma | Cat#MINI26-1KT | |
| Poly(diallyldimethylammonium chloride) solution (PDAC) | Sigma Aldrich | 409014 | 20 wt. % in H2O |
| Poly(sodium 4-styrenesulfonate) (SPS) | Sigma Aldrich | 243051 | average MW ~70,000 |
| Primary Astrocytes, isolated from Srague Dawley rats | Charles River | Crl:SD | Rats from Charles River; Lab isolated Cells |
| Scalpel | N/A | N/A | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sylgard 184 Silicone Elastomer Kit | Dow Chemical | Cat#2646340 | |
| Trypan Blue Stain | Fisher Scientific | 15-250-061 | |
| TryplE | Fisher Scientific | Gibco TrypLE | |
| U87-MG GBM cell line | ATCC | HTB-14 | |
| Vacuum Desiccator | N/A | N/A |
References
- Ostrom, Q. T., et al. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the United States in 2012-2016. Neuro Oncology. 21, 1 (2019).
- Ostrom, Q. T., et al. CBTRUS statistical report: Primary brain and other central nervous system tumors diagnosed in the United States in 2010-2014. Neuro Oncology. 19, 1-88 (2017).
- Roos, A., Ding, Z., Loftus, J. C., Tran, N. L. Molecular and microenvironmental determinants of glioma stem-like cell survival and invasion. Frontiers in Oncology. 7, 120 (2017).
- Rath, B. H., Fair, J. M., Jamal, M., Camphausen, K., Tofilon, P. J. Astrocytes enhance the invasion potential of glioblastoma stem-like cells. PLoS One. 8 (1), 54752 (2013).
- Le, D. M., et al. Exploitation of astrocytes by glioma cells to facilitate invasiveness: a mechanism involving matrix metalloproteinase-2 and the urokinase-type plasminogen activator-plasmin cascade. The Journal of Neuroscience. 23 (10), 4034-4043 (2003).
- Daverey, A., Brown, K. M., Kidambi, S. Breast cancer/stromal cells coculture on polyelectrolyte films emulates tumor stages and miRNA profiles of clinical samples. Langmuir. 31 (36), 9991-10001 (2015).
- Kidambi, S., Lee, I., Chan, C. Primary neuron/astrocyte co-culture on polyelectrolyte multilayer films: A template for studying astrocyte-mediated oxidative stress in neurons. Advanced Functional Materials. 18 (2), 294-301 (2008).
- Kidambi, S., et al. Patterned co-culture of primary hepatocytes and fibroblasts using polyelectrolyte multilayer templates. Macromolecular Bioscience. 7 (3), 344-353 (2007).
- Kidambi, S., Lee, I., Chan, C. Controlling primary hepatocyte adhesion and spreading on protein-free polyelectrolyte multilayer films. Journal of the American Chemical Society. 126 (50), 16286-16287 (2004).
- Mohammed, J. S., DeCoster, M. A., McShane, M. J. Micropatterning of nanoengineered surfaces to study neuronal cell attachment in vitro. Biomacromolecules. 5 (5), 1745-1755 (2004).
- Beaudoin, G. M., et al. Culturing pyramidal neurons from the early postnatal mouse hippocampus and cortex. Nature Protocols. 7 (9), 1741-1754 (2012).
- Wilson, C. L., Hayward, S. L., Kidambi, S. Astrogliosis in a dish: substrate stiffness induces astrogliosis in primary rat astrocytes. Rsc Advances. 6 (41), 34447-34457 (2016).
- Bogdanowicz, D. R., Lu, H. H. Studying cell-cell communication in co-culture. Biotechnololgy Journal. 8 (4), 395-396 (2013).
- Chen, W., et al. Glioma cells escaped from cytotoxicity of temozolomide and vincristine by communicating with human astrocytes. Medical Oncology. 32 (3), 43 (2015).
- Belot, N., et al. Molecular characterization of cell substratum attachments in human glial tumors relates to prognostic features. Glia. 36 (3), 375-390 (2001).
- Sin, W. C., et al. Astrocytes promote glioma invasion via the gap junction protein connexin43. Oncogene. 35 (12), 1504-1516 (2016).
- Sin, W. C., Crespin, S., Mesnil, M. Opposing roles of connexin43 in glioma progression. Biochimica et Biophysica Acta. 1818 (8), 2058-2067 (2012).
- Oliveira, R., et al. Contribution of gap junctional communication between tumor cells and astroglia to the invasion of the brain parenchyma by human glioblastomas. BMC Cell Biology. 6 (1), 7 (2005).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology (Bethesda). 32 (4), 266-277 (2017).
- Rape, A., Ananthanarayanan, B., Kumar, S. Engineering strategies to mimic the glioblastoma microenvironment). Advanced Drug Delivery Reviews. 79-80, 172-183 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved