Method Article
זיהוי וסיווג של גרסאות missense של תת-יחידה לקולטן GABAA ספציפיות לתפקידן בנוירונים פירמידליים בהיפוקמפוס
In This Article
Summary
מחקר זה מציג מסגרת רב-ממדית, המשתרעת מ-DNA לתפקוד חלבון והתנהגות עצבית. הוא מציג גישה חדשה לחקירת מוטציות פתוגניות חזויות בתת-היחידה של קולטן GABAA , ומשער כי מוטציות אפילפטוגניות ומוטציות פרוקסימליות, הצפויות כפתולוגיות, עשויות לייצר השפעות דומות על מודל הנוירונים הפירמידליים CA1.
Abstract
הבנת ההשפעות של וריאנטים לא ידועים מבחינה תפקודית בגנים הקשורים לאפילפסיה היא חיונית להבהרת פתופיזיולוגיה של מחלה ולפיתוח טיפולים מותאמים אישית. עם מסגרת רב-ממדית, המשתרעת מרצף DNA לתפקוד חלבון והתנהגות עצבית, אנו מתארים גישה חדשה לחיזוי וחקירת מוטציות פתוגניות, תוך השערה כי מוטציות אפילפטוגניות בתת-יחידת הקולטן GABAA ומוטציות חזויות סמוכות עשויות לייצר השפעות דומות על מודל הנוירונים הפירמידלי CA1. על ידי בחינת הקשרים האופייניים בין מוטציות פתוגניות חזויות למוטציות אפילפטוגניות פרוקסימליות, המחקר נועד להעריך את ההשפעות של מוטציות חזויות על סמך ההשפעות של מוטציות אפילפטוגניות על סימולציות נוירונים פירמידליים בהיפוקמפוס.
המתודולוגיה מתחילה באיסוף נתונים גנטיים של תת-יחידה γ2 של קולטן GABAA , ולאחר מכן ניקוי ועיצוב נתונים המבוצעים ב-R באמצעות סקריפט מותאם אישית. לאחר מכן, יוחלו מנבאים אנסמבל כדי לזהות ולתעדף את גרסאות הטעות הפתוגניות של תת-היחידה γ2 . יומחש מיפוי וריאנט פתוגני ספציפי (חזוי) לתחומים המבניים של תת-היחידה המשותפים למוטציות אפילפטוגניות, מלווה במודלים מולקולאריים של השפעותיהם והתחשבות בשימור אבולוציוני. לאחר מכן, יבוצעו מטא-אנליזה ספציפית לוריאנט ונורמליזציה של פרמטרים, ואחריה ניתוח מתאם כדי לזהות קשרים משמעותיים בין מוטציות חזויות למוטציות אפילפטוגניות פרוקסימליות. באמצעות סימולטור עצבי מבוסס Python, יתואר מודל נוירונים מבוסס מוליכות רב-תאיתית, המשקף את ההשפעה של מוטציות מסוג פרא ואפילפטוגני. סימולציה של תגובות עצביות שנוצרו על ידי תת-סוג קולטן GABAA אפילפטוגני תישקל לצורך הערכה גסה של ההשפעה החזויה של הווריאנטים הפתוגניים על התגובה העצבית. למיטב ידיעתנו, זהו הפרוטוקול הראשון החוקר מסגרת רב-ממדית להערכת ההשפעות של וריאנטים של קולטני GABAA על התנהגות עצבית, חיונית לחקר אפילפסיה. פרוטוקול זה יכול לשמש בסיס לשיפור התחזיות של פנוטיפים תאיים הנגרמים על ידי גרסאות פתוגניות פוטנציאליות של קולטני GABAA הקשורים לאפילפסיה.
Introduction
כמעט בכל המחלות האנושיות, השונות הגנטית ממלאת תפקיד משמעותי ברגישות האינדיבידואלית. לכן, הבנת האופן שבו וריאציות רצף קשורות לסיכון למחלה מציעה דרך רבת ערך לחשוף תהליכים מרכזיים המעורבים בהתפתחות מחלות ולזהות גישות חדשות למניעה וטיפול1. זה חל גם על הפרעות נוירו-התפתחותיות, המדורגות בין המצבים הרפואיים הכרוניים השכיחים ביותר בטיפול ראשוני בילדים2. מצבים כגון הפרעת הספקטרום האוטיסטי, מוגבלות שכלית ואפילפסיה ממחישים כיצד שונות גנטית משפיעה באופן משמעותי על רגישות הפרט במהלך ההתפתחות3.
המוח המתפתח רגיש יותר להתקפים אפילפטיים מאשר המוח הבוגר בשל חוסר התאמה נוירו-התפתחותית מתוכנתת גנטית באיזון הקריטי בין עירור לעיכוב4. מכיוון ש-GABA (חומצה גמא-אמינובוטירית), המוליך העצבי המעכב העיקרי במוח הבוגר, מעורר במהלך ההתפתחות העוברית והמוקדמת לאחר הלידה, זה לא חיובי ליציבות הדרושה למניעת התקפים במוח צעיר. מצב זמני זה, הנגרם על ידי היעדר ביטוי מספיק של K-Cl co-transporters5, יכול לתרום לסיכון מוגבר לפעילות התקפים בנוכחות קולטני GABAA לא מתפקדים. קולטני GABAA מתווכים פעולות מעוררות ומעכבות של GABA, בהתאם לריכוז התוך תאי של Cl-ion 6. לפיכך, ככל שהמוח מתבגר, מוטציות בגנים המקודדים לקולטן GABAA , כמו גם בתעלות יונים אחרות, מעוותות את הריגוש ומוטציות בגנים המעורבים במטבוליזם עצבי, איתות תאים ויצירת סינפסות7, עלולות לגרום למצבים כמו אפילפסיה של היעדר ילדות8.
התערבויות קליניות ממנפות יותר ויותר ניתוח גנטי כדי לשפר את הדיוק בטיפול בהפרעות נוירו-התפתחותיות2. בדיקות גנטיות באפילפסיה של ילדים מציגות יעדים פוטנציאליים לגישות רפואה מדויקת9, ומדגישות את החשיבות של וריאנטים גנטיים בהנחיית החלטות טיפוליות. בנוסף, ~25% מחולי האפילפסיה עם מוטציות דה נובו מקבלים אבחונים גנטיים המזהים מטרות פוטנציאליות לרפואה מדויקת, מה שמדגיש את הערך המשמעותי של וריאנטים גנטיים בהנחיית החלטות טיפוליות10. זה ניזון על ידי התקדמות בטכנולוגיות ריצוף של הדור הבא, כגון לוחות גנים ממוקדים, ריצוף אקסום שלם וריצוף גנום שלם, שהאיצו באופן דרמטי את התגליות הגנטיות11. עם זאת, המספר ההולך וגדל של תגליות גנים חדשים מגיע עם אתגר כאשר התוצאות מניבות וריאנט בעל משמעות לא ידועה (VUS), סיווג המשקף ראיות סותרות או מידע לא מספיק לגבי התפקיד המולקולרי של הווריאנט בפתוגנזה של המחלה. וריאנטים המסווגים כ-VUS תואמים לקטגוריה אחת בתוך מערכת סיווג הווריאנטים בת חמש השכבות המוצעת על ידי הקולג' האמריקאי לגנטיקה רפואית וגנומיקה (ACMG) והאגודה לפתולוגיה מולקולרית (AMP)12.
התמודדות עם האתגר של וריאנטים גנטיים לא ידועים מבחינה תפקודית דורשת מאמצים בשני ממדים מרכזיים: פרקטיקה קלינית ומחקר. מבחינה קלינית, חוסר הוודאות סביב VUS יכול לסבך את ניהול המטופלים וקבלת ההחלטות13. מנקודת מבט של מחקר מדעי, זיהוי וריאנטים פתוגניים בין המספר ההולך וגדל של וריאנטים בעלי משמעות לא ודאית וקביעת תפקידיהם בפתופיזיולוגיה של מחלות והשפעות פנוטיפיות הם קריטיים1. תרחיש אידיאלי אחד יהיה כרוך בחיזוי מדויק של ההשפעות המולקולריות, העצביות וברמת הרשת של כל הווריאנטים הלא מאופיינים מבחינה תפקודית, ובכך למזער את המשאבים, הזמן והמאמץ הנדרשים לחקירות מבוססות מעבדה. היבטים אלה מדגישים את החשיבות של סיווג מדויק של וריאנטים גנטיים כדי לאפשר אבחון מדויק של אפילפסיה גנטית, לתמוך בטיפול מותאם אישית ולהקל על גילוי מטרות פרמקולוגיות פוטנציאליות. כלי החיזוי הנוכחיים 14,15,16,17 מדויקים יחסית אך בדרך כלל מספקים רק סיווגים בינאריים (פתוגניים לעומת שפירים) וחסרים תובנות ספציפיות למחלה לגבי פתופיזיולוגיה מולקולרית, השלכות פנוטיפיות ומנגנונים בסיסיים. תוך התמקדות בגרסאות השגויות הלא ידועות של גנים נבחרים המקודדים לקולטן GABAA, מאמר זה מציג מסגרת שמטרתה לשפר את הנחיית המחקר על ידי שילוב גורמים הקשריים של וריאנטים כגון היבטים מולקולריים, אבולוציוניים ומבניים, כמו גם סימולציות של פתולוגיה עצבית הנגזרת מנתונים ביופיזיים במבחנה של מוטציות הקשורות לאפילפסיה. המתודולוגיה שלנו מתייחסת לזיהוי וריאנטים פתוגניים לא ידועים של תת-היחידה γ2 של קולטן GABAA, תת-יחידה מרכזית המעורבת בפתופיזיולוגיה של אפילפסיה 18,19,20. לאחר מכן נבדק ההתאמה הספציפית למיקום של הגרסאות החזויות הללו עם המוטציות הקשורות לאפילפסיה המאופיינות בנתונים מבניים ואלקטרופיזיולוגיים. נתונים אלה משמשים לאחר מכן להערכת ההשפעה המשתנה על מודל של נוירון פירמידלי בהיפוקמפוס המבטא תת-סוג של קולטן GABAA, המורכב מתת-יחידות γ2, α1 ו-β3 (קולטני γ2-GABAA), האחראים לעיכוב סינפטי מהיר6. חשוב לציין כי קולטני GABAA מורכבים ממאגר תת-יחידות גדול (α1-α6, β1-β3, γ1-γ3, δ, Ε, θ, π ו-ρ1-ρ3) ובהתאם להרכב תת-היחידה, קולטני GABAA נבדלים זה מזה באפנון, במאפיינים הביופיזיים שלהם, כמו גם בדפוסי ביטוי אזוריים, תאיים ותת-תאיים יחד עם פונקציות ספציפיות 6,21,22,23, 24,25. לפיכך, המחקר הנוכחי מתמקד בקולטני γ2-GABAA או בקולטני GABAA המכילים γ2 בלבד.
תת-יחידות קולטן GABAA מורכבות ממאפיינים מבניים אופייניים - תחום חוץ-תאי ארוך N-terminal (ECD), ארבעה תחומים טרנסממברניים (TM1 עד TM4), מקשר תוך-תאי המחבר את TM1 ו-TM2, מקשר חוץ-תאי המחבר את TM2 ו-TM3, לולאה תוך-תאית גדולה בין TM3 ל-TM4 (לולאת TM3-TM4), ומסוף C חוץ-תאי קצר 6,26, 27. מוצע כי קולטן GABAA פועל באמצעות מנגנון "נעילה ומשיכה" מורכב, שבו קשירת GABA נועלת את תת-היחידות β ו-α, וגורמת להן למשוך את התחומים החוץ-תאיים (ECDs) של יחידות המשנה, ולסובב אותן נגד כיוון השעון27. תנועה זו מכופפת את התחומים הטרנסממברניים (TMDs), ובכך פותחת את תעלת היונים27. לפיכך, נראה כי פעילות הערוץ מתואמת יחד עם קלטות מבניות בתוך קולטני GABAA. מתברר שמוטציות אפילפסיה גורמות לתפקוד לקוי בפעילות הערוץ באמצעות עיוות של קלטות מבניות אלה28. כתוצאה מכך, המחקר שלנו מבוסס על הרעיון כי וריאנטים פתוגניים חזויים בסמיכות למוטציות אפילפטוגניות שזוהו תפקודית בקלטות המבניות הספציפיות של תת-יחידות הקולטן GABAA עשויות להציג דפוסים דומים של עיוות אלקטרופיזיולוגי או ביופיזי בתפקוד הערוץ, כפי שנצפה במקרים של מוטציות אפילפטוגניות אלה. בעוד שנוכחותן של קלטות מבניות אפילפטוגניות ביחידות המשנה של קולטן GABAA 28 תומכת בעקיפין ברעיון זה, המחקר שלנו מדגים את המורכבות והאתגר של מתאם בין פרמטרים ביופיזיים של מוטציות אפילפטוגניות לאלו של מוטציות פתוגניות חזויות. כדי לחשוף את הקשרים המורכבים הללו, המסגרת שלנו משמעותית מכיוון שהיא מדגישה גישה רב-ממדית הנעה בין DNA לתפקוד חלבון והתנהגות עצבית קריטית לחקר אפילפסיה. גישה זו משלבת גנטיקה חישובית עם מודלים מולקולריים וסימולציות עצביות תוך הדגשת החשיבות של שיטות משלימות, כגון למידת מכונה המאומנת על מערכי נתונים גדולים, שיכולות ללכוד את ההשפעות של מוטציות על מבנה הערוץ, הפעילות והריגוש העצבי. בנוסף, סימולציה של פעילות קולטן γ2-GABAA אפילפטוגני במודל הנוירונים הפירמידליים של ההיפוקמפוס מאפשרת שכפול של פנוטיפ תאי במבחנה הקשור לתעלות קולטן GABAA והדגמה של תגובות נוירון בודד משתנות במרכז תפקוד לקוי של הרשת.
Protocol
1. חיזוי בסיליקו של וריאנטים פתוגניים
- איסוף נתונים של וריאנטים
- באמצעות מסד הנתונים ClinVar29, חפש וריאנטים בעלי משמעות לא ודאית (VUS) באזור המקודד של הגן המעניין באמצעות האתר: https://www.ncbi.nlm.nih.gov/clinvar/. הזן את סמל הגן (למשל, GABRG2) בשורת החיפוש וסנן את התוצאות כך שיכללו רק את סוגי הגרסאות הרצויות, כגון גרסאות חד-נוקלאוטידיות, גרסאות מיסנסנס עם משמעות לא ודאית. הורד ושמור את הנתונים כ- data.xlxs (קובץ משלים 4: טבלה משלימה S1). רשום את תאריך הנתונים שהורדת.
הערה: בפרוטוקול הנוכחי, תת-יחידת γ2 אנושית של קולטן GABAA , במיוחד תת-יחידה של קולטן חומצה גמא-אמינו-בוטירית מסוג A של הומו ספיינס גמא-אמינובוטירית מסוג GABRG2 (GABRG2), וריאנט תעתיק 1, mRNA (NCBI Ref. seq.: NM_198904.4), הידוע גם בשם γ2L, ינותח. חשוב לתעד את תעתיק הייחוס של הגן המעניין כמו גם מזהים מתאימים אחרים על פני מסדי נתונים שונים (UniProt, ENSEMBL, PDB) מכיוון ששיטות חישוביות שונות עשויות לדרוש מזהים שונים (קובץ משלים 4: טבלה משלימה S2). במקרה שמסד הנתונים או הכלי החישובי אינם מזהים את מספרי הגרסה של מזהי הרצף, נסה גם את המזהה עם מספר הגרסה (NM_198904.4) וגם ללא מספר הגרסה (NM_198904). - מידע בסיסי על חלבון התייחסות
- במסד הנתונים של NCBI https://www.ncbi.nlm.nih.gov/, בחר Nucleotide באפשרויות החיפוש והזן את מזהה NCBI Ref. seq. של הגן המעניין (NM_198904.4). לאחר מכן, על ידי גלילה מטה בעמודה הימנית, לחץ על החלבון תחת הקטגוריה מידע קשור כדי למצוא את החלבון (NP_944494.1) המקודד על ידי התעתיק NM_198904.4. באמצעות המידע שניתן עבור החלבון NP_944494.1, רשום את מיקומי הרצף של האזורים הספציפיים בצורה של טבלה (קובץ משלים 4: טבלה משלימה S3).
הערה: חשוב לקבוע את המידע הידוע הראשוני עבור מיקום הרצף של אזורים, מוטיבים או שאריות קריטיים מבחינה תפקודית ומבנית כגון תחומי חלבון, אתרי זרחון, אתרי קשירת ליגנד וממשקי אינטראקציה מולקולרית. ניתן להשיג זאת על ידי שילוב של מסדי נתונים (NCBI, ENSEMBL, UniProt...) וחיפושי ספרות.
- במסד הנתונים של NCBI https://www.ncbi.nlm.nih.gov/, בחר Nucleotide באפשרויות החיפוש והזן את מזהה NCBI Ref. seq. של הגן המעניין (NM_198904.4). לאחר מכן, על ידי גלילה מטה בעמודה הימנית, לחץ על החלבון תחת הקטגוריה מידע קשור כדי למצוא את החלבון (NP_944494.1) המקודד על ידי התעתיק NM_198904.4. באמצעות המידע שניתן עבור החלבון NP_944494.1, רשום את מיקומי הרצף של האזורים הספציפיים בצורה של טבלה (קובץ משלים 4: טבלה משלימה S3).
- באמצעות מסד הנתונים ClinVar29, חפש וריאנטים בעלי משמעות לא ודאית (VUS) באזור המקודד של הגן המעניין באמצעות האתר: https://www.ncbi.nlm.nih.gov/clinvar/. הזן את סמל הגן (למשל, GABRG2) בשורת החיפוש וסנן את התוצאות כך שיכללו רק את סוגי הגרסאות הרצויות, כגון גרסאות חד-נוקלאוטידיות, גרסאות מיסנסנס עם משמעות לא ודאית. הורד ושמור את הנתונים כ- data.xlxs (קובץ משלים 4: טבלה משלימה S1). רשום את תאריך הנתונים שהורדת.
- ארגון נתונים משתנה
- ארגן את הנתונים כך שיעמדו בדרישות הקלט עבור המנבאים שנבחרו. ודא שפורמט הנתונים שאוחזרו מאורגן כך שיתאים לדרישות של http://database.liulab.science/dbNSFP שרת dbNSFP. לשם כך, הסר עמודות מיותרות מקובץ data.xlsx (קובץ משלים 4: טבלה משלימה S1 משלב 1.1.1), תוך שמירה על העמודות הבאות בלבד בסדר שצוין:
"GRCh38Chromosome", "GRCh38Location", "Name", "Protein change". - שמור את הקובץ בשם קובץ חדש: "data1.xlsx" (טבלה משלימה S4). פרמט את קובץ data1.xlsx ב-R על-ידי הפעלת הקוד (קובץ משלים 1: Data_GABAA. R), אשר ישמור את הנתונים המעוצבים data1_output.xlsx (קובץ משלים 4: טבלה משלימה S5) בספריית העבודה הרלוונטית לפרויקט R.
הערה: שיטות חישוביות שונות דורשות סוגי נתונים ופורמטים שונים. איסוף וארגון נתונים על פי דרישות פורמט ספציפיות, אפילו עבור תריסר גרסאות, עלול להיות מועד לשגיאות ולגזול זמן, ולכן שלב זה חשוב אלא אם כן מאגר הגרסאות מורכב מכמה גרסאות בלבד. לאחר מכן, ייתכן שארגון נתונים ידני יהיה אפשרי.
- ארגן את הנתונים כך שיעמדו בדרישות הקלט עבור המנבאים שנבחרו. ודא שפורמט הנתונים שאוחזרו מאורגן כך שיתאים לדרישות של http://database.liulab.science/dbNSFP שרת dbNSFP. לשם כך, הסר עמודות מיותרות מקובץ data.xlsx (קובץ משלים 4: טבלה משלימה S1 משלב 1.1.1), תוך שמירה על העמודות הבאות בלבד בסדר שצוין:
- חיזוי פתוגניות
- העבר את התוכן של קובץ data1_output.xlsx לגרסה האקדמית של שרת dbNSFP30,31 אליו ניתן לגשת באמצעות http://database.liulab.science/dbNSFP. לשם כך, העתק/הדבק או העלה ישירות את הקובץ בפורמט .txt.
- ודא שהאפשרויות הבאות נבחרו מראש ואושרו בשרת: HG38 (בניית גנום), ClinPred32 ו-BayesDEL33 לפני ההגשה. תוך מספר דקות, השרת יפיק את התוצאות.
הערה: בפרוטוקול הנוכחי, נבחרו שני מנבאי אנסמבל, כלומר BayesDEL33 ו-ClinPred32, עבור דיוק גבוה34 ופרקטיות. עם זאת, ניתן לבחור גם מנבאים אחרים, כגון AlphaMissense, הזמין במסד הנתונים dbNSFP30,31. הבחירה בכלים בסיליקו תלויה במספר גורמים, כולל יצירת מספיק קווים מרובים של ראיות חישוביות לחיזוי רב עוצמה12. מנבאים אנסמבל המשלבים ניתוח של אלגוריתמי חיזוי מרובים יכולים לשרת מטרה זו. - הורד את קובץ הפלט (תבנית .txt) ושמור אותו בשם data2.xlsx (קובץ משלים 4: טבלה משלימה S6).
- הגדר את המסננים ב-data2.xlsx (קובץ משלים 4: טבלה משלימה S6) על ידי לחיצה על אפשרות הסינון בתפריט וקביעת גרסאות הקונצנזוס בשתי העמודות על ידי סינון עבור D. זה ייתן את רשימת הגרסאות הפתוגניות ביותר; שמור אותו (ראה לשונית קונצנזוס בטבלה משלימה S6 [קובץ משלים 4]).
- בחירת גרסאות
- בין התחזיות הפתוגניות הקונצנזוס, קבע את הגרסאות בסמיכות למוטציות אפילפטוגניות שהתקבלו מהספרות. ודא שלאחרונים יש פרמטרים מבניים וביופיזיים המתאימים למידול נוירונים.
הערה: שלב זה הוא גישוש וקשור גם לסקירת החלבון המעניין מבחינת הפרמטרים המבניים, הפיזיקוכימיים והביופיזיקליים שלו. במחקר הנוכחי, נתונים אלה התקבלו מ-Brünger et al.35 ו-Guo et al.36 בנוסף לסקר של מוטציות הקשורות לאפילפסיה. חוץ מזה, כאופציה, ניגשו לציונים של AlphaMissense37 ממסד הנתונים dbNSFP30,31 החוזר על שלב 1.3 (קובץ משלים 4: טבלה משלימה S7). פרטים נוספים ניתנים בסעיפי הפרוטוקול 2.1.1 ו-2.1.2 ובתוצאות (ראה "אשכולות וריאנטים לפרמטרים מבניים וביופיזיים"). - להדמיה בסיסית, השתמש בשרתי Protter38 (https://wlab.ethz.ch/protter/start/) ו-HOPE39 (https://www3.cmbi.umcn.nl/hope/) כדי לבחון את הגרסאות בשלב הקודם בהקשר של מוטציות נבחרות בגן GABRG2 : P302L40 ו-K328M (או K289M41, כאשר לא כוללים את פפטיד האות של 39 שאריות).
הערה: בשל המורכבות העצומה, יש לבצע הערכה מבנית של השפעות הווריאנטים ברמות ניתוח מרובות. כלים כמו Protter38 יאפשרו הדמיה ברורה של הגרסאות בהקשר של תכונות טופולוגיות של החלבון ושרתים ידידותיים למשתמש כמו HOPE39 יתנו תובנה לגבי השפעת הווריאנט על ידי מודלים מולקולריים. בנוסף, סקירת ספרות מקיפה של החלבון המעניין היא קריטית לזיהוי ושילוב המידע על מוטציות הקשורות לאפילפסיה. - ניתוח שימור אבולוציוני ותובנות מבניות
- פתח את Jalview 42,43,44, תוכנית קוד פתוח לעריכה, הדמיה וניתוח של חלבונים.
- ייבוא רצפים ליישור. לחץ על קובץ בתפריט העליון | אחזור רצפים; בחר את מסד הנתונים בתיבת הדו-שיח (כגון UniProt); לחץ על הכרטיסייה אחזור מזהים; וכפי שמתואר בתיבת הדו-שיח, הזן מזהי הצטרפות UniProt של הגן המעניין (GABRG2) מבני אדם ומינים אחרים של בעלי חוליות: P18507, P22723, Q6PW52, A0A2I3TKX0, F1RR72, A0A8I3MDZ2, A0A8M1P4D6. לחץ על OK.
הערה: מספרי ההצטרפות של UniProt של חלבונים המקודדים על ידי GABRG2 הם כדלקמן: P18507 (P18507-2) עבור הומו ספיינס, P22723 עבור Mus musculus, A0A2I3TKX0 עבור Pan troglodytes, F1RR72 עבור Sus scrofa, A0A8I3MDZ2 עבור Canis familiaris ו-A0A8M1P4D6 עבור Danio rerio. - בהתאם לגן המבוקש, ייתכן שחלק מהרצפים לא יהיו מוערים; לכן, בצע חיפוש BLAST כדי לזהות מידע רלוונטי והומולוגים פוטנציאליים להבנה הקשרית טובה יותר. במקרה זה, העלה את פורמט FASTA של רצפי חלבונים באמצעות הוסף רצפים / מאפשרות תיבת הטקסט מתחת ל שלח תפריט כדי לייצר יישורי רצף מרובים של הרצפים הרצויים.
- לאחר טעינת היישור, שים לב לרצפים המוצגים להשוואת רצפים מרובים. כל שורה מייצגת רצף וכל עמודה מייצגת מיקום ביישור. כדי לקבוע את שיטת היישור הטובה ביותר, השתמש בגישות שונות; לדוגמה, לחץ על שירותי האינטרנט בתפריט רצף ובחר באפשרות הפעל T-Coffee עם הגדרה מוגדרת מראש , המאפשרת יישור אופטימלי.
- לחץ לחיצה ימנית על הרצף P18507 Homo sapiens (רצף הייחוס במחקר הנוכחי) והגדר אותו כרצף הייחוס. בחר פורמט בתפריט העליון ולחץ על גלישה להדמיה של היישור המלא במסך. באותו תפריט פורמט, לחץ על הסולם למעלה כדי לשפר את ההדמיה של מספרי שאריות ספציפיים. כדי לשפר עוד יותר את ההדמיה, התאם את ערכות הצבעים על ידי מעבר לצבע ובחירת אפשרויות שונות (למשל, צבע קלוסטלי, תכונה כימית); שנה את גודל הגופן במידת הצורך.
- לחץ על חשב בשורת התפריטים ובחר חישוב אוטומטי של קונצנזוס כדי להדגיש אזורים שמורים.
- התמקדו במיקום של וריאנטים מעניינים שזוהו בשלב החיזוי בסיליקו ובחנו מיקומי וריאנטים ספציפיים. הוסף ביאורים לשאריות ספציפיות על-ידי לחיצה ימנית עליהן ובחירה באפשרות הוסף ביאור. כתוב את התווית (למשל, מזהה גרסה) עם קוד הצבע המתאים ושמור.
הערה: בניתוח הנוכחי, P302L (סגול) ו-A303T (אדום) נבחרו כדי לדמיין אותם ביישור הרצפים המרובים יחד עם הנתונים המבניים (ראה סעיף הבא).
- שחזור תלת מימדי של החלבון המלא המציג את השאריות השמורות שנבחרו
- בקובץ שהתקבל מהשלב הקודם, לחץ לחיצה ימנית על רצף ההתייחסות (GABRG2 human) ובחר נתוני מבנה תלת מימדיים.
- זהה את הנתונים המבניים המתאימים (7QNE, שרשרת C)26 מהתפריט הנפתח ובחר פתח תצוגת מבנה חדשה עם Jmol.
הערה: זה יאפשר שילוב של השאריות שנבחרו ביישור הרצפים המרובים בנתונים המבניים על ידי Jmol, צופה מבוסס Java בקוד פתוח למבנים כימיים תלת מימדיים.
- בין התחזיות הפתוגניות הקונצנזוס, קבע את הגרסאות בסמיכות למוטציות אפילפטוגניות שהתקבלו מהספרות. ודא שלאחרונים יש פרמטרים מבניים וביופיזיים המתאימים למידול נוירונים.
2. בחירת פרמטרים ומידול ביופיזיקלי
- מטא-אנליזה ספציפית לוריאנט ונורמליזציה של פרמטרים
- סקר את הספרות הנוכחית כדי לאסוף גרסאות תת-יחידות מזוהות עם מוליכות ערוץ נתונים אלקטרופיזיולוגית (gGABAA), זמן השבתה (השבתת τ), זמן עלייה (עלייהτ) ומשרעת זרם מקסימלית (Imax). ספק את קומפוזיציות יחידות המשנה, סוג התא ומדידות מסוג פרא עבור כל מקרה. סמן את הווריאנטים ואת הבקרות שלהם בהתאם (למשל, ידוע עבור וריאנטים עם מאפיינים ביופיזיים מזוהים ובקרה ידועה למדידות מסוג פרא עבור כל וריאנט).
- השג ציוני פתוגניות של AlphaMissense עבור גרסאות עם מאפיינים ביופיזיים מזוהים.
הערה: עיין בסעיף פרוטוקול 1.3 לפרטים נוספים. - צור מסגרת נתונים עם תת-יחידה ומיקום חומצות אמינו עבור כל גרסה, חומצות האמינו המקוריות והמשתנות, ציון הפתוגניות והפרמטרים הביופיזיקליים המתקבלים מהספרות. כדי למנוע אי התאמות ניסיוניות, לנרמל את הפרמטרים הביופיזיים עבור וריאנטים מזוהים כשינויים פי X במדידות מסוג בר.
- ניתוח גרסאות השוואתי לפי מאפיינים מבניים ותפקודיים
- ארגן את הגרסאות החזויות על מסגרת נתונים; בהתאם (למשל, צפוי עבור וריאנטים ללא ספרות זמינה על המאפיינים הביופיזיים שלהם).
- סווג את הגרסאות לפי מיקומן ברצף חומצות האמינו ובמבנה השלישוני. הוסף פרמטרי סיווג מבניים (למשל, לוקליזציה בסלילי אלפא, סלילים, יריעות בטא, תחומים חוץ-תאיים, תוך-תאיים או טרנסממברניים, רירית נקבוביות, קשירת אגוניסטים, אינטראקציות חלבון-חלבון) על מסגרת הנתונים וספק מידע עבור כל וריאנט ביחס למיקום חומצות האמינו שלהם.
- סווג את הגרסאות לפי המרחק שלהן למרכז הממברנה וציר הנקבוביות. הוסף מרחק לציר הנקבוביות ומרחק לפרמטרים של מרכז הממברנה במסגרת הנתונים.
- לנתח את המתאם בין פרמטרים מבניים וביופיזיים על פני וריאנטים ידועים. במידת האפשר, הערך את הגרסאות החזויות ביחס למתאמים שהתקבלו.
- בניית מודל סינפסה ונוירונים
- השתמש ב-Brian245, סימולטור עצבי בקוד פתוח שפותח בפייתון למידול וסימולציה של רשתות עצביות מתפרצות, כדי לבנות מודל ביופיזיקלי רב-תאורי של סינפסה GABAergic על נוירון פירמידלי היפוקמפוס מבוסס מוליכות רב-תאית.
- תכנן את המודל מבוסס המוליכות על ידי הגדרת קינטיקה של שער תעלת יונים, פרמטרים פסיביים ואקטיביים ומוליכות פוסט-סינפטית. הגדר את המודל מבוסס המוליכות כפי שניתן בקובץ משלים 2, המתאר את המשוואות המשמשות במודל.
- הגדר את קיבול הממברנה (Cm) כ-1 μF/cm2 ואת ההתנגדות התוך-תאית (Ra) כ-200 Ω.ס"מ.
- השתמש במוליכות מסוג הודג'קין-האקסלי שהשתנתה עבור נוירונים פירמידליים בהיפוקמפוס39 עם gL = 0.0003 S/cm2, gK = 0.036 S/cm2, EL = -76.5 mV, ENa = 50 mV ו- EK = -90 mV.
- התאם את התפלגות הצפיפות של תעלות NaV על פני gNa כ-0.05 S/cm2 עבור סומה, 0.5 S/cm2 עבור מקטע התחלתי של אקסון (AIS) וצומת של Ranvier (NR), ו-0.005 S/cm2 עבור דנדריטים. הגדר את gK ו-gNa כ-0 במקטעים מיאליניים.
- בנה קינטיקה של שער תעלות יונים עבור NaV ו-KV כמתואר בקובץ משלים 2.
- הציגו זרמים סינפטיים (Isyn) כסיכום של כל הסינפסות הגלוטמטרגיות וה-GABAergic בתא. כלול גם זרם מתווך קולטן AMPA מהיר (IAMPA) וגם זרם איטי בתיווך קולטן NMDA (INMDA) בזרם הגלוטמטרגי (Iglu). כלול רק זרם מהיר בתיווך קולטן GABAA בזרם GABAergic (IGABA). נניח שכמות קבועה של גלוטמט משתחררת לסינפסה עבור כל ספייק פרה-סינפטי; לכן, הפעלת הקולטנים תלויה בזמן ספייק (sAMPA ו-sNMDA) וסך מוליכות הקולטנים (gAMPA ו-gNMDA) משקף את כמות הגלוטמט המשתחררת על ידי כל אירוע.
- השתמש במודל הסינפטי כמתואר בקובץ משלים 2.
הערה: להסבר מפורט על המשוואות, ראה קובץ משלים 2 המתאר את המשוואות המשמשות במודל.
- השג את הקוטר שנמדד בניסוי עבור סומה ונויריטים ואת האורך של כל תא נויריט ודפוסי הסתעפות מהספרות הקודמת46,47. צמצם את המורפולוגיה האמיתית של הנוירונים למודל רב-תאים, על ידי חלוקת התא למספר תאים, המשמר במדויק את מבנה ההסתעפות הראשי ושומר על סימטריה דו-צדדית.
- הגדר את המורפולוגי (אורך וקוטר המקטע; כלומר, d_soma: 30 מיקרומטר; l_AH: 5 מיקרומטר; d_AH_i: 1.5 מיקרומטר; d_AH_f: 1.3 מיקרומטר; l_AIS: 40 מיקרומטר; d_axon: 1 מיקרומטר; l_myseg: 100 מיקרומטר; l_NR: 2 מיקרומטר; l_AxTer: 4 מיקרומטר; d_AxTer: 2 מיקרומטר; l_approx: 100 מיקרומטר; l_apmed: 100 מיקרומטר; l_apdis: 200 מיקרומטר; d_approx_i: 4 מיקרומטר; d_approx_f: 3 מיקרומטר; d_apmed : 2 מיקרומטר; d_apdis: 2 מיקרומטר; l_apLM: 70 מיקרומטר; d_apLM: 2 מיקרומטר; l_nAcDbasal: 400 מיקרומטר; d_nAcDbasal: 1.4 מיקרומטר; l_nAcDbasal_stem: 20 מיקרומטר; d_nAcDbasal_stem: 1.5 מיקרומטר) ופרמטרים ביופיזיים (כפי שניתן בסעיף 2.3.2) עבור כל תא של מודל הנוירונים הפירמידליים46,47 כפי שמפורט גם בסקריפט פייתון (קובץ משלים 3: GABAAvar.py).
- קבע את הפרמטרים הביופיזיים עבור מודל הסינפסה GABAergic על ידי הערכת מדידות הבקרה מסוג הבר שהתקבלו בשלב 2.1.1.
- לתכנן את הטופולוגיה של מודל הנוירונים ולהקצות פרמטרים מורפולוגיים וביופיזיים, הכוללים ציון הסידור המרחבי והקשרים ההדדיים של התאים, על סמך המידע המורפולוגי וההסתעפות שהושג בעבר. הקצה את הפרמטרים המורפולוגיים המתאימים (למשל, אורך וקוטר המקטע) והביופיזיקה (סעיף 2.3.2) לכל תא של המודל, כמתואר בקובץ משלים 3: GABAAvar.py.
- בניית סינפסות והזרקת זרם
- צור את הפעילות הפרה-סינפטית באמצעות SpikeGeneratorGroup (מחלקה מספריית Brian2) כפי שמופיע ב-"GABAAvar.py" (קובץ משלים 3). חבר את מחולל הספייק לתא היעד של נוירון המודל באמצעות מחלקת Synapses כדי לדגמן קשרים סינפטיים.
- הגדר זרם קבוע מתמשך (I inj) כ-0.85nA ומקם בסומה כדי לחקות את פעילות תת-הסף המונעת על ידי עומס זרם יוני בסיסי בזמן נתון כמתואר בקובץ משלים 3: GABAAvar.py.
- כדי לבנות צגי הקלטה, הקלט עקבות מתח מתאי יעד באמצעות StateMonitor.
- בנה והפעל את הרשת.
- בנה את הרשת עם נוירון המודל, חיבורים וצגים באמצעות רשת.
- הגדר את שלב הזמן של הסימולציה על ידי defaultclock.dt (למשל, 0.01 אלפיות השנייה).
- הפעל את הסימולציה ברשת באמצעות network.run(T*ms), כאשר T מוגדר כ- 1,000 אלפיות השנייה בדוגמה.
- בדיקת ההשפעה של מוטציות שגויות בקולטן GABAA
- הגדר את ההשפעה של כל מוטציה שגויה על קינטיקה של הערוץ באמצעות הפרמטרים הביופיזיקליים שנאספו בשלב 2.1.1.
- הפעל את הגירוי על ידי שינוי פרמטרים אלה ושרטט את התוצאות באמצעות "matplotlib.pyplot" כפי שמופיע ב-"GABAAvar.py" (קובץ משלים 3).
- בדוק שילובי פרמטרים כדי לנתח את השינויים בדפוסי הירי ובקצבי הירי. התוויית תוצאות להשוואה.
תוצאות
מחקר זה משתמש בגישה רב-ממדית כדי לחזות ולאפיין את הגרסאות הפתוגניות בתת-היחידה γ2 של קולטן GABAA , מרכיב מרכזי בפתופיזיולוגיה של אפילפסיה. באמצעות שימוש במודלים חיזויים, מודלים מולקולריים, שימור אבולוציוני, בחינה מבנית, ניתוח מתאם וסימולציות עצביות, גישה זו משפרת את סיווג הווריאנטים, עם רלוונטיות משמעותית לחקר אפילפסיה ואולי לשימוש קליני. הסיכום הכולל של המתודולוגיה מוצג באיור 1.
הערכה השוואתית של שתי מוטציות סמוכות של תת-יחידות γ2
בהתבסס על ההנחה שלנו שמוטציות פתוגניות חזויות בסמוך למוטציות אפילפטוגניות בתת-יחידות קולטן GABAA עשויות לייצר השפעות אלקטרופיזיולוגיות דומות על תפקוד הערוץ והתנהגות עצבית, ערכנו תחילה בדיקה קצרה של הקשר בין מוטציה אפילפטוגנית ידועה למוטציה חזויה פרוקסימלית של תת-יחידה γ2.
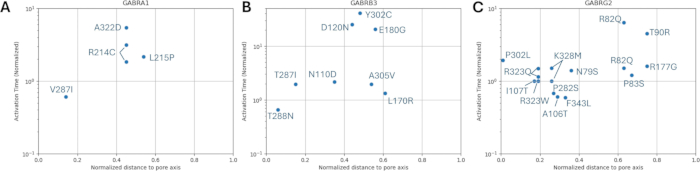
בין הווריאנטים שנחזו כפתוגנים (טבלה משלימה S6), A303T (rs1581439874, ClinVar Accession: VCV000663033.6) נבחר כדוגמה. בנוסף לחיזוי על ידי מודלים של אנסמבל, הפתוגניות של A303T אושרה על ידי ציוני AlphaMissense (קובץ משלים 4: טבלה משלימה S7). A303T נמצא בתחום הטרנסממברני השני של תת-היחידה של קולטן GABAA γ2 וממוקם ליד המוטציה האפילפטוגנית P302L40, כפי שמוצג באיור 2. כפי שהוערך על ידי מודלים מולקולריים, גם החלפות γ2P302L וגם γ2A303T הביאו לחומצות אמינו בעלות שרשראות צד גדולות יותר, כפי שמוצג באיור 3. גם השאריות המוטנטיות וגם השאריות מסוג הבר אינן קוטביות במוטציה γ2P302L, בעוד שב-γ2A303T, לשאריות המוטנטיות יש שרשרת צד קוטבית ולשאריות מסוג הבר יש שרשרת צד לא קוטבית. גם P302 וגם Ala303 ממוקמים בממשק האינטראקציה של תת-היחידה עם תת-היחידה β3 (נצפה ב-7QNB ו-7QNA, בהתאמה). גם ל-P302 וגם ל-Ala303 יש שטח פנים נגיש לממס (SASA). בנוסף, שתי השאריות נשמרות ב-100% לאורך טווח האבולוציה של בעלי החוליות (איור 4, הפאנל העליון). שניהם ממוקמים בסמיכות לאזור הטרנסממברני השני (תחום TM2) של תת-היחידה γ2, כפי שמוצג בצהוב בשחזור התלת מימדי של חלבון הקולטן GABAA (7QNE26, כאשר A303, המוצג באדום, הוא השאריות הראשונות בתחום זה (איור 4). בהתבסס על מאפיינים דומים אלה ובאמצעות מודל נוירונים פירמידלי, ניתן להשתמש בסימולציה של מוטציות אפילפטוגניות פרוקסימליות כגון מוטציית תת-יחידה γ2 P302L40 לאפיון ראשוני של השפעת הווריאנט החזוי (γ2A303T) על התגובה העצבית. בשלב הבא, הרחבנו את הניתוח שלנו לקבוצה רחבה יותר של וריאנטים בתוך יחידות המשנה של קולטן GABAA .
אשכולות וריאנטים לפרמטרים מבניים וביופיזיים
בעקבות ההערכה ההשוואתית של שתי מוטציות סמוכות בסעיף הקודם, יישמנו גישה שיטתית כדי להעריך אם ניתן לזהות תכונות מולקולריות משותפות בין וריאנטים. שלב זה נועד לחקור האם דפוסים עקביים מופיעים בתכונות מבניות, פיזיקוכימיות וביופיזיקליות על פני חומצות האמינו והגרסאות, ובכך לספק תמיכה נוספת להשערה הראשונית שלנו.
מסגרת הנתונים ששימשה במחקר זה וההפניות מסופקות בקובץ משלים 4: טבלה משלימה S840, 48,49,50,51,52,53,54,55,56,57,58,59,60, 61,62,63, טבלה משלימהS936, וטבלה משלימהS1035. בנוסף, נקבעו מתאמים בין פרמטרים מבניים וביופיזיקליים עבור כל תת-יחידה ועבור כל הגרסאות ללא הבחנה בין תת-יחידות (תיק משלים 4: טבלה משלימה S11, טבלה משלימה S12, טבלה משלימה S13, טבלה משלימה S14 וטבלה משלימה S15). מידע על פרמטרים מבניים (לוקליזציה על סלילי אלפא, סלילים, יריעות בטא; תחומים חוץ-תאיים, תוך-תאיים או טרנסממברניים; רירית נקבוביות, קשירה אגוניסטית/אלוסטרית ואינטראקציות חלבון-חלבון) התקבל מ-Brünger et al.35. פרמטרים ביופיזיקליים התקבלו ממחקרי אלקטרופיזיולוגיה של מהדק טלאי על תאי כליה עוברית אנושית (HEK) 293. הערכים נורמלו עם קבועי זמן הפעלת הקולטן מסוג הבר (τr) וזמן ההשבתה (τd) המתאימים.
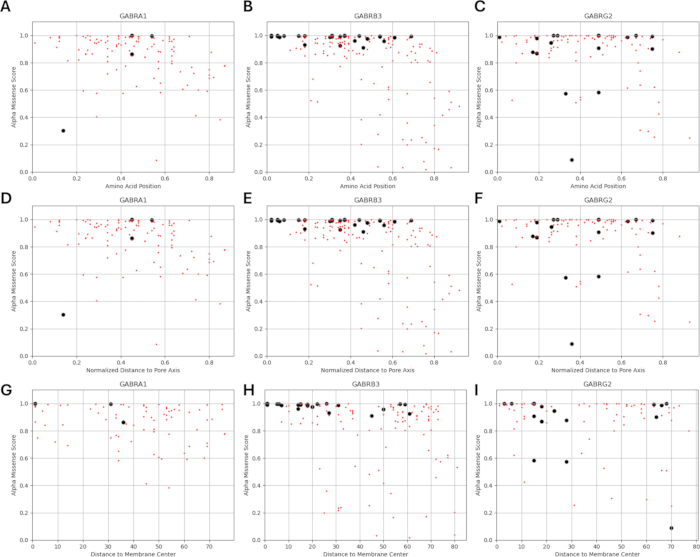
מכיוון שהמחקר שלנו מבוסס על הרעיון שגרסאות של חומצות אמינו הסמוכות או בסמיכות למוטציות שזוהו תפקודית בתת-יחידות קולטן GABAA עשויות להציג דפוסים דומים של שינויים אלקטרופיזיולוגיים בתפקוד הערוץ, כפי שנצפה במקרים של מוטציות אלה, בדקנו את האפשרות של קשר בין פרמטרים מבניים, פיזיקוכימיים וביופיזיקליים. מיקומי הגרסאות ביחס למרחקיהם ממרכז הממברנה וציר הנקבוביות ניתנים באיור 5 ובאיור 6. בהקשר זה, השתמשנו גם בציונים (קובץ משלים 4: טבלה משלימה S7) של AlphaMissense37; מופעל על ידי מודל חיזוי מבנה החלבון המדויק ביותר AlphaFold264, שיכול לנצל את רצף חומצות האמינו הבסיסי כקלט. AlphaMissense יכול לספק רמזים להיבטים המבניים של החלפות חומצות אמינו בודדות. ההתפלגות של ציוני AlphaMissense עבור וריאנטים ידועים (שחורים) וחזויים (אדומים) ביחס למיקום המשתנה (מיקום חומצת אמינו, מרחק למרכז הממברנה ומרחק לציר הנקבוביות) של תת-יחידות קולטן GABAA (תת-יחידות α1, β3, γ2 המקודדות על ידי גנים GABRA1, GABRB3, GABRG2 בהתאמה) ניתנת באיור 7.
איור 7A-C מציג את התפלגות ציון AlphaMissense על פני מיקומי חומצות אמינו, איור 7D-F מציג את התפלגות ציון AlphaMissense על פני מרחק מנורמל מציר הנקבוביות, ואיור 7G-I מציג את התפלגות ציון AlphaMissense על פני המרחק ממרכז הממברנה. ניתוח המתאם באיור 7 הצביע על הקושי לברר קשר בסיסי באמצעות מאפיינים מבניים כדי לחזות את התוצאה עבור וריאנטים חדשים שזוהו. וריאנטים של תת-יחידה b2 (מקודדים על ידי גן GABRB2) נכללו בקטעי האשכולות והמתאם כדי להיות מסוגלים לבצע ניתוח רחב יותר. עם זאת, רק הגרסאות של תת-היחידה α1 המקודדת על ידי GABRA1 (איור 7A,D,G), תת-יחידה β3 המקודדת על ידי GABRB3 (איור 7B,E,H), ותת-יחידה γ2 המקודדת על ידי GABRBG2 (איור 7C,F,I) נכללו במודלים הביופיזיקליים, מכיוון שהמודל מתמקד בתפקוד של נוירון פירמידלי בהיפוקמפוס ובשילוב α1β3γ2 של GABAA תת-יחידות קולטן הוא השילוב הנפוץ ביותר בהיפוקמפוס65. באופן דומה, כל גרסאות של α1, β3 או γ2 שעבורן לא נחקרה קינטיקה של ערוצים בקולטן α1β3γ2 GABAA לא נכללו גם הן בסימולציות. היה מתאם מתון (איור משלים S1 ואיור משלים S2) בין ציוני AlphaMissense לבין פרמטרים ביופיזיקליים (זמני הפעלה וביטול מנורמלים) הנגזרים מההשפעות של מוטציות קולטן GABAA (קובץ משלים 4 וטבלה משלימה S8) בניתוח הנוכחי. זה מצביע על כך שמוטציות הצפויות להיות פתוגניות (בהתבסס על ציוני AlphaMissense) עשויות גם להוביל לשינויים מדידים ועלולים לשבש את קינטיקה של הקולטנים (למשל, זמני הפעלה והשבתת). עם זאת, היעדר המתאם בין המתאמים המיקומיים באיור 7 מקשה על שימוש בציוני AlphaMissense עבור ההנחה שלנו, המבוססת על הרעיון שלחומצות אמינו סמוכות יהיו השלכות דומות על מאפיינים ביופיזיקליים.
ההתפלגות של מרחק מנורמל לציר הנקבוביות ביחס לקינטיקה של ההפעלה וההשבתה של הגרסאות הידועות מוצגות באיור 8 ובאיור 9. קיים מתאם מתון עבור תת-היחידה γ2 (איור 8C), מה שמרמז על האפשרות שההשערה שלנו, המבוססת על ההנחה שלחומצות אמינו סמוכות יהיו השלכות דומות, עשויה להיות נכונה באזורים מסוימים, במיוחד בקרבה לאזור הנקבוביות של תעלת הקולטן, תחום TM2. אזור זה צמוד למוטציה האפילפטוגנית הייחוס שלנו (איור 2 ואיור 4; γ2P302), מה שהופך אותו למועמד טוב יחסית לסימולציות עצביות. על סמך זה, ניתן לבצע הערכה גסה של ההשפעות של מוטציות חזויות סמוכות כגון γ2A303T (איור 2 ואיור 4). התוצאות שלנו המוצגות כאן מתייחסות רק למדידות על α1β3γ2; לכן, הגרסאות שהוערכו במודל שלנו הוגבלו לגרסאות שניתנו בקובץ משלים 4: טבלה משלימה S16.
השפעת מוטציות על עיכוב בתיווך קולטן GABA A של ירי נוירונים פירמידליים CA1
השפעת המוטציות על עיכוב בתיווך קולטן GABAA מודגמת במודל נוירונים פירמידלי CA1 מבוסס מוליכות רב-תאית. ניתן לחקור את ההשפעה של גרסאות missense של קולטן GABAA על תפקוד הנוירונים הפירמידליים בהיפוקמפוס באמצעות עיתוק GABAergic של קלטים אפיקליים לנוירון העצב, מההקרנות של נוירונים פירמידליים CA3 וקליפת המוח האנטורינלית (EC) III. במילים אחרות, אחת הדרכים לדמות את פעילותם של קולטני GABAA היא להניח הקשר שבו הסימולציה מייצגת הנחות מציאותיות לגבי המשמעות הפיזיולוגית של הקולטנים, כגון עיכוב עיתוק, אחד המנגנונים של עיכוב GABAergic. לנוירונים הפירמידליים של ההיפוקמפוס CA1, בדרך כלל בדנדריטים האפיקליים שלהם, יש קולטני GABAA באזורים אלה, הממוקדים על ידי הקרנות מהנוירונים של CA3 ו-EC III. סידור זה מתאים אפוא לסימולציה. שאלת מחקר זו דורשת תכנון קלט עם עיכובים ועוצמות משתנים. לכן, שלוש סינפסות גלוטמטרגיות שונות (GluS1/2/3) הונחו על הדנדריטים האפיקליים הדיסטליים, האפיקליים המדיאליים והבסיסיים, כפי שמוצג באיור 10, והן הופעלו ברצף. להערכת ההשפעה של כניסות סינפטיות, משרעת הזרם הקבוע צריכה להישאר מתחת לסף המינימלי להפעלת ספייק (Iinj < Imin). מודל הנוירונים הפירמידליים עם קולטן GABAA מסוג פרא או מוטנטי התחיל עם הזרקת זרם קבוע של 0.85 nA בסומה. לאחר מכן הונחה הסינפסה GABAergic בסומה. הפעילות הפרה-סינפטית, המחקה על ידי מחולל הספייק, החלה תחילה בדנדריט האפיקלי הדיסטלי. הכניסות הסינפטיות על הדנדריטים האפיקליים והבסיסיים המדיאליים התעכבו ב-25 אלפיות השנייה ו-50 אלפיות השנייה, בהתאמה. הסינפסה GABAergic הופעלה בעיכוב של 40 אלפיות השנייה. עוצמת העיכוב GABAergic הותאמה כך שכל רכבת הספייק, למעט הספייק הראשון, מעוכבת. לאחר מכן, ההשפעה של וריאנטים נחקרת בהגדרה זו על ידי שינוי τעלייה,השבתה τ ו- gGABAA .
הפרמטרים לקולטנים מסוג בר ומוטנטיים התקבלו מהאוסף המתואר בפרוטוקול שלב 2.1.1 במיוחד עבור קולטנים המורכבים מ-α1β3γ2, שהוא הרכב תת-היחידה הנפוץ ביותר בנוירונים פירמידליים בהיפוקמפוס65. התפלגות הפרמטרים ניתנת בקובץ משלים 4: טבלה משלימה S16.
כל מוטציה בתת-יחידה נבדקה על מקרי סינפסה גלוטמטרגיים בודדים, כפולים ומשולשים. בגישה פשוטה, ניתן להעריך את השפעת המוטציות על קצב הירי והדפוס. ניתן גם להעריך את הממוצעים וסטיית התקן של ΔtISI כדי לאמוד עוד יותר את השינויים בדפוס הירי, כאשר ΔtISI מייצג את השינוי במרווח הבין-ספייק. התוצאות עבור כל מקרה ניתנות כקצב ירי, ו-ΔtISI (ממוצע וסטיית תקן) בקובץ משלים 4: טבלה משלימה S17 ואיור משלים S3. רכבות הספייק ועקבות המתח עבור הגרסאות ששינו את דפוסי הירי ניתנים באיור 11, איור 12 ואיור 13.
עבור הפעלת סינפסה גלוטמטרגית בודדת (GluS1) ומשולשת (GluS1-2-3), המוטציות ששינו את תגובת הנוירונים היו רקβ 3מוטציות N110D ו-γ2K328M. במקרה הקלט הגלוטמטרגי היחיד, β3N110D הוביל לעיכוב לקוי, ודפוס הירי ננעל על רכבת הספייק הגלוטמטרגי לאחר הספייק הקדם-סינפטיהרביעי עם עיכוב קצר (איור 11). γ2K328M גם פגע בעיכוב, אם כי רק סביב הספייק הקדם-סינפטיה-5 , והכניס עיכוב גדול יותר בספייק הפוסט-סינפטי בהשוואה ל-β3N110D (איור 11). במקרה ההפעלה של GluS1-2-3 (איור 13), התגובה הייתה דומה בין מוטציות β3N110D ו-γ2K328M. שני המוטאנטים הניבו דפוס ירי שבו כמעט כל הקוצים הפרה-סינפטיים המצטברים זוהו ועוררו תגובה. בשני המקרים, מודלים של נוירונים נורו עם זוג ספייק בתגובה לפעילות פרה-סינפטית.
הפעלת הסינפסה הגלוטמטרגית הכפולה הניבה תוצאות שונות בהשוואה לשתי ההגדרות האחרות (איור 12). במקרה זה, שתי מוטציות בתת-היחידה b3 של קולטן GABAA (β3N110D ו-β3T288N) ושתי מוטציות בתת-היחידה של קולטן GABAA γ2 (γ2P302L ו-γ2K328M) פגעו בעיכוב GABAergic. מודל הנוירונים עם מוטציה γ2P302L נורה כמעט בסנכרון עם ה-GluS2, מה שככל הנראה היה תגובה מושהית ל-GluS1 עם אותו עיכוב בערך של קוצים פרה-סינפטיים בין GluS1-2. המוטציה β3T288N הניבה תוצאה דומה, כאשר ההבחנה של הספייק השני עדיין מסונכרנת עם GluS2. מודל הנוירונים עם מוטנט β3N110D הגיב כמעט לכל קלט גלוטמטרגי מצטבר, למעט שני הקוצים הפרה-סינפטיים הראשונים של GluS1/2, שהוצגו עם ΔtISI קצר יותר. דפוס הירי של γ2K328M היה שוב כמו β3N110D, עם החמצה של קוצים פרה-סינפטיים שני ושלישי.
תוצאות אלו מדגימות את ההשפעות המגוונות של תת-יחידה b3 (מקודדת על ידי גן GABRB3 ) ותת-יחידה γ2 (מקודדת על ידי GABRG2) על פעילות הנוירונים הפירמידליים בהיפוקמפוס. מעניין שהמוטציות β3L170R, β3A305V, β3E180G, β3D120N, β3Y302Cו-γ 2R82Q לא הניבו כל שינוי בפעילות העצבית. הפגיעה החמורה ביותר בעיכוב הייתה עבור β3N110D ו-γ2K328M, שלשניהם הייתההשבתה נמוכה משמעותית של τועלייה גבוהה יותר ב-τ. הניתוח הראשוני שלנו הראה גם ששינוייםבעליית τ או gGABAA לבדם אינם מספיקים כדי לפגוע בעיכוב (נתונים לא מוצגים). ניתן לטעון כי המוטציות המובילות לירידה משמעותיתבנטרול τ יחד עםעלייה מוגברת ב-τ מובילות לפגיעה משמעותית יותר בעיכוב GABAergic.
במקרה בו יש לעכב את כל הכניסות המעוררות, כל מוטציה שתוביל לירי תניב תגובות עצביות חריגות ולא ספציפיות, שיש להן פוטנציאל להיות מוגזמות במעגל עצבי המורכב מנוירונים עם אותן מוטציות. איזון העירור/עיכוב ברשת עצבית יכול להיות מושפע באופן משמעותי מהמשוב המעכב הלקוי שנוצר, שהוא מרכיב מכריע בכל פעילות רשת.
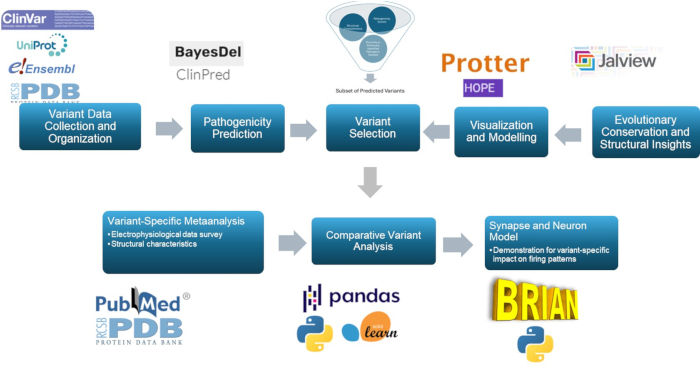
איור 1: סקירה כללית של חיזוי וניתוח אפקט וריאנט למטרות קליניות ומחקריות, עם דגש ספציפי על ניתוח סיליקו וסימולציות תגובה עצבית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: מיקום γ2A303T ומוטציות נבחרות של חולים;γ2P302L ו-γ2K328L משמשים לסימולציות עצביות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
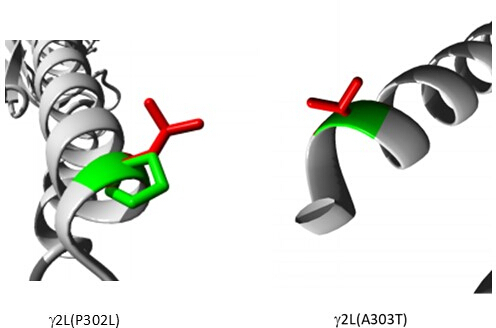
איור 3: מודלים השוואתיים של מוטציית החולה γ2P302L והגרסה הסמוכה γ2L(A303T) שנחזה כפתוגנית. בשני הדגמים, ירוק מייצג סוג פרא ואדום מייצג שאריות מוטנטיות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
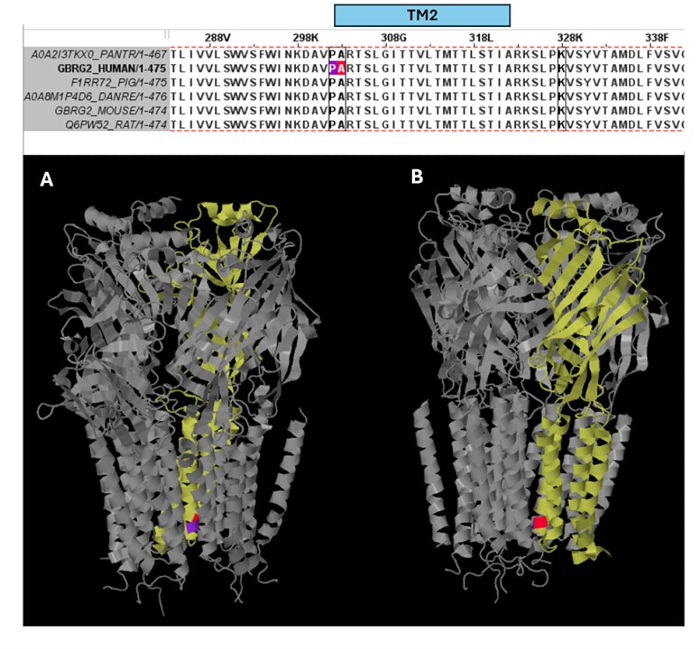
איור 4: יישור רצפים מרובים ותובנות מבניות. הפאנל העליון מציג את השימור האבולוציוני של השאריות במיקום של מוטציית המטופל (P302L) (סגול) בקצה ה-TM2 ושל הגרסה הפתוגנית A303T (צבע אדום) בתחילת ה-TM2 של תת-היחידה γ2. הפאנל התחתון מציג את ההדמיה של שאריות שמורות אלה במבנה הקולטן התלת מימדי GABAA (7QNE), כאשר תת-היחידה γ2 (שרשרת C ב-7QNE) מוצגת כצהובה ומזוויות שונות (A, B). קיצור: TM2 = תחום טרנסממברני שני. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: לוקליזציה של כל הווריאנטים הכלולים. מוצגים המיקומים של גרסאות ידועות (שחורות) וחזויות (אדומות) ביחס למרחק המנורמל שלהן (A) מציר הנקבוביות ו-(B) ממרכז הממברנה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
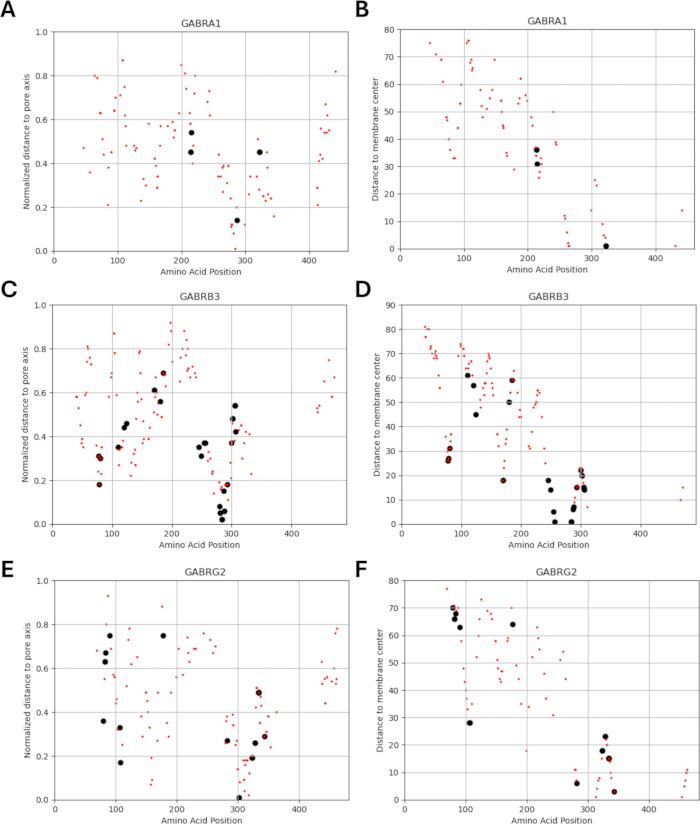
איור 6: לוקליזציה של וריאנטים עבור כל תת-יחידה. מוצגים המיקומים של וריאנטים ידועים (שחורים) וחזויים (אדומים) ביחס למרחק המנורמל שלהם (A, C, E) מציר הנקבוביות והמרחק (B, D, F) ממרכז הממברנה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור 7: התפלגות ציוני AlphaMissense על פני מיקום הווריאנט. (א-ג) התפלגות ציון AlphaMissense על פני מיקום חומצות אמינו, מרחק מנורמל (D-F) מציר הנקבוביות ומרחק (G-I) ממרכז הממברנה ניתנים עבור גרסאות ידועות (שחורות) וחזויות (אדומות). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור 8: זמן הפעלה מנורמל של קולטני GABAA עם מוטציות בתת-יחידה α1 (GABRA1), תת-יחידה β3 (GABRB3) ותת-יחידה γ2 (GABRG2). קבועי זמן ההפעלה שהושגו בניסוי ביחס למרחק מנורמל מציר הנקבוביות עבור כל מוטציה בתת-יחידות (A) α1, (B) β3 ו-(C) γ2 מוצגים. הערכים נורמלו עם זמן הפעלת הקולטן מסוג הבר המתאים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 9: זמן השבתה מנורמל של קולטני GABAA עם מוטציות בתת-יחידה α1 (GABRA1) של קולטן GABA A, תת-יחידה β3 (GABRB3) של קולטן GABA A ותת-יחידה γ2 (GABRG2).קבועי זמן ההשבתה שהושגו בניסוי ביחס למרחק מנורמל מציר הנקבוביות עבור כל מוטציה בתת-יחידות (A) α1, (B) β3 ו-(C) γ2 מוצגים. הערכים נורמלו עם זמן השבתת הקולטן מסוג הבר המתאים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 10: מודל נוירונים פירמידליים CA1. נוירון המודל מורכב מ-(1) סומה, (2) דנדריט אפיקלי עם תאים פרוקסימליים, מדיאליים ודיסטליים, המסתיימים בשני ענפים ב-lamina molecularis, (3) שני דנדריטים בסיסיים מורכבים באופן סימטרי המסתעפים לשני חלקים לאחר גבעול דנדריט בסיסי קצר, ו-(4) אקסון שמתחיל בגבעת אקסון חרוטית, ואחריו קטע התחלתי של אקסון גלילי, מקטעים מיאליניים, וצמתים של Ranvier, המסתיימים במסוף אקסון כדורי. המשולשים הירוקים מציינים את מיקומן של סינפסות גלוטמטרגיות, והמשולש האדום מייצג את הסינפסה GABAergic הממוקמת בסומה. סרגל קנה מידה = 100 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 11: דפוס ירי עם פעילות GluS1 בלבד. רכבות הספייק לנוירונים פרה-סינפטיים (GluS1 (משולש ירוק) ו-GABAergic (עיגול אדום)) והנוירונים הפוסט-סינפטיים עם קולטני GABAA מסוג פרא או מוטנטי (ריבוע שחור) ניתנים בפאנל העליון. עקבות מתח בודדים עבור נוירונים עם קולטן GABAA מסוג פרא עם או בלי עיכוב GABAergic ועבור נוירונים עם קולטני GABAA מוטנטיים עם עיכוב GABAergic מוצגים בפאנלים התחתונים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
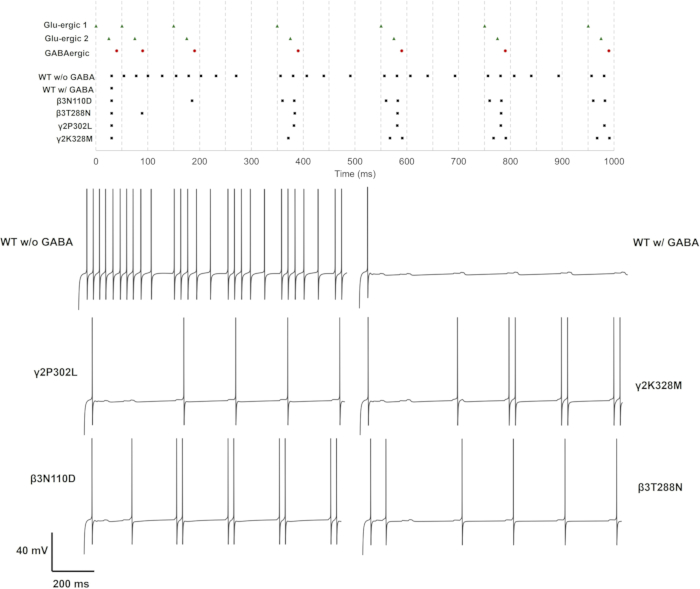
איור 12: דפוס ירי עם פעילות GluS1 ו-GluS2 בלבד. רכבות הספייק לנוירונים פרה-סינפטיים (GluS1/2 (משולש ירוק) ו-GABAergic (עיגול אדום)) והנוירונים הפוסט-סינפטיים עם קולטני GABAA מסוג פרא או מוטנטי (ריבוע שחור) ניתנים בפאנל העליון. עקבות מתח בודדים עבור נוירונים עם קולטן GABAA מסוג פרא עם או בלי עיכוב GABAergic ועבור נוירונים עם קולטני GABAA מוטנטיים עם עיכוב GABAergic מוצגים בפאנלים התחתונים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 13: דפוס ירי עם פעילות GluS1, GluS2 ו-GluS3 בלבד. רכבות הספייק לנוירונים פרה-סינפטיים (GluS1/2/3 (משולש ירוק) ו-GABAergic (עיגול אדום) והנוירונים הפוסט-סינפטיים עם קולטני GABAA מסוג פרא או מוטנטי (ריבוע שחור) ניתנים בפאנל העליון. עקבות מתח בודדים עבור נוירונים עם קולטן GABAA מסוג פרא עם או בלי עיכוב GABAergic ועבור נוירונים עם קולטני GABAA מוטנטיים עם עיכוב GABAergic מוצגים בפאנלים התחתונים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור משלים S1: התפלגות ציוני AlphaMissense ופרמטרים ביופיזיקליים (זמן השבתה מנורמל; מנורמל τd) של מוטציות תת-יחידה של קולטן GABAA שנבחרו במחקר הנוכחי. ראה גם קובץ משלים 4: טבלה משלימה 8. אנא לחץ כאן להורדת איור זה.
איור משלים S2: התפלגות ציוני AlphaMissense ופרמטרים ביופיזיים (זמן הפעלה מנורמל; τr מנורמל) של מוטציות תת-יחידה של קולטן GABAA שנבחרו במחקר הנוכחי. ראה גם קובץ משלים 4: טבלה משלימה 8. אנא לחץ כאן להורדת איור זה.
איור משלים S3: מרווחי הבין-ספייק לתגובה עצבית עם קולטני GABAA מסוג פרא ומוטנטי. התרשים העליון מציין את מרווחי הזמן הבין-ספייק עבור קלט גלוטמטרגי יחיד. התרשים האמצעי מציג שתיים, והתרשים התחתון ביותר מציג שלוש סינפסות גלוטמטרגיות הפעילות בו זמנית. אנא לחץ כאן להורדת איור זה.
תיק משלים 1: הקובץ "Data_GABAA. R" נדרש להפעלה ב-R לעיצוב נתונים. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 2: משוואות המשמשות בתכנון מודל מבוסס מוליכות. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 3: GABAAvar.py נדרש להפעלה ב-Brian2 לסימולציה עצבית. הקובץ מכיל את קודי פייתון למודל נוירונים רב-תאיים מבוסס Brian2 (פונקציה: CA1_Pyr), משוואות למודלים של נוירונים וסינפטיים מבוססי מוליכות (פונקציה: model_eqns, syn_eqns) ופרמטרים ראשוניים (פונקציה: biophys_param, morpho_param, syn_param). אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 4: תיקיית zip המכילה את כל הטבלאות המשלימות. אנא לחץ כאן להורדת קובץ זה.
טבלה משלימה S1: גרסאות Missense בעלות משמעות לא ידועה בגן GABRG2 שהורדו מ-ClinVar כקובץ .txt ולאחר מכן נשמרו כ-"data.xlxs". אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S2: מזהים של הרצפים ששימשו במחקר, תעתיק הייחוס של הגן המעניין (NCBI Ref. seq.) ומזהים תואמים אחרים במאגרי מידע שונים). אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S3: מיקומי האזורים המבניים והפונקציונליים. המיקומים של האזורים הספציפיים של חלבון תת-היחידה γ2 (רצף ייחוס NCBI: NP_944494.1) המקודדים על ידי תמליל הייחוס (NM_198904.4) אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S4: תוכן הקובץ "data1.xlxs", המייצג את נתוני ClinVar של GABRG2 הכולל רק את העמודות: "GRCh38Chromosome", "GRCh38Location", "Name", "Protein change". אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S5: התוכן של קובץ "data1_output.xlsx" המכיל את העיצוב הנדרש של גרסאות missense של נתוני GABRG2 להעלאה לשרת dbNSFP לחיזוי אפקט וריאנט. אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S6: התוכן של קובץ "data2.xlsx" המכיל את הפלט משרת dbNSFP לחיזוי אפקט המשתנה עבור גרסאות שגויות לא ידועות של GABRG2. אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S7: ציוני AlphaMissense עבור גרסאות תת-יחידות של קולטן GABAA . אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S8: מאפיינים ביופיזיים של גרסאות. ערכים לפרמטרים הביופיזיים התקבלו ממחקרים קודמים עם ניסויים באלקטרופיזיולוגיה. גרסאות מסומנות בסוג "S" (החלפה), בעוד שפרמטרי הקולטן מסוג פרא ניתנים עבור כל החלפה ומסומנים ב-"C" (בקרה). τd : קבוע זמן השבתה, Pפתוח : הסתברות פתוחה, gGABA: מוליכות קולטן, Iמקסימום: זרם מקסימלי, τr : קבוע זמן הפעלה. אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S9: מאפיינים פיזיקוכימיים של גרסאות. וריאנטים שזוהו בעבר עם פרמטרים ביופיזיקליים מסומנים בסוג "S" (החלפה), ואילו הגרסאות החזויות מיוצגות ב-"P". H: שינוי בהידרופוביות, VSC: שינוי בנפח השרשרת הצדדית, P1: שינוי בקוטביות, P2: שינוי בקיטוב, SASA: שינוי במשטח הנגיש לממס, NCISC: שינוי במדד המטען הנקי. הערכים מתקבלים עבור כל חומצת אמינו מקורית וגרסה מ- Guo et al.36 והשינוי בכל פרמטר מוערך כנתון. אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S10: מאפיינים מבניים של גרסאות. וריאנטים שזוהו בעבר עם פרמטרים ביופיזיקליים מסומנים בסוג "S" (החלפה), בעוד שהווריאנטים החזויים מיוצגים ב-"P". הלוקליזציה של הווריאנט בתחום מיוצגת עם 1, אחרת 0. כל הערכים מתקבלים מ-Brünger et al.35. אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S11: מתאמים מבניים וביופיזיקליים של פרמטרים עבור כל הווריאנטים הידועים. אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S12: מתאמים פרמטריים מבניים, פיזיקוכימיים וביופיזיקליים עבור גרסאות ידועות של GABRA1 . אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S13: מתאמים פרמטריים מבניים, פיזיקוכימיים וביופיזיים עבור גרסאות ידועות של GABRB2 . אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S14: מתאמים פרמטריים מבניים, פיזיקוכימיים וביופיזיקליים עבור גרסאות ידועות של GABRB3 . אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S15: מתאמים פרמטריים מבניים, פיזיקוכימיים וביופיזיים עבור גרסאות GABRG2 ידועות. אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S16: פרמטרים ביופיזיים לקולטני α1β3γ2 GABAA מסוג בר ומוטנטי. אנא לחץ כאן להורדת טבלה זו.
טבלה משלימה S17: קצב ירי ומרווחי אינטרספייק בתגובה לסינפסות גלוטמטרגיות בודדות, כפולות או משולשות עם קולטני GABAA מסוג פרא ומוטנטי. אנא לחץ כאן להורדת טבלה זו.
Discussion
על ידי יישום שילוב של גנטיקה חישובית, מודלים מולקולריים וסימולציות עצביות, לגישה המוצגת במאמר זה יש פוטנציאל לשפר את הסיווג של גרסאות קולטן GABAA, ולהציע תובנות חשובות הן למחקר אפילפסיה והן ליישומים קליניים. ניתוח מקיף לזיהוי ותעדוף של מוטציות פתוגניות חזויות מוצג ומורחב למסגרת שעשויה לגשר על הפער בין השפעות הווריאנטים על פנוטיפ חלבון ותאי. הערכת ההשפעה של פעילות קולטן GABAA אפילפטוגנית על סימולציה של נוירונים פירמידליים בהיפוקמפוס מאפשרת שכפול של פנוטיפ במבחנה הקשור לתפקוד לקוי של קולטן GABAA והדגמה של שינוי תגובת נוירון בודד בשורש תפקוד לקוי ברשת. בהתבסס על סימולציות אלה של תגובות עצביות שנוצרו על ידי מוטציות אפילפטוגניות, נחקרה הערכה גסה של ההשפעות התפקודיות של מוטציות חזויות פרוקסימליות מבנית. התחזיות לגבי השפעת המוטציות החזויות על קינטיקה של הערוצים דורשות ניתוח יסודי עם קבוצות וריאנטים ידועות. ניתוחים השוואתיים, כמו אלה המוצגים במאמר זה, וסימולציות פעילות עצבית מספקים תובנות קריטיות להמשך היצירה והשיפור של מודלים חיזויים המתמקדים בהשפעת המשתנה על תפקוד החלבון והפתולוגיה העצבית. בנוסף, ניתן להשתמש במתודולוגיה שלנו כדי לבחור ולתעדף את הגרסאות הפתוגניות ביותר מבין הגרסאות הלא ידועות כדי לבחון את השפעות הווריאנטים הקשורות להפרעות נוירו-התפתחותיות הקשורות לקולטן GABAA. לדוגמה, תת-יחידות קולטן המתויגות בבדיקות פלואורסצנטיות 66,67,68,69,70 ונושאות את המוטציות החזויות יכולות להתבטא במבחנה כדי לחקור את הסחר בהן, ביטוי פני התא ונוירופיזיולוגיה. חוץ מזה, מודלים של בעלי חיים כגון C. elegans עשויים להיחשב כדי לאמת את ההשפעות של מוטציות חזויות. לדוגמה, עריכת גנים CRISPR-Cas9 שימשה ליצירת מחיקה של unc-49, קולטן C. elegans GABAA, ובכך ליצור מוטציות הומוזיגוטיות הקשורות לאפילפסיה ב-unc-49 או תת-יחידות של קולטן GABAA אנושי71.
באופן כללי, סיווג הווריאנטים נהנה משימוש ברמות מרובות של ראיות חישוביות, כפי שהומלץ על ידי ACMG-AMP12. גישה זו מחזקת את האמינות של סיווג וריאנטים על ידי שילוב כלי חיזוי ומקורות נתונים שונים, ובסופו של דבר משפרת את הדיוק של הערכות קליניות ומשפרת את תהליך קבלת ההחלטות הכולל באבחון גנומי. במתודולוגיה שלנו, השימוש במנבאים אנסמבל, המשלבים תחזיות של מספר כלים, ובכך ממלאים את הדרישה למספר שורות של ראיות חישוביות ומבטל את הצורך להשתמש בכלים שונים בנפרד הוא יתרון. גישה זו גם מתגברת על האתגר של טיפול בתפוקות שונות מכלים בודדים, ובכך מייעלת את תהליך החיזוי ומשפרת את היעילות. עם זאת, אין ערובה לגבי דיוק החיזוי של ניתוחים ממוקדי גנים או ספציפיים לווריאנטים. זה מוביל למסקנה כי יש לבצע תחזיות ממוקדות גן או ספציפיות לוריאנטים בתנאים ספציפיים המותאמים להקשרים וליעדים הספציפיים 15,72,73,74. עבור התערבויות קליניות, זה ידרוש הערכה של דיוק הניבוי של כלי סיליקו עבור גן ספציפי או תת-קבוצה של גנים בהקשר של מחלה נתונה, לעתים קרובות עם אופטימיזציה אינדיבידואלית75. עם זאת, הערכת דיוק החיזוי מוגבלת לרוב על ידי היעדר מספר מספיק של גרסאות, מה שיכול להשפיע על מהימנות הערכת הדיוק.
כלים שונים בספרות זמינים, והדיוק שלהם נבדק ומאומת במערכי נתונים14. עם זאת, תוצאות דיוק אלה המבוססות על מערכי נתונים גדולים אינן בהכרח באות לידי ביטוי בחיזוי של כמה וריאנטים לא ידועים עבור גן נתון. בהקשר זה, ספרות מצטברת מצביעה על כך שמנבאי אנסמבל, המרכיבים ומחשבים את התוצאות של מנבאים בודדים, ידועים כבעלי ביצועים טובים יותר מאשר קונקורדנציה של מנבאים בודדים 33,76,77,78 ולכן, במחקר הנוכחי, בחרנו להשתמש במנבאים אנסמבל, כלומר BayesDEL33 ו-ClinPred32 במיוחד עבור הביצועים המעולים שלהם 32, 34 BayesDEL הוערך באופן השוואתי עבור 4,094 וריאנטים שגויים בגנים רלוונטיים מבחינה קלינית, כולל גנים המקודדים לחלבונים טרנסממברניים כגון תת-יחידה 5 של תעלת נתרן אלפא (SCN5A), והראה ביצועים מעולים33. בפרוטוקול חיזוי אפקט הווריאנט שלנו, כצעד ראשון, שקלנו את הקונצנזוס משני מנבאים אנסמבל (BayesDEL ו-ClinPred). AlphaMissense37, מודל למידה עמוקה שפותח על ידי Google DeepMind, הוא הרחבה של AlphaFold 64,79, ובכך מנצל את הכוח של חיזוי מבנה חלבון ברמת דיוק גבוהה. כאשר השווינו את תוצאות החיזוי הראשוניות של מודלים אנסמבליים (BayesDEL ו-ClinPred כמתואר בשלב הפרוטוקול שלנו 1.3) עם התוצאות של AlphaMissense, התחזיות היו תואמות זו את זו באופן חלקי (קובץ משלים 4: טבלה משלימה S15) ולא התיישרו לחלוטין עם התחזיות של מודלים אנסמבליים (BayesDEL ו-ClinPred), שהגיעו לקונצנזוס של פתוגני או קשור למחלה, מוצג כשורות ורודות (קובץ משלים 4: טבלה משלימה S15). עם זאת, הווריאנטים הלא ידועים (L81F, A303T ו-V329F) ליד מוטציות GABRG2 R82Q, P302L ו-K328M, בהם השתמשנו במודל הנוירונים שלנו, ונחזו כפתוגנים הן על ידי ClinPred והן על ידי BayesDEL, נחזו גם כפתוגנים על ידי AlphaMissense כפי שמוצג על ידי הדגשות צהובות (קובץ משלים 4: טבלה משלימה S15).
מכיוון ש-AlphaMissense29 משתמש בחיזוי רצף והקשר מבני, במחקר שלנו, רצינו גם לראות אם יש קשר כלשהו בין ציוני AlphaMissense לבין מיקומי מוטציות בקולטן GABAA על סמך המרחקים שלהם ממרכז הממברנה וציר הנקבוביות. ההשערה שלנו מבוססת על הרעיון שההשפעה התפקודית של וריאנטים של חומצות אמינו הסמוכות או הקרובות למוטציות המזוהות תפקודית של תת-יחידות קולטן GABAA עשויות להראות דפוסים דומים של שינויים פיזיקוכימיים בתפקוד הערוץ שנצפו במקרים של מוטציות. מתאם בין מיקומי מוטציות תת-יחידות של קולטן GABAA לבין ציוני AlphaMissense יעזור לנו לזהות קשר שמיש לבניית מסגרת להשערה שלנו המאפשרת חיזוי של ההשלכות התפקודיות של וריאנטים חדשים של Missense בתת-יחידות קולטן GABAA . עם זאת, ציוני AlphaMissense לא ניבאו שינויים בפרמטרים הביופיזיקליים האלה (איור 7). חשוב לציין שגודל המדגם המצומצם בניתוח שלנו מקשה על הסקת מסקנות חד משמעיות. עם זאת, הניתוח שלנו מצא כי ציוני AlphaMissense לא היו בקורלציה עם הפרמטרים המבניים של קולטני GABAA . היעדר מתאם מיקום ברור (למשל, בין מיקומי המוטציות לבין ציוני AlphaMissense) מאתגר את תקפות ההנחה שלנו. אם לשאריות סמוכות היו באמת השפעות דומות, היינו מצפים לראות מתאם ברור יותר. מכיוון שזה לא המקרה, זה מחליש את היכולת להשתמש בציוני AlphaMissense ככלי אמין לבדיקת ההנחה שלנו.
מעניין לציין שבמחקר שלנו, מצאנו מתאם מתון בין המרחק של וריאנט לציר הנקבוביות וזמן הפעלת הערוץ המנורמל עבור מוטציות הגן GABRG2 . לפיכך, ההנחה הראשונית שלנו שלחומצות אמינו סמוכות יהיו השלכות דומות עשויה להיות נכונה באזורים מסוימים של הערוץ כגון אזורים בנקבוביות או באתרי מפתח המעורבים בשער, אך עשויה להיות פחות ברורה באזורים אחרים. מערך הנתונים הקטן מגביל את היכולת להבחין בשונות זו, אך נתונים עתידיים או ניתוח מבני מפורט יותר יכולים לעזור לחדד היבט זה של ההשערה שלנו. סימולציות דינמיקה מולקולרית80 יכולות לשמש כגישה משלימה רבת עוצמה להמשך חקירה של ממצאים ראשוניים אלה, במיוחד בהקשר של הערכה השוואתית של שתי מוטציות תת-יחידות γ2 סמוכות, כלומר המוטציה האפילפטוגנית γ2P302L40 והמוטציה החזויה הפרוקסימלית γ2A303T (rs1581439874), שבוצעה במחקר שלנו. בעתיד, גישה זו יכולה לאפשר הערכה מדויקת יותר של ההשפעה של וריאנט לא ידוע על הפנוטיפ התאי, במיוחד כאשר היא משולבת עם הסימולציות העצביות שהוצגו במחקר שלנו.
בנוסף, יהיה מעניין לחקור האם ניתן להשתמש בתכונות המבניות והפיזיקוכימיות של תת-יחידות קולטן GABAA יחד עם תכונות אחרות כדי לאמן מודלים רבי עוצמה של למידת מכונה לחיזוי פונקציונלי של השפעות וריאנטים חדשים על הערוץ, הנוירונים, הרשת ופנוטיפ המחלה. עם הופעתן של גישות אוטומטיות של למידת מכונה, הגענו לנקודה שבה רופאים ומדעני מעבדה רטובה יכולים גם לפתח מודלים משלהם בסביבה דמוקרטית יותר81. לכן, שילוב טכנולוגיות אלו בפרקטיקה הקלינית עשוי לייעל את התהליך, להפוך את הרפואה המותאמת אישית לנגישה יותר ולהפחית את ההסתמכות על מומחיות מיוחדת ביותר לניתוח וריאנטים פונקציונליים. בהקשר זה, הגישה שלנו מספקת תובנות לגבי הדינמיקה המבנית והתפקודית של הקולטן, מה שעשוי לסייע במחקרים עתידיים לחיזוי תפקודי של אפקט הווריאנט.
למרות ההתקדמות הנוכחית בחיזוי מבנה החלבון ופריצת הדרך המיוצגת על ידי AlphaFold64, חיזוי מדויק של השפעת המוטציות ותפקוד החלבון נותר אתגר בשל היעדר הנתונים הנדרשים לאימון מודל79. לצורך חיזוי אפקט הווריאנט, AlphaMissense מראה ביצועים גבוהים יותר בהשוואה לתת-קבוצה של מודלים חיזויים, אך מנבאי האנסמבל BayesDEL25 ו-ClinPred24, ששימשו במחקר שלנו, לא נכללו בהשוואה זו29. חשוב לציין כי במחקר שלנו, הכלים בסיליקו BayesDEL, ClinPred ו-AlphaMissense שימשו למטרות שונות. מנבאי האנסמבל, BayesDEL ו-ClinPred, שימשו בעיקר לחיזוי פתוגניות, בעוד ש-AlphaMissense שימש במיוחד כדי לחקור את הקשר בין הציונים שלו לנתונים הידועים על השפעת מוטציות בתת-היחידה γ2. באופן ספציפי, ההשערה שלנו מניחה כי וריאנטים פתוגניים חזויים, במיוחד אלה הממוקמים ליד או בסמוך למוטציות שזוהו תפקודית בתת-יחידות קולטן GABAA , יציגו פרמטרים ביופיזיקליים הדומים לאלה שנצפו במוטציות המאופיינות תפקודית. כדי לחקור זאת, בחרנו ב-AlphaMissense בשל העובדה שהוא מופעל על ידי מודל AlphaFold264 המדויק ביותר, המשתמש ברצף הפפטידים הבסיסי כדי לחזות את ההשלכות של החלפות חומצות אמינו בודדות.
כתוצאה מכך, מגבלה עיקרית של המחקר שלנו מונעת בעיקר על ידי הזמינות המוגבלת של נתונים ניסיוניים. לדוגמה, מודל הנוירונים שלנו מבוסס על ביטוי הנתונים הנגזרים משילוב תת-יחידות α1β3γ2 של קולטני GABAA , אשר מגביל מטבעו את המוטציות שנחקרו בספרות ליחידות המשנה המתבטאות כחלק משילוב קולטנים ספציפי זה. בנוסף, הסתמכנו על נתונים אלקטרופיזיולוגיים שמקורם אך ורק בביטוי של תת-יחידות אלה בתאי HEK, מה שצמצם עוד יותר את היקף הנתונים הזמינים בספרות. השימוש שלנו במודלים עצביים כדי להעריך את ההשפעות של וריאנטים לא ידועים מניח כי וריאנטים לא ידועים (הצפויים כפתוגניים בזרימת העבודה שלנו) הממוקמים בסמיכות למוטציות ידועות יציגו דפוסים דומים בפרמטרים של קינטיקת ערוץ או תכונות פיזיקוכימיות של השפעות מוטציות המתוארות בספרות. הנחה זו, יחד עם הצורך בנתונים אלקטרופיזיולוגיים עבור מכלולי קולטנים ספציפיים בתאי HEK293, מפחיתה את כמות הנתונים הניסיוניים הזמינים למידול. כתוצאה מאילוצים אלה, הנתונים הזמינים אפשרו לנו למדל רק מספר מוגבל של גרסאות בתת-יחידות α1β3γ2. עם זאת, אימון מודל הנוירונים עבור מכלולי תת-יחידות שונים כגון שילובי תת-יחידות α1β2γ2, שילובי תת-יחידות α1β2δ או α4β3δ, שיש להם השלכות ספציפיות לתת-יחידה ברמת התא, המעגל והרשת, ככל הנראה יראה ישימות רחבה יותר לסוגי אפילפסיה שונים והפרעות נוירו-התפתחותיות. בעתיד, עם הגידול בנתונים האלקטרופיזיולוגיים הזמינים ובמחקרים המתמקדים במוטציות במכלולי קולטנים מוגדרים היטב ובסוגי תאים ספציפיים, ייתכן שניתן יהיה לשפר את יכולת ההכללה והדיוק של הגישה שלנו.
מודלים של נוירונים מבוססי מוליכות רב-תאית מספקים כלי רב עוצמה ליצירת תחזיות למשמעות התפקודית של גרסאות הקולטן של תגובת הנוירון היחיד. כלי זה מאפשר הגדרות גמישות של פרמטרים תאיים/סינפטיים ומיקומם כדי לבחון כל שאלה ספציפית. ניתן להחליף מחוללי ספייק פשוטים המשמשים בפרוטוקול זה במודלים אחרים של נוירונים כדי לחקור את פעילות המיקרו-מעגלים. השלב הקריטי של הפרוטוקול הוא גם השלב המגביל ביותר: ההגדרה של כל וריאנט קולטן במונחים של קינטיקה של ערוץ שונה. המידע הנדרש מסופק באופן אידיאלי על ידי מחקרי אלקטרופיזיולוגיה של מהדק טלאי; עם זאת, הניתוח החישובי של תחליפי חומצות אמינו עם משמעות קלינית חזויה וההשוואות עם תחליפים ידועים יכולים גם לספק תובנה מסוימת. המחקר והפרוטוקול המתואר שלנו משלבים את השימוש בסימולציות פעילות עצבית לא ככלי חיזוי, אלא ככלי לחקר ההשפעות של מוטציות כדי לתמוך בהשקפה רחבה יותר על ההשלכות של מאפיינים ביופיזיים משתנים של קולטן GABAA על פעילות נוירון יחיד. התלות בנתונים ניסויים בסימולציות עצביות היא מגבלה חשובה בגישה שלנו, שעשויה להפיק תועלת ממודלים מולקולריים מתקדמים כדי לגשר על הפער בין מבנה לתפקוד.
בפרוטוקול שלנו, יש להעריך באופן ביקורתי צעדים מסוימים. ראשית, הבחירה במודל החיזוי המשמש בחלק הראשון של הפרוטוקול שלנו עשויה להיות קריטית. הבחירה בכלים בסיליקו תלויה במספר גורמים, כולל יצירת מספיק קווים מרובים של ראיות חישוביות לחיזוי רב עוצמה12. מנבאים אנסמבל המשלבים ניתוח של אלגוריתמי חיזוי מרובים מתאימים יותר להמלצה זו ולכן מועדפים בהשוואה למנבאים בודדים. ישנם מנבאים שונים, והדיוק שלהם נבדק בדרך כלל במערכי נתונים גדולים, מה שלא בהכרח מבטיח את הדיוק של מודל החיזוי המשמש להשפעות וריאנטים לא ידועות הממוקמות בגן ספציפי. זה מפוצה על ידי שימוש בשני מודלים אנסמבל, שאוספים ומחשבים את תוצאות החיזוי ממספר מנבאים. בנוסף, ניתן להתאים את החתכים של מודלי החיזוי כדי להגביר את הספציפיות אם המטרה היא בעיקר לזהות את הגרסאות הפתוגניות ביותר. קביעת חתכים מתאימים חשובה לאיזון הפשרה בין רגישות לספציפיות ולהבטחת סיווג מדויק של וריאנטים. במחקר שלנו, השתמשנו בחיתוכי ברירת המחדל. במיוחד לא שינינו את החתך לטובת לכידת וריאנטים שעשויים להיות פתוגניים יותר מכיוון שהדבר יקטין את היקף הווריאנטים שייבחנו ברמות מרובות של הניתוח שלנו כמתואר בזרימת העבודה שלנו. כמו כן, חשוב לציין כי בבחירת הנתונים המבניים לשחזור תלת מימדי של החלבון המבוקש, יש צורך בסקירה ראשונית של הנתונים המבניים בספרות. הבדיקה המבנית של קולטני GABAA צברה תאוצה לאחרונה עם מחקרים מבניים חזקים המדווחים על המבנה התלת מימדי של מכלולי קולטנים שונים בתנאים שונים 26,27,82,83,84,85. בהתחשב בזמינותם של נתונים אלה, במחקר שלנו, התמקדנו במבנים שנקבעו בניסוי לשחזור נתונים מבניים. עם זאת, החיזוי של AlphaFold64 עשוי להיות מועדף לניתוח חלבונים אחרים שחסרים נתונים כאלה שנקבעו בניסוי. לנתונים מבניים שמקורם במחקרים ניסיוניים, חשוב לשים לב למספור חומצות האמינו. מספור PDB של חומצות אמינו עשוי להיות שונה ממספור UniProt מכיוון שהראשון עשוי שלא לכלול את פפטיד האות שהוסר במהלך הבשלת החלבון. חוץ מזה, חלבונים כימריים המתבטאים במערכת הניסויים עלולים לגרום לאי התאמות. במקרה זה, יישור זוגי של רצף העניין עם הרצף הנגזר מהנתונים המבניים יעזור לשמור על עקביות. בספרות, הנתונים המבניים של חלבון תת-היחידה γ2 מבוססים על שיטות שונות, כולל שיטות ניסיוניות כגון מיקרוסקופ אלקטרונים (EM) ושיטת החיזוי ברמת דיוק גבוהה של AlphaFold. אם השיטה הניסיונית אינה מכסה את הרצף הרצוי במלואו ברזולוציה גבוהה, ניתן להשתמש בתחזיות AlphaFold. במחקר הנוכחי נבחר המבנה 7QNE26 מכיוון שהוא מתאים למבנה מיקרוסקופי אלקטרונים קריוגני של קולטן סינפטי אנושי באורך מלא α1β3γ2 GABAA. זה מייצג בדיוק את שילוב תת-היחידות באורך מלא, שהיה המוקד של המחקר הנוכחי.
בנוסף, לניתוח השוואתי, יש להעדיף את השימוש בפרמטרים מנורמלים של קינטיקה של ערוצים, שכן הערכים של פרמטרים אלה עשויים להשתנות בהתאם להרכב תת-יחידת הקולטן ולהגדרות הניסוי. לדוגמה,יש לקבוע את עליית τוהשבתת τ על פני שינויים פי x על ערכי הבקרה מסוג הבר. בשלב פרוטוקול 2.5, עבור מספר נמוך של וריאנטים ידועים, ניתן להעדיף ניתוח מתאם פרמטרי או קטגורי וקביעת ערכי rho ו-p. באופן אידיאלי, שיטות כגון ניתוח רכיבים עיקריים צפויות להניב קשרים מדויקים יותר אך דורשות מספר גבוה יותר של דגימות.
ניתן לשנות את סביבת הסימולציה. במחקר זה, Brian2 הועדף מהסיבות הבאות: מחלקת הנוירונים המרחביים ב-Brian2 מספקת כלי רב ערך להדמיית פעילות עצבית. ל-Brian2 יש יתרון משמעותי בשימוש במשוואות דיפרנציאליות לתיאור דינמיקה רציפה ועדכון משפטים לאירועים בדידים במקום להסתמך על מודלים מוגדרים מראש של "קופסה שחורה", וזה מוביל לקריאות קוד ויכולת הסתגלות מצוינת מכיוון שניתן להגדיר כל היבט של המודל במפורש בסקריפט Python יחיד, כאשר משוואות המודל מצוינות בסימון מתמטי ורק כמות זעירה של אוצר מילים ספציפי לבריאן בשימוש37. מכיוון שהמודל מתואר במפורש, כל התכונות מתועדות וניתן למצוא אותן בקובץ תיאור הסימולציה הראשי, מה שמבטל את הצורך במודלים של "קופסה שחורה" שהסתמכו עליהם בעבר, כפי שהוזכר במחקרים של Stimberg et al.45,86.
מודל הנוירונים הנוכחי משתמש במוליכות מסוג הודג'קין-האקסלי46 עם Na+, K+ וזרם דליפה. ניתן להרחיב עוד יותר מודל מבוסס מוליכות זה על ידי הכללת מספר סוגי ערוצים אחרים, כגון ערוצי Ca2+ . עבור מודלים של סינפסות, חשוב לציין כי יש להשיג פרמטרים אלה עבור קומפוזיציות תת-יחידות ספציפיות, ויש להעריך רק את הגרסאות עם פרמטרים שנמדדו עם קומפוזיציות אלה. במחקר זה נבחר הרכב הקולטן α1β3γ2; לכן, נכללו רק הגרסאות של α1, β3 או γ2, עם פרמטרים קינטיים של ערוץ שנמדדו על קולטן α1β3γ2 GABAA .
הערכת הביופיזיקה התאית כוללת פילוח התא למספר תאים גליליים, שלכל אחד מהם יש מאפייני מוליכות משתנים. למרות אי הסדירות בדנדריטים של נוירון, ניתן לראות אותם כגדילים הומוגניים מקומיים. מודלים כאלה מסייעים בהבנת המבנה והתפקוד המורכבים של תאים. עיצוב המודל מתמקד בגרסה פשוטה של המורפולוגיה בפועל שיכולה לשקף את התכונות הללו.
המיקום והמאפיינים הפיזיקוכימיים של חומצת האמינו שהשתנתה קובעים את ההשפעה על קינטיקה של הערוץ. לדוגמה, החלפת חומצות אמינו וכתוצאה מכך חומצת אמינו עם שרשרת צד גדולה יותר תפחית את מוליכות התעלה אם שינוי זה מתרחש על חומצת אמינו המצפה את נקבוביות התעלה. ההחלפות עשויות להשפיע גם על פתיחה/סגירה של הערוץ. לשם הפשטות במודל זה, קינטיקה של קשירת GABA מצטמצמת רק ליחס של קולטנים זמינים; עם זאת, ניתן לתכנן מודלים מפורטים יותר כך שיכללו אינטראקציה זו כדי לחקור את ההשפעה האפשרית של החלפות המשנות את זיקה קשירת ליגנד.
לסיכום, המחקר הנוכחי משתמש בשיטות חישוביות כדי לחזות וריאנטים פתוגניים בתת-יחידות הקולטן GABAA ולהעריך באופן איכותי את הפנוטיפ התאי האפשרי על סמך סימולציה של מוטציות הקשורות לאפילפסיה במודל הנוירונים הפירמידליים של ההיפוקמפוס. למיטב ידיעתנו, זהו הפרוטוקול הראשון החוקר את היישום המשולב של גנטיקה חישובית, מודלים מולקולריים וסימולציות עצביות כדי להעריך כיצד וריאנטים גנטיים עשויים לתרום לתפקוד לקוי של קולטן GABAA ברמות מורכבות מרובות, מ-DNA ועד תפקוד חלבון והתנהגות עצבית. פרוטוקול זה יכול לספק בסיס לשיפור ההערכה של וריאנטים שעלולים להזיק ופתולוגיה עצבית הקשורה באפילפסיה. בנוסף, ניתן להשתמש בו בחקר תעלות אחרות המניבות תובנות חשובות לגבי המנגנון הבסיסי של הפרעות נוירו-התפתחותיות והפרעות רשת רלוונטיות. בהתבסס על כך, על ידי שילוב ההערכות המבניות והפיזיקוכימיות של קולטן GABAA כדי לבחון את ההשפעה התפקודית של וריאנטים ושילובם בקינטיקה של הערוץ של קולטן GABAA , ניתן לפתח ניתוח מדויק יותר בעתיד.
Disclosures
כל המחברים מצהירים שאין להם ניגודי אינטרסים הקשורים לעבודה זו.
Acknowledgements
אנו מודים ל-Çağla Koca על סיועה בבניית תא העצב של המודל.
Materials
| Name | Company | Catalog Number | Comments |
| Brian2 | Sorbonne Université, INSERM, CNRS, Institut de la Vision, France; Imperial College London, United Kingdom | 2.8.0.4 | Stimberg et al., 2019 (https://pypi.org/project/Brian2/ ) |
| dbNSFP server | Genos Bioinformatics LLC, USA | v3.0 | Liu et al., 2020 (http://database.liulab.science/dbNSFP) (https://sites.google.com/site/jpopgen/dbNSFP) |
| HOPE | Centre for Molecular and Biomolecular Informatics CMBI, Radboud University, Netherlands | 1.1.1 | Venselaar et al., 2010 (https://www3.cmbi.umcn.nl/hope/) |
| Jalview | University of Dundee, UK | JV2 | Waterhouse et al., 2009 (https://www.jalview.org/) |
| Jupyter Notebook | Project Jupyter, USA | https://jupyter.org/install | |
| Phyton | Python Software Foundation, USA | 3.13 | https://www.python.org/downloads/ |
| Protter | ETH Zurich, Switzerland | Version 1.0 | Omasits, et al., 2014 (https://wlab.ethz.ch/protter/start/) |
| R | The R Foundation for Statistical Computing, USA | R version 4.3.2 | https://www.r-project.org/ |
| RStudio | Posit software, PBC, USA | RStudio 2023.12.1+402 "Ocean Storm" Release | https://posit.co/downloads/ |
References
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved