Method Article
تحديد وتصنيف متغيرات المعنى الخاطئ لمستقبلاتGABA A الخاصة بالموقف لدورها في الخلايا العصبية الهرمية في الحصين
In This Article
Summary
تقدم هذه الدراسة إطارا متعدد النطاقات ، يمتد من الحمض النووي إلى وظيفة البروتين والسلوك العصبي. يقدم نهجا جديدا للتحقيق في الطفرات المسببة للأمراض المتوقعة في الوحدة الفرعية لمستقبلات GABAA ، بافتراض أن طفرات الصرع والطفرات القريبة ، التي يتم التنبؤ بها على أنها مسببة للأمراض ، قد تنتج تأثيرات مماثلة على نموذج الخلايا العصبية الهرمية CA1.
Abstract
يعد فهم تأثيرات المتغيرات غير المعروفة وظيفيا في الجينات المرتبطة بالصرع أمرا بالغ الأهمية لتوضيح الفيزيولوجيا المرضية للمرض وتطوير علاجات مخصصة. من خلال إطار متعدد النطاقات ، يمتد من تسلسل الحمض النووي إلى وظيفة البروتين والسلوك العصبي ، نصف نهجا جديدا للتنبؤ وافحص الطفرات المسببة للأمراض ، بافتراض أن طفرات الصرع في الوحدة الفرعية لمستقبلات GABAA والطفرات المتوقعة القريبة قد تنتج تأثيرات مماثلة على نموذج الخلايا العصبية الهرمية CA1. من خلال استكشاف العلاقات المميزة بين الطفرات المسببة للأمراض المتوقعة والطفرات الصرعية القريبة ، تهدف الدراسة إلى تقدير آثار الطفرات المتوقعة بناء على تأثيرات طفرات الصرع على محاكاة الخلايا العصبية الهرمية في الحصين.
تبدأ المنهجية بجمع البيانات الجينية للوحدة الفرعية لمستقبلات GABAA γ2 ، متبوعة بتنظيف البيانات وتنسيقها التي يتم إجراؤها في R باستخدام برنامج نصي مخصص. بعد ذلك ، سيتم تطبيق تنبؤات المجموعة لتحديد وتحديد أولويات المتغيرات الخاطئة المسببة للأمراض للوحدة الفرعية γ2 . سيتم توضيح رسم خريطة متغير ممرض معين (متوقع) إلى المجالات الهيكلية للوحدة الفرعية التي تشترك فيها طفرات الصرع ، مصحوبة بالنمذجة الجزيئية لآثارها والنظر في الحفظ التطوري. بعد ذلك ، سيتم إجراء التحليل التلوي الخاص بالمتغير وتطبيع المعلمات ، متبوعا بتحليل الارتباط لتحديد أي علاقات ذات دلالة إحصائية بين الطفرات المتوقعة وطفرات الصرع القريبة. باستخدام محاكي عصبي قائم على Python ، سيتم وصف نموذج الخلايا العصبية القائم على التوصيل متعدد المقصورات ، والذي يعكس تأثير الطفرات البرية والصرع. سيتم النظر في محاكاة الاستجابات العصبية الناتجة عن النوع الفرعي لمستقبلاتGABA A المنشأ للصرع من أجل التقدير التقريبي لتأثير المتغيرات المسببة للأمراض المتوقعة على الاستجابة العصبية. على حد علمنا ، هذا هو أول بروتوكول يستكشف إطارا متعدد النطاقات لتقدير تأثيرات متغيرات مستقبلات GABAA على السلوك العصبي ، وهو أمر بالغ الأهمية لأبحاث الصرع. يمكن أن يكون هذا البروتوكول بمثابة أساس لتعزيز التنبؤات بالأنماط الظاهرية الخلوية الناجمة عن المتغيرات المسببة للأمراض المحتملة لمستقبلات GABAA المرتبطة بالصرع.
Introduction
بالنسبة لجميع الأمراض البشرية تقريبا ، يلعب التباين الجيني دورا مهما في القابلية الفردية. لذلك ، فإن فهم كيفية ارتباط اختلافات التسلسل بمخاطر المرض يوفر طريقة قيمة للكشف عن العمليات الرئيسية التي ينطوي عليها تطور المرض وتحديد مناهج جديدة للوقاية والعلاج1. ينطبق هذا أيضا على اضطرابات النمو العصبي ، والتي تصنف من بين الحالات الطبية المزمنة الأكثر انتشارا في الرعاية الأولية للأطفال2. توضح حالات مثل اضطراب طيف التوحد والإعاقة الذهنية والصرع كيف يؤثر التباين الجيني بشكل كبير على قابلية الفرد أثناء التطور3.
يكون الدماغ النامي أكثر عرضة لنوبات الصرع من الدماغ البالغ بسبب عدم تطابق النمو العصبي المبرمج وراثيا في التوازن الحاسم بين الإثارة والتثبيط4. نظرا لأن GABA (حمض جاما أمينوبوتيريك) ، وهو الناقل العصبي المثبط الأساسي في دماغ البالغين ، مثير أثناء التطور الجنيني والمبكر بعد الولادة ، فإن هذا ليس مواتيا للاستقرار اللازم لمنع النوبات في أدمغة الشباب. هذه الحالة المؤقتة ، الناجمة عن عدم وجود تعبير كاف عن الناقلات المشتركة K-Cl5 ، يمكن أن تسهم في زيادة خطر نشاط النوبة في وجود مستقبلات GABAA المختلة. تتوسط مستقبلات GABAA الإجراءات المثيرة والمثبطة ل GABA, اعتمادا على التركيز داخل الخلايا من Cl- أيون6. وبالتالي ، مع نضوج الدماغ ، يمكن أن تسبب الطفرات في جينات ترميز مستقبلات GABAA ، وكذلك في القنوات الأيونية الأخرى ، الاستثارة ، والطفرات في الجينات المشاركة في التمثيل الغذائي للخلايا العصبية ، وإشارات الخلايا ، وتكوين المشبك7 ، حالات مثل صرع غيابالطفولة 8.
تستفيد التدخلات السريرية بشكل متزايد من التحليل الجيني لتحسين الدقة في علاج اضطرابات النمو العصبي2. يقدم الاختبار الجيني في صرع الأطفال أهدافا محتملة لمناهج الطب الدقيق9 ، مما يسلط الضوء على أهمية المتغيرات الجينية في توجيه قرارات العلاج. بالإضافة إلى ذلك ، يتلقى ~ 25٪ من مرضى الصرع الذين يعانون من طفرات من جديد تشخيصات جينية تحدد الأهداف المحتملة للطب الدقيق ، مما يؤكد القيمة الكبيرة للمتغيرات الجينية في توجيه قراراتالعلاج 10. وقد تم تغذية ذلك من خلال التطورات في تقنيات تسلسل الجيل التالي ، مثل لوحات الجينات المستهدفة ، وتسلسل الإكسوم الكامل ، وتسلسل الجينوم الكامل ، والتي أدت إلى تسريع الاكتشافات الجينية بشكل كبير11. ومع ذلك ، فإن العدد المتزايد من الاكتشافات الجينية الجديدة يأتي مع تحد عندما تسفر النتائج عن متغير غير معروف الأهمية (VUS) ، وهو تصنيف يعكس أدلة متضاربة أو معلومات غير كافية فيما يتعلق بالدور الجزيئي للمتحور في التسبب في المرض. تتوافق المتغيرات المصنفة على أنها VUS مع فئة واحدة ضمن نظام تصنيف المتغيرات المكون من خمسة مستويات الذي اقترحته الكلية الأمريكية لعلم الوراثة الطبية وعلم الجينوم (ACMG) وجمعية علم الأمراض الجزيئي (AMP) 12.
تتطلب معالجة التحدي المتمثل في المتغيرات الجينية غير المعروفة وظيفيا بذل جهود عبر بعدين رئيسيين: الممارسة السريرية والبحث. سريريا ، يمكن أن يؤدي عدم اليقين المحيط ب VUS إلى تعقيد إدارة المرضى واتخاذ القرار13. من منظور البحث العلمي ، يعد تحديد المتغيرات المسببة للأمراض بين العدد المتزايد من المتغيرات ذات الأهمية غير المؤكدة وتحديد أدوارها في الفيزيولوجيا المرضية للمرض وتأثيرات النمط الظاهري أمرا بالغ الأهمية1. قد يتضمن أحد السيناريوهات المثالية التنبؤ بدقة بالتأثيرات الجزيئية والعصبية ومستوى الشبكة لجميع المتغيرات غير المميزة وظيفيا ، وبالتالي تقليل الموارد والوقت والجهد المطلوب للتحقيقات المعملية تؤكد هذه الجوانب على أهمية تصنيف المتغيرات الجينية بدقة لتمكين التشخيص الدقيق للصرع الوراثي ، ودعم العلاج الشخصي ، وتسهيل اكتشاف الأهداف الدوائية المحتملة. الأدوات التنبؤية الحالية14،15،16،17 دقيقة نسبيا ولكنها عادة ما توفر تصنيفات ثنائية فقط (مسببة للأمراض مقابل حميدة) وتفتقر إلى رؤى خاصة بالمرض في الفيزيولوجيا المرضية الجزيئية ، والعواقب المظهرية ، والآليات الأساسية. مع التركيز على المتغيرات غير المعروفة للمعنى الخاطئ لجينات ترميز الوحدة الفرعية لمستقبلات GABAA المختارة ، تقدم هذه الورقة إطارا يهدف إلى تعزيز التوجيه البحثي من خلال دمج العوامل السياقية للمتغيرات مثل الجوانب الجزيئية والتطورية والهيكلية ، بالإضافة إلى محاكاة علم الأمراض العصبي المستمدة من البيانات الفيزيائية الحيوية في المختبر للطفرات المرتبطة بالصرع. تتناول منهجيتنا تحديد المتغيرات المسببة للأمراض غير المعروفة للوحدة الفرعية γ2 لمستقبلات GABAA ، وهي وحدة فرعية رئيسية تشارك في الفيزيولوجيا المرضية للصرع18،19،20. يتبع ذلك استكشاف المطابقة الخاصة بالموضع لهذه المتغيرات المتوقعة مع الطفرات المرتبطة بالصرع التي تتميز بالبيانات الهيكلية والفيزيولوجية الكهربية. ثم يتم استخدام هذه البيانات لتقدير التأثير المتغير على نموذج للخلايا العصبية الهرمية في الحصين التي تعبر عن نوع فرعي لمستقبلات GABAA ، تتكون من وحدات فرعية γ2 و α1 و β3 (مستقبلات γ2-GABAA) ، المسؤولة عن التثبيط المشبكيالسريع 6. من المهم ملاحظة أن مستقبلات GABAA تتجمع من مجموعة وحدات فرعية كبيرة (α1-α6 ، β1-β3 ، γ1-γ3 ، δ ، Ε ، θ ، π ، و ρ1-ρ3) واعتمادا على تكوين الوحدة الفرعية ، تختلف مستقبلات GABAA في تعديلها ، وخصائصها الفيزيائية الحيوية ، بالإضافة إلى أنماط التعبير الإقليمية والخلوية وتحت الخلوية إلى جانب وظائف محددة6،21،22،23 ، 24،25. وبالتالي ، تركز الدراسة الحالية على مستقبلات γ2-GABAA أو مستقبلات GABAA المحتوية على γ2 فقط.
تتكون الوحدات الفرعية لمستقبلات GABAA من سمات هيكلية مميزة - مجال طويل خارج الخلية الطرفية N (ECD) ، وأربعة مجالات تمتد عبر الغشاء (TM1 إلى TM4) ، ورابط داخل الخلايا يربط TM1 و TM2 ، ورابط خارج الخلية يربط TM2 و TM3 ، وحلقة كبيرة داخل الخلايا بين TM3 و TM4 (حلقة TM3-TM4) ، ومحطة C قصيرة خارج الخلية6،26 ، 27. يقترح أن يعمل مستقبل GABAA عبر آلية معقدة "قفل وسحب" ، حيث يقوم ربط GABA بقفل الوحدات الفرعية β و α ، مما يجعلها تسحب المجالات خارج الخلية (ECDs) للوحدات الفرعية ، وتدويرها عكس اتجاه عقارب الساعة27. تعمل هذه الحركة على ثني مجالات الغشاء (TMDs) ، وبالتالي فتح القناة الأيونية27. وبالتالي ، يبدو أن نشاط القناة منسق مع الكاسيت الهيكلي داخل مستقبلات GABAA. اتضح أن طفرات الصرع تسبب خللا وظيفيا في نشاط القناة عن طريق تشويه هذه الكاسيت الهيكلية28. وبالتالي ، تستند دراستنا إلى فكرة أن المتغيرات المسببة للأمراض المتوقعة بالقرب من طفرات الصرع المحددة وظيفيا في الكاسيتات الهيكلية المحددة للوحدات الفرعية لمستقبلات GABAA قد تظهر أنماطا مماثلة من التشويه الفيزيائي الكهربي أو الفيزيائي الحيوي في وظيفة القناة ، كما لوحظ في حالات هذه الطفرات الصرعية. في حين أن وجود أشرطة هيكلية مسببة للصرع في الوحدات الفرعية لمستقبلات GABAA 28 يدعم هذه الفكرة بشكل غير مباشر ، توضح دراستنا تعقيد وتحدي ربط المعلمات الفيزيائية الحيوية لطفرات الصرع مع تلك الخاصة بالطفرات المسببة للأمراض المتوقعة. للكشف عن هذه العلاقات المعقدة ، يعد إطار عملنا مهما لأنه يسلط الضوء على نهج متعدد النطاقات يتراوح من الحمض النووي إلى وظيفة البروتين والسلوك العصبي الحاسم لأبحاث الصرع. يدمج هذا النهج علم الوراثة الحسابي مع النمذجة الجزيئية والمحاكاة العصبية مع التأكيد أيضا على أهمية الأساليب التكميلية ، مثل التعلم الآلي المدرب على مجموعات البيانات الكبيرة ، والتي يمكن أن تلتقط تأثيرات الطفرات على بنية القناة والنشاط والاستثارة العصبية. بالإضافة إلى ذلك ، تسمح محاكاة نشاط مستقبلات γ2-GABAA المنشأ للصرع على نموذج الخلايا العصبية الهرمية للحصين بتكرار النمط الظاهري الخلوي في المختبر المرتبط باعتلال قناة مستقبلات GABAA وإظهار استجابات الخلايا العصبية المفردة المتغيرة في مركز الخلل الوظيفي في الشبكة.
Protocol
1. في التنبؤ بالسيليكو للمتغيرات المسببة للأمراض
- جمع بيانات المتغير
- باستخدام قاعدة بيانات ClinVar29 ، ابحث عن المتغيرات ذات الأهمية غير المؤكدة (VUS) في منطقة الترميز للجين محل الاهتمام عبر موقع الويب: https://www.ncbi.nlm.nih.gov/clinvar/. أدخل رمز الجين (على سبيل المثال ، GABRG2) في شريط البحث وقم بتصفية النتائج لتشمل فقط الأنواع المطلوبة من المتغيرات ، مثل المتغيرات أحادية النيوكليوتيدات ، والمتغيرات الخاطئة ذات الأهمية غير المؤكدة. قم بتنزيل البيانات وحفظها ك data.xlxs (الملف التكميلي 4: الجدول التكميلي S1). سجل تاريخ البيانات التي تم تنزيلها.
ملاحظة: في البروتوكول الحالي ، سيتم تحليل الوحدة الفرعية البشرية γ2 لمستقبلاتGABA A ، وتحديدا الوحدة الفرعية لمستقبلات حمض جاما أمينوبوتيريك من النوع A Homo sapiens gamma2 (GABRG2) ، متغير النسخ 1 ، mRNA (NCBI Ref. seq.: NM_198904.4) ، المعروف أيضا باسم γ2L. من المهم تسجيل النسخة المرجعية للجين محل الاهتمام بالإضافة إلى المعرفات المقابلة الأخرى عبر قواعد البيانات المختلفة (UniProt و ENSEMBL و PDB) نظرا لأن الطرق الحسابية المختلفة قد تتطلب معرفات مختلفة (الملف التكميلي 4: الجدول التكميلي S2). في حالة عدم تعرف قاعدة البيانات أو الأداة الحسابية على أرقام إصدارات معرفات التسلسل، جرب كلا من المعرف برقم الإصدار (NM_198904.4) وبدون رقم الإصدار (NM_198904). - المعلومات الأساسية للبروتين المرجعي
- في https://www.ncbi.nlm.nih.gov/ قاعدة بيانات NCBI ، حدد النيوكليوتيدات في خيارات البحث وأدخل NCBI Ref. seq. معرف الجين محل الاهتمام (NM_198904.4). بعد ذلك ، من خلال التمرير لأسفل في العمود الأيمن ، انقر فوق البروتين ضمن فئة المعلومات ذات الصلة للعثور على البروتين (NP_944494.1) المشفر بواسطة النص NM_198904.4. باستخدام المعلومات المقدمة للبروتين NP_944494.1 ، سجل مواضع التسلسل للمناطق المحددة في شكل جدول (الملف التكميلي 4: الجدول التكميلي S3).
ملاحظة: من المهم تحديد المعلومات الأولية المعروفة لموضع التسلسل للمناطق أو الزخارف أو المخلفات الحرجة وظيفيا وهيكليا مثل مجالات البروتين ومواقع الفسفرة ومواقع ربط الترابط وواجهات التفاعل الجزيئي. يمكن تحقيق ذلك من خلال الجمع بين قاعدة البيانات (NCBI و ENSEMBL و UniProt ...) والبحث في الأدبيات.
- في https://www.ncbi.nlm.nih.gov/ قاعدة بيانات NCBI ، حدد النيوكليوتيدات في خيارات البحث وأدخل NCBI Ref. seq. معرف الجين محل الاهتمام (NM_198904.4). بعد ذلك ، من خلال التمرير لأسفل في العمود الأيمن ، انقر فوق البروتين ضمن فئة المعلومات ذات الصلة للعثور على البروتين (NP_944494.1) المشفر بواسطة النص NM_198904.4. باستخدام المعلومات المقدمة للبروتين NP_944494.1 ، سجل مواضع التسلسل للمناطق المحددة في شكل جدول (الملف التكميلي 4: الجدول التكميلي S3).
- باستخدام قاعدة بيانات ClinVar29 ، ابحث عن المتغيرات ذات الأهمية غير المؤكدة (VUS) في منطقة الترميز للجين محل الاهتمام عبر موقع الويب: https://www.ncbi.nlm.nih.gov/clinvar/. أدخل رمز الجين (على سبيل المثال ، GABRG2) في شريط البحث وقم بتصفية النتائج لتشمل فقط الأنواع المطلوبة من المتغيرات ، مثل المتغيرات أحادية النيوكليوتيدات ، والمتغيرات الخاطئة ذات الأهمية غير المؤكدة. قم بتنزيل البيانات وحفظها ك data.xlxs (الملف التكميلي 4: الجدول التكميلي S1). سجل تاريخ البيانات التي تم تنزيلها.
- تنظيم البيانات المتغيرة
- تنظيم البيانات لتلبية متطلبات الإدخال للتنبؤات المختارة. تأكد من تنظيم تنسيق البيانات التي تم استردادها ليتوافق مع متطلبات http://database.liulab.science/dbNSFP خادم dbNSFP. للقيام بذلك، قم بإزالة الأعمدة غير الضرورية من الملف data.xlsx (الملف التكميلي 4: الجدول التكميلي S1 من الخطوة 1.1.1)، مع الاحتفاظ بالأعمدة التالية فقط بالترتيب المحدد:
"كروموسوم GRCh38" ، "GRCh38Location" ، "الاسم" ، "تغيير البروتين". - احفظ الملف تحت اسم ملف جديد: "data1.xlsx" (الجدول التكميلي S4). قم بتهيئة الملف data1.xlsx في R عن طريق تشغيل التعليمات البرمجية (الملف التكميلي 1: Data_GABAA. R) ، والتي ستحفظ البيانات المنسقة بصيغة data1_output.xlsx (الملف التكميلي 4: الجدول التكميلي S5) في دليل العمل ذي الصلة بمشروع R.
ملاحظة: تتطلب الطرق الحسابية المختلفة أنواعا وتنسيقات بيانات مختلفة. يمكن أن يكون جمع البيانات وتنظيمها وفقا لمتطلبات التنسيق المحددة ، حتى بالنسبة لعشرات المتغيرات ، عرضة للأخطاء وتستغرق وقتا طويلا ، لذا فإن هذه الخطوة مهمة ما لم يكن تجمع المتغيرات يتكون من عدد قليل من المتغيرات فقط. بعد ذلك ، قد يكون التنظيم اليدوي للبيانات ممكنا.
- تنظيم البيانات لتلبية متطلبات الإدخال للتنبؤات المختارة. تأكد من تنظيم تنسيق البيانات التي تم استردادها ليتوافق مع متطلبات http://database.liulab.science/dbNSFP خادم dbNSFP. للقيام بذلك، قم بإزالة الأعمدة غير الضرورية من الملف data.xlsx (الملف التكميلي 4: الجدول التكميلي S1 من الخطوة 1.1.1)، مع الاحتفاظ بالأعمدة التالية فقط بالترتيب المحدد:
- التنبؤ بالإمراضية
- انقل محتوى الملف data1_output.xlsx إلى الإصدار الأكاديمي من خادم dbNSFP30،31 الذي تم الوصول إليه عبر http://database.liulab.science/dbNSFP. للقيام بذلك ، قم بنسخ / لصق الملف أو تحميله مباشرة بتنسيق .txt .
- تأكد من تحديد الخيارات التالية مسبقا وتأكيدها في الخادم: HG38 (بناء الجينوم) و ClinPred32 و BayesDEL33 قبل الإرسال. في غضون بضع دقائق ، سيقوم الخادم بإنشاء النتائج.
ملاحظة: في البروتوكول الحالي ، تم اختيار اثنين من المتنبئين الجماعيين ، وهما BayesDEL33 و ClinPred32 ، للدقةالعالية 34 والتطبيق العملي. ومع ذلك ، يمكن أيضا تحديد تنبؤات أخرى ، مثل AlphaMissense ، المتوفرة في قاعدة بيانات dbNSFP30،31 . يعتمد اختيار أدوات السيليكو على عدة عوامل ، بما في ذلك توليد خطوط متعددة كافية من الأدلة الحسابية للتنبؤ القوي12. يمكن أن تخدم التنبؤات الجماعية التي تدمج تحليل الخوارزميات التنبؤية المتعددة هذا الغرض. - قم بتنزيل ملف الإخراج (بتنسيق .txt) واحفظه بتنسيق data2.xlsx (الملف التكميلي 4: الجدول التكميلي S6).
- قم بتعيين المرشحات في data2.xlsx (الملف التكميلي 4: الجدول التكميلي S6) بالنقر فوق خيار التصفية في القائمة وتحديد متغيرات الإجماع في كلا العمودين عن طريق التصفية ل D. سيعطي هذا قائمة بأكثر المتغيرات مسببة للأمراض. احفظه (انظر علامة تبويب الإجماع في الجدول التكميلي S6 [الملف التكميلي 4]).
- اختيار المتغير
- من بين التنبؤات المسببة للأمراض بالإجماع ، حدد المتغيرات في قرب طفرات الصرع التي تم الحصول عليها من الأدبيات. تأكد من أن هذا الأخير يحتوي على معلمات هيكلية وفيزيائية حيوية مناسبة لنمذجة الخلايا العصبية.
ملاحظة: هذه الخطوة استكشافية وترتبط أيضا بمسح البروتين محل الاهتمام من حيث معاييره الهيكلية والفيزيائية الكيميائية والفيزيائية الحيوية. في هذه الدراسة ، تم الحصول على هذه البيانات من Brünger et al.35 و Guo et al.36 بالإضافة إلى مسح الطفرات المرتبطة بالصرع. إلى جانب ذلك ، كخيار ، تم الوصول إلى درجات AlphaMissense37 من قاعدة بيانات dbNSFP30،31 تكرارا الخطوة 1.3 (الملف التكميلي 4: الجدول التكميلي S7). ويرد مزيد من التفاصيل في قسمي البروتوكول 2-1-1 و2-1-2 وفي النتائج (انظر "المتغيرات التجميعية للمعلمات الهيكلية والفيزيائية الحيوية"). - للتصور الأساسي ، استخدم خوادم Protter38 ((https://wlab.ethz.ch/protter/start/) و HOPE39 (https://www3.cmbi.umcn.nl/hope/) لفحص المتغيرات في الخطوة السابقة في سياق طفرات جينية GABRG2 المختارة: P302L40 و K328M (أو K289M41 ، عند استبعاد ببتيد إشارة 39 متبقيا).
ملاحظة: نظرا للتعقيد الهائل ، يجب إجراء التقييم الهيكلي للتأثيرات المتغيرة على مستويات متعددة من التحليل. ستسمح أدوات مثل Protter38 بالتصور الواضح للمتغيرات في سياق الميزات الطوبولوجية للبروتين ، وستعطي الخوادم سهلة الاستخدام مثل HOPE39 نظرة ثاقبة للتأثير المتغير عن طريق النمذجة الجزيئية. بالإضافة إلى ذلك ، تعد مراجعة الأدبيات الشاملة للبروتين محل الاهتمام أمرا بالغ الأهمية لتحديد ودمج المعلومات حول الطفرات المرتبطة بالصرع. - تحليل الحفظ التطوري والرؤى الهيكلية
- افتح Jalview42،43،44 ، وهو برنامج مفتوح المصدر لتحرير البروتينات وتصورها وتحليلها.
- استيراد التسلسلات للمحاذاة. انقر فوق ملف في القائمة العلوية | جلب التسلسلات. حدد قاعدة البيانات في مربع الحوار (مثل UniProt) ؛ انقر فوق علامة التبويب استرداد المعرفات ؛ وكما هو موضح في مربع الحوار ، أدخل معرفات انضمام UniProt للجين محل الاهتمام (GABRG2) من الأنواع البشرية والفقاريات الأخرى: P18507 ، P22723 ، Q6PW52 ، A0A2I3TKX0 ، F1RR72 ، A0A8I3MDZ2 ، A0A8M1P4D6. انقر فوق موافق.
ملاحظة: أرقام انضمام UniProt للبروتينات المشفرة بواسطة GABRG2 هي كما يلي: P18507 (P18507-2) ل Homo sapiens ، P22723 ل Mus musculus ، A0A2I3TKX0 ل Pan troglodytes ، F1RR72 ل Sus scrofa ، A0A8I3MDZ2 ل Canis familiaris ، و A0A8M1P4D6 ل Danio rerio. - اعتمادا على الجين محل الاهتمام ، قد لا يتم شرح بعض التسلسلات. لذلك ، قم بإجراء بحث BLAST لتحديد المعلومات ذات الصلة والمتماثلات المحتملة لفهم سياقي أفضل. في هذه الحالة ، قم بتحميل تنسيق FASTA لتسلسلات البروتين عبر خيار إضافة تسلسلات / من ضمن ملف القائمة لإنتاج محاذاة تسلسل متعددة للتسلسلات المطلوبة.
- بمجرد تحميل المحاذاة ، راقب التسلسلات المعروضة لمقارنة التسلسل المتعدد. يمثل كل صف تسلسلا، ويمثل كل عمود موضعا في المحاذاة. لتحديد أفضل طريقة للمحاذاة ، استخدم مناهج مختلفة ؛ على سبيل المثال ، انقر فوق خدمات الويب في قائمة التسلسل وحدد خيار تشغيل T-Coffee مع الضبط المسبق ، والذي يسمح بالمحاذاة المثلى.
- انقر بزر الماوس الأيمن على التسلسل P18507 Homo sapiens (التسلسل المرجعي في الدراسة الحالية) وقم بتعيينه كتسلسل مرجعي. اختر تنسيق في القائمة العلوية وانقر على التفاف لتصور المحاذاة الكاملة في الشاشة. في نفس قائمة التنسيق ، انقر فوق المقياس أعلاه لتحسين تصور أرقام بقايا معينة. لزيادة تحسين التصور ، اضبط أنظمة الألوان بالانتقال إلى اللون وتحديد خيارات مختلفة (على سبيل المثال ، اللون المزخرف ، الخاصية الكيميائية) ؛ قم بتعديل حجم الخط إذا لزم الأمر.
- انقر فوق حساب في شريط القائمة وحدد حساب تلقائي للإجماع لتمييز المناطق المحفوظة.
- ركز على موضع المتغيرات ذات الأهمية المحددة في خطوة التنبؤ في السيليكو وفحص مواضع متغيرة محددة. قم بالتعليق على بقايا معينة عن طريق النقر بزر الماوس الأيمن عليها وتحديد إضافة تعليق توضيحي. اكتب التسمية (على سبيل المثال ، معرف المتغير) برمز اللون المناسب واحفظها.
ملاحظة: في التحليل الحالي ، تم اختيار P302L (أرجواني) و A303T (أحمر) لتصورهما في محاذاة التسلسل المتعدد جنبا إلى جنب مع البيانات الهيكلية (انظر القسم التالي).
- إعادة بناء ثلاثية الأبعاد للبروتين الكامل تظهر المخلفات المحفوظة المختارة
- في الملف الذي تم الحصول عليه من الخطوة السابقة ، انقر بزر الماوس الأيمن فوق التسلسل المرجعي (GABRG2 human) وحدد بيانات الهيكل ثلاثي الأبعاد.
- حدد البيانات الهيكلية المناسبة (7QNE، السلسلة C)26 من القائمة المنسدلة وحدد فتح عرض هيكل جديد باستخدام Jmol.
ملاحظة: سيسمح ذلك بدمج المخلفات المحددة في محاذاة التسلسل المتعدد في البيانات الهيكلية بواسطة Jmol ، وهو عارض مفتوح المصدر قائم على Java للهياكل الكيميائية ثلاثية الأبعاد.
- من بين التنبؤات المسببة للأمراض بالإجماع ، حدد المتغيرات في قرب طفرات الصرع التي تم الحصول عليها من الأدبيات. تأكد من أن هذا الأخير يحتوي على معلمات هيكلية وفيزيائية حيوية مناسبة لنمذجة الخلايا العصبية.
2. اختيار المعلمة والنمذجة الفيزيائية الحيوية
- التحليل التلوي الخاص بالمتغير وتطبيع المعلمات
- مسح الأدبيات الحالية لجمع متغيرات الوحدة الفرعية المحددة مع توصيل قناة البيانات الفيزيولوجية الكهربية (gGABAA) ، ووقت التعطيل (إلغاء تنشيط τ) ، ووقت الارتفاع (ارتفاع τ) ، والحد الأقصى للسعة الحالية (Imax). قم بتوفير تركيبات الوحدات الفرعية ونوع الخلية وقياسات النوع البري لكل حالة. قم بتسمية المتغيرات ومراقبتها وفقا لذلك (على سبيل المثال ، المعروفة بالمتغيرات ذات الخصائص الفيزيائية الحيوية المحددة والتحكم المعروف لقياسات النوع البري لكل متغير).
- الحصول على درجات الإمراضية AlphaMissense للمتغيرات ذات الخصائص الفيزيائية الحيوية المحددة.
ملاحظة: انظر قسم البروتوكول 1.3 لمزيد من التفاصيل. - قم بإنشاء إطار بيانات مع الوحدة الفرعية وموضع الأحماض الأمينية لكل متغير ، والأحماض الأمينية الأصلية والمتغيرة ، ودرجة الإمراضية ، والمعلمات الفيزيائية الحيوية التي تم الحصول عليها من الأدبيات. لتجنب التناقضات التجريبية ، قم بتطبيع المعلمات الفيزيائية الحيوية للمتغيرات المحددة كتغييرات x في قياسات النوع البري.
- تحليل المتغيرات المقارن حسب الخصائص الهيكلية والوظيفية
- تنظيم المتغيرات المتوقعة على إطار البيانات ؛ التسمية وفقا لذلك (على سبيل المثال ، متوقعة للمتغيرات التي لا تتوفر فيها الأدبيات حول خصائصها الفيزيائية الحيوية).
- تصنيف المتغيرات حسب موقعها في تسلسل الأحماض الأمينية والبنية الثالثة. أضف معلمات التصنيف الهيكلي (على سبيل المثال ، التوطين في حلزونات ألفا ، والملفات ، وأوراق بيتا ، والمجالات خارج الخلية ، أو داخل الخلايا أو عبر الغشاء ، وبطانة المسام ، وربط ناهض ، وتفاعلات البروتين والبروتين) على إطار البيانات وقدم معلومات لكل متغير فيما يتعلق بموضع الأحماض الأمينية.
- صنف المتغيرات حسب المسافة إلى مركز الغشاء ومحور المسام. أضف مسافة إلى محور المسام والمسافة إلى معلمات مركز الغشاء على إطار البيانات.
- تحليل العلاقة بين المعلمات الهيكلية والفيزيائية الحيوية على المتغيرات المعروفة. إذا أمكن ، قم بتقييم المتغيرات المتوقعة فيما يتعلق بالارتباطات التي تم الحصول عليها.
- بناء نموذج المشبك والخلايا العصبية
- استخدم Brian245 ، وهو محاكي عصبي مفتوح المصدر تم تطويره في Python لنمذجة ومحاكاة الشبكات العصبية المتصاعدة ، لبناء نموذج فيزيائي حيوي متعدد الأجزاء لمشبك GABAergic على خلية عصبية هرمية متعددة الأجزاء قائمة على الموصلية متعددة الجزءات.
- صمم النموذج القائم على الموصلية من خلال تحديد حركية بوابات القناة الأيونية والمعلمات السلبية والنشطة وموصلات ما بعد المشبكي. حدد النموذج المستند إلى الموصلية كما هو موضح في الملف التكميلي 2 ، والذي يصف المعادلات المستخدمة في النموذج.
- اضبط سعة الغشاء (Cm) على أنها 1 μF / cm2 والمقاومة داخل الخلايا (Ra) على أنها 200 Ω.cm.
- استخدم الموصليات المعدلة من نوع هودجكين هكسلي للخلايا العصبية الهرمية للحصين39 مع gL = 0.0003 S / cm2 ، gK = 0.036 S / cm2 ، EL = -76.5 mV ، ENa = 50 mV ، و EK = -90 mV.
- اضبط توزيع كثافة قنوات NaV على gNa ك 0.05 S / cm2 ل soma ، و 0.5 S / cm2 للمقطع الأولي المحوري (AIS) وعقدة Ranvier (NR) ، و 0.005 S / cm2 للتشعبات. اضبط gK و gNa على أنها 0 في المقاطع النخاعي.
- بناء حركية بوابات القناة الأيونية ل NaV و KV كما هو موضح في الملف التكميلي 2.
- إدخال التيارات المشبكية (أناsyn) كمجموع لجميع نقاط الاشتباك العصبي الجلوتاماتيرجيك و GABAergic في مقصورة. قم بتضمين كل من التيار السريع بوساطة مستقبلات AMPA (IAMPA) والتيار البطيء بوساطة مستقبلات NMDA (INMDA) في التيار الغلوتاماتيرجيك (Iglu). قم بتضمين تيار سريع بوساطة مستقبلات GABAA فقط في تيار GABAergic (IGABA). افترض أن كمية ثابتة من الغلوتامات يتم إطلاقها إلى المشبك لكل ارتفاع قبل المشبكي. لذلك ، فإن تنشيط المستقبلات يعتمد على وقت السنبلة (sAMPA وs NMDA) وتعكس الموصليات الكلية للمستقبلات (gAMPA و gNMDA) كمية الغلوتامات التي يتم إطلاقها بواسطة كل حدث.
- استخدم النموذج المشبكي كما هو موضح في الملف التكميلي 2.
ملاحظة: للحصول على شرح مفصل للمعادلات ، راجع الملف التكميلي 2 الذي يصف المعادلات المستخدمة في النموذج.
- احصل على القطر المقاس تجريبيا للسوما والعصبيات وطول كل حجرة عصبية وأنماط متفرعة من الأدبيات السابقة46،47. تقليل مورفولوجيا الخلايا العصبية الحقيقية إلى نموذج متعدد الأجزاء ، عن طريق تقسيم الخلية إلى مقصورات متعددة ، تحافظ بدقة على الهيكل المتفرع الرئيسي وتحافظ على التماثل الثنائي.
- اضبط المورفولوجية (طول القطعة وقطرها ؛ أي d_soma: 30 ميكرومتر ؛ l_AH: 5 ميكرومتر ؛ d_AH_i: 1.5 ميكرومتر ؛ d_AH_f: 1.3 ميكرومتر ؛ l_AIS: 40 ميكرومتر ؛ d_axon: 1 ميكرومتر ؛ l_myseg: 100 ميكرومتر ؛ l_NR: 2 ميكرومتر ؛ l_AxTer: 4 ميكرومتر ؛ d_AxTer: 2 ميكرومتر ؛ l_approx: 100 ميكرومتر ؛ l_apmed: 100 ميكرومتر ؛ l_apdis: 200 ميكرومتر ؛ d_approx_i: 4 ميكرومتر ؛ d_approx_f: 3 ميكرومتر ؛ d_apmed : 2 ميكرومتر ؛ d_apdis: 2 ميكرومتر ؛ l_apLM: 70 ميكرومتر ؛ d_apLM: 2 ميكرومتر ؛ l_nAcDbasal: 400 ميكرومتر ؛ d_nAcDbasal: 1.4 ميكرومتر؛ l_nAcDbasal_stem: 20 ميكرومتر ؛ d_nAcDbasal_stem: 1.5 ميكرومتر) والمعلمات الفيزيائية الحيوية (كما هو موضح في القسم 2.3.2) لكل جزء من نموذج الخلايا العصبية الهرمية46،47 كما هو مفصل أيضا في نص بايثون (الملف التكميلي 3: GABAAvar.py).
- تحديد المعلمات الفيزيائية الحيوية لنموذج المشبك GABAergic من خلال تقييم قياسات التحكم من النوع البري التي تم الحصول عليها في الخطوة 2.1.1.
- تصميم طوبولوجيا نموذج الخلايا العصبية وتعيين المعلمات المورفولوجية والفيزيائية الحيوية ، والتي تشمل تحديد الترتيب المكاني والترابط للمقصورات ، بناء على المعلومات المورفولوجية والمتفرعة التي تم الحصول عليها مسبقا. قم بتعيين المعلمات المورفولوجية المناسبة (على سبيل المثال ، طول القطعة وقطرها) والمعلمات الفيزيائية الحيوية (القسم 2.3.2) لكل جزء من النموذج ، كما هو موضح في الملف التكميلي 3: GABAAvar.py.
- بناء نقاط الاشتباك العصبي والحقن الحالي
- قم بإنشاء نشاط ما قبل المشبكي باستخدام SpikeGeneratorGroup (فئة من مكتبة Brian2) كما هو موضح في "GABAAvar.py" (الملف التكميلي 3). قم بتوصيل مولد السنبلة بالمقصورة المستهدفة للخلايا العصبية النموذجية باستخدام فئة Synapses لنمذجة الوصلات المتشابكة.
- قم بتعيين تيار ثابت مستمر (Iinj) على أنه 0.85 nA وضعه في soma لتقليد نشاط العتبة الفرعية المدفوع بحمل التيار الأيوني الأساسي في وقت معين كما هو موضح في الملف التكميلي 3: GABAAvar.py.
- لإنشاء شاشات تسجيل ، قم بتسجيل آثار الجهد من المقصورات المستهدفة باستخدام StateMonitor.
- بناء الشبكة وتشغيلها.
- قم ببناء الشبكة باستخدام الخلية العصبية النموذجية والاتصالات والشاشات باستخدام الشبكة.
- قم بتعيين الخطوة الزمنية للمحاكاة بواسطة defaultclock.dt (على سبيل المثال ، 0.01 مللي ثانية).
- قم بتشغيل المحاكاة على الشبكة باستخدام network.run(T*ms)، حيث يتم تعيين T على أنه 1,000 مللي ثانية في المثال.
- اختبار تأثير طفرات سوء فهم مستقبلاتGABA A
- حدد تأثير كل طفرة خاطئة على حركية القناة من خلال المعلمات الفيزيائية الحيوية التي تم جمعها في الخطوة 2.1.1.
- قم بتشغيل التحفيز عن طريق تغيير هذه المعلمات ورسم النتائج باستخدام "matplotlib.pyplot" كما هو موضح في "GABAAvar.py" (الملف التكميلي 3).
- مجموعات المعلمات التجريبية لتحليل التغييرات في أنماط ومعدلات إطلاق النار. ارسم نتائج المقارنات.
النتائج
تستخدم هذه الدراسة نهجا متعدد النطاقات للتنبؤ بالمتغيرات المسببة للأمراض وتوصيفها في الوحدة الفرعية γ2 لمستقبلات GABAA ، وهو مكون رئيسي في الفيزيولوجيا المرضية للصرع. من خلال استخدام النماذج التنبؤية ، والنمذجة الجزيئية ، والحفظ التطوري ، والفحص الهيكلي ، وتحليل الارتباط ، والمحاكاة العصبية ، يعزز هذا النهج تصنيف المتغيرات ، مع أهمية كبيرة لأبحاث الصرع وربما للاستخدام السريري. يتم عرض الملخص العام للمنهجية في الشكل 1.
تقييم مقارن لطفرتين متجاورتين للوحدة الفرعية γ2
بناء على افتراضنا أن الطفرات المسببة للأمراض المتوقعة المجاورة لطفرات الصرع في الوحدات الفرعية لمستقبلات GABAA قد تنتج تأثيرات فيزيولوجية كهربية مماثلة على وظيفة القناة والسلوك العصبي ، أجرينا أولا فحصا موجزا للعلاقة بين طفرة صرع معروفة وطفرة قريبة متوقعة من γ2 الوحدة الفرعية.
من بين المتغيرات المتوقعة على أنها مسببة للأمراض (الجدول التكميلي S6) ، تم اختيار A303T (rs1581439874 ، ClinVar Accession: VCV000663033.6) كمثال. بالإضافة إلى التنبؤ بواسطة نماذج المجموعة ، تم تأكيد إمراضية A303T من خلال درجات AlphaMissense (الملف التكميلي 4: الجدول التكميلي S7). يقع A303T في المجال الغشائي الثاني للوحدة الفرعية لمستقبلات GABAA γ2 ويقع بجوار طفرة الصرع P302L40 ، كما هو موضح في الشكل 2. كما تم تقييمه من خلال النمذجة الجزيئية ، أدى كل من بدائل γ2P302L و γ2A303T إلى أحماض أمينية لها سلاسل جانبية أكبر ، كما هو موضح في الشكل 3. كل من المخلفات الطافرة والبرية غير قطبية في طفرة γ2P302L ، بينما في γ2A303T ، تحتوي البقايا الطافرة على سلسلة جانبية قطبية والبقايا البرية لها سلسلة جانبية غير قطبية. يقع كل من P302 و Ala303 في واجهة تفاعل الوحدة الفرعية مع الوحدة الفرعية β3 (لوحظت في 7QNB و 7QNA ، على التوالي). يتمتع كل من P302 و Ala303 بمساحة سطح قابلة للمقارنة يمكن الوصول إليها بواسطة المذيبات (SASA). بالإضافة إلى ذلك ، يتم الحفاظ على كلتا البقايا بنسبة 100٪ عبر فترة تطور الفقاريات (الشكل 4 ، اللوحة العلوية). كلاهما يقع بالقرب من منطقة الغشاء الثانية (مجال TM2) من الوحدة الفرعية γ2 ، كما هو موضح باللون الأصفر في إعادة البناء ثلاثية الأبعاد لبروتين مستقبلات GABAA (7QNE26 ، حيث A303 ، كما هو موضح باللون الأحمر ، هو أول بقايا في هذا المجال (الشكل 4). بناء على هذه الميزات القابلة للمقارنة وباستخدام نموذج الخلايا العصبية الهرمية ، يمكن استخدام محاكاة طفرة (طفرات) الصرع القريبة مثل طفرة الوحدة الفرعية γ2 P302L40 للتوصيف الأولي لتأثير المتغير المتوقع (γ2A303T) على الاستجابة العصبية. في الخطوة التالية ، قمنا بتوسيع تحليلنا ليشمل مجموعة أوسع من المتغيرات داخل الوحدات الفرعية لمستقبلات GABAA .
متغيرات التجميع للبارامترات الهيكلية والفيزيائية الحيوية
بعد التقييم المقارن لطفورتين متجاورتين في القسم السابق ، قمنا بتنفيذ نهج منهجي لتقييم ما إذا كان يمكن تحديد السمات الجزيئية المشتركة بين المتغيرات. تهدف هذه المرحلة إلى استكشاف ما إذا كانت الأنماط المتسقة تظهر في السمات الهيكلية والفيزيائية والكيميائية والفيزيائية الحيوية عبر الأحماض الأمينية والمتغيرات ، وبالتالي توفير مزيد من الدعم لفرضيتنا الأولية.
يتم توفير إطار البيانات المستخدم في هذه الدراسة والمراجع في الملف التكميلي 4: الجدول التكميلي S840 ، 48 ، 49 ، 50 ، 51 ، 52 ، 53 ، 54 ، 55 ، 56 ، 57 ، 58 ، 59 ، 60 ،61،62،63 ، الجدول التكميليS936 ، والجدول التكميليS1035. بالإضافة إلى ذلك ، تم تحديد الارتباطات بين المعلمات الهيكلية والفيزيائية الحيوية لكل وحدة فرعية ولجميع المتغيرات دون تمييز الوحدة الفرعية (الملف التكميلي 4: الجدول التكميلي S11 ، الجدول التكميلي S12 ، الجدول التكميلي S13 ، الجدول التكميلي S14 ، والجدول التكميلي S15). تم الحصول على معلومات حول المعلمات الهيكلية (التوطين على حلزونات ألفا ، والملفات ، وأوراق بيتا ؛ المجالات خارج الخلية أو داخل الخلايا أو عبر الغشاء ؛ بطانة المسام ، والارتباط الناهض / الخيفي ، والتفاعلات بين البروتين والبروتين) من Brünger et al.35. تم الحصول على المعلمات الفيزيائية الحيوية من دراسات الفيزيولوجيا الكهربية المشبك على 293 خلية الكلى الجنينية البشرية (HEK). تم تطبيع القيم مع ثوابت وقت تنشيط المستقبلات من النوع البري (τr) ووقت التعطيل (τd).
نظرا لأن دراستنا تستند إلى فكرة أن متغيرات الأحماض الأمينية المجاورة أو بالقرب من الطفرات المحددة وظيفيا في الوحدات الفرعية لمستقبلات GABAA قد تظهر أنماطا مماثلة من التغيرات الفيزيولوجية الكهربية في وظيفة القناة ، كما لوحظ في حالات هذه الطفرات ، فقد استكشفنا إمكانية وجود علاقة بين المعلمات الهيكلية والفيزيائية والكيميائية والفيزيائية الحيوية. يتم إعطاء مواقع المتغيرات فيما يتعلق بمسافتها من مركز الغشاء ومحور المسام في الشكل 5 والشكل 6. في هذا السياق ، استخدمنا أيضا الدرجات (الملف التكميلي 4: الجدول التكميلي S7) ل AlphaMissense37 ؛ مدعوم من نموذج التنبؤ ببنية البروتين عالي الدقة AlphaFold264 ، والذي يمكنه استخدام تسلسل الأحماض الأمينية الأساسي كمدخلات. يمكن أن يوفر AlphaMissense أدلة على الجوانب الهيكلية لبدائل الأحماض الأمينية المفردة. توزيع درجات AlphaMissense للمتغيرات المعروفة (السوداء) والمتوقعة (الحمراء) فيما يتعلق بموضع المتغير (موضع الأحماض الأمينية ، والمسافة إلى مركز الغشاء ، والمسافة إلى محور المسام) للوحدات الفرعية لمستقبلات GABAA (α1 ، β3 ، γ2 الوحدات الفرعية المشفرة بواسطة جينات GABRA1 و GABRB3 و GABRG2 على التوالي) في الشكل 7.
يوضح الشكل 7A-C توزيع درجة AlphaMissense عبر مواضع الأحماض الأمينية ، ويوضح الشكل 7D-F توزيع درجة AlphaMissense على المسافة الطبيعية من محور المسام ، ويوضح الشكل 7G-I توزيع درجة AlphaMissense على المسافة من مركز الغشاء. أشار تحليل الارتباط في الشكل 7 إلى صعوبة التأكد من العلاقة الأساسية من خلال الخصائص الهيكلية للتنبؤ بنتيجة المتغيرات المحددة حديثا. تم تضمين متغيرات الوحدة الفرعية b2 (المشفرة بواسطة جين GABRB2) في أقسام التجميع والارتباط لتكون قادرة على إجراء تحليل أوسع. ومع ذلك ، تم تضمين متغيرات الوحدة الفرعية α1 المشفرة بواسطة GABRA1 (الشكل 7A ، D ، G) ، الوحدة الفرعية β3 المشفرة بواسطة GABRB3 (الشكل 7B ، E ، H) ، و γ2 الوحدة الفرعية المشفرة بواسطة GABRBG2 (الشكل 7C ، F ، I) في النماذج الفيزيائية الحيوية ، حيث يركز النموذج على وظيفة الخلايا العصبية الهرمية الحصين ومزيج α1β3γ2 من GABAA الوحدات الفرعية للمستقبلات هي التركيبة الأكثر انتشارا في الحصين65. وبالمثل ، تم أيضا استبعاد أي متغيرات من α1 أو β3 أو γ2 لم تتم دراسة حركية القناة الخاصة بها في مستقبلات α1β3γ2 GABAA من عمليات المحاكاة. كان هناك ارتباط خفيف (الشكل التكميلي S1 والشكل التكميلي S2) بين درجات AlphaMissense والمعلمات الفيزيائية الحيوية (أوقات التنشيط والتعطيل الطبيعية) المستمدة من تأثيرات طفرات مستقبلات GABAA (الملف التكميلي 4 والجدول التكميلي S8) في التحليل الحالي. يشير هذا إلى أن الطفرات التي يتوقع أن تكون مسببة للأمراض (بناء على درجات AlphaMissense) قد تؤدي أيضا إلى تغييرات قابلة للقياس وربما مدمرة في حركية المستقبلات (على سبيل المثال ، أوقات التنشيط وإلغاء التنشيط). ومع ذلك ، فإن عدم وجود ارتباط بين الارتباطات الموضعية في الشكل 7 يجعل من الصعب استخدام درجات AlphaMissense لافتراضنا ، والذي يعتمد على فكرة أن الأحماض الأمينية المجاورة سيكون لها عواقب مماثلة على الخصائص الفيزيائية الحيوية.
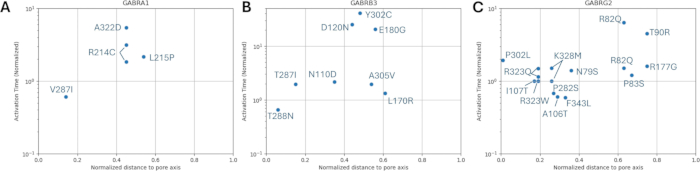
يتم عرض توزيعات المسافة الطبيعية لمحور المسام فيما يتعلق بحركية التنشيط والتعطيل للمتغيرات المعروفة في الشكل 8 والشكل 9. هناك ارتباط خفيف للوحدة الفرعية γ2 (الشكل 8C) ، مما يشير إلى احتمال أن فرضيتنا ، التي تستند إلى افتراض أن الأحماض الأمينية المجاورة سيكون لها عواقب مماثلة ، قد تكون صحيحة في بعض المناطق ، وتحديدا في قرب منطقة المسام لقناة المستقبل ، مجال TM2. هذه المنطقة مجاورة لطفرة الصرع المرجعية (الشكل 2 والشكل 4 ؛ γ2P302) ، مما يجعلها مرشحا جيدا نسبيا للمحاكاة العصبية. بناء على ذلك ، يمكن إجراء تقدير تقريبي لتأثيرات الطفرات المتوقعة المجاورة مثل γ2A303T (الشكل 2 والشكل 4). نتائجنا المعروضة هنا تأخذ في الاعتبار فقط القياسات على α1β3γ2. لذلك ، كانت المتغيرات التي تم تقييمها في نموذجنا مقيدة بالمتغيرات الواردة في الملف التكميلي 4: الجدول التكميلي S16.
تأثير الطفرات على تثبيط مستقبلات GABA A لإطلاق الخلايا العصبية الهرمية CA1
تم توضيح تأثير الطفرات على تثبيط مستقبلات GABAA على نموذج الخلايا العصبية الهرمية CA1 متعدد المقصورات. يمكن استكشاف تأثير متغيرات سوء فهم مستقبلاتGABA A على وظيفة الخلايا العصبية الهرمية في الحصين من خلال تحويل GABAergic للمدخلات القمية إلى الخلايا العصبية ، من إسقاطات CA3 والخلايا العصبية الهرمية للقشرة المخية الداخلية (EC) III. بمعنى آخر ، تتمثل إحدى طرق محاكاة نشاط مستقبلات GABAA في افتراض سياق تمثل فيه المحاكاة افتراضات واقعية حول الأهمية الفسيولوجية للمستقبلات ، مثل تثبيط التحويلة ، إحدى آليات تثبيط GABAergic. تحتوي الخلايا العصبية الهرمية في الحصين CA1 ، عادة في التشعبات القمية ، على مستقبلات GABAA في هذه المناطق ، والتي تستهدفها الإسقاطات من الخلايا العصبية CA3 و EC III. وبالتالي فإن هذا الترتيب مناسب للمحاكاة. يتطلب سؤال البحث هذا تصميم مدخلات مع تأخيرات وشدة متفاوتة. لذلك ، تم وضع ثلاثة نقاط اشتباك عصبي مختلفة (GluS1 / 2/3) على التشعبات القمية البعيدة والقمية الإنسية والقاعدية ، كما هو موضح في الشكل 10 ، وتم تنشيطها بالتتابع. لتقييم تأثير المدخلات المشبكية ، يجب أن يظل سعة التيار الثابت أقل من الحد الأدنى من عتبة تحفيز السنبلة (Iinj < Imin). بدأ نموذج الخلايا العصبية الهرمية مع مستقبلاتGABA A من النوع البري أو المتحور بحقن تيار مستمر يبلغ 0.85 نانو أمبير في سوما. ثم وضعت المشبك GABAergic في سوما. بدأ النشاط قبل المشبكي ، الذي يحاكيه مولد السنبلة ، أولا في التغصنات القمية البعيدة. تأخرت المدخلات المشبكية على التشعبات القمية والقاعدية الإنسية بمقدار 25 مللي ثانية و 50 مللي ثانية على التوالي. تم تنشيط المشبك GABAergic مع تأخير 40 مللي ثانية. تم تعديل شدة تثبيط GABAergic بحيث يتم تثبيط قطار السنبلة بأكمله ، باستثناء الارتفاع الأول. بعد ذلك ، يتم استكشاف تأثير المتغيرات في هذا الإعداد عن طريق تغييرارتفاع τ ،وإلغاء تنشيط τ ، و gGABAA.
تم الحصول على معلمات المستقبلات البرية والمتحولة من المجموعة الموضحة في خطوة البروتوكول 2.1.1 على وجه التحديد للمستقبلات المكونة من α1β3γ2 ، وهي أكثر تركيبات الوحدات الفرعية وفرة في الخلايا العصبية الهرمية للحصين65. يتم إعطاء توزيع المعلمات في الملف التكميلي 4: الجدول التكميلي S16.
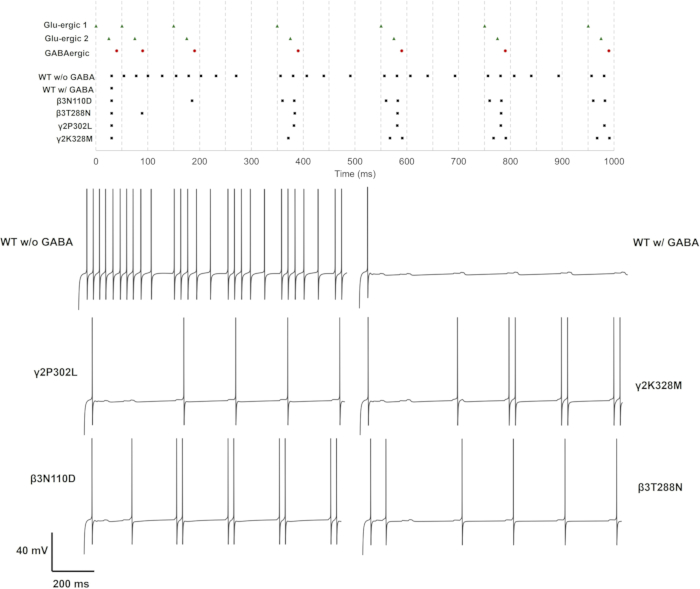
تم اختبار كل طفرة وحدة فرعية في حالات المشبك الجلوتاماتيرجيك المفردة والمزدوجة والثلاثية. في نهج بسيط ، يمكن تقييم تأثير الطفرات على معدل إطلاق النار ونمطه. يمكن أيضا تقدير متوسطاتΔt ISI والانحراف المعياري لقياس التغيرات في نمط إطلاق النار ، حيث يمثل ΔtISI التغيير في الفاصل الزمني المتنابع. يتم إعطاء النتائج لكل حالة كمعدلات إطلاق نار ، و ΔtISI (المتوسط والانحراف المعياري) في الملف التكميلي 4: الجدول التكميلي S17 والشكل التكميلي S3. يتم إعطاء قطارات السنبلة وآثار الجهد للمتغيرات التي غيرت أنماط إطلاق النار في الشكل 11 والشكل 12 والشكل 13.
بالنسبة لتنشيط المشبك الجلوتاماتيرجيك الفردي (GluS1) والثلاثي (GluS1-2-3) ، كانت الطفرات التي غيرت استجابة الخلايا العصبية β 3 طفرات N110D و γ2K328M فقط. في حالة إدخال الغلوتاماتيرجيك الفردي ، أدى β3N110D إلى ضعف التثبيط ، وتم قفل نمط إطلاق النار على قطار سبايك الجلوتاماتيرجيك بعد الارتفاعقبل المشبكي الرابع مع تأخير قصير (الشكل 11). أضعف γ2K328M أيضا التثبيط ، وإن كان فقط حول الارتفاعقبل المشبكي الخامس ، وأدخل تأخيرا أكبر في ارتفاع ما بعد المشبكي مقارنة ب β3N110D (الشكل 11). في حالة تنشيط GluS1-2-3 (الشكل 13) ، كانت الاستجابة متشابهة بين طفرات β3N110D و γ2K328M. أسفر كلا الطفرين عن نمط إطلاق النار حيث تم اكتشاف جميع المسامير المتراكمة قبل المشبكي تقريبا وأثارت استجابة. في كلتا الحالتين ، أطلقت نماذج الخلايا العصبية بزوج سبايك استجابة لنشاط ما قبل المشبكي.
أسفر تنشيط المشبك المغلوتاماتيرجيك المزدوج عن نتائج مميزة مقارنة بالإعدادين الآخرين (الشكل 12). في هذه الحالة ، أضعفت طفرتان في الوحدة الفرعية لمستقبلات GABAA b3 (β3N110D و β3T288N) وطفرتان في الوحدة الفرعية لمستقبلات GABAA γ2 (γ2P302L و γ2K328M) تثبيط GABAergic. تم إطلاق نموذج الخلايا العصبية مع طفرة γ2P302L بالتزامن تقريبا مع GluS2 ، والذي كان على الأرجح استجابة متأخرة ل GluS1 مع نفس التأخير تقريبا في المسامير قبل المشبكية بين GluS1-2. أسفرت طفرة β3T288N عن نتيجة مماثلة ، مع تمييز الارتفاع الثاني الذي لا يزال متزامنا مع GluS2. استجاب نموذج الخلايا العصبية مع β3N110D المتحولة لكل مدخلات جلوتاماتيرجيك متراكمة تقريبا ، باستثناء أول طفرتين قبل المشبكي ل GluS1 / 2 ، والتي تم تقديمها مع ΔtISI. كان نمط إطلاق النار ل γ2K328M مرة أخرى مثل β3N110D ، مع تفويت تمييز المسامير قبل المشبكي الثانية والثالثة.
توضح هذه النتائج التأثيرات المتنوعة للوحدة الفرعية b3 (المشفرة بواسطة جين GABRB3 ) وطفرات الوحدة الفرعية γ2 (المشفرة بواسطة GABRG2) على نشاط الخلايا العصبية الهرمية في الحصين. ومن المثير للاهتمام أن الطفرات β3L170R و β3A305V و β3E180G و β3D120N و β3Y302C و γ2R82Q لم تسفر عن أي تغيير في النشاط العصبي. كان الضعف الأكثر خطورة في التثبيط هو β3N110D و γ2K328M ، وكلاهما كان لهما تعطيل أقلبكثير τ وارتفاع أعلى τ. أظهر تحليلنا الأولي أيضا أن التغييرات فيارتفاع τ أو gGABAA وحدها لا تكفي لإضعاف التثبيط (البيانات غير معروضة). يمكن القول أن الطفرات التي تؤدي إلى انخفاض كبيرفي تعطيل τ جنبا إلى جنب مع زيادةارتفاع τ تؤدي إلى ضعف أكبر في تثبيط GABAergic.
في حالة ضرورة تثبيط جميع المدخلات المثيرة ، فإن أي طفرة تؤدي إلى إطلاق النار ستؤدي إلى استجابات عصبية غير طبيعية وغير محددة ، والتي من المحتمل أن تكون مبالغة في دائرة عصبية مكونة من خلايا عصبية لها نفس الطفرات. يمكن أن يتأثر توازن الإثارة / التثبيط في الشبكة العصبية بشكل كبير بالتغذية الراجعة المثبطة الضعيفة الناتجة ، والتي تعد مكونا حاسما في أي نشاط للشبكة.
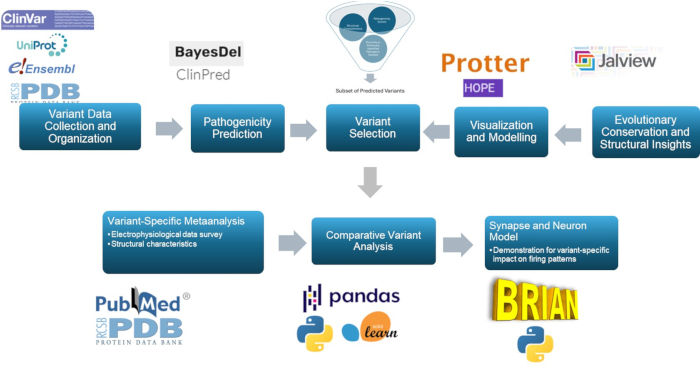
الشكل 1: نظرة عامة على التنبؤ بتأثير المتغير وتحليله للأغراض السريرية والبحثية ، مع التركيز بشكل خاص على تحليل السيليكو ومحاكاة الاستجابة العصبية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: موضع γ2A303T وطفرات المريض المختارة.γ2P302L و γ2K328L المستخدمة في المحاكاة العصبية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
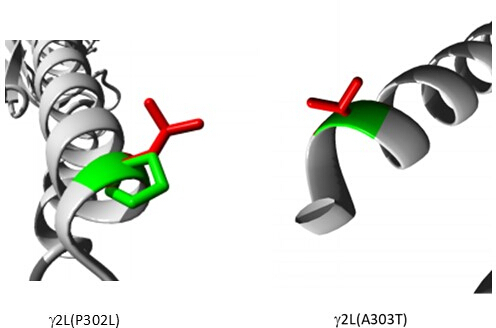
الشكل 3: النمذجة المقارنة لطفرة المريض γ2P302L والمتغير المجاور γ2L (A303T) المتوقع على أنه ممرض في كلا الطرازين ، يمثل اللون الأخضر من النوع البري ويمثل اللون الأحمر المخلفات الطافرة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
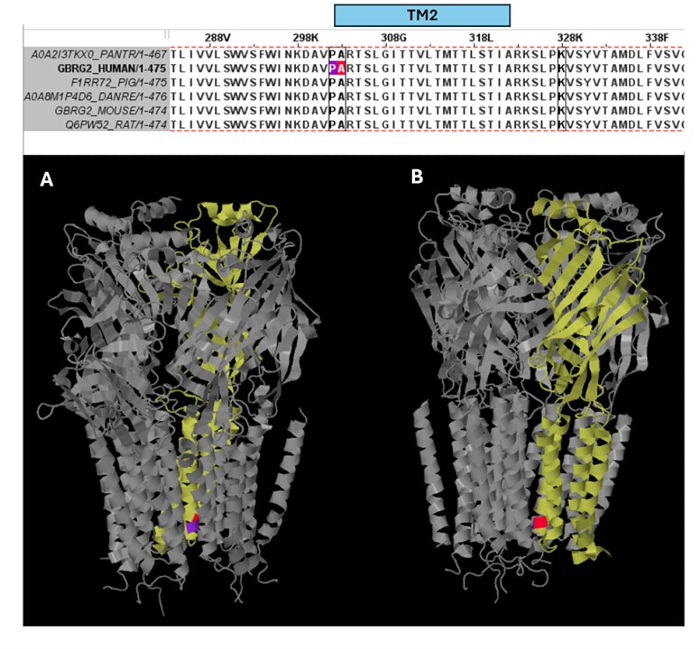
الشكل 4: محاذاة التسلسل المتعددة والرؤى الهيكلية. تظهر اللوحة العلوية الحفظ التطوري للمخلفات في موضع طفرة المريض (P302L) (أرجواني) عند حافة TM2 والمتغير الممرض A303T (اللون الأحمر) في بداية TM2 للوحدة الفرعية γ2. تظهر اللوحة السفلية تصور هذه المخلفات المحفوظة في بنية مستقبلات GABAA ثلاثية الأبعاد (7QNE) ، حيث تظهر الوحدة الفرعية γ2 (السلسلة C في 7QNE) باللون الأصفر ومن زوايا مختلفة (A ، B). اختصار: TM2 = مجال الغشاء الثاني. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: توطين جميع المتغيرات المدرجة. يتم عرض مواقع المتغيرات المعروفة (السوداء) والمتوقعة (الحمراء) فيما يتعلق بالمسافة الطبيعية (A) من محور المسام و (B) المسافة من مركز الغشاء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
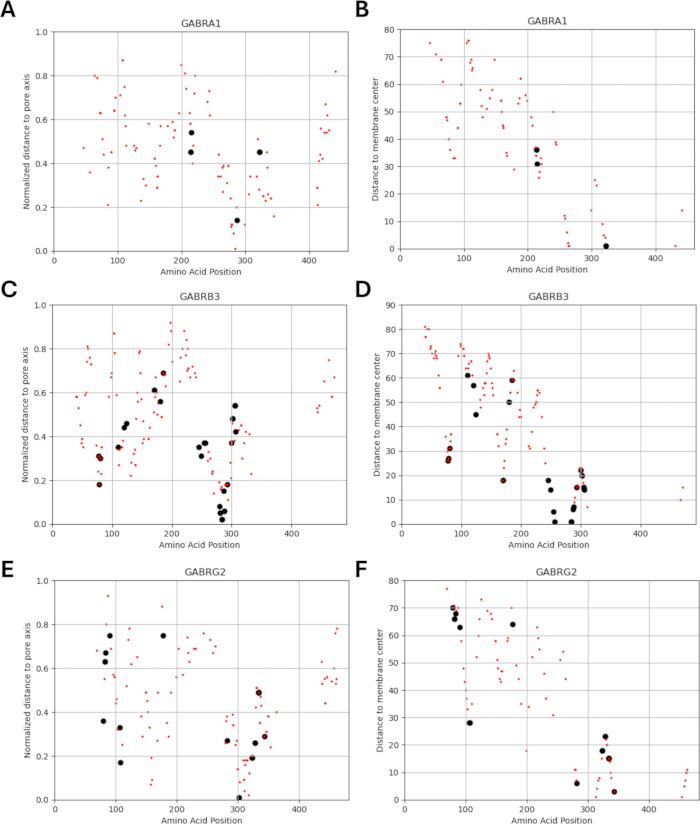
الشكل 6: توطين المتغيرات لكل وحدة فرعية. يتم عرض مواقع المتغيرات المعروفة (السوداء) والمتوقعة (الحمراء) فيما يتعلق بالمسافة الطبيعية (A ، C ، E) من محور المسام والمسافة (B ، D ، F) من مركز الغشاء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
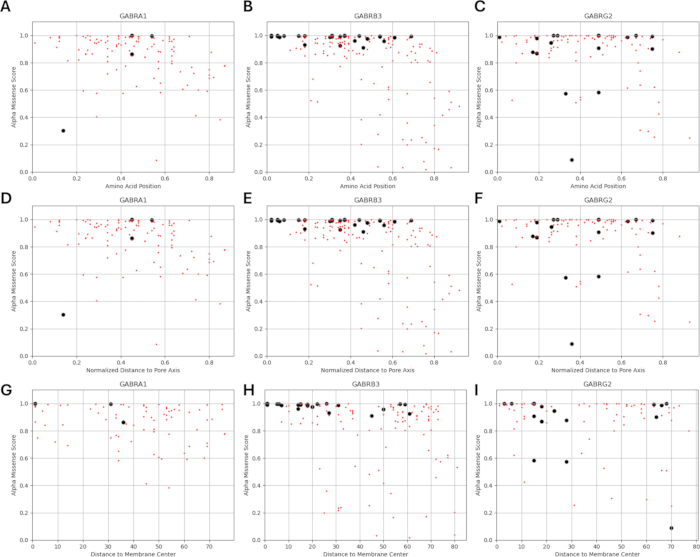
الشكل 7: توزيع درجة AlphaMissense على موقع المتغير. (أ-ج) يتم إعطاء توزيع درجة AlphaMissense على موضع الأحماض الأمينية ، والمسافة الطبيعية (D-F) من محور المسام ، والمسافة (G-I) من مركز الغشاء للمتغيرات المعروفة (السوداء) والمتوقعة (الحمراء). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 8: وقت التنشيط الطبيعي لمستقبلات GABAA مع طفرات في الوحدة الفرعية α1 (GABRA1) ، والوحدة الفرعية β3 (GABRB3) ، والوحدة الفرعية γ2 (GABRG2). يتم عرض ثوابت وقت التنشيط التي تم الحصول عليها تجريبيا فيما يتعلق بالمسافة الطبيعية من محور المسام لكل طفرة في الوحدات الفرعية (A) α1 و (B) β3 و (C) γ2. تم تطبيع القيم مع وقت تنشيط المستقبلات من النوع البري المعني. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 9: وقت التعطيل الطبيعي لمستقبلات GABAA مع طفرات في الوحدة الفرعية α1 (GABRA1) لمستقبل GABA A ، و β3 (GABRB3) الوحدة الفرعية لمستقبل GABAA ، و γ2 (GABRG2) الوحدة الفرعية. يتم عرض ثوابت وقت التعطيل التي تم الحصول عليها تجريبيا فيما يتعلق بالمسافة الطبيعية من محور المسام لكل طفرة على الوحدات الفرعية (A) α1 و (B) β3 و (C) γ2. تم تطبيع القيم مع وقت تعطيل المستقبلات من النوع البري المعني. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 10: نموذج الخلايا العصبية الهرمية CA1. تتكون الخلايا العصبية النموذجية من (1) سوما ، (2) تغصنات قمية مع مقصورات قريبة ووسطية وبعيدة ، تنتهي بفرعين في الصفيحة المموليكولاریس ، (3) تشعبان قاعديان متكونان بشكل متماثل يتفرعان إلى قسمين بعد جذع التغصني القاعدي القصير ، و (4) محور عصبي يبدأ بتل محوري مخروطي الشكل ، متبوعا بالجزء الأولي المحوري الأسطواني ، الأجزاء النخاعية ، وعقد Ranvier ، تنتهي بمحطة محورية كروية. تشير المثلثات الخضراء إلى موقع نقاط الاشتباك العصبي الجلوتاماتيرجيك ، ويمثل المثلث الأحمر المشبك GABAergic الموجود في سوما. شريط المقياس = 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 11: نمط إطلاق النار مع نشاط GluS1 فقط. يتم إعطاء قطارات السنبلة للخلايا العصبية قبل المشبكية (GluS1 (المثلث الأخضر) و GABAergic (الدائرة الحمراء)) والخلايا العصبية بعد المشبكية مع مستقبلات GABAA من النوع البري أو الطافرة (المربع الأسود) في اللوحة العلوية. يتم عرض آثار الجهد الفردية للخلايا العصبية ذات مستقبلات GABAA من النوع البري مع أو بدون تثبيط GABAergic وللخلايا العصبية ذات مستقبلات GABAA الطافرة مع تثبيط GABAergic في اللوحات السفلية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 12: نمط إطلاق النار مع نشاط GluS1 و GluS2 فقط. يتم إعطاء قطارات السنبلة للخلايا العصبية قبل المشبكية (GluS1 / 2 (مثلث أخضر) و GABAergic (الدائرة الحمراء)) والخلايا العصبية بعد المشبكية مع مستقبلات GABAA من النوع البري أو الطافرة (المربع الأسود) في اللوحة العلوية. يتم عرض آثار الجهد الفردية للخلايا العصبية ذات مستقبلات GABAA من النوع البري مع أو بدون تثبيط GABAergic وللخلايا العصبية ذات مستقبلات GABAA الطافرة مع تثبيط GABAergic في اللوحات السفلية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 13: نمط إطلاق النار مع نشاط GluS1 و GluS2 و GluS3 فقط. يتم إعطاء قطارات السنبلة للخلايا العصبية قبل المشبكية (GluS1 / 2/3 (مثلث أخضر) و GABAergic (الدائرة الحمراء) والخلايا العصبية بعد المشبكي مع مستقبلات GABAA من النوع البري أو الطافرة (المربع الأسود) في اللوحة العلوية. يتم عرض آثار الجهد الفردية للخلايا العصبية ذات مستقبلات GABAA من النوع البري مع أو بدون تثبيط GABAergic وللخلايا العصبية ذات مستقبلات GABAA الطافرة مع تثبيط GABAergic في اللوحات السفلية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي S1: توزيع درجات AlphaMissense والمعلمات الفيزيائية الحيوية (وقت التعطيل الطبيعي ؛ تطبيع τd) من طفرات الوحدة الفرعية لمستقبلات GABAA المختارة في هذه الدراسة. انظر أيضا الملف التكميلي 4: الجدول التكميلي 8. الرجاء النقر هنا لتنزيل هذا الرقم.
الشكل التكميلي S2: توزيع درجات AlphaMissense والمعلمات الفيزيائية الحيوية (وقت التنشيط الطبيعي ؛ تطبيع τr) من طفرات الوحدة الفرعية لمستقبلات GABAA المختارة في هذه الدراسة. انظر أيضا الملف التكميلي 4: الجدول التكميلي 8. الرجاء النقر هنا لتنزيل هذا الرقم.
الشكل التكميلي S3: الفترات الفاصلة للاستجابة العصبية مع مستقبلات GABA A من النوع البري والمتحورة. تشير المخطط العلوي إلى الفترات الزمنية المتداخلة لمدخلات جلوتاماتيرجيك واحدة. تظهر المؤامرة الوسطى اثنين ، وتظهر المؤامرة السفلية ثلاثة نقاط اشتباك عصبي نشطة في وقت واحد. الرجاء النقر هنا لتنزيل هذا الرقم.
الملف التكميلي 1: الملف "Data_GABAA. R" مطلوب للتشغيل في R لتنسيق البيانات. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 2: المعادلات المستخدمة في تصميم النموذج القائم على التوصيل. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 3: GABAAvar.py مطلوب للتشغيل في Brian2 للمحاكاة العصبية. يحتوي الملف على رموز Python لنموذج الخلايا العصبية متعددة الأقسام المستند إلى Brian2 (الوظيفة: CA1_Pyr) ، ومعادلات الخلايا العصبية القائمة على الموصلية والنماذج المشبكية (الوظيفة: model_eqns ، syn_eqns) والمعلمات الأولية (الوظيفة: biophys_param ، morpho_param ، syn_param). الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 4: مجلد مضغوط يحتوي على جميع الجداول التكميلية. الرجاء النقر هنا لتنزيل هذا الملف.
الجدول التكميلي S1: المتغيرات الخاطئة ذات الأهمية غير المعروفة في جين GABRG2 التي تم تنزيلها من ClinVar كملف .txt وتم حفظها لاحقا باسم "data.xlxs". الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي S2: معرفات التسلسلات المستخدمة في الدراسة ، والنسخة المرجعية للجين محل الاهتمام (NCBI Ref. seq.) والمعرفات الأخرى المقابلة عبر قواعد البيانات المختلفة). الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي S3: مواقع المناطق الهيكلية والوظيفية. مواضع المناطق المحددة لبروتين الوحدة الفرعية γ2 (التسلسل المرجعي NCBI: NP_944494.1) المشفرة بواسطة النص المرجعي (NM_198904.4) الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول التكميلي S4: محتوى الملف "data1.xlxs" ، والذي يمثل بيانات ClinVar ل GABRG2 التي تتضمن فقط الأعمدة: "GRCh38Chromosome" ، "GRCh38Location" ، "Name" ، "Protein change". الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي S5: محتوى الملف "data1_output.xlsx" الذي يحتوي على التنسيق المطلوب لمتغيرات المعنى الخاطئ لبيانات GABRG2 ليتم تحميلها على خادم dbNSFP للتنبؤ بتأثير المتغير. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي S6: محتوى الملف "data2.xlsx" الذي يحتوي على الإخراج من خادم dbNSFP للتنبؤ بتأثير المتغير لمتغيرات غير معروفة من GABRG2. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي S7: درجات AlphaMissense لمتغيرات الوحدة الفرعية لمستقبلات GABAA . الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي S8: الخصائص الفيزيائية الحيوية للمتغيرات. تم الحصول على قيم المعلمات الفيزيائية الحيوية من الدراسات السابقة مع تجارب الفيزيولوجيا الكهربية. يتم تصنيف المتغيرات بنوع "S" (الاستبدال) ، بينما يتم إعطاء معلمات المستقبلات من النوع البري لكل استبدال وتصنيفها ب "C" (التحكم). τd : ثابت وقت التعطيل ، Pمفتوح : احتمال مفتوح ، gGABA: توصيل المستقبل ، Imax: الحد الأقصى للتيار ، τr : ثابت وقت التنشيط. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي S9: الخصائص الفيزيائية والكيميائية للمتغيرات. يتم تصنيف المتغيرات التي تم تحديدها سابقا مع المعلمات الفيزيائية الحيوية بالنوع "S" (الاستبدال) ، بينما يتم تمثيل المتغيرات المتوقعة ب "P". H: التغيير في الكراهية للماء ، VSC: التغيير في حجم السلسلة الجانبية ، P1: التغيير في القطبية ، P2: التغيير في الاستقطاب ، SASA: التغيير في السطح الذي يمكن الوصول إليه بواسطة المذيبات ، NCISC: التغيير في مؤشر الشحن الصافي. يتم الحصول على القيم لكل حمض أميني أصلي ومتغير من Guo et al.36 ويتم تقدير التغيير في كل معلمة على أنه معطى. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي S10: الخصائص الهيكلية للمتغيرات. يتم تصنيف المتغيرات التي تم تحديدها سابقا مع المعلمات الفيزيائية الحيوية بنوع "S" (الاستبدال) ، بينما يتم تمثيل المتغيرات المتوقعة ب "P". يتم تمثيل توطين المتغير في المجال ب 1 ، وإلا 0. يتم الحصول على جميع القيم من Brünger et al.35. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي S11: ارتباطات المعلمات الهيكلية والفيزيائية الحيوية لجميع المتغيرات المعروفة. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي S12: ارتباطات المعلمات الهيكلية والفيزيائية والكيميائية والفيزيائية الحيوية لمتغيرات GABRA1 المعروفة. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول التكميلي S13: ارتباطات المعلمات الهيكلية والفيزيائية والكيميائية والفيزيائية الحيوية لمتغيرات GABRB2 المعروفة. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي S14: ارتباطات المعلمات الهيكلية والفيزيائية والكيميائية والفيزيائية الحيوية لمتغيرات GABRB3 المعروفة. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي S15: ارتباطات المعلمات الهيكلية والفيزيائية والكيميائية والفيزيائية الحيوية لمتغيرات GABRG2 المعروفة. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي S16: المعلمات الفيزيائية الحيوية لمستقبلات α1β3γ2 من النوع البري والمتحورة GABA A. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول التكميلي S17: معدل إطلاق النار والفترات الفاصلة استجابة لنقاط الاشتباك العصبي الجلوتاماتيرجية المفردة أو المزدوجة أو الثلاثية مع مستقبلات GABAA من النوع البري والمتحورة. الرجاء الضغط هنا لتحميل هذا الجدول.
Discussion
من خلال تطبيق مزيج من علم الوراثة الحسابي والنمذجة الجزيئية والمحاكاة العصبية ، فإن النهج المقدم في هذه الورقة لديه القدرة على تحسين تصنيف متغيرات مستقبلات GABAA ، مما يوفر رؤى قيمة لكل من أبحاث الصرع والتطبيقات السريرية. يتم تقديم تحليل شامل لتحديد الطفرات المسببة للأمراض المتوقعة وتحديد أولوياتها وتوسيعه في إطار من المحتمل أن يسد الفجوة بين التأثيرات المتغيرة على البروتين والنمط الظاهري الخلوي. يسمح تقييم تأثير نشاط مستقبلاتGABA A المنشأ الصرع على محاكاة الخلايا العصبية الهرمية في الحصين بتكرار النمط الظاهري في المختبر المرتبط بخلل وظيفي في مستقبلات GABAA وإظهار تغيير استجابة الخلايا العصبية المفردة في جذر الخلل الوظيفي في الشبكة. بناء على عمليات المحاكاة هذه للاستجابات العصبية الناتجة عن طفرات الصرع ، تم استكشاف تقدير تقريبي للتأثيرات الوظيفية للطفرات القريبة من الناحية الهيكلية. تتطلب التنبؤات المتعلقة بتأثير الطفرات المتوقعة على حركية القناة تحليلا شاملا مع مجموعات متغيرة معروفة. توفر التحليلات المقارنة ، مثل تلك المعروضة في هذه الورقة ، ومحاكاة النشاط العصبي رؤى مهمة لمزيد من التوليد والتحسين للنماذج التنبؤية التي تركز على التأثير المتغير على وظيفة البروتين وعلم الأمراض العصبي. بالإضافة إلى ذلك ، يمكن استخدام منهجيتنا لتحديد وتحديد أولويات المتغيرات الأكثر إمراضا بين المتغيرات غير المعروفة لفحص التأثيرات المتغيرة المرتبطة باضطرابات النمو العصبي المرتبطة بمستقبلات GABAA . على سبيل المثال ، يمكن التعبير عن الوحدات الفرعية للمستقبلات الموسومة بمجسات الفلورسنت66،67،68،69،70 والتي تحمل الطفرات المتوقعة في المختبر لدراسة الاتجار بها ، والتعبير عن سطح الخلية ، والفيزيولوجيا العصبية. إلى جانب ذلك ، يمكن اعتبار النماذج الحيوانية مثل C. ايليجانس للتحقق من آثار الطفرات المتوقعة. على سبيل المثال ، تم استخدام تحرير الجينات CRISPR-Cas9 لتوليد حذف unc-49 ، وهو C. ايليجانس مستقبلات GABAA ، وبالتالي توليد طفرات مرتبطة بالصرع متماثل اللواقح في unc-49 أو الوحدات الفرعية لمستقبلات GABAA البشرية71.
بشكل عام ، يستفيد تصنيف المتغيرات من استخدام مستويات متعددة من الأدلة الحسابية ، على النحو الموصى به من قبل ACMG-AMP12. يعزز هذا النهج موثوقية تصنيف المتغيرات من خلال دمج أدوات تنبؤية ومصادر بيانات مختلفة ، مما يعزز في النهاية دقة التقييمات السريرية ويحسن عملية صنع القرار الشاملة في التشخيص الجيني. في منهجيتنا ، يعد استخدام التنبؤات الجماعية ، التي تجمع بين تنبؤات الأدوات المتعددة ، وبالتالي تلبية متطلبات خطوط متعددة من الأدلة الحسابية والقضاء على الحاجة إلى استخدام أدوات مختلفة بشكل منفصل ميزة. يتغلب هذا النهج أيضا على التحدي المتمثل في التعامل مع المخرجات المتباينة من الأدوات الفردية ، وبالتالي تبسيط عملية التنبؤ وتعزيز الكفاءة. ومع ذلك ، لا يوجد ضمان فيما يتعلق بالدقة التنبؤية للتحليلات التي تركز على الجينات أو الخاصة بالمتغيرات. يؤدي هذا إلى استنتاج مفاده أنه يجب إجراء التنبؤات التي تركز على الجينات أو الخاصة بالمتغير في ظل ظروف محددة معدلة للسياقات والأهدافالمحددة 15،72،73،74. بالنسبة للتدخلات السريرية ، سيتطلب ذلك تقييم الدقة التنبؤية لأدوات السيليكو لجين معين أو مجموعة فرعية من الجينات في سياق مرض معين غالبا مع التحسين الفردي75. ومع ذلك، فإن تقييم الدقة التنبؤية غالبا ما يكون محدودا بسبب عدم وجود عدد كاف من المتغيرات، مما قد يؤثر على موثوقية تقييم الدقة.
تتوفر أدوات مختلفة في الأدبيات ، ويتم اختبار دقتها والتحقق من صحتها في مجموعات البيانات14. ومع ذلك ، فإن نتائج الدقة هذه المستندة إلى مجموعات البيانات الكبيرة لا تنعكس بالضرورة على التنبؤ ببعض المتغيرات غير المعروفة لجين معين. في هذا السياق ، تشير الأدبيات المتراكمة إلى أن التنبؤات الجماعية ، التي تجمع وتحسب نتائج المتنبئين الفرديين ، معروفة بأنها تعمل بشكل أفضل من توافق التنبؤات الفردية33،76،77،78 ، وبالتالي ، في الدراسة الحالية ، اخترنا استخدام تنبؤات المجموعة ، وهي BayesDEL33 و ClinPred32 على وجه التحديد لأدائها المتفوق32 ، 34 تم تقييم BayesDEL نسبيا ل 4،094 متغيرا خاطئا في الجينات ذات الصلة سريريا ، بما في ذلك الجينات المشفرة للبروتينات عبر الغشاء مثل قناة الصوديوم ذات الجهد الكهربائي الوحدة الفرعية ألفا 5 (SCN5A) ، وأظهرت أداء متفوقا33. في بروتوكول التنبؤ بالتأثير المتغير الخاص بنا ، كخطوة أولى ، نظرنا في الإجماع من اثنين من المتنبئين بالفرقة (BayesDEL و ClinPred). AlphaMissense37 ، نموذج التعلم العميق الذي طورته Google DeepMind ، هو امتداد ل AlphaFold64،79 ، وبالتالي الاستفادة من قوة التنبؤ ببنية البروتين عالية الدقة. عندما قارنا نتائج التنبؤ الأولية لنماذج المجموعة (BayesDEL و ClinPred كما هو موضح في خطوة البروتوكول 1.3) مع نتائج AlphaMissense ، كانت التنبؤات متفقة جزئيا مع بعضها البعض (الملف التكميلي 4: الجدول التكميلي S15) ولم تتماشى تماما مع تنبؤات النماذج الجماعية (BayesDEL و ClinPred) ، والتي توصلت إلى إجماع على الأمراض أو المرتبطة بالأمراض ، يظهر في شكل صفوف وردية (الملف التكميلي 4: الجدول التكميلي S15). ومع ذلك ، فإن المتغيرات غير المعروفة (L81F و A303T و V329F) بالقرب من طفرات GABRG2 R82Q و P302L و K328M ، والتي استخدمناها في نموذج الخلايا العصبية الخاص بنا ، وتوقعناها على أنها مسببة للأمراض بواسطة كل من ClinPred و BayesDEL ، تم التنبؤ بها أيضا على أنها مسببة للأمراض بواسطة AlphaMissense كما هو موضح في الإبرازات الصفراء (الملف التكميلي 4: الجدول التكميلي S15).
نظرا لأن AlphaMissense29 يستخدم التنبؤ بالتسلسل والسياق الهيكلي ، في دراستنا ، أردنا أيضا معرفة ما إذا كان هناك أي ارتباط بين درجات AlphaMissense ومواقع طفرة مستقبلات GABAA بناء على مسافتها من مركز الغشاء ومحور المسام. تعتمد فرضيتنا على فكرة أن التأثير الوظيفي لمتغيرات الأحماض الأمينية المجاورة أو القريبة من الطفرات المحددة وظيفيا للوحدات الفرعية لمستقبلات GABAA قد تظهر أنماطا مماثلة من التغيرات الفيزيائية والكيميائية في وظيفة القناة التي لوحظت في حالات الطفرات. سيساعدنا الارتباط بين مواضع طفرة الوحدة الفرعية لمستقبلات GABAA ودرجات AlphaMissense في تحديد العلاقة القابلة للاستخدام لبناء إطار عمل لفرضيتنا مما يسمح بالتنبؤ بالعواقب الوظيفية لمتغيرات المعنى الخاطئ الجديدة في الوحدات الفرعية لمستقبلات GABAA . ومع ذلك ، لم تكن درجات AlphaMissense تنبؤية بالتغيرات في هذه المعلمات الفيزيائية الحيوية (الشكل 7). من المهم ملاحظة أن حجم العينة المحدود في تحليلنا يجعل من الصعب استخلاص استنتاجات نهائية. ومع ذلك ، وجد تحليلنا أن درجات AlphaMissense لا ترتبط بالمعلمات الهيكلية لمستقبلاتGABA A . إن عدم وجود ارتباط موضعي واضح (على سبيل المثال ، بين مواضع الطفرات ودرجات AlphaMissense) يتحدى صحة افتراضنا. إذا كانت المخلفات المجاورة لها تأثيرات مماثلة حقا ، فإننا نتوقع أن نرى ارتباطا أكثر وضوحا. نظرا لأن هذا ليس هو الحال ، فإنه يضعف القدرة على استخدام درجات AlphaMissense كأداة موثوقة لاختبار افتراضنا.
ومن المثير للاهتمام ، في دراستنا ، أننا وجدنا ارتباطا خفيفا بين مسافة المتغير إلى محور المسام ووقت تنشيط القناة الطبيعي لطفرات الجينات GABRG2 . وبالتالي ، فإن افتراضنا الأولي بأن الأحماض الأمينية المجاورة سيكون لها عواقب مماثلة قد يكون صحيحا في بعض مناطق القناة مثل المناطق الموجودة في المسام أو في المواقع الرئيسية المشاركة في البوابات ولكنها قد لا تكون واضحة في مناطق أخرى. تحد مجموعة البيانات الصغيرة من القدرة على تمييز هذا التباين ، لكن البيانات المستقبلية أو التحليل الهيكلي الأكثر تفصيلا يمكن أن تساعد في تحسين هذا الجانب من فرضيتنا. يمكن أن تكون محاكاة الديناميكيات الجزيئية80 بمثابة نهج تكميلي قوي لمزيد من التحقيق في هذه النتائج الأولية خاصة في سياق التقييم المقارن لطفرتين متجاورتين للوحدة الفرعية γ2 ، وهما طفرة الصرع γ2P302L40 والطفرة القريبة المتوقعة γ2A303T (rs1581439874) ، التي تم إجراؤها في دراستنا. في المستقبل ، يمكن أن يتيح هذا النهج تقديرا أكثر دقة لتأثير المتغير غير المعروف على النمط الظاهري الخلوي ، خاصة عند دمجه مع عمليات المحاكاة العصبية المقدمة في دراستنا.
بالإضافة إلى ذلك ، سيكون من المثير للاهتمام استكشاف ما إذا كان يمكن استخدام الخصائص الهيكلية والفيزيائية والكيميائية للوحدات الفرعية لمستقبلات GABAA جنبا إلى جنب مع الميزات الأخرى لتدريب نماذج التعلم الآلي القوية للتنبؤ الوظيفي بتأثيرات متغيرة جديدة على القناة والخلايا العصبية والشبكة والنمط الظاهري للمرض. مع ظهور مناهج التعلم الآلي الآلي ، وصلنا إلى نقطة يمكن للأطباء وعلماء المختبرات الرطبة أيضا تطوير نماذجهم الخاصة في بيئة أكثر ديمقراطية81. لذلك ، يمكن أن يؤدي دمج هذه التقنيات في الممارسة السريرية إلى تبسيط العملية ، مما يجعل الطب الشخصي أكثر سهولة ويقلل من الاعتماد على الخبرة عالية التخصص لتحليل المتغيرات الوظيفية. في هذا السياق ، يوفر نهجنا رؤى حول الديناميكيات الهيكلية والوظيفية للمستقبل ، مما قد يساعد في الدراسات المستقبلية للتنبؤ الوظيفي بتأثير المتغير.
على الرغم من التقدم الحالي في التنبؤ ببنية البروتين والاختراق الذي يمثله AlphaFold64 ، إلا أن التنبؤ الدقيق بتأثير الطفرات ووظيفة البروتين لا يزال يمثل تحديا بسبب نقص البيانات المطلوبة لتدريب النموذج79. للتنبؤ بالتأثير المتغير ، يظهر AlphaMissense أداء أعلى مقارنة بمجموعة فرعية من النماذج التنبؤية ولكن لم يتم تضمين التنبؤات الجماعية BayesDEL25 و ClinPred24 ، التي تم استخدامها في دراستنا ، في هذه المقارنة29. من المهم ملاحظة أنه في دراستنا ، تم استخدام أدوات السيليكو BayesDEL و ClinPred و AlphaMissense لأغراض متميزة. تم استخدام تنبؤات المجموعة ، BayesDEL و ClinPred ، بشكل أساسي للتنبؤ بالإمراضية ، بينما تم استخدام AlphaMissense على وجه التحديد لاستكشاف العلاقة بين درجاتها والبيانات المعروفة لتأثير الطفرات في الوحدة الفرعية γ2. على وجه التحديد ، تفترض فرضيتنا أن المتغيرات المسببة للأمراض المتوقعة ، لا سيما تلك الموجودة بالقرب من أو بجوار الطفرات المحددة وظيفيا في الوحدات الفرعية لمستقبلات GABAA ، ستظهر معلمات فيزيائية حيوية مماثلة لتلك التي لوحظت في الطفرات المميزة وظيفيا. للتحقيق في هذا الأمر ، اخترنا AlphaMissense نظرا لحقيقة أنه مدعوم بنموذج AlphaFold264 عالي الدقة ، والذي يستخدم تسلسل الببتيد الأساسي للتنبؤ بعواقب بدائل الأحماض الأمينية المفردة.
وبالتالي ، فإن أحد القيود الرئيسية في دراستنا مدفوع في المقام الأول بالتوافر المحدود للبيانات التجريبية. على سبيل المثال ، يعتمد نموذج الخلايا العصبية لدينا على التعبير عن البيانات المشتقة من مجموعة الوحدات الفرعية α1β3γ2 لمستقبلات GABAA ، والتي تحد بطبيعتها من الطفرات المدروسة في الأدبيات إلى الوحدات الفرعية المعبر عنها كجزء من مجموعة المستقبلات المحددة هذه. بالإضافة إلى ذلك ، اعتمدنا على البيانات الفيزيولوجية الكهربية المستمدة حصريا من التعبير عن هذه الوحدات الفرعية في خلايا HEK ، مما أدى إلى تضييق نطاق البيانات المتاحة في الأدبيات. يفترض استخدامنا للنمذجة العصبية لتقدير تأثيرات المتغيرات غير المعروفة أن المتغيرات غير المعروفة (التي يتم توقعها على أنها مسببة للأمراض في سير عملنا) الواقعة على مقربة من الطفرات المعروفة ستظهر أنماطا مماثلة في معلمات حركية القناة أو الخصائص الفيزيائية والكيميائية لتأثيرات الطفرات الموصوفة في الأدبيات. هذا الافتراض ، إلى جانب الحاجة إلى بيانات الفيزيولوجيا الكهربية لتجميعات مستقبلات محددة في خلايا HEK293 ، يقلل من كمية البيانات التجريبية المتاحة للنمذجة. نتيجة لهذه القيود ، سمحت لنا البيانات المتاحة بنمذجة عدد محدود فقط من المتغيرات في الوحدات الفرعية α1β3γ2. ومع ذلك ، فإن تدريب نموذج الخلايا العصبية لتجميعات الوحدات الفرعية المختلفة مثل مجموعات الوحدات الفرعية α1β2γ2 ، أو مجموعات الوحدات الفرعية α1β2δ ، أو α4β3δ ، والتي لها آثار خلوية ودائرة وشبكة خاصة بالوحدة الفرعية ، من المحتمل أن يظهر قابلية تطبيق أوسع على أنواع الصرع المختلفة واضطرابات النمو العصبي. في المستقبل ، مع زيادة البيانات الفيزيولوجية الكهربية المتاحة والدراسات التي تركز على الطفرات في تجميعات المستقبلات المحددة جيدا وأنواع الخلايا المحددة جيدا ، قد يصبح من الممكن تعزيز قابلية التعميم ودقة نهجنا.
توفر نماذج الخلايا العصبية القائمة على الموصلية متعددة المقصورات أداة قوية لتوليد تنبؤات بالأهمية الوظيفية لمتغيرات المستقبلات لاستجابة الخلايا العصبية الواحدة. تتيح هذه الأداة تعريفات مرنة لكل من المعلمات الخلوية / المشبكية ومواقعها لاختبار أي سؤال محدد. يمكن استبدال مولدات السنبلة البسيطة المستخدمة في هذا البروتوكول بنماذج الخلايا العصبية الأخرى لدراسة نشاط الدوائر الدقيقة. الخطوة الحاسمة للبروتوكول هي أيضا الخطوة الأكثر تقييدا: تعريف أي متغير مستقبلات من حيث حركية القناة المتغيرة. يتم توفير المعلومات المطلوبة بشكل مثالي من خلال دراسات الفيزيولوجيا الكهربية للمشبك. ومع ذلك ، فإن التحليل الحسابي لبدائل الأحماض الأمينية ذات الأهمية السريرية المتوقعة والمقارنات مع البدائل المعروفة يمكن أن توفر أيضا بعض البصيرة. تتضمن دراستنا والبروتوكول الموصوف استخدام محاكاة النشاط العصبي ليس كأداة تنبؤية ، بل كأداة لاستكشاف آثار الطفرات لدعم نظرة أوسع حول عواقب الخصائص الفيزيائية الحيوية المتغيرة لمستقبل GABAA على نشاط الخلايا العصبية الفردية. يعد الاعتماد على البيانات التجريبية في المحاكاة العصبية قيدا مهما في نهجنا ، والذي قد يستفيد من النمذجة الجزيئية المتقدمة لسد الفجوة بين الهيكل والوظيفة.
في بروتوكولنا ، يجب إجراء تقييم نقدي لبعض الخطوات. أولا ، قد يكون اختيار النموذج التنبؤي المستخدم في الجزء الأول من بروتوكولنا أمرا بالغ الأهمية. يعتمد اختيار أدوات السيليكو على عدة عوامل بما في ذلك توليد خطوط متعددة كافية من الأدلة الحسابية للتنبؤ القوي12. تتناسب التنبؤات الجماعية التي تدمج تحليل الخوارزميات التنبؤية المتعددة بشكل أفضل مع هذه التوصية وبالتالي فهي مفضلة مقارنة بالتنبؤات الفردية. هناك تنبؤات مختلفة ، وعادة ما يتم اختبار دقتها في مجموعات بيانات كبيرة ، والتي لا تضمن بالضرورة دقة النموذج التنبؤي المستخدم لتأثيرات متغيرة غير معروفة موجودة في جين معين. يتم تعويض ذلك باستخدام نموذجين جماعيين ، يجمعان ويحسبان نتائج التنبؤ من متنبئين متعددين. بالإضافة إلى ذلك ، يمكن تعديل قطع النماذج التنبؤية لزيادة الخصوصية إذا كان الغرض في المقام الأول هو تحديد المتغيرات الأكثر إمراضا. يعد تحديد القطع المناسب أمرا مهما لتحقيق التوازن بين المفاضلة بين الحساسية والنوعية وضمان التصنيف الدقيق للمتغيرات. في دراستنا ، استخدمنا القطع الافتراضي. لم نقم على وجه الخصوص بتغيير الحد الأقصى لصالح التقاط المتغيرات التي قد تكون أكثر عرضة للأمراض لأن هذا من شأنه أن يقلل من نطاق المتغيرات التي سيتم فحصها في مستويات متعددة من تحليلنا كما هو موضح في سير عملنا. من المهم أيضا ملاحظة أنه عند اختيار البيانات الهيكلية لإعادة البناء ثلاثي الأبعاد للبروتين محل الاهتمام ، هناك حاجة إلى المراجعة الأولية للبيانات الهيكلية في الأدبيات. اكتسب الفحص الهيكلي لمستقبلات GABAA زخما مؤخرا مع دراسات هيكلية قوية أبلغت عن الهيكل ثلاثي الأبعاد لتجميعات المستقبلات المختلفة في ظروف مختلفة26،27،82،83،84،85. نظرا لتوافر هذه البيانات ، ركزنا في دراستنا على الهياكل المحددة تجريبيا لإعادة بناء البيانات الهيكلية. ومع ذلك ، قد يكون التنبؤ ب AlphaFold64 مفضلا لتحليل البروتينات الأخرى التي تفتقر إلى مثل هذه البيانات المحددة تجريبيا. بالنسبة للبيانات الهيكلية المستمدة من الدراسات التجريبية ، من المهم الانتباه إلى ترقيم الأحماض الأمينية. قد يختلف ترقيم PDB للأحماض الأمينية عن ترقيم UniProt لأن الأول قد لا يتضمن ببتيد الإشارة الذي تتم إزالته أثناء نضوج البروتين. إلى جانب ذلك ، قد تسبب البروتينات الخيمرية المعبر عنها في النظام التجريبي تناقضات. في هذه الحالة ، ستساعد المحاذاة الزوجية لتسلسل الاهتمام مع التسلسل المشتق من البيانات الهيكلية في الحفاظ على الاتساق. في الأدبيات ، تستند البيانات الهيكلية لبروتين الوحدة الفرعية γ2 إلى طرق مختلفة ، بما في ذلك الطرق التجريبية مثل المجهر الإلكتروني (EM) وطريقة التنبؤ عالية الدقة ل AlphaFold. إذا كانت الطريقة التجريبية لا تغطي التسلسل المطلوب بالكامل بدقة عالية ، فيمكن استخدام تنبؤات AlphaFold. في هذه الدراسة ، تم اختيار الهيكل 7QNE26 لأنه يتوافق مع التركيب المجهري الإلكتروني المبرد لمستقبلاتGABA A المشبكية البشرية كاملة الطول. يمثل هذا بالضبط مجموعة الوحدات الفرعية كاملة الطول ، والتي كانت محور هذه الدراسة.
بالإضافة إلى ذلك ، بالنسبة للتحليل المقارن ، يجب تفضيل استخدام المعلمات المعيارية لحركية القناة ، حيث قد تختلف قيم هذه المعلمات اعتمادا على تكوين الوحدة الفرعية للمستقبلات والإعدادات التجريبية. على سبيل المثال ، يجب تحديدارتفاع τوإلغاء تنشيط τ على تغييرات أضعاف x على قيم التحكم من النوع البري. في خطوة البروتوكول 2.5 ، بالنسبة لعدد قليل من المتغيرات المعروفة ، قد يفضل تحليل الارتباط البارامتري أو الفئوي وتحديد قيم rho و p. من الناحية المثالية ، من المتوقع أن تؤدي طرق مثل تحليل المكونات الرئيسية إلى علاقات أكثر دقة ولكنها تتطلب عددا أكبر من العينات.
يمكن تغيير بيئة المحاكاة. في هذه الدراسة ، تم تفضيل Brian2 للأسباب التالية: توفر فئة الخلايا العصبية المكانية في Brian2 أداة قيمة لمحاكاة النشاط العصبي. يتمتع Brian2 بميزة كبيرة في استخدام المعادلات التفاضلية لوصف الديناميكيات المستمرة وتحديث العبارات للأحداث المنفصلة بدلا من الاعتماد على نماذج "الصندوق الأسود" المحددة مسبقا ، وهذا يؤدي إلى قابلية ممتازة لقراءة الكود وقابلية للتكيف حيث يمكن تعريف كل جانب من جوانب النموذج بشكل صريح في نص Python واحد ، مع ذكر معادلات النموذج في التدوين الرياضي وكمية ضئيلة فقط من المفردات الخاصة ببراين المستخدمة37. نظرا لأن النموذج موصوف صراحة ، يتم توثيق جميع الميزات ويمكن العثور عليها في ملف وصف المحاكاة الأساسي ، مما يلغي الحاجة إلى نماذج "الصندوق الأسود" التي تم الاعتماد عليها سابقا ، كما هو مذكور في الدراسات التي أجراها Stimberg et al.45،86.
يستخدم نموذج الخلايا العصبية الحالي موصليات من نوع Hodgkin-Huxleyالمعدلة 46 مع Na + و K + وتيار التسرب. ويمكن توسيع هذا النموذج القائم على التوصيل بزيادة إدراج عدة أنماط أخرى من القنوات، مثل قنوات Ca2+ . بالنسبة لنماذج المشبك ، من المهم ملاحظة أنه يجب الحصول على هذه المعلمات لتركيبات وحدة فرعية محددة ، ويجب تقييم المتغيرات ذات المعلمات المقاسة بهذه التركيبات فقط. في هذه الدراسة ، تم اختيار تكوين مستقبلات α1β3γ2. لذلك ، تم تضمين متغيرات α1 أو β3 أو γ2 فقط ، مع معلمات حركية القناة المقاسة على مستقبلات α1β3γ2GABA A .
يتضمن تقدير الفيزياء الحيوية الخلوية تقسيم الخلية إلى مقصورات أسطوانية متعددة ، من المحتمل أن تمتلك كل منها خصائص توصيل مختلفة. على الرغم من المخالفات في تشعبات الخلايا العصبية ، يمكن اعتبارها خيوطا متجانسة محليا. تساعد هذه النماذج في فهم البنية المعقدة وعمل الخلايا. يركز تصميم النموذج على نسخة مبسطة من التشكل الفعلي الذي يمكن أن يعكس هذه الميزات.
يحدد الموقع والخصائص الفيزيائية والكيميائية للحمض الأميني المتغير التأثير على حركية القناة. على سبيل المثال ، سيؤدي استبدال الأحماض الأمينية الذي ينتج عنه حمض أميني بسلسلة جانبية أكبر إلى تقليل توصيل القناة إذا حدث هذا التغيير على حمض أميني يبطن مسام القناة. قد تؤثر البدائل أيضا على فتح / إغلاق القناة. من أجل البساطة في هذا النموذج, يتم تخفيض حركية ربط GABA فقط إلى نسبة من المستقبلات المتاحة; ومع ذلك ، يمكن تصميم نماذج أكثر تفصيلا لتشمل هذا التفاعل لدراسة التأثير المحتمل للبدائل التي تغير تقارب ربط الترابط.
في الختام ، تستخدم الدراسة الحالية طرقا حسابية للتنبؤ بالمتغيرات المسببة للأمراض في الوحدات الفرعية لمستقبلات GABAA وتقدير النمط الظاهري الخلوي المحتمل نوعيا بناء على محاكاة الطفرات المرتبطة بالصرع في نموذج الخلايا العصبية الهرمية للحصين. على حد علمنا ، هذا هو البروتوكول الأول لاستكشاف التطبيق المشترك لعلم الوراثة الحسابي والنمذجة الجزيئية والمحاكاة العصبية لتقييم كيف يمكن أن تساهم المتغيرات الجينية في خلل مستقبلات GABAA عبر مستويات متعددة من التعقيد ، من الحمض النووي إلى وظيفة البروتين والسلوك العصبي. يمكن أن يوفر هذا البروتوكول أساسا لتحسين تقدير المتغيرات الضارة المحتملة والأمراض العصبية المرتبطة بها في الصرع. بالإضافة إلى ذلك ، يمكن استخدامه في دراسة اعتلالات القنوات الأخرى التي تسفر عن رؤى مهمة حول الآلية الأساسية لاضطرابات النمو العصبي والشبكات ذات الصلة. بناء على ذلك ، من خلال دمج التقييمات الهيكلية والفيزيائية والكيميائية لمستقبلات GABAA لفحص التأثير الوظيفي للمتغيرات ودمجها في حركية قناة مستقبلات GABAA ، يمكن تطوير تحليل أكثر دقة في المستقبل.
Disclosures
يعلن جميع المؤلفين أنه ليس لديهم تضارب في المصالح فيما يتعلق بهذا العمل.
Acknowledgements
نشكر Çağla Koca على مساعدتها في بناء الخلايا العصبية النموذجية.
Materials
| Name | Company | Catalog Number | Comments |
| Brian2 | Sorbonne Université, INSERM, CNRS, Institut de la Vision, France; Imperial College London, United Kingdom | 2.8.0.4 | Stimberg et al., 2019 (https://pypi.org/project/Brian2/ ) |
| dbNSFP server | Genos Bioinformatics LLC, USA | v3.0 | Liu et al., 2020 (http://database.liulab.science/dbNSFP) (https://sites.google.com/site/jpopgen/dbNSFP) |
| HOPE | Centre for Molecular and Biomolecular Informatics CMBI, Radboud University, Netherlands | 1.1.1 | Venselaar et al., 2010 (https://www3.cmbi.umcn.nl/hope/) |
| Jalview | University of Dundee, UK | JV2 | Waterhouse et al., 2009 (https://www.jalview.org/) |
| Jupyter Notebook | Project Jupyter, USA | https://jupyter.org/install | |
| Phyton | Python Software Foundation, USA | 3.13 | https://www.python.org/downloads/ |
| Protter | ETH Zurich, Switzerland | Version 1.0 | Omasits, et al., 2014 (https://wlab.ethz.ch/protter/start/) |
| R | The R Foundation for Statistical Computing, USA | R version 4.3.2 | https://www.r-project.org/ |
| RStudio | Posit software, PBC, USA | RStudio 2023.12.1+402 "Ocean Storm" Release | https://posit.co/downloads/ |
References
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved