Method Article
Discectomie et fusion cervicales antérieures assistées par endoscope pour le traitement de la myélopathie spondylotique cervicale
Dans cet article
Résumé
Nous décrivons une chirurgie mini-invasive utilisant la discectomie cervicale antérieure assistée par endoscope et la fusion pour la myélopathie spondylotique cervicale.
Résumé
La myélopathie spondylotique cervicale (MCS) est une cause fréquente de maladie de la moelle épinière cervicale. L’endoscopie rachidienne offre des avantages chirurgicaux tels qu’une vue agrandie et un champ chirurgical clair médié par l’eau. Cette étude décrit une procédure de discectomie et de fusion cervicale antérieure assistée par endoscope (ACDF). L’ajout de l’endoscopie rachidienne à la chirurgie traditionnelle ACDF amplifie le champ opératoire et permet des opérations plus précises, améliorant ainsi la sécurité chirurgicale. En postopératoire, les patients ont constaté des améliorations significatives de la fonction neurologique, sans complications telles que dysphagie, hématome ou lésion de la moelle épinière. L’imagerie postopératoire a révélé que la compression de la moelle épinière était complètement soulagée, avec une décompression suffisante de la moelle épinière et un placement optimal de la cage de fusion. Le champ visuel dégagé fourni par l’endoscopie rachidienne améliore l’identification des structures anatomiques cervicales pendant la chirurgie, réduisant ainsi efficacement le risque de lésion de la moelle épinière et des nerfs. L’ACDF assistée par endoscope a démontré d’excellents résultats cliniques et radiologiques dans le traitement de la MCS.
Introduction
La myélopathie spondylotique cervicale (MCS) est l’une des formes les plus graves de spondylose cervicale. La MCS est un groupe de syndromes causés par des modifications dégénératives de la colonne cervicale, entraînant une dégénérescence des structures environnantes telles que les disques intervertébraux et les ligaments. Ces structures compriment ensuite la moelle épinière, entraînant un dysfonctionnement des membres, voire une paralysie. Un diagnostic précoce et une intervention rapide sont essentiels pour améliorer le pronostic du patient. Une intervention chirurgicale est souvent nécessaire lorsque les traitements conservateurs échouent ou que le dysfonctionnement de la moelle épinière s’aggrave 1,2.
Plusieurs options chirurgicales sont disponibles pour le traitement de la myélopathie spondylotique cervicale (MCS), notamment la discectomie et la fusion cervicales antérieures traditionnelles (ACDF), la corpectomie et la fusion cervicales antérieures (ACCF), le remplacement du disque cervical (CDR) et la chirurgie hybride (HS), qui combine ACDF et CDR3. La discectomie et fusion cervicales antérieures traditionnelles (ACDF) est une approche de traitement courante de la MCS qui atténue efficacement les symptômes en décompressant directement la moelle épinière et les racines nerveuses. Cependant, cette chirurgie traditionnelle présente des limites, notamment un champ opératoire étroit et des défis liés à l’hémostase peropératoire. Ces problèmes sont particulièrement prononcés chez les patients présentant une ossification du ligament longitudinal postérieur (OPLL), ce qui empêche le matériau compressif d’être complètement retiré pendant la chirurgie et augmente considérablement le risque de lésion de la moelle épinière 4,5,6. En 1983, Bollati a rapporté 57 chirurgies cervicales antérieures réalisées à l’aide d’un microscope ; Ces patients ont démontré une réduction substantielle des complications postopératoires et une augmentation de l’innocuité et de l’efficacité7. Par rapport à l’ACDF traditionnelle, les techniques microchirurgicales offrent certains avantages ; Cependant, des défis tels qu’une précision insuffisante, une mauvaise coordination œil-main et des angles morts dans le domaine chirurgical sont toujours présents, limitant l’application clinique de ces techniques8.
Les techniques chirurgicales endoscopiques de la colonne vertébrale, caractérisées par une plus grande clarté visuelle, une excellente identification des tissus et une flexibilité opérationnelle, ont été largement appliquées dans les chirurgies de la colonne lombaire et ont obtenu des résultats cliniques favorables 9,10,11. Par conséquent, nous avons intégré des techniques d’endoscopie vertébrale avec l’ACDF traditionnel pour éliminer complètement l’ossification ou le tissu du noyau pulpeux libre situé en avant de la moelle épinière sous le champ chirurgical dégagé fourni par l’endoscope rachidien. Cette approche élimine les angles morts associés aux chirurgies traditionnelles et réduit considérablement le risque de lésion peropératoire de la moelle épinière. Cet article vise à présenter les principaux aspects techniques de l’ACDF assisté par endoscope. Comme la chirurgie traditionnelle de l’ACDF a été décrite en détail dans des études antérieures12, elle ne sera pas réitérée dans cet article.
Protocole
Cette étude a été approuvée par le Comité d’éthique de l’Hôpital général du Hebei. Le consentement éclairé a été obtenu de tous les participants.
1. Préparation préopératoire
- Avant l’opération, placez le patient en position couchée sur le lit d’hôpital, avec des oreillers moelleux sous les deux épaules et un oreiller cylindrique sous l’occiput pour maintenir la colonne cervicale en position hyperétendue.
REMARQUE : Cette étape a deux objectifs : (1) permettre au patient de s’adapter à la position chirurgicale et (2) évaluer, pendant que le patient était éveillé, si l’hyperextension aggrave les symptômes neurologiques. - Planification de l’opération sur l’image : Acquérir une tomodensitométrie (TDM) préopératoire avec reconstructions sagittale et coronale pour détecter l’ossification du ligament longitudinal postérieur (OPLL). Effectuer une imagerie par résonance magnétique (IRM) pour évaluer la compression préopératoire de la moelle épinière.
REMARQUE : La distance d’ossification sur les images CT sagittales peut aider à déterminer les plages supérieure et inférieure de la fenêtre.
2. Marquage cutané et anesthésie
- Placez le patient en position couchée sur la table d’opération et faites des marques cutanées au niveau du segment chirurgical.
- Désinfectez le site chirurgical en appliquant de l’iode appliqué deux fois et suivi d’une application unique d’alcool à 75 %, en utilisant un mouvement circulaire du site d’incision vers l’extérieur. Planifiez l’incision comme une incision transversale sur la partie antérieure droite du cou.
- La gamme de désinfection chirurgicale couvre principalement la partie antérieure du cou et le haut du thorax. Assurez-vous que, verticalement, il s’étend du bord inférieur de la mandibule au bord supérieur du sternum et de la clavicule, et horizontalement, il atteint les bords latéraux des muscles sterno-cléido-mastoïdiens des deux côtés.
- Administrer la préoxygénation à l’aide d’un masque facial à oxygène pur de 5 L/min pendant au moins 3 minutes pour maintenir une saturation en oxygène pulsée de 100 % avant de commencer l’induction de l’anesthésie générale. Demandez à un seul anesthésiste d’administrer par voie intraveineuse l’injection de citrate de sufentanil (0,3 à 0,5 μg/kg), le bésylate de cisatracurium pour injection (0,15 à 0,20 mg/kg) et l’injection d’étomidate (0,2 à 0,4 mg/kg), tout en surveillant en permanence l’électrocardiogramme (ECG), la pression artérielle et la saturation en oxygène pour assurer la sécurité peropératoire.
3. Exposition du segment touché
- Faites une incision transversale d’environ 3 cm de longueur sur la partie antérieure droite du cou (figure 1).
- À l’aide de l’approche Smith-Robinson, exposez la face antérieure du corps vertébral cervical et du disque intervertébral12. Utilisez la fluoroscopie peropératoire de l’arceau pour confirmer l’espace du disque cible.
- Incisez l’anneau fibreux du segment affecté et retirez progressivement le disque intervertébral et les plaques cartilagineuses jusqu’à ce que le bord postérieur du corps vertébral soit atteint.
- Installez un écarteur Caspar et insérez le système d’endoscope rachidien dans l’espace intervertébral (Figure 2).
4. Procédures endoscopiques pour la colonne cervicale
- Sous la visualisation endoscopique de la colonne vertébrale, adressez-vous aux éperons osseux à la marge postérieure du corps vertébral cervical et élargissez l’espace intervertébral. À l’aide d’une meule, retirez les éperons osseux supérieurs et inférieurs ainsi que les points d’attache de l’anneau fibreux.
- L’amplitude de l’ablation osseuse des deux côtés s’étend aux articulations uncovertébrales ; Déterminer l’étendue de l’exérèse crânienne et caudale sur la base de la localisation et de la taille de l’ossification observée à l’imagerie préopératoire, en assurant une exérèse suffisante aux deux extrémités.
- Exciser l’anneau fibreux profond. Utilisez alternativement des pinces à noyau pulpeux, des coups de poing Kerrison et d’autres outils pour décompresser le canal rachidien, en étendant progressivement la décompression vers la moelle épinière (Figure 3).
REMARQUE : Au cours du processus d’ébavurage, les techniques de meulage latéral et de meulage par traction ascendante ont été priorisées pour éviter l’enlèvement excessif de l’os superficiel, protégeant ainsi la plaque d’extrémité osseuse. L’utilisation d’un endoscope rachidien avec un angle de 30°, une capacité d’inclinaison et une fraise multidirectionnelle a encore élargi la plage de décompression et assuré une plus grande précision chirurgicale.
- Inciser le ligament longitudinal postérieur (LPL) pour exposer la moelle épinière. Une fois que l’anneau fibreux et la couche superficielle de la LPL ont été incisés, utilisez un poinçon Kerrison et un couteau à crochet pour couper la LPL molle et séparer l’espace entre la LPL et la moelle épinière (Figure 4).
REMARQUE : Une fois que l’espace entre la moelle épinière et la PLL sont séparés, la décompression ultérieure devient considérablement plus facile. L’ablation de l’ELP et l’exposition de la moelle épinière sont des étapes essentielles de cette procédure. - Pour les patients atteints d’OPLL, commencez la procédure par l’ablation de la PLL molle et l’exposition de la moelle épinière. Utilisez un dissecteur de la racine nerveuse pour évaluer l’espace entre l’ossification et la moelle épinière afin de confirmer s’il y a adhérence entre l’ossification et la dure-mère. À l’aide d’une pince nucleus pulposus à 45° ou d’un poinçon Kerrison, vous retirerez progressivement le ligament ossifié jusqu’à ce que la dure-mère soit complètement exposée. Effectuer une visualisation endoscopique pour vérifier si la pulsation de la dure-mère est satisfaisante (Figure 5).
REMARQUE : Au cours de ce processus, une meule, un dissecteur de la racine nerveuse, une pince à noyau pulpeux ou un poinçon Kerrison ont été utilisés en alternance pour augmenter la flexibilité et la sécurité opérationnelles. - Utilisez des sondes d’électrocoagulation bipolaires pour l’hémostase et appliquez de la gélatine liquide pour aider à contrôler les saignements. Une fois que l’on a confirmé que le champ opératoire est exempt de saignement actif, retirez lentement l’endoscope rachidien (Figure 6).
REMARQUE : Évitez de retirer rapidement l’endoscope rachidien pour prévenir la hernie durale causée par une pression négative. - Remplissez une cage en maille de titane de taille appropriée avec de l’os autologue et insérez-la dans l’espace intervertébral. Sélectionnez une plaque de titane suffisamment longue pour couvrir le segment chirurgical et implantez six vis dans les vertèbres pour fixer la plaque de titane, en suivant la procédure standard de l’ACDF12 traditionnel pour assurer la stabilité postopératoire et la fusion réussie.
5. Soins postopératoires
- Effectuer une surveillance continue de l’ECG et administrer l’inhalation et la nébulisation intermittentes d’oxygène ; Encouragez le patient à tousser et à expectorer.
- Évaluez l’intensité de la douleur du patient par enquête et administrez rapidement des analgésiques non stéroïdiens au besoin.
- Surveillez de près les changements dans la force musculaire des membres et la fonction sensorielle.
- Retirer le tube de drainage lorsque le volume de drainage est inférieur à 30 mL dans les 24 heures suivant l’opération.
Résultats
Cette étude a porté sur 20 patients qui ont subi une chirurgie ACDF assistée par endoscope de janvier 2024 à novembre 2024. L’âge moyen était de 62,2 ans et l’échantillon de l’étude comprenait 9 femmes et 11 hommes. La durée moyenne de l’opération était de 125,5 min, et le volume moyen de perte de sang était de 59,0 mL (tableau 1 et tableau 2). Tous les patients ont réussi à soulager les symptômes de la moelle épinière, avec des scores postopératoires plus faibles sur l’échelle visuelle analogique (EVA) par rapport aux scores préopératoires et des scores JOA postopératoires significativement améliorés. Le taux moyen d’amélioration du score JOA était de 60,7 %. Aucune complication, comme une dysphagie, un hématome ou une lésion de la moelle épinière, n’est survenue (tableau 1 et tableau 2). L’imagerie postopératoire a confirmé l’ablation complète du matériau compressif, une décompression suffisante de la moelle épinière et la mise en place correcte de la cage de fusion (figures 7 et 8).
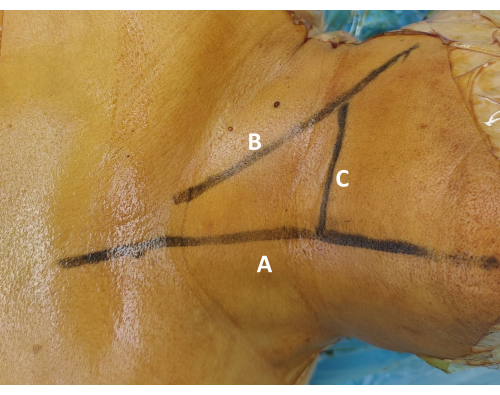
Figure 1 : Marquage de surface du segment chirurgical. (A) Tracez le marquage de la ligne médiane le long de la ligne médiane trachéale pour assurer la symétrie chirurgicale. (B) Tracez la ligne de localisation transversale le long du bord supérieur de la clavicule. Palper le muscle sterno-cléido-mastoïdien et le cartilage cricoïde pour guider ce marquage. (C) Confirmez le marquage du niveau cible à l’aide d’un guidage fluoroscopique et marquez la projection cutanée correspondante du disque intervertébral prévu. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Procédures préopératoires pour l’endoscopie rachidienne. (A) Positionnement peropératoire de la fluoroscopie de l’arceau. (B) Installation d’un enrouleur Caspar. (C) Endoscopie rachidienne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
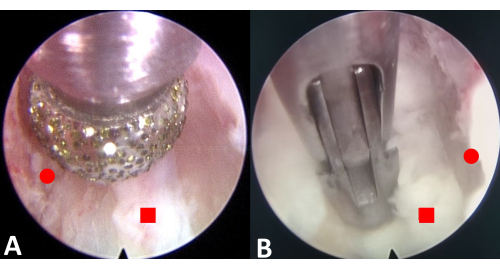
Figure 3 : Excision endoscopique des ostéophytes et de l’anneau fibreux. (A) Meuler les ostéophytes supérieurs et inférieurs. (B) Réséquer l’anneau fibreux. Le cercle rouge représente l’ostéophyte, et le carré rouge représente l’anneau fibreux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
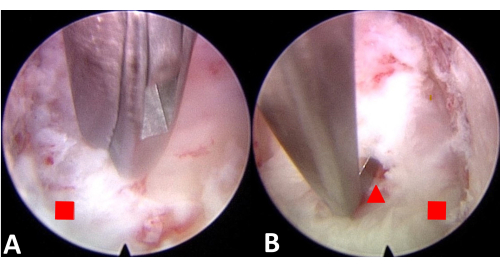
Figure 4 : Incision endoscopique de la LPL et séparation de la LPL de la moelle épinière pour créer de l’espace. (A) Inciser la LPL. (B) Séparez la PLL de la moelle épinière. Le carré rouge représente le ligament longitudinal postérieur et le triangle rouge représente la moelle épinière. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Excision endoscopique de l’ossification. (A) Évaluer l’espace entre le tissu ossifié et la moelle épinière. (B) Exciser le ligament ossifié. Le triangle rouge représente la moelle épinière et la flèche rouge pointe vers l’ossification du ligament longitudinal postérieur. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Hémostase. (A) Point de saignement. (B) Hémostase sous visualisation endoscopique. L’astérisque représente le point de saignement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
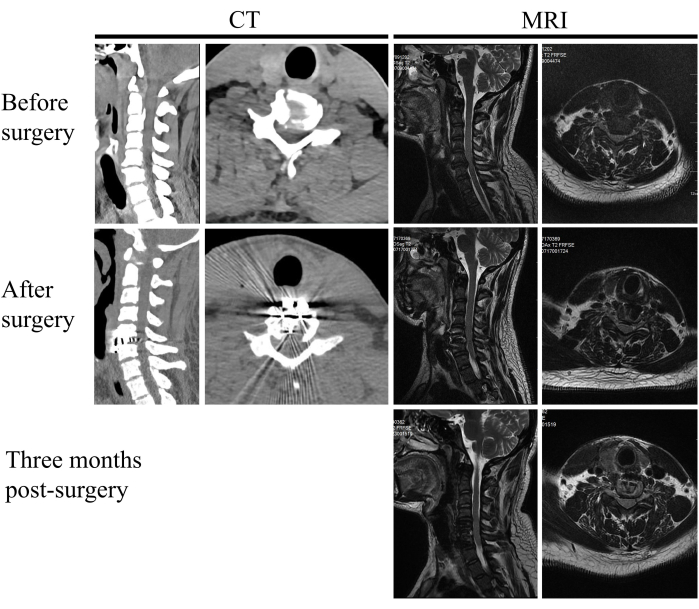
Figure 7 : Imagerie pré et postopératoire. Un patient atteint de myélopathie spondylotique cervicale avant la chirurgie, après la chirurgie et 3 mois après la chirurgie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
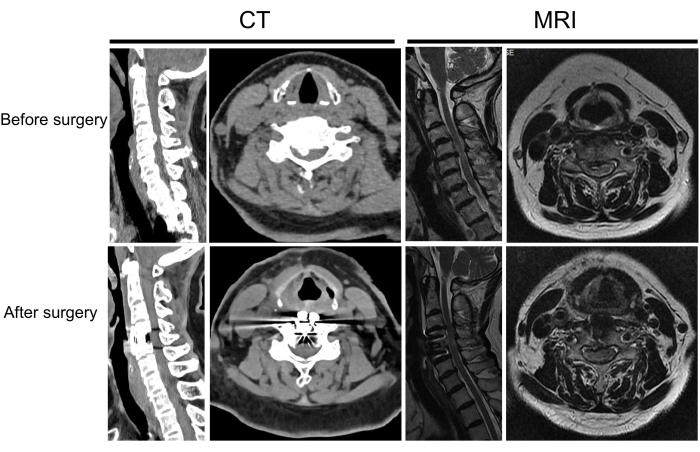
Figure 8 : Imagerie pré et postopératoire d’un autre patient. Un patient atteint de myélopathie spondylotique cervicale avant et après la chirurgie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Renseignements pour le patient. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Caractéristiques chirurgicales et résultats postopératoires. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
La discectomie et fusion cervicales antérieures (ACDF) est une méthode chirurgicale courante pour traiter la myélopathie spondylotique cervicale (MCS) et a des résultats cliniques satisfaisants 13,14. Cependant, la chirurgie traditionnelle est confrontée à des défis tels qu’un champ opératoire limité et des difficultés d’hémostase. Ces problèmes sont particulièrement prononcés en cas d’ossification du ligament longitudinal postérieur (LPO) ou de hernie discale à distance ; Dans ces cas, le matériau compressif ne peut pas être complètement retiré en peropératoire et le risque de lésion de la moelle épinière reste élevé15.
Avec les progrès des techniques de chirurgie rachidienne mini-invasive, l’application de l’endoscopie microscopique dans l’ACDF a progressivement augmenté, élargissant le champ chirurgical et améliorant la précision opératoire. Cependant, la procédure assistée par microscope présente encore des limites, telles qu’une mauvaise coordination œil-main et des angles morts dans le champ de vision8. La discectomie cervicale antérieure endoscopique complète (FACD) est une procédure peu invasive. Par rapport à la chirurgie conventionnelle, la FACD réduit considérablement les lésions des tissus mous, le temps opératoire et les complications. Le processus de récupération est rapide, il n’est pas nécessaire de recourir à d’autres interventions chirurgicales16.
Cependant, l’ACDF assistée par endoscope offre plusieurs avantages par rapport à la décompression cervicale antérieure endoscopique complète, notamment en termes de stabilité postopératoire, d’indications plus larges et de facilité d’exécution chirurgicale. En incorporant la fusion intersomatique avec une cage et une fixation de plaque en titane, il améliore la stabilité segmentaire et minimise le risque de perte ou de récidive de la hauteur du disque postopératoire, ce qui est une préoccupation avec les techniques d’endoscopie complète sans fusion. De plus, l’ACDF assistée par endoscope est mieux adaptée aux maladies à plusieurs niveaux, aux dégénérescences discales sévères et aux cas d’ossification du ligament longitudinal postérieur (OPLL), où la décompression endoscopique complète peut être insuffisante. Cette technique offre également un champ opératoire plus large, permettant une décompression neurale plus complète et réduisant le risque de compression résiduelle. De plus, il suit la procédure standard ACDF, ce qui le rend plus facile à adopter par les chirurgiens par rapport à l’approche endoscopique complète techniquement exigeante.
Alors que la décompression antérieure endoscopique complète est avantageuse pour certains cas de hernie discale molle à un seul niveau, l’ACDF assistée par endoscope reste une option plus polyvalente et reproductible pour un plus large éventail de pathologies de la colonne cervicale. L’ACDF assisté par endoscope a obtenu d’excellents résultats cliniques et radiologiques, démontrant une efficacité fiable et une sécurité chirurgicale élevée. Wu et al.17. a constaté que l’ACDF assisté par endoscope offre des avantages significatifs par rapport à l’ACDF traditionnel, notamment un champ opératoire plus clair, moins de perte de sang peropératoire et un risque plus faible de lésions nerveuses. Cependant, ils ont également signalé une durée opératoire plus longue en raison de la complexité des techniques endoscopiques. Nos résultats sont cohérents avec leurs résultats, car notre étude a également démontré une durée chirurgicale légèrement prolongée avec l’ACDF assisté par endoscope. Néanmoins, la durée prolongée n’a pas d’impact significatif sur les résultats cliniques, et les avantages d’une meilleure visualisation et d’une réduction des traumatismes l’emportent sur cette limitation, ce qui fait de l’ACDF assisté par endoscope une alternative viable aux ACDF.As traditionnels un nouvel outil de grossissement pour l’ACDF, l’endoscopie spinale offre une visualisation plus claire et une plus grande flexibilité opérationnelle, ce qui résout efficacement ces problèmes.
Les avantages des opérations assistées par endoscopie sont les suivants. Tout d’abord, sous endoscopie spinale, la PLL peut être distinguée plus en détail, ce qui permet une dissection nette à l’aide de poinçons Kerrison. L’endoscope offre une vue plus claire de la moelle épinière, ce qui permet au chirurgien d’évaluer avec précision l’adéquation de la décompression et de minimiser efficacement le risque de lésion de la moelle épinière. De plus, l’utilisation d’une meule permet une opération à proximité, assurant une élimination plus précise et plus complète des éperons osseux. Par rapport à l’œil nu et au microscope, l’endoscope offre une visualisation supérieure lors de l’exposition et de la décompression des articulations non vertébrales bilatérales.
Deuxièmement, l’endoscope rachidien offre une plus grande liberté d’utilisation grâce à son angle de vision intégré de 30° et à sa tête de fraise réglable, ce qui permet une plage de décompression plus large. Cette caractéristique améliore la flexibilité et la précision lors du travail dans des régions anatomiques complexes. Troisièmement, l’endoscopie à médiation hydrique permet une identification plus précise des points de saignement. Pour les saignements à la marge postérieure du corps vertébral, la sonde radiofréquence incurvée peut atteindre et traiter le site de saignement avec précision, améliorant considérablement l’efficacité hémostatique et la précision chirurgicale. Quatrièmement, le système endoscopique minimise les interférences des mains du chirurgien, réduisant ainsi le nombre de points aveugles dans le champ opératoire. La conception coaxiale de l’endoscope s’aligne sur les habitudes de fonctionnement des chirurgiens endoscopiques, évitant les collisions d’instruments et assurant des procédures plus fluides et plus efficaces.
Cependant, l’application des techniques d’endoscopie vertébrale présente également certains défis, tels que la durée prolongée des opérations et la nécessité de chirurgiens possédant des compétences chirurgicales avancées et une connaissance détaillée de la microanatomie. De plus, bien que la chirurgie endoscopique offre un champ visuel plus large, le champ peut encore être limité dans des cas extrêmement complexes. Avec l’avancement continu de la technologie et les améliorations des instruments chirurgicaux, nous pensons que l’utilisation de l’endoscopie vertébrale dans la chirurgie de la colonne cervicale va progressivement mûrir et que le temps opératoire va encore diminuer.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Aucun
matériels
| Name | Company | Catalog Number | Comments |
| 75% alcohol | Hebei Ruihe Medical Equipment Co., Ltd | CC-01A | PEEK |
| Anterior Cervical Nail Plate Fixation System | Hebei Ruihe Medical Equipment Co., Ltd | PN-03 | Plate:TA3G, Nail:TC4 |
| Cervical Fusion Cage | |||
| cisatracurium besylate | SPINENDOS GmbH | SP081430.030 | Inner diameter:4.3 mm; Outer diameter:7.0 mm; Field angle: 80 °; Visual angle: 30 °; Working length: 181 mm |
| Endoscope system | SPINENDOS GmbH | SP082628.351 | Φ2.5 mm × 310 mm |
| Endoscopic forceps | SPINENDOS GmbH | SP082700.040L | Φ4.0 mm × 360 mm |
| Endoscopic hook | XIYI | MQZ | Φ3.2 mm × 328 mm |
| Endoscopic rongeur | ELLIQUENCE | DTF-40 | 40 cm |
| etomidate | SPINENDOS GmbH | SP082781.835 | Φ2.5 mm × 330 mm |
| High-speed burr | Neusoft Corporation | ||
| Interventional radiology | Ferrosan Medical Devices A/S | MS0010 | |
| iodine | Sichuan Guona Technology Co.,LTD | NNBP/40D/ | |
| Neusoft PACS/RIS | Elliquence, LLC | DTF-40 | |
| n-HA/PA66 | SPINENDOS GmbH | SP082615.265 | Φ7.2 mm × 178 mm |
| sufentanil citrate injection | |||
| SURGIFLO Haemostatic Matrix | |||
| Trigger-Flex Bipolar System | |||
| Working sheath |
Références
- Bakhsheshian, J., Mehta, V. A., Liu, J. C. Current diagnosis and management of cervical spondylotic myelopathy. Global Spine J. 7 (6), 572-586 (2017).
- McCormick, J. R., Sama, A. J., Schiller, N. C., Butler, A. J., Donnally, C. J. III Cervical spondylotic myelopathy: A guide to diagnosis and management. J Am Board Fam Med. 33 (2), 303-313 (2020).
- Visocchi, M., et al. Hybrid implants in anterior cervical decompressive surgery for degenerative disease. J Craniovertebr Junction Spine. 12 (1), 54-60 (2021).
- Lee, C. J., Boody, B. S., Demeter, J., Smucker, J. D., Sasso, R. C. Long-term radiographic and functional outcomes of patients with absence of radiographic union at 2 years after single-level anterior cervical discectomy and fusion. Global Spine J. 10 (6), 741-747 (2020).
- Luo, H. T., et al. Meta-analysis of the treatment of cervical spondylosis by microscopy-assisted and traditional anterior cervical decompression under direct vision. Chin J Tissue Eng Res. 24 (9), 1369-1377 (2020).
- Marawar, S., et al. National trends in anterior cervical fusion procedures. Spine (Phila Pa 1976). 35 (15), 1454-1459 (2010).
- Bollati, A., Galli, G., Gandolfini, M., Marini, G., Gatta, G. Microsurgical anterior cervical disk removal without interbody fusion. Surg Neurol. 19 (4), 329-333 (1983).
- Damodaran, O., Lee, J., Lee, G. Microscope in modern spinal surgery: Advantages, ergonomics and limitations. ANZ J Surg. 83 (4), 211-214 (2013).
- Liu, L., Dong, J., Wang, D., Zhang, C., Zhou, Y. Clinical outcomes and quality of life in elderly patients treated with a newly designed double tube endoscopy for degenerative lumbar spinal stenosis. Orthop Surg. 14 (7), 1359-1368 (2022).
- Han, S., et al. Clinical application of large channel endoscopic systems with full endoscopic visualization technique in lumbar central spinal stenosis: A retrospective cohort study. Pain Ther. 11 (4), 1309-1326 (2022).
- Liang, J., Li, H., Tao, Y., Yuan, W., Wang, H. Efficacy and complications of unilateral biportal endoscopic spinal surgery for lumbar spinal stenosis: A meta-analysis and systematic review. World Neurosurg. 159, e91-e102 (2022).
- Tian, X., Rudd, S., Yang, D., Ding, W., Yang, S. Anterior cervical hybrid decompression and fusion surgery to treat multilevel cervical spondylotic myelopathy. J Vis Exp. (196), e65034(2023).
- Sun, X., et al. The frequency and treatment of dural tears and cerebrospinal fluid leakage in 266 patients with thoracic myelopathy caused by ossification of the ligamentum flavum. Spine (Phila Pa 1976). 37 (12), E702-E707 (2012).
- Wang, T., et al. Anterior cervical discectomy and fusion versus anterior cervical corpectomy and fusion in multilevel cervical spondylotic myelopathy: A meta-analysis. Medicine (Baltimore). 95 (49), e5437(2016).
- Nakajima, H., et al. Long-term outcome of anterior cervical decompression with fusion for cervical ossification of posterior longitudinal ligament including postsurgical remnant ossified spinal lesion. Spine (Phila Pa 1976). 44 (24), E1452-E1460 (2019).
- Ruetten, S., Komp, M., Merk, H., Godolias, G. Full-endoscopic anterior decompression versus conventional anterior decompression and fusion in cervical disc herniations. Int Orthop. 33 (6), 1677-1682 (2009).
- Wu, Z. P., Wei, Z. Y., Song, X. L. Comparison of efficacy between endoscope-assisted anterior cervical discectomy and fusion (ACDF) and open ACDF in the treatment of single-segment cervical spondylotic myelopathy. J Orthop Surg Res. 19 (1), 35(2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon