Method Article
Tratamiento quirúrgico del varicocele de grado III mediante derivación de vena espermática-vena abdominal superficial
En este artículo
Resumen
En este trabajo presentamos un protocolo para el tratamiento quirúrgico del varicocele grado III que tiene como objetivo reconstruir el drenaje venoso del cordón espermático mediante una derivación vena espermática-vena abdominal superficial realizada al microscopio.
Resumen
La varicocelectomía microquirúrgica es el método más utilizado para el tratamiento del varicocele (VC) en los últimos años. Sin embargo, es técnicamente exigente con el riesgo de dañar la estructura anatómica normal del cordón espermático, como el músculo cremaster, la arteria testicular y los conductos deferentes durante la ligadura del plexo pampiniforme. Además, la varicocelectomía tradicional dificulta el drenaje de la sangre venosa estancada del testículo afectado, lo que resulta en una apariencia escrotal persistente de venas varicosas y una remisión más lenta de la sensación de hinchazón en pacientes postoperatorios con VC grado III. Por lo tanto, desarrollamos una varicocelectomía retroperitoneal con un procedimiento microscópico espermático venoso-superficial de la vena de la pared abdominal. La vena espermática fue seccionada y ligada proximalmente a través del espacio retroperitoneal. Luego, se liberó la vena espermática distal y se pasó a través del anillo interno; Debajo de la piel de la ingle, se realizó una anastomosis vascular microscópica para construir el bypass de la vena espermática distal y la vena epigástrica inferior proximal. La ligadura alta facilita la protección de la anatomía normal del cordón espermático, y el bypass venoso permite un drenaje rápido de la sangre testicular, lo que puede mejorar eficazmente el grado de varicocele, el dolor testicular e incluso la función espermatogénica. En conclusión, el presente protocolo describe una forma prometedora de reconstruir el retorno espermático a través de la ligadura retroperitoneal alta de la vena espermática y la anastomosis de la vena espermática-vena epigástrica inferior, lo que resultó en una mejoría más rápida y evidente de los síntomas y un mejor pronóstico de la VC grado III.
Introducción
La incidencia de varicocele (VC) en varones adultos es del 11,7%, y en varones con calidad seminal anormal, la incidencia es de hasta el 25,4%1. Las manifestaciones clínicas incluyen síntomas de crecimiento testicular ipsilateral y trastornos del desarrollo acompañados de dolor, malestar, baja fertilidad e hipogonadismo. Los exámenes clínicos de especialistas pueden detectar y clasificar el varicocele2. El grado VC III muestra positivo para palpación clínica y varicocele ultrasónico, diámetro interno ≥ 3,1 mm y tiempo de reflujo ≥ 6 s, a menudo acompañado de dolor testicular más severo o molestias con hinchazón 3,4.
Estudios recientes han demostrado que la varicocelectomía microquirúrgica VC es considerada como la forma más efectiva de reparación de VC debido a sus ventajas de menor complicación y baja tasa de recurrencia 5,6,7. Sin embargo, este procedimiento tiene algunas deficiencias: como en el pasado, a menudo se utilizan incisiones escrotales, inguinales o subinguinales, que dañan fácilmente el músculo cremaster, la arteria testicular, la arteria deferente y los vasos linfáticos. Especialmente en la VC de grado III, es más probable que se lesione accidentalmente debido a las muchas ramas del plexo pampiniforme, y el daño a la estructura anatómica normal del cordón espermático causará complicaciones postoperatorias como dolor testicular, hinchazón y atrofia8. Además, la varicocelectomía tradicional por ligadura simple de la vena espermática dificulta el drenaje de la sangre venosa estancada del testículo afectado, lo que resulta en una aparición escrotal persistente de venas varicosas y una remisión más lenta de la sensación de hinchazón en pacientes postoperatorios con VC grado III y el alivio del dolor testicular o la molestia de la hinchazón es lento o no evidente. con escasa eficacia9. Es propicio para restaurar la hemodinámica fisiológica de los testículos mediante la reparación del varicocele en lugar de la simple varicocelectomía10. Por ejemplo, también se ha descrito la anastomosis microscópica interna de la vena espermática inferior-vena epigástrica inferior aplicada al tratamiento del varicocele11. En este trabajo describimos un protocolo para el tratamiento quirúrgico del varicocele grado III que tiene como objetivo ligar las venas espermáticas a un nivel retroperitoneal alto y reconstruir el drenaje venoso del cordón espermático mediante una derivación vena espermática-vena abdominal superficial (también conocida como vena epigastrina superficial o vena epigástrica superficial) bajo el microscopio.
Para este estudio, se realizó un análisis retrospectivo de los datos clínicos de 96 pacientes hospitalizados desde junio de 2018 hasta agosto de 2021 que presentaban VC grado III y se quejaban de dolor testicular o molestias distensivas, que habían recibido ligadura venosa espermática y que contaban con datos de seguimiento completos. La puntuación del dolor se evaluó mediante puntuación visual (EVA). Se dividieron en dos grupos según los métodos quirúrgicos: el grupo de estudio A fue tratado con ligadura alta de la vena espermática bajo microscopio y transferencia de vena abdominal espermática local-superficial (49 casos), y el grupo de estudio B fue tratado con ligadura baja de la vena espermática bajo microscopio (47 casos).
Protocolo
Este estudio fue aprobado por el comité de ética del Primer Hospital Afiliado, Universidad Sun Yat-sen (NO. 2020-478), antes del inicio del estudio clínico. Todos los sujetos dieron su consentimiento informado antes del estudio. Los criterios de inclusión para los casos son: (1) varicocele grado III confirmado por palpación clínica y examen ultrasónico del varicocele ≥ 3,1 mm de diámetro interno y tiempo de reflujo ≥ 6 s; (2) Dolor y malestar escrotal combinados; (3) Tratamiento quirúrgico completo para el varicocele en el hospital. Criterios de exclusión: (1) cualquiera de los siguientes antecedentes relacionados con la pelvis: operación pélvica, radioterapia pélvica o traumatismo pélvico; (2) enfermedad de la piel perineal; o (3) contraindicaciones quirúrgicas.
1. Alta ligadura de venas espermáticas
- Administrar anestesia inhalatoria intravenosa y evaluar la profundidad mediante la desaparición de la conciencia del paciente y la respuesta al dolor, así como la relajación del músculo esquelético.
- Realizar una incisión oblicua externa paralela a la ingle a través del anillo interno con una longitud de 3 cm. Cortar la piel y el tejido subcutáneo con un bisturí, y utilizar un bisturí eléctrico unipolar combinado con separación roma para separar la aponeurosis de los músculos oblicuos externos y oblicuos internos. Luego, en la parte exterior de la incisión, se aplican fórceps a través del oblicuo interno hasta el retroperitoneo.
- Empuje el tejido peritoneal con una gasa húmeda de solución salina y encuentre la vena espermática flexionada y engrosada delante del músculo psoas mayor y detrás del peritoneo, prestando atención a la protección de la arteria.
- La vaina del cordón espermático se abrió sin obstáculos con una pinza vascular para liberar cuidadosamente una vena espermática de unos 6-8 cm de longitud hasta el extremo proximal. Levante el cabestrillo vascular, lige el extremo proximal con una sutura 2-0 no absorbible y corte. Levante el nudo final distal y libérelo hasta las proximidades de la unión peritoneal. Utilice la vena espermática con un diámetro mayor para la derivación posterior de la vena espermática inferior a la vena epigástrica (Figura 1).
- Libar otras ramas de la vena espermática con una sutura 2-0 no absorbible.
2. Liberación de la vena epigástrica inferior
- En el aspecto medial de la incisión, identifique y retraiga el cordón espermático. La vena epigástrica inferior se localizaba debajo de la fascia que rodeaba el cordón espermático a la izquierda del anillo interno.
- Levante el cabestrillo vascular, libere la vena epigástrica inferior con una longitud suficiente de unos 3 cm hacia su extremo distal y observe la dirección del flujo sanguíneo. Tras la ligadura con sutura 3-0 no reabsorbible, se extirpó el extremo distal y se disecó el extremo proximal para su posterior anastomosa con el extremo distal de la vena espermática con pinza vascular (Figura 2).
3. Anastomosis de la vena espermática - vena epigástrica inferior
- Basándose en la manipulación de pinzas de flexión, la vena espermática se guió cuidadosamente a través de la abertura del anillo interno a la incisión abdominal y se aseguró con una pinza vascular en preparación para la anastomosis posterior con la vena epigástrica inferior.
- Compruebe que no haya tensión en relación con la vena superficial libre de repuesto de la pared abdominal y, a continuación, sutura 6-8 puntos con 8-0 Sutura de polipropileno (Figura 3).
- Suelte la pinza vascular para asegurarse de que la vena esté llena, que el flujo sanguíneo sea suave y que no haya fugas de sangre al presionar el testículo.
4. Cierre de la incisión
- Para cerrar la incisión capa por capa, utilice suturas absorbibles 2-0 para suturar la aponeurosis oblicua externa y el tejido subcutáneo. Use suturas absorbibles 3-0 para suturar la piel.
5. Manejo postoperatorio
- Pida al paciente que preste atención al descanso y evite el ejercicio extenuante. Después de la cirugía, administrar una inyección subcutánea de 40 mg de Enoxaparina Sódica, y al día siguiente, cambiar a Rivaroxabán oral, 10 mg diarios durante 1 mes.
Resultados
Para este estudio, los 96 pacientes se dividieron en dos grupos: grupo de estudio A, tratado con ligadura alta de la vena espermática al microscopio y transferencia de vena espermática-vena epigástrica inferior (49 casos), y grupo de estudio B, tratado con ligadura baja 9,12,13,14,15 de la vena espermática al microscopio (47 casos). Los datos básicos, el tiempo de operación, la estancia hospitalaria, el edema escrotal postoperatorio, la puntuación de dolor o molestias por hinchazón testicular y la remisión del varicocele se compararon entre los dos grupos durante 1 mes después de la operación. Los datos de medición se expresaron como media ± desviación estándar, y se utilizó una prueba t de muestra independiente para la comparación. Los datos de conteo se expresan como porcentajes (%) y se comparan mediante la prueba de chi-cuadrado con p <0,05, lo que indica una diferencia estadísticamente significativa.
No hubo diferencias significativas en la edad, el IMC, el grado de varices y la puntuación de dolor testicular entre los 2 grupos (p>0,05; Tabla 1). No hubo diferencia significativa en la duración de la estancia hospitalaria entre el grupo A y el grupo B, 5,32 ± 0,42 días vs. 5,16 ± 0,28 días (p>0,05; Tabla 2). Sin embargo, el tiempo de operación del grupo A fue significativamente mayor que el del grupo B, 146,26 ± 14,33 min vs. 92,27 ± 8,66 min, y la diferencia fue estadísticamente significativa (p<0,01; Tabla 2). La incidencia de edema escrotal postoperatorio o hidrocele de testículo y epididimitis aguda en el grupo A fue menor que en el grupo B (0% vs. 5,1%, 0% vs. 6,0%, 0,9% vs. 7,7%, respectivamente; p<0,05; Tabla 2). Las tasas de alivio del dolor testicular o de las molestias distensivas en el grupo A y en el grupo B, 1 mes después de la cirugía, fueron del 91,8% y del 61,78%, respectivamente (Tabla 2). La disminución del varicocele fue de 0,16 ± 0,06 mm vs. 0,08 ± 0,04 mm para el grupo A y el grupo B, respectivamente, y la diferencia fue estadísticamente significativa (p<0,05; Tabla 2).
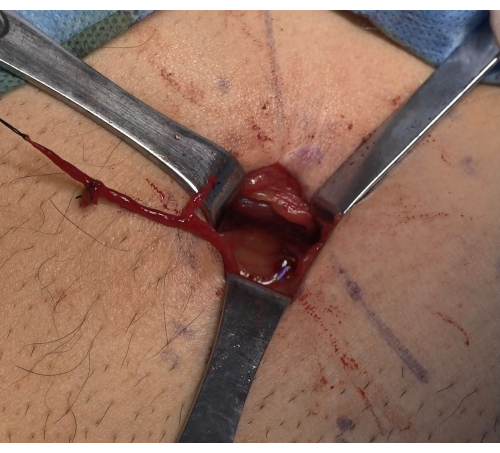
Figura 1: Disociación de una vena espermática de longitud suficiente. Selección de una vena espermática de mayor diámetro para la posterior derivación vena espermática-vena abdominal superficial. Haga clic aquí para ver una versión más grande de esta figura.
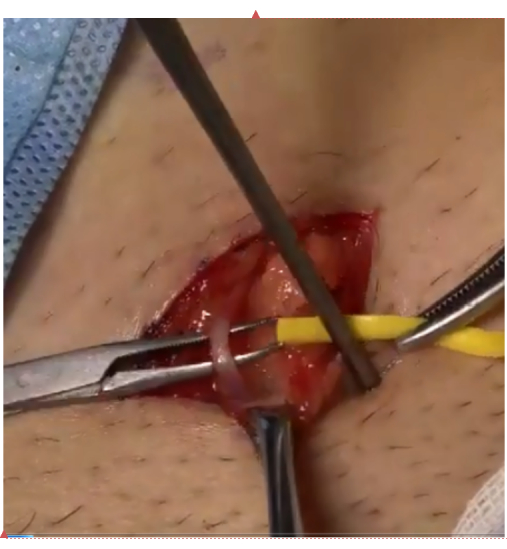
Figura 2: Disociación de la vena epigástrica inferior de longitud suficiente. Asegúrese de que la longitud y el diámetro estén a la veta espermática reservada. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Reconstrucción de la circunvalación. Bypass reconstruido entre la vena espermática y la vena superficial de la pared abdominal bajo microscopio. Haga clic aquí para ver una versión más grande de esta figura.
| Artículo | Grupo A | Grupo B | Valor T | Valor de p |
| Número de casos | 47 | 49 | ||
| Edad (años) | 32. 6±5. 4 | 30. 8±5. 1 | 1.16 | 0.14 |
| IMC | 20.64±3.34 | 20.09±3.91 | 0.83 | 0.38 |
| Curso de la enfermedad (años) | 3.8±1.3 | 4.3±1.4 | -1.682 | 0.078 |
| Ancho de la vena espermática (cm) | 3,62±0,41 | 3,67±0,35 | - 0. 665 | 0.512 |
| Puntuación de la EVA del dolor testicular | 3.6±1.5 | 3.4±1.7 | 0.186 | 0.398 |
Tabla 1: Comparación de los datos basales preoperatorios de los pacientes. Los datos de medición se expresan como media ± desviación estándar, y se utiliza una prueba t de muestra independiente para la comparación. Los datos de conteo se expresan como porcentajes (%) y se comparan mediante la prueba de chi-cuadrado con p <0,05, lo que indica una diferencia estadísticamente significativa.
| Artículo | Grupo A | Grupo B | Valor T | Valor de p | |
| Tiempo de operación | 146,26±14,33 | 92.27±8.66 | 6.5 | 0.015 | |
| Duración de la estancia | 5,32±0,42 | 5,16±0,28 | 1.7 | 0.093 | |
| 1 mes después de la cirugía para el estrechamiento del ancho de la vena espermática (cm) | 0,16±0,06 | 0,08±0,04 | -1.7 | <0.01 | |
| Tasa de alivio del dolor o malestar testicular | 91.80% | 61.78% | 0.047 | ||
| Complicación | Edema escrotal | 1 | 3 | ||
| (Número de casos) | Epididimitis | 0 | 1 | ||
| Hidrocele | 0 | 1 | |||
| Atrofia de los testículos | 0 | 0 | |||
Tabla 2: Comparación de índices perioperatorios. Los datos de medición se expresan como media ± desviación estándar, y se utiliza una prueba t de muestra independiente para la comparación. Los datos de conteo se expresan como porcentajes (%) y se comparan mediante la prueba de chi-cuadrado con p <0,05, lo que indica una diferencia estadísticamente significativa.
Discusión
Cada vez hay más evidencias que demuestran que la varicocelectomía microquirúrgica tiene más ventajas que la varicocelectomía abierta o laparoscópica para el tratamiento quirúrgico de la VC 5,6. El microscopio quirúrgico puede ampliar los detalles anatómicos con un campo de visión claro, y los vasos arteriovenosos, linfáticos y nerviosos se pueden discernir más fácilmente. Por el contrario, es difícil distinguir claramente las arterias y las venas en otros procedimientos quirúrgicos. Pueden pasar por alto los vasos venosos para la ligadura o lesionar accidentalmente los vasos linfáticos y los nervios que los acompañan, lo que conduce a complicaciones postoperatorias como dolor escrotal, edema testicular y recurrencia. Además, en la varicocelectomía microquirúrgica se suele adoptar una incisión sublingual o intralingual, que es conveniente para exponer las venas espermáticas 12,13. Sin embargo, las venas espermáticas internas en el canal inguinal tienen la forma del plexo pampiniforme con ramas más complejas en los niveles inferiores14,15. Todavía es difícil evitar daños potenciales en la anatomía del cordón espermático. Otro hecho que no puede ser ignorado es que la varicocelectomía no ha restablecido el drenaje venoso normal del cordón espermático, lo que causa edema testicular persistente10.
Recientemente, la reparación microscópica del varicocele mediante anastomosis interna de la vena espermática inferior-vena epigástrica inferior también se ha aplicado al tratamiento del varicocele11. Sin embargo, su objetivo principal es desviar la sangre del reflujo venoso renal para aliviar la carga sobre los riñones, mientras que nuestro objetivo es restablecer el flujo sanguíneo normal a los testículos. Del mismo modo, seleccionamos a los pacientes con varicocele grado III como sujetos de estudio, adoptamos una ligadura alta de la vena espermática con menos ramificaciones y construimos el bypass desde la vena espermática hasta la vena epigástrica inferior bajo un microscopio, que no solo conservó algunas de las ventajas de la varicocelectomía sino que también recuperó el drenaje venoso del cordón espermático para restaurar el reflujo venoso testicular. De esta manera, la sangre venosa estancada en los testículos puede drenarse después de la cirugía, lo que favorece la desaparición de las venas varicosas en la superficie del escroto.
Para lograr una cirugía exitosa, es necesario separar las venas de suficiente longitud libre y garantizar una anastomosis sin tensión. Además, la búsqueda de la vena epigástrica inferior es un desafío y requiere amplios conocimientos anatómicos.
Hay algunas limitaciones que deben abordarse. El protocolo quirúrgico añade más pasos quirúrgicos, aunque a medida que pasa el tiempo, nuestras técnicas quirúrgicas siguen madurando y el tiempo quirúrgico se sigue acortando. Estos pasos pueden traer complicaciones potenciales como sangrado y obstrucción durante la anastomosis. Exige mayores exigencias de técnicas microquirúrgicas y de manejo postoperatorio, incluyendo la aplicación de fármacos anticoagulantes. Además, el protocolo hace que sea poco práctico ligar la vena espermática externa y la vena gubernáculo, que se infieren como las vías de recurrencia más comunes. Además, es importante tener en cuenta que, debido al corto período de seguimiento, necesitamos comprender mejor la evaluación de los resultados a largo plazo, como la calidad del semen y la tasa de embarazo. Además, el tiempo quirúrgico del grupo A fue relativamente largo, lo que puede traer los riesgos asociados al largo tiempo quirúrgico, como el riesgo de anestesia16. Además, verificar y asegurar la permeabilidad a largo plazo de la vena espermática también es un tema que requiere seguimiento.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Esta investigación contó con el apoyo de una subvención del proyecto Plan de Ciencia y Tecnología de Guangdong, financiado por el Departamento de Ciencia y Tecnología de la provincia de Guangdong (número de subvención: 2021A1515410004); Centro de Investigación para el Desarrollo de Medicina y Ciencia y Tecnología de la Salud, Comisión Nacional de Salud (número de subvención: HDSL202001007).
Materiales
| Name | Company | Catalog Number | Comments |
| Clexan (Enoxaparin Sodium Injection) | Sanofi (Beijing) Pharmaceutical Co., LTD | ||
| CROWNJUN (Nylon suture) | Kono Seisakusho Co., Ltd., Japan | ||
| Doppler ultrasonography | Mindray, Shenzhen, China | Resona R9 | |
| Microscope | Zeiss, Jena, Germany | OPMI PENTERO 800 | |
| Non-absorbable suture | Johnson, (Shanghai) Medical Equipment Co., LTD | ||
| Rivaroxaban | Bayer Healthcare GMBH | ||
| VICRYL (absorbable surgical suture) | Johnson, (Shanghai) Medical Equipment Co., LTD |
Referencias
- World Health Organization. The influence of varicocele on parameters of fertility in a large group of men presenting to infertility clinics. Fertil Steril. 57 (6), 1289-1293 (1992).
- Goldstein, M. Surgical management of male infertility. , Elsevier Saunders. Philadelphia, PA. 648-687 (2012).
- Punjani, N., Wald, G., Gaffney, C. D., Goldstein, M., Kashanian, J. A. Predictors of varicocele-associated pain and its impact on semen parameters following microsurgical repair. Andrologia. 53 (8), e14121(2021).
- Jellad, S., et al. Sperm DNA status in infertile patients with clinical varicocele. Prog Urol. 31 (2), 105-111 (2021).
- Jensen, C., et al. Varicocele and male infertility. Nat Rev Urol. 14 (9), 523-533 (2017).
- Ding, H., et al. Open non-microsurgical, laparoscopic or open microsurgical varicocelectomy for male infertility: a meta-analysis of randomized controlled trials. BJU Int. 110 (10), 1536-1542 (2012).
- Mehta, A., Goldstein, M. Microsurgical varicocelectomy: a review. Asian J Androl. 15 (1), 56-60 (2013).
- Tatem, A. J., Brannigan, R. E. The role of microsurgical varicocelectomy in treating male infertility. Transl Androl Urol. 6 (4), 722-729 (2017).
- Kim, S. O., Jung, H., Park, K. Outcomes of microsurgical subinguinal varicocelectomy for painful varicoceles. J Androl. 33 (5), 872-875 (2012).
- Pagani, R. L., Ohlander, S. J., Niederberger, C. S. Microsurgical varicocele ligation: surgical methodology and associated outcomes. Fertil Steril. 111 (3), 415-419 (2019).
- Wang, L., Yang, Q., Xie, X., Dou, K. Microscopic internal spermatic vein- inferior epigastric vein anastomosis in the treatment of left varicocele: A review and case report. Asian J Surg. 46 (9), 3963-3964 (2023).
- Salehzadeh, M., et al. Evaluation of the role of reflux pattern in Color Doppler Ultrasound on spermogram improvement after varicocelectomy. Int Urol Nephrol. 52 (12), 2245-2251 (2020).
- Wan, X., Wang, H., Ji, Z. Microsurgical varicocelectomy for clinical varicocele: A review for potential new indications. Andrologia. 49 (10), 10(2017).
- Lv, K. L., et al. Varicocele anatomy during subinguinal microsurgical varicocelectomy in Chinese men. Andrologia. 47 (10), 1190-1195 (2015).
- Hopps, C. V., Lemer, M. L., Schlegel, P. N., Goldstein, M. Intraoperative varicocele anatomy: a microscopic study of the inguinal versus subinguinal approach. J Urol. 170, 6 Pt 1 2366-2370 (2003).
- Mashour, G. A., Woodrum, D. T., Avidan, M. S. Neurological complications of surgery and anaesthesia. Br J Anaesth. 114 (2), 194-203 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados