Method Article
Silencios de
En este artículo
Resumen
Gene silencing by siRNA represents a convenient experimental strategy to analyze BRCA2-dependent biological functions with immediate implications to better understand cancer biology. A method to efficiently silence BRCA2, along with the experimental procedure to detect and quantify changes in BRCA2 protein expression by immunoblotting in human cell lines, is presented.
Resumen
El silenciamiento de la proteína BRCA2 supresor de tumores y su detección por análisis bioquímicos convencionales representan un gran desafío técnico debido al gran tamaño de la proteína BRCA2 humano (aproximadamente 390 kDa). Se presenta modificaciones de transfección y inmunotransferencia protocolos estándar siRNA para silenciar BRCA2 humano y detectar la proteína BRCA2 endógeno, respectivamente, en las líneas de células epiteliales humanas. Los pasos clave incluyen una alta proporción de reactivo de transfección siRNA ay dos rondas posteriores de siRNA transfección dentro del mismo experimento. El uso de estas y otras modificaciones en el protocolo estándar logramos consistentemente más de 70% silenciamiento del gen BRCA2 humano a juzgar por el análisis de inmunotransferencia con anticuerpos anti-BRCA2. Además, la desnaturalización de los lisados de células a 55 ° C en lugar de la convencional 70-100 ° C y otras optimizaciones técnicas del procedimiento de inmunotransferencia permite la detección de la proteína BRCA2 intacta incluso when muy bajas cantidades de material de partida están disponibles o cuando los niveles de expresión de proteínas BRCA2 son muy bajos. Silenciamiento eficiente de BRCA2 en las células humanas ofrece una valiosa estrategia para interrumpir la función de BRCA2 en células con BRCA2 intacto, incluyendo las células tumorales, para examinar nuevas vías moleculares y las funciones celulares que pueden ser afectados por mutaciones BRCA2 patógenos en los tumores. La adaptación de este protocolo para el silenciamiento y el análisis de otros "grandes" como proteínas BRCA2 eficiente debe ser fácilmente alcanzable.
Introducción
El gen BRCA2 (cáncer de mama susceptibilidad gen-2) codifica para una proteína supresora de tumores que juega un papel crucial en la reparación de ADN de doble filamento se rompe mediante la regulación de la función de la enzima recombinasa Rad51 1. BRCA2 también ha sido implicado en la modulación de la transcripción y en el control del ciclo celular 2. Mutaciones de la línea germinal en el gen BRCA2 inducen una susceptibilidad autosómica dominante a cáncer de mama y de ovario en mujeres y el cáncer de próstata en hombres, así como predisposición a otros tipos de cáncer 3,4. Sin embargo, a pesar del aumento en el riesgo de desarrollar cáncer, mutaciones BRCA2 que suprimen o reducen la función BRCA2 pueden hacer que las células cancerosas sean más vulnerables a los agentes quimioterapéuticos que causan daño en el ADN de 5-7. Cánceres esporádicos presentan una baja tasa de mutaciones BRCA2 (<3%) a pesar de los niveles reducidos de la proteína BRCA2 han sido detectados en algunos tipos de cáncer, lo que sugiere que la proteína BRCA2se puede perder durante la tumorigénesis en cánceres esporádicos a través de mecanismos no mutacional dependientes 7,8. Por lo tanto, es importante para entender completamente las funciones de BRCA2 en el contexto de la biología del cáncer, así como en otros entornos biológicos.
Una poderosa herramienta utilizada para identificar nuevas funciones de un gen en células de mamífero es silenciar su expresión. Como un ejemplo, silenciamiento de la expresión de BRCA2 en una variedad de células epiteliales normales ha conducido recientemente a la identificación de una nueva función de BRCA2 como regulador de la resistencia a la anoikis, un paso importante durante la adquisición de la capacidad invasiva de células de cáncer metastásico y 9. El silenciamiento génico puede conseguirse mediante la introducción en las células ya sea de interferencia (SI) de ARN pequeño o corto horquilla (sh) moléculas de ARN dirigidas a la gen específico. La alta potencia de siRNA y su facilidad de uso lo convierten en la herramienta preferente para silenciar a los experimentos encaminados a la obtención de nuevos conocimientos sobre los procesos biológicos críticos unnd para identificar nuevas dianas terapéuticas. Sin embargo, desmontables eficiente de la expresión génica puede no ser fácilmente alcanzable para todos los genes y puede ser muy variable dependiendo del tipo de célula. Debido a una disminución en los niveles de proteína intracelular es el fenotipo más relevante bajo investigación, es crucial para cuantificar el silenciamiento de genes por análisis de inmunotransferencia del producto del gen. Con este sentido, la proteína BRCA2 presenta otro desafío: ser una proteína grande (aproximadamente 390 kDa), existen dificultades técnicas para el análisis bioquímico convencional, incluyendo inmunotransferencia.
Presentamos aquí un protocolo optimizado para silenciamiento eficiente de BRCA2 en líneas de células epiteliales humanas y para la detección rápida y exitosa de la proteína BRCA2 desmontables por inmunotransferencia análisis.
Protocolo
1. Preparar soluciones siRNA
- Resuspender 5 nmol de revueltos (Ctrl) y 5 nmol de BRCA2 siRNA gránulos secos en 100 l de RNasa libre de agua (concentración final de siRNA: 50 m). Este es el stock siRNA y debe ser almacenado a -20 ° C en 10 alícuotas.
- Tomar una alícuota de 10 l de la población de siRNA y añadir 40 l de RNasa libre de agua para obtener la solución de trabajo de 10 M siRNA. Esta dilución debe ser almacenado a -20 ° C hasta su uso.
NOTA: La solución de trabajo siRNA no debe someterse a la congelación / descongelación de más de 3 veces.
2. Siembra del epiteliales humanas Líneas Celulares
- Retire el medio de crecimiento de las líneas celulares epiteliales humanas que crecen como monocapas de células en placas de cultivo de tejidos en un incubador humidificado a 37 ° C, 5% de CO 2.
- Lavar las células en la placa una vez con PBS (RT 10 ml de PBS para una placa de 100 mm).
- Para separar las células de la placa,añadir 2 ml de 0,25% de tripsina / EDTA 0,53 mM solución e incubar 3-5 min dependiendo del tipo de célula.
- Antes de recolectar las células desprendidas, neutralizar la tripsina mediante la adición de 2 ml de medio de crecimiento completo que contenía suero bovino fetal al 10%.
- Transferir las células a un tubo de 15 ml.
- Centrifugar las células a 320-330 xg durante 3 min a 4 ° C en un rotor de cubeta oscilante.
- Resuspender los sedimentos celulares en 5 ml de medio de antibióticos libres.
- Contar las células bajo el microscopio en una cámara de Burker o mediante el uso de un sistema de conteo automatizado de acuerdo con las instrucciones del fabricante.
- Semilla las células en placas de 6 pocillos a ser alrededor del 80% de confluencia después de 24 horas (0,5 a 1 x 10 6 células en 2 ml de medio para cada pocillo). El número de células óptimas que se sembró pueden variar dependiendo de las líneas celulares específicos y la tasa de crecimiento.
NOTA: No agregue los antibióticos en el medio en este punto porque los antibióticos interfieren negativamente con la eficiencia de transfección. Es muy importante que las células están en pases de cultivo bajo (<10) para lograr una alta eficiencia de transfección de ARNsi BRCA2.
3. transfectar células con siRNA
- Veinticuatro horas después de la siembra de las células, proceder con la primera ronda de la transfección.
- Diluir 6 l de 10 siRNA transfección reactivo específico basado en lípidos en 130 l de medio de suero reducido.
- Diluir 3 l de 10 mM siRNA (30 pmol) en 130 l de medio de suero reducido.
- Combine el siRNA diluida con el reactivo de transfección se diluye y se incuba durante 5-10 minutos a temperatura ambiente.
- Durante la incubación, retirar el medio de las células y añadir 2 ml de medio fresco pre-calentado a 37 ° C (sin antibióticos).
- Añadir 250 l de los complejos de reactivo de transfección siRNA-a las células (esta cantidad es para un solo pocillo de una placa de 6 pocillos).
- Se incuban las células en un incubador humidificado a 3776; C con 5% de CO 2.
- Después de 24 horas, proceder a la segunda ronda de transfección repitiendo los pasos 3.1.1-3.1.5 con la siguiente modificación para el paso 3.1.2: diluir 5 l de 10 mM siRNA (50 pmol) en 130 l de medio de suero reducido.
- Se incuban las células durante 1-2 días a 37 ° C antes del análisis.
NOTA: Dos rondas de transfecciones y uso de una relación de reactivos de alta siRNA / transfección en la segunda ronda son esenciales para conseguir una alta eficiencia de silenciamiento BRCA2.
- Se incuban las células durante 1-2 días a 37 ° C antes del análisis.
4. lisar células para el análisis de inmunotransferencia
- Preparar tampón de lisis fresco con PBS (pH 7,4) que contiene 1% de la no iónico, no desnaturalizante octilfenoxipolietoxietanol detergente, pirofosfato de sodio 5 mM, ortovanadato de sodio 1 mM, fluoruro de sodio 10 mM, fluoruro de fenilmetilsulfonilo 2 mM, 10 mg / ml de leupeptina, 10 g / ml de aprotinina. Guárdelo en hielo.
- Retire el medio de las células y wcenizas ellos una vez con PBS frío (2 ml / pocillo) en la placa. Para evitar cualquier arrastre PBS, retire completamente de la placa.
- Añadir 200 l de tampón de lisis a cada pocillo.
NOTA: Si las células tienen que ser utilizados también para otros ensayos, trypsinize las células como se describe en el paso 2.1 a 2.6 y resuspender las células en tampón apropiado / medio de acuerdo a la aplicación a utilizar. - Girar suavemente la placa para distribuir uniformemente el tampón de lisis y se incuba durante 15 min a 4 ° C en un rotador.
- Recoger el lisado celular en un tubo de microcentrífuga en hielo utilizando un rascador de células.
- Centrifugar a 17900 xg durante 25 min a 4 ° C y recoger el sobrenadante en un tubo nuevo.
- Medir la concentración de proteína usando un ensayo de proteína disponible comercialmente de acuerdo con las instrucciones del fabricante.
Análisis de inmunotransferencia 5. BRCA2
- Preparar el tampón de desarrollo diluyendo 50 ml de 20x Tris-Acetato SDS corriendo bUffer (Tricina 50 mM, 50 mM Tris Base, 0,1% SDS, pH 8,24) con 950 ml de agua destilada.
- Preparar la muestra como sigue: añadir 15 g de lisado celular total, 5 l de tampón de muestra 4x que contienen dodecil sulfato de litio a pH 8,4, 2 l de 10x muestra de agente reductor (0.5 M DTT), y tampón de lisis hasta un volumen final de 20 l.
NOTA: Este protocolo permite la detección de BRCA2 en líneas de células normales también cuando se utiliza una menor cantidad de proteínas totales (hasta 5 g). - Desnaturalizar las muestras a 55 ° C durante 10 min.
NOTA: Es fundamental utilizar 55 ° C. Dado que la proteína BRCA2 es termosensible 11, las temperaturas de desnaturalización más altos dan lugar a la pérdida constante de larga duración intacta (390 kDa) proteína BRCA2. - Configurar la cámara electroforética de acuerdo con las instrucciones del fabricante.
- Cargar las muestras y 10 l de alto peso molecular pre-manchado estándar de la proteína en un gel prefabricado (Tris-acetato 3-8%) y funcionar a 120 V para abcabo de 2 h 12. Detener la ejecución de electroforesis antes del 55 kDa marcador azul deja el gel prefabricado.
- Preparar el tampón de transferencia con 50 ml de tampón de transferencia de 20x, 100 ml de 100% de metanol y 850 ml de agua.
- Activar membrana de PVDF (0,45 micras de tamaño de poro) por inmersión en metanol al 100% durante 5 minutos, enjuague con agua destilada y se equilibre en tampón de transferencia al menos durante 5 minutos. Remojar las esponjas del aparato de transferencia en tampón de transferencia a 4 ° C hasta su uso.
- Cuando la corrida electroforética es más, armar el sándwich en la pila de la transferencia en el siguiente orden (de abajo arriba): tres esponjas saturadas en tampón de transferencia, una hoja de papel de grado 3MM saturado en tampón de transferencia, el gel, membrana de PVDF se activa, uno 3MM hoja de papel de grado saturado en tampón de transferencia, tres esponjas saturado en tampón de transferencia 13,14. Coloque la pila en las proteínas de aparatos y de transferencia a 350 mA durante 4 horas a 4 ° C oa 180 mA durante la noche a 4 ° C.
NOTA: Ser BRCA2 una proteína muy grande, es crucial para extender el tiempo de transferencia de 1 hr (como se sugiere por el fabricante y la mayoría de los protocolos de transferencia) a 4 hr o durante la noche para asegurar la transferencia completa de proteínas de alto peso molecular. Además, debido al tiempo de transferencia de largo, es esencial para realizar la transferencia en una habitación fría a 4 ° C para minimizar el sobrecalentamiento y facilitar el desmontaje sandwich. Sistemas de transferencia semi-secos no son buenas para la transferencia de las proteínas de gran tamaño. - Después de la transferencia, lavar la membrana con TBS, bloquearlo durante 1 hora a RT en TBS-Tween 0,25% (TBS-T) que contiene leche en polvo desnatada al 5% y la sonda durante la noche a 4 ° C con anticuerpo policlonal de conejo anti-l 30 BRCA2 ( 200 g / ml), se diluyó en 9 ml de TBS-T + 5% leche en polvo desnatada [1: 300 (v / v) de dilución].
- Se lava la membrana tres veces (10 min cada una) con TBS-T, entonces incubar el filtro durante 1 hora con 1 l de rábano picante conjugada con peroxidasa anti-conejo anticuerpo secundario diluido en 10 ml de TBS-T + 5% leche en polvo desnatada. A partir de entonces, lavar la membrana tres veces (10 min cada uno) con TBS-T.
- Realizar inmunodetección por ECL para revelar proteína BRCA2 mediante un aumento de quimioluminiscencia (ECL) Western Blot reactivo de detección, siguiendo las instrucciones del fabricante. Visualizar bandas immunochemiluminescent en alta resolución de películas ECL.
- Realizar la inmunodetección con un anticuerpo para un gen de mantenimiento, como β-tubulina (55 kDa), en el mismo filtro como control de carga mediante el uso de un anticuerpo monoclonal para β-tubulina diluido a 1: 1000 (10 l de anticuerpo anti-tubulina en 10 ml TBS-T + 5% de leche seca no grasa) durante 1 hora a RT. Lavar y se incuba el anticuerpo secundario como se describe para BRCA2 (5.10 a 5.11), excepto para el uso de rábano picante conjugado con peroxidasa anti-ratón en lugar de anti-anticuerpo secundario de conejo.
- Adquirir una imagen digital de las películas impresionadas con bandas immunochemiluminescent y analizar la intensidad de la banda de imagen dedicada software de análisis (por ejemplo,., ImageJ).
Resultados
Antes de proceder con un ensayo biológico / bioquímica para examinar el efecto de silenciamiento BRCA2 en las funciones celulares, el primer paso es para confirmar la especificidad de la silenciamiento mediante el uso de un siRNA revueltos (no la orientación siRNA) lado a lado con BRCA2 siRNA (Figura 1A ). Es importante llevar a cabo una segunda ronda de siRNA transfección con una alta relación de siRNA / transfección para conseguir una alta eficiencia del silenciamiento BRCA2. De hecho, la realización de una sola ronda de siRNA transfección o mediante un siRNA inferior a la proporción de transfección en la segunda ronda (25 pmol de siRNA y 6 l de reactivo de transfección) se traduciría en una menor eficiencia desmontables (Figura 1B). El segundo paso es evaluar el tiempo mínimo óptimo para conseguir el mayor nivel de silenciamiento génico. Dependiendo del tipo de célula, esto puede variar entre 24 y 48 horas después de la segunda ronda de siRNA transfección. Por ejemplo, 24 horas son suficientes para las células tiroideas Nthy pero hasta el 48hr se necesitan para caída BRCA2 eficiente en células de la próstata PNT1A (Figura 2). silenciamiento BRCA2 es bastante estable hasta 7 días después del segundo ciclo de la transfección (Figura 2B). De la nota, la desnaturalización los lisados celulares a una temperatura por encima de 55 ° C (100 ° C durante 5 min), da como resultado hasta 50% de pérdida de la proteína BRCA2 (Figura 2C), debido a la termosensibilidad de BRCA2 11.
Una vez que se estableció el tiempo óptimo silenciamiento, los efectos de la pérdida de la proteína BRCA2 pueden ser explotados en varios ensayos. Dado que las mutaciones in vivo que causan la pérdida de la función de BRCA2 promueven el aumento de la sensibilidad a los inhibidores de PARP así como a otros fármacos quimioterapéuticos que causan daños en el ADN 15-18, un ensayo común es determinar la sensibilidad de las células a la -silenced BRCA2 rucaparib inhibidor de PARP o oloparib. En el experimento reportado en la Figura 3, las células PNT1A agotan of proteína BRCA2 a través de siRNA han sido tratados con 10 mM rucaparib durante 24 horas, después de lo cual la proliferación celular ha sido evaluado por un ensayo de proliferación celular basado en MTT. El agotamiento de los resultados de proteína BRCA2 en una disminución dependiente del tiempo en la proliferación celular después del tratamiento rucaparib (Figura 3).

Figura 1. Dos rondas de transfección y alta siRNA relación reactivo de transfección a mejorar silenciamiento BRCA2. (A) La especificidad de silenciamiento BRCA2 se confirmó en células Nthy por análisis de inmunotransferencia 24 hr después de la segunda ronda de la transfección, usando siRNA revueltos (Ctrl) como control para la comparación de los niveles de proteína BRCA2. Marcadores de peso molecular se indican a la izquierda. (B) las células se sometieron a PNT1A 1 o 2 ciclos de BRCA2 stransfección RNAi como se describe en el protocolo [Ciclos (#) 1 y 2] y la proteína BRCA2 agotamiento se cuantificó por inmunotransferencia. Dos ciclos de transfección con siRNA revueltos fueron utilizados como control (Ctrl). En 2b, las células PNT1A se sometieron a dos ciclos de BRCA2 siRNA transfección utilizando un siRNA menor relación de reactivo de transfección en el segundo ciclo como una modificación (25 pmol siRNA / 6 reactivo de transfección l). En todos los casos, los niveles de proteína BRCA2 se analizaron 48 horas después del segundo ciclo. En la parte inferior, la cuantificación de los niveles de proteína BRCA2 se reporta como relación BRCA2 / tubulina. Haga clic aquí para ver una versión más grande de esta figura.
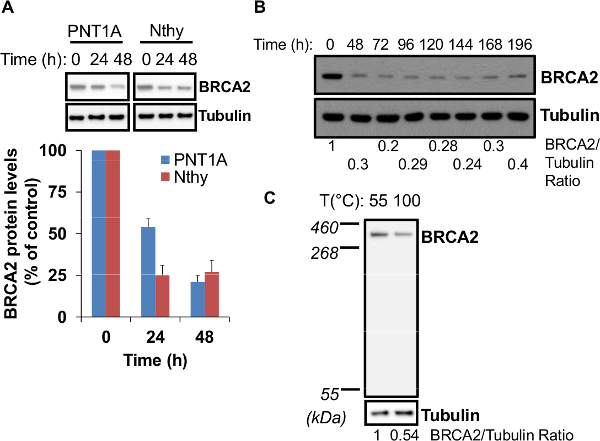
Figura 2. Optimización de caída BRCA2. (A) Optimal BRCA2 caída puede requerir de 24 a 48 horas después de la transfección segundo ciclo de siRNA. Dos líneas celulares diferentes (PNT1A y Nthy) fueron evaluados para BRCA2 desmontables 24 horas y 48 horas después de que el segundo ciclo de la transfección siRNA por inmunotransferencia análisis. En la parte inferior, los niveles de proteína BRCA2 se informan como porcentaje de los niveles en el tiempo 0 horas, fijado en 100. Los datos representan la media ± DE de tres experimentos independientes. (B) caída BRCA2 es estable durante 7 días. Células PNT1A Se evaluó la caída BRCA2, hasta 196 horas después del segundo ciclo de la transfección siRNA por inmunotransferencia. La relación de BRCA2 a la señal de tubulina se informó en la parte inferior. (C) proteína BRCA2 es termosensible. PNT1A células no transfectadas se recogieron 24 h después de la siembra (aproximadamente 70% de confluencia) y se lisaron de acuerdo con el protocolo. Dos alícuotas de la misma lisado de células (15 g de proteínas totales) se desnaturalizaron ya sea a 55 ° C durante 10 min o en & # 100176; C durante 5 min y los niveles de proteína BRCA2 se evaluaron por inmunotransferencia. En la parte inferior, la proporción de BRCA2 a la señal de tubulina se informó. Por favor, haga clic aquí para ver una versión más grande de esta figura.
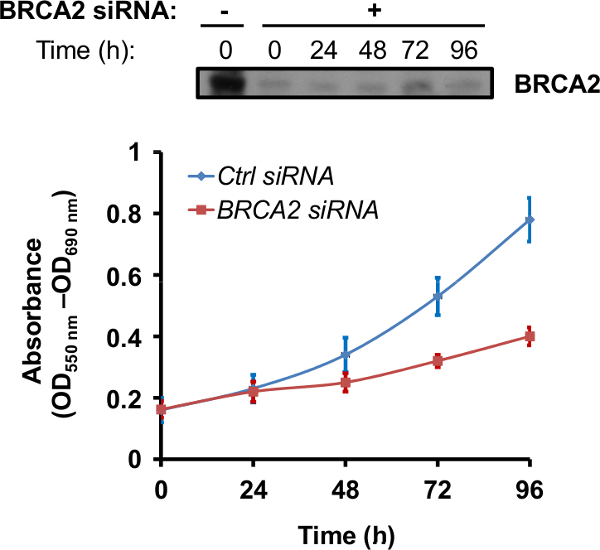
Figura 3. BRCA2 silenciamiento aumenta la sensibilidad de las células a la rucaparib inhibidor de PARP. PNT1A ya sea células transfectadas con el control (Ctrl) o BRCA2 siRNA se recogieron 48 h después de la transfección y se sembraron en placa de 96 pocillos (2000 células / pocillo). Después de 24 horas, se añadió 10 mM rucaparib a las células durante 24 horas, después de lo cual las células se mantuvieron en ausencia de la droga hasta 96 horas. La proliferación celular se evaluó en el momento indicado utilizando el ensayo MTT, midiendo la absorbancia a 550-690 nm. Eacpunto h de tiempo representa la media ± SD de tres pozos de un experimento representativo. Ctrl siRNA, línea azul; BRCA2 siRNA, línea roja. En la parte superior, el perfil de proteína BRCA2 en las células transfectadas con siRNA BRCA2 se informó. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
Debido a que las mutaciones en la línea germinal del gen BRCA2 plomo a un mayor riesgo de varios tipos de cáncer, incluyendo el cáncer femenino y masculino de mama, cáncer de ovario, cáncer de próstata, cáncer de páncreas, y el melanoma 3,4, una serie de estudios se han realizado para entender la función biológica de la proteína BRCA2. La mayoría de estos estudios son principalmente basados en genética debido a dificultades técnicas en el análisis de una proteína gigante como BRCA2. El método descrito aquí para silenciar y el análisis de expresión de la proteína BRCA2 proporciona una herramienta eficaz para investigar las funciones del gen supresor de tumores BRCA2 en un amplio espectro de ensayos biológicos. El protocolo de silenciamiento se basa en procedimientos de transfección estándar siRNA todavía contiene varias modificaciones cruciales, así como consejos para la caída exitosa y consistente de BRCA2. El protocolo de transfección siRNA es seguro, rápido y eficiente y, a diferencia de shRNA, que por lo general hace uso de lenvectores antiviral, no necesita procedimientos específicos de bioseguridad y se puede realizar fácilmente en cualquier laboratorio equipado con un centro de cultivo de células. Del mismo modo, el protocolo de inmunotransferencia ha sido optimizado para la detección eficiente de una proteína grande como BRCA2. El protocolo de inmunotransferencia también se ha validado para la detección de la proteína BRCA2 humano recombinante expresado de manera heteróloga en células de levadura 9.
Varios factores importantes para la prestación eficiente de siRNA se reportan aquí. Incluyen dos ciclos de transfecciones y un alto ratio de siRNA transfección reactivo a, especialmente en el segundo ciclo. La ausencia de antibióticos antes y durante el procedimiento de transfección es otro factor crítico. Sin embargo, este procedimiento expone las células en cultivo a un mayor riesgo de contaminación bacteriana; por tanto, se deben tomar precauciones adicionales para garantizar un alto nivel de esterilidad en todas las etapas. Cabe señalar que, dependiendo del tipo de célula, knockdo génica eficazwn requerirá típicamente de 24-48 hr después del segundo ciclo. El método actual tiene la ventaja de mantener silenciamiento génico bastante estable al menos hasta 7 días después del segundo ciclo de la transfección. Esto permite el estudio de los efectos de BRCA2 caída en una variedad de ensayos biológicos, incluyendo la respuesta celular a diferentes fármacos quimioterapéuticos. Sin embargo, una limitación de la presente técnica está representada por el hecho de que las moléculas de siRNA exógenos no están integrados en el genoma, desmontables por lo tanto estable de la expresión génica no se puede lograr. Por otra parte, para conseguir caída estable, se puede realizar shRNA infección lentiviral, siempre que el laboratorio está preparado para los requisitos de bioseguridad adicionales (normas BSL-2 de acuerdo con las directrices del NIH). Además, cuando la transfección no es un enfoque aplicable para estudiar la función de genes en un tipo específico de célula (por ejemplo., Los linfocitos T), el uso de ratones knockout Brca2 condicional específicos de células sigue siendo el único alternAtive 19.
Este método informes también varios consejos para la detección exitosa de una proteína de alto peso molecular por inmunotransferencia y es ideal tanto para proteínas de alta y de baja abundancia. En particular, debido a la termosensibilidad de la proteína BRCA2, una temperatura más baja de desnaturalización es crítico para su detección óptima, de acuerdo con un estudio previo 11. Este "truco" técnica también puede ser útil para otras proteínas para los que la detección por inmunotransferencia protocolos estándar ha sido probada sin éxito. Anticipamos que este método contiene consejos de validez general y por lo tanto puede facilitar el silenciamiento y la detección de muchas otras proteínas desafiantes.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was supported by FIRB-Merit grants RBNE08YFN3_005 and RBNE08HWLZ_012, and the Italian Ministry of Economy and Finance to the CNR for the Project “FaReBio di Qualità”.
Materiales
| Name | Company | Catalog Number | Comments |
| BRCA2 siRNA | Dharmacon | L-003462-00 | SMARTpool: ON-TARGETplus BRCA2 siRNA |
| Ctrl siRNA | Dharmacon | D-001810-10-05 | ON-TARGETplus Non-targeting Pool |
| Lipofectamine RNAiMAX Reagent | Life Technologies | 13778075 | Transfection Reagent |
| OPTI-MEM I Reduced Serum Medium | Life Technologies | 31985-070 | Medium for transfection procedure |
| NuPAGE Tris-Acetate 3-8% 1,5 mm Gel precast | Life Technologies | EA0378 | Gel for protein electrophoresis |
| NuPAGE LDS Sample buffer | Life Technologies | NP0007 | Reagent for protein electrophoresis |
| NuPAGE Sample Reducing agent (10x) | Life Technologies | NP0004 | Reagent for protein electrophoresis |
| NuPAGE Antioxidant | Life Technologies | NP0005 | Reagent for protein electrophoresis |
| HiMark Pre-stained protein standard | Life Technologies | LC5699 | Prestained marker for gel electrophoresis |
| XCell SureLoc Mini-Cell System | Life Technologies | EI0002 | Equipment for protein electrophoresis/transfer |
| NuPAGE Tris-Acetate SDS Running Buffer | Life Technologies | LA0041 | Reagent for Western blotting |
| PVDF membrane | Millipore | IPVH00010 | Reagent for Western blotting |
| NuPAGE Transfer Buffer | Life Technologies | NP0006-1 | Reagent for Western blotting |
| BRCA2 H-300 rabbit polyclonal antibody | Santa Cruz Biotechnology | sc-8326 | 1:300 dilution |
| Beta-tubulin monoclonal antibody | Sigma Aldrich | T4026-100UL | 1:1,000 dilution |
| Skim Milk powder | Sigma Aldrich | 70166 | Reagent for Western blotting |
| Tween-20 | Sigma Aldrich | P1379 | Reagent for Western blotting |
| SuperSignal West Pico/Femto Chemiluminescent Substrate | Pierce Thermo Scientific | 34080/34096 | Chemiluminescence system |
| PNT1A cells | SIGMA Aldrich (for ECACC) | 95012614 | PNT1A human, normal prostate epithelium immortalized with SV40 |
| Nthy cells | SIGMA Aldrich (for ECACC) | 90011609 | Nthy-ori 3-1 Cell Line human, thyroid follicular epithelial cells |
| Cell Proliferation Kit I (MTT) | Roche | 11465007001 | Kit for cell proliferation assays |
Referencias
- Thorslund, T., West, S. C. BRCA2: a universal recombinase regulator. Oncogene. 26, 7720-7730 (2007).
- Yoshida, K., Miki, Y. Role of BRCA1 and BRCA2 as regulators of DNA repair, transcription, and cell cycle in response to DNA damage. Cancer Sci. 95, 866-871 (2004).
- Martin, A. M., et al. Germline mutations in BRCA1 and BRCA2 in breast-ovarian families from a breast cancer risk evaluation clinic. J Clin Oncol. 19, 2247-2253 (2001).
- Castro, E., Eeles, R. The role of BRCA1 and BRCA2 in prostate cancer. Asian J Androl. 14, 409-414 (2012).
- Vencken, P. M., et al. Chemosensitivity and outcome of BRCA1- and BRCA2-associated ovarian cancer patients after first-line chemotherapy compared with sporadic ovarian cancer patients. Ann Oncol. 22, 1346-1352 (2011).
- Farmer, H., et al. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy. Nature. 434, 917-921 (2005).
- Arbini, A. A., et al. Mitochondrial DNA depletion sensitizes cancer cells to PARP inhibitors by translational and post-translational repression of BRCA2. Oncogenesis. 2, e82 (2013).
- Yang, F., Guo, X., Yang, G., Rosen, D. G., Liu, J. AURKA and BRCA2 expression highly correlate with prognosis of endometrioid ovarian carcinoma. Mod Pathol. 24, 836-845 (2011).
- Guaragnella, N., Marra, E., Galli, A., Moro, L., Giannattasio, S. Silencing of BRCA2 decreases anoikis and its heterologous expression sensitizes yeast cells to acetic acid-induced programmed cell death. Apoptosis. 19, 1330-1341 (2014).
- Mahato, R. I., Rolland, A., Tomlinson, E. Cationic lipid-based gene delivery systems: pharmaceutical perspectives. Pharm Res. 14, 853-859 (1997).
- Su, L. K., et al. Characterization of BRCA2: temperature sensitivity of detection and cell-cycle regulated expression. Oncogene. 17, 2377-2381 (1998).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227, 680-685 (1970).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci U S A. 76, 4350-4354 (1979).
- Burnette, W. N. '. 'Western blotting': electrophoretic transfer of proteins from sodium dodecyl sulfate--polyacrylamide gels to unmodified nitrocellulose and radiographic detection with antibody and radioiodinated protein A. Anal Biochem. 112, 195-203 (1981).
- Hunter, F. W., et al. Dual targeting of hypoxia and homologous recombination repair dysfunction in triple-negative breast cancer. Mol Cancer Ther. , (2014).
- Drew, Y., et al. Therapeutic potential of poly(ADP-ribose) polymerase inhibitor AG014699 in human cancers with mutated or methylated BRCA1 or BRCA2. J Natl Cancer Inst. 103, 334-346 (2011).
- Bryant, H. E., et al. Specific killing of BRCA2-deficient tumours with inhibitors of poly(ADP-ribose) polymerase. Nature. 434, 913-917 (2005).
- Ihnen, M., et al. Therapeutic potential of the poly(ADP-ribose) polymerase inhibitor rucaparib for the treatment of sporadic human ovarian cancer. Mol Cancer Ther. 12, 1002-1015 (2013).
- Jeong, J. H., Jo, A., Park, P., Lee, H., Lee, H. O. Brca2 Deficiency Leads to T Cell Loss and Immune Dysfunction. Mol Cells. , (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados