Method Article
Silencing
In diesem Artikel
Zusammenfassung
Gene silencing by siRNA represents a convenient experimental strategy to analyze BRCA2-dependent biological functions with immediate implications to better understand cancer biology. A method to efficiently silence BRCA2, along with the experimental procedure to detect and quantify changes in BRCA2 protein expression by immunoblotting in human cell lines, is presented.
Zusammenfassung
Inaktivierung des Tumorsuppressor-Proteins BRCA2 und seine Erkennung durch herkömmliche biochemische Analysen stellen eine große technische Herausforderung auf Grund der Größe des menschlichen BRCA2-Protein (etwa 390 kDa). Wir berichten Modifikationen von Standard siRNA-Transfektion und Immunoblotting Protokolle menschlichen BRCA2 endogenen BRCA2-Protein, bzw. in humanen epithelialen Zellinien auszuschalten und zu detektieren. Die wichtigsten Schritte sind, um eine hohe siRNA Transfektionsreagenz Verhältnis und zwei weiteren Runden von siRNA-Transfektion in demselben Experiment. Mit diesen und anderen Modifikationen an dem Standardprotokoll wir mehr als 70% Inaktivierung des menschlichen BRCA2 konsistent zu erreichen, wie durch Immunoblotting mit anti-BRCA2-Antikörpern beurteilt. Zusätzlich Denaturierung der Zelllysate auf 55 ° C anstatt der üblichen 70-100 ° C und anderen technischen Optimierungen des Immunoblotting Verfahren den Nachweis von intakten BRCA2-Protein selbst when sehr geringe Mengen an Ausgangsmaterial zur Verfügung stehen oder wenn BRCA2 Proteinexpressionsniveaus sehr niedrig sind. Effiziente Silencing von BRCA2 in menschlichen Zellen bietet eine wertvolle Strategie zur BRCA2-Funktion in Zellen mit intakten BRCA2, einschließlich Tumorzellen unterbrechen, um neue molekulare Signalwege und zellulären Funktionen, die durch pathogene BRCA2-Mutationen in Tumoren betroffen sein können, zu prüfen. Anpassung dieses Protokoll für die effiziente Schalldämpfung und Analyse von anderen "großen" Proteine wie BRCA2 sollte leicht erreichbar sein.
Einleitung
Der BRCA2 (Brustkrebsanfälligkeit Gen-2) Gen kodiert für ein Protein, das Tumorsuppressor eine entscheidende Rolle bei der Reparatur von DNA-Doppelstrangbrüchen durch die Regelung der Funktion des Rekombinaseenzym Rad51 1 spielt. BRCA2 ist auch in der Modulation der Transkription und an der Zellzyklussteuerung 2 in Verbindung gebracht. Keimbahnmutationen im BRCA2-Gen induzieren eine autosomal dominant Anfälligkeit für Brust- und Eierstockkrebs bei Frauen und Prostatakrebs bei Männern, als auch Veranlagung zu anderen Krebsarten 3,4. Trotz des erhöhten Risikos bei der Entwicklung von Krebs, BRCA2-Mutationen, die zu unterdrücken oder zu reduzieren BRCA2-Funktion können Krebszellen anfälliger für Chemotherapeutika, die DNA-Schäden verursachen 5-7 rendern. Sporadische Krebserkrankungen weisen eine niedrige Rate von BRCA2-Mutationen (<3%), obwohl reduzierte Mengen an BRCA2-Protein wurden bei einigen Krebsarten festgestellt, was darauf hindeutet, dass die BRCA2-Proteinkann während der Tumorgenese in sporadische Krebserkrankungen durch nicht-Mutationsabhängige Mechanismen 7,8 verloren. Somit ist es wichtig, BRCA2 Funktionen im Zusammenhang mit der Krebsbiologie sowie in anderen biologischen Systemen vollständig verstehen.
Ein leistungsfähiges Werkzeug, um neue Funktionen eines Gens in Säugetierzellen zu identifizieren, ist seine Expression unterdrücken. Als ein Beispiel hat Silencing BRCA2-Expression in einer Vielzahl von normalen Epithelzellen kürzlich zur Identifizierung eines neuartigen Funktion BRCA2 als Regulator der anoikis Beständigkeit ein wichtiger Schritt bei der Erfassung von Krebszell invasive und metastatische Fähigkeit 9 geführt. Gen-Silencing kann durch die Einführung in den Zellen entweder small interfering (si) RNA oder short hairpin (sh) RNA-Moleküle gezielt den spezifischen Gens erreicht werden. Die hohe Wirksamkeit der siRNA und seine Benutzerfreundlichkeit machen es die bevorzugte Werkzeug für Silencing-Experimente bei der Gewinnung neuer Erkenntnisse über kritische biologische Prozesse richtet einnd neue therapeutische Targets zu identifizieren. Jedoch kann effizient Zuschlags der Genexpression nicht für alle Gene leicht erreichbar sein und kann sehr unterschiedlich sein, je nach dem Zelltyp. Weil eine Abnahme der intrazellulären Proteinspiegel der relevanteste Phänotyp untersuchten, ist es wichtig, das Gen-Silencing durch Immunoblotting-Analyse des Genprodukts zu quantifizieren. In dieser Hinsicht stellt der BRCA2-Protein eine weitere Herausforderung: ein großes Protein (etwa 390 kDa), haben technische Schwierigkeiten bei herkömmlichen biochemischen Analyse, einschließlich Immunoblotting existieren.
Wir berichten hier über ein Protokoll für die effiziente Silencing von BRCA2 in humanen epithelialen Zelllinien und für die schnelle und erfolgreiche Detektion von BRCA2-Protein durch Immunoblotting-Analyse Knockdown optimiert.
Protokoll
1. Bereiten siRNA-Lösungen
- Resuspendieren 5 nmol von verschlüsselten (Strg) und 5 nmol BRCA2 siRNA getrockneten Pellets in 100 ul RNase-freies Wasser (final siRNA-Konzentration: 50 um). Dies ist die siRNA Lager und muss bei -20 ° C in 10 & mgr; l Aliquots gelagert werden.
- Einen aliquoten von 10 & mgr; l von der siRNA Lager und fügen Sie 40 ul RNase-freies Wasser, das 10 uM siRNA Arbeitslösung zu erhalten. Diese Verdünnung ist bei -20 ° C bis zur Verwendung gelagert werden.
HINWEIS: Die siRNA Arbeitslösung sollte nicht unterzogen Einfrieren / Auftauen mehr als 3 mal.
2. Seeding der Menschen Epithelzelllinien
- Entfernen des Wachstumsmediums aus menschlichen epithelialen Zellinien wachsen als Zellmonoschichten in Gewebekulturplatten in einem befeuchteten Inkubator bei 37 ° C, 5% CO 2.
- Die Zellen in der Platte einmal mit RT PBS (10 ml PBS für eine 100 mm-Platte) zu waschen.
- Um die Zellen von der Platte zu trennen,2 ml 0,25% Trypsin / 0,53 mM EDTA-Lösung und Inkubation 3-5 min, je nach Zelltyp.
- Vor dem Sammeln der abgelösten Zellen neutralisieren Trypsin durch Zugabe von 2 ml komplettem Wachstumsmedium enthaltend 10% fötales Rinderserum enthielt.
- Übertragen Sie die Zellen in ein 15-ml-Tube.
- Zentrifugieren der Zellen bei 320-330 g für 3 Minuten bei 4ºC in einem Schwingbecher-Rotor.
- Resuspendieren des Zellpellets in 5 ml von Antibiotika-freiem Medium.
- Zähle die Zellen unter dem Mikroskop in einer Burker Kammer oder durch Verwendung eines automatischen Zählsystem nach den Anweisungen des Herstellers.
- Seed die Zellen in 6-Well-Platten auf etwa 80% konfluent nach 24 Stunden (0,5-1 x10 6 Zellen in 2 ml Medium für jede Vertiefung) sein. Optimale Zellennummer ausgesät werden können, abhängig von den spezifischen Zellen und der Wachstumsrate variieren.
HINWEIS: Antibiotika im Medium Fügen Sie nicht an dieser Stelle, weil Antibiotika negativ mit der Effizienz der transfe störenction. Es ist sehr wichtig, dass die Zellen bei niedrigen Kulturpassagen (<10), um einen hohen Wirkungsgrad der BRCA2 siRNA-Transfektion zu erzielen.
3. Transfektion von Zellen mit siRNA
- Vierundzwanzig Stunden nach der Plattierung der Zellen, fahren Sie mit der ersten Runde der Transfektion.
- Verdünnen 6 ul Lipidbasis 10 siRNA spezifischen Transfektionsreagenz in 130 & mgr; l reduziert Serummedium.
- Verdünnen 3 ul von 10 uM siRNA (30 pmol) in 130 & mgr; l reduziert Serummedium.
- Kombinieren Sie die verdünnten siRNA mit der verdünnten Transfektionsreagenz und Inkubation für 5-10 min bei RT.
- Während der Inkubation, entfernen Sie das Medium aus den Zellen und 2 ml frischem Medium bei 37 ° C vorgewärmt (ohne Antibiotika).
- Fügen Sie 250 ul der siRNA-Transfektionsreagenz Komplexe zu den Zellen (dieser Betrag ist für einen einzelnen Vertiefung einer 6-Well-Platte).
- Inkubieren der Zellen in einem befeuchteten Inkubator bei 3776; C mit 5% CO 2.
- Nach 24 Stunden, weiter mit der zweiten Runde der Transfektion durch Wiederholung der Schritte 3.1.1-3.1.5 mit folgender Änderung für Schritt 3.1.2: verdünnen 5 ul von 10 uM siRNA (50 pmol) in 130 & mgr; l reduziert Serummedium.
- Die Zellen für 1-2 Tage bei 37 ° C vor der Analyse.
HINWEIS: Zwei Runden Transfektionen und Verwendung eines Hoch siRNA / Transfektionsreagenz Verhältnis in der zweiten Runde sind unerlässlich, um hohe Effizienz der BRCA2-Silencing zu bekommen.
- Die Zellen für 1-2 Tage bei 37 ° C vor der Analyse.
4. Lyse Zellen für Immunoblot-Analyse
- Ansetzen Lysepuffer mit PBS (pH 7,4), enthaltend 1% des nicht-ionischen, nicht-denaturierenden Detergens Octylphenoxypolyethoxyethanol, 5 mM Natriumpyrophosphat, 1 mM Natriumorthovanadat, 10 mM Natriumfluorid, 2 mM Phenylmethylsulfonylfluorid, 10 ug / ml Leupeptin, 10 ug / ml Aprotinin. Halten Sie es auf Eis.
- Entfernen des Mediums von den Zellen und wAsche sie einmal mit kaltem PBS (2 ml / Vertiefung) in der Platte. Um jede PBS Verschleppung zu vermeiden, vollständig zu entfernen von der Platte.
- Zugeben von 200 & mgr; l Lysepuffer zu jedem Well.
HINWEIS: Die Zellen müssen auch für andere Tests verwendet werden, trypsinize die Zellen wie in Schritt 2.1-2.6 beschrieben und Resuspendieren der Zellen in einem geeigneten Puffer / Medium gemäß der Anwendung eingesetzt werden. - Drehen Sie vorsichtig die Platte gleichmäßig zu verteilen das Lyse-Puffer und Inkubation für 15 min bei 4 ° C auf einem Rotator.
- Sammeln des Zelllysats in einem Mikrozentrifugenröhrchen auf Eis mit einem Zellschaber.
- Zentrifuge bei 17.900 xg für 25 min bei 4 ° C und Sammeln des Überstands in ein neues Röhrchen.
- Messung der Proteinkonzentration unter Verwendung eines im Handel erhältlichen Protein-Assay gemß den Herstelleranweisungen.
5. BRCA2 Immunoblotting-Analyse
- Bereiten Sie den Laufpuffer durch Verdünnung von 50 ml 20x Tris-Acetat SDS Lauf buffer (50 mM Tricin, 50 mM Tris-Base, 0,1% SDS, pH-Wert 8,24) mit 950 ml destilliertem Wasser.
- Vorbereitung der Probe wie folgt: in 15 ug Gesamt-Zelllysat wurden 5 ul 4x Probenpuffer, Lithiumdodecylsulfat bei pH 8,4, 2 ul 10x Probe Reduktionsmittels (0,5 M DTT) und Lyse-Puffer auf ein Endvolumen von 20 ul.
Hinweis: Dieses Protokoll ermöglicht den Nachweis von BRCA2 in normalen Zelllinien auch bei Verwendung einer geringeren Menge an Gesamtproteinen (bis auf 5 ug). - Denaturieren Proben bei 55 ° C für 10 min.
Hinweis: Es ist wichtig, auf 55 ° C zu verwenden. Seit BRCA2-Protein ist thermo 11 führen höhere Denaturierung Temperaturen in Einklang Verlust der intakten voller Länge (390 kDa) BRCA2-Protein. - Die elektrophoretische Kammer gemäß den Anweisungen des Herstellers eingestellt.
- Laden Sie die Proben und 10 ul mit hohem Molekulargewicht vorgefärbten Proteinstandard auf vorgefertigte Gel (Tris-Acetat 8.3%) und bei 120 V für ab laufenout 2 h 12. Stoppen Sie den Elektrophoreselauf bevor die 55 kDa blaue Markierung lässt die vorgefertigte Gel.
- Bereiten Sie den Transferpuffer mit 50 ml 20x Transferpuffer, 100 ml 100% Methanol und 850 ml Wasser.
- Aktivieren PVDF-Membran (0,45 um Porengrße) durch Einweichen in 100% Methanol für 5 min mit destilliertem Wasser gespült und in Transferpuffer äquilibriert für mindestens 5 min. Weichen Sie die Schwämme der Transfervorrichtung in Transferpuffer bei 4 ° C bis zur Verwendung.
- Wenn die Elektrophoreselauf vorbei ist, montieren Sie die Sandwich in der Transferstapel in der folgenden Reihenfolge (von unten nach oben): Drei Schwämme in Transferpuffer gesättigt, ein 3MM Grade Blatt Papier in Transferpuffer, Gels, aktiviert PVDF-Membran, einer gesättigten 3MM Grade Blatt Papier in Transferpuffer gesättigt, drei Schwämme in Transferpuffer 13,14 gesättigt. Platzieren des Stapels in die Vorrichtung und das Transferproteine bei 350 mA für 4 Stunden bei 4 ° C oder bei 180 mA über Nacht bei 4 ° C.
HINWEIS: Being BRCA2 ein sehr großes Protein ist, ist es von entscheidender Bedeutung, um die Übertragungszeit von 1 h bis 4 h erstrecken oder über Nacht (wie durch den Hersteller und die meisten Übertragungsprotokolle vorgeschlagen), um eine vollständige Übertragung der hochmolekularen Proteine zu gewährleisten. Darüber hinaus aufgrund der langen Transferzeit ist es wichtig, die Blotting in einem Kühlraum bei 4 ° C durchzuführen, um eine Überhitzung zu minimieren und zu erleichtern Sandwich-Demontage. Halbtrockentransfersysteme sind nicht gut für die Übertragung von großen Proteinen. - Nach dem Transfer, waschen der Membran mit TBS, blockieren für 1 h bei RT in TBS-Tween 0,25% (TBS-T), das 5% fettfreie Trockenmilch und der Sonde über Nacht bei 4 ° C mit 30 & mgr; l anti-BRCA2 polyklonaler Kaninchen-Antikörper ( 200 ug / ml) in 9 ml TBS-T + 5% fettfreier Trockenmilch verdünnt [1: 300 (v / v) Verdünnung].
- Dreimal (jeweils 10 Minuten) mit TBS-T Waschen der Membran dann Inkubieren der Filter für 1 h mit 1 & mgr; l Meerrettichperoxidase-konjugiertem anti-Kaninchen Sekundär-Antikörper in 10 ml TBS-T + 5% fettfreier Trockenmilch. Danach waschen Sie die Membran drei Mal (jeweils 10 Minuten) mit TBS-T.
- Führen Immundetektion von ECL zu BRCA2-Proteins aufdecken Verwendung verstärkter Chemilumineszenz (ECL) Western Blotting Nachweisreagenz nach den Anweisungen des Herstellers. Visualisieren immunochemiluminescent Bands auf hochauflösende ECL-Filme.
- Zuführen Immunodetektion mit einem Antikörper für ein Housekeeping-Gen, wie β-Tubulin (55 kDa), auf dem gleichen Filter als Ladekontrolle durch die Verwendung eines monoklonalen Antikörper gegen β-Tubulin einer Verdünnung von 1: 1000 (10 ul von Anti-Tubulin-Antikörper in 10 ml TBS-T + 5% fettfreie Trockenmilch) für 1 h bei RT. Waschen und Inkubieren sekundären Antikörper für BRCA2 (5,10-5,11) beschrieben, mit Ausnahme der Verwendung von Meerrettichperoxidase-konjugiertem Anti-Maus anstelle von Anti-Kaninchen-Sekundärantikörper.
- Erwerben Sie ein digitales Bild der mit immunochemiluminescent Bands beeindruckt Filme und die Bandenintensität von engagierten Bildanalyse-Software zu analysieren (zB., ImageJ).
Ergebnisse
Bevor mit einer biologischen / biochemischen Test fortfahren, um die Wirkung der BRCA2-Unterdrückung auf Zellfunktionen zu untersuchen, ist der erste Schritt, um die Spezifität des Silencing unter Verwendung eines verschlüsselten siRNA (Non-Targeting-siRNA) Seite an Seite mit BRCA2 siRNA (1A bestätigen ). Es ist wichtig, eine zweite Runde von siRNA-Transfektion mit einem hohen siRNA / Transfektion Verhältnis durchzuführen, um einen hohen Wirkungsgrad der BRCA2-Silencing zu erhalten. In der Tat, die Durchführung nur eine Runde von siRNA-Transfektion oder mit einer niedrigeren siRNA Transfektion Verhältnis in der zweiten Runde (25 pmol siRNA und 6 ul Transfektionsreagenz) würde in unteren Zuschlagseffizienz (1B) zur Folge haben. Der zweite Schritt besteht darin, die optimale Mindestzeit, um das höchste Niveau der Gen-Silencing erhalten beurteilen. Je nach Zelltyp, kann diese zwischen 24 und 48 Stunden nach der zweiten Runde der siRNA-Transfektion variieren. Zum Beispiel sind 24 Stunden ausreichend für Nthy Schilddrüsenzellen, aber bis zu 48h sind für die effiziente BRCA2 Zuschlags in PNT1A Prostatazellen (Abbildung 2A) benötigt. BRCA2-Silencing ist bis zum 7. Tag nach der Transfektion zweiten Zyklus (2B) recht stabil. Zu beachten ist, Denaturieren der Zelllysate auf einer Temperatur über 55 ° C (100 ° C für 5 min), ergibt sich bis zu 50% Verlust der BRCA2-Protein (Figur 2C), aufgrund der Wärmeempfindlichkeit von BRCA2 11.
Sobald eine optimale Schalldämpfung Zeit hergestellt ist, können die Auswirkungen der Verlust von BRCA2-Protein in mehreren Tests genutzt werden. Da in vivo-Mutationen, die den Verlust der Funktion der BRCA2 Ursache fördert erhöhte Empfindlichkeit gegenüber PARP-Inhibitoren sowie für andere chemotherapeutische Arzneimittel, die DNA-Schädigung verursachen, 15-18, ist eine gemeinsame Assay, um die Sensitivität der BRCA2 -silenced Zellen dem PARP-Inhibitor rucaparib bestimmen oder oloparib. Im Versuch in Abbildung 3 wiedergegeben, PNT1A Zellen abgereichert of BRCA2-Protein durch siRNA wurden mit 10 uM rucaparib 24 h, nach denen die Zellproliferation wurde durch einen MTT-basierte Zellproliferationstest bewertet wurde behandelt. Abreicherung von BRCA2-Protein führt zu einer zeitabhängigen Abnahme der Zellproliferation nach rucaparib Behandlung (Abbildung 3).

Abbildung 1. Zwei Runden Transfektion und hohe siRNA zu Transfektionsreagenz Verhältnis zu verbessern BRCA2-Silencing. (A) Die Spezifität der BRCA2-Silencing wurde in Nthy Zellen durch Immunoblot-Analyse von 24 Stunden nach der zweiten Runde der Transfektion bestätigt, mit Rührei siRNA (Strg) als Kontrolle zum Vergleich von BRCA2-Proteinspiegel. Molekulargewichtsmarker sind auf der linken Seite angegeben. (B) PNT1A Zellen wurden in 1 oder 2 Zyklen BRCA2 s unterworfeniRNA Transfektion wie in dem Protokoll beschrieben [Cycles (#), 1 und 2] und BRCA2 Proteinabbau wurde durch Immunoblotting quantifiziert. Zwei Zyklen der Transfektion mit siRNA verschlüsselt wurden als Kontrolle (Ctrl) verwendet. In 2b wurden PNT1A Zellen zwei Zyklen BRCA2 siRNA-Transfektion unter Verwendung einer niedrigeren siRNA Transfektionsreagenz Verhältnis in dem zweiten Zyklus als Modifikation (25 pmol siRNA / 6 ul Transfektionsreagenz) unterworfen. In allen Fällen wurden die BRCA2-Proteinspiegel 48 Stunden nach dem zweiten Zyklus analysiert. An der Unterseite ist die Quantifizierung der BRCA2-Proteinspiegel als BRCA2 / Tubulin Verhältnis angegeben. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
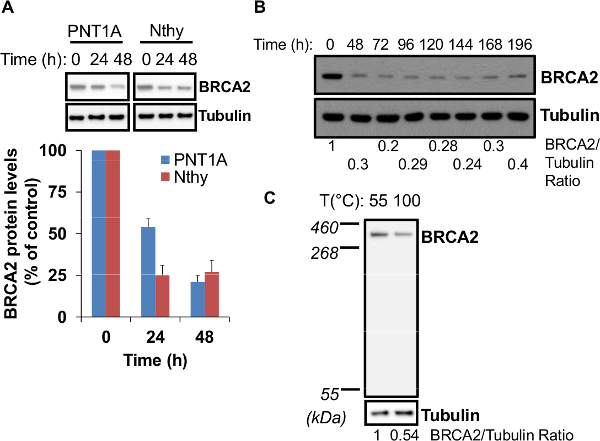
Abbildung 2. Optimierung der BRCA2 Zuschlags. (A) Optimal BRCA2 Zuschlags kann 24 bis 48 Stunden nach der zweiten siRNA-Transfektion Zyklus. Zwei verschiedene Zelllinien (PNT1A und Nthy) wurden für BRCA2 Knockdown von 24 h und 48 h nach der zweiten siRNA-Transfektion Zyklus durch Immunoblotting-Analyse beurteilt. An der Unterseite, sind BRCA2-Proteinspiegel in Prozent der Ebenen zum Zeitpunkt 0 h berichtet, eingestellt auf 100 Die Daten stellen den Mittelwert ± SE von drei unabhängigen Experimenten. (B) BRCA2 Zuschlags ist für 7 Tage stabil. PNT1A Zellen wurden BRCA2 Zuschlags beurteilt, bis 196 Stunden nach der zweiten siRNA-Transfektion Zyklus durch Immunoblotting. Das Verhältnis von BRCA2 an Tubulin Signal wird am Boden ausgewiesen. (C) BRCA2-Protein ist thermosensitiv. Untransfizierten PNT1A Zellen wurden 24 Stunden nach dem Ausplattieren (ca. 70% Konfluenz) gesammelt und nach dem Protokoll lysiert. Zwei Aliquots derselben Zelllysat (15 ug Gesamtprotein) wurden bei 55 ° C für 10 min oder bei 100 & # denaturiert entweder176; C für 5 min und BRCA2-Protein-Spiegel wurden durch Immunoblotting untersucht. An der Unterseite ist das Verhältnis von BRCA2 an Tubulin-Signal gemeldet. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
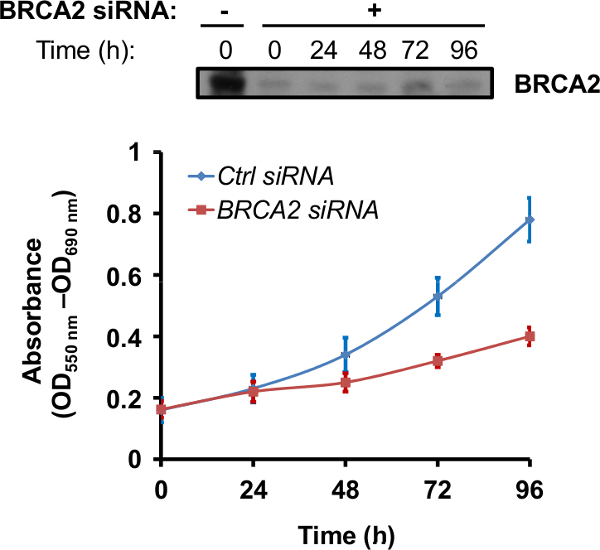
Abbildung 3. BRCA2 silencing erhöht die Zellenempfindlichkeits zur PARP-Inhibitor rucaparib. PNT1A Zellen entweder mit Kontroll (Ctrl) oder BRCA2 siRNA transfizierten wurden gesammelt von 48 h nach der Transfektion und in 96-Well-Platte ausplattiert (2000 Zellen / Vertiefung). Nach 24 Stunden wurden 10 & mgr; M rucaparib an die Zellen 24 Stunden, wonach die Zellen in Abwesenheit des Arzneimittels von bis zu 96 Stunden gehalten wird. 690 nm - Zellproliferation wurde auf die angegebene Zeit unter Verwendung des MTT-Assays durch Messen der Absorption bei 550 beurteilt. Each Zeitpunkt repräsentiert den Mittelwert ± SD von drei Vertiefungen aus einem repräsentativen Experiment. Ctrl siRNA, blaue Linie; BRCA2 siRNA, rote Linie. An der Spitze, BRCA2 Proteinprofil in BRCA2 siRNA-transfizierten Zellen berichtet. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Da Keimbahnmutationen des BRCA2-Gen zu einem erhöhten Risiko für verschiedene Krebsarten, einschließlich der weiblichen und männlichen Brustkrebs, Eierstockkrebs, Prostatakrebs, Bauchspeicheldrüsenkrebs, Melanom und 3,4, eine Reihe von Studien durchgeführt, um die biologische Funktion zu verstehen, des BRCA2-Protein. Die meisten dieser Studien sind genetisch-basierte vor allem auf technische Schwierigkeiten bei der Analyse eines Riesenprotein wie BRCA2. Die zum Dämpfen und Analysieren BRCA2-Protein-Expression hier beschriebene Verfahren stellt ein effizientes Werkzeug, um die Funktionen der BRCA2 Tumorsuppressorgen in einem breiten Spektrum von biologischen Assays zu untersuchen. Das Silencing-Protokoll basiert auf Standard-siRNA-Transfektion Verfahren auf der Grundlage noch enthält mehrere wichtige Änderungen sowie Tipps für eine erfolgreiche und konsequente Knockdown von BRCA2. Die siRNA-Transfektion Protokoll ist sicher, schnell und effizient, und, anders shRNA, die in der Regel nutzt lentiviral Vektoren benötigt keine besonderen biologischen Sicherheit Verfahren und kann leicht in jedem Labor mit einer Zellkultur-Anlage ausgestattet durchgeführt werden. Ebenso hat das Immunoblotting-Protokoll für die effiziente Erfassung eines großen Protein wie BRCA2 optimiert. Das Immunoblotting Protokoll wurde auch für den Nachweis von rekombinantem menschlichen BRCA2-Protein heterolog in Hefezellen exprimiert 9 validiert.
Mehrere wichtige Faktoren für die effiziente Bereitstellung von siRNA werden hier ausgewiesen. Sie umfassen zwei Zyklen Transfektionen und eine hohe siRNA Transfektionsreagenz Verhältnis, insbesondere im zweiten Zyklus. Abwesenheit von Antibiotika vor und während des Transfektionsverfahrens ist ein weiterer kritischer Faktor. Jedoch macht dieses Verfahren Zellen in Kultur zu einem erhöhten Risiko einer bakteriellen Kontamination; so sollten zusätzliche Vorsichtsmaßnahmen getroffen werden, um einen hohen Standard der Sterilität auf allen Stufen zu gewährleisten. Es sollte angemerkt werden, dass, abhängig von dem Zelltyp, effiziente Gen knockdown benötigt typischerweise 24-48 Stunden nach dem zweiten Zyklus. Das gegenwärtige Verfahren hat den Vorteil, dass Gen-Silencing, zumindest bis Tag 7 nach der zweiten Transfektion Zyklus recht stabil. Dies ermöglicht die Untersuchung der Wirkungen von BRCA2 in einer Vielzahl biologischer Assays, einschließlich der zellulären Reaktion auf verschiedene Chemotherapeutika Zuschlag. Jedoch ist eine Einschränkung der vorliegenden Technik durch die Tatsache, dass exogene siRNA Moleküle nicht in das Genom integriert dargestellt ist, kann somit stabil Zuschlags der Genexpression nicht erreicht werden. Alternativ kann, um stabile Zuschlags bekommen kann shRNA Lentivirale Infektion durchgeführt werden, vorausgesetzt, dass das Labor zusätzliche Biosicherheitsanforderungen (BSL-2-Standards nach den NIH-Richtlinien) hergestellt. Darüber hinaus, wenn die Transfektion kein geeigneter Ansatz, um die Genfunktion in einem bestimmten Zelltyp zu untersuchen (z. B. T-Lymphozyten), die Verwendung von zellspezifischen bedingten Brca2 Knockoutmäusen bleibt die einzige alterntive 19.
Diese Methode berichtet auch einige Tipps für eine erfolgreiche Erkennung eines hochmolekularen Protein durch Immunoblotting und für hohe und niedrige Fülle Proteinen geeignet ist. Insbesondere aufgrund der Wärmeempfindlichkeit des BRCA2-Protein, ist ein niedriger Denaturierungstemperatur entscheidend für die optimale Detektion im Einvernehmen mit einer früheren Studie 11. Diese technische "Trick" kann auch für andere Proteine, für die Erkennung von Standard-Protokollen Immunoblotting wurde erfolgreich nachgewiesen werden. Wir gehen davon aus, dass diese Methode enthält Tipps von allgemeiner Gültigkeit und können somit silencing und Detektion von vielen anderen herausfordernden Proteine zu erleichtern.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was supported by FIRB-Merit grants RBNE08YFN3_005 and RBNE08HWLZ_012, and the Italian Ministry of Economy and Finance to the CNR for the Project “FaReBio di Qualità”.
Materialien
| Name | Company | Catalog Number | Comments |
| BRCA2 siRNA | Dharmacon | L-003462-00 | SMARTpool: ON-TARGETplus BRCA2 siRNA |
| Ctrl siRNA | Dharmacon | D-001810-10-05 | ON-TARGETplus Non-targeting Pool |
| Lipofectamine RNAiMAX Reagent | Life Technologies | 13778075 | Transfection Reagent |
| OPTI-MEM I Reduced Serum Medium | Life Technologies | 31985-070 | Medium for transfection procedure |
| NuPAGE Tris-Acetate 3-8% 1,5 mm Gel precast | Life Technologies | EA0378 | Gel for protein electrophoresis |
| NuPAGE LDS Sample buffer | Life Technologies | NP0007 | Reagent for protein electrophoresis |
| NuPAGE Sample Reducing agent (10x) | Life Technologies | NP0004 | Reagent for protein electrophoresis |
| NuPAGE Antioxidant | Life Technologies | NP0005 | Reagent for protein electrophoresis |
| HiMark Pre-stained protein standard | Life Technologies | LC5699 | Prestained marker for gel electrophoresis |
| XCell SureLoc Mini-Cell System | Life Technologies | EI0002 | Equipment for protein electrophoresis/transfer |
| NuPAGE Tris-Acetate SDS Running Buffer | Life Technologies | LA0041 | Reagent for Western blotting |
| PVDF membrane | Millipore | IPVH00010 | Reagent for Western blotting |
| NuPAGE Transfer Buffer | Life Technologies | NP0006-1 | Reagent for Western blotting |
| BRCA2 H-300 rabbit polyclonal antibody | Santa Cruz Biotechnology | sc-8326 | 1:300 dilution |
| Beta-tubulin monoclonal antibody | Sigma Aldrich | T4026-100UL | 1:1,000 dilution |
| Skim Milk powder | Sigma Aldrich | 70166 | Reagent for Western blotting |
| Tween-20 | Sigma Aldrich | P1379 | Reagent for Western blotting |
| SuperSignal West Pico/Femto Chemiluminescent Substrate | Pierce Thermo Scientific | 34080/34096 | Chemiluminescence system |
| PNT1A cells | SIGMA Aldrich (for ECACC) | 95012614 | PNT1A human, normal prostate epithelium immortalized with SV40 |
| Nthy cells | SIGMA Aldrich (for ECACC) | 90011609 | Nthy-ori 3-1 Cell Line human, thyroid follicular epithelial cells |
| Cell Proliferation Kit I (MTT) | Roche | 11465007001 | Kit for cell proliferation assays |
Referenzen
- Thorslund, T., West, S. C. BRCA2: a universal recombinase regulator. Oncogene. 26, 7720-7730 (2007).
- Yoshida, K., Miki, Y. Role of BRCA1 and BRCA2 as regulators of DNA repair, transcription, and cell cycle in response to DNA damage. Cancer Sci. 95, 866-871 (2004).
- Martin, A. M., et al. Germline mutations in BRCA1 and BRCA2 in breast-ovarian families from a breast cancer risk evaluation clinic. J Clin Oncol. 19, 2247-2253 (2001).
- Castro, E., Eeles, R. The role of BRCA1 and BRCA2 in prostate cancer. Asian J Androl. 14, 409-414 (2012).
- Vencken, P. M., et al. Chemosensitivity and outcome of BRCA1- and BRCA2-associated ovarian cancer patients after first-line chemotherapy compared with sporadic ovarian cancer patients. Ann Oncol. 22, 1346-1352 (2011).
- Farmer, H., et al. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy. Nature. 434, 917-921 (2005).
- Arbini, A. A., et al. Mitochondrial DNA depletion sensitizes cancer cells to PARP inhibitors by translational and post-translational repression of BRCA2. Oncogenesis. 2, e82 (2013).
- Yang, F., Guo, X., Yang, G., Rosen, D. G., Liu, J. AURKA and BRCA2 expression highly correlate with prognosis of endometrioid ovarian carcinoma. Mod Pathol. 24, 836-845 (2011).
- Guaragnella, N., Marra, E., Galli, A., Moro, L., Giannattasio, S. Silencing of BRCA2 decreases anoikis and its heterologous expression sensitizes yeast cells to acetic acid-induced programmed cell death. Apoptosis. 19, 1330-1341 (2014).
- Mahato, R. I., Rolland, A., Tomlinson, E. Cationic lipid-based gene delivery systems: pharmaceutical perspectives. Pharm Res. 14, 853-859 (1997).
- Su, L. K., et al. Characterization of BRCA2: temperature sensitivity of detection and cell-cycle regulated expression. Oncogene. 17, 2377-2381 (1998).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227, 680-685 (1970).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci U S A. 76, 4350-4354 (1979).
- Burnette, W. N. '. 'Western blotting': electrophoretic transfer of proteins from sodium dodecyl sulfate--polyacrylamide gels to unmodified nitrocellulose and radiographic detection with antibody and radioiodinated protein A. Anal Biochem. 112, 195-203 (1981).
- Hunter, F. W., et al. Dual targeting of hypoxia and homologous recombination repair dysfunction in triple-negative breast cancer. Mol Cancer Ther. , (2014).
- Drew, Y., et al. Therapeutic potential of poly(ADP-ribose) polymerase inhibitor AG014699 in human cancers with mutated or methylated BRCA1 or BRCA2. J Natl Cancer Inst. 103, 334-346 (2011).
- Bryant, H. E., et al. Specific killing of BRCA2-deficient tumours with inhibitors of poly(ADP-ribose) polymerase. Nature. 434, 913-917 (2005).
- Ihnen, M., et al. Therapeutic potential of the poly(ADP-ribose) polymerase inhibitor rucaparib for the treatment of sporadic human ovarian cancer. Mol Cancer Ther. 12, 1002-1015 (2013).
- Jeong, J. H., Jo, A., Park, P., Lee, H., Lee, H. O. Brca2 Deficiency Leads to T Cell Loss and Immune Dysfunction. Mol Cells. , (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten