Method Article
مقارنة الأداء التنبؤي لثلاثة أنظمة تدريج للعقدة الليمفاوية في سرطان الخلايا الحلقية للقولون والمستقيم بناء على نموذج التعلم الآلي
* These authors contributed equally
In This Article
Summary
تقوم هذه الدراسة بتقييم الأنظمة التنبؤية لمرضى سرطان الخلايا الحلقية في القولون والمستقيم باستخدام نماذج التعلم الآلي وتحليلات المخاطر المتنافسة. يحدد احتمالات العقد الليمفاوية الإيجابية كمؤشر متفوق مقارنة بمرحلة pN ، مما يدل على أداء تنبؤي قوي ويساعد في اتخاذ القرارات السريرية من خلال أدوات التنبؤ بالبقاء على قيد الحياة القوية.
Abstract
حالة العقدة الليمفاوية هي مؤشر تنبؤي حاسم للمرضى. ومع ذلك ، فإن تشخيص سرطان الخلايا الحلقية القولون والمستقيم (SRCC) قد حظي باهتمام محدود. تبحث هذه الدراسة في القدرة التنبؤية التشخيصية لاحتمالات السجل للغدد الليمفاوية الإيجابية (LODDS) ، ونسبة العقدة الليمفاوية (LNR) ، والتدريج pN في مرضى SRCC باستخدام نماذج التعلم الآلي (Random Forest و XGBoost و Neural Network) جنبا إلى جنب مع نماذج المخاطر المتنافسة. تم استخراج البيانات ذات الصلة من قاعدة بيانات الترصد وعلم الأوبئة والنتائج النهائية (SEER). بالنسبة لنماذج التعلم الآلي ، تم تحديد العوامل التنبؤية للبقاء على قيد الحياة النوعي للسرطان (CSS) من خلال تحليلات انحدار كوكس أحادية المتغير ومتعددة المتغيرات ، متبوعة بتطبيق ثلاث طرق للتعلم الآلي - XGBoost و RF و NN - للتأكد من نظام التدريج الأمثل للعقدة الليمفاوية. في نموذج المخاطر المتنافس ، تم استخدام تحليلات المخاطر المتنافسة أحادية المتغير ومتعددة المتغيرات لتحديد العوامل التنبؤية ، وتم إنشاء مخطط للرسم البياني للتنبؤ بتشخيص مرضى SRCC. واستخدمت المنطقة الواقعة أسفل منحنى الخصائص التشغيلية للمستقبل (AUC-ROC) ومنحنيات المعايرة لتقييم أداء النموذج. تم تضمين ما مجموعه 2,409 مريضا من SRCC في هذه الدراسة. للتحقق من فعالية النموذج ، تم تضمين مجموعة إضافية من 15,122 مريضا بسرطان القولون والمستقيم ، باستثناء حالات SRCC ، للتحقق من الصحة الخارجية. أظهر كل من نماذج التعلم الآلي ومخطط المخاطر المتنافس أداء قويا في التنبؤ بنتائج البقاء على قيد الحياة. بالمقارنة مع التدريج pN ، أظهرت أنظمة التدريج LODDS قدرة تنبؤية فائقة. عند التقييم ، حققت نماذج التعلم الآلي ونماذج المخاطر المتنافسة أداء تنبؤيا ممتازا يتميز بالتمييز الجيد والمعايرة وقابلية التفسير. قد تساعد النتائج التي توصلنا إليها في إبلاغ عملية صنع القرار السريري للمرضى.
Introduction
يصنف سرطان القولون والمستقيم (CRC) على أنه ثالث أكثر الأورام الخبيثة انتشارا على مستوى العالم1،2،3. سرطان الخلايا الحلقية الخاتم (SRCC) ، وهو نوع فرعي نادر من سرطان الخلايا الحلقية ، يشتمل على ما يقرب من 1٪ من الحالات ويتميز بكثرة من الميوسين داخل الخلايا الذي يزيح نواة الخلية1،2،4. غالبا ما يرتبط SRCC بالمرضى الأصغر سنا ، وله انتشار أعلى بين الإناث ، ولديه مراحل متقدمة من الورم عند التشخيص. بالمقارنة مع سرطان القولون والمستقيم الغدي ، يظهر SRCC تمايزا أضعف ، وخطرا أعلى للإصابة بالورم الخبيث البعيد ، ومعدل بقاء لمدة 5 سنوات فقط 12٪ -20٪ 5،6. يعد تطوير نموذج تنبؤي دقيق وفعال ل SRCC أمرا بالغ الأهمية لتحسين استراتيجيات العلاج وتحسين النتائج السريرية.
تهدف هذه الدراسة إلى بناء نموذج تنبؤي قوي لمرضى SRCC باستخدام مناهج إحصائية متقدمة ، بما في ذلك التعلم الآلي (ML) ونماذج المخاطر المتنافسة. يمكن لهذه المنهجيات أن تستوعب العلاقات المعقدة في البيانات السريرية ، وتقدم تقييمات فردية للمخاطر وتتجاوز الأساليب التقليدية في الدقة التنبؤية. تتفوق نماذج التعلم الآلي ، مثل Random Forest و XGBoost و Neural Networks ، في معالجة البيانات عالية الأبعاد وتحديد الأنماط المعقدة. أظهرت الدراسات أن نماذج الذكاء الاصطناعي تتنبأ بشكل فعال بنتائج البقاء على قيد الحياة في سرطان القولون والمستقيم ، مع التركيز على إمكانات ML في التطبيقات السريرية7،8. استكمالا للتعلم الآلي ، تعالج نماذج المخاطر المتنافسة أنواعا متعددة من الأحداث ، مثل الوفيات الخاصة بالسرطان مقابل أسباب الوفاة الأخرى ، لتحسين تحليل البقاء على قيد الحياة. على عكس الأساليب التقليدية مثل مقدر كابلان ماير ، تقدر نماذج المخاطر المتنافسة بدقة الاحتمال الهامشي للأحداث في وجود مخاطر متنافسة ، مما يوفر تقييمات أكثر دقة للبقاءعلى قيد الحياة 8. يعزز دمج التعلم الآلي وتحليل المخاطر المتنافسة الأداء التنبؤي ، مما يوفر إطارا قويا لأدوات التشخيص الشخصية في SRCC9،10،11.
يؤثر ورم خبيث العقدة الليمفاوية بشكل كبير على التشخيص والتكرار لدى مرضى سرطان القولون. في حين أن تقييم المرحلة N في تصنيف TNM أمر بالغ الأهمية ، إلا أن فحص العقدة الليمفاوية غير الكافي - الذي تم الإبلاغ عنه في 48٪ -63٪ من الحالات - يمكن أن يؤدي إلى التقليل من تقدير المرض. لمعالجة هذا الأمر ، تم تقديم مناهج بديلة مثل نسبة العقدة الليمفاوية (LNR) واحتمالات العقد الليمفاوية الإيجابية (LODDS). LNR ، نسبة الغدد الليمفاوية الإيجابية (PLNs) إلى إجمالي الغدد الليمفاوية (TLNs) ، أقل تأثرا بعدد TLN وتعمل كعامل تنبؤي في CRC. أظهرت LODDS ، النسبة اللوغاريتمية ل PLNs إلى الغدد الليمفاوية السالبة (NLNs) ، قدرة تنبؤية فائقة في كل من SRCC المعدة وسرطان القولون والمستقيم10،11. تم تطبيق التعلم الآلي بشكل متزايد في علم الأورام ، حيث تعمل النماذج على تحسين التقسيم الطبقي للمخاطر والتنبؤات التنبؤية عبر أنواع مختلفة من السرطان ، بما في ذلك سرطان الثدي والبروستاتا والرئة12،13،14. ومع ذلك ، فإن تطبيقه في SRCC للقولون والمستقيم لا يزال محدودا.
تسعى هذه الدراسة إلى سد هذه الفجوة من خلال دمج LODDS مع التعلم الآلي ونماذج المخاطر المتنافسة لإنشاء أداة تنبؤية شاملة. من خلال تقييم القيمة التنبؤية ل LODDS والاستفادة من التقنيات التنبؤية المتقدمة ، يهدف هذا البحث إلى تعزيز اتخاذ القرار السريري وتحسين النتائج لمرضى SRCC.
Protocol
لا تشير هذه الدراسة إلى الموافقة الأخلاقية والموافقة على المشاركة. تم الحصول على البيانات المستخدمة في هذه الدراسة من قواعد البيانات. قمنا بتضمين المرضى الذين تم تشخيص إصابتهم بسرطان الخلايا الحلقية في القولون والمستقيم من عام 2004 إلى عام 2015 ، بالإضافة إلى أنواع أخرى من سرطان القولون والمستقيم. وشملت معايير الاستبعاد المرضى الذين تقل مدة بقائهم على قيد الحياة عن شهر واحد، وأولئك الذين لديهم معلومات سريرية مرضية غير مكتملة، والحالات التي كان فيها سبب الوفاة غير واضح أو غير محدد.
1. الحصول على البيانات
- قم بتنزيل SEER. احصل على برنامج الإحصائيات 8.4.3 من موقع قاعدة بيانات SEER (http://seer.cancer.gov/about/overview.html). بعد تسجيل الدخول إلى البرنامج ، انقر فوق جلسة قائمة الحالات > البيانات وحدد قاعدة بيانات Incident SEER Research Plus ، 17 تسجيلا ، نوفمبر 2021 الفرعية (2000-2019).
- انقر فوق التحديد > تحرير واختر {العرق ، الجنس ، السنة Dx. سنة التشخيص} = "2004" ، "2005" ، "2006" ، "2007" ، "2008" ، "2009" ، "2010" ، "2011" ، "2012" ، "2013" ، "2014" ، "2015" و {الموقع والتشكل. إعادة ترميز الموقع ICD-O-3/WHO 2008} = '8490/3'.
- ثم انقر فوق الجدول ، وفي واجهة المتغيرات المتاحة ، حدد إعادة ترميز العمر مع الأعمار الفردية و 100+ ، الجنس ، الزواج ، إعادة ترميز الموقع ICD-O-3 / WHO 2008 ، حجم ورم CS ، nodes_examined الإقليمي (1988+) ، nodes_positive الإقليمي (1988+) ، مجموعة المرحلة المشتقة من AJCC ، الطبعة السادسة (2004-2015) ، AJCC T المشتقة ، 6th ed (2004-2015) ، Derived AJCC N ، 6th ed (2004-2015) ، Derived AJCC M ، 6 إد (2004-2015) ، CEA ، إعادة ترميز الإشعاع ، إعادة ترميز العلاج الكيميائي (نعم ، لا / غير ذلك) ، تصنيف الوفاة الخاصة بالسبب SEER ، إعادة ترميز الحالة الحيوية (قطع الدراسة المستخدمة) ، أشهر البقاء على قيد الحياة ، سنة التشخيص.
- أخيرا ، انقر فوق الإخراج ، وقم بتسمية البيانات ، وانقر فوق تنفيذ لإخراج البيانات وحفظها. يتم عرض عملية التضمين التفصيلية في الشكل 1.
- قم بتنزيل البيانات من مرضى سرطان القولون والمستقيم ، باستثناء حالات SRCC ، للتحقق الخارجي اللاحق. انقر فوق التحديد > تحرير واختر {العرق ، الجنس ، السنة Dx. سنة التشخيص} = '2004' ، '2005' ، '2006' ، '2007' ، '2008' ، '2009' ، '2010' ، '2011' ، '2012' ، '2013' ، '2014' ، '2015' و {الموقع الأساسي - المسمى} = 'C18-C20'. كرر الخطوتين 1.3 و 1.4 للحصول على المعلومات المرضية السريرية واستبعاد العينات التي تحتوي على {الموقع والمورفولوجيا. إعادة ترميز الموقع ICD-O-3/WHO 2008} = '8490/3' من الملف الذي تم تنزيله.
- لأغراض المقارنة ، قم بمعالجة العديد من المتغيرات. تصنيف حالة العقدة الليمفاوية باستخدام كل من نسبة العقدة الليمفاوية (LNR) ولوغاريتم احتمالات الغدد الليمفاوية الإيجابية (LODDS).
- تعريف LNR على أنه نسبة الغدد الليمفاوية الإيجابية (PLNs) إلى إجمالي الغدد الليمفاوية (TLNs). احسب قيمة LODDS باستخدام الصيغة:
loge(عدد PLNs + 0.5) / (عدد الغدد الليمفاوية السالبة (NLNs) + 0.5)
حيث تمت إضافة 0.5 لمنع نتيجة لا نهائية. تم تحديد القيم الفاصلة ل LNR و LODDS وحجم الورم باستخدام برنامج X-tile (الإصدار 3.6.1) بناء على طريقة الحد الأدنى من قيمة P.
- تعريف LNR على أنه نسبة الغدد الليمفاوية الإيجابية (PLNs) إلى إجمالي الغدد الليمفاوية (TLNs). احسب قيمة LODDS باستخدام الصيغة:
- افتح برنامج X-tile ، وانقر فوق ملف > فتح ، وحدد ملف البيانات لاستيراده إلى البرنامج. بمجرد تحميل البيانات ، قم بتعيين المتغيرات: يتوافق الرقيب مع حالة البقاء على قيد الحياة ، ويتوافق وقت البقاء على قيد الحياة مع وقت البقاء على قيد الحياة ، والعلامة 1 هي المتغير المراد تحليله ، مما يضمن تطابق البيانات بشكل صحيح.
- ثم انقر فوق Do > Kaplan-Meier > Marker1 لإجراء تحليل بقاء كابلان ماير وإنشاء منحنى البقاء على قيد الحياة. بناء على فصل منحنيات بقاء كابلان ماير ، والدلالة الإحصائية (على سبيل المثال ، القيمة الاحتمالية) ، والأهمية السريرية ، تحدد قيمة القطع المثلى ، وأخيرا قم بتسجيل أو تصدير نتائج التحليل.
- قسم LNR إلى ثلاث مجموعات: LNR 1 (≤0.16) و LNR 2 (0.16 - 0.78) و LNR 3 (≥ 0.78). صنف المرضى إلى ثلاث مجموعات بناء على LODDS: LODDS 1 (≤ -1.44) ، LODDS 2 (-1.44 - 0.86) ، و LODDS 3 (≥ 0.86).
- يصنف حجم الورم إلى ثلاث فئات: ≤ 3.5 سم ، 3.5 - 5.5 سم ، ≥ 5.5 سم. تحويل العمر من متغير مستمر إلى متغير فئوي. تصنيف أعمار المرضى في وقت التشخيص الأولي على أنها ≥60 عاما و <60 عاما. تصنيف موقع الورم بناء على توزيع أورام سرطان الخلايا الحلقية (SRCC) على أنها القولون الأيمن والقولون الأيسر والمستقيم. يشمل القولون الأيمن الأعور ، والقولون الصاعد ، والانثناء الكبدي ، والقولون المستعرض ، بينما يشمل القولون الأيسر الانثناء الطحال ، والقولون الهابط ، والقولون السيني ، والتقاطع المستقيم السيني.
- بالنسبة لهذه الدراسة ، قم بتعيين ما مجموعه 2409 من بيانات المرضى المؤهلين بشكل عشوائي مع SRCC إلى مجموعة تدريب (N = 1686) ومجموعة التحقق من الصحة (N = 723) بنسبة 7: 3. استخدم الكود التالي للتقسيم العشوائي ، ومصدر data.csv من قاعدة بيانات SEER. سيتم استخدام الملفات التي تم إنشاؤها بعد التقسيم العشوائي لمزيد من التحليل.
المكتبة (قحام)
البيانات <- read.csv ("data.csv")
مجموعة.بذرة(123)
train_indices <- createDataPartition (data$variable ، p = 0.7 ، list = FALSE)
train_data <- البيانات[train_indices ، ]
test_data <- البيانات[-train_indices ، ]
write.csv(train_data ، "traindata.csv" ، row.names = FALSE)
write.csv(test_data، "testdata.csv"، row.names = FALSE)
2. تطوير نماذج ML والتحقق منها
- قم بتنزيل برنامج RStudio (2024.04.2+764) و R (4.4.1). افتح RStudio لتشغيل برنامج R. انقر فوق ملف جديد وحدد R Script لإنشاء واجهة برمجة R جديدة. أدخل الكود ذي الصلة في محرر التعليمات البرمجية وانقر فوق تشغيل لتنفيذ الكود.
- استخدم التعليمات البرمجية التالية لفحص المتغيرات المضمنة في نماذج التعلم الآلي بواسطة تحليل انحدار كوكس. بالإضافة إلى ذلك ، استكشف تأثير التدريج LODDS و LNR و pN على البقاء على قيد الحياة الخاص بالسرطان (CSS) لدى مرضى SRCC. traindata.csv هي البيانات التي تم الحصول عليها من قاعدة بيانات SEER.
المكتبة("البقاء على قيد الحياة")
المكتبة("Survminer")
المكتبة("RMS")
المكتبة("DPLYR")
البيانات <- read.csv ("traindata.csv")
data$time=as.numeric(data$time)
data$status=as.numeric(data$status)
المتغيرات <- ج ("الجنس" ، "العمر" ، "العرق" ، "الزوجي" ، "المرحلة" ، "T" ، "N" ، "M" ، "Tumor_size" ، "LNR" ، "LODDS" ، "CEA" ، "الإشعاع" ، "العلاج الكيميائي" ، "الموقع")
< البيانات- البيانات ٪>٪
تحور (عبر (all_of (المتغيرات) ، كعامل ))
cox = coxph (Surv (الوقت ، الحالة) ~ البيانات $ T ، البيانات = البيانات)
معاملات cox $
pval = anova (كوكس) $Pr [2]
clean_data = البيانات [، ج (1:12 ، 14:18)]
get_coxVariable=الوظيفة (your_data ، الفهرس) {cox_list = c () k = 1
ل (i في 1: index) {mod = coxph (Surv (الوقت ، الحالة) ~ your_data[، i] ، البيانات = your_data) pval = anova (mod) $Pr [2] print (pval) print (colnames (your_data) [i]) if (pval <0.05) {cox_list[k] = colnames (your_data) [i] k = k + 1}}return (cox_list)}
variable_select=get_coxVariable(clean_data،15)
من أجل (أنا في 1:15) {طباعة (variable_select[i])}
ل (var في variable_select) {formula <- as.formula(paste("Surv(time, status) ~", var))cox_model <- coxph(formula, data = data) print(ملخص(cox_model))
GGFOREST(كوكس)
المتغيرات <- ج ("الجنس" ، "العمر" ، "العرق" ، "الزوجي" ، "المرحلة" ، "T" ، "N" ، "M" ، "Tumor_size" ، "LNR" ، "LODDS" ، "العلاج الكيميائي")
< البيانات- البيانات ٪>٪
تحور (عبر (all_of (المتغيرات) ، كعامل ))
كوكس = كوكسف (Surv (الوقت ، الحالة) ~ الجنس + العمر + العرق + الزوجي + T + N + M + Tumor_size + LNR +
LODDS + العلاج الكيميائي ، البيانات = البيانات)
ggforest(كوكس، البيانات = البيانات)
ggplot_forest <- ggforest(كوكس، البيانات = البيانات) - استخدم التعليمات البرمجية التالية لمقارنة قدرات التنبؤ التنبؤي لثلاثة أنظمة LN (LODDS و LNR و pN) عبر مجموعات التدريب والتحقق من الصحة والتحقق الخارجية.
المكتبة (RMS)
المكتبة (البقاء على قيد الحياة)
المكتبة (Survminer)
المكتبة (riskRegression)
المكتبة(GT)
train_data <- read.csv("train_data123.csv")
validation_data <- read.csv("test_data123.csv")
DD <- Datadist (train_data)
الخيارات (datadist = "dd")
model_LNR <- cph (Surv (الوقت ، الحالة) ~ LNR ، البيانات = train_data ، x = TRUE ، y = TRUE)
model_LODDS <- cph (Surv (الوقت ، الحالة) ~ LODDS ، البيانات = train_data ، x = TRUE ، y = TRUE)
model_pN <- cph (Surv (الوقت ، الحالة) ~ N ، البيانات = train_data ، x = TRUE ، y = TRUE)
calculate_performance <- الوظيفة (النموذج ، البيانات) {pred <- التنبؤ (النموذج ، البيانات الجديدة = البيانات) c_index_result <- التوافق (Surv (البيانات $ الوقت ، البيانات $ الحالة) ~ pred) c_index <- c_index_result $ concordance aic <- AIC (نموذج) bic <- BIC (نموذج) عائد (c (C_index = جولة (c_index ، 3) ، AIC = جولة (aic ، 2) ، BIC = جولة (bic ، 2))}
calculate_performance <- الوظيفة (النموذج ، البيانات) {pred <- التنبؤ (النموذج ، البيانات الجديدة = البيانات ، النوع = "lp") concordance_result <- concordancefit (Surv (data $ time ، data $ status) ، x = pred) c_index <- concordance_result $ concordance ci_lower <- c_index - 1.96 * sqrt (concordance_result $ var) ci_upper <- c_index + 1.96 * sqrt (concordance_result $ var) aic <- AIC (نموذج) bic <- BIC (نموذج) إرجاع (c (C_Index = دائري (c_index ، 3) ، CI_Lower = جولة (ci_lower ، 3) ، CI_Upper = جولة (ci_upper ، 3) ، AIC = جولة (aic ، 2) ، BIC = جولة (bic ، 2)))}
train_LNR <- calculate_performance(model_LNR ، train_data)
train_LODDS <- calculate_performance(model_LODDS ، train_data)
train_pN <- calculate_performance(model_pN ، train_data)
model_LNR_val <- cph (Surv (الوقت ، الحالة) ~ LNR ، البيانات = validation_data ، x = TRUE ، y = TRUE)
model_LODDS_val <- cph (Surv (الوقت ، الحالة) ~ LODDS ، البيانات = validation_data ، x = TRUE ، y = TRUE)
model_pN_val <- cph (Surv (الوقت ، الحالة) ~ N ، البيانات = validation_data ، x = TRUE ، y = TRUE)
val_LNR <- calculate_performance (model_LNR_val ، validation_data)
val_LODDS <- calculate_performance (model_LODDS_val ، validation_data)
val_pN <- calculate_performance (model_pN_val ، validation_data)
النتائج <- data.frame(المتغير = c ("LNR" ، "LODDS" ، "pN") ، Training_C_Index = c (paste (train_LNR ["C_Index") ، "("، train_LNR["CI_Lower"] ، "، "، "، train_LNR["CI_Upper"] ، ")" ، sep = "") ، لصق (train_LODDS["C_Index"] ، "("، train_LODDS["CI_Lower"] ، "، "، "، train_LODDS["CI_Upper"] ، ")" ، sep = "") ، لصق (train_pN ["C_Index"] ، "("، train_pN["CI_Lower"] ، "، "، "، train_pN["CI_Upper"] ، ")" ، سبتمبر = "")) ، Training_AIC = c (train_LNR ["AIC"] ، train_LODDS["AIC"], train_pN["AIC"]), Training_BIC = c(train_LNR["BIC"], train_LODDS["BIC"], train_pN["BIC"]), Validation_C_Index = c(paste(val_LNR["C_Index"], "(", val_LNR["CI_Lower"], ", ", ", val_LNR["CI_Upper"], ")", sep = """), paste(val_LODDS["C_Index"], "(", val_LODDS["CI_Lower"], ", ", ", val_LODDS["CI_Upper"], ")", sep = """), paste(val_pN["C_Index"], "(", val_pN["CI_Lower"], "، "، val_pN["CI_Upper"]، ")"، SEP = ""))، Validation_AIC = c(val_LNR["AIC"] ، val_LODDS["AIC"] ، val_pN["AIC"]) ، Validation_BIC = c (val_LNR["BIC"] ، val_LODDS["BIC"] ، val_pN["BIC"]))
results_table <- gt (النتائج) ٪>٪
tab_header(العنوان = "أداء التنبؤ بأنظمة التدريج العقدية الليمفاوية الثلاثة") ٪ >٪
cols_label(المتغير = "المتغير"، Training_C_Index = "مؤشر C (95٪ CI) (التدريب)"، Training_AIC = "AIC (التدريب)"، Training_BIC = "BIC (التدريب)"، Validation_C_Index = "مؤشر C (95٪ CI) (التحقق من الصحة)"، Validation_AIC = "AIC (التحقق)"، Validation_BIC = "BIC (التحقق)")
write.csv(النتائج، "prediction_performance.csv"، row.names = FALSE) - استخدم الكود التالي لبناء نموذج XGBoost وإنشاء رسوم بيانية شريطية للأهمية النسبية للمتغيرات ، وبالتالي ، لمقارنة أهمية أنظمة LN الثلاثة. وبالمثل ، قم بإنشاء منحنيات ROC ومنحنيات المعايرة. يتم الحصول على البيانات من قاعدة بيانات SEER.
المكتبة (XGBOOST)
المكتبة (قحام)
المكتبة(pROC)
train_data <- read.csv("train_data.csv")
test_data <- read.csv("test_data.csv")
train_matrix <- XGB. DMatrix (البيانات = as.matrix (train_data [، c ('العمر' ، 'T' ، 'N' ، 'M' ، 'LODDS' ، 'العلاج الكيميائي')]) ، التسمية = train_data$status)
test_matrix <- XGB. DMatrix (البيانات = as.matrix (test_data [، c ('العمر' ، 'T' ، 'N' ، 'M' ، 'lodds' ، 'العلاج الكيميائي')]) ، التسمية = test_data$status)
المعلمات <- القائمة (الداعم = "GBtree" ، الهدف = "ثنائي: لوجستي" ، eval_metric = "AUC" ، ETA = 0.1 ، max_depth = 6 ، عينة فرعية = 0.8 ، colsample_bytree = 0.8)
xgb_model <- xgb.train (المعلمات = المعلمات ، البيانات = train_matrix ، nrounds = 100 ، قائمة المراقبة = القائمة (القطار = train_matrix) ، الإسطول = 1)
pred_probs <- التنبؤ (xgb_model ، newdata = test_matrix)
pred_labels <- ifelse(pred_probs > 0.5 ، 1 ، 0)
conf_matrix <- مصفوفة الارتباك (كعامل (pred_labels) ، كعامل (test_data $ حالة))
roc_curve <- ROC (test_data $ الحالة ، pred_probs)
auc_value <- AUC(roc_curve)
ci_auc <- ci.auc(roc_curve)
الحساسية <- conf_matrix $ byClass ["الحساسية"]
الخصوصية <- conf_matrix $ byClass["الخصوصية"]
الدقة <- conf_matrix دولار بشكل عام["الدقة"]
ppv <- conf_matrix $ byClass["قيمة Pos Pred Value"]
npv <- conf_matrix$byClass["قيمة Neg Pred"]
result_table <- data.frame(النموذج = "XGBoost", AUC = sprintf("٪.3f (٪.3f-٪.3f)", auc_value, ci_auc[1], ci_auc[3]), الحساسية = sprintf("٪.3f", الحساسية), الخصوصية = sprintf("٪.3f", الخصوصية), الدقة = sprintf("٪.3f", الدقة), PPV = sprintf("٪.3f", ppv), NPV = sprintf("٪.3f", npv))
write.csv(result_table ، "xgboost_model_performance.csv" ، row.names = FALSE)
roc_df <- data.frame(FPR = 1 - roc_curve $ specificities ، TPR = roc_curve $ حساسيات)
roc_plot <- ggplot (roc_df ، aes (x = FPR ، y = TPR)) + geom_line (اللون = "steelblue" ، الحجم = 1.2) + geom_abline (الاعتراض = 0 ، المنحدر = 1 ، linetype = "متقطع" ، اللون = "الرمادي") + تعليق توضيحي ("نص" ، x = 0.9 ، y = 0.2 ، تسمية = لصق ("AUC =" ، دائري (auc_value ، 3)) ، الحجم = 5 ، اللون = "أسود") + labs (العنوان = "منحنى ROC لنموذج XGBoost" ، x = "معدل إيجابي خاطئ" ، y = "معدل إيجابي حقيقي") + theme_minimal () + سمة (panel.border = element_rect (اللون = "أسود" ، ملء = NA ، الحجم = 1))
calibration_data <- data.frame(الحالة = as.factor(test_data$status) ، pred_probs = pred_probs)
calib_model <- المعايرة (الحالة ~ pred_probs ، البيانات = calibration_data ، الفئة = "1" ، التخفيضات = 5)
ggplot (calib_model $ data ، aes (x = نقطة المنتصف ، y = النسبة المئوية)) + geom_line (اللون = "steelblue" ، الحجم = 1) + geom_point (اللون = "الأحمر" ، الحجم = 2) + geom_abline (الاعتراض = 0 ، المنحدر = 1 ، linetype = "متقطع" ، اللون = "أسود") + labs (العنوان = "منحنى المعايرة لنموذج XGBoost" ، x = "الاحتمال المتوقع" ، y = "النسبة المرصودة") + theme_minimal () + سمة (panel.border = element_rect (اللون = "أسود" ، تعبئة = NA ، الحجم = 0.5)) - استخدم الكود التالي لبناء نموذج RF وإنشاء رسوم بيانية شريطية للأهمية النسبية للمتغيرات ، وبالتالي مقارنة أهمية أنظمة LN الثلاثة. وبالمثل ، قم بإنشاء منحنيات ROC ومنحنيات المعايرة. يتم الحصول على البيانات من قاعدة بيانات SEER.library (randomForest)
المكتبة (DPLYR)
المكتبة (ggplot2)
المكتبة(pROC)
المكتبة (قحام)
المكتبة (RMS)
مجموعة القطارات <- read.csv ("train_data.csv")
تم اختباره <- read.csv ("test_data.csv")
trainset$status=factor(trainset$status)
المتغيرات 1 <- ج ("العمر" ، "T" ، "N" ، "M" ، "Lodds" ، "العلاج الكيميائي")
مجموعة القطارات <- مجموعة القطار٪>٪
تحور (عبر (all_of (المتغيرات 1) ، على النحو الرقمي))
اختبارات$status=عامل(اختبار$حالة)
تم اختباره < - تم اختباره ٪ >٪
تحور (عبر (all_of (المتغيرات 1) ، على النحو الرقمي))
RF = randomForest (مجموعة القطارات = الحالة ~ العمر + T + N + M + LODDS + العلاج الكيميائي ، البيانات = مجموعة القطارات ، ntree = 100 ، الأهمية = TRUE ، القرب = TRUE)
imp = أهمية (RF)
varImpPlot (RF)
impvar = أسماء الصفوف (عفريت) [الترتيب (عفريت [، 4] ، متناقص = صحيح)]
importance_df <- as.data.frame (عفريت عفرية)
importance_df $ المتغيرات < - أسماء الصفوف (importance_df)
importance_plot <- ggplot (importance_df ، aes (x = إعادة الترتيب (المتغيرات ، MeanDecreaseAccuracy) ، y = MeanDecreaseAccuracy)) + geom_bar (stat = "identity" ، fill = "steelblue") + coord_flip () + labs (title = "الأهمية المتغيرة" ، x = "المتغيرات" ، y = "متوسط دقة الانخفاض") + theme_minimal ()
pred_probs <- التنبؤ (الترددات اللاسلكية ، مجموعة الاختبار ، النوع = "prob") [، 2]
roc_obj <- ROC (testset$status, pred_probs)
auc_value <- AUC(roc_obj)
roc_plot <- ggplot() + geom_line (AES (x = 1 - roc_obj $ الخصائص ، y = roc_obj $ حساسيات) ، اللون = "steelblue" ، الحجم = 1.2) + geom_abline (الاعتراض = 0 ، المنحدر = 1 ، linetype = "متقطع" ، اللون = "الرمادي") + التعليق التوضيحي ("النص" ، x = 0.8 ، y = 0.2 ، التسمية = لصق ("AUC =" ، دائري (auc_value ، 3)) ، اللون = "أسود" ، الحجم = 5 ، hjust = 0) + labs (title = "منحنى ROC لنموذج الغابة العشوائية" ، x = "المعدل الإيجابي الخاطئ" ، y = "المعدل الإيجابي الحقيقي") + theme_minimal () + السمة (panel.border = element_rect(اللون = "أسود" ، التعبئة = NA ، الحجم = 1))
calibration_data <- data.frame(pred_probs = pred_probs، الحالة = tested$status)
calib_model <- المعايرة(الحالة ~ pred_probs ، البيانات = calibration_data ، الفئة = "1" ، التخفيضات = 5)
calib_df <- as.data.frame(calib_model[["data"]])
calib_df دولار منتصف < - calib_df دولار منتصف
calib_df دولار في المائة < - calib_df دولار في المائة
calibration_plot <- ggplot (calib_df ، aes (x = mid ، y = Percent)) + geom_line (اللون = "steelblue" ، الحجم = 1.2) + geom_point (اللون = "steelblue" ، الحجم = 3) + geom_abline (التقاطع = 0 ، المنحدر = 1 ، linetype = "متقطع" ، اللون = "أسود" ، الحجم = 0.8) + labs (title = "منحنى المعايرة للغابة العشوائية" ، x = "الاحتمال المتوقع" ، y = "الاحتمال الفعلي") + theme_minimal () + سمة (panel.border = element_rect (اللون = "أسود" ، ملء = NA ، الحجم = 1) ، plot.title = element_text (hjust = -0.05 ، vjust = -1.5 ، الوجه = "غامق" ، الحجم = 12) )
rf_probs <- التنبؤ (RF ، newdata = اختبارها ، النوع = "prob") [، 2]
rf_auc <- ROC (تم اختباره $الحالة ، rf_probs)
auc_value <- AUC(rf_auc)
ci_auc <- ci.auc(rf_auc)
rf_predictions <- التنبؤ (RF ، newdata = اختبار)
conf_matrix <- confusionMatrix (rf_predictions ، تم اختباره $status)
الحساسية <- conf_matrix $ byClass ["الحساسية"]
الخصوصية <- conf_matrix $ byClass["الخصوصية"]
الدقة <- conf_matrix دولار بشكل عام["الدقة"]
ppv <- conf_matrix $ byClass["قيمة Pos Pred Value"]
npv <- conf_matrix$byClass["قيمة Neg Pred"]
result_table <- data.frame(النموذج = "RF" ، AUC = sprintf ("٪ .3f (٪ .3f-٪ .3f)" ، auc_value ، ci_auc [1] ، ci_auc [3]) ، الحساسية = sprintf ("٪ .3f" ، الحساسية) ، الخصوصية = sprintf ("٪ .3f" ، الخصوصية) ، الدقة = sprintf ("٪ .3f" ، الدقة) ، PPV = sprintf ("٪ .3f" ، ppv) ، NPV = sprintf ("٪ .3f" ، npv))
write.csv(result_table، "RF_model_performance.csv"، row.names = FALSE) - استخدم الكود التالي لبناء نموذج NN وإنشاء رسوم بيانية شريطية للأهمية النسبية للمتغيرات ، وبالتالي مقارنة أهمية أنظمة LN الثلاثة. وبالمثل ، قم بإنشاء منحنيات ROC ومنحنيات المعايرة. يتم الحصول على البيانات من قاعدة بيانات SEER.library (nnet)
المكتبة (قحام)
المكتبة(pROC)
المكتبة (ggplot2)
train_data <- read.csv("train_data.csv")
test_data <- read.csv("test_data.csv")
train_data $ الحالة <- as.factor (train_data $ status)
test_data $ الحالة < - as.factor (test_data$status)
الميزات <- C ("العمر" ، "T" ، "N" ، "M" ، "Lodds" ، "العلاج الكيميائي")
x_train <- train_data[، الميزات]
y_train <- train_data$status
x_test <- test_data[، الميزات]
y_test <- حالة test_data$
nn_model <- nnet (الحالة ~ العمر + T + N + M + LODDS + العلاج الكيميائي ، البيانات = train_data ، الحجم = 5 ، الاضمحلال = 0.01 ، الحد الأقصى = 200)
pred_probs <- التنبؤ (nn_model ، newdata = x_test ، اكتب = "خام")
pred_labels <- ifelse(pred_probs > 0.5 ، 1 ، 0)
roc_curve <- روك (ك.رقمي (y_test) ، pred_probs)
auc_value <- AUC(roc_curve)
auc_ci <- ci.auc(roc_curve)
auc_text <- paste0 (دائري (auc_value ، 3) ، " ("، دائري (auc_ci [1] ، 3) ، "-" ، دائري (auc_ci[3] ، 3 ، ")")
conf_matrix <- مصفوفة الارتباك (كعامل (pred_labels) ، y_test)
الدقة <- conf_matrix دولار بشكل عام["الدقة"]
الحساسية <- conf_matrix $ byClass ["الحساسية"]
الخصوصية <- conf_matrix $ byClass["الخصوصية"]
ppv <- conf_matrix $ byClass["قيمة Pos Pred Value"]
npv <- conf_matrix$byClass["قيمة Neg Pred"]
performance_table <- data.frame(متري = c ("AUC (95٪ CI)" ، "الدقة" ، "الحساسية" ، "الخصوصية" ، "PPV" ، "NPV") ، القيمة = c (auc_text ، جولة (دقة ، 3) ، جولة (حساسية ، 3) ، جولة (خصوصية ، 3) ، جولة (PPV ، 3) ، جولة (NPV ، 3)))
write.csv(performance_table ، "NN_performance_table.csv" ، row.names = FALSE)
roc_curve <- روك (y_test ، pred_probs)
auc_value <- AUC(roc_curve)
roc_plot <- ggplot () + geom_line (AES (x = 1 - roc_curve $ الخصائص ، y = roc_curve $ sensitivities) ، اللون = "steelblue" ، الحجم = 1.2) + geom_abline (الاعتراض = 0 ، المنحدر = 1 ، linetype = "متقطع" ، اللون = "الرمادي") + التعليق التوضيحي ("النص" ، x = 0.8 ، y = 0.2 ، التسمية = لصق ("AUC =" ، دائري (auc_value ، 3)) ، اللون = "أسود" ، الحجم = 5 ، hjust = 0) + labs (title = "منحنى ROC لنموذج الشبكة العصبية" ، x = "معدل إيجابي خاطئ" ، y = "معدل إيجابي حقيقي") + theme_minimal() + سمة (panel.border = element_rect (اللون = "أسود" ، تعبئة = NA ، الحجم = 1))
calibration_data <- data.frame(pred_probs = pred_probs ، الحالة = as.numeric(y_test) - 1)
calibration_data pred_probs < دولارا - كرقم (calibration_data دولارا pred_probs)
calibration_data calibration_bin < دولارات - قطع (calibration_data دولار pred_probs ، فواصل = تسلسل (0 ، 1 ، بواسطة = 0.2) ، include.lowest = صحيح)
calibration_summary <- التجميع (الحالة ~ calibration_bin ، البيانات = calibration_data ، المرح = المتوسط)
calibration_summary دولارا pred_mean <- التجميع (pred_probs ~ calibration_bin ، البيانات = calibration_data ، المرح = المتوسط) $pred_probs
calibration_plot <- ggplot (calibration_summary ، AES (x = pred_mean ، y = الحالة)) + geom_line (اللون = "steelblue" ، الحجم = 1.2) + geom_point (اللون = "الأحمر" ، الحجم = 3) + geom_abline (التقاطع = 0 ، المنحدر = 1 ، linetype = "متقطع" ، اللون = "الأسود" ، الحجم = 0.8) + labs (title = "منحنى المعايرة للشبكة العصبية" ، x = "الاحتمال المتوقع" ، y = "الاحتمال الفعلي") + theme_minimal () + سمة (panel.border = element_rect (اللون = "أسود" ، ملء = NA ، الحجم = 1))
nn_var_importance <- varImp (nn_model)
importance_df <- data.frame(الميزة = أسماء الصفوف (nn_var_importance) ، الأهمية = nn_var_importance $ بشكل عام )
importance_plot <- ggplot (importance_df ، aes (x = إعادة ترتيب (ميزة ، أهمية) ، y = أهمية)) + geom_bar (stat = "هوية" ، fill = "steelblue") + coord_flip () + labs (title = "الأهمية المتغيرة للشبكة العصبية" ، x = "الميزات" ، y = "الأهمية") + theme_minimal ()
3. تطوير نموذج المخاطر المتنافس والتحقق منه
- استخدم الكود التالي لإجراء تحليل أحادي المتغير ورسم منحنى دالة الوقوع التراكمي (CIF). data.csv هي البيانات التي تم الحصول عليها من قاعدة بيانات SEER. ستكون طريقة حفظ الصور اللاحقة هي نفسها كما في هذه الخطوة. استبدل الموقع في الكود واحدا تلو الآخر بعوامل أخرى لإجراء تحليل أحادي المتغير لجميع العوامل.
المكتبة (TidyCMPRSK)
المكتبة (GTملخص)
المكتبة (ggplot2)
المكتبة (ggsurvfit)
المكتبة (GGPRISM)
AA <- read.csv ("data.csv")
cif2 <- tidycmprsk:: cuminc (Surv (الوقت ، الحالة 1) ~ الموقع ، البيانات = aa)
مرتبة (cif2 ، مرات = ج (12،24،36،48،60))
tbl_cuminc(cif2 ، مرات = ج (12،24،36،48،60) ، النتائج = c ("CSS" ، "OSS") ، estimate_fun = NULL ، label_header = "** {الوقت / 12} سنة cuminc **") ٪ >٪
add_p () ٪ >٪
add_n(الموقع = "المستوى")
cuminc_plot <- ggcuminc (cif2 ، النتيجة = c ("CSS" ، "OSS") ، الحجم = 1.5) + المختبرات (x = "الوقت") + add_quantile (y_value = 0.20 ، الحجم = 1) + scale_x_continuous (فواصل = التسلسل (0 ، 84 ، بواسطة = 12) ، الحدود = c (0 ، 84)) + scale_y_continuous (التسمية = المقاييس: :p ercent ، فواصل = seq (0 ، 1 ، بواسطة = 0.2) ، حدود = c (0 ، 1)) + theme_prism () + سمة (legend.position = c (0.2 ، 0.8) ، panel.grid = element_blank() ، panel.grid.major.y = element_line(اللون = "grey80")) + سمة (legend.spacing.x = وحدة (0.1 ، "سم") ، legend.spacing.y = وحدة (0.01 ، "سم") + سمة (axis.ticks.length.x = وحدة (-0.2 ، "سم") ، axis.ticks.x = element_line (اللون = "أسود" ، الحجم = 1 ، الخط الأقصى = 1)) + سمة (axis.ticks.length.y = وحدة (-0.2 ، "سم") ، axis.ticks.y = element_line (اللون = "أسود" ، الحجم = 1 ، lineend = 1)) - استخدم التعليمات البرمجية التالية لإجراء تحليل وتصور متعدد المتغيرات. يأتي data1.csv من نتائج الكود السابق. بعد تشغيل الكود ، انقر فوق تصدير ، ثم انقر فوق حفظ كملف PDF ، وأخيرا انقر فوق حفظ لحفظ الصورة.
المكتبة (TidyCMPRSK)
المكتبة (GTملخص)
AA <-read.csv('data1.csv')
ل (i في الأسماء (aa) [c (1:16 ، 19)]) {aa [، i] <- as.factor (aa [، i])}
mul1الجدول 2 <- mul1 ٪>٪
gtsummary::tbl_regression(الأس = TRUE) ٪>٪
add_n(الموقع = "المستوى")؛ الجدول 2
table_df <- as_tibble (الجدول 2)
علامة التبويب <- الجدول2$table_body
علامة التبويب 1 <- علامة التبويب [، ج (12،19،20،22: 29)] - استخدم الكود التالي لرسم الرسم التخطيطي ومنحنى ROC ومنحنى المعايرة. بعد تدريب النموذج باستخدام بيانات من مجموعة التدريب، استخدم بيانات مجموعات التحقق من الصحة والتحقق الخارجية للتحقق من صحة model.library(QHScrnomo). تتكون بيانات الأترابية الخارجية من عينات من سرطان القولون والمستقيم بخلاف سرطان الخلايا الحلقية ، والتي تم اختيارها في الخطوة 1.4.
المكتبة (RMS)
المكتبة (timeROC)
المكتبة (البقاء على قيد الحياة)
AA <-read.csv('data3.csv')
ل (i في الأسماء (aa) [c (1:16 ، 19)]) {aa [، i] <- as.factor (aa [، i])}
DD <- datadist (AA)
الخيارات (datadist = "dd")
mul <- cph (Surv (الوقت ، الحالة 1 == 1) ~ T + N + M + LODDS + الموقع ، البيانات = aa ، x = TRUE ، y = TRUE ، surv = TRUE)
M3 <- crr.fit (mul ، Failcode = 1 ، cencode = 0)
nomo <-Newlabels(fit = m3 ، labels = c (T = "T" ، N = "N" ، M = "M" ، LODDS = "LODDS" ، Site = "Site"))
nomoc("N0","N1","N2"),M=c("M0","M1"),LODDS=c
("LODDS1","LODDS2","LODDS3"),Site=
ج ("RSC" ، "LSC" ، "المستقيم")
nomogram.crr (fit = nomo ، lp = F ، xfrac = 0.3 ، fun.at = seq (من = 0 ، إلى = 1 ، بواسطة = 0.1) ، وقت الفشل = c (12،36،60) ، funlabel = c ("الحدوث التراكمي لمدة 1 سنة" ، "الحدوث التراكمي ل CSS لمدة 3 سنوات" ، "الحدوث التراكمي ل CSS لمدة 5 سنوات"))
time_points <- ج (12 ، 36 ، 60)
pred_risks_list <- lapply(time_points, function(time_point) {predict(m3, newdata = aa, type = "risk", time = time_point)})
pred_risks_df <- data.frame(do.call(cbind، pred_risks_list))
colnames(pred_risks_df) <- لصق ("risk_at" ، time_points ، "أشهر" ، سبتمبر = "_")
roc_1year <- timeROC (T = aa $ time ، delta = ifelse (aa $ Status1 == "CSS" ، 1 ، 0) ، علامة = pred_risks_df $ risk_at_12_months ، السبب = 1 ، مرات = 12 ، iid = TRUE)
roc_3year <- timeROC (T = aa $ time ، delta = ifelse (aa $ Status1 == "CSS" ، 1 ، 0) ، علامة = pred_risks_df $ risk_at_36_months ، السبب = 1 ، مرات = 36 ، iid = TRUE)
roc_5year <- timeROC (T = aa $ time ، delta = ifelse (aa $ Status1 == "CSS" ، 1 ، 0) ، علامة = pred_risks_df $ risk_at_60_months ، السبب = 1 ، مرات = 60 ، iid = TRUE)
legend ("bottomright" ، legend = c ("1 سنة CSS" ، "3 سنوات CSS" ، "5 سنوات CSS") ، col = c ("#BF1D2D" ، "# 262626" ، "#397FC7") ، lwd = 2)
sas.cmprsk (م 3 ، الوقت = 36)
مجموعة.بذرة(123)
AA $ Pro <- Tenf.CRR (م 3 ، الوقت = 36)
cindex (prob = aa $ pro ، fstatus = aa $ Status1 ، ftime = aa $ time ، النوع = "crr" ، رمز الفشل = 1 ، cencode = 0 ، tol = 1e-20)
groupci (x = aa $ pro ، ftime = aa $ time ، fstatus = aa $ Status1 ، Failcode = 1 ، cencode = 0 ، ci = TRUE ، g = 5 ، m = 1000 ، u = 36 ، xlab = "الاحتمال المتوقع" ، ylab = "الاحتمال الفعلي" ، lty = 1 ، lwd = 2 ، col = "# 262626" ، xlim = c (0،1.0) ، ylim = c (0،1.0) ، أضف = TRUE)
النتائج
خصائص المرضى
ركزت هذه الدراسة على المرضى الذين تم تشخيص إصابتهم بسرطان القولون والمستقيم SRCC ، باستخدام بيانات من قاعدة بيانات SEER الممتدة من 2004 إلى 2015. وشملت معايير الاستبعاد المرضى الذين تقل مدة بقائهم على قيد الحياة عن شهر واحد، وأولئك الذين لديهم معلومات سريرية مرضية غير مكتملة، والحالات التي كان فيها سبب الوفاة غير واضح أو غير محدد. تم تقسيم ما مجموعه 2409 من مرضى SRCC القولون والمستقيم الذين استوفوا معايير التضمين بشكل عشوائي إلى مجموعة تدريب (N = 1686) ومجموعة التحقق من الصحة (N = 723). تم تحليل المعلمات الديموغرافية والسريرية لأفواج التدريب والتحقق باستخدام برنامج R ، كما هو موضح في الجدول 1. من بين جميع المرضى المشمولين ، كان الغالبية فوق سن 60 عاما ، مع عدد مماثل من المرضى من الذكور والإناث. كان معظم المرضى من البيض. أكثر من نصف المرضى (56٪) كانوا متزوجين. تم تصنيف غالبية الأورام على أنها III-IV (76٪). كان معظم المرضى (82٪) لديهم أحجام أورام أكبر من 3.5 سم ، وينتمي غالبية المرضى إلى مجموعة LODDS1 (42٪). في المجموعة بأكملها ، تلقت نسبة عالية من المرضى (53٪) العلاج الكيميائي. كانت الأورام الأولية موجودة بشكل رئيسي في القولون الأيمن (67٪). بعد التوزيع العشوائي ، لم تكن هناك فروق يعتد بها في خصائص خط الأساس بين المجموعتين إحصائيا.
تحديد العوامل السريرية التنبؤية المدرجة في نماذج التعلم الآلي
قمنا أولا بفحص المتغيرات المهمة لإدراجها في نموذج التعلم الآلي باستخدام تحليل انحدار كوكس. أظهرت نتائج انحدار كوكس أحادي المتغير أن وقت البقاء على قيد الحياة كان مرتبطا بشكل كبير ببعض المتغيرات السريرية ، بما في ذلك الجنس ، والعمر ، والعرق ، والحالة الاجتماعية ، وتدريج AJCC ، والتدريج pT ، والتدريج pN ، والتدريج pM ، وحجم الورم ، ومستوى CEA ، وتصنيف LNR ، وتصنيف LODDS ، وما إذا كان المريض قد تلقى العلاج الإشعاعي أو العلاج الكيميائي (الجدول 2). والجدير بالذكر أن التدريج LNR و LODDS و pN أظهرت جميعها نسب خطر ذات دلالة إحصائية (HR) ، مما يشير إلى أن أنظمة التدريج الثلاثة LN مرتبطة بالتشخيص. تم إجراء تحليل انحدار كوكس متعدد المتغيرات اللاحق لتحديد العلاقة بين التدريج pN و LODDS و LNR و CSS في مرضى SRCC. أشارت النتائج إلى أن حالة LODDS و LNR و pN أثرت بشكل كبير على CSS لمرضى SRCC (الشكل 2).
مقارنة بين أنظمة LN
كانت القدرات التنبؤية لأنظمة LN الثلاثة متشابهة في كل من مجموعات التدريب والتحقق من الصحة والتحقق الخارجي (عينات من سرطان القولون والمستقيم بخلاف سرطان الخلايا الحلقية ، والتي تم اختيارها في الخطوة 1.4. الجدول 3). في مجموعة التدريب ، كانت مؤشرات C ل LNR و LODDS و pN 0.309 و 0.308 و 0.337 على التوالي ، بينما في مجموعة التحقق ، كانت مؤشرات C 0.288 و 0.279 و 0.319 على التوالي. في مجموعة التحقق الخارجية ، كانت مؤشرات C ل LNR و LODDS و pN 0.419 و 0.420 و 0.424 على التوالي. بالإضافة إلى ذلك ، كانت قيم AIC لكل نظام في مجموعة التدريب 12667.56 و 12670.57 و 12731.89 ، وفي مجموعة التحقق ، كانت 4575.36 و 4559.13 و 4613.20 على التوالي. في مجموعة التحقق الخارجية ، كانت قيم AIC لكل نظام كما يلي: 106554.68 ل LODDS ، و 106581.85 ل LNR ، و 106915.45 ل pN. وتشير هذه النتائج إلى وجود اختلافات طفيفة في النوعية التمييزية بين النظم الثلاثة. لذلك ، استخدمنا طرق التعلم الآلي - RF و XGBoost و NN - لتحديد نظام LN الأمثل من حيث القدرة التنبؤية. تضمن هذا التحليل متغيرات كانت مهمة في انحدار كوكس أحادي المتغير ونموذج واحد على الأقل متعدد المتغيرات (pN أو LODDS أو LNR) لبناء نماذج التعلم الآلي ، بما في ذلك pN و pT و pM والعمر والعرق وتصنيف LNR وتصنيف LODDS وما إذا كان المريض قد تلقى العلاج الإشعاعي أو العلاج الكيميائي.
قمنا ببناء نماذج RF و XGBoost و NN باستخدام مجموعة بيانات التدريب. يتم عرض قيم الأهمية لكل متغير في الشكل 3. في RF و XGBoost ، أظهر LNR أهمية قصوى ، بينما أظهر LODDS أيضا أهمية كبيرة. ومع ذلك ، في نموذج NN ، أظهر LODDS قدرة تنبؤية أفضل مقارنة ب pN و LNR. بالنظر إلى النتائج المجمعة من مناهج التعلم الآلي الثلاثة ، نستنتج أن نظام LODDS قد يكون أفضل نظام لتقييم حالة LN في مرضى SRCC.
أداء نماذج ML
كما هو موضح في الجدول 4 والشكل 4A-C ، كانت جميع النماذج الثلاثة قادرة على التنبؤ بالتشخيص بشكل فعال ، وتراوحت AUCs للنماذج الثلاثة من 0.777 إلى 0.851 في مجموعة بيانات الاختبار (XGBoost: AUC = 0.820 ، 95٪ CI = 0.789-0.851 ؛ الترددات اللاسلكية: AUC = 0.819 ، 95٪ CI = 0.788-0.850 ؛ NN: AUC = 0.809 ، 95٪ CI = 0.777-0.841). أظهرت نماذج XGBoost و RF و NN خصوصية كبيرة (0.82 ، 0.825 ، 0.815) ، ودقة (0.762 ، 0.763 ، 0.757). تظهر منحنيات المعايرة في الشكل 5D-F.
بناء نموذج المخاطر التنافسية والتحقق من صحته.
بالنظر إلى أن نماذج التعلم الآلي لم تأخذ في الحسبان تأثير عوامل الخطر المتنافسة ، فقد أنشأنا نموذجا منافسا للمخاطر لتحديد نظام LN الذي كان أفضل أداء من حيث القدرة التنبؤية. يمثل البقاء على قيد الحياة النوعي للسرطان (CSS) الوفاة بسبب السرطان ، بينما يمثل البقاء على قيد الحياة الكلي (OSS) الوفيات الناجمة عن أسباب أخرى ، ويعمل كأحداث مخاطر متنافسة. استخدمنا نماذج مخاطر متنافسة أحادية المتغير ومتعددة المتغيرات لتحليل العوامل التنبؤية ل CSS في مجموعة التدريب. أشار نموذج المخاطر المتنافسة أحادي المتغير إلى أن العوامل التنبؤية ل CSS تضمنت الجنس ، والعمر ، والعرق ، والحالة الاجتماعية ، وتدريج AJCC ، وتحديد مراحل TNM ، وحجم الورم ، وتصنيف LNR ، وتصنيف LODDS ، ومستوى CEA ، وما إذا كان المريض قد تلقى العلاج الإشعاعي أو العلاج الكيميائي ، وموقع الورم الأساسي. أخيرا ، تم تحديد تحليل المخاطر المتنافسة متعددة المتغيرات ، والتدريج T ، والتدريج N ، والتدريج M ، وتصنيف LODDS ، وموقع الورم الأولي كخمس علامات تنبؤية مستقلة لمرضى SRCC القولون والمستقيم. تظهر نتائج تحليلات المخاطر المتنافسة أحادية المتغير ومتعددة المتغيرات في الجدول 5 ، ويتم عرض منحنيات دالة الوقوع التراكمي المقابلة (CIF) لعوامل الخطر المستقلة في الشكل 5. بناء على المتغيرات الخمسة المهمة (التدريج T ، التدريج N ، التدريج M ، تصنيف LODDS ، وموقع الورم الأساسي) ، قمنا بتطوير مخطط تنبؤي (الشكل 6 أ). وجدنا أنه بالمقارنة مع pN ، أظهر LODDS وزنا أعلى. تتوافق هذه النتيجة مع النتائج السابقة ، مما يشير إلى أن نظام LODDS هو أفضل نظام لتقييم حالة LN في مرضى SRCC.
لتقييم دقة النموذج ، قمنا ببناء منحنيات المعايرة (الأشكال 6B-D). أشارت النتائج إلى أن النموذج كان جيدا في التنبؤ بإجمالي البقاء على قيد الحياة للمرضى في 1 و 3 و 5 سنوات. يظهر ملاءمة المنحنيات على خط 45 درجة تناسقا قويا للنموذج. أظهرت نتائج تقييم منحنى ROC للرسم البياني (الأشكال 5E-G) أن المنطقة الواقعة تحت المنحنى (AUC) للتنبؤات في 1 و 3 و 5 سنوات كانت أكبر من 0.75. تشير هذه النتائج إلى أن منحنيات التنبؤ لمدة 3 و 5 سنوات أظهرت فوائد كبيرة ، مما يشير إلى أن الرسم البياني له تطبيقات سريرية قيمة وقيمة مرجعية.

الشكل 1: مخطط التدفق الذي يعرض عملية الفرز في قاعدة بيانات SEER. من خلال معايير التضمين والاستبعاد الخاصة بنا ، اخترنا بنجاح مرضى سرطان القولون والمستقيم من قاعدة بيانات SEER لسلسلة لاحقة من التحليلات بناء على R. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: ارتباط LNR و LODDS و pN التدريج مع CSS في مجموعة التدريب. يوضح هذا الشكل نتائج تحليل انحدار كوكس متعددة المتغيرات ل (أ) LNR ، (ب) LODDS ، و (ج) التدريج pN ، والتي تم تقييمها جنبا إلى جنب مع عوامل تنبؤية مستقلة أخرى. يتضمن التحليل نسب المخاطر (HR) وفواصل الثقة 95٪ (CI). توضح النتائج أن LNR و LODDS و pN هي عوامل تنبؤية مهمة للبقاء على قيد الحياة الخاص بالسرطان لدى المرضى الذين يعانون من SRCC ، مع إظهار جميع قيم الموارد البشرية دلالة إحصائية (ص < 0.05). * ص < 0.05 ، ** ص < 0.01 ، *** ص < 0.001. تمثل أشرطة الخطأ 95٪ CI. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: الأهمية النسبية للمتغيرات. (أ) نموذج XGBoost ، (ب) نموذج RF ، و (ج) نموذج NN. يقيم هذا الشكل الأهمية النسبية للمتغيرات. في طرازي XGBoost و RF ، أظهر LNR أهمية قصوى ، حيث أظهر LODDS أيضا أهمية كبيرة. على العكس من ذلك ، في نموذج NN ، أظهر LODDS قدرة تنبؤية فائقة مقارنة ب pN و LNR. بناء على النتائج المجمعة للنماذج الثلاثة ، يقترح أن يكون نظام LODDS هو الأكثر فعالية لتقييم حالة LN في مرضى SRCC. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: منحنيات ROC ومنحنيات المعايرة لنماذج ML و XGBoost و eXtreme تدرج التدرج. (أ ، د) مجموعة التدريب ، (ب ، ه) مجموعة التحقق من الصحة ، و (ج ، و) مجموعة التحقق من الصحة الخارجية. تشير قيمة المنطقة الواقعة أسفل المنحنى (AUC) الأقرب إلى 1 إلى أداء تصنيف أفضل للنموذج. تمثل أشرطة الخطأ فاصل الثقة بنسبة 95٪ للاحتمال المتوقع لحدوث الحدث الفعلي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
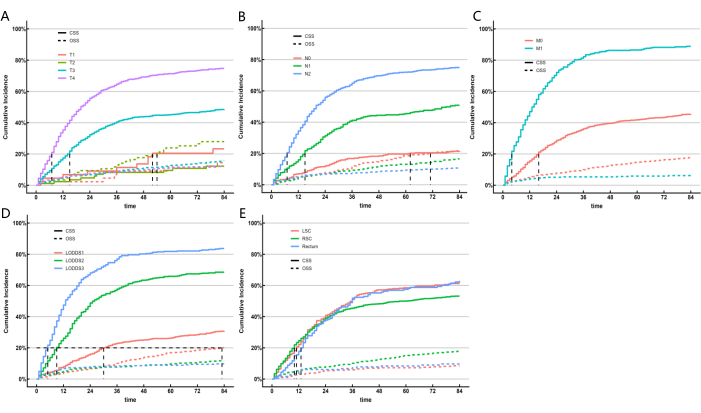
الشكل 5: تقديرات الوقوع التراكمي للوفاة وفقا لخصائص المريض على سرطان القولون والمستقيم. CIF للمجموعات الفرعية. تم تطبيق اختبار جراي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
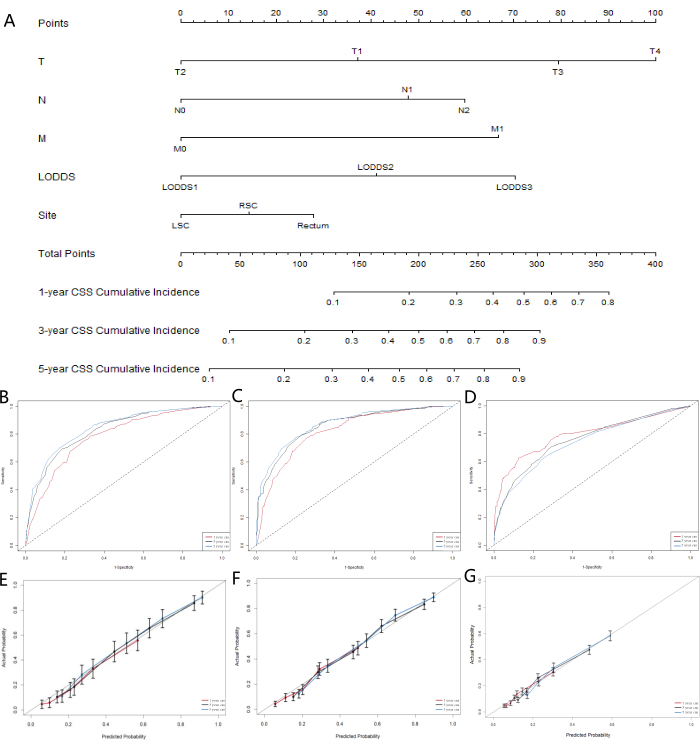
الشكل 6: تطوير الرسم البياني والتحقق من صحة CSS في مرضى SRCC للقولون والمستقيم. (أ) مخطط خطير تنافسي يتنبأ باحتمال البقاء على قيد الحياة لمدة عام و 3 سنوات و 5 سنوات للمرضى الذين يعانون من سرطان القولون والمستقيم. منحنيات معايرة المخططات للتنبؤ بالبقاء على قيد الحياة الخاص بالسرطان لمدة 1 و 3 و 5 سنوات في (ب) مجموعة التدريب ، (ج) مجموعة التحقق من الصحة ، و (د) مجموعة التحقق من الصحة الخارجية. منحنيات خصائص تشغيل المتلقي للتنبؤ بالبقاء على قيد الحياة الخاص بالسرطان لمدة 1 و 3 و 5 سنوات في مجموعة التدريب (E) ، (F) مجموعة التحقق من الصحة ، و (G) مجموعة التحقق من الصحة الخارجية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: الخصائص السريرية للمرضى الذين يعانون من سرطان القولون والمستقيم. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 2: تحليل انحدار كوكس أحادي المتغير ل CSS في مجموعة التدريب. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 3: أداء التنبؤ بأنظمة التدريج العقدية الليمفاوية الثلاثة. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 4: الأداء التنبؤي للنماذج في أترابية التحقق ومجموعات التحقق الخارجية. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 5: تحليل المخاطر المتنافسة أحادية المتغير ومتعددة المتغيرات للوفيات الخاصة بالسرطان من SRCC القولون والمستقيم في مجموعة التدريب. الرجاء النقر هنا لتنزيل هذا الجدول.
Discussion
سرطان القولون والمستقيم (CRC) SRCC هو نوع فرعي نادر وخاص من سرطان القولون والمستقيم مع تشخيص ضعيف. لذلك ، يجب إيلاء اهتمام أكبر لتشخيص مرضى SRCC. يعد التنبؤ الدقيق بالبقاء على قيد الحياة لمرضى SRCC أمرا بالغ الأهمية لتحديد توقعات سير المرض واتخاذ قرارات العلاج الفردية. في هذه الدراسة ، استكشفنا العلاقة بين السمات السريرية والتشخيص لدى مرضى SRCC وحددنا نظام التدريج الأمثل LN لمرضى SRCC من قاعدة بيانات SEER. على حد علمنا ، هذه هي الدراسة الأولى لتحديد نظام LN المناسب لمرضى SRCC القولون والمستقيم من خلال الاستخدام الشامل للتعلم الآلي وطرق تحليل المخاطر المتنافسة وإنشاء مخطط للتنبؤ بالتشخيص.
يعد عدد LNs النقيلي في مرضى CRC مؤشرا مهما على التشخيص والتكرار. يلعب التدريج الدقيق لل إن دورا رئيسيا في تحديد استراتيجيات العلاج والتشخيص لمرضى SRCC. LNR و LODDS هي طرق بديلة تستخدم لتقييم مشاركة LN في GC ، وتحسين أنظمة التدريج ، وتوفير معلومات تنبؤية أكثر دقة10،13. كشفنا عن العلاقة بين التدريج LODDS و LNR و pN مع CSS في مرضى SRCC باستخدام قاعدة بيانات SEER. تمت مقارنة القدرات التنبؤية لأنظمة LN الثلاثة هذه (LNR و LODDS و pN) باستخدام مؤشرات AUCs و AICs و BICs و C. ومع ذلك ، كانت الاختلافات بينهما ضئيلة. لذلك ، استخدمنا ثلاث طرق للتعلم الآلي - Xgboost و RF و NN - لتحديد أهم الميزات كنظام LN الأمثل. بناء على النتائج المجمعة للطرق الثلاث ، حددنا LODDS على أنه نظام LN المناسب.
ومع ذلك ، فإن OSS هو حدث خطر منافس يؤثر على تشخيص مرضى CSS. لم تأخذ عملية فحص المتغيرات لإدراجها في نموذج التعلم الآلي باستخدام طريقة انحدار كوكس في الاعتبار تأثير OSS ، مما قد يؤدي إلى تقييم غير دقيق لمعدلات الاختطار12. لذلك ، لتحديد نظام تقييم LN الأمثل لمرضى SRCC ، قمنا ببناء نموذج مخاطر منافس. أكدت النتائج مرة أخرى أن نظام التدريج LODDS يوفر معلومات تنبؤية أكثر دقة مقارنة بنظام pN. خلال المتابعة ، من بين 2409 مرضى ، توفي 1339 (56٪) بسبب CSS ، وتوفي 464 (19٪) بسبب OSS. علاوة على ذلك ، قمنا أيضا بتطوير مخطط مخاطر منافس للتنبؤ بمعدلات الوفيات الخاصة بالسرطان في عام واحد و 3 سنوات و 5 سنوات. نعتقد أن هذا النموذج له آثار كبيرة على الأبحاث السريرية التي تشمل مرضى سرطان القولون والمستقيم. على الرغم من أن اللجنة الأمريكية المشتركة للسرطان توصي بنظام TNM كنظام التدريج لجميع الأنواع النسيجية لسرطان القولون والمستقيم ، إلا أنه يستخدم بشكل أساسي لتنظيم سرطان القولون والمستقيم الغدي. مرحلة AJCC N محدودة ب TLN ، بينما لا تأخذ LNR في الاعتبار تأثير NLN13،14،15،16. تشير التقارير إلى أن LODDS أقل تأثرا ب TLN وتأخذ في الاعتبار رقم NLN10,17. Scarinci et al. أظهر أن LODDS يتنبأ بنظام التشغيل في مرضى CRC بشكل أفضل من LNR و pN التدريج واقترح أن الأبحاث المستقبلية يجب أن تتحقق من دورها في الأنواع الفرعية المختلفة من CRC18. في هذه الدراسة ، وجدنا أن LODDS له تأثير تنبؤي كبير على CSS في SRCC للقولون والمستقيم. لذلك ، قد يكون LODDS أداة قيمة لتقييم تشريح العقدة الليمفاوية والتشخيص في مرضى SRCC القولون والمستقيم. على الرغم من عدم وجود عتبة مثالية ل LODDS حتى الآن ، فقد ثبت أنها نظام التدريج LN الأكثر موثوقية. مع الاهتمام المتزايد ب LODDS ، يعتقد عموما أنه سيكتسب اعترافا واسعا في الإعدادات السريرية في المستقبل المنظور.
وجدت دراستنا أن موقع الورم الأساسي هو عامل تنبؤي مهم ل CSS ، مع تشخيص أسوأ بكثير ل SRCC المستقيمي ، وهو ما يتوافق مع الدراسات السابقة12،19،20. قد يكون ل SRCC الشرجي خصائص سريرية ومرضية وجزيئية فريدةمن نوعها 21،22 ، مما يستدعي مزيدا من التحقيق. تعد المخططات المستمدة من النماذج التنبؤية أدوات رئيسية وفعالة لاتخاذ القرارات السريرية واستشارة المرضى. على حد علمنا ، هذه الدراسة هي الأولى التي تدمج نماذج التعلم الآلي ونماذج المخاطر المتنافسة لاستكشاف نظام التدريج الأمثل للشبكة المحلية المنخفضة لمرضى SRCC. قمنا بتطوير والتحقق من صحة ثلاثة نماذج ML للتنبؤ بتشخيص مرضى SRCC. في مجموعة بيانات الاختبار ، أظهرت نماذج XGBoost و RF و NN أداء تنبؤيا تنبؤيا جيدا بناء على قيم AUC والمقاييس المقابلة. وبالتالي ، يمكن أن تساعد نماذج ML في قرارات العلاج لمرضى SRCC من خلال التنبؤ بالتشخيص. بالإضافة إلى ذلك ، قمنا بإنشاء مخططات مخاطر متنافسة بناء على نماذج المخاطر النسبية لتحليل العوامل التنبؤية ل SRCC القولون والمستقيم وتقييم دور LODDS داخلها. استخدمنا مؤشر C ومنحنيات المعايرة لتقييم الأداء التنبؤي للرسم التخطيطي. أظهر الرسم البياني المتغيرات السريرية الشائعة ، مثل الموقع الأساسي للورم ومجموعة LODDS. علاوة على ذلك ، فإن الرسم البياني الذي أنشأناه هو طريقة فعالة للتنبؤ ب CSS لمدة عام و 3 سنوات و 5 سنوات في مرضى SRCC للقولون والمستقيم. يمكن أن تساعد هذه الأداة الأطباء في إجراء تقييمات تنبؤية دقيقة وشاملة وفي الوقت المناسب لكل مريض بالقولون والمستقيم SRCC ، مما يمكنهم من صياغة خطط علاج مخصصة23.
أخيرا ، هذه الدراسة لها العديد من القيود. أولا ، تم تشخيص المرضى في الدراسة بين عامي 2004 و 2015 ، مما أدى إلى فترة متابعة قصيرة نسبيا. نتوقع أن تساعد فترة متابعة أطول في تحسين دقة تنبؤات النموذج. ثانيا ، تصميم الدراسة المستخدم هنا بأثر رجعي ويعتمد على البيانات التي تم الحصول عليها من قاعدة بيانات SEER ، والتي قد تقدم بعض التحيزات المتأصلة. لم يتم تسجيل بعض المعلومات ، مثل موقع LNs النقيلية. أخيرا ، كان غالبية المرضى في هذه الدراسة من البيض ، مما استلزم دراسات أوسع تشمل مجموعات سكانية متنوعة لتأكيد هذه النتائج وتعزيزها.
استنتاج
وجدت الدراسة أن LODDS تظهر قدرة تنبؤية قوية للقولون والمستقيم SRCC. بناء على هذا الأساس ، قمنا بتطوير رسم تخطيطي للبيانات بناء على نموذج مخاطر منافس للتنبؤ بمعدلات البقاء على قيد الحياة الإجمالية في فترات 1 و 3 سنوات و 5 سنوات لمرضى SRCC القولون والمستقيم. بعد سلسلة من التقييمات والتحقق الداخلي ، أظهر الرسم البياني قابلية تطبيق وقيمة سريرية كبيرة ، مما يوفر إرشادات للأطباء في اتخاذ قرارات العلاج. بالإضافة إلى ذلك ، قمنا ببناء ثلاثة نماذج ML. تتمتع مناهج التعلم الآلي هذه بالقدرة على تعزيز القدرات التنبؤية للتشخيص ل SRCC ومساعدة الأطباء في فهم كيفية استخدام التعلم الآلي لتحسين استراتيجيات العلاج والمتابعة.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح المالية للإفصاح عنهم.
Acknowledgements
اي
Materials
| Name | Company | Catalog Number | Comments |
| SEER database | National Cancer institiute at NIH | ||
| X-tile software | Yale school of medicine | ||
| R-studio | Posit |
References
- Siegel, R. L., Giaquinto, A. N., Jemal, A. Cancer statistics, 2024. CA Cancer J Clin. 74 (1), 12-49 (2024).
- Korphaisarn, K., et al. Signet ring cell colorectal cancer: Genomic insights into a rare subpopulation of colorectal adenocarcinoma. Br J Cancer. 121 (6), 505-510 (2019).
- Willauer, A. N., et al. Clinical and molecular characterization of early-onset colorectal cancer. Cancer. 125 (12), 2002-2010 (2019).
- Watanabe, A., et al. A case of primary colonic signet ring cell carcinoma in a young man which preoperatively mimicked Phlebosclerotic colitis. Acta Med Okayama. 73 (4), 361-365 (2019).
- Kim, H., Kim, B. H., Lee, D., Shin, E. Genomic alterations in signet ring and mucinous patterned colorectal carcinoma. Pathol Res Pract. 215 (10), 152566(2019).
- Deng, X., et al. Neoadjuvant radiotherapy versus surgery alone for stage II/III mid-low rectal cancer with or without high-risk factors: A prospective multicenter stratified randomized trial. Ann Surg. 272 (6), 1060-1069 (2020).
- Buk Cardoso, L., et al. Machine learning for predicting survival of colorectal cancer patients. Sci Rep. 13 (1), 8874(2023).
- Monterrubio-Gómez, K., Constantine-Cooke, N., Vallejos, C. A. A review on statistical and machine learning competing risks methods. Biom J. 66 (2), e2300060(2024).
- Kim, H. J., Choi, G. S. Clinical implications of lymph node metastasis in colorectal cancer: Current status and future perspectives. Ann Coloproctol. 35 (3), 109-117 (2019).
- Xu, T., et al. Log odds of positive lymph nodes is an excellent prognostic factor for patients with rectal cancer after neoadjuvant chemoradiotherapy. Ann Transl Med. 9 (8), 637(2021).
- Chen, Y. R., et al. Prognostic performance of different lymph node classification systems in young gastric cancer. J Gastrointest Oncol. 12 (4), 285-1300 (2021).
- Bouvier, A. M., et al. How many nodes must be examined to accurately stage gastric carcinomas? Results from a population based study. Cancer. 94 (11), 2862-2866 (2002).
- Coburn, N. G., Swallow, C. J., Kiss, A., Law, C. Significant regional variation in adequacy of lymph node assessment and survival in gastric cancer. Cancer. 107 (9), 2143-2151 (2006).
- Li Destri, G., Di Carlo, I., Scilletta, R., Scilletta, B., Puleo, S. Colorectal cancer and lymph nodes: the obsession with the number 12. World J Gastroenterol. 20 (8), 1951-1960 (2014).
- Dinaux, A. M., et al. Outcomes of persistent lymph node involvement after neoadjuvant therapy for stage III rectal cancer. Surgery. 163 (4), 784-788 (2018).
- Sun, Y., Zhang, Y., Huang, Z., Chi, P. Prognostic implication of negative lymph node count in ypN+ rectal cancer after neoadjuvant chemoradiotherapy and construction of a prediction nomogram. J Gastrointest Surg. 23 (5), 1006-1014 (2019).
- Xu, Z., Jing, J., Ma, G. Development and validation of prognostic nomogram based on log odds of positive lymph nodes for patients with gastric signet ring cell carcinoma. Chin J Cancer Res. 32 (6), 778-793 (2020).
- Scarinci, A., et al. The impact of log odds of positive lymph nodes (LODDS) in colon and rectal cancer patient stratification: a single-center analysis of 323 patients. Updates Surg. 70 (1), 23-31 (2018).
- Nitsche, U., et al. Prognosis of mucinous and signet-ring cell colorectal cancer in a population-based cohort. J Cancer Res Clin Oncol. 142 (11), 2357-2366 (2016).
- Kang, H., O'Connell, J. B., Maggard, M. A., Sack, J., Ko, C. Y. A 10-year outcomes evaluation of mucinous and signet-ring cell carcinoma of the colon and rectum. Dis Colon Rectum. 48 (6), 1161-1168 (2005).
- Sung, C. O., et al. Clinical significance of signet ring cells in colorectal mucinous adenocarcinoma. Mod Pathol. 21 (12), 1533-1541 (2008).
- Alvi, M. A., et al. Molecular profiling of signet ring cell colorectal cancer provides a strong rationale for genomic targeted and immune checkpoint inhibitor therapies. Br J Cancer. 117 (2), 203-209 (2017).
- Brownlee, S., et al. Evidence for overuse of medical services around the world. Lancet. 390 (10090), 156-168 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved