Method Article
منصة التصوير البصري متعدد الوسائط لدراسة التمثيل الغذائي الخلوي
* These authors contributed equally
In This Article
Summary
باستخدام منصة متعددة الوسائط تجمع بين طرائق التصوير البصري الخالية من الملصقات ، قمنا بتطوير بروتوكول لتصور وقياس الديناميكيات الخلوية والتمثيل الغذائي. من خلال التصوير عبر التألق متعدد الفوتون ، والجيل التوافقي الثاني ، والفحص المجهري المشتت رامان المحفز ، يمكننا إنشاء نظرة عامة شاملة على البيئة الخلوية والجزيئية.
Abstract
تعتبر تقنيات التصوير البصري ضرورية في الدراسات الطبية الحيوية لقدرتها على الحصول على المعلومات المورفولوجية والوظيفية من العينات البيولوجية بدقة مكانية عالية. تستغل هذه العمليات البصرية تفاعلات جزيئات الضوء المختلفة ، مثل التشتت والامتصاص والانبعاث والتوليد التوافقي ، بين الفوتونات والجزيئات داخل الخلايا أو الأنسجة أو الأعضاء. في حين أن التصوير الطبي الحيوي التقليدي قد ركز تاريخيا على تطبيق طريقة واحدة ، فقد أظهرت الأبحاث الحديثة أن هذه التقنيات المتنوعة توفر رؤى تكميلية ، وتوفر مخرجاتها مجتمعة فهما أكثر شمولا للتغيرات الجزيئية في عمليات الشيخوخة وتطور المرض والأساسيات في بيولوجيا الخلية.
في العقود الماضية ، تقدمت طرق التصوير البصري الخالية من الملصقات ، مما مكن من الاستكشاف التفصيلي للبيئات الخلوية وتحت الخلوية. على سبيل المثال ، لا يسهل التألق متعدد الفوتون (MPF) تصوير البروتين المستهدف فحسب ، بل يحدد أيضا النشاط الأيضي من خلال الإنزيمات المساعدة الفلورية الذاتية ، مما يحقق عمق اختراق عال ودقة مكانية. يستخدم الجيل التوافقي الثاني (SHG) لتصوير هياكل مثل الكولاجين في المصفوفة خارج الخلية ، بينما يرسم تشتت رامان المحفز (SRS) الروابط الكيميائية والتركيب الجزيئي في الموقع بدقة تحت الخلية.
لقد قمنا بتطوير منصة تصوير متعددة الوسائط تجمع بين طرائق MPF و SHG و SRS. يتيح دمج هذه الطرائق في منصة واحدة الحصول على معلومات متعددة الأوجه من نفس التوطين داخل الخلايا أو الأنسجة أو الأعضاء أو حتى الأجسام ، مما يسهل استكشافا أكثر تفصيلا للعلاقات المعقدة بين التمثيل الغذائي الخلوي وبنية المصفوفة خارج الخلية والتركيب الجزيئي. يوفر هذا النظام متعدد الوسائط دقة تحت الخلايا ، واختراق الأنسجة العميقة ، وتصوير الخلايا الحية / الأنسجة في الموقع ، بالإضافة إلى الكشف الخالي من الملصقات والتسجيل المشترك الفوري دون الحاجة إلى تعديلات الموضع أو تبديل الجهاز أو محاذاة ما بعد التحليل. هنا ، نقدم بروتوكولا للتصوير الخالي من الملصقات باستخدام هذه المنصة متعددة الوسائط ونوضح تطبيقه في توصيف التمثيل الغذائي الخلوي ، وعدم التجانس الجزيئي في الخلايا والأنسجة لدراسة الشيخوخة والأمراض.
Introduction
كان التصوير الطبي الحيوي البصري محوريا في تعزيز فهمنا للبنية البيولوجية والوظيفة. يتم إنشاء الصور عن طريق تعديل ضوء الإثارة واكتشاف الإشارات من تفاعلات الأنسجة الضوئية. استخدم المجهر المركب الأول ، الذي طوره هانز وزكريا يانسن حوالي عام 1590 ، عدستين محدبتين في أنبوب ، مما يوفر تكبيرا يصل إلى 30 ×1. يمكن للمجاهر البصرية الحديثة ، بعد قرون من التقدم ، أن تحقق الآن دقة تصل إلى 1-3 نانومتر2،3. بالإضافة إلى تقديم دقة عالية ، توفر أنظمة التصوير المتقدمة الآن اختراقا أعمق للأنسجة ، وكفاءة أكبر ، وأقل ضررا للعينة ، مما يجعلها مناسبة بشكل خاص لتصوير الخلايا الحية والأنسجة. يعد التصوير الخالي من الملصقات مفيدا بشكل خاص لأنه يلتقط المعلومات دون تعطيل العمليات داخل الخلايا أو المساس بسلامة العينة.
تم استخدام الفحص المجهري الفلوري متعدد الفوتون (MPF) ، وخاصة الفحص المجهري الفلوري ثنائي الفوتون ، على نطاق واسع للتصوير الخالي من الملصقات. على عكس الفحص المجهري الفلوري التقليدي ، الذي يعتمد على امتصاص وانبعاث الفوتون الأحادي الخطي ، فإن إثارة MPF تتضمن امتصاصا متزامنا لفوتونات متعددة ، والتي تثير طاقتها المجمعة جزيء فلوروفور واحد4،5. تمتلك هذه الفوتونات ، عادة في طيف الأشعة تحت الحمراء ، نصف أو أقل من الطاقة المطلوبة لإثارة الفوتون الفردي. تؤدي الأطوال الموجية الأطول والإثارة الموضعية في النقطة المحورية في هذه العملية غير الخطية إلى تشتت أقل ، واختراق أعمق للأنسجة ، وتقليل السمية الضوئية.
يمكن التقاط معلومات التمثيل الغذائي الخلوي عن طريق الفحص المجهري MPF الخالي من الملصقات من خلال الكشف عن إشارات التألق الذاتي من ركائز التمثيل الغذائي الذاتية ، مثل انخفاض نيكوتيناميد الأدينين ثنائي النوكليوتيد (NADH) وفلافين الأدينين ثنائي النوكليوتيد (FAD). تظهر هذه الإنزيمات المساعدة أطياف إثارة وانبعاث مميزة ، وتعكس نسبة شدة التألق ، والمعروفة باسم نسبة الأكسدة والاختزال (NADH / FAD) ، الحالة التأكسدية للخلية. منذ أن قدم Britton Chance مفهوم نسبة الأكسدة والاختزال لأول مرة في عام 1979 ، تم اقتراح نسب إضافية ، بما في ذلك NAD (P) H / FAD و NAD (P) H / (FAD + NAD (P) H) ، و FAD / (FAD + NAD (P) H)، 6،7،8،9. يوفر القياس الكمي لنسب الأكسدة والاختزال البصرية هذه عبر تصوير MPF نظرة ثاقبة لديناميكيات التمثيل الغذائي. على سبيل المثال ، يمكن لتصوير MPF التمييز بين الخلايا السرطانية والخلايا الطبيعية بناء على عملية التمثيل الغذائي المتغيرة ، مما يدل على قدرتها على تشخيص السرطان10،11،12. ومع ذلك ، فإن الكشف عن التألق الذاتي القائم على MPF له قيود. قد تساهم الفلوروفورات الجوهرية الأخرى ، مثل الكيراتين ، في شدة التألق ، مما يؤدي إلى الحديث الطيفي وتفسير الإشارة غير الدقيق13. بالإضافة إلى ذلك ، تعكس نسبة الأكسدة والاختزال فقط التغيرات الإجمالية في تقليل الأكسدة الخلوية ولا تميز بين NADH من مصادر مختلفة (على سبيل المثال ، السيتوبلازمي أو الميتوكوندريا) أو بين NADH و NAD (P) H ، حيث يظهر كلاهما قمما طيفية متشابهة عند 450 نانومتر ، مما ينتج عنه إشارات شدة ممزوجة14.
تم استخدام الجيل التوافقي الثاني (SHG) ، وهي عملية بصرية غير خطية تم عرضها لأول مرة في المجال الطبي الحيوي في الثمانينيات ، على نطاق واسع للتصوير الخالي من الملصقات للهياكل الخلوية15،16. على غرار MPF ، يتضمن SHG الامتصاص المتزامن لفوتونين من نفس الطاقة من ليزر نبضي فائق السرعة. يتم إعادة تجميع هذه الفوتونات لإصدار فوتون جديد ضعف تردد الضوء الساقط ، مما يؤدي إلى اكتشاف الإشارة التوافقية الثانية. يحدث هذا التفاعل البصري غير الخطي حصريا في المواد غير المتماثلة المركزية التي تظهر قابلية غير صفرية من الدرجة الثانية للحث على استقطاب لتوليد الإشارة التوافقية الثانية17،18. هذا يجعل SHG فعالا بشكل خاص في تصوير البروتينات الخيطية والهياكل الليفية ، مثل الكولاجين والميوسين والتوبولين ، دون الحاجة إلى أصباغ مضان خارجية15،17،19،20. ينتشر الشذوذ في وفرة التليف والكولاجين وتصلبه ومحاذاته وهيكله في العديد من الحالات مثل الالتهاب والسرطان ، مما يجعل SHG أداة واعدة للكشف الفعال وغير الجراحي لبعض الحالات المرضية21،22،23. سلط التطبيق الواسع النطاق لتصوير SHG في أبحاث الأورام ، بما في ذلك الدراسات التي أجريت على سرطان الثدي والمبيض والجلد ، الضوء على دوره الحاسم في كل من الأبحاث الأساسية والتطبيقات السريريةالمحتملة 24،25،26،27.
تظهر الجزيئات المختلفة مستويات طاقة اهتزازية مميزة ، والتي تحفز درجات متفاوتة من التشتت غير المرن عند إثارة الضوء الساقط - وهي ظاهرة تميزت لأول مرة بواسطة C. V. Raman في عام 192828. منذ ذلك الحين ، تم استخدام تأثير رامان على نطاق واسع في المجهر البصري للكشف عن التركيبات الجزيئية والأنسجة دون وضع العلامات الخارجية. يثير كل من تشتت رامان المحفز (SRS) وتشتت رامان المتماسك المضاد للستوكس (CARS) الاهتزازات الجزيئية بشكل متماسك ويستفيد من التفاعل غير الخطي للضوء لإنتاج إشارة أقوى مقارنة بالتحليل الطيفي التقليدي لرامان. تم الإبلاغ عن ظاهرة SRS لأول مرة في عام 196229. في عام 2008 ، تم دمج هذه الآلية في التصوير ثلاثي الأبعاد متعدد الفوتون ، مما يسمح بالكشف الانتقائي عن المواد الكيميائية بناء على تغيرات الشدة في حزم المضخة وستوكس بسبب التحولات الاهتزازية الجزيئية30. تقلل هذه الطريقة من تداخل الخلفية غير الرنانة ، مما يولد إشارة شدة نظيفة تتجاوز إشارة CARS. يتفوق تصوير SRS في توفير التصوير متعدد الإرسال وفائق الأطياف ، مما يتيح الكشف المتزامن عن الروابط الكيميائية المتعددة والسماح بتصور عالي الدقة للتركيب الجزيئي في العينات ذات عمق الاختراق الكبير. على الرغم من كونه تقنية جديدة نسبيا ، فقد أثبت تصوير SRS فعاليته في كل من التشخيص السريري وأبحاث التمثيل الغذائي ، في الجسم الحي وفي المختبر30،31،32،33،34،35،36. على سبيل المثال ، يمكن ل SRS التمييز بين الأنسجة التي تتسلل إلى ورم المخ عن القشرة والمادة البيضاء عن طريق تحديد نسبة الدهون إلى البروتين ، مما يتيح تحديد هوامش الورم بطريقة خالية من الملصقات وغيرجراحية 37،38. بالإضافة إلى ذلك ، يمكن تقييم التغيرات الأيضية ، التي غالبا ما تعتبر السمات المميزة للأمراض المرتبطة بالشيخوخة والسرطان ، كميا باستخدام SRS الذي يتم تحقيقه عن طريق اكتشاف روابط الكربون الديوتيريوم في العينات المعالجة بالماء الثقيل (D2O) ، مما يسمح بالقياس الكمي لتخليق البروتين ، وتكوين الدهون ، وعمليات التمثيل الغذائي الجزيئية الكبيرة الأخرى31،33،34،35،36. تضع القدرة على تتبع المستقلبات ذات الدقة الزمنية والمكانية العالية SRS كأداة واعدة للتحقيق في المرض وتشخيصه ، مع إمكانية التطبيقات السريرية الأوسع.
ظهر التصوير متعدد الوسائط كنهج قوي في البحوث الطبية الحيوية ، حيث يدمج طريقتين أو أكثر من طرق التصوير لاكتساب فهم أكثر شمولا للأنظمة البيولوجية المعقدة داخل نفس العينة. في عام 2018 ، تم تقديم تقنية الفحص المجهري متعدد التوافقيات الخالية من الملصقات ، والتي تدمج مضان ثنائي الفوتون (2PF) ، ومضان ثلاثي الفوتون (3PF) ، و SHG ، والجيل التوافقي الثالث (THG) 39. يسهل هذا النهج التصور المتزامن للتفاعلات الخلوية والعمليات الديناميكية والمكونات الفردية داخل البيئة المكروية للورم. يوفر الفحص المجهري SLAM الحد الأدنى من الاضطراب ومتطلبات طاقة الليزر المنخفضة للعينة ، مما يتيح توصيف الأنسجة العميقة ويوفر طريقة أكثر أمانا للمراقبة داخل الحيوية40. تم تطوير طريقة أخرى متعددة الوسائط ، تجمع بين التحليل الطيفي المضان الجوهري ، والتحليل الطيفي للانعكاس المنتشر ، والتحليل الطيفي رامان ، للكشف عن السرطان في الموقع أثناء العملياتالجراحية 41. بالإضافة إلى ذلك ، أظهر نظام التنظير الداخلي غير الخطي متعدد الوسائط المصمم مؤخرا ، والذي يدمج CARS و SHG والتألق ثنائي الفوتون (TPF) ، القدرة على تصوير العينات البيولوجية بدقة مكانية دون ميكرون وشبه الخلوية42. تم استخدام الفحص المجهري المشترك 2PF و SRS بالمثل للتصوير عالي الدقة في الجسم الحي للأنسجة والخلايا والعضيات42،43،44،45. تسخر تقنيات التصوير متعددة الوسائط الناشئة نقاط القوة في الطرائق الفردية ، مما يؤدي إلى تحسين الدقة وعمق الاختراق وكفاءة الحصول على الصور ، وبالتالي إظهار إمكانات كبيرة للتطبيقات السريرية والجراحية.
يفضل هذا النهج متعدد الوسائط بشكل متزايد على التصوير أحادي الطريقة لأنه يوفر نطاقا أوسع من القياسات مع التخفيف من القيود المرتبطة بالتقنيات الفردية. كما تمت مناقشته سابقا ، يقيس MPF التألق الداخلي ليعكس التغيرات الأيضية ، ويمكن ل SHG تصوير الهياكل غير المتماثلة المركزية مثل الكولاجين في العينات البيولوجية ، ويكتشف SRS في الغالب البروتينات والدهون بسبب الكثافة العالية للروابط الكيميائية التي تولد إشارات رامان مميزة بناء على أوضاعها الاهتزازية. نظرا لخصائصها المتماسكة والمبدأ المشترك للخصائص البصرية غير الخطية ، يمكن دمج طرق التصوير هذه في إعداد مجهر واحد باستخدام ليزر نبضي فائق القصر ، مما يسمح بالحصول على العديد من المؤشرات الحيوية في المناطق المحلية لتوفير رؤية أكثر اكتمالا للعملياتالبيولوجية 44،45. تحدد هذه الورقة بروتوكولا لتنفيذ منصة تصوير متعددة الوسائط تدمج MPF و SHG و SRS لتطبيقات البحوث الطبية الحيوية.
Protocol
1. تجارب التصوير متعدد الوسائط الخالية من الملصقات
ملاحظة: يركز هذا البروتوكول على إجراء إعداد واستحواذ التصوير متعدد الوسائط الخالي من الملصقات.
- إعداد المجهر متعدد الوسائط (الشكل 1 أ) ومعايرة النظام
- قم بتسخين الليزر وانتظر حوالي 15-20 دقيقة.
- قم بتشغيل وحدات التحكم والشاشات بالتسلسل التالي: صندوق التحكم | وحدة تحكم في لوحة اللمس | محول التيار المتردد لمحول التيار المتردد عن بعد بالليزر الرئيسي لجهاز التحكم عن بعد بالليزر الفرعي.
- قم بتشغيل كاشف الثنائي الضوئي Si ومكبر للصوت.
- قم بتكوين أشعة الليزر للمضخة وشعاع ستوكس. قم بإعداد نظام الليزر بشعاع مضخة قابل للضبط من 780 نانومتر إلى 990 نانومتر ، وعرض نبضة 5-6 ps ، ومعدل تكرار 80 ميجاهرتز. شعاع ليزر ستوكس له طول موجي ثابت يبلغ 1,031 نانومتر مع نبضة 6 ps ومعدل تكرار 80 ميجاهرتز . تأكد من أن كل من المضخة وعوارض Stokes منخفضة الطاقة (20 ميجاوات على الأقل) لتكون مرئية على لوحة المحاذاة.
- ضع لوحة محاذاة واحدة في المسار البصري (مباشرة بعد صندوق الليزر) للتحقق من التداخل المكاني للمضخات وحزم Stokes وضبط المرآة حتى تتداخل كلتا النقطتين في وسط لوحة المحاذاة.
ملاحظة: على الرغم من أن المضخات وحزم ستوكس متداخلة تقريبا ، إلا أن الضبط الدقيق للتداخل المكاني لشعاعي ليزر يمكن أن يحقق إشارة SRS المثلى. - بعد التداخل المكاني ، قم بالضبط الدقيق مع PSD (كاشف حساس للموضع) بالنقر أولا على برنامج التحكم OPO . استخدم المفتاح السداسي لضبط المرآة البصرية 1 (OM1) بعناية ومشاهدة شاشة PSD لتغيير موضع XY لاستهداف الحد الأدنى من الانحراف عن المركز. بعد ذلك ، لإجراء تعديلات أكثر دقة ، استخدم المفتاح السداسي العشري على المرآة البصرية 2 (OM2) حتى يتم توسيط مؤشر الموضع على شاشة PSD.
ملاحظة: OM1 و OM2 مرآتان في رأس OPO لضبط محاذاة الليزر. - أخيرا ، قم بتوسيط المكثف عن طريق تدوير المسمارين لتوسيط المكثف لتحريك صورة غشاء القزحية إلى مركز مجال الرؤية.
ملاحظة: يمكن أن يحد غشاء القزحية الميداني من قطر شعاع الضوء الذي يدخل الهدف وبالتالي يستبعد الضوء الدخيل ، مما يحسن تباين الصورة.
- خطوات الحصول على التصوير متعدد الوسائط بدون ملصقات
- ضع الزيت على مكثف الزيت ذو الفتحة العددية العالية (1.4 NA) وقم بتركيب شريحة المجهر على المكثف المزيت. أخيرا ، ضع قطرة ماء كبيرة على شريحة المجهر لهدف الماء 25x. تأكد من أن المجهر مثبت بإحكام وغير متحرك ثم اضبط المرحلة z لضبط التركيز البؤري حتى يمكن رؤية صورة المجال الساطع للعينة البيولوجية تحت هدف الماء 25x.
- ابدأ عملية التصوير بالتسلسل الصحيح: MPF و SHG و SRS لتجنب التبييض الضوئي ، مما سيؤثر على جودة الصورة والتحليل الدقيق ل MPF. للتبديل بين MPF و SHG بسرعة ، قم بالتبديل من شعاع المضخة إلى شعاع Stokes الثابت.
ملاحظة: يمكن أن يستغرق ضبط ليزر المضخة من 800 نانومتر (التألق الذاتي NADH و FAD) إلى 791.3 نانومتر (إزاحة CH3 Raman) 1-2 دقيقة. - حدد دقة الصورة (512 × 512 بكسل) ووقت المكوث المناسب لكل طريقة. استخدم 8 ميكرو ثانية / بكسل ل MPF و SHG بمتوسط إطار أعلى من 3. استخدم 40 ميكرو ثانية / بكسل مع متوسط الإطار 2 لطريقة SRS.
ملاحظة: متوسط الإطار يعني عدد الصور التي سيتم حساب متوسطها قبل الحفظ. - للحصول على التألق الذاتي باستخدام MPF ، قم بإيقاف تشغيل شعاع ليزر Stokes وضبط ليزر المضخة على 800 نانومتر للحصول على NADH و flavin المثيرين. قم بتثبيت مكعب مرشح FVOPT في مسار الضوء مع 460 ± 10 نانومتر و 515 ± 10 نانومتر ل NADH و flavin ، على التوالي. وبالتالي فإن القوة على العينة تقريبا 15 [مو].
- احصل على إشارة ألياف الكولاجين باستخدام SHG. قم بإيقاف تشغيل شعاع ليزر المضخة ، واستخدم فقط شعاع ليزر stokes ، واضبط الطاقة على 500 ميجاوات. احصل فقط على القناة المتعلقة بمرشح 515 نانومتر.
- الحصول على التوزيع المكاني للبروتينات والدهون باستخدام SRS. حافظ على كل من حزم الليزر واضبط تردد شعاع الليزر ليتناسب مع الوضع الاهتزازي المحدد لكل جزيء.
ملاحظة: عادة ، يتم استخدام 791.3 نانومتر ل CH3 ، و 797 نانومتر ل CH2 ، و 787 نانومتر للدهون غير المشبعة ، و 794.6 للدهون المشبعة. وبالتالي فإن القوة على العينة حوالي 40 [مو]. - للحصول على مجموعات بيانات الصور الفائقة الطيفية SRS ، افتح برنامج التحكم OPO لتحديد المسح ، واضبط نطاق الطول الموجي من 780 نانومتر إلى 806.5 نانومتر ، واختر رقم مكدس لا يقل عن 60. ثم التقط مكدس الصور الفائق الطيفي.
ملاحظة: تحتوي مجموعة البيانات الناتجة على 60 صورة ، تمثل كل منها التوزيع المكاني عند تحول رامان محدد (من 2,700 سم -1 إلى 3,150 سم -1). يعتمد وقت الحصول على الطيف الفائق على مجال الرؤية (FOV) للصورة ووقت المسح الضوئي ولكنه سيكون ما بين 5 دقائق و 8 دقائق تقريبا لصورة 512 × 512. بالنسبة للصور الأكبر حجما ، يجب توخي الحذر لتقليل المدة تحت الليزر لمنع أي تلف ضوئي ، والذي يمكن أن يحدث بعد ساعتين (اعتمادا على سمك العينة وحجم مجال الرؤية). - احفظ جميع الصور من نفس مناطق الاهتمام (ROIs) في نفس المجلد. تنسيق الصورة هو ملف Olympus .oir.
2. تحليل الصور
- استخدم برنامج معالجة الصور لفتح جميع الصور الأولية المحفوظة لتعيين اللون وإضافة شريط المقياس لعرض الصورة. استخدمه أيضا لإنشاء القناع الثنائي ل NADH والأحماض الدهنية المشبعة (SFAs ، 2،880 سم -1) لنسبة الأكسدة والاختزال البصرية وتحليل عدم تشبع الدهون.
ملاحظة: تأكد من أن شدة القناع تحتوي على 0 و 1 فقط. - استخدم البرنامج النصي python المصمم محليا لإجراء أي تحليل نهائي (الكود متاح في https://github.com/lingyanshi2020/HSI_Analysis).
ملاحظة: تم تصميم هذا البرنامج النصي لمعالجة مناطق متعددة ذات أهمية (ROIs) من كل من عينات التحكم والسرطان. تتطلب الوظيفة الرئيسية للبرنامج النصي مدخلين فقط: مسارات الملفات لمجلدات التحكم وصور السرطان.- كرر من خلال المجلدات ، ومطابقة الصور بنفس الاسم الأساسي (على سبيل المثال ، "roi_1_flavin.tif" و "roi_1_nadh.tif" و "roi1_mask.tif").
- لكل مجموعة من الصور المتطابقة ، دع البرنامج النصي يقوم بإجراء تحليل القياس النسبي وإنشاء صور نسبية قياسية جديدة بناء على هذه العمليات الحسابية.
يتم حساب نسبة الأكسدة والاختزال البصرية على أنها فلافين / (NADH + فلافين).
يتم حساب عدم تشبع الدهون على النحو التالي: USFAs / (SFAs + USFAs) حيث تمثل USFAs الأحماض الدهنية غير المشبعة. - ثم يتم تخزين جميع القيم النسبية من الصور في إطار بيانات الباندا لسهولة التلاعب. قم بإجراء ANOVA أحادي الاتجاه واستخدم matplotlib مع styple "ggplot" أو seaborn للقيام بقطعة شريطية أو boxplot للقياس الكمي.
- استخدم الصور 2,930 سم -1 (CH3) و 2,850 سم -1 (CH2) لإنشاء صورة مطروحة (CH3 -CH 2). بعد ذلك ، امزج صورة CH2 CH3 - CH2 في مساحة ألوان RGB مع جدول بحث مخصص يحاكي تلطيخ H & E لإنشاء صورة الأنسجةالرقمية 46.
- بعد الحصول على صور SRS الفائقة الطيفية ، استخدم نص python المبني محليا للقيام بتجميع k-means لتقسيم الصور بناء على أوجه التشابه الطيفية (الكود متاح في https://github.com/lingyanshi2020/HSI_Analysis).
- قم بتحميل مكدسات الصور .tiff باستخدام حزمة tifffile. أعد تشكيل مكدس الصور الفائق الطيفي SRS (x ، y ، الأطياف) إلى مصفوفة ثنائية الأبعاد (وحدات البكسل ، الأطياف).
- استخدم حزمة scikit-learn لنشر خوارزمية k-means إلى هذه المصفوفة ثنائية الأبعاد، مع العدد المحدد من المجموعات.
- أعد تشكيل تسميات نظام المجموعة الناتجة مرة أخرى إلى أبعاد الصورة الأصلية، وإنشاء خريطة تجزئة.
- قم بتعيين ألوان فريدة لكل مجموعة ، مما يؤدي إلى إنشاء صورة بألوان زائفة تمثل تركيبات كيميائية حيوية مختلفة داخل الأنسجة.
- استخدم matplotlib لرسم أطیف كل مجموعة بقيمة متوسطة (خط متصل) والانحراف المعياري (منطقة الظل)
- اتبع بروتوكول بروتوكول مطابقة المرجع المرجعي المعاقب SRS (PRM-SRS) باستخدام MATLAB لإنشاء الكشف عن النوع الفرعي للدهون الخالي من التسمية المكانية باستخدام مجموعات بيانات الصور الفائقة الطيفية SRS47.
- قم بتنظيم الصور وحفظها بتنسيق 300 نقطة في البوصة .tif.
النتائج
تمثل الصور الواردة في الشكل 2 النتائج التي تم الحصول عليها من اتباع بروتوكول الحصول على التألق الذاتي ل FAD و NADH بالإضافة إلى قنوات SRS الأربع للبروتين والدهون الكلية والدهون غير المشبعة والدهون المشبعة. هنا نقوم أيضا بإنشاء صورة نسيجية زائفة كما هو موضح في البروتوكول من خلال مزج ألوان RGB. يوفر الحصول على قنوات MPF و SRS ملفات الصور التي سيتم استخدامها لاحقا في التحليل النسبي. يمكن رؤية مثال على هذا التحليل في الشكل 3 على أنسجة الرئة البشرية. بعد الحصول على الصور في البروتوكول ، تستفيد منهجية تحليل الصور الخاصة بنا باستخدام Python أو ImageJ من نسبة القنوات المتميزة لتوفير معلومات التمثيل الغذائي الكمية. كما هو موضح في صور عدم تشبع الدهون ونسبة الأكسدة والاختزال البصرية في الشكل 3 ، يوفر تحليل النسبة القياسية خريطة ملونة لتوزيع النشاط الأيضي النسبي والتركيب الجزيئي. لقد استفدنا من هذه القياسات لإجراء ملاحظات فيما يتعلق بالتغيرات في مسارات التمثيل الغذائي ومحتوى الدهون في أنسجة معينة أو أمراض أو عوامل بيولوجية مميزة. كما هو موضح في الشكل 4 ، يمكن أن يوفر هذا مقارنة كمية بين الأنسجة السليمة والورمية من خلال مقارنة متوسط قيم الإجهاد التأكسدي وعدم تشبع الدهون بالإضافة إلى توزيعه في صورة مجهرية ثنائية الأبعاد.
بالنسبة للتحليل النسبي لصور MPF و SRS ، فإننا نستهدف عادة الأكسدة والاختزال البصرية ونسبة عدم التشبع ، كما هو موضح في المعادلة (1) و (2).
 (1)
(1)
 (2)
(2)
حيث IC هي شدة وحدات البكسل من القناة C. وبالتالي ، نقيس النسبة لكل بكسل ونكتسب التوزيع المكاني لهذه العلامات الأيضية والجزيئية.
بالإضافة إلى تحليل النسبة القياسية ، يوضح الشكل 4 أيضا وسيلة أخرى محتملة للتطبيق لمنصتنا متعددة الوسائط: تحليل الصور الفائقة الطيفية. كما هو موضح في هذا البروتوكول ، يمكننا الحصول على صورة فائقة الطيف SRS عن طريق إجراء مسح عبر أطوال موجية ليزر متعددة باستخدام شعاع مضخة قابل للضبط. يتيح لنا ذلك إعادة بناء منطقة CH من طيف إزاحة رامان لكل بكسل داخل صورة الفحص المجهري ، والانضمام إلى كل من المعلومات الكيميائية التي يوفرها التحليل الطيفي رامان والمعلومات المكانية التي يوفرها الفحص المجهري البصري. في سير عمل تحليل الصور ، نسلط الضوء على تقنيتين تم تنفيذهما لتحليل هذه الصور الفائقة الطيفية: PRM-SRS للكشف عن الجزيئات الحيوية وتجميع k-means. يعرض الشكل 4E تطبيق PRM-SRS على صورة ورم كبدي في الفأر. توفر خوارزمية PRM-SRS الارتباط بين الأطياف لكل بكسل فردي ، يتم تعديلها عن طريق عقوبة التحولات في طيف رامان. تقوم الخوارزمية بعد ذلك بإنشاء صور توزيع احتمالية لكل من الدهون.
يعد تجميع K-means لأطياف البكسل تقنية أخرى ننفذها لتصور تجميع الأنماط الظاهرية الطيفية المحددة ، مما يتيح الفصل عن طريق تركيز الرابطة والتركيب الجزيئي من خلال الشدة والشكل الطيفي على التوالي. يقدم الشكل 5 مثالا على كيفية تطبيق تحليل الصور عبر تجميع k-means في بروتوكولنا. نتوقع أن تتماشى مجموعات k-mean هيكليا مع ميزات من أشكال الأنسجة الزائفة بالإضافة إلى توفير مزيد من التجميع من الميزات التي لا يمكن تمييزها بسهولة من قنوات SRS أو تلطيخ الهيماتوكسيلين الزائف والإيوسين النسيجي (H & E). يكمل تحليل التجميع PRM-SRS و k-means منصة التصوير الخالية من الملصقات هذه من خلال توفير معلومات كيميائية وشبه قابلة للاستهداف فيما يتعلق بتحليلات محددة وروابط جزيئية دون الحاجة إلى الفحص الخارجي.
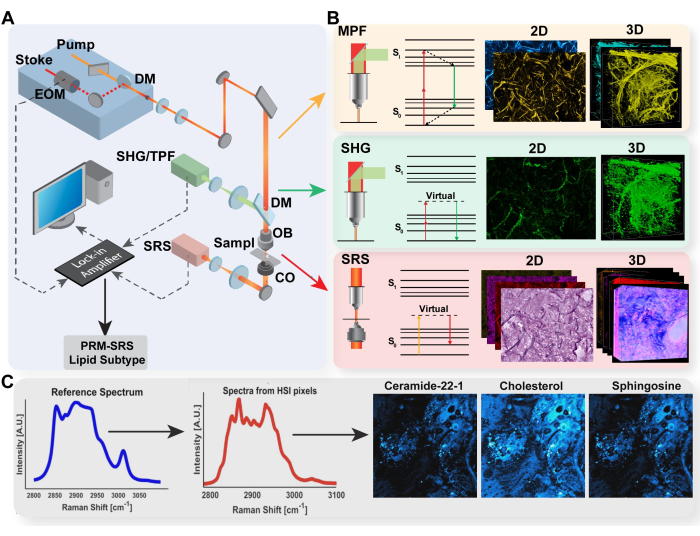
الشكل 1: رسم تخطيطي لمنصة التصوير متعدد الوسائط واكتشاف الجزيئات الحيوية PRM-SRS. (أ) رسم تخطيطي لإعداد الأجهزة لنظام التصوير MPF / TPF و SHG و SRS. (ب) مسار الضوء ومخطط جابلونسكي ل TPF و SHG و SRS مع صور مكتسب تمثيلية لكل طريقة. (ج) مخطط سير عمل PRM-SRS للمطابقة المرجعية الطيفية بين التحليل الطيفي لرامان والتصوير الفائق الطيفي SRS. الاختصارات: MPF = مضان متعدد الفوتونات. TPF = مضان ثنائي الفوتون ؛ SHG = الجيل التوافقي الثاني ؛ SRS = تحفيز تشتت رامان. PRM = المطابقة المرجعية المعقابة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: قنوات MPF و SRS من أنسجة القشرة الحركية الأولية للإنسان (M1). (أ ، ب) قنوات التألق الذاتي MPF ل Flavin / FAD و NADH. (C-F) تم التقاط قنوات SRS عند قمم تحول رامان محددة ؛ ذروة التمدد غير المتماثلة CH3 (2,930 سم -1) للبروتينات ، وذروة التمدد غير المتماثل CH2 (2,845 سم -1) للدهون ، وذروة 2,885 سم -1 للأحماض الدهنية المشبعة ، و 3,010 سم -1 ذروة للأحماض الدهنية غير المشبعة. (ز) قنوات بروتين SRS المدمجة (الزرقاء) والدهون (الخضراء) لتحديد التوزيع المكاني لكل منهما. (ح) الصور النسيجية الزائفة SRS (SRH) تعكس تلطيخ H & E. أشرطة المقياس = 20 ميكرومتر. الاختصارات: MPF = مضان متعدد الفوتونات. FAD = فلافين الأدينين ثنائي النوكليوتيد. NADH = انخفاض نيكوتيناميد الأدينين ثنائي النوكليوتيد; SRS = تحفيز تشتت رامان. SRH = أنسجة SRS. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
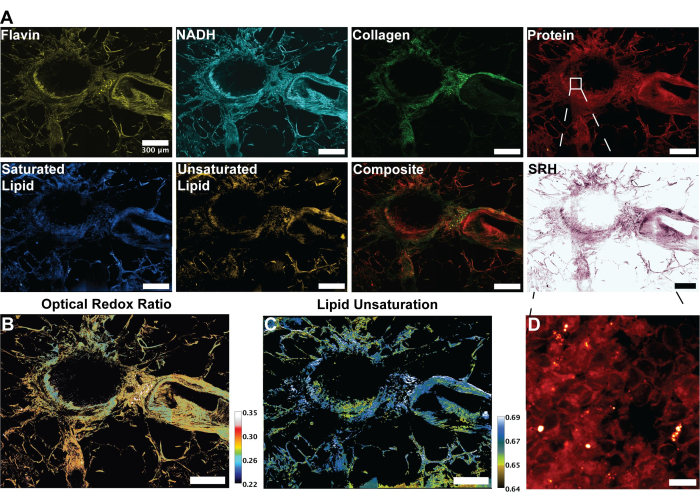
الشكل 3: صور MPF و SHG و SRS وتحليل أنسجة الرئة البشرية. (أ) التألق الذاتي MPF ل Flavin / FAD و NADH ، إشارة SHG لألياف الكولاجين ، إشارة SRS للبروتين (2،930 سم -1) ، الدهون (2،845 سم -1) ، الدهون المشبعة (2،885 سم -1) والدهون غير المشبعة (3،010 سم -1) قمم ، وصورة مدمجة مركبة للطرائق المتعددة. (ب) الصورة النسبية لنسبة الأكسدة والاختزال البصرية. (ج) الصورة النسبية لعدم تشبع الدهون. (د) صورة مكبرة للخلايا الظهارية في الطبقة الداخلية للقصبات الهوائية. أشرطة المقياس = 200 ميكرومتر. الاختصارات: MPF = مضان متعدد الفوتونات. SHG = الجيل التوافقي الثاني ؛ SRS = تحفيز تشتت رامان. FAD = فلافين الأدينين ثنائي النوكليوتيد. NADH = انخفاض نيكوتيناميد الأدينين ثنائي النوكليوتيد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: التحليل النسبي والفائق الطيفي لأورام الكبد في الفئران. (أ) صور التألق الذاتي MPF ل NAD [P] H و FAD ، وقنوات SRS للبروتين الكلي ، والدهون المشبعة وغير المشبعة ، والصور النسيجية الزائفة للتحكم الصحي في كبد الفأر (الأعلى) والأنسجة الورمية (السفلية). (ب) الإجهاد التأكسدي (أصفر-أخضر) ، كما تم قياسه بنسبة الأكسدة والاختزال البصرية ، وعدم تشبع الدهون (أزرق-أحمر) محسوبة من أنسجة التحكم (اليسار) والورم (الأيمن). أشرطة المقياس = 100 ميكرومتر. (C ، D) الرسوم البيانية الشريطية التي توضح الاختلافات النسبية في الإجهاد التأكسدي وعدم تشبع الدهون بين عينات الكبد الضابطة (الزرقاء) والورم (الأحمر). إحصائيات الأهمية: * لأهمية p ≤ 0.05 ، ** لأهمية p ≤ 0.01. (ه) ينتج تحليل النوع الفرعي للدهون PRM-SRS من الصور الفائقة الطيفية. من اليسار إلى اليمين: قناة بروتين SRS للإشارة الهيكلية ، شريط المقياس = 100 ميكرومتر ، صورة التوزيع الاحتمالي للأنواع الفرعية للدهون (TAG 18: 1 ، الكوليسترول ، و C24: 0 Ceramide). رسم بياني للأطياف المرجعية للنوع الفرعي للدهون وأطياف البكسل المتوسطة من SRS HSI عبر منطقة CH. الاختصارات: MPF = مضان متعدد الفوتونات. SRS = تحفيز تشتت رامان. NAD [P] H = انخفاض نيكوتيناميد الأدينين ثنائي النوكليوتيد فوسفات ؛ FAD = فلافين الأدينين ثنائي النوكليوتيد. HSI = الصور الفائقة الطيفية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تجمع SRS Hyperspectral k-means على القشرة الحركية الأولية للإنسان (M1). (A-F) ست مناطق تمثيلية تظهر: اليسار: صور أنسجة رامان المحفزة (SRH) التي توفر تصور الأنسجة الشبيهة ب H & E ؛ الوسط: نتائج تجميع K-Means المقابلة ؛ على اليمين: ملامح رامان الطيفية الخاصة بالكتلة مع متوسط الشدة (الخطوط الصلبة) والانحرافات المعيارية (المناطق المظللة). عدد المراكز الوسطى التي تتراوح من 4 إلى 6 وسائل. تم استخدام التجميع غير الخاضع للإشراف ، لذلك تمثل الألوان المختلفة في الصور المجمعة تركيبات كيميائية مميزة تم تحديدها بواسطة خوارزمية k-means. تتوافق كل مجموعة (ممثلة بلون فريد) مع مناطق ذات ملامح طيفية متشابهة في منطقة تمدد CH. شريط المقياس = 20 ميكرومتر. الاختصارات: SRH = أنسجة SRS. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هذا النظام متعدد الوسائط هو منصة تصوير قوية لالتقاط تصور شامل للبيئة الجزيئية للعينات عبر مجموعة واسعة من الأصول البيولوجية والظروف المرضية. تكمن ميزة الاستفادة من الطرائق المختلفة الخالية من الملصقات في القدرة على الحصول على معلومات تكميلية واستهداف تحليلات محددة قد تكون صعبة أو مستحيلة في تقنية تصوير واحدة خالية من الملصقات. على وجه التحديد ، تسمح تقنيات التصوير غير الخطية الثلاث (SRS ، MPF ، SHG) المذكورة في هذه الورقة بالقياس الكمي لتكوين الجزيئات الكبيرة ، وديناميكيات الطاقة عبر نسبة الأكسدة والاختزال البصرية ، والمعلومات الهيكلية ، بما في ذلك تكوين المصفوفة خارج الخلية والتشكل6،48،49. علاوة على ذلك ، مقارنة باستخدام كل طريقة تصوير فردية على حدة ، يسمح التصوير باستخدام نظام مجهر واحد مدمج بتسجيل الصور الفوري وأوقات تخزين عينات أقصر. لقد أجرينا حتى تصويرا للخلايا الحية بهذا النهج ، ربما بسبب انخفاض التعرض الضوئي مقارنة بالفحص المجهري الفلوري متحد البؤر ، باستخدام نقاط زمنية محددة للحصول على كل طريقة بالتتابع كما هو منصوص عليه في البروتوكول أعلاه. بصرف النظر عن مزاياها الفردية ، تستفيد المنصة متعددة الوسائط أيضا من وجهات النظر المتعددة حول الحالة البيولوجية من خلال القياس الخالي من الملصقات للمؤشرات الحيوية المختلفة.
تم توجيه التصوير الخالي من الملصقات للبروتينات الفلورية الذاتية عبر MPF بشكل أساسي نحو القياس الكمي لنسبة الأكسدة والاختزال البصرية ، وهو مقياس لتفاعلات الأكسدة والاختزال التي تسهلها أكسدة FAD إلى FAD + وتقليل NAD + إلى NADH50. هذه علامة مهمة على التمثيل الغذائي داخل الخلايا والأنسجة لأنها توفر قياسا للنشاط النسبي بين الفسفرة المؤكسدة وتحلل السكر ، وهما المساران الرئيسيان لجيل ATP6. على وجه التحديد ، تعد الانخفاض في تركيز NADH والزيادات في FAD + علامة على زيادة الفسفرة المؤكسدة في الميتوكوندريا. وفي الوقت نفسه ، فإن العكس هو الصحيح بالنسبة لزيادة تحلل السكر في السيتوبلازم. تم ربط الميل إلى تفضيل مسار استقلابي واحد على الآخر في إنتاج الطاقة بالعديد من التغييرات المرضية وتنشيط المسار المرتبط بالسرطان ، مما يسلط الضوء على الاستخدام المحتمل ل ORR كعلامة اكتشاف مبكر6،51.
وبالمثل ، فإن الحصول على إشارة الكولاجين الليفية SHG يستفيد من طريقة تصوير غير خطية خالية من الملصقات لتحديد وتصور علامة بيولوجية للصحة. يمكن ل SHG تتبع توزيع الكولاجين من النوع الأول إلى الثالث بشكل فعال بسبب هيكلها غير المتماثل المركزي. تم التعرف على بروتينات الكولاجين الليفية التي تم قياسها بواسطة SHG كعلامات تشخيصية مهمة للعديد من الأمراض بما في ذلك السرطان والتليف25،26،27،52،53. بالإضافة إلى اكتشافه كعلامة للمرض ، يمكن أن يكون اكتسابنا للكولاجين عبر SHG بمثابة مؤشر قوي للبنية في الخلايا والأنسجة بسبب دور الكولاجين الليفي في تكوين المصفوفة خارج الخلية والحدود الهيكلية عبر الأنسجة54،55. من خلال إشارة الكولاجين SHG ، يمكننا بعد ذلك إجراء ملاحظات مستنيرة للخلايا المنفصلة أو الوحدات الوظيفية المتميزة للأنسجة دون الحاجة إلى علامة خارجية للأغشية الخلوية. بشكل عام ، يقدم القياس الكمي لألياف الكولاجين SHG فائدة واضحة لكل من القدرة التشخيصية وسهولة التحليل عند دمجها مع تقنيات التصوير الأخرى الخالية من الملصقات.
باستخدام الفحص المجهري SRS ، يمكننا التقاط العديد من العلامات لتكوين الجزيئات الكبيرة ، خاصة بالنسبة للدهون والأحماض الدهنية. في هذا البروتوكول ، نصف كيفية الحصول على إشارة SRS للأحماض الدهنية غير المشبعة والمشبعة للتحليل النسبي لعدم تشبع الدهون داخل نفس العينة. تم تطبيق مجهر مسح بالليزر عمودي مع هدف مائي 25x لإنتاجية قريبة من الأشعة تحت الحمراء. مرت أشعة الليزر عبر العينة وتم جمعها بواسطة مكثف زيت عالي الفتحة (1.4 NA). تم استخدام مرشح ممر قصير عالي OD (950 نانومتر) لمنع شعاع ستوكس مع السماح فقط لشعاع المضخة بالوصول إلى كاشف الصمام الثنائي الضوئي Si للكشف عن إشارة فقدان رامان المحفزة. تم إنهاء تيار الإخراج من الصمام الثنائي الضوئي وتصفيته. بعد ذلك ، قام مضخم قفل عند 20 ميجاهرتز بإزالة تشكيل التيار في X مع تحول الطور الصفري ، واستخدمت وحدة برمجية الإشارة غير المعدلة لتوليد الصورة أثناء المسح بالليزر.
أظهرت الدراسات أن التغيرات في عدم تشبع الدهون لها تأثير عميق على الغشاء الخلوي والعضية ويمكن أن يكون خلل التنظيم في استقلاب الدهون علامة قوية للعديد من الأمراض ، بما في ذلك السرطان والأمراض التنكسيةالعصبية 56،57،58،59. للحصول على نظرة عامة أكثر شمولا على خلل تنظيم الدهون ، نقوم بتحليل تكوين النوع الفرعي باستخدام التصوير الفائق الطيفي SRS. تجمع الصور الفائقة الطيفية SRS (HSIs) بين المعلومات المكانية عالية الدقة التي تم الحصول عليها بواسطة الفحص المجهري SRS مع الإشارة ذات الأهمية الكيميائية للتحليل الطيفي رامان من خلال الضبط المتسلسل كما هو موضح في البروتوكول. ثم يتم تحليل أطياف البكسل هذه بطريقتين ، التجميع عبر k-means والكشف عن الجزيئات الحيوية باستخدام PRM-SRS.
ينتج عن تجميع K-means لأطياف البكسل فصل المناطق داخل صورة ثنائية الأبعاد عن طريق التركيز الجزيئي والتكوين بسبب العلاقة الخطية بين شدة إشارة SRS وتركيز الرابطة الجزيئية60،61. من خلال هذه المنهجية ، نطبق البروتوكول للتأكد من المناطق التي تمتلك أنماطا ظاهرية جزيئية محددة على النحو الموصوف بواسطة أطياف البكسل والنقطة الوسطى الطيفية المشتركة. لإجراء فحص شامل للتعبير الجزيئي المميز في وحدات بكسل محددة ، نقوم بتنفيذ PRM-SRS لإجراء مطابقة طيفية بين الطيف المرجعي لجزيء معين تم التقاطه باستخدام التحليل الطيفي التلقائي لرامان وأطياف البكسل من اكتساب SRS HSI. عند القيام بذلك ، يمكننا تحديد احتمالية التعبير عن الجزيئات المتميزة دون استخدام مجسات أو ملصقات خارجية. أظهر هذا التحليل القدرة على تتبع أنواع فرعية معينة من الدهون عبر الأنسجة والنماذج البيولوجية ، والقدرة على تحديد التغيرات المرضية في تغيرات تكوين الدهون وبالتالي عسر شحمياتالدم 47. علاوة على ذلك ، فإن التطورات الحديثة في تحسين الدقة الطيفية من خلال الانقسام الطيفي لانتشار نبضة بيكو ثانية من خلال ألياف السيليكا تحفز بشكل أكبر على تطبيق SRS HSI كطريقة للتصور الكيميائي الحيوي الخالي منالملصقات 62. من خلال هذه الطرق الموضحة في البروتوكول ، نقوم بإنشاء منصة لإجراء تحليل شامل للنسبو القياسي والطيفي باستخدام طريقة SRS خالية من الملصقات.
بالإضافة إلى التعقيد النسبي وحداثة هذه التقنيات ، هناك بعض القيود المهمة في نهجنا الذي يجب مراعاته. يتطلب الحصول على صور MPF باستخدام ليزر نبضي بيكو ثانية ، على عكس ليزر الفيمتو ثانية شائع الاستخدام ، قوة إثارة أعلى للفلوروفور ويخاطر بالتبييض الضوئي. مع وضع ذلك في الاعتبار ، قمنا بتحسين البروتوكول أعلاه للتخفيف من الضرر الضوئي المحتمل من منصتنا عن طريق تقليل حادث طاقة الليزر على العينة. علاوة على ذلك ، في حين أظهرت الدراسات السابقة القدرة على تقييم نسبة الأكسدة والاختزال البصرية من التصوير الذاتي MPF ل NADH و FAD ، فقد أظهر الفحص المجهري للتصوير مدى الحياة الفلورية (FLIM) دقة أعلى في تقييم استقلاب الطاقة63،64،65. ويرجع ذلك إلى القدرة على التمييز بين التركيزات المرتبطة بالبروتين وغير المرتبطة ب NADH و FAD بناء على عمرها الفلوري المتميز ، مقارنة بقدرات MPF ، فقد سمح ذلك باستخدام FLIM في دراسات شاملة لنشاط التمثيل الغذائي من مسارات طاقة متميزة ، بما في ذلك الفسفرة المؤكسدة وتحلل السكر16،63،64،65،66،67 ، 68. في حين أن هذا البروتوكول يستثني FLIM ، فإننا نتوقع دمج الطريقة في منصة التصوير هذه في المستقبل القريب ، مما يعزز تحليل استقلاب الطاقة الذي نقوم به حاليا. ومع ذلك ، من خلال البروتوكول الذي تم إنشاؤه هنا ، نقدم إعداد سير العمل والأجهزة لنهج التصوير متعدد الوسائط الذي يمكنه قياس استقلاب البنية البيولوجية من وجهات نظر متعددة.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
نشكر الدكتورة غلوريا بريهوبر وأعضاء فريق HuBMAP على توفير شرائح أنسجة الرئة البشرية. نشكر الدكتور كون تشانغ على توفير أنسجة المخ البشري. نشكر أيضا الدكتور جنرال شنغ فنغ على تقديم عينات من كبد الفأر. نحن نقدر الدعم من NIHU54DK134301 ، R01GM149976 المعاهد الوطنية للصحة ، U01AI167892 المعاهد الوطنية للصحة ، R01HL170107 المعاهد الوطنية للصحة ، المعاهد الوطنية للصحة 5R01NS111039 ، المعاهد الوطنية للصحة R21NS125395 ، المعاهد الوطنية للصحة U54CA132378 ، صناديق بدء التشغيل في جامعة كاليفورنيا في سان ديسكو ، جائزة زميل أبحاث سلون ، وجائزة CZI DAF2023-328667.
Materials
| Name | Company | Catalog Number | Comments |
| 460 nm Filter Cube | Olympus | OCT-ET 460/50M32 | |
| Bandpass Filter | KR Electronics | KR2724 | 8 MHz |
| BNC 50 Ohm Terminator | Mini Circuits | STRM-50 | |
| DC power supply | TopWard | 6302D | |
| Dichroic Mount | Thorlabs | KM100CL | |
| FIJI ImageJ | ImageJ | ||
| High NA oil condenser | Olympus | 6-U130 | |
| High O.D. shortpass filter | Thorlabs | 950 nm | |
| Inverted Laser Scanning Microscope | Olympus | FV1200MPE | |
| Lock-in Amplifier | Zurich Instruments | ||
| picoEmerald Laser System | Applied Physics & Electronics, Inc. | Synchronized pulsed pump beam (tunable 720–990 nm wavelength, 5–6 ps pulse width, and 80 MHz repetition rate) and Stokes (wavelength at 1032 nm, 6 ps pulse width, and 80 MHz repetition rate) | |
| SI Photodiode Detector | Home Built | ||
| Touch Panel Controller | Olympus | ||
| VF-300 Compresstome | Precisionary |
References
- Wollman, A. J. M., Nudd, R., Hedlund, E. G., Leake, M. C. From Animaculum to single molecules: 300 years of the light microscope. Open Biol. 5 (4), 150019(2015).
- Vicidomini, G., Bianchini, P., Diaspro, A. STED super-resolved microscopy. Nat Methods. 15 (3), 173-182 (2018).
- Weber, M., et al. MINSTED fluorescence localization and nanoscopy. Nat Photonics. 15 (5), 361-366 (2021).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. , (1990).
- Hell, S. W., et al. Three-photon excitation in fluorescence microscopy. J Biomed Optics. 1 (1), 71-74 (1996).
- Alhallak, K., Rebello, L. G., Muldoon, T. J., Quinn, K. P., Rajaram, N. Optical redox ratio identifies metastatic potential-dependent changes in breast cancer cell metabolism. Biomed Opt Express. 7 (11), 4364-4374 (2016).
- Pena, A. -M., et al. Multiphoton FLIM imaging of NADH and FAD to analyze cellular metabolic activity of reconstructed human skin in response to UVA light. Multiphoton Microscopy in the Biomedical Sciences XIX. 10882, 23-33 (2019).
- Hu, L., Wang, N., Cardona, E., Walsh, A. J. Fluorescence intensity and lifetime redox ratios detect metabolic perturbations in T cells. Biomed Opt Express. 11 (10), 5674-5688 (2020).
- Chance, B., Schoener, B., Oshino, R., Itshak, F., Nakase, Y. Oxidation-reduction ratio studies of mitochondria in freeze-trapped samples. NADH and flavoprotein fluorescence signals. J Biol Chem. 254 (11), 4764-4771 (1979).
- Ostrander, J. H., et al. Optical redox ratio differentiates breast cancer cell lines based on estrogen receptor status. Cancer Res. 70 (11), (2010).
- Skala, M. C., et al. In vivo multiphoton microscopy of NADH and FAD redox states, fluorescence lifetimes, and cellular morphology in precancerous epithelia. Proc Natl Acad Sci USA. 104 (49), 19494-19499 (2007).
- Varone, A., et al. Endogenous two-photon fluorescence imaging elucidates metabolic changes related to enhanced glycolysis and glutamine consumption in precancerous epithelial tissues. Cancer Res. 74 (11), 3067-3075 (2014).
- Malak, M., James, J., Grantham, J., Ericson, M. B. Contribution of autofluorescence from intracellular proteins in multiphoton fluorescence lifetime imaging. Sci Rep. 12, 16584(2022).
- Blacker, T. S., Duchen, M. R. Investigating mitochondrial redox state using NADH and NADPH autofluorescence. Free Radic Biol Med. 100, 53-65 (2016).
- Roth, S., Freund, I. Second harmonic generation in collagen. J Chem Phys. 70 (4), 1637-1643 (1979).
- Freund, I., Deutsch, M. Second-harmonic microscopy of biological tissue. Opt Lett. 11 (2), 94(1986).
- Boyd, R. W., Gaeta, A. L., Giese, E. Nonlinear optics. Springer Handbook of Atomic, Molecular, and Optical Physics. Drake, G. W. F. , Springer. 1097-1110 (2023).
- Aghigh, A., et al. Second harmonic generation microscopy: a powerful tool for bio-imaging. Biophys Rev. 15 (1), 43-70 (2023).
- Mohler, W., Millard, A. C., Campagnola, P. J. Second harmonic generation imaging of endogenous structural proteins. Methods. 29 (1), 97-109 (2003).
- Cox, G. Biological applications of second harmonic imaging. Biophys Rev. 3 (3), 131(2011).
- Brown, E., et al. Dynamic imaging of collagen and its modulation in tumors in vivo using second-harmonic generation. Nat Med. 9 (6), 796-800 (2003).
- Keikhosravi, A., Bredfeldt, J. S., Sagar, A. K., Eliceiri, K. W. Chapter 28 - Second-harmonic generation imaging of cancer. Methods Cell Bio. 123, 531-546 (2014).
- Hui Mingalone, C. K., et al. Bioluminescence and second harmonic generation imaging reveal dynamic changes in the inflammatory and collagen landscape in early osteoarthritis. Lab Invest. 98 (5), 656-669 (2018).
- Tsafas, V., et al. Polarization-dependent second-harmonic generation for collagen-based differentiation of breast cancer samples. J Biophotonics. 13 (10), e202000180(2020).
- Nadiarnykh, O., LaComb, R. B., Brewer, M. A., Campagnola, P. J. Alterations of the extracellular matrix in ovarian cancer studied by Second Harmonic Generation imaging microscopy. BMC Cancer. 10, 94(2010).
- Xiong, S. Y., Yang, J. G., Zhuang, J. Nonlinear spectral imaging of human normal skin, basal cell carcinoma and squamous cell carcinoma based on two-photon excited fluorescence and second-harmonic generation. Laser Phys. 21 (10), 1844-1849 (2011).
- Tilbury, K., Campagnola, P. J. Applications of second-harmonic generation imaging microscopy in ovarian and breast cancer. Perspect Medicin Chem. 7, 21-32 (2015).
- Raman, C. V., Krishnan, K. S. A New type of secondary radiation. Nature. 121 (3048), 501-502 (1928).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Phys Rev Lett. 9 (11), 455-457 (1962).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Li, Y., et al. Microglial lipid droplet accumulation in tauopathy brain is regulated by neuronal AMPK. Cell Metab. 36 (6), 1351-1370.e8 (2024).
- Lu, F. -K., et al. Label-free neurosurgical pathology with stimulated Raman imaging. Cancer Res. 76 (12), 3451-3462 (2016).
- Shi, L., et al. Optical imaging of metabolic dynamics in animals. Nat Commun. 9 (1), 2995(2018).
- Zhang, L., et al. Spectral tracing of deuterium for imaging glucose metabolism. Nat Biomed Eng. 3 (5), 402-413 (2019).
- Li, Y., et al. Bioorthogonal stimulated Raman scattering imaging uncovers lipid metabolic dynamics in Drosophila brain during aging. GEN Biotechnol. 2 (3), 247-261 (2023).
- Li, X., et al. Quantitative imaging of lipid synthesis and lipolysis dynamics in Caenorhabditis elegans by stimulated Raman scattering microscopy. Anal Chem. 91 (3), 2279-2287 (2019).
- Ji, M., et al. Detection of human brain tumor infiltration with quantitative stimulated Raman scattering microscopy. Sci Transl Med. 7 (309), 309ra163(2015).
- Ji, M., et al. Rapid, label-free detection of brain tumors with stimulated Raman scattering microscopy. Sci Transl Med. 5 (201ra119), 201ra119(2013).
- You, S., et al. Intravital imaging by simultaneous label-free autofluorescence-multiharmonic microscopy. Nat Commun. 9, 2125(2018).
- You, S., et al. Label-free deep profiling of the tumor microenvironment. Cancer Res. 81 (9), 2534-2544 (2021).
- Jermyn, M., et al. Highly accurate detection of cancer in situ with intraoperative, label-free, multimodal optical spectroscopy. Cancer Res. 77 (14), 3942-3950 (2017).
- Pshenay-Severin, E., et al. Multimodal nonlinear endomicroscopic imaging probe using a double-core double-clad fiber and focus-combining micro-optical concept. Light Sci Appl. 10 (1), 207(2021).
- Wu, W., Li, X., Qu, J. Y., He, S. In vivo imaging of biological tissues with combined two-photon fluorescence and stimulated Raman scattering microscopy. J Vis Exp. (178), e63411(2021).
- Li, X., Jiang, M., Lam, J. W. Y., Tang, B. Z., Qu, J. Y. Mitochondrial imaging with combined fluorescence and stimulated Raman scattering microscopy using a probe of the aggregation-induced emission characteristic. J Am Chem Soc. 139 (47), 17022-17030 (2017).
- Li, Z., et al. Multimodal imaging of metabolic activities for distinguishing subtypes of breast cancer. Biomed Opt Express. 14 (11), 5764-5780 (2023).
- Fung, A. A., et al. Label-free optical biopsy reveals biomolecular and morphological features of diabetic kidney tissue in 2D and 3D. , (2024).
- Zhang, W., et al. Multi-molecular hyperspectral PRM-SRS microscopy. Nat Commun. 15 (1), 1599(2024).
- Xu, F. X., et al. Discrimination of lipid composition and cellular localization in human liver tissues by stimulated Raman scattering microscopy. J Biomed Opt. 29 (1), 016008(2024).
- Zoumi, A., Yeh, A., Tromberg, B. J. Imaging cells and extracellular matrix in vivo by using second-harmonic generation and two-photon excited fluorescence. Proc Natl Acad Sci USA. 99 (17), 11014-11019 (2002).
- Liaudanskaya, V., et al. Mitochondria dysregulation contributes to secondary neurodegeneration progression post-contusion injury in human 3D in vitro triculture brain tissue model. Cell Death Dis. 14 (8), 1-15 (2023).
- Walsh, A. J., et al. Optical metabolic imaging identifies glycolytic levels, sub-types and early treatment response in breast cancer. Cancer Res. 73 (20), 6164-6174 (2013).
- Conklin, M. W., et al. Aligned collagen is a prognostic signature for survival in human breast carcinoma. Am J Pathol. 178 (3), 1221-1232 (2011).
- Sun, W., et al. Nonlinear optical microscopy: use of second harmonic generation and two-photon microscopy for automated quantitative liver fibrosis studies. J Biomed Optics. 13 (6), 064010(2008).
- Nejim, Z., Navarro, L., Morin, C., Badel, P. Quantitative analysis of second harmonic generated images of collagen fibers: a review. Res Biomed Eng. 39 (1), 273-295 (2023).
- Burke, K., Brown, E. The use of second harmonic generation to image the extracellular matrix during tumor progression. Intravital. 3 (3), e984509(2015).
- Balasubramanian, P., Prabhakaran, M. P., Sireesha, M., Ramakrishna, S. Collagen in human tissues: Structure, function, and biomedical implications from a tissue engineering perspective. Polymer Composites - Polyolefin Fractionation - Polymeric Peptidomimetics - Collagens. Abe, A., Kausch, H. H., Möller, M., Pasch, H. 251, 173-206 (2012).
- Dadsena, S., et al. Lipid unsaturation promotes BAX and BAK pore activity during apoptosis. Nat Commun. 15, 4700(2024).
- Barelli, H., Antonny, B. Lipid unsaturation and organelle dynamics. Curr Opin Cell Biol. 41, 25-32 (2016).
- Harayama, T., Antonny, B. Beyond fluidity: The role of lipid unsaturation in membrane function. Cold Spring Harb Perspect Biol. 15 (7), a041409(2023).
- Yoon, H., Shaw, J. L., Haigis, M. C., Greka, A. Lipid metabolism in sickness and in health: Emerging regulators of lipotoxicity. Mol Cell. 81 (18), 3708-3730 (2021).
- Villazon, J., Shi, L. Utilizing K-means clustering on hyperspectral DO-SRS images of the mouse hippocampus. CLEO 2024, Technical Digest Series. , Optica Publishing Group. (2024).
- Fu, D., et al. Quantitative chemical imaging with multiplex stimulated Raman scattering microscopy. J Am Chem Soc. 134 (8), 3623-3626 (2012).
- Periasamy, A., Diaspro, A. Special section guest editorial: Multiphoton microscopy. J Biomed Optics. 8 (3), 327(2003).
- Lakowicz, J. R., Szmacinski, H., Nowaczyk, K., Johnson, M. L. Fluorescence lifetime imaging of free and protein-bound NADH. Proc Natl Acad Sci USA. 89 (4), 1271-1275 (1992).
- Blacker, T. S., et al. Separating NADH and NADPH fluorescence in live cells and tissues using FLIM. Nat Commun. 5, 3936(2014).
- Xiong, H., et al. Background-free imaging of chemical bonds by a simple and robust frequency-modulated stimulated Raman scattering microscopy. Opt Express. 28 (10), 15663-15677 (2020).
- Georgakoudi, I., Quinn, K. P. Label-free optical metabolic imaging in cells and tissues. Annu Rev Biomed Eng. 25, 413-443 (2023).
- Alam, S. R., Wallrabe, H., Christopher, K. G., Siller, K. H., Periasamy, A. Characterization of mitochondrial dysfunction due to laser damage by 2-photon FLIM microscopy. Sci Rep. 12 (1), 11938(2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved