Method Article
Орофарингеальное введение блеомицина в мышиной модели легочного фиброза
В этой статье
Резюме
Этот протокол демонстрирует технику орофарингеальной аспирации для использования в мышиной модели легочного фиброза с блеомицином.
Аннотация
Интерстициальная болезнь легких (ИЗЛ) представляет собой широкий спектр нарушений, характеризующихся прогрессирующим и часто необратимым рубцеванием паренхимы легких, наиболее распространенным из которых является идиопатический легочный фиброз (ИЛФ). Было разработано несколько животных моделей IPF, наиболее широко используемой является мышиная модель с блеомицином. Блеомицин является химиотерапевтическим средством, которое, как известно, вызывает повреждение ДНК в альвеолярном эпителии, что приводит к острому повреждению легких и фиброзу легких у людей. В моделях ИЛФ у грызунов используется введение блеомицина различными методами, наиболее распространенным из которых является интратрахея (ИТ). Недавно было показано, что метод орофарингеальной аспирации (ОА) столь же эффективен, как и ИТ для нескольких фиброзирующих агентов, со значительно меньшим количеством побочных эффектов и более простым путем доставки. В этом протоколе подробно описан метод доставки блеомицина при ОА в легкие мышей и приведены примеры потенциальных применений для количественного определения данных на последующих этапах. Эта методология предлагает простой, быстрый и безопасный способ использования этой широко используемой животной модели для изучения молекулярных механизмов, лежащих в основе IPF.
Введение
Интерстициальная болезнь легких (ИЗЛ) относится к гетерогенной группе нарушений, характеризующихся прогрессирующим и необратимым рубцеванием альвеолярного пространства, интерстиция и дистальных отделов дыхательных путей1. Идиопатический легочный фиброз (ИЛФ) является наиболее распространенной формой ИЗЛ и имеет медиану выживаемости около трех лет2. ИЛФ является в конечном счете неизлечимым заболеванием, при этом ортотопическая трансплантация легких является спасительной терапией для отдельных пациентов. В настоящее время существует два одобренных FDA метода лечения ИЛФ, оба из которых просто замедляют скорость прогрессирования, а не стабилизируют или улучшают функцию легких у пациентов 3,4. В настоящее время предпринимаются значительные исследовательские усилия для выяснения основ ИЛФ и определения новых терапевтических мишеней. Существует множество животных моделей для изучения патогенеза IPF, каждая из которых имеет свои преимущества и недостатки5. Несмотря на то, что ни одна модель не способна в полной мере описать сложность заболевания человека, эти подходы позволяют получить значительное представление о молекулярных механизмах ИЛФ и могут дополнить трансляционные исследования.
Мышиная модель блеомицина остается наиболее широко используемой и хорошо охарактеризованной in vivo моделью IPF6. Блеомицин является пептидным агентом, который индуцирует одно- и двухцепочечные разрывы ДНК. После его открытия в 1962 году было обнаружено, что блеомицин эффективен в лечении ряда видов рака, включая опухоли яичек и лимфому, однако его использование было ограничено дозозависимым пневмонитом и возникающим в результате легочным фиброзом. Эта легочная токсичность повторяется у мышей. При введении в виде однократной дозы, после начальной воспалительной фазы, фиброз может наблюдаться, начиная примерно с 5-го дня и достигая пика на 14-21 день9, 10, 11 (Рисунок 1). Спонтанное разрешение происходит примерно через 6 недель, хотя постоянные фиброзные изменения могут быть достигнуты при повторном приеме12. Учитывая преходящий и воспалительный характер, у блеомицина модели13 есть некоторые недостатки, однако он предлагает быструю, надежную и воспроизводимую систему, позволяющую начать восполнять некоторые из основных пробелов в понимании ИЗЛ в нашей области и позволяет исследователям сравнивать результаты за последние пять десятилетий. Другие подходы к установке включают модели мышей с асбестозом и диоксидом кремния, которые предлагают аналогичные временные циклы (дни 14-28)6,14,15,16. Тем не менее, эти модели генерируют гистологическую картину, более соответствующую пневмокониозу, чем ИЛФ, и требуют использования взвешенных в воздухе частиц, что требует осторожного обращения. В качестве альтернативы существуют животные модели, использующие эпителиальную экспрессию трансгенов, таких как дифтерийный токсин и TGF-β1. Они повторяют невоспалительное повреждение эпителиальных клеток альвеолярного типа 2, наблюдаемое при IPF, однако занимают немного больше времени (21-30d) и требуют использования специализированных животных, которые должны быть скрещены с любыми существующими трансгенными моделями, представляющими интерес. Наконец, было показано, что аденовирально-опосредованная сверхэкспрессия цитокинов, включая TGF-β1, IL-β1 и TNF-α, вызывает фиброз легких у грызунов, как правило, к 14-му дню 17,18,19. Эти модели сверхэкспрессии цитокинов обеспечивают удобную интраназальную доставку, хотя и требуют тщательной очистки и обращения.
Существует несколько подходов к доставке блеомицина, включая интратрахеальный (IT), интраназальный, внутрибрюшинный, подкожный и внутривенный пути6. Наиболее распространенным методом является доставка ИТ, традиционно включающий либо эндотрахеальную интубацию, либо хирургическую трахеостомию20, оба из которых требуют глубокой седации, технических тонкостей и связаны с периоперационной заболеваемостью и смертностью. Недавно было показано, что метод орофарингеальной аспирации (ОА) столь же эффективен, как и ИТ, со значительно меньшим количеством побочных эффектов и более простым путем доставки 14,21,22,23,24,25,26. В этой статье мы представляем подробный визуальный протокол для метода доставки блеомицина в легкие мышей с помощью ОА и освещаем различные потенциальные приложения для количественного определения данных.
протокол
Исследования на животных, описанные в этих экспериментах, проводились в соответствии с протоколами (ARC-2021-025, ARC-2010-039), утвержденными Комитетом по исследованиям животных (ARC) Калифорнийского университета в Лос-Анджелесе и Институциональным комитетом по уходу за животными и их использованию (IACUC). Было поддержано полное соответствие всем государственным и федеральным нормам и политикам в отношении использования лабораторных животных. Животные были размещены в учреждении по уходу за животными Калифорнийского университета в Лос-Анджелесе и ухаживали за ними квалифицированным персоналом Отделения лабораторной медицины и медицины животных (DLAM) Калифорнийского университета в Лос-Анджелесе в условиях, свободных от патогенов. Мышей дикого типа C57BL/6 получили коммерчески и дали им возможность акклиматизироваться в течение не менее 14 дней. Для этих исследований использовались самцы мышей в возрасте 8-12 недель, со средней массой тела 20-25 г. Также можно использовать самок мышей, хотя важно сопоставлять пол и возраст животных в разных экспериментальных группах и условиях. Коммерческие данные о животных, реагентах и оборудовании, использованных в этом исследовании, перечислены в Таблице материалов.
1. Орофарингеальный прием блеомицина
- Приготовление блеомицина
ПРИМЕЧАНИЕ: Используйте блеомицин фармацевтического класса для обеспечения согласованности и воспроизводимости между животными и экспериментами. Доза блеомицина в единицах препарата на кг животного (Ед/кг), а не миллиграмм (мг) на кг.- Растворите порошок блеомицина в стерильном PBS фармацевтического класса до исходной концентрации 10 Ед/мл. Блеомицин следует готовить под химическим колпаком с использованием надлежащих химиотерапевтических мер предосторожности. Хранить аликвоты при температуре -20 °C до 6 месяцев.
- Приготовьте окончательную рабочую концентрацию. Доза зависит от веса (0,5-3 ЕД/кг), и при необходимости вносятся коррективы в зависимости от используемого блеомицина и цели эксперимента (например, выживаемость или смертельная дозировка).
- При необходимости отрегулируйте итоговый объем введения. Для этих исследований блеомицин разбавляли до 0,375 Ед/мл, что соответствует 50 мкл для мыши массой 25 г, в результате чего конечная рабочая концентрация составила 0,75 Ед/кг.
2. Индукция анестезии
- Приготовьте коктейль для анестезии путем разведения кетамина и ксилазина в PBS до рабочих концентраций 10 мг/мл и 1 мг/мл соответственно. Выполняйте этот этап в стерильных условиях с использованием реагентов фармацевтического класса и в соответствии с утвержденными в учреждении протоколами.
- Вводите 10 мкл коктейля на грамм массы тела животного (рабочая концентрация: кетамин 100 мг/кг, ксилазин 10 мг/кг) путем внутрибрюшинной инъекции с помощью иглы 27,5 г и шприца объемом 1 мл.
- Убедитесь, что мышь должным образом обезболечена и не реагирует на вредные раздражители, такие как защемление пальца ноги. Эффект должен проявиться в течение 5 минут. Если чувствительность все еще сохраняется, введите дополнительный кетамин/ксилазин с шагом 20 мкл до тех пор, пока не будет достигнут желаемый уровень анестезии. Наносите офтальмологическую мазь, чтобы предотвратить сухость глаз во время анестезии.
ПРИМЕЧАНИЕ: Кетамин предпочтительнее других инъекционных анестетиков и седативных средств из-за его благоприятного профиля побочных эффектов. Оказывает минимальное влияние на гемодинамику, включая частоту сердечных сокращений и частоту дыхания. Ингаляционный изофлуран может быть использован в качестве альтернативного анестетика. В этих исследованиях предпочтение отдается кетамину/ксилазину, поскольку он приводит к длительному седативному эффекту и минимальному кашлю или рефлюксу блеомицина после введения.
- Убедитесь, что мышь должным образом обезболечена и не реагирует на вредные раздражители, такие как защемление пальца ноги. Эффект должен проявиться в течение 5 минут. Если чувствительность все еще сохраняется, введите дополнительный кетамин/ксилазин с шагом 20 мкл до тех пор, пока не будет достигнут желаемый уровень анестезии. Наносите офтальмологическую мазь, чтобы предотвратить сухость глаз во время анестезии.
3. Орофарингеальный прием
- После надлежащего успокоения подвесьте мышь на процедурной платформе под углом 60°-80°, подвесив ее за передние резцы, чтобы эффективно открыть ротоглотку (Рисунок 2A).
- Окклюзируйте носовой ход гладким микрососудистым зажимом, заставляя мышь дышать через ротоглотку.
- Выведите язык из ротоглотки с помощью щипцов.
- С помощью шаговой пипетки с острым наконечником аккуратно поместите желаемый объем блеомицина или физиологического раствора в заднюю часть ротоглотки. Убедитесь, что пузырь с жидкостью хорошо виден (рисунок 2B).
- Продолжайте удерживать язык на месте, пока животное не всосет раствор. Это должно быть заметно и часто слышно.
ПРИМЕЧАНИЕ: Если животное быстро отсасывает раствор, визуализация в задней части ротоглотки может быть преходящей в течение нескольких секунд. В любом случае, в случае успеха, животное будет демонстрировать резкое и преходящее изменение в своем дыхании, делая быстрые, неглубокие вдохи. Может произойти пузырчатое выделение жидкости, что еще раз указывает на то, что жидкость успешно попала в нижние дыхательные пути. Также может возникать периодический кашель. Обычно это незначительный объем раствора блеомицина, который не должен влиять на результаты эксперимента, позволяя животному оставаться включенным в исследование. Избегайте повторного приема, так как это увеличивает риск удушья и изменяет конечную дозировку в зависимости от веса. - После подтверждения аспирации осторожно снимите носовой зажим.
- Понаблюдайте за животным в подвешенном положении в течение 15-30 с, чтобы убедиться в отсутствии рефлюкса раствора блеомицина, затем верните его в клетку.
ПРИМЕЧАНИЕ: Максимальный объем рекомендуется 50 μл, чтобы свести к минимуму риск удушья. В зависимости от желаемой дозы блеомицина и веса мыши при необходимости регулируйте концентрацию раствора блеомицина. При выполнении этой техники используйте краситель на водной основе, такой как синий Эванса, чтобы подтвердить, что раствор вводится в нижние дыхательные пути, а не в желудок.
4. Восстановление животных
- После обработки поместите животное на бок в клетку с грелкой под ней, чтобы сохранить термонейтральность.
- Наблюдайте за мышами до тех пор, пока они не придут в полное сознание. Обычно это занимает 1-2 часа, в зависимости от используемой дозы кетамина и метаболизма животного. Аккуратно ущипните пальцы ног и поддерживайте эвтермию животных, чтобы облегчить пробуждение.
- Ежедневно проводите клиническое наблюдение за мышами на предмет изменений массы тела, груминга, уровня активности и респираторного статуса. Подобно другим методам доставки блеомицина, животные могут испытывать значительную потерю веса в течение 14-21 дня, что является ключевым маркером эффективности модели.
- Согласно протоколам ARC и IACUC, усыпляйте животных, если потеря веса превышает 20% от начального веса животного. Распространенность и тяжесть потери веса зависят от используемой дозы блеомицина и демографических характеристик мышей (см. выше).
5. Забор тканей, обработка и анализ конечных точек
- В зависимости от экспериментального вопроса и желаемого момента времени, усыпьте мышей в соответствии с протоколами IACUC и соберите у нихлегкие 28 в нужное время. Эффекты блеомицина часто сильно заметны визуально по сравнению с контролем, что указывает на успешное введение. В этих исследованиях мышей приносили в жертву на 7, 14 и 21 день.
- Для гистологии рассекают легкие en bloc и фиксируют их в 4% PFA на 24 ч. Продолжайте заделку парафина, срезы, гематоксилин и эозин (H&E) и/или трихромное окрашивание по Массону, как описано ранее 28,29,30.
- Для измерения коллагена гомогенизируйте правое легкое и используйте коммерчески доступный набор (см. Таблицу материалов) для измерения содержания гидроксипролина, как описано ранее31.
- Для проточной цитометрии переваривают правое легкое с помощью диссоциатора тканей и ферментативного раствора для получения одноклеточной суспензии. Проведите проточное цитометрическое окрашивание и анализ, как описано ранее 32,33,34.
Результаты
Описанный здесь протокол обобщает путь введения орофарингеальной аспирации в мышиной модели блеомицина. В этих экспериментах животных лечили либо блеомицином (0,75 ЕД/кг массы тела), либо PBS для фиктивного контроля. На 7, 14 и 21 день мышей усыпляли, их легкие высаживали, а ткани фиксировали,как описано ранее. Фиброз оценивали с помощью гематоксилина и эозина (H&E) гистологического окрашивания. К 7-му дню можно увидеть фиброзное изменение альвеолярных перегородок, наряду с небольшими воспалительными/фиброзными изменениями, по сравнению с контролем PBS (рис. 3A, B). К 14-му дню наблюдаются более крупные и сливающиеся участки фиброза со значительным разрушением нормальной альвеолярной архитектуры (рисунок 3C). На 21-й день эти значительные фиброзные изменения сохраняются (Рисунок 3D). Эти гистопатологические изменения были количественно оценены с использованием модифицированной системы оценки Эшкрофта29, которая продемонстрировала аналогичную степень фиброза между 14 и 21 днями (рисунок 3E).
В то время как гистопатология остается золотым стандартом, могут быть проведены дополнительные анализы для объективной количественной оценки фиброзных и воспалительных изменений, вызванных блеомицином. Для подтверждения результатов H&E на14-31-й день был проведен анализ гидроксипролина, который продемонстрировал увеличение общего количества коллагена с блеомицином (рис. 4A). Кроме того, на 14-й день РНК была выделена из цельных гомогенатов легких, а количественная полимеразная цепная реакция (qPCR) продемонстрировала активацию профибротических генов Col3a1 и Tgfb с помощью блеомицина (рис. 4B). Чтобы охарактеризовать иммунные изменения, вызванные орофарингеальным блеомицином, проводили проточную цитометрию, как описано ранее 32,33,34 (рис. 4C). В ответ на ОА блеомицин наблюдается устойчивая инфильтрация миелоидных клеток в легкое мышей, включая интерстициальные макрофаги (ИМ), альвеолярные макрофаги, полученные из моноцитов, и нейтрофилы (Рисунок 4D). Эти данные демонстрируют, что метод аспирации ротоглотки является безопасной, удобной и воспроизводимой методологией индуцирования фиброза легких с помощью блеомицина на мышиной животной модели.
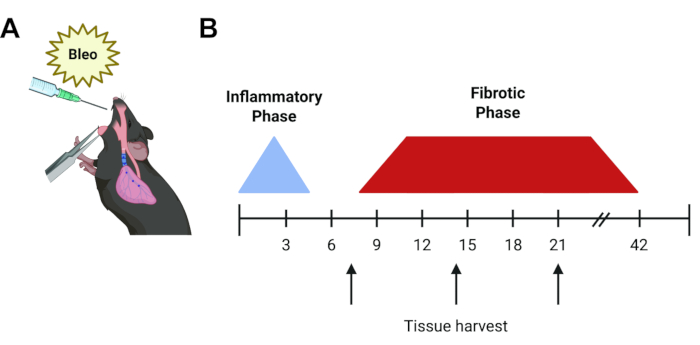
Рисунок 1: Хронология протокола эксперимента. (A) Графическое изображение орофарингеального введения блеомицина в легкое мыши. (B) Хронология течения болезни блеомицина. Начальная воспалительная фаза длится 48-72 часа, за ней следует фиброзная фаза, начинающаяся примерно на 7-й день, которая разрешается через 6 недель при индивидуальных инъекциях. Стрелками обозначено общее потенциальное время сбора тканей (день 7, 14 или 21) в зависимости от вопроса эксперимента и используемых анализов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Схема введения блеомицина в ротоглотку. (A) После надлежащего введения седативных препаратов мышь подвешивается за передние резцы под углом 60°-80° на защищенную платформу. (B) Носовой ход окклюзируется с помощью незубчатого микрососудистого зажима. Язык отводится от ротоглотки, и с помощью шаговой пипетки с острым наконечником в заднюю часть ротоглотки вводится раствор блеомицина, или PBS control. Видимый пузырь жидкости должен быть виден до тех пор, пока он не будет аспирирован в нижние дыхательные пути. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
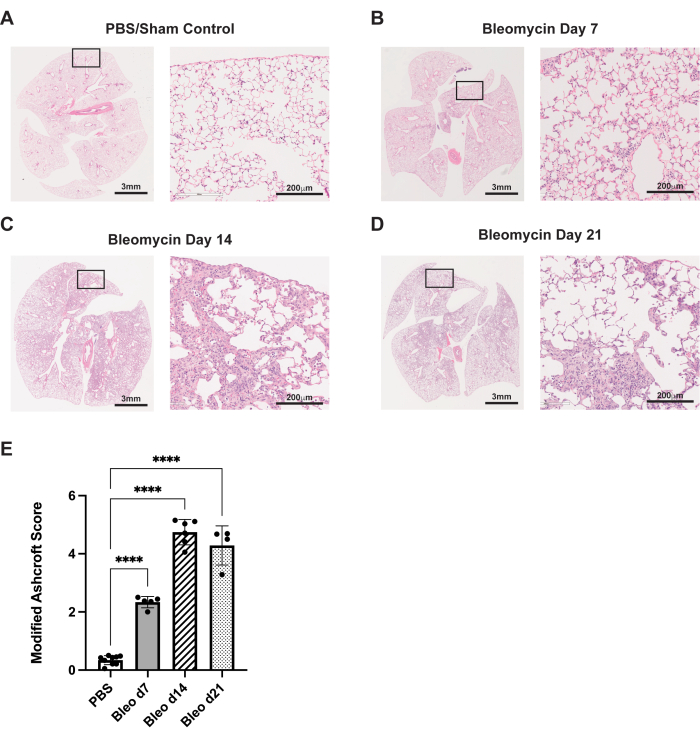
Рисунок 3: Введение блеомицина через орофарингеальную аспирацию приводит к устойчивым фиброзным гистологическим изменениям. Мышей дикого типа C57Bl/6 лечили однократной дозой блеомицина (0,75 ед/кг) или PBS в 0-й день. (A) Фиктивный контроль демонстрирует нормальную гистологию легких. (Б-Г) Блеомицин приводит к прогрессирующему фиброзу и архитектурному искажению легкого мыши. (E) Модифицированная оценка гистологических образцов по методу Эшкрофта. Полосы погрешностей представляют собой стандартное отклонение. p < 0,0001 по методу одностороннего ANOVA. Изображения являются репрезентативными для трех независимых экспериментов, проведенных с 4-8 животными в группе. Изображения 20x (справа, масштабные линейки: 200 μм) взяты из обозначенных вставок на изображениях 1x (слева, масштабные линейки: 3 мм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Количественная оценка профибротических и провоспалительных изменений, вызванных блеомицином. (A) Легкие были собраны на 14-й день у мышей дикого типа C57Bl/6, получавших либо блеомицин (0,75 ед./кг), либо PBS. Был проведен анализ гидроксипролина и измерено содержание коллагена (мг на правое легкое). (B) РНК выделяли из гомогенизированной легочной ткани блеомицина или животных, получавших PBS, на 14-й день. Для измерения уровня транскриптов Col1a1 и Tgfb проводили количественную ПЦР. Изменение кратности, относящееся к контрольной группе PBS, рассчитывали с использованием метода 2CP с учетом гена внутреннего хозяйства. (C) Стратегия потокового гейтинга миелоидных популяций в легких мышей. (D) Количественная оценка миелоидных популяций в легких мышей на 14-й день в ответ на блеомицин. Данные репрезентативны для трех независимых экспериментов с 4-8 животными в группе в каждом эксперименте. Полосы погрешностей представляют собой стандартное отклонение. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001 по данным непарного t-критерия Стьюдента (гидроксипролин и qPCR) или двустороннего ANOVA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Представлен подробный видеопротокол по методике орофарингеальной аспирации для введения блеомицина для использования в мышиной модели легочного фиброза. Кроме того, мы выделяем потенциальные последующие применения для количественной оценки фиброзных и воспалительных изменений, вызванных блеомицином ОА.
Хотя ни одно животное полностью не отражает сложность болезни человека, мышиная модель блеомицина используется в течение последних пяти десятилетий и остается наиболее широко используемой для изучения патогенеза IPF36. Существует множество способов введения блеомицина на моделях грызунов, в том числе через интратрахеальное (IT), интраназальное (IN), внутривенное (IV), внутрибрюшинное и подкожное введение6. В то время как внутривенное введение более точно имитирует механизм блеомицин-индуцированного пневмонита у людей, чаще используется IT-способ; Фиброз достигается при приеме однократной дозы, без системной токсичности, связанной с более высокими дозами, и является более экономически эффективным8. Для проведения ИТ-терапии требуется либо эндотрахеальная интубация, либо хирургическое исследование на шее и трахеостомия, что требует глубокого уровня седации и высокой степени процессуальных навыков, в то же время неся значительную связанную с этим перипроцедурную заболеваемость и смертность. Введение ИН является разумной альтернативой ИТ, однако, было показано, что он вызывает более вариабельные паттерны распределения и повреждения легких37,38. Подход ОА получил все более широкое распространение и представляет, по-видимому, более воспроизводимую замену доставки блеомицина и других фиброзирующих агентов в легкие мышей 14,21,22,23,24,25,26. Недавно пути введения блеомицина с помощью ОА и ИТ были непосредственно сравнены у мышей, продемонстрировав одинаковую эффективность и гомогенное фиброзное повреждение, при этом минимизировав перипроцедурную смертность21. Аналогичным образом, в этом исследовании ни одна мышь не умерла при введении ОА (данные не показаны), что подчеркивает благоприятный технический и этический профиль этого метода.
Степень фиброза и сроки повреждения, вызванного блеомицином, зависят от нескольких факторов. После инстилляции блеомицина в легкое мыши наступает начальный воспалительный период острого повреждения легких, за которым следует фибропролиферативная фаза, которая начинается через 5-7 дней10 дней. Как правило, конечные точки заболевания оцениваются в период с 14 по 21 день, когда достигается устойчивый фиброз (рисунок 3C). Настоящее исследование было сосредоточено на 14-м дне, который, как было показано, является оптимальным временем для измерения параметров фиброза легких, поскольку у животных развился обширный фиброз с меньшей вариабельностью и меньшей смертностью, чем на21-11 день. Было отмечено, что после однократного приема фиброз у мышей спонтанно исчезает примерно через 6 недель. Чтобы зафиксировать необратимость, наблюдаемую при многих формах ИЗЛ у людей, исследователи разработали повторяющиеся модели дозирования для достижения постоянных фиброзных изменений в мышиных моделях 9,12.
Предыдущие исследования продемонстрировали деформационную вариабельность в отношении тяжести фиброза, достигаемую при приеме однократной дозы блеомицина, при этом мыши C57Bl/6 были «высокочувствительными», DBA/2 и швейцарские мыши были «промежуточными ответчиками», а мыши BALB/c были «низко реагирующими»39. Кроме того, возраст и пол используемых мышей также влияют на степень воспаления и фиброза. У пожилых мышей (52-54 недели) наблюдался повышенный фиброз, чем у молодых мышей (8-12 недель), а самцы мышей оказались более восприимчивыми к блеомицину в целом, чем их самки 9,40. Эти наблюдения позволяют предположить, что основные генетические факторы влияют на воспалительную реакцию и реакцию заживления ран, и исследователи должны сопоставлять возраст и пол мышей при тестировании потенциальных терапевтических возможностей, как это предлагается в недавнихофициальных рекомендациях Американского торакального общества (ATS).
Блеомицин представляет собой воспалительную модель фиброза. Первоначальное повреждение эпителия, вызванное блеомицином, приводит к преходящей, острой продукции цитокинов и рекрутированию нейтрофилов в легких41,42. Сама по себе ИЛЛ клинически не характеризуется сильным иммунологическим фенотипом, за исключением острых обострений, хотя другие типы ИЗЛ, такие как связанные с заболеванием соединительной ткани (ДСТ-ИЗЛ), более явно обусловлены иммунной дисрегуляцией 43,44,45. Таким образом, в зависимости от проверяемой гипотезы, исследователи могут выбрать для изучения вмешательства, которые перехватывают оси болезни в более ранние или более поздние моменты времени. Кроме того, рекомендуется рассмотреть вторую модель для валидации ключевых результатов при скрининге доклинических методов лечения, таких как диоксид кремния, гиперэкспрессия аденовируса TGF-β1, повреждение эпителия, вызванное дифтерией, или гуманизированные модели мышей 5,17,46,47,48.
В заключение следует отметить, что методика орофарингеальной аспирации представляет собой надежную, воспроизводимую, переводимую и безопасную альтернативу внутритрахеальной доставке блеомицина для индуцирования фиброза в мышином легком.
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Эта работа была поддержана грантом NIH имени Рут Л. Кирхштейн Национальной исследовательской службы (NRSA) на институциональную исследовательскую подготовку (T32), присужденным RW (2T32HL072752-16). Авторы также хотели бы выразить признательность за поддержку Центру здоровья легких Фонда Сола и Джойс Брандманов.
Материалы
| Name | Company | Catalog Number | Comments |
| anti-mouse CD45, Brlliant Violet 605 | BioLegend | 103155 | |
| anti-mouse CD64, AlexaFluor 647 | BioLegend | 139322 | |
| anti-mouse Ly6G, AlexaFluor 700 | BioLegend | 127622 | |
| anti-mouse MerTK, PE/Cy7 | BioLegend | 151522 | |
| anti-mouse SiglecF, PE | BD Biosciences | 552126 | |
| BD Luer-Stub Adaptors | Fisher Scientific | 13-681-21 | |
| Bleomycin | McKesson | 1129996 | From NorthStar Rx 16714088601 |
| Endotracheal Mouse Intubation Kit | Kent Scientific | ETI-MSE | |
| Fixable Live/Dead Violet | Thermo | L34955 | |
| FlowJo v10 Software | FlowJo | ||
| gentleMACS Dissociator | Miltenyi | 130-093-235 | |
| Hydroxyproline Assay Kit | Sigma | MAK463 | |
| Liberase TM | Roche | 5401127001 | |
| Moria Vessel Clamp | Fine Science Tools | 18350-11 | |
| Mouse Endotracheal Intubation Kit | Kent | ETI-MSE | |
| Stepper Pipette | Dymax | TI15469 | |
| Wildtype C57BL/6 mice | Jackson Laboratories | JAX, stain #000664 |
Ссылки
- Martinez, F. J., et al. Idiopathic pulmonary fibrosis. Nat Rev Dis Primers. 3, 17074(2017).
- Hutchinson, J., Fogarty, A., Hubbard, R., Mckeever, T. Global incidence and mortality of idiopathic pulmonary fibrosis: A systematic review. Eur Respir J. 46 (3), 795-806 (2015).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E. Jr, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Moore, B. B., Hogaboam, C. M. Murine models of pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 294 (2), L152-L160 (2008).
- Umezawa, H. Chemistry and mechanism of action of bleomycin. Fed Proc. 33 (11), 2296-2302 (1974).
- Muggia, F. M., Louie, A. C., Sikic, B. I. Pulmonary toxicity of antitumor agents. Cancer Treat Rev. 10 (4), 221-243 (1983).
- Degryse, A. L., et al. Repetitive intratracheal bleomycin models several features of idiopathic pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 299 (4), L442-L452 (2010).
- Kolb, P., et al. The importance of interventional timing in the bleomycin model of pulmonary fibrosis. Eur Respir J. 55 (6), 1901105(2020).
- Izbicki, G., Segel, M. J., Christensen, T. G., Conner, M. W., Breuer, R. Time course of bleomycin-induced lung fibrosis. Int J Exp Pathol. 83 (3), 111-119 (2002).
- Chung, M. P., et al. Role of repeated lung injury and genetic background in bleomycin-induced fibrosis. Am J Respir Cell Mol Biol. 29 (3 Pt 1), 375-380 (2003).
- Moeller, A., Ask, K., Warburton, D., Gauldie, J., Kolb, M. The bleomycin animal model: A useful tool to investigate treatment options for idiopathic pulmonary fibrosis. Int J Biochem Cell Biol. 40 (3), 362-382 (2008).
- Lakatos, H. F., et al. Oropharyngeal aspiration of a silica suspension produces a superior model of silicosis in the mouse when compared to intratracheal instillation. Exp Lung Res. 32 (5), 181-199 (2006).
- Sanchez, V. C., Pietruska, J. R., Miselis, N. R., Hurt, R. H., Kane, A. B. Biopersistence and potential adverse health impacts of fibrous nanomaterials: What have we learned from asbestos. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 1 (5), 511-529 (2009).
- Barbarin, V., et al. The role of pro- and anti-inflammatory responses in silica-induced lung fibrosis. Respir Res. 6 (1), 112(2005).
- Sime, P. J., Xing, Z., Graham, F. L., Csaky, K. G., Gauldie, J. Adenovector-mediated gene transfer of active transforming growth factor-beta1 induces prolonged severe fibrosis in rat lung. J Clin Invest. 100 (4), 768-776 (1997).
- Kolb, M., Margetts, P. J., Anthony, D. C., Pitossi, F., Gauldie, J. Transient expression of il-1beta induces acute lung injury and chronic repair leading to pulmonary fibrosis. J Clin Invest. 107 (12), 1529-1536 (2001).
- Sime, P. J., et al. Transfer of tumor necrosis factor-alpha to rat lung induces severe pulmonary inflammation and patchy interstitial fibrogenesis with induction of transforming growth factor-beta1 and myofibroblasts. Am J Pathol. 153 (3), 825-832 (1998).
- Orlando, F., et al. Induction of mouse lung injury by endotracheal injection of bleomycin. J Vis Exp. (146), e58922(2019).
- Barbayianni, I., Ninou, I., Tzouvelekis, A., Aidinis, V. Bleomycin revisited: A direct comparison of the intratracheal micro-spraying and the oropharyngeal aspiration routes of bleomycin administration in mice. Front Med (Lausanne). 5, 269(2018).
- Egger, C., et al. Administration of bleomycin via the oropharyngeal aspiration route leads to sustained lung fibrosis in mice and rats as quantified by ute-MRI and histology. PLoS One. 8 (5), e63432(2013).
- Bale, S., Sunkoju, M., Reddy, S. S., Swamy, V., Godugu, C. Oropharyngeal aspiration of bleomycin: An alternative experimental model of pulmonary fibrosis developed in Swiss mice. Indian J Pharmacol. 48 (6), 643-648 (2016).
- Scotton, C. J., et al. Increased local expression of coagulation factor x contributes to the fibrotic response in human and murine lung injury. J Clin Invest. 119 (9), 2550-2563 (2009).
- Jenkins, R. G., et al. An official American Thoracic Society Workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Rao, G. V., et al. Efficacy of a technique for exposing the mouse lung to particles aspirated from the pharynx. J Toxicol Environ Health A. 66 (15), 1441-1452 (2003).
- Redente, E. F., et al. Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis. Am J Physiol Lung Cell Mol Physiol. 301 (4), L510-L518 (2011).
- Birjandi, S. Z., et al. CD4(+)CD25(hi)Foxp3(+) cells exacerbate bleomycin-induced pulmonary fibrosis. Am J Pathol. 186 (8), 2008-2020 (2016).
- Hubner, R. H., et al. Standardized quantification of pulmonary fibrosis in histological samples. Biotechniques. 44 (4), 507-514 (2008).
- Joshi, N., et al. A spatially restricted fibrotic niche in pulmonary fibrosis is sustained by M-CSF/M-CSFR signalling in monocyte-derived alveolar macrophages. Eur Respir J. 55 (1), 1900646(2020).
- Belperio, J. A., et al. Interaction of IL-13 and C10 in the pathogenesis of bleomycin-induced pulmonary fibrosis. Am J Respir Cell Mol Biol. 27 (4), 419-427 (2002).
- Misharin, A. V., Morales-Nebreda, L., Mutlu, G. M., Budinger, G. R., Perlman, H. Flow cytometric analysis of macrophages and dendritic cell subsets in the mouse lung. Am J Respir Cell Mol Biol. 49 (4), 503-510 (2013).
- Misharin, A. V., et al. Monocyte-derived alveolar macrophages drive lung fibrosis and persist in the lung over the life span. J Exp Med. 214 (8), 2387-2404 (2017).
- Tighe, R. M., et al. Improving the quality and reproducibility of flow cytometry in the lung. An official American Thoracic Society workshop report. Am J Respir Cell Mol Biol. 61 (2), 150-161 (2019).
- Limjunyawong, N., Mock, J., Mitzner, W. Instillation and fixation methods useful in mouse lung cancer research. J Vis Exp. 102, e52964(2015).
- Adamson, I. Y., Bowden, D. H. The pathogenesis of bleomycin-induced pulmonary fibrosis in mice. Am J Pathol. 77 (2), 185-197 (1974).
- Southam, D. S., Dolovich, M., O'byrne, P. M., Inman, M. D. Distribution of intranasal instillations in mice: Effects of volume, time, body position, and anesthesia. Am J Physiol Lung Cell Mol Physiol. 282 (4), L833-L839 (2002).
- Foster, W. M., Walters, D. M., Longphre, M., Macri, K., Miller, L. M. Methodology for the measurement of mucociliary function in the mouse by scintigraphy. J Appl Physiol (1985). 90 (3), 1111-1117 (2001).
- Schrier, D. J., Kunkel, R. G., Phan, S. H. The role of strain variation in murine bleomycin-induced pulmonary fibrosis. Am Rev Respir Dis. 127 (1), 63-66 (1983).
- Hecker, L., et al. Reversal of persistent fibrosis in aging by targeting nox4-nrf2 redox imbalance. Sci Transl Med. 6 (231), 231ra247(2014).
- Chaudhary, N. I., Schnapp, A., Park, J. E. Pharmacologic differentiation of inflammation and fibrosis in the rat bleomycin model. Am J Respir Crit Care Med. 173 (7), 769-776 (2006).
- Kim, S. N., et al. Dose-response effects of bleomycin on inflammation and pulmonary fibrosis in mice. Toxicol Res. 26 (3), 217-222 (2010).
- Wells, A. U., Denton, C. P. Interstitial lung disease in connective tissue disease--mechanisms and management. Nat Rev Rheumatol. 10 (12), 728-739 (2014).
- Idiopathic Pulmonary Fibrosis Clinical Research Network. Prednisone, azathioprine, and n-acetylcysteine for pulmonary fibrosis. N Engl J Med. 366 (21), 1968-1977 (2012).
- Raghu, G., et al. An official ATS/ERS/JRS/ALAT statement: Idiopathic pulmonary fibrosis: Evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 183 (6), 788-824 (2011).
- Kolb, M., et al. Differences in the fibrogenic response after transfer of active transforming growth factor-beta1 gene to lungs of "fibrosis-prone" and "fibrosis-resistant" mouse strains. Am J Respir Cell Mol Biol. 27 (2), 141-150 (2002).
- Sisson, T. H., et al. Targeted injury of type ii alveolar epithelial cells induces pulmonary fibrosis. Am J Respir Crit Care Med. 181 (3), 254-263 (2010).
- Pierce, E. M., et al. Therapeutic targeting of cc ligand 21 or cc chemokine receptor 7 abrogates pulmonary fibrosis induced by the adoptive transfer of human pulmonary fibroblasts to immunodeficient mice. Am J Pathol. 170 (4), 1152-1164 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены