Method Article
Administração orofaríngea de bleomicina no modelo murino de fibrose pulmonar
Neste Artigo
Resumo
Este protocolo demonstra a técnica de aspiração orofaríngea para uso no modelo murino de bleomicina de fibrose pulmonar.
Resumo
A doença pulmonar intersticial (DPI) representa um amplo espectro de distúrbios caracterizados pela cicatrização progressiva e muitas vezes irreversível do parênquima pulmonar, sendo a mais comum a fibrose pulmonar idiopática (FPI). Vários modelos animais de FPI têm sido desenvolvidos, sendo o modelo murino de bleomicina o mais utilizado. A bleomicina é um quimioterápico conhecido por induzir danos ao DNA no epitélio alveolar, resultando em lesão pulmonar aguda e fibrose pulmonar em humanos. Modelos de FPI em roedores usam a administração de bleomicina por vários métodos, sendo o mais comum o intratraqueal (TI). Recentemente, a técnica de aspiração orofaríngea (OA) demonstrou ser tão eficaz quanto a IT para múltiplos agentes fibrosantes, com consideravelmente menos efeitos colaterais e uma via de entrega mais fácil. Este protocolo detalha o método OA de entrega de bleomicina no pulmão murino e destaca exemplos de possíveis aplicações a jusante para quantificação de dados. Essa metodologia oferece uma maneira simples, rápida e segura de utilizar esse modelo animal amplamente utilizado para estudar os mecanismos moleculares subjacentes à FPI.
Introdução
A doença pulmonar intersticial (DPI) refere-se a um grupo heterogêneo de distúrbios caracterizados por cicatrização progressiva e irreversível do espaço alvéolo, interstício e vias aéreas distais1. A fibrose pulmonar idiopática (FPI) é a forma mais comum de DPI e tem uma sobrevida mediana de aproximadamente três anos2. A FPI é uma condição terminal, sendo o transplante pulmonar ortotópico uma terapia de resgate para pacientes selecionados. Atualmente, existem duas terapias aprovadas pela FDA para FPI, ambas apenas diminuem a taxa de progressão em vez de estabilizar ou melhorar a função pulmonar dos pacientes 3,4. Esforços significativos de pesquisa estão em andamento para elucidar os fundamentos da FPI e identificar novos alvos terapêuticos. Existem inúmeros modelos animais para estudar a patogênese da FPI, cada um com suas próprias vantagens e desvantagens5. Embora nenhum modelo seja capaz de recapitular completamente a complexidade da doença humana, essas abordagens oferecem uma visão significativa dos mecanismos moleculares da FPI e podem complementar os estudos translacionais.
O modelo murino de bleomicina continua sendo o modelo in vivo mais amplamente utilizado e bem caracterizado da FPI6. A bleomicina é um agente peptídico que induz quebras de DNA de fita simples e dupla. Após sua descoberta em 1962, a bleomicina mostrou-se eficaz no tratamento de vários tipos de câncer, incluindo tumores testiculares e linfoma, no entanto, seu uso foi limitado pela pneumonite dose-dependente e pela fibrose pulmonar resultante 7,8. Essa toxicidade pulmonar é recapitulada em camundongos. Quando administrada em dose única, após uma fase inflamatória inicial, a fibrose pode ser observada a partir do dia 5, com pico nos dias 14-21 9,10,11 (Figura 1). A resolução espontânea ocorre após cerca de 6 semanas, embora alterações fibróticas permanentes possam ser alcançadas com doses repetitivas12. Dada a natureza transitória e inflamatória, existem algumas desvantagens inerentes ao modelo de bleomicina13, no entanto, ele oferece um sistema rápido, robusto e reprodutível para começar a responder a algumas das principais lacunas na compreensão da DPI em nosso campo e permite que os investigadores comparem os resultados nas últimas cinco décadas. Outras abordagens de instalação incluem os modelos de asbestose e sílica murina, que oferecem cursos de tempo semelhantes (dias 14-28)6,14,15,16. No entanto, esses modelos geram um padrão histológico mais consistente com pneumoconiose do que FPI e requerem o uso de partículas transportadas pelo ar, necessitando de manuseio cuidadoso. Alternativamente, existem modelos animais que utilizam a expressão de transgenes impulsionados por epitelial, como toxina diftérica e TGF-β1. Estes recapitulam a lesão de células epiteliais alveolares tipo 2 não inflamatórias observada na FPI, mas demoram um pouco mais (21-30d) e requerem o uso de animais especializados que devem ser retrocruzados em quaisquer modelos transgênicos existentes de interesse. Por fim, a superexpressão de citocinas mediada por adenovírus, incluindo TGF-β1, IL-β1 e TNF-α, demonstrou induzir fibrose pulmonar em roedores, geralmente no dia 14 17,18,19. Esses modelos de superexpressão de citocinas permitem uma administração intranasal conveniente, embora exijam purificação e manuseio cuidadosos.
Existem múltiplas abordagens para a administração de bleomicina, incluindo vias intratraqueal (IT), intranasal, intraperitoneal, subcutânea e intravenosa6. A administração de TI é o método mais comum, tradicionalmente envolvendo intubação endotraqueal ou traqueostomia cirúrgica20, ambas as quais requerem sedação profunda, sutileza técnica e estão associadas à morbidade e mortalidade perioperatórias. Recentemente, a técnica de aspiração orofaríngea (OA) tem se mostrado tão eficaz quanto a TI, com consideravelmente menos efeitos colaterais e uma via de parto mais fácil 14,21,22,23,24,25,26. Aqui, apresentamos um protocolo visual detalhado para o método OA de entrega de bleomicina no pulmão murino e destacamos várias aplicações potenciais a jusante para quantificação de dados.
Protocolo
Os estudos em animais descritos nesses experimentos foram conduzidos sob protocolos (ARC-2021-025, ARC-2010-039) aprovados pelo Comitê de Pesquisa Animal da UCLA (ARC) e pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC). A conformidade total com todos os regulamentos e políticas estaduais e federais relativos ao uso de animais de laboratório foi mantida. Os animais foram alojados no Centro de Cuidados com Animais da UCLA e cuidados pela equipe qualificada da Divisão de Laboratório e Medicina Animal da UCLA (DLAM) em condições livres de patógenos. Camundongos C57BL/6 do tipo selvagem foram obtidos comercialmente e aclimatados por pelo menos 14 dias. Camundongos machos com idades entre 8 e 12 semanas foram usados para esses estudos, com peso corporal médio de 20 a 25 g. Camundongos fêmeas também podem ser usados, embora seja importante para animais de correspondência de sexo e idade em grupos e condições experimentais27. Os detalhes comerciais dos animais, reagentes e equipamentos usados neste estudo estão listados na Tabela de Materiais.
1. Administração orofaríngea de bleomicina
- Preparação de bleomicina
NOTA: Use bleomicina de grau farmacêutico para garantir consistência e reprodutibilidade entre animais e experimentos. Dose a bleomicina em unidades de medicamento por kg de animal (U / kg), não miligramas (mg) por kg.- Dissolva a bleomicina em pó em PBS estéril de grau farmacêutico até uma concentração de estoque de 10 U / mL. A bleomicina deve ser preparada sob um capuz químico usando as devidas precauções quimioterápicas. Conservar as alíquotas a -20 °C durante um período máximo de 6 meses.
- Preparar a concentração final de trabalho. A dose é baseada no peso (0,5-3 U/kg) e os ajustes são feitos conforme necessário, dependendo da bleomicina usada e do objetivo do experimento (por exemplo, sobrevivência ou dosagem letal).
- Ajuste o volume final de administração conforme necessário. Para esses estudos, dilua a bleomicina a 0,375 U / mL, o que equivale a 50 μL para um camundongo de 25 g, resultando em uma concentração final de trabalho de 0,75 U / kg.
2. Indução da anestesia
- Prepare o coquetel de anestesia diluindo cetamina e xilazina em PBS para concentrações de trabalho de 10 mg / mL e 1 mg / mL, respectivamente. Execute esta etapa em condições estéreis usando reagentes de grau farmacêutico e de acordo com protocolos aprovados institucionalmente.
- Administrar 10 μL do coquetel por grama de peso corporal do animal (concentração de trabalho: cetamina 100 mg / kg, xilazina 10 mg / kg) por injeção intraperitoneal usando uma agulha de 27,5 G e uma seringa de 1 mL.
- Certifique-se de que o mouse esteja devidamente anestesiado e não responda a estímulos nocivos, como beliscar o dedo do pé. Os efeitos devem ser observados dentro de 5 min. Se ainda estiver responsivo, administre cetamina/xilazina adicionais em incrementos de 20 μL até que o nível desejado de anestesia seja alcançado. Aplique pomada oftálmica para evitar o ressecamento dos olhos durante a anestesia.
NOTA: A cetamina é preferida a outros anestésicos e sedativos injetados devido ao seu perfil de efeitos colaterais favorável. Tem efeitos mínimos na hemodinâmica, incluindo frequência cardíaca e respiratória. O isoflurano inalado pode ser usado como agente anestésico alternativo. Nesses estudos, a cetamina/xilazina é preferida porque resulta em sedação prolongada e tosse mínima ou refluxo de bleomicina após a administração.
- Certifique-se de que o mouse esteja devidamente anestesiado e não responda a estímulos nocivos, como beliscar o dedo do pé. Os efeitos devem ser observados dentro de 5 min. Se ainda estiver responsivo, administre cetamina/xilazina adicionais em incrementos de 20 μL até que o nível desejado de anestesia seja alcançado. Aplique pomada oftálmica para evitar o ressecamento dos olhos durante a anestesia.
3. Administração orofaríngea
- Uma vez devidamente sedado, suspenda o mouse na plataforma processual em um ângulo de 60 ° a 80 °, pendurando-o pelos incisivos frontais para abrir efetivamente a orofaringe ( Figura 2A ).
- Oclua a passagem nasal com uma pinça microvascular lisa, forçando o camundongo a respirar pela orofaringe.
- Retraia a língua para fora da orofaringe usando uma pinça.
- Usando uma pipeta de passo com uma ponta de ponta de leur, coloque suavemente o volume desejado de bleomicina, ou controle salino, na parte de trás da orofaringe. Certifique-se de que uma bolha de líquido esteja grosseiramente visível (Figura 2B).
- Continue segurando a língua no lugar até que o animal aspire a solução. Isso deve ser visível e muitas vezes audivelmente aparente.
NOTA: Se o animal aspirar rapidamente a solução, a visualização na parte posterior da orofaringe pode ser transitória, em poucos segundos. Independentemente disso, se for bem-sucedido, o animal demonstrará uma mudança abrupta e transitória em seu padrão respiratório, respirando rapidamente e superficialmente. Pode ocorrer borbulhamento do fluido, indicando ainda que o fluido entrou com sucesso no trato respiratório inferior. Tosse ocasional também pode ocorrer. Este é geralmente um volume insignificante da solução de bleomicina e não deve afetar os resultados experimentais, permitindo que o animal permaneça incluído no estudo. Evite a dosagem repetitiva, pois aumenta o risco de asfixia e altera a dosagem final com base no peso. - Após a confirmação da aspiração, remova cuidadosamente o clipe nasal.
- Observe o animal na posição de suspensão por 15-30 s para garantir que não haja refluxo da solução de bleomicina e, em seguida, devolva-o à gaiola.
NOTA: Recomenda-se um volume máximo de 50 μL para minimizar o risco de asfixia. Dependendo da dose desejada de bleomicina e do peso do camundongo, ajuste a concentração da solução de bleomicina conforme necessário. Ao praticar essa técnica, use um corante à base de água, como o azul de Evans, para confirmar que a solução é administrada no trato respiratório inferior, e não no estômago14.
4. Recuperação de animais
- Após o tratamento, coloque o animal de lado em sua gaiola com uma almofada de aquecimento embaixo para manter a termoneutralidade.
- Monitore os ratos até que estejam totalmente conscientes. Isso normalmente leva de 1 a 2 horas, dependendo da dose de cetamina usada e do metabolismo do animal. Aperte suavemente os dedos dos pés e mantenha os animais eutérmicos para facilitar o despertar.
- Monitore clinicamente os camundongos diariamente quanto a mudanças no peso corporal, higiene, nível de atividade e estado respiratório. Semelhante a outros métodos de administração de bleomicina, os animais podem experimentar perda de peso significativa ao longo do curso de 14 a 21 dias, o que é um marcador chave da eficácia do modelo.
- De acordo com os protocolos ARC e IACUC, sacrificar animais se a perda de peso exceder 20% do peso inicial do animal. A prevalência e a gravidade da perda de peso dependem da dose de bleomicina usada e da demografia dos camundongos (veja acima).
5. Coleta de tecidos, processamento e análise de ponto final
- Dependendo da questão experimental e do ponto de tempo desejado, eutanasiar os camundongos seguindo os protocolos IACUC e colher seus pulmões28 no momento apropriado. Os efeitos da bleomicina são frequentemente aparentes visualmente em comparação com o controle, indicando administração bem-sucedida. Nesses estudos, os camundongos foram sacrificados nos dias 7, 14 e 21.
- Para histologia, dissecar os pulmões em bloco e fixá-los em PFA a 4% por 24 h. Prossiga com a inclusão de parafina, seccionamento, hematoxilina e eosina (H & E) e / ou coloração tricrômica de Masson conforme descrito anteriormente 28,29,30.
- Para a medição do colágeno, homogeneizar o pulmão direito e usar um kit disponível comercialmente (ver Tabela de Materiais) para medir o conteúdo de hidroxiprolina conforme descrito anteriormente31.
- Para citometria de fluxo, digerir o pulmão direito usando o dissociador de tecido e uma solução enzimática para obter uma suspensão de célula única. Realize a coloração e análise por citometria de fluxo conforme descrito anteriormente 32,33,34.
Resultados
O protocolo aqui descrito resume a via de administração da aspiração orofaríngea no modelo murino de bleomicina. Nesses experimentos, os animais foram tratados com bleomicina (0,75U/kg de peso corporal) ou PBS para controle simulado. Nos dias 7, 14 e 21, os camundongos foram sacrificados, seus pulmões explantados e o tecido fixado, conforme descrito anteriormente35. A fibrose foi avaliada por meio de coloração histológica de hematoxilina e eosina (H&E). No dia 7, a alteração fibrótica dos septos alveolares pode ser observada, juntamente com pequenas alterações inflamatórias/fibróticas, em comparação com o controle da PBS (Figura 3A,B). No dia 14, áreas de fibrose maiores e mais confluentes são observadas, com destruição significativa da arquitetura alveolar normal (Figura 3C). No dia 21, essas alterações fibróticas significativas permanecem (Figura 3D). Essas alterações histopatológicas foram quantificadas usando o sistema de pontuação de Ashcroft modificado29, que demonstrou um grau semelhante de fibrose entre os dias 14 e 21 (Figura 3E).
Embora a histopatologia continue sendo o padrão-ouro, ensaios adicionais podem ser realizados para quantificar objetivamente as alterações fibróticas e inflamatórias induzidas pela bleomicina. Para confirmar os achados de H&E, foram realizados ensaios de hidroxiprolina no dia 1431, que demonstraram um aumento na quantidade total de conteúdo de colágeno com bleomicina (Figura 4A). Além disso, o RNA foi isolado de homogeneizados de pulmão inteiro no dia 14, e uma reação em cadeia da polimerase quantitativa (qPCR) demonstrou a regulação positiva dos genes profibróticos Col3a1 e Tgfb com bleomicina (Figura 4B). Para caracterizar as alterações imunes induzidas pela bleomicina orofaríngea, foi realizada citometria de fluxo conforme descrito anteriormente 32,33,34 (Figura 4C). Em resposta à bleomicina OA, observa-se uma infiltração robusta de células mieloides no pulmão murino, incluindo macrófagos intersticiais (IM), macrófagos alveolares derivados de monócitos (MoAM) e neutrófilos (Figura 4D). Esses dados demonstram que a técnica de aspiração orofaríngea é uma metodologia segura, conveniente e reprodutível para induzir fibrose pulmonar com bleomicina no modelo animal murino.
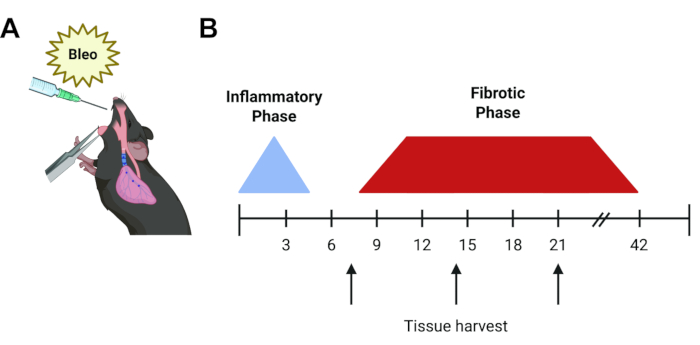
Figura 1: Linha do tempo do protocolo experimental. (A) Representação gráfica da administração orofaríngea de bleomicina no pulmão murino. (B) Linha do tempo do curso da doença de bleomicina. A fase inflamatória inicial dura 48-72 h e é seguida por uma fase fibrótica que começa aproximadamente no dia 7, que se resolve após 6 semanas para injeções individuais. As setas representam os tempos potenciais comuns de colheita de tecido (dia 7, 14 ou 21), dependendo da questão do experimento e dos ensaios utilizados. Clique aqui para ver uma versão maior desta figura.

Figura 2: Esquema da administração orofaríngea de bleomicina. (A) Uma vez devidamente sedado, o camundongo é amarrado por seus incisivos frontais a 60 ° -80 ° em uma plataforma segura. (B) A passagem nasal é ocluída usando uma pinça microvascular não serrilhada. A língua é retraída da orofaringe e, usando uma pipeta de passo com ponta de ponta de leur, a solução de bleomicina, ou controle PBS, é administrada na parte de trás da orofaringe. Uma bolha visível de fluido deve ser visível até ser aspirada para o trato respiratório inferior. Clique aqui para ver uma versão maior desta figura.
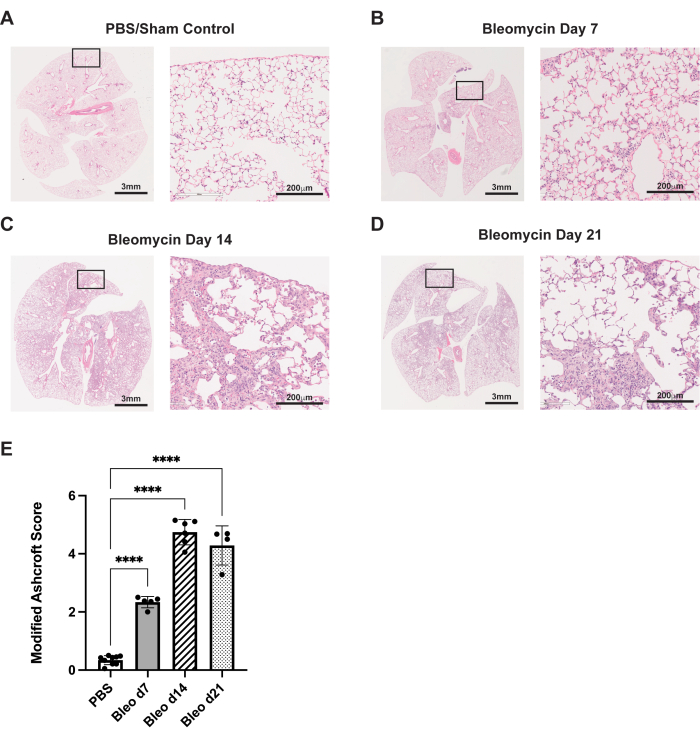
Figura 3: A administração de bleomicina por aspiração orofaríngea resulta em alterações histológicas fibróticas robustas. Camundongos C57Bl / 6 do tipo selvagem foram tratados com uma dose única de bleomicina (0,75U / kg) ou PBS no dia 0. (A) Os controles simulados demonstram histologia pulmonar normal. (BD) A bleomicina resulta em fibrose progressiva e distorção arquitetural do pulmão murino. (E) Pontuação de Ashcroft modificada de amostras histológicas. As barras de erro representam o desvio padrão. p < 0,0001 conforme determinado pela ANOVA unidirecional. As imagens são representativas de três experimentos independentes realizados com 4-8 animais por grupo. As imagens 20x (direita, barras de escala: 200 μm) são das inserções designadas nas imagens 1x (esquerda, barras de escala: 3 mm). Clique aqui para ver uma versão maior desta figura.

Figura 4: Quantificação das alterações pró-fibróticas e pró-inflamatórias induzidas pela bleomicina. (A) Os pulmões foram colhidos no dia 14 de camundongos C57Bl / 6 do tipo selvagem tratados com bleomicina (0,75U / kg) ou PBS. Foram realizados ensaios de hidroxiprolina e medido o conteúdo de colágeno (mg por pulmão direito). (B) O RNA foi isolado do tecido pulmonar homogeneizado de animais tratados com bleomicina ou PBS no dia 14. A PCR quantitativa foi realizada para medir o nível de transcritos Col1a1 e Tgfb . A mudança de dobra relacionada ao grupo controle PBS foi calculada usando o método 2CP em referência ao gene de limpeza interna. (C) Estratégia de bloqueio de fluxo de populações mieloides no pulmão murino. (D) Quantificação de populações mieloides no pulmão murino no dia 14, em resposta à bleomicina. Os dados são representativos de três experimentos independentes com 4-8 animais por grupo por experimento. As barras de erro representam o desvio padrão. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001 conforme determinado pelo teste t de Student não pareado (hidroxiprolina e qPCR) ou ANOVA de duas vias. Clique aqui para ver uma versão maior desta figura.
Discussão
Um protocolo de vídeo detalhado é fornecido sobre a técnica de aspiração orofaríngea para administração de bleomicina para uso no modelo murino de fibrose pulmonar. Além disso, destacamos potenciais aplicações a jusante para quantificar alterações fibróticas e inflamatórias induzidas pela bleomicina OA.
Embora nenhum animal recapitule totalmente a complexidade da doença humana, o modelo de camundongo com bleomicina tem sido usado nas últimas cinco décadas e continua sendo o mais amplamente implementado para estudar a patogênese da FPI36. Há uma infinidade de maneiras de administrar bleomicina em modelos de roedores, inclusive por injeção intratraqueal (IT), intranasal (IN), intravenosa (IV), intraperitoneal e subcutânea6. Embora a administração intravenosa imite mais de perto o mecanismo da pneumonite induzida por bleomicina em humanos, a via IT é mais comumente usada; A fibrose é obtida com uma dose única, sem toxicidades sistêmicas associadas a doses mais altas, e é mais custo-efetiva8. A entrega de IT requer intubação endotraqueal ou exploração cirúrgica no pescoço e traqueostomia, ambas exigindo níveis profundos de sedação e um alto grau de habilidade de procedimento, ao mesmo tempo em que acarretam morbidade e mortalidade periprocedimento associadas significativas. A administração de IN é uma alternativa razoável à TI, no entanto, tem se mostrado mais variável A abordagem OA tem visto um uso crescente e representa um substituto aparentemente mais reprodutível para a entrega de bleomicina e outros agentes fibrosantes no pulmão murino 14,21,22,23,24,25,26. Recentemente, as vias de administração de bleomicina para OA e IT foram comparadas diretamente em camundongos, demonstrando igual eficácia e lesão fibrótica homogênea, minimizando a mortalidade periprocedimento21. Da mesma forma, neste estudo, nenhum camundongo morreu após a administração de OA (dados não mostrados), ressaltando o perfil técnico e ético favorável desse método.
O grau de fibrose e o momento da lesão induzida pela bleomicina dependem de vários fatores. Após a instilação de bleomicina no pulmão murino, ocorre um período inflamatório inicial de lesão pulmonar aguda, seguido por uma fase fibroproliferativa que se inicia após 5-7 dias10. Rotineiramente, os desfechos da doença são avaliados entre os dias 14-21, quando a fibrose sustentada é alcançada (Figura 3C). O presente estudo concentrou-se no dia 14, que se mostrou o momento ideal para medir os parâmetros de fibrose pulmonar, pois os animais desenvolveram fibrose extensa, com menor variabilidade e menor mortalidade do que no dia 2111. Após uma dose única, observou-se que a fibrose se resolve espontaneamente após aproximadamente 6 semanas em camundongos. Para capturar a irreversibilidade observada com muitas formas de DPI em humanos, os pesquisadores desenvolveram modelos de dosagem repetitivos para alcançar alterações fibróticas permanentes em modelos murinos 9,12.
Estudos anteriores demonstraram uma variação de cepa em relação à gravidade da fibrose alcançada com uma dose única de bleomicina, sendo os camundongos C57Bl/6 "respondedores altos", os camundongos DBA/2 e Swiss "respondedores intermediários" e os camundongos BALB/c sendo "respondedores baixos"39. Além disso, a idade e o sexo dos camundongos usados também influenciam o grau de inflamação e fibrose. Camundongos mais velhos (52-54 semanas) demonstraram fibrose aumentada do que camundongos mais jovens (8-12 semanas), e camundongos machos parecem mais suscetíveis à bleomicina, em geral, do que suas contrapartes fêmeas 9,40. Essas observações sugerem fatores genéticos subjacentes que influenciam a resposta inflamatória e de cicatrização de feridas, e os investigadores devem combinar a idade e o sexo dos camundongos ao testar possíveis vias terapêuticas, conforme sugerido pelas recentes diretrizes oficiais da American Thoracic Society (ATS)25.
A bleomicina representa um modelo inflamatório de fibrose. O dano epitelial inicial induzido pela bleomicina resulta em produção aguda e transitória de citocinas e recrutamento de neutrófilos no pulmão41,42. A FPI em si não é clinicamente caracterizada por um fenótipo imunológico forte, além de exacerbações agudas, embora outros tipos de DPI, como aqueles associados à doença do tecido conjuntivo (DTC-DPI), sejam mais claramente impulsionados pela desregulação imunológica 43,44,45. Portanto, dependendo da hipótese que está sendo testada, os investigadores podem optar por estudar intervenções que interceptam os eixos da doença em momentos anteriores ou posteriores. Além disso, recomenda-se que um segundo modelo seja considerado para validar os principais achados na triagem de terapias pré-clínicas, como sílica, superexpressão de adenovírus TGF-β1, dano epitelial induzido por difteria ou modelos de camundongos humanizados 5,17,46,47,48.
Em conclusão, a técnica de aspiração orofaríngea representa uma alternativa robusta, reprodutível, traduzível e segura à administração intratraqueal de bleomicina para induzir fibrose no pulmão murino.
Divulgações
Os autores não têm conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado pelo Prêmio de Serviço Nacional de Pesquisa (NRSA) do NIH Ruth L. Kirchstein Bolsa de Treinamento em Pesquisa Institucional (T32) concedido a RW (2T32HL072752-16). Os autores também gostariam de agradecer o apoio do Centro de Saúde Pulmonar da Fundação Saul e Joyce Brandman.
Materiais
| Name | Company | Catalog Number | Comments |
| anti-mouse CD45, Brlliant Violet 605 | BioLegend | 103155 | |
| anti-mouse CD64, AlexaFluor 647 | BioLegend | 139322 | |
| anti-mouse Ly6G, AlexaFluor 700 | BioLegend | 127622 | |
| anti-mouse MerTK, PE/Cy7 | BioLegend | 151522 | |
| anti-mouse SiglecF, PE | BD Biosciences | 552126 | |
| BD Luer-Stub Adaptors | Fisher Scientific | 13-681-21 | |
| Bleomycin | McKesson | 1129996 | From NorthStar Rx 16714088601 |
| Endotracheal Mouse Intubation Kit | Kent Scientific | ETI-MSE | |
| Fixable Live/Dead Violet | Thermo | L34955 | |
| FlowJo v10 Software | FlowJo | ||
| gentleMACS Dissociator | Miltenyi | 130-093-235 | |
| Hydroxyproline Assay Kit | Sigma | MAK463 | |
| Liberase TM | Roche | 5401127001 | |
| Moria Vessel Clamp | Fine Science Tools | 18350-11 | |
| Mouse Endotracheal Intubation Kit | Kent | ETI-MSE | |
| Stepper Pipette | Dymax | TI15469 | |
| Wildtype C57BL/6 mice | Jackson Laboratories | JAX, stain #000664 |
Referências
- Martinez, F. J., et al. Idiopathic pulmonary fibrosis. Nat Rev Dis Primers. 3, 17074 (2017).
- Hutchinson, J., Fogarty, A., Hubbard, R., Mckeever, T. Global incidence and mortality of idiopathic pulmonary fibrosis: A systematic review. Eur Respir J. 46 (3), 795-806 (2015).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E., et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Moore, B. B., Hogaboam, C. M. Murine models of pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 294 (2), L152-L160 (2008).
- Umezawa, H. Chemistry and mechanism of action of bleomycin. Fed Proc. 33 (11), 2296-2302 (1974).
- Muggia, F. M., Louie, A. C., Sikic, B. I. Pulmonary toxicity of antitumor agents. Cancer Treat Rev. 10 (4), 221-243 (1983).
- Degryse, A. L., et al. Repetitive intratracheal bleomycin models several features of idiopathic pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 299 (4), L442-L452 (2010).
- Kolb, P., et al. The importance of interventional timing in the bleomycin model of pulmonary fibrosis. Eur Respir J. 55 (6), 1901105 (2020).
- Izbicki, G., Segel, M. J., Christensen, T. G., Conner, M. W., Breuer, R. Time course of bleomycin-induced lung fibrosis. Int J Exp Pathol. 83 (3), 111-119 (2002).
- Chung, M. P., et al. Role of repeated lung injury and genetic background in bleomycin-induced fibrosis. Am J Respir Cell Mol Biol. 29 (3 Pt 1), 375-380 (2003).
- Moeller, A., Ask, K., Warburton, D., Gauldie, J., Kolb, M. The bleomycin animal model: A useful tool to investigate treatment options for idiopathic pulmonary fibrosis. Int J Biochem Cell Biol. 40 (3), 362-382 (2008).
- Lakatos, H. F., et al. Oropharyngeal aspiration of a silica suspension produces a superior model of silicosis in the mouse when compared to intratracheal instillation. Exp Lung Res. 32 (5), 181-199 (2006).
- Sanchez, V. C., Pietruska, J. R., Miselis, N. R., Hurt, R. H., Kane, A. B. Biopersistence and potential adverse health impacts of fibrous nanomaterials: What have we learned from asbestos. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 1 (5), 511-529 (2009).
- Barbarin, V., et al. The role of pro- and anti-inflammatory responses in silica-induced lung fibrosis. Respir Res. 6 (1), 112 (2005).
- Sime, P. J., Xing, Z., Graham, F. L., Csaky, K. G., Gauldie, J. Adenovector-mediated gene transfer of active transforming growth factor-beta1 induces prolonged severe fibrosis in rat lung. J Clin Invest. 100 (4), 768-776 (1997).
- Kolb, M., Margetts, P. J., Anthony, D. C., Pitossi, F., Gauldie, J. Transient expression of il-1beta induces acute lung injury and chronic repair leading to pulmonary fibrosis. J Clin Invest. 107 (12), 1529-1536 (2001).
- Sime, P. J., et al. Transfer of tumor necrosis factor-alpha to rat lung induces severe pulmonary inflammation and patchy interstitial fibrogenesis with induction of transforming growth factor-beta1 and myofibroblasts. Am J Pathol. 153 (3), 825-832 (1998).
- Orlando, F., et al. Induction of mouse lung injury by endotracheal injection of bleomycin. J Vis Exp. (146), e58922 (2019).
- Barbayianni, I., Ninou, I., Tzouvelekis, A., Aidinis, V. Bleomycin revisited: A direct comparison of the intratracheal micro-spraying and the oropharyngeal aspiration routes of bleomycin administration in mice. Front Med (Lausanne). 5, 269 (2018).
- Egger, C., et al. Administration of bleomycin via the oropharyngeal aspiration route leads to sustained lung fibrosis in mice and rats as quantified by ute-MRI and histology. PLoS One. 8 (5), e63432 (2013).
- Bale, S., Sunkoju, M., Reddy, S. S., Swamy, V., Godugu, C. Oropharyngeal aspiration of bleomycin: An alternative experimental model of pulmonary fibrosis developed in Swiss mice. Indian J Pharmacol. 48 (6), 643-648 (2016).
- Scotton, C. J., et al. Increased local expression of coagulation factor x contributes to the fibrotic response in human and murine lung injury. J Clin Invest. 119 (9), 2550-2563 (2009).
- Jenkins, R. G., et al. An official American Thoracic Society Workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Rao, G. V., et al. Efficacy of a technique for exposing the mouse lung to particles aspirated from the pharynx. J Toxicol Environ Health A. 66 (15), 1441-1452 (2003).
- Redente, E. F., et al. Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis. Am J Physiol Lung Cell Mol Physiol. 301 (4), L510-L518 (2011).
- Birjandi, S. Z., et al. CD4(+)CD25(hi)Foxp3(+) cells exacerbate bleomycin-induced pulmonary fibrosis. Am J Pathol. 186 (8), 2008-2020 (2016).
- Hubner, R. H., et al. Standardized quantification of pulmonary fibrosis in histological samples. Biotechniques. 44 (4), 507-514 (2008).
- Joshi, N., et al. A spatially restricted fibrotic niche in pulmonary fibrosis is sustained by M-CSF/M-CSFR signalling in monocyte-derived alveolar macrophages. Eur Respir J. 55 (1), 1900646 (2020).
- Belperio, J. A., et al. Interaction of IL-13 and C10 in the pathogenesis of bleomycin-induced pulmonary fibrosis. Am J Respir Cell Mol Biol. 27 (4), 419-427 (2002).
- Misharin, A. V., Morales-Nebreda, L., Mutlu, G. M., Budinger, G. R., Perlman, H. Flow cytometric analysis of macrophages and dendritic cell subsets in the mouse lung. Am J Respir Cell Mol Biol. 49 (4), 503-510 (2013).
- Misharin, A. V., et al. Monocyte-derived alveolar macrophages drive lung fibrosis and persist in the lung over the life span. J Exp Med. 214 (8), 2387-2404 (2017).
- Tighe, R. M., et al. Improving the quality and reproducibility of flow cytometry in the lung. An official American Thoracic Society workshop report. Am J Respir Cell Mol Biol. 61 (2), 150-161 (2019).
- Limjunyawong, N., Mock, J., Mitzner, W. Instillation and fixation methods useful in mouse lung cancer research. J Vis Exp. 102, e52964 (2015).
- Adamson, I. Y., Bowden, D. H. The pathogenesis of bleomycin-induced pulmonary fibrosis in mice. Am J Pathol. 77 (2), 185-197 (1974).
- Southam, D. S., Dolovich, M., O'byrne, P. M., Inman, M. D. Distribution of intranasal instillations in mice: Effects of volume, time, body position, and anesthesia. Am J Physiol Lung Cell Mol Physiol. 282 (4), L833-L839 (2002).
- Foster, W. M., Walters, D. M., Longphre, M., Macri, K., Miller, L. M. Methodology for the measurement of mucociliary function in the mouse by scintigraphy. J Appl Physiol (1985). 90 (3), 1111-1117 (2001).
- Schrier, D. J., Kunkel, R. G., Phan, S. H. The role of strain variation in murine bleomycin-induced pulmonary fibrosis. Am Rev Respir Dis. 127 (1), 63-66 (1983).
- Hecker, L., et al. Reversal of persistent fibrosis in aging by targeting nox4-nrf2 redox imbalance. Sci Transl Med. 6 (231), 231ra247 (2014).
- Chaudhary, N. I., Schnapp, A., Park, J. E. Pharmacologic differentiation of inflammation and fibrosis in the rat bleomycin model. Am J Respir Crit Care Med. 173 (7), 769-776 (2006).
- Kim, S. N., et al. Dose-response effects of bleomycin on inflammation and pulmonary fibrosis in mice. Toxicol Res. 26 (3), 217-222 (2010).
- Wells, A. U., Denton, C. P. Interstitial lung disease in connective tissue disease--mechanisms and management. Nat Rev Rheumatol. 10 (12), 728-739 (2014).
- Idiopathic Pulmonary Fibrosis Clinical Research Network. Prednisone, azathioprine, and n-acetylcysteine for pulmonary fibrosis. N Engl J Med. 366 (21), 1968-1977 (2012).
- Raghu, G., et al. An official ATS/ERS/JRS/ALAT statement: Idiopathic pulmonary fibrosis: Evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 183 (6), 788-824 (2011).
- Kolb, M., et al. Differences in the fibrogenic response after transfer of active transforming growth factor-beta1 gene to lungs of "fibrosis-prone" and "fibrosis-resistant" mouse strains. Am J Respir Cell Mol Biol. 27 (2), 141-150 (2002).
- Sisson, T. H., et al. Targeted injury of type ii alveolar epithelial cells induces pulmonary fibrosis. Am J Respir Crit Care Med. 181 (3), 254-263 (2010).
- Pierce, E. M., et al. Therapeutic targeting of cc ligand 21 or cc chemokine receptor 7 abrogates pulmonary fibrosis induced by the adoptive transfer of human pulmonary fibroblasts to immunodeficient mice. Am J Pathol. 170 (4), 1152-1164 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados