Method Article
إعطاء البلعوم الفموي للبليوميسين في نموذج الفئران للتليف الرئوي
In This Article
Summary
يوضح هذا البروتوكول تقنية الشفط الفموي البلعومي لاستخدامها في نموذج الفئران البيوميسين للتليف الرئوي.
Abstract
يمثل مرض الرئة الخلالي (ILD) مجموعة واسعة من الاضطرابات التي تتميز بالتندب التدريجي الذي لا رجعة فيه في كثير من الأحيان في حمة الرئة ، وأكثرها شيوعا هو التليف الرئوي مجهول السبب (IPF). تم تطوير العديد من النماذج الحيوانية ل IPF ، مع كون نموذج الفئران bleomycin هو الأكثر استخداما. Bleomycin هو علاج كيميائي معروف بأنه يسبب تلف الحمض النووي في الظهارة السنخية ، مما يؤدي إلى إصابة الرئة الحادة والتليف الرئوي لدى البشر. تستخدم نماذج القوارض من IPF إدارة البليومايسين عبر طرق مختلفة ، وأكثرها شيوعا هي داخل القصبة الهوائية (IT). في الآونة الأخيرة ، ثبت أن تقنية الشفط الفموي البلعومي (OA) فعالة بنفس القدر من تكنولوجيا المعلومات لعوامل التليف المتعددة ، مع آثار جانبية أقل بكثير وطريق أسهل للولادة. يوضح هذا البروتوكول بالتفصيل طريقة الزراعة العضوية لتوصيل البليومايسين إلى رئة الفئران ويسلط الضوء على أمثلة على التطبيقات النهائية المحتملة لقياس البيانات الكمي. تقدم هذه المنهجية طريقة بسيطة وسريعة وآمنة لاستخدام هذا النموذج الحيواني المستخدم على نطاق واسع لدراسة الآليات الجزيئية الكامنة وراء IPF.
Introduction
يشير مرض الرئة الخلالي (ILD) إلى مجموعة غير متجانسة من الاضطرابات التي تتميز بالتندب التدريجي الذي لا رجعة فيه في الفضاء الحويصلات الهوائية والنسيج الخلالي والممرات الهوائيةالبعيدة 1. التليف الرئوي مجهول السبب (IPF) هو الشكل الأكثر شيوعا ل ILD ويحمل متوسط بقاء على قيد الحياة حوالي ثلاث سنوات2. IPF هي حالة نهائية في نهاية المطاف ، حيث تعتبر زراعة الرئة التقويمية علاجا إنقاذيا لمرضى مختارين. يوجد حاليا علاجان معتمدان من إدارة الغذاء والدواء الأمريكية ل IPF ، وكلاهما يبطئ معدل التقدم بدلا من استقرار أو تحسين وظائف الرئة للمرضى3،4. وتبذل جهود بحثية كبيرة لتوضيح أسس المنتدى الحكومي الدولي المعني بالغابات وتحديد أهداف علاجية جديدة. توجد نماذج حيوانية لا تعد ولا تحصى لدراسة التسبب في التسبب في IPF ، ولكل منها مزاياهاوعيوبها 5. في حين أنه لا يوجد نموذج واحد قادر على تلخيص تعقيد الأمراض البشرية بشكل كامل ، إلا أن هذه الأساليب تقدم نظرة ثاقبة حول الآليات الجزيئية ل IPF ويمكن أن تكمل الدراسات الانتقالية.
يظل نموذج الفئران البليومايسين هو الأكثر استخداما وتميزا في الجسم الحي من IPF6. Bleomycin هو عامل ببتيد يحفز فواصل الحمض النووي أحادي ومزدوج الشريطة. بعد اكتشافه في عام 1962 ، وجد أن البليومايسين فعال في علاج عدد من أنواع السرطان ، بما في ذلك أورام الخصية والأورام اللمفاوية ، ولكن استخدامه كان محدودا بسبب الالتهاب الرئوي المعتمد على الجرعة والتليف الرئوي الناتجعن ذلك 7،8. يتم تلخيص هذه السمية الرئوية في الفئران. عند تناوله بجرعة واحدة ، بعد مرحلة التهابية أولية ، يمكن رؤية التليف بدءا من اليوم الخامس ، ويبلغ ذروته في الأيام 14-219،10،11 (الشكل 1). يحدث الحل التلقائي بعد حوالي 6 أسابيع ، على الرغم من أنه يمكن تحقيق التغيرات الليفية الدائمة مع الجرعات المتكررة12. نظرا للطبيعة العابرة والالتهابية ، هناك بعض العيوب المتأصلة في نموذج البيوميسين13 ، ومع ذلك فهو يوفر نظاما سريعا وقويا وقابلا للتكرار للبدء في الإجابة على بعض الفجوات الرئيسية في فهم مجالنا ل ILD ويسمح للمحققين بمقارنة النتائج على مدى العقود الخمسة الماضية. تشمل طرق التثبيت الأخرى نماذج الأسبست والفئران السيليكا ، والتي تقدم دورات زمنية مماثلة (الأيام 14-28) 6،14،15،16. ومع ذلك ، فإن هذه النماذج تولد نمطا نسيجيا أكثر اتساقا مع التهاب الرئة من IPF وتتطلب استخدام الجسيمات المحمولة جوا ، مما يستلزم معالجة دقيقة. بدلا من ذلك ، توجد نماذج حيوانية تستخدم التعبير الجيني المعدل المدفوع بالظهارة ، مثل سموم الخناق و TGF-β1. تلخص هذه الإصابة بالخلايا الظهارية السنخية غير الالتهابية من النوع 2 التي شوهدت في IPF ، ولكنها تستغرق وقتا أطول قليلا (21-30 د) وتتطلب استخدام متخصصة يجب عكسها في أي نماذج معدلة وراثيا موجودة ذات أهمية. أخيرا ، ثبت أن الإفراط في التعبير عن السيتوكينات بوساطة الغدانية ، بما في ذلك TGF-β1 و IL-β1 و TNF-α ، يحفز التليف الرئوي في القوارض ، عادة بحلول اليوم 1417،18،19. تسمح نماذج الإفراط في التعبير عن السيتوكين هذه بالتوصيل المريح داخل الأنف ، على الرغم من أنها تتطلب تنقية ومعالجة دقيقة.
توجد طرق متعددة لتوصيل البليومايسين ، بما في ذلك الطرق داخل القصبة الهوائية (IT) ، داخل الأنف ، داخل الصفاق ، تحت الجلد ، والطرقالوريدية 6. توصيل تكنولوجيا المعلومات هو الطريقة الأكثر شيوعا ، حيث يتضمن تقليديا إما التنبيب الرغامي أو فغر القصبة الهوائية الجراحي20 ، وكلاهما يتطلب تخديرا عميقا وبراعة تقنية ويرتبطان بالمراضة والوفيات في الفترة المحيطة بالجراحة. في الآونة الأخيرة ، ثبت أن تقنية الشفط الفموي البلعومي (OA) فعالة بنفس القدر من تكنولوجيا المعلومات ، مع آثار جانبية أقل بكثير وطريق أسهل للولادة14،21،22،23،24،25،26. هنا ، نقدم بروتوكولا مرئيا مفصلا لطريقة الزراعة العضوية لتوصيل البيوميسين إلى رئة الفئران ونسلط الضوء على العديد من التطبيقات النهائية المحتملة لقياس البيانات الكمي.
Protocol
أجريت الدراسات التي أجريت على الموصوفة في هذه التجارب بموجب بروتوكولات (ARC-2021-025 ، ARC-2010-039) المعتمدة من قبل لجنة أبحاث بجامعة كاليفورنيا في لوس أنجلوس (ARC) واللجنة المؤسسية لرعاية واستخدامه (IACUC). تم الحفاظ على الامتثال الكامل لجميع اللوائح والسياسات الحكومية والفيدرالية المتعلقة باستخدام المختبر. تم إيواء في مرفق رعاية بجامعة كاليفورنيا في لوس أنجلوس ورعايتها من قبل الموظفين المهرة في قسم المختبرات وطب بجامعة كاليفورنيا في لوس أنجلوس (DLAM) في ظل ظروف خالية من مسببات الأمراض. تم الحصول على الفئران من النوع البري C57BL / 6 تجاريا وسمح لها بالتأقلم لمدة 14 يوما على الأقل. تم استخدام ذكور الفئران التي تتراوح أعمارها بين 8-12 أسبوعا في هذه الدراسات ، بمتوسط وزن الجسم 20-25 جم. يمكن أيضا استخدام إناث الفئران ، على الرغم من أنه من المهم أن تطابق بين الجنسين والعمر عبر المجموعات والظروفالتجريبية 27. التفاصيل التجارية للحيوانات والكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. إعطاء البلعوم الفموي للبليومايسين
- تحضير البيوميسين
ملاحظة: استخدم البليومايسين الصيدلاني لضمان الاتساق وقابلية التكاثر بين والتجارب. جرعة البليومايسين بوحدات الدواء لكل كيلوغرام (U / كجم) ، وليس ملليغرام (ملغ) لكل كيلوغرام.- قم بإذابة مسحوق البليومايسين في PBS معقم من الدرجة الصيدلانية بتركيز مخزون 10 U / mL. يجب تحضير Bleomycin تحت غطاء كيميائي باستخدام احتياطات العلاج الكيميائي المناسبة. قم بتخزين الكميات عند -20 درجة مئوية لمدة تصل إلى 6 أشهر.
- تحضير تركيز العمل النهائي. تعتمد الجرعة على الوزن (0.5-3 U / kg) ، ويتم إجراء التعديلات حسب الضرورة اعتمادا على البليومايسين المستخدم والغرض من التجربة (على سبيل المثال ، البقاء على قيد الحياة أو الجرعات المميتة).
- اضبط الحجم النهائي للإدارة حسب الحاجة. بالنسبة لهذه الدراسات ، قم بتخفيف البلومايسين إلى 0.375 وحدة / مل ، وهو ما يعادل 50 ميكرولتر لفأر 25 جم ، مما ينتج عنه تركيز عمل نهائي يبلغ 0.75 وحدة / كجم.
2. تحريض التخدير
- تحضير كوكتيل التخدير عن طريق تخفيف الكيتامين والزيلازين في PBS إلى تركيزات عمل تبلغ 10 مجم / مل و 1 مجم / مل ، على التوالي. قم بتنفيذ هذه الخطوة في ظل ظروف معقمة باستخدام كواشف صيدلانية ووفقا للبروتوكولات المعتمدة مؤسسيا.
- يجب تطبيق 10 ميكرولتر من الكوكتيل لكل جرام من وزن جسم (تركيز العمل: الكيتامين 100 ملغم/كغ، زيليازين 10 ملغ/كغ) عن طريق الحقن داخل الصفاق باستخدام إبرة 27.5 جم وحقنة سعة 1 مل.
- تأكد من تخدير الماوس بشكل صحيح وعدم الاستجابة للمنبهات الضارة ، مثل قرص إصبع القدم. يجب رؤية التأثيرات في غضون 5 دقائق. إذا كنت لا تزال مستجيبة، فقم بإعطاء كيتامين / زيلازين إضافي بزيادات قدرها 20 ميكرولتر حتى يتم تحقيق المستوى المطلوب من التخدير. ضع مرهم للعيون لمنع جفاف العين أثناء التخدير.
ملاحظة: يفضل الكيتامين على التخدير والمهدئات المحقونة الأخرى نظرا لآثاره الجانبية المواتية. له تأثيرات ضئيلة على ديناميكا الدم ، بما في ذلك معدل ضربات القلب ومعدل التنفس. يمكن استخدام الأيزوفلوران المستنشق كعامل مخدر بديل. في هذه الدراسات ، يفضل استخدام الكيتامين / الزيلازين لأنه يؤدي إلى تخدير طويل الأمد والحد الأدنى من السعال أو ارتجاع البليومايسين بعد تناوله.
- تأكد من تخدير الماوس بشكل صحيح وعدم الاستجابة للمنبهات الضارة ، مثل قرص إصبع القدم. يجب رؤية التأثيرات في غضون 5 دقائق. إذا كنت لا تزال مستجيبة، فقم بإعطاء كيتامين / زيلازين إضافي بزيادات قدرها 20 ميكرولتر حتى يتم تحقيق المستوى المطلوب من التخدير. ضع مرهم للعيون لمنع جفاف العين أثناء التخدير.
3. إدارة البلعوم الفموي
- بمجرد تخديره بشكل صحيح ، قم بتعليق الماوس على المنصة الإجرائية بزاوية 60 درجة -80 درجة عن طريق تعليقه بواسطة القواطع الأمامية لفتح البلعوم الفموي بشكل فعال (الشكل 2 أ).
- سد الممر الأنفي بمشبك الأوعية الدموية الدقيقة الناعم ، مما يجبر الفأر على التنفس من خلال البلعوم الفموي.
- اسحب اللسان من البلعوم الفموي باستخدام الملقط.
- باستخدام ماصة متدرجة ذات طرف كعب كعب ، ضع برفق الحجم المطلوب من البليونيسين ، أو التحكم في المحلول الملحي ، في الجزء الخلفي من البلعوم الفموي. تأكد من أن فقاعة السائل مرئية بشكل كبير (الشكل 2 ب).
- استمر في تثبيت اللسان في مكانه حتى يشتاح المحلول. يجب أن يكون هذا واضحا بشكل واضح ومسموع في كثير من الأحيان.
ملاحظة: إذا كان يستنشق المحلول بسرعة ، فقد يكون التصور في الجزء الخلفي من البلعوم الفموي عابرا ، في غضون ثوان قليلة. بغض النظر ، إذا نجح ، فسيظهر تغييرا مفاجئا وعابرا في نمط تنفسه ، ويأخذ نفسا سريعا وضحلا. قد يحدث فقاعات في السائل ، مما يشير أيضا إلى أن السائل قد دخل بنجاح إلى الجهاز التنفسي السفلي. قد يحدث أيضا السعال العرضي. عادة ما يكون هذا حجما ضئيلا من محلول البيوميسين ويجب ألا يؤثر على النتائج التجريبية ، مما يسمح للحيوان بالبقاء مدرجا في الدراسة. تجنب الجرعات المتكررة ، لأنها تزيد من خطر الاختناق وتغير الجرعات النهائية القائمة على الوزن. - بعد تأكيد الشفط ، قم بإزالة مشبك الأنف بعناية.
- راقب في وضع التعليق لمدة 15-30 ثانية لضمان عدم ارتجاع محلول البيوميسين ، ثم أعده إلى قفصه.
ملاحظة: يوصى بحجم أقصى يبلغ 50 ميكرولتر لتقليل خطر الاختناق. اعتمادا على الجرعة المطلوبة من البيوميسين ووزن الفأر ، اضبط تركيز محلول البيوميسين حسب الحاجة. عند ممارسة هذه التقنية ، استخدم صبغة مائية مثل إيفانز الأزرق للتأكد من أن المحلول يتم إعطاؤه في الجهاز التنفسي السفلي ، بدلا من المعدة14.
4. استعادة
- بعد العلاج ، ضع على جانبه في قفصه مع وسادة تدفئة تحته للحفاظ على الحياد الحراري.
- راقب الفئران حتى تصبح واعية تماما. يستغرق هذا عادة 1-2 ساعة ، اعتمادا على جرعة الكيتامين المستخدمة والتمثيل الغذائي للحيوان. اضغط برفق على أصابع القدم وحافظ على حرارة لتسهيل الاستيقاظ.
- راقب الفئران سريريا على أساس يومي بحثا عن التغيرات في وزن الجسم والاستمالة ومستوى النشاط وحالة الجهاز التنفسي. على غرار طرق توصيل البليومايسين الأخرى ، قد تشهد خسارة كبيرة في الوزن خلال الدورة التدريبية التي تتراوح من 14 إلى 21 يوما ، وهي علامة رئيسية على فعالية النموذج.
- بموجب بروتوكولات ARC و IACUC ، قتل إذا تجاوز فقدان الوزن 20٪ من الوزن الأولي للحيوان. يعتمد انتشار وشدة فقدان الوزن على جرعة البليومايسين المستخدمة والتركيبة السكانية للفئران (انظر أعلاه).
5. حصاد الأنسجة ومعالجتها وتحليل نقطة النهاية
- اعتمادا على السؤال التجريبي والنقطة الزمنية المطلوبة ، قم بالقتل الرحيم للفئران باتباع بروتوكولات IACUC وحصاد رئتيها28 في الوقت المناسب. غالبا ما تكون تأثيرات البليومايسين واضحة بصريا بشكل صارخ مقارنة بالسيطرة ، مما يشير إلى الإعطاء الناجح. في هذه الدراسات ، تم التضحية بالفئران في الأيام 7 و 14 و 21.
- بالنسبة لعلم الأنسجة ، قم بتشريح الرئتين في كتلة وإصلاحها في 4٪ PFA لمدة 24 ساعة. استمر في تضمين البارافين ، والتقسيم ، والهيماتوكسيلين واليوزين (H & E) ، و / أو تلطيخ ماسون ثلاثي الألوان كما هو موضح سابقا28،29،30.
- لقياس الكولاجين ، قم بتجانس الرئة اليمنى واستخدم مجموعة متوفرة تجاريا (انظر جدول المواد) لقياس محتوى هيدروكسي برولين كما هو موضح سابقا31.
- لقياس التدفق الخلوي ، هضم الرئة اليمنى باستخدام مفكك الأنسجة ومحلول إنزيمي للحصول على تعليق أحادي الخلية. قم بإجراء تلطيخ وتحليل قياس التدفق الخلوي كما هو موضح سابقا32،33،34.
النتائج
يلخص البروتوكول الموصوف هنا مسار الشفط الفموي البلعومي للإعطاء في نموذج الفئران bleomycin. في هذه التجارب ، عولجت إما ببليومايسين (0.75 وحدة / كجم من وزن الجسم) أو PBS للتحكم في الوهم. في الأيام 7 و 14 و 21 ، تم قتل الفئران رحيما ، واستئصال رئتيها ، وإصلاح الأنسجة ، كما هو موضح سابقا35. تم تقييم التليف باستخدام تلطيخ الهيماتوكسيلين واليوزين (H & E). بحلول اليوم 7 ، يمكن رؤية التغير الليفي في الحاجز السنخي ، جنبا إلى جنب مع التغيرات الالتهابية / الليفية الصغيرة ، مقارنة بالتحكم في PBS (الشكل 3 أ ، ب). بحلول اليوم 14 ، شوهدت مناطق أكبر وأكثر تماسكا من التليف ، مع تدمير كبير للبنية السنخية الطبيعية (الشكل 3 ج). في اليوم 21 ، تظل هذه التغيرات الليفية الكبيرة (الشكل 3 د). تم قياس هذه التغييرات النسيجية المرضية باستخدام نظام تسجيل أشكروفتالمعدل 29 ، والذي أظهر درجة مماثلة من التليف بين اليومين 14 و 21 (الشكل 3E).
بينما يظل علم الأنسجة المرضي هو المعيار الذهبي ، يمكن إجراء فحوصات إضافية لتحديد التغيرات الليفية والالتهابية التي يسببها البليومايسين بشكل موضوعي. لتأكيد نتائج H & E ، تم إجراء فحوصات هيدروكسي برولين في اليوم 1431 ، والتي أظهرت زيادة في الكمية الإجمالية لمحتوى الكولاجين مع البليومايسين (الشكل 4 أ). بالإضافة إلى ذلك ، تم عزل الحمض النووي الريبي من مجانسات الرئة الكاملة في اليوم 14 ، وأظهر تفاعل البوليميراز المتسلسل الكمي (qPCR) تنظيم الجينات الليفية Col3a1 و Tgfb مع البليومايسين (الشكل 4 ب). لتوصيف التغيرات المناعية التي يسببها البليومايسين الفموي البلعومي ، تم إجراء قياس التدفق الخلوي كما هو موضح سابقا32،33،34 (الشكل 4 ج). استجابة لالتهاب المفاصل البليومايسين ، لوحظ تسلل قوي للخلايا النخاعية إلى رئة الفئران ، بما في ذلك البلاعم الخلالية (IM) ، والبلاعم السنخية المشتقة من الخلايا الأحادية (MoAM) ، والعدلات (الشكل 4 د). توضح هذه البيانات أن تقنية الشفط الفموي البلعومي هي منهجية آمنة ومريحة وقابلة للتكرار لإحداث التليف الرئوي مع البيوميسين في نموذج الفئران.
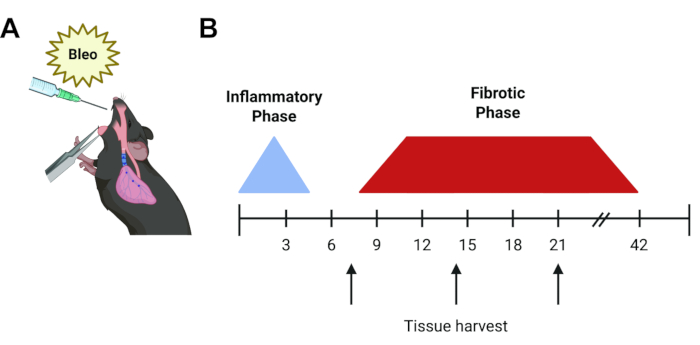
الشكل 1: الجدول الزمني للبروتوكول التجريبي. (أ) التمثيل الرسومي للإعطاء الفموي البلعومي للبليومايسين في رئة الفئران. (ب) الجدول الزمني لمسار مرض البيوميسين. تستمر المرحلة الالتهابية الأولية لمدة 48-72 ساعة وتتبعها مرحلة ليفية تبدأ في اليوم 7 تقريبا ، والتي تحل بعد 6 أسابيع للحقن الفردية. تمثل الأسهم أوقات حصاد الأنسجة المحتملة الشائعة (اليوم 7 أو 14 أو 21) اعتمادا على سؤال التجربة والمقايسات المستخدمة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تخطيطي للإعطاء الفموي البلعومي بليومايسين. (أ) بمجرد تخديره بشكل صحيح ، يتم تعليق الفأر بواسطة القواطع الأمامية عند 60 درجة -80 درجة على منصة آمنة. (ب) يتم انسداد الممر الأنفي باستخدام مشبك الأوعية الدموية الدقيقة غير المسنن. يتم سحب اللسان من البلعوم الفموي ، وباستخدام ماصة متدرجة بطرف كعب كعب ، يتم إعطاء محلول البيوميسين ، أو التحكم في PBS ، في الجزء الخلفي من البلعوم الفموي. يجب أن تكون فقاعة السوائل مرئية مرئية حتى يتم استنشاقها في الجهاز التنفسي السفلي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
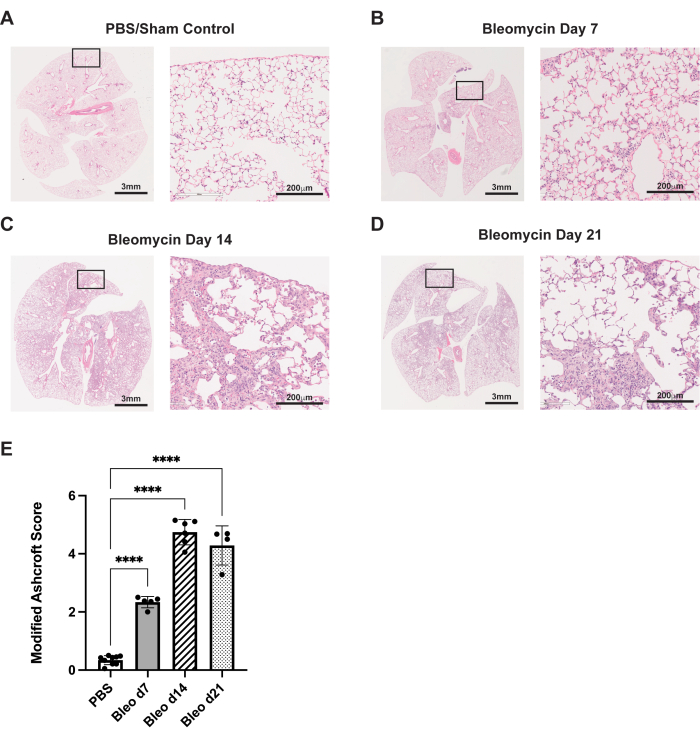
الشكل 3: يؤدي إعطاء البيوميسين عن طريق الشفط الفموي البلعومي إلى تغيرات نسيجية ليفية قوية. تم علاج الفئران من النوع البري C57Bl / 6 بجرعة لمرة واحدة إما من البليومايسين (0.75U / كجم) أو PBS في اليوم 0. (أ) تظهر الضوابط الشامية أنسجة الرئة الطبيعية. (ب-د) ينتج عن البليومايسين تليف تدريجي وتشوه معماري لرئة الفئران. (ه) تسجيل أشكروفت المعدل للعينات النسيجية. تمثل أشرطة الخطأ الانحراف المعياري. ص < 0.0001 كما هو محدد بواسطة ANOVA أحادي الاتجاه. تمثل الصور ثلاث تجارب مستقلة أجريت على 4-8 لكل مجموعة. الصور 20x (اليمين، أشرطة المقياس: 200 ميكرومتر) مأخوذة من الإدخالات المحددة في الصور 1x (على اليسار، أشرطة المقياس: 3 مم). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: القياس الكمي للتغيرات الليفية والالتهابات التي يسببها البليومايسين. (أ) تم حصاد الرئتين في اليوم 14 من الفئران من النوع البري C57Bl / 6 التي عولجت إما ببليومايسين (0.75U / كجم) أو PBS. تم إجراء فحوصات هيدروكسي برولين ، وتم قياس محتوى الكولاجين (ملغ لكل رئة أيمن). (ب) تم عزل الحمض النووي الريبي من أنسجة الرئة المتجانسة للحيوانات المعالجة ببليومايسين أو PBS في اليوم 14. تم إجراء تفاعل البوليميراز المتسلسل الكمي لقياس مستوى نسخ Col1a1 و Tgfb . تم حساب تغيير الطية المتعلق بمجموعة التحكم في PBS باستخدام طريقة 2CP في إشارة إلى جين التدبير المنزلي الداخلي. (ج) استراتيجية تدفق البوابات لمجموعات النخاع في رئة الفئران. (د) القياس الكمي لمجموعات النخاع في رئة الفئران في اليوم 14 ، استجابة للبلومايسين. تمثل البيانات ثلاث تجارب مستقلة مع 4-8 لكل مجموعة لكل تجربة. تمثل أشرطة الخطأ الانحراف المعياري. * ص < 0.05 ، ** ص < 0.01 ، *** ص < 0.001 ، **** ص < 0.0001 كما هو محدد من خلال اختبار t للطالب غير المقترن (هيدروكسي برولين و qPCR) أو ANOVA ثنائي الاتجاه. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يتم توفير بروتوكول فيديو مفصل حول تقنية الشفط الفموي البلعومي لإدارة البيوميسين لاستخدامه في نموذج الفئران للتليف الرئوي. بالإضافة إلى ذلك ، نسلط الضوء على التطبيقات النهائية المحتملة لتحديد التغيرات الليفية والالتهابية التي يسببها التهاب المفاصل البليومايسين.
في حين أنه لا يوجد واحد يلخص بشكل كامل تعقيد المرض البشري ، فقد تم استخدام نموذج فأر البليومايسين على مدى العقود الخمسة الماضية ولا يزال الأكثر تطبيقا على نطاق واسع لدراسة التسبب في IPF36. هناك العديد من الطرق لإعطاء البليومايسين في نماذج القوارض ، بما في ذلك عن طريق القصبة الهوائية (IT) ، داخل الأنف (IN) ، الوريدي (IV) ، داخل الصفاق ، والحقن تحت الجلد6. في حين أن الإدارة الوريدية تحاكي عن كثب آلية الالتهاب الرئوي الناجم عن البليومايسين في البشر ، فإن طريق تكنولوجيا المعلومات يستخدم بشكل أكثر شيوعا. يتحقق التليف بجرعة واحدة ، دون سمية جهازية مرتبطة بجرعات أعلى ، وهو أكثر فعالية من حيث التكلفة8. يتطلب توصيل تكنولوجيا المعلومات إما التنبيب الرغامي أو الاستكشاف الجراحي في الرقبة وفغر القصبة الهوائية ، وكلاهما يتطلب مستويات عميقة من التخدير ودرجة عالية من المهارة الإجرائية ، مع حمل مراضة ووفيات كبيرة مرتبطة ب ما وراء الإجراءات. تعد إدارة IN بديلا معقولا لتكنولوجيا المعلومات ، ومع ذلك ، فقد ثبت أنها تسبب أنماطا أكثر تنوعا من التوزيع وإصابة الرئة37،38. شهد نهج الزراعة العضوية استخداما متزايدا ويمثل بديلا أكثر قابلية للتكرار على ما يبدو لتوصيل البليومايسين وعوامل التليف الأخرى إلى رئة الفئران14،21،22،23،24،25،26. في الآونة الأخيرة ، تمت مقارنة طرق الزراعة العضوية وتكنولوجيا المعلومات لإدارة البليومايسين مباشرة في الفئران ، مما يدل على فعالية متساوية وإصابة ليفية متجانسة ، مع تقليل الوفيات المحيطة بالإجراء21. وبالمثل ، في هذه الدراسة ، لم يمت أي فئران عند إعطاء الزراعة العضوية (البيانات غير معروضة) ، مما يؤكد الملف الفني والأخلاقي الإيجابي لهذه الطريقة.
تعتمد درجة التليف وتوقيت الإصابة الناجمة عن البليومايسين على عدة عوامل. بعد تقطير البليومايسين في رئة الفئران ، تحدث فترة التهابية أولية لإصابة الرئة الحادة ، تليها مرحلة تكاثر ليفي تبدأ بعد 5-7 أيام10. بشكل روتيني ، يتم تقييم نقاط نهاية المرض بين الأيام 14-21 ، عندما يتحقق التليف المستمر (الشكل 3 ج). ركزت الدراسة الحالية على اليوم 14 ، والذي ثبت أنه الوقت الأمثل لقياس معايير تليف الرئة ، حيث طورت تليافا واسع النطاق ، مع تقلبات أقل ومعدل وفيات أقل مما شوهد في اليوم 2111. بعد جرعة واحدة ، لوحظ أن التليف يزول تلقائيا بعد حوالي 6 أسابيع في الفئران. لالتقاط اللارجعة التي شوهدت مع العديد من أشكال ILD في البشر ، طور الباحثون نماذج جرعات متكررة لتحقيق تغيرات ليفية دائمة في نماذج الفئران9،12.
أظهرت الدراسات السابقة تباينا في السلالة فيما يتعلق بشدة التليف الذي تم تحقيقه بجرعة واحدة من البليومايسين ، حيث كانت الفئران C57Bl / 6 "مستجيبة عالية" ، و DBA / 2 والفئران السويسرية "مستجيبون متوسطون" ، والفئران BALB / c هي "مستجيبين منخفضين" 39. علاوة على ذلك ، يؤثر عمر وجنس الفئران المستخدمة أيضا على درجة الالتهاب والتليف. أظهرت الفئران الأكبر سنا (52-54 أسبوعا) زيادة في التليف مقارنة بالفئران الأصغر سنا (8-12 أسبوعا) ، ويبدو أن ذكور الفئران أكثر عرضة للإصابة بالبلومايسين ، بشكل عام ، من نظيراتها الإناث9،40. تشير هذه الملاحظات إلى عوامل وراثية أساسية تؤثر على الاستجابة الالتهابية والتئام الجروح ، ويجب على الباحثين مطابقة الفئران بين العمر والجنس عند اختبار السبل العلاجية المحتملة ، كما اقترحت الإرشادات الرسمية الأخيرة للجمعية الأمريكية لأمراض الصدر (ATS) 25.
يمثل Bleomycin نموذجا التهابيا للتليف. ينتج عن الضرر الظهاري الأولي الناجم عن البليومايسين إنتاج السيتوكين العابر والحاد وتجنيد العدلات في الرئة41،42. لا يتميز IPF نفسه سريريا بنمط ظاهري مناعي قوي ، بصرف النظر عن التفاقم الحاد ، على الرغم من أن الأنواع الأخرى من مرض النسيج الضام ، مثل تلك المرتبطة بمرض النسيج الضام (CTD-ILD) ، مدفوعة بشكل أكثر وضوحا بخلل التنظيم المناعي43،44،45. لذلك ، اعتمادا على الفرضية التي يتم اختبارها ، قد يختار الباحثون دراسة التدخلات التي تعترض محاور المرض في نقاط زمنية مبكرة أو لاحقة. علاوة على ذلك ، يوصى بالنظر في نموذج ثان للتحقق من صحة النتائج الرئيسية عند فحص العلاجات قبل السريرية ، مثل السيليكا ، أو الإفراط في التعبير عن الفيروسات الغدية TGF-β1 ، أو التلف الظهاري الناجم عن الخناق ، أو نماذج الفئران المتوافقة مع البشر5،17،46،47،48.
في الختام ، تمثل تقنية الشفط الفموي البلعومي بديلا قويا وقابلا للتكرار وقابلا للترجمة وآمنا لتوصيل بليومايسين داخل القصبة الهوائية للحث على التليف في رئة الفئران.
Disclosures
لا يوجد تضارب في المصالح بين المؤلفين.
Acknowledgements
تم دعم هذا العمل من خلال منحة التدريب المؤسسي للبحث البحثي (T32) من المعاهد الوطنية للصحة روث إل كيرششتاين (NRSA) الممنوحة إلى RW (2T32HL072752-16). يود المؤلفون أيضا أن يشعروا بتقدير دعم مركز صحة الرئة التابع لمؤسسة شاول وجويس براندمان.
Materials
| Name | Company | Catalog Number | Comments |
| anti-mouse CD45, Brlliant Violet 605 | BioLegend | 103155 | |
| anti-mouse CD64, AlexaFluor 647 | BioLegend | 139322 | |
| anti-mouse Ly6G, AlexaFluor 700 | BioLegend | 127622 | |
| anti-mouse MerTK, PE/Cy7 | BioLegend | 151522 | |
| anti-mouse SiglecF, PE | BD Biosciences | 552126 | |
| BD Luer-Stub Adaptors | Fisher Scientific | 13-681-21 | |
| Bleomycin | McKesson | 1129996 | From NorthStar Rx 16714088601 |
| Endotracheal Mouse Intubation Kit | Kent Scientific | ETI-MSE | |
| Fixable Live/Dead Violet | Thermo | L34955 | |
| FlowJo v10 Software | FlowJo | ||
| gentleMACS Dissociator | Miltenyi | 130-093-235 | |
| Hydroxyproline Assay Kit | Sigma | MAK463 | |
| Liberase TM | Roche | 5401127001 | |
| Moria Vessel Clamp | Fine Science Tools | 18350-11 | |
| Mouse Endotracheal Intubation Kit | Kent | ETI-MSE | |
| Stepper Pipette | Dymax | TI15469 | |
| Wildtype C57BL/6 mice | Jackson Laboratories | JAX, stain #000664 |
References
- Martinez, F. J., et al. Idiopathic pulmonary fibrosis. Nat Rev Dis Primers. 3, 17074(2017).
- Hutchinson, J., Fogarty, A., Hubbard, R., Mckeever, T. Global incidence and mortality of idiopathic pulmonary fibrosis: A systematic review. Eur Respir J. 46 (3), 795-806 (2015).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E. Jr, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Moore, B. B., Hogaboam, C. M. Murine models of pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 294 (2), L152-L160 (2008).
- Umezawa, H. Chemistry and mechanism of action of bleomycin. Fed Proc. 33 (11), 2296-2302 (1974).
- Muggia, F. M., Louie, A. C., Sikic, B. I. Pulmonary toxicity of antitumor agents. Cancer Treat Rev. 10 (4), 221-243 (1983).
- Degryse, A. L., et al. Repetitive intratracheal bleomycin models several features of idiopathic pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 299 (4), L442-L452 (2010).
- Kolb, P., et al. The importance of interventional timing in the bleomycin model of pulmonary fibrosis. Eur Respir J. 55 (6), 1901105(2020).
- Izbicki, G., Segel, M. J., Christensen, T. G., Conner, M. W., Breuer, R. Time course of bleomycin-induced lung fibrosis. Int J Exp Pathol. 83 (3), 111-119 (2002).
- Chung, M. P., et al. Role of repeated lung injury and genetic background in bleomycin-induced fibrosis. Am J Respir Cell Mol Biol. 29 (3 Pt 1), 375-380 (2003).
- Moeller, A., Ask, K., Warburton, D., Gauldie, J., Kolb, M. The bleomycin animal model: A useful tool to investigate treatment options for idiopathic pulmonary fibrosis. Int J Biochem Cell Biol. 40 (3), 362-382 (2008).
- Lakatos, H. F., et al. Oropharyngeal aspiration of a silica suspension produces a superior model of silicosis in the mouse when compared to intratracheal instillation. Exp Lung Res. 32 (5), 181-199 (2006).
- Sanchez, V. C., Pietruska, J. R., Miselis, N. R., Hurt, R. H., Kane, A. B. Biopersistence and potential adverse health impacts of fibrous nanomaterials: What have we learned from asbestos. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 1 (5), 511-529 (2009).
- Barbarin, V., et al. The role of pro- and anti-inflammatory responses in silica-induced lung fibrosis. Respir Res. 6 (1), 112(2005).
- Sime, P. J., Xing, Z., Graham, F. L., Csaky, K. G., Gauldie, J. Adenovector-mediated gene transfer of active transforming growth factor-beta1 induces prolonged severe fibrosis in rat lung. J Clin Invest. 100 (4), 768-776 (1997).
- Kolb, M., Margetts, P. J., Anthony, D. C., Pitossi, F., Gauldie, J. Transient expression of il-1beta induces acute lung injury and chronic repair leading to pulmonary fibrosis. J Clin Invest. 107 (12), 1529-1536 (2001).
- Sime, P. J., et al. Transfer of tumor necrosis factor-alpha to rat lung induces severe pulmonary inflammation and patchy interstitial fibrogenesis with induction of transforming growth factor-beta1 and myofibroblasts. Am J Pathol. 153 (3), 825-832 (1998).
- Orlando, F., et al. Induction of mouse lung injury by endotracheal injection of bleomycin. J Vis Exp. (146), e58922(2019).
- Barbayianni, I., Ninou, I., Tzouvelekis, A., Aidinis, V. Bleomycin revisited: A direct comparison of the intratracheal micro-spraying and the oropharyngeal aspiration routes of bleomycin administration in mice. Front Med (Lausanne). 5, 269(2018).
- Egger, C., et al. Administration of bleomycin via the oropharyngeal aspiration route leads to sustained lung fibrosis in mice and rats as quantified by ute-MRI and histology. PLoS One. 8 (5), e63432(2013).
- Bale, S., Sunkoju, M., Reddy, S. S., Swamy, V., Godugu, C. Oropharyngeal aspiration of bleomycin: An alternative experimental model of pulmonary fibrosis developed in Swiss mice. Indian J Pharmacol. 48 (6), 643-648 (2016).
- Scotton, C. J., et al. Increased local expression of coagulation factor x contributes to the fibrotic response in human and murine lung injury. J Clin Invest. 119 (9), 2550-2563 (2009).
- Jenkins, R. G., et al. An official American Thoracic Society Workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Rao, G. V., et al. Efficacy of a technique for exposing the mouse lung to particles aspirated from the pharynx. J Toxicol Environ Health A. 66 (15), 1441-1452 (2003).
- Redente, E. F., et al. Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis. Am J Physiol Lung Cell Mol Physiol. 301 (4), L510-L518 (2011).
- Birjandi, S. Z., et al. CD4(+)CD25(hi)Foxp3(+) cells exacerbate bleomycin-induced pulmonary fibrosis. Am J Pathol. 186 (8), 2008-2020 (2016).
- Hubner, R. H., et al. Standardized quantification of pulmonary fibrosis in histological samples. Biotechniques. 44 (4), 507-514 (2008).
- Joshi, N., et al. A spatially restricted fibrotic niche in pulmonary fibrosis is sustained by M-CSF/M-CSFR signalling in monocyte-derived alveolar macrophages. Eur Respir J. 55 (1), 1900646(2020).
- Belperio, J. A., et al. Interaction of IL-13 and C10 in the pathogenesis of bleomycin-induced pulmonary fibrosis. Am J Respir Cell Mol Biol. 27 (4), 419-427 (2002).
- Misharin, A. V., Morales-Nebreda, L., Mutlu, G. M., Budinger, G. R., Perlman, H. Flow cytometric analysis of macrophages and dendritic cell subsets in the mouse lung. Am J Respir Cell Mol Biol. 49 (4), 503-510 (2013).
- Misharin, A. V., et al. Monocyte-derived alveolar macrophages drive lung fibrosis and persist in the lung over the life span. J Exp Med. 214 (8), 2387-2404 (2017).
- Tighe, R. M., et al. Improving the quality and reproducibility of flow cytometry in the lung. An official American Thoracic Society workshop report. Am J Respir Cell Mol Biol. 61 (2), 150-161 (2019).
- Limjunyawong, N., Mock, J., Mitzner, W. Instillation and fixation methods useful in mouse lung cancer research. J Vis Exp. 102, e52964(2015).
- Adamson, I. Y., Bowden, D. H. The pathogenesis of bleomycin-induced pulmonary fibrosis in mice. Am J Pathol. 77 (2), 185-197 (1974).
- Southam, D. S., Dolovich, M., O'byrne, P. M., Inman, M. D. Distribution of intranasal instillations in mice: Effects of volume, time, body position, and anesthesia. Am J Physiol Lung Cell Mol Physiol. 282 (4), L833-L839 (2002).
- Foster, W. M., Walters, D. M., Longphre, M., Macri, K., Miller, L. M. Methodology for the measurement of mucociliary function in the mouse by scintigraphy. J Appl Physiol (1985). 90 (3), 1111-1117 (2001).
- Schrier, D. J., Kunkel, R. G., Phan, S. H. The role of strain variation in murine bleomycin-induced pulmonary fibrosis. Am Rev Respir Dis. 127 (1), 63-66 (1983).
- Hecker, L., et al. Reversal of persistent fibrosis in aging by targeting nox4-nrf2 redox imbalance. Sci Transl Med. 6 (231), 231ra247(2014).
- Chaudhary, N. I., Schnapp, A., Park, J. E. Pharmacologic differentiation of inflammation and fibrosis in the rat bleomycin model. Am J Respir Crit Care Med. 173 (7), 769-776 (2006).
- Kim, S. N., et al. Dose-response effects of bleomycin on inflammation and pulmonary fibrosis in mice. Toxicol Res. 26 (3), 217-222 (2010).
- Wells, A. U., Denton, C. P. Interstitial lung disease in connective tissue disease--mechanisms and management. Nat Rev Rheumatol. 10 (12), 728-739 (2014).
- Idiopathic Pulmonary Fibrosis Clinical Research Network. Prednisone, azathioprine, and n-acetylcysteine for pulmonary fibrosis. N Engl J Med. 366 (21), 1968-1977 (2012).
- Raghu, G., et al. An official ATS/ERS/JRS/ALAT statement: Idiopathic pulmonary fibrosis: Evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 183 (6), 788-824 (2011).
- Kolb, M., et al. Differences in the fibrogenic response after transfer of active transforming growth factor-beta1 gene to lungs of "fibrosis-prone" and "fibrosis-resistant" mouse strains. Am J Respir Cell Mol Biol. 27 (2), 141-150 (2002).
- Sisson, T. H., et al. Targeted injury of type ii alveolar epithelial cells induces pulmonary fibrosis. Am J Respir Crit Care Med. 181 (3), 254-263 (2010).
- Pierce, E. M., et al. Therapeutic targeting of cc ligand 21 or cc chemokine receptor 7 abrogates pulmonary fibrosis induced by the adoptive transfer of human pulmonary fibroblasts to immunodeficient mice. Am J Pathol. 170 (4), 1152-1164 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved