Method Article
肺線維症のマウスモデルにおけるブレオマイシンの中咽頭投与
要約
このプロトコルは、肺線維症のブレオマイシンマウスモデルで使用するための中咽頭吸引技術を示しています。
要約
間質性肺疾患 (ILD) は、肺実質の進行性でしばしば不可逆的な瘢痕化を特徴とする幅広い障害を表し、最も一般的なのは特発性肺線維症 (IPF) です。IPFの動物モデルはいくつか開発されており、ブレオマイシンマウスモデルが最も広く使用されています。ブレオマイシンは、肺胞上皮にDNA損傷を誘発し、ヒトに急性肺損傷および肺線維症を引き起こすことが知られている化学療法です。IPFのげっ歯類モデルは、さまざまな方法でブレオマイシンを投与しますが、最も一般的なのは気管内投与(IT)です。最近、中咽頭吸引(OA)技術は、複数の線維化剤に対してITと同等に有効であることが示されています。副作用はかなり少なく、送達経路も容易です。このプロトコルでは、マウスの肺へのブレオマイシン送達のOA法を詳しく説明し、データ定量化のための潜在的なダウンストリームアプリケーションの例を強調しています。この方法論は、IPFの根底にある分子メカニズムを研究するために、この広く使用されている動物モデルを利用するための簡単、迅速、安全な方法を提供します。
概要
間質性肺疾患(ILD)とは、肺胞腔、間質、および遠位気道の進行性および不可逆的な瘢痕形成を特徴とする不均一な疾患のグループを指します1。特発性肺線維症 (IPF) は、ILD の最も一般的な形態であり、生存期間の中央値は約 3 年です2。IPFは最終的には末期疾患であり、同所性肺移植は一部の患者に対するサルベージ療法です。現在、IPFにはFDAが承認した2つの治療法がありますが、どちらも患者の肺機能を安定させたり改善したりするのではなく、進行速度を遅らせるだけです3,4。IPFの基盤を解明し、新しい治療標的を特定するために、重要な研究努力が進行中です。IPFの病因を研究するための動物モデルは無数に存在し、それぞれに長所と短所があります5。1つのモデルでヒトの疾患の複雑さを完全に再現することはできませんが、これらのアプローチはIPFの分子メカニズムに関する重要な洞察を提供し、トランスレーショナル研究を補完することができます。
ブレオマイシンマウスモデルは、IPF6の最も広く使用され、十分に特徴付けられたin vivoモデルであり続けています。ブレオマイシンは、一本鎖および二本鎖DNAの切断を誘導するペプチド剤です。1962年の発見後、ブレオマイシンは精巣腫瘍やリンパ腫を含む多くの癌の治療に有効であることがわかりましたが、用量依存性肺炎とその結果生じる肺線維症によってその使用は制限されています7,8。この肺毒性はマウスで再現されます。.単回投与で投与すると、最初の炎症段階に続いて、線維化は5日目近くから始まり、14〜21日目にピークに達する9,10,11(図1)に見られます。自発的な解消は約6週間後に起こりますが、反復投与12で永続的な線維性変化を達成することができます。一過性で炎症性の性質を考えると、ブレオマイシンモデル13にはいくつかの固有の欠点がありますが、ILDに関する私たちの分野の理解における主要なギャップのいくつかに答え始めるための迅速で堅牢で再現性のあるシステムを提供し、研究者が過去50年間の結果を比較できるようにします。他の設置アプローチには、アスベスト症およびシリカマウスモデルが含まれ、これらは同様の時間コース(14-28日目)を提供する6,14,15,16。ただし、これらのモデルは、IPF よりもじん肺と一致する組織学的パターンを生成し、空気中の微粒子を使用する必要があるため、慎重な取り扱いが必要です。あるいは、ジフテリア毒素やTGF-β1など、上皮主導の導入遺伝子発現を利用する動物モデルが存在します。これらは、IPFに見られる非炎症性肺胞2型上皮細胞損傷を再現していますが、わずかに時間がかかり(21-30d)、既存の目的のトランスジェニックモデルに戻し交配する必要がある特殊な動物を使用する必要があります。最後に、TGF-β1、IL-β1、およびTNF-αを含むサイトカインのアデノウイルス媒介性過剰発現は、通常14日目までにげっ歯類の肺線維症を誘発することが示されています17,18,19。これらのサイトカイン過剰発現モデルは、便利な鼻腔内送達を可能にしますが、慎重な精製と取り扱いが必要です。
ブレオマイシンの送達には、気管内(IT)、鼻腔内、腹腔内、皮下、静脈内経路6など、複数のアプローチが存在します。ITデリバリーは最も一般的な方法であり、伝統的に気管内挿管または外科的気管切開術のいずれかを含む 20、どちらも深い鎮静、技術的な巧妙さを必要とし、周術期の罹患率と死亡率に関連しています。最近、中咽頭吸引(OA)技術は、ITと同等に効果的であることが示されています。副作用はかなり少なく、送達経路は簡単です14,21,22,23,24,25,26。ここでは、マウスの肺へのブレオマイシン送達のOA法の詳細な視覚的プロトコルを提示し、データ定量化のためのさまざまな潜在的なダウンストリームアプリケーションに焦点を当てます。
プロトコル
これらの実験で報告された動物実験は、UCLA動物研究委員会(ARC)および動物実験委員会(IACUC)によって承認されたプロトコル(ARC-2021-025、ARC-2010-039)の下で実施されました。実験動物の使用に関するすべての州および連邦の規制および方針への完全な遵守が維持されました。動物はUCLAの動物管理施設に収容され、UCLA研究所および動物医学部門(DLAM)の熟練したスタッフによって病原体のない条件下で世話をされました。野生型C57BL/6マウスを市販で入手し、少なくとも14日間順応させた。これらの研究には、8〜12週齢の雄マウスを使用し、平均体重は20〜25gでした。雌マウスも使用され得るが、実験グループや条件間で動物の性別と年齢を一致させることが重要である27。この研究で使用された動物、試薬、および機器の商業的な詳細は、 資料表に記載されています。
1. ブレオマイシンの中咽頭投与
- ブレオマイシンの調製
注:医薬品グレードのブレオマイシンを使用して、動物と実験間の一貫性と再現性を確保してください。ブレオマイシンは、ミリグラム(mg)/kgではなく、動物1kgあたりの薬物単位(U / kg)で投与します。.- ブレオマイシン粉末を無菌の医薬品グレードのPBSに10 U/mLのストック濃度で溶解します。ブレオマイシンは、適切な化学療法の予防措置を使用して、化学フードの下で調製する必要があります。.アリコートは-20°Cで最大6か月間保管してください。
- 最終的な作業集中を準備します。用量は重量(0.5-3 U / kg)に基づいており、使用されるブレオマイシンと実験の目的(生存または致死量など)に応じて必要に応じて調整が行われます。
- 必要に応じて、最終的な管理量を調整します。これらの研究では、ブレオマイシンを0.375 U/mL(25 gマウスで50 μLに相当)に希釈し、最終使用濃度を0.75 U/kgにします。
2.麻酔の導入
- PBSでケタミンとキシラジンをそれぞれ10 mg / mLと1 mg / mLの使用濃度に希釈して、麻酔カクテルを準備します。.このステップは、無菌条件下で医薬品グレードの試薬を使用し、施設で承認されたプロトコルに従って実施します。
- 動物の体重1グラムあたり10μLのカクテル(使用濃度:ケタミン100 mg / kg、キシラジン10 mg / kg)を、27.5 Gの針と1 mLの注射器を使用した腹腔内注射で投与します。.
- マウスが適切に麻酔され、つま先のつま先つまみなどの有害な刺激に反応しないことを確認してください。効果は5分以内に確認できるはずです。それでも反応性がある場合は、必要な麻酔レベルに達するまで、追加のケタミン/キシラジンを20μL刻みで投与します。.麻酔下での目の乾燥を防ぐために、眼科用軟膏を塗布します。
注:ケタミンは、その好ましい副作用プロファイルのために、他の注射された麻酔薬や鎮静剤よりも好まれます。心拍数や呼吸数などの血行動態への影響は最小限に抑えられています。吸入イソフルランは、代替麻酔薬として使用できます。.これらの研究では、ケタミン/キシラジンは、投与後の鎮静が長くなり、咳やブレオマイシンの逆流が最小限に抑えられるため、好まれます。
- マウスが適切に麻酔され、つま先のつま先つまみなどの有害な刺激に反応しないことを確認してください。効果は5分以内に確認できるはずです。それでも反応性がある場合は、必要な麻酔レベルに達するまで、追加のケタミン/キシラジンを20μL刻みで投与します。.麻酔下での目の乾燥を防ぐために、眼科用軟膏を塗布します。
3. 中咽頭投与
- 適切に鎮静したら、マウスを前切歯で吊るして、マウスを手技プラットフォームに60°〜80°の角度で吊り下げて、中咽頭を効果的に開きます(図2A)。
- 滑らかな微小血管クランプで鼻腔を閉塞し、マウスに中咽頭から呼吸を強制します。
- 鉗子を使用して舌を中咽頭から引っ込めます。
- スタブリュールスタブチップ付きのステッパーピペットを使用して、必要な量のブレオマイシンまたは生理食塩水コントロールを中咽頭の後ろに静かに置きます。液体の泡が目立って見えることを確認します(図2B)。
- 動物が溶液を吸引するまで、舌を所定の位置に保持し続けます。これは、目に見えて、そしてしばしば聴覚的に明らかであるべきです。
注:動物が溶液を迅速に吸引すると、中咽頭の後ろでの視覚化が数秒以内に一過性になる可能性があります。いずれにせよ、成功すれば、動物は呼吸パターンに急激で一時的な変化を示し、急速で浅い呼吸をします。体液の泡立ちが発生する可能性があり、さらに体液が下気道に正常に侵入したことを示しています。時折咳をすることもあります。これは通常、ブレオマイシン溶液のごくわずかな量であり、実験結果に影響を与えないはずであり、動物を研究に含め続けることができます。繰り返しの投与は、窒息のリスクを高め、最終的な体重ベースの投与を変更するため、避けてください。. - 誤嚥が確認されたら、ノーズクリップを慎重に取り外します。
- ブレオマイシン溶液の逆流がないことを確認してから、動物を吊り下げ位置で15〜30秒間観察し、ケージに戻します。.
注:窒息のリスクを最小限に抑えるために、最大容量は50μLをお勧めします。ブレオマイシンの所望用量とマウスの体重に応じて、必要に応じてブレオマイシン溶液の濃度を調整します。.この技術を実践するときは、溶液が胃14ではなく下気道に投与されることを確認するために、エバンスブルーのような水性染料を使用する。
4. 動物の回復
- 治療後、動物をケージに横向きに置き、その下に加熱パッドを付けて熱中性を維持します。
- マウスが完全に意識を持つまでマウスを監視します。これには、使用するケタミンの投与量と動物の代謝にもよりますが、通常は1〜2時間かかります。つま先をそっとつまみ、動物を優体温に保ち、目覚めを促進します。
- マウスの体重、グルーミング、活動レベル、呼吸状態の変化について、毎日臨床的にモニタリングします。ブレオマイシンの他の送達方法と同様に、動物は14〜21日間のコースで大幅な体重減少を経験する可能性があり、これはモデルの有効性の重要なマーカーです。
- ARCおよびIACUCプロトコルでは、体重減少が動物の開始体重の20%を超える場合は、動物を安楽死させます。体重減少の有病率と重症度は、使用されるブレオマイシンの用量とマウスの人口統計によって異なります(上記を参照)。.
5. 組織採取、プロセシング、エンドポイント分析
- 実験上の問題と所望の時点に応じて、IACUCプロトコルに従ってマウスを安楽死させ、適切な時期に彼らの肺28 を採取する。ブレオマイシンの効果は、対照と比較して視覚的に大きく明らかであることが多く、投与が成功したことを示しています。これらの研究では、マウスを7日目、14日目、21日目に犠牲にしました。
- 組織学では、肺を一括して解剖し、4% PFA に 24 時間固定します。パラフィン包埋、切片化、ヘマトキシリンおよびエオシン(H&E)、および/または前述の28,29,30のMassonのトリクローム染色を進める。
- コラーゲン測定のためには、右肺を均質化し、市販のキット( 材料の表を参照)を使用して、前述のようにヒドロキシプロリン含有量を測定する31。
- フローサイトメトリーでは、組織解離剤と酵素溶液を用いて右肺を消化し、単一細胞懸濁液を得ます。前述の32,33,34のようにフローサイトメトリー染色および分析を行う。
結果
ここで説明するプロトコルは、ブレオマイシンマウスモデルにおける中咽頭吸引の投与経路をまとめたものです。これらの実験では、動物をブレオマイシン(0.75U / kg体重)または偽制御のためのPBSのいずれかで処理しました。7日目、14日目、21日目に、マウスを安楽死させ、肺を摘出し、組織を固定した(前述の通りである35)。線維症は、ヘマトキシリンおよびエオシン(H&E)組織学的染色を使用して評価されました。7日目までに、PBSコントロールと比較して、肺胞中隔の線維性変化が、小さな炎症性/線維性変化とともに見られます(図3A、B)。14日目までに、線維症のより大きく、より合流した領域が見られ、正常な肺胞構造が著しく破壊されます(図3C)。21日目には、これらの顕著な線維性変化が残っています(図3D)。これらの病理組織学的変化は、修正されたアシュクロフトスコアリングシステム29を使用して定量化され、14日目と21日目の間に同様の程度の線維化が示されました(図3E)。
組織病理学は依然としてゴールドスタンダードですが、ブレオマイシンによって誘発される線維性および炎症性の変化を客観的に定量するために、追加のアッセイを実施することができます。H&E所見を確認するために、ヒドロキシプロリンアッセイを14日目31日目に実施し、ブレオマイシンによるコラーゲン含有量の総量の増加を示しました(図4A)。さらに、14日目に全肺ホモジネートからRNAを単離し、定量的ポリメラーゼ連鎖反応(qPCR)により、ブレオマイシンによるプロフィブロッシャシー遺伝子Col3a1およびTgfbのアップレギュレーションが実証されました(図4B)。中咽頭ブレオマイシンによって誘導される免疫変化を特徴付けるために、フローサイトメトリーを前述の32,33,34(図4C)に従って行った。OAブレオマイシンに応答して、間質性マクロファージ(IM)、単球由来肺胞マクロファージ(MoAM)、好中球などの骨髄細胞のマウス肺への強力な浸潤が観察されます(図4D)。これらのデータは、中咽頭吸引技術が、マウス動物モデルでブレオマイシンによる肺線維症を誘発するための安全で便利で再現性のある方法論であることを示しています。
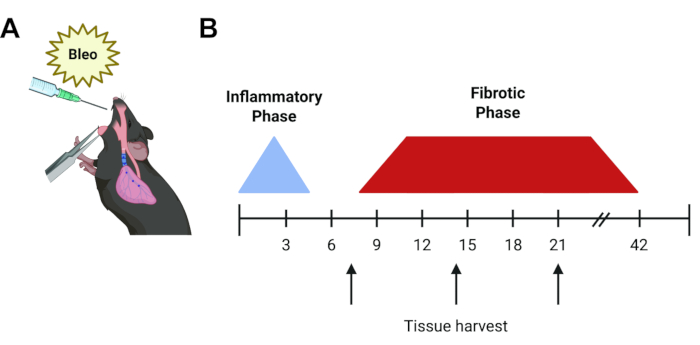
図1:実験プロトコルのタイムライン(A)マウスの肺へのブレオマイシンの中咽頭投与のグラフィック表現。(B)ブレオマイシン疾患の経過のタイムライン。最初の炎症期は48〜72時間続き、その後、約7日目に線維化期が始まり、個々の注射で6週間後に解消します。矢印は、実験の質問と利用されているアッセイに応じて、一般的な潜在的な組織採取時間(7日目、14日目、または21日目)を表しています。この図の拡大版を表示するには、ここをクリックしてください。

図2:ブレオマイシン中咽頭投与の概略図 (A)適切に鎮静された後、マウスは安全なプラットフォーム上で前切歯によって60°〜80°につながれます。(B)鼻腔は、鋸歯状のない微小血管クランプを使用して閉塞します。舌を中咽頭から引っ込め、スタブ ルール スタブ チップを備えたステッパー ピペットを使用して、ブレオマイシン溶液 (PBS コントロール) を中咽頭の後ろに投与します。目に見える液体の泡は、下気道に吸引されるまで見えるはずです。 この図の拡大版を表示するには、ここをクリックしてください。
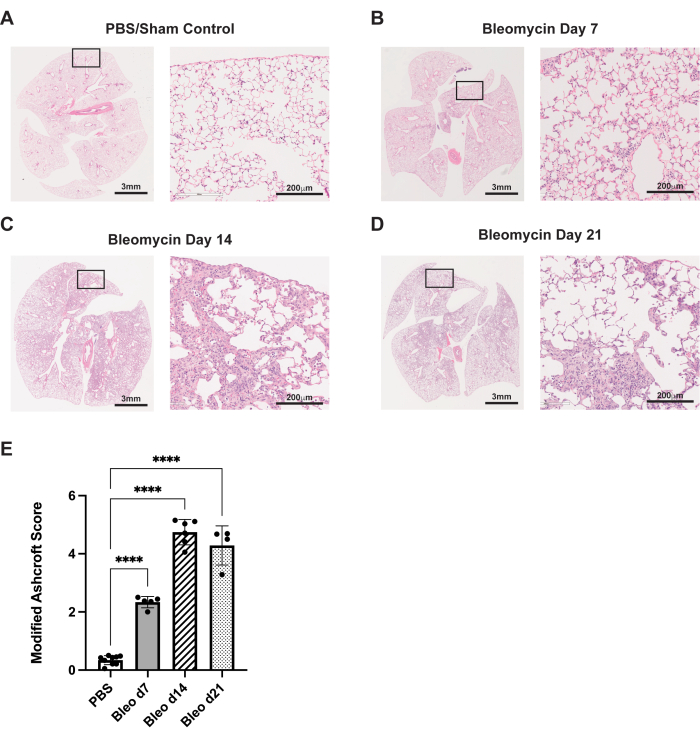
図3:中咽頭吸引によるブレオマイシン投与は、強力な線維性組織学的変化をもたらします。野生型C57Bl/6マウスを0日目にブレオマイシン(0.75U/kg)またはPBSのいずれかを1回投与しました。(A)偽のコントロールは、正常な肺組織型を示しています。(B-D)ブレオマイシンは、進行性の線維症とマウスの肺の構造的歪みを引き起こします。(E)組織学的サンプルの修正アシュクロフトスコアリング。エラーバーは標準偏差を表します。p < 0.0001 で、一元配置分散分析で決定されます。画像は、グループごとに4〜8匹の動物で行われた3つの独立した実験の代表的なものです。20x画像(右、スケールバー:200μm)は、1x画像(左、スケールバー:3mm)の指定されたインセットからのものです。この図の拡大版を表示するには、ここをクリックしてください。

図4:ブレオマイシンによって誘発される線維化促進性および炎症誘発性変化の定量化 (A)ブレオマイシン(0.75U/kg)またはPBSのいずれかで処理した野生型C57Bl/6マウスから14日目に肺を採取した。ヒドロキシプロリンアッセイを実施し、コラーゲン含有量を測定しました(右肺あたりのmg)。(B)RNAは、14日目にブレオマイシンまたはPBS処理動物の均質化された肺組織から単離されました。 Col1a1 および Tgfb 転写産物のレベルを測定するために、定量的PCRを実施しました。PBS対照群に関連する倍率変化は、内部ハウスキーピング遺伝子を参照して2CP 法を用いて計算した。(C)マウス肺における骨髄系集団のフローゲーティング戦略。(D)ブレオマイシンに応答した14日目のマウス肺の骨髄系集団の定量化。データは、1グループあたり4〜8匹の動物を用いた3つの独立した実験を代表するものです。エラーバーは標準偏差を表します。*p < 0.05、**p < 0.01、***p < 0.001、****p < 0.0001 対応のないスチューデントの t 検定 (ヒドロキシプロリンと qPCR) または二元配置分散分析によって決定されます。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
詳細なビデオプロトコルは、肺線維症のマウスモデルで使用するためのブレオマイシンを投与するための中咽頭吸引技術について提供されています。さらに、OAブレオマイシンによって誘発される線維性および炎症性の変化を定量化するための潜在的なダウンストリームアプリケーションに焦点を当てています。
ヒトの疾患の複雑さを完全に再現する動物は1匹もいませんが、ブレオマイシンマウスモデルは過去50年間に使用されており、IPF36の病因を研究するために最も広く実施されています。げっ歯類モデルでブレオマイシンを投与するには、気管内注射(IT)、鼻腔内注射(IN)、静脈内注射(IV)、腹腔内注射、皮下注射など、さまざまな方法があります6。IV投与は、ヒトのブレオマイシン誘発性肺炎のメカニズムにより密接に模倣されていますが、ITルートがより一般的に使用されます。線維化は、高用量に関連する全身毒性なしに、単回投与で達成され、より費用対効果が高い8。ITデリバリーには、気管内挿管または頸部への外科的探索と気管切開のいずれかが必要であり、どちらも深いレベルの鎮静と高度な処置スキルを必要としますが、関連する周術期の罹患率と死亡率は高くなります。IN投与はITの合理的な代替手段ですが、分布と肺損傷のより変動するパターンを引き起こすことが示されています37,38。OAアプローチは、使用が増加しており、ブレオマイシンおよび他の線維化剤のマウス肺への送達のより再現性の高い代替品である14,21,22,23,24,25,26を表している。最近、ブレオマイシン投与のOA経路とIT経路がマウスで直接比較され、周術期の死亡率を最小限に抑えながら、同等の有効性と均質な線維性損傷が示されました21。同様に、この研究では、OA投与時に死亡したマウスはなく(データは示されていません)、この方法の良好な技術的および倫理的プロファイルが強調されています。
ブレオマイシンによって引き起こされる線維症の程度と損傷のタイミングは、いくつかの要因によって異なります。.マウスの肺へのブレオマイシン注入後、急性肺損傷の初期炎症期が発生し、続いて5〜7日後に始まる線維増殖期が続きます10。通常、疾患のエンドポイントは、持続的な線維化が達成される14〜21日目に評価されます(図3C)。本研究は、動物が広範な線維症を発症したため、肺線維症パラメータを測定するのに最適な時間であることが示されています14日目に焦点を当てました。これは、21日目11に見られるよりも変動が少なく、死亡率も低いです。単回投与後、線維化はマウスで約6週間後に自然に解消することが注目されています。.ヒトの多くの形態のILDで見られる不可逆性を捉えるために、研究者はマウスモデル9,12の永続的な線維性変化を達成するための反復投与モデルを開発しました。
以前の研究では、ブレオマイシンの単回投与で達成される線維化の重症度に関して、C57Bl/6マウスが「高応答者」、DBA/2およびスイスマウスが「中間応答者」、BALB/cマウスが「低応答者」であることが示されている39。さらに、使用するマウスの年齢と性別も、炎症と線維化の程度に影響を与えます。高齢のマウス(52〜54週)は、若いマウス(8〜12週)よりも線維化の増加を示し、雄のマウスは、一般的に、雌のマウスよりもブレオマイシンに感受しやすいようです9,40。これらの観察は、炎症反応および創傷治癒反応に影響を与える根本的な遺伝的要因を示唆しており、研究者は、最近の米国胸部学会(ATS)の公式ガイドライン25で示唆されているように、潜在的な治療手段をテストする際にマウスの年齢と性別を一致させる必要があります。
ブレオマイシンは、線維症の炎症モデルです。ブレオマイシンによって誘発される最初の上皮損傷は、肺41,42における一過性の急性サイトカイン産生および好中球動員をもたらす。IPF自体は、急性増悪を除けば、強い免疫学的表現型によって臨床的に特徴付けられるわけではないが、結合組織病(CTD-ILD)に関連するILDなどの他のタイプのILDは、免疫調節不全によってより明確に引き起こされている43,44,45。したがって、検証される仮説に応じて、研究者は、より早いまたは後の時点で疾患軸を遮断する介入を研究することを選択できます。さらに、シリカ、TGF-β1アデノウイルスの過剰発現、ジフテリア誘発性上皮損傷、またはヒト化マウスモデル5,17,46,47,48などの前臨床試験をスクリーニングする際に重要な所見を検証するために、2番目のモデルを検討することをお勧めします。
結論として、中咽頭吸引技術は、マウスの肺に線維症を誘発するためのブレオマイシンの気管内送達に代わる、堅牢で再現性があり、翻訳可能で安全な代替手段です。
開示事項
著者には利益相反はありません。
謝辞
この研究は、NIH Ruth L. Kirchstein National Research Service Award (NRSA) Institutional Research Training Grant (T32) が RW (2T32HL072752-16) に授与されたものです。著者はまた、Saul and Joyce Brandman Foundation Lung Health Centerの支援に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| anti-mouse CD45, Brlliant Violet 605 | BioLegend | 103155 | |
| anti-mouse CD64, AlexaFluor 647 | BioLegend | 139322 | |
| anti-mouse Ly6G, AlexaFluor 700 | BioLegend | 127622 | |
| anti-mouse MerTK, PE/Cy7 | BioLegend | 151522 | |
| anti-mouse SiglecF, PE | BD Biosciences | 552126 | |
| BD Luer-Stub Adaptors | Fisher Scientific | 13-681-21 | |
| Bleomycin | McKesson | 1129996 | From NorthStar Rx 16714088601 |
| Endotracheal Mouse Intubation Kit | Kent Scientific | ETI-MSE | |
| Fixable Live/Dead Violet | Thermo | L34955 | |
| FlowJo v10 Software | FlowJo | ||
| gentleMACS Dissociator | Miltenyi | 130-093-235 | |
| Hydroxyproline Assay Kit | Sigma | MAK463 | |
| Liberase TM | Roche | 5401127001 | |
| Moria Vessel Clamp | Fine Science Tools | 18350-11 | |
| Mouse Endotracheal Intubation Kit | Kent | ETI-MSE | |
| Stepper Pipette | Dymax | TI15469 | |
| Wildtype C57BL/6 mice | Jackson Laboratories | JAX, stain #000664 |
参考文献
- Martinez, F. J., et al. Idiopathic pulmonary fibrosis. Nat Rev Dis Primers. 3, 17074 (2017).
- Hutchinson, J., Fogarty, A., Hubbard, R., Mckeever, T. Global incidence and mortality of idiopathic pulmonary fibrosis: A systematic review. Eur Respir J. 46 (3), 795-806 (2015).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E., et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Moore, B. B., Hogaboam, C. M. Murine models of pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 294 (2), L152-L160 (2008).
- Umezawa, H. Chemistry and mechanism of action of bleomycin. Fed Proc. 33 (11), 2296-2302 (1974).
- Muggia, F. M., Louie, A. C., Sikic, B. I. Pulmonary toxicity of antitumor agents. Cancer Treat Rev. 10 (4), 221-243 (1983).
- Degryse, A. L., et al. Repetitive intratracheal bleomycin models several features of idiopathic pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 299 (4), L442-L452 (2010).
- Kolb, P., et al. The importance of interventional timing in the bleomycin model of pulmonary fibrosis. Eur Respir J. 55 (6), 1901105 (2020).
- Izbicki, G., Segel, M. J., Christensen, T. G., Conner, M. W., Breuer, R. Time course of bleomycin-induced lung fibrosis. Int J Exp Pathol. 83 (3), 111-119 (2002).
- Chung, M. P., et al. Role of repeated lung injury and genetic background in bleomycin-induced fibrosis. Am J Respir Cell Mol Biol. 29 (3 Pt 1), 375-380 (2003).
- Moeller, A., Ask, K., Warburton, D., Gauldie, J., Kolb, M. The bleomycin animal model: A useful tool to investigate treatment options for idiopathic pulmonary fibrosis. Int J Biochem Cell Biol. 40 (3), 362-382 (2008).
- Lakatos, H. F., et al. Oropharyngeal aspiration of a silica suspension produces a superior model of silicosis in the mouse when compared to intratracheal instillation. Exp Lung Res. 32 (5), 181-199 (2006).
- Sanchez, V. C., Pietruska, J. R., Miselis, N. R., Hurt, R. H., Kane, A. B. Biopersistence and potential adverse health impacts of fibrous nanomaterials: What have we learned from asbestos. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 1 (5), 511-529 (2009).
- Barbarin, V., et al. The role of pro- and anti-inflammatory responses in silica-induced lung fibrosis. Respir Res. 6 (1), 112 (2005).
- Sime, P. J., Xing, Z., Graham, F. L., Csaky, K. G., Gauldie, J. Adenovector-mediated gene transfer of active transforming growth factor-beta1 induces prolonged severe fibrosis in rat lung. J Clin Invest. 100 (4), 768-776 (1997).
- Kolb, M., Margetts, P. J., Anthony, D. C., Pitossi, F., Gauldie, J. Transient expression of il-1beta induces acute lung injury and chronic repair leading to pulmonary fibrosis. J Clin Invest. 107 (12), 1529-1536 (2001).
- Sime, P. J., et al. Transfer of tumor necrosis factor-alpha to rat lung induces severe pulmonary inflammation and patchy interstitial fibrogenesis with induction of transforming growth factor-beta1 and myofibroblasts. Am J Pathol. 153 (3), 825-832 (1998).
- Orlando, F., et al. Induction of mouse lung injury by endotracheal injection of bleomycin. J Vis Exp. (146), e58922 (2019).
- Barbayianni, I., Ninou, I., Tzouvelekis, A., Aidinis, V. Bleomycin revisited: A direct comparison of the intratracheal micro-spraying and the oropharyngeal aspiration routes of bleomycin administration in mice. Front Med (Lausanne). 5, 269 (2018).
- Egger, C., et al. Administration of bleomycin via the oropharyngeal aspiration route leads to sustained lung fibrosis in mice and rats as quantified by ute-MRI and histology. PLoS One. 8 (5), e63432 (2013).
- Bale, S., Sunkoju, M., Reddy, S. S., Swamy, V., Godugu, C. Oropharyngeal aspiration of bleomycin: An alternative experimental model of pulmonary fibrosis developed in Swiss mice. Indian J Pharmacol. 48 (6), 643-648 (2016).
- Scotton, C. J., et al. Increased local expression of coagulation factor x contributes to the fibrotic response in human and murine lung injury. J Clin Invest. 119 (9), 2550-2563 (2009).
- Jenkins, R. G., et al. An official American Thoracic Society Workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Rao, G. V., et al. Efficacy of a technique for exposing the mouse lung to particles aspirated from the pharynx. J Toxicol Environ Health A. 66 (15), 1441-1452 (2003).
- Redente, E. F., et al. Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis. Am J Physiol Lung Cell Mol Physiol. 301 (4), L510-L518 (2011).
- Birjandi, S. Z., et al. CD4(+)CD25(hi)Foxp3(+) cells exacerbate bleomycin-induced pulmonary fibrosis. Am J Pathol. 186 (8), 2008-2020 (2016).
- Hubner, R. H., et al. Standardized quantification of pulmonary fibrosis in histological samples. Biotechniques. 44 (4), 507-514 (2008).
- Joshi, N., et al. A spatially restricted fibrotic niche in pulmonary fibrosis is sustained by M-CSF/M-CSFR signalling in monocyte-derived alveolar macrophages. Eur Respir J. 55 (1), 1900646 (2020).
- Belperio, J. A., et al. Interaction of IL-13 and C10 in the pathogenesis of bleomycin-induced pulmonary fibrosis. Am J Respir Cell Mol Biol. 27 (4), 419-427 (2002).
- Misharin, A. V., Morales-Nebreda, L., Mutlu, G. M., Budinger, G. R., Perlman, H. Flow cytometric analysis of macrophages and dendritic cell subsets in the mouse lung. Am J Respir Cell Mol Biol. 49 (4), 503-510 (2013).
- Misharin, A. V., et al. Monocyte-derived alveolar macrophages drive lung fibrosis and persist in the lung over the life span. J Exp Med. 214 (8), 2387-2404 (2017).
- Tighe, R. M., et al. Improving the quality and reproducibility of flow cytometry in the lung. An official American Thoracic Society workshop report. Am J Respir Cell Mol Biol. 61 (2), 150-161 (2019).
- Limjunyawong, N., Mock, J., Mitzner, W. Instillation and fixation methods useful in mouse lung cancer research. J Vis Exp. 102, e52964 (2015).
- Adamson, I. Y., Bowden, D. H. The pathogenesis of bleomycin-induced pulmonary fibrosis in mice. Am J Pathol. 77 (2), 185-197 (1974).
- Southam, D. S., Dolovich, M., O'byrne, P. M., Inman, M. D. Distribution of intranasal instillations in mice: Effects of volume, time, body position, and anesthesia. Am J Physiol Lung Cell Mol Physiol. 282 (4), L833-L839 (2002).
- Foster, W. M., Walters, D. M., Longphre, M., Macri, K., Miller, L. M. Methodology for the measurement of mucociliary function in the mouse by scintigraphy. J Appl Physiol (1985). 90 (3), 1111-1117 (2001).
- Schrier, D. J., Kunkel, R. G., Phan, S. H. The role of strain variation in murine bleomycin-induced pulmonary fibrosis. Am Rev Respir Dis. 127 (1), 63-66 (1983).
- Hecker, L., et al. Reversal of persistent fibrosis in aging by targeting nox4-nrf2 redox imbalance. Sci Transl Med. 6 (231), 231ra247 (2014).
- Chaudhary, N. I., Schnapp, A., Park, J. E. Pharmacologic differentiation of inflammation and fibrosis in the rat bleomycin model. Am J Respir Crit Care Med. 173 (7), 769-776 (2006).
- Kim, S. N., et al. Dose-response effects of bleomycin on inflammation and pulmonary fibrosis in mice. Toxicol Res. 26 (3), 217-222 (2010).
- Wells, A. U., Denton, C. P. Interstitial lung disease in connective tissue disease--mechanisms and management. Nat Rev Rheumatol. 10 (12), 728-739 (2014).
- Idiopathic Pulmonary Fibrosis Clinical Research Network. Prednisone, azathioprine, and n-acetylcysteine for pulmonary fibrosis. N Engl J Med. 366 (21), 1968-1977 (2012).
- Raghu, G., et al. An official ATS/ERS/JRS/ALAT statement: Idiopathic pulmonary fibrosis: Evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 183 (6), 788-824 (2011).
- Kolb, M., et al. Differences in the fibrogenic response after transfer of active transforming growth factor-beta1 gene to lungs of "fibrosis-prone" and "fibrosis-resistant" mouse strains. Am J Respir Cell Mol Biol. 27 (2), 141-150 (2002).
- Sisson, T. H., et al. Targeted injury of type ii alveolar epithelial cells induces pulmonary fibrosis. Am J Respir Crit Care Med. 181 (3), 254-263 (2010).
- Pierce, E. M., et al. Therapeutic targeting of cc ligand 21 or cc chemokine receptor 7 abrogates pulmonary fibrosis induced by the adoptive transfer of human pulmonary fibroblasts to immunodeficient mice. Am J Pathol. 170 (4), 1152-1164 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved