Method Article
Измерение митохондриальной функции наивных и эффекторных CD8 Т-клеток
В этой статье
Резюме
Биоэнергетика CD8 Т-клеток может быть исследована с помощью стресс-теста Мито. Эта методология может быть использована для изучения острого и хронического метаболического программирования. В этом протоколе описываются подходы к изучению взаимосвязи между биологией Т-клеточных рецепторов и биоэнергетическим анализом.
Аннотация
Понимание того, как иммунометаболизм влияет на функцию, дифференцировку и судьбу лимфоцитов, привлекло значительный интерес и внимание. Биология лимфоцитов была изучена с помощью биоэнергетического анализа и в настоящее время стала критически важным инструментом в этой области. Таким образом, мы стремились оптимизировать анализ биоэнергетического анализа, который может быть адаптирован с помощью предварительной обработки и острой инъекции для стимуляции рецепторов. В данной работе мы оценили метаболизм CD8 Т-клеток ex vivo с помощью стресс-теста Cell Mito для оценки скорости потребления кислорода и внеклеточного закисления в наивных и эффекторных CD8 Т-клетках. Антиген-специфические эффекторные CD8 Т-клетки были получены путем стимуляции ex vivo , а наивные CD8 Т-клетки были собраны из спленоцитов и выделены с помощью магнитной колонки с шариками.
Предварительная обработка выполняется в микропланшетах, и мы подробно описываем, как подготовить картриджи датчиков. Мы показываем, как инъекционные порты могут быть заполнены лекарствами для косвенного измерения метаболических способностей, а с помощью метаболических модуляторов этот протокол может быть использован для изучения специфической активности фермента. Стимуляция Т-клеточных рецепторов может быть изучена в режиме реального времени при острой инъекции и стимуляции анти-CD3/CD28 с использованием инъекционных портов. Инструментальные анализаторы используются для измерений и сбора данных, а визуализация данных осуществляется с помощью программного обеспечения для интерпретации клеточного метаболизма. Эта стратегия позволяет получить обширный объем данных о биологии иммунных клеток и митохондриальной биоэнергетике, что позволяет исследователям настраивать протокол различными способами для изучения метаболизма CD8 Т-клеток.
Введение
На судьбу и функциональность иммунных клеток существенно влияют метаболизм, окислительное потребление и анаэробное дыхание 1,2,3,4. В последнее время растет интерес к таргетной метаболической модуляции в качестве стратегии перепрограммирования или оживления судьбы CD8 Т-клеток и эффекторной функции, а также улучшения вирусного клиренса или усиления эндогенного противоопухолевого иммунитета 5,6,7,8,9. В частности, передача сигналов антигенных рецепторов через Т-клеточный рецептор (TCR) является ключевым требованием для дифференцировки CD8 Т-клеток, что приводит к нисходящей передаче сигналов и активации 10,11,12 (рис. 1). Длительное воздействие иммунологических повреждений вызывает стойкую антиген-специфическую стимуляцию TCR, что в конечном итоге приводит к хронически воспаленным состояниям, усталости Т-клеток, ремоделированию иммунного микроокружения и ускользанию от иммунитета 11,13,14,15,16,17,18,19.
Метаболизм истощенных CD8 Т-клеток принципиально отличается от метаболизма функциональных эффекторных CD8 Т-клеток 2,3,14,15,18,20. Дифференцировка Т-клеток, секреция интерферона γ (ИФНγ) и способность вспоминать частично определяются функцией митохондрий и продуктами распада β-окисления. Т-клетки IFNγ+ CD8 являются важнейшими компонентами как противоопухолевого, так и противовирусного иммунного ответа 21,22,23. Специфический метаболический поток через гликолиз и цепь переноса электронов важен для активации CD8 Т-клеток, секреции цитокинов и реакции памяти 4,11,13,15,18,24,25,26,27,28 . Оптимальные ответы, включая активацию Т-клеток и дифференцировку эффекторов, требуют скоординированного и специфического митохондриального ответа, в то время как митохондриальные дефекты и избыточные активные формы кислорода (АФК) характеризуют истощенные или дисфункциональные Т-клетки 9,29. В последнее время персистирующая стимуляция TCR CD8 Т-клеток in vitro способствует истощенной дифференцировке CD8 Т-клеток, частично индуцируя окислительный стресс и перепрограммируя окислительный метаболизм и метаболические способности, необходимые для пролиферации Т-клеток 1,2,13,20,24,29 . В целом, оси метаболического контроля являются критическими компонентами в направлении дифференцировки CD8 Т-клеток и их прогрессирования в эффекторы, память или истощенные/дисфункциональные фенотипы.
Метаболические соединения также управляют реакциями иммунных клеток, функционируя как аутокринные или паракринные сигнальные молекулы 9,30,31,32,33,34,35. Сфингозин-1-фосфат (S1P) и лизофосфатидная кислота (ЛПА) являются биоактивными и воспалительными липидами, которые сигнализируют через рецепторы, сопряженные с G-белком (GPCR), модулируя выход лимфоцитов и цитотоксичность CD8 Т-клетками36. Передача сигналов LPA через рецепторы GPCR LPA на CD8 Т-клетках перепрограммирует метаболизм на увеличение липолиза, окисления жирных кислот и утечки протонов9. В целом, биоэнергетика и метаболизм CD8 Т-клеток в значительной степени обусловлены доступностью субстрата, сигналами окружающей среды и энергетическими потребностями.
Методологии исследования метаболизма CD8 Т-клеток становятся все более важными. Стресс-тест Cell Mito обеспечивает всестороннюю оценку биоэнергетики и в настоящее время признан отличительной методикой в области иммунометаболизма и энергетики CD8 Т-клеток 9,37. Адгезивные клетки исторически использовались для анализа стресс-теста Мито38; тем не менее, растет интерес к применению этого протокола к клеткам, выращенным в суспензии, и, в частности, к использованию иммунных клеток для анализа стресс-теста Cell Mito. Здесь мы представляем подробный протокол измерения метаболической активности CD8 Т-клеток, основанный на нашей недавней публикации9. Мы подробно объясняем интродукцию CD8 Т-клеток, наивное выделение CD8 Т-клеток, подготовку к анализу и лечение с помощью протоколов как предварительной обработки, так и острых инъекций в анализе стресс-теста Cell Mito. Важно отметить, что мы сравниваем и сопоставляем несколько методов стимуляции TCR и активации CD8 Т-клеток, включая поликлональную и антиген-специфическую стимуляцию TCR.
В этом протоколе подробно описывается антиген-специфическая стимуляция с использованием трансгенных мышей OT-I (классическая трансгенная мышиная модель), для которой все Т-клетки мыши экспрессируют одни и те же гены Vα2 и Vβ5 39. Все мышиные CD8 Т-клетки OT-I содержат один и тот же TCR, специфичный против октапептида овальбумина (OVA257-264, также записывается как аминокислотная последовательность SIINFEKL или N4, широко изученный эпитоп, который при презентации главным комплексом гистосовместимости (MHC) класса I активирует цитотоксические CD8 Т-клетки39 (рисунок 1A). В целом, модель трансгенной мыши OT-I широко используется иммунологами для изучения передачи сигналов TCR и эффекторной функции антиген-специфических Т-клеток. В отличие от моноклональной активации с помощью мышиной модели OT-I, поликлональные CD8 Т-клетки могут быть получены с антителами анти-CD3/CD28 против субъединиц TCR CD3 и костимулирующей молекулы40 CD28 (рисунок 1B). Антитела к CD3/CD28 обходят антиген-специфический компонент передачи сигналов TCR для активации поликлональной популяции Т-клеток40. В конечном счете, результаты, описанные в этом отчете, сравнивают несколько методов использования стресс-теста Cell Mito для количественной оценки динамического метаболического потока в CD8 Т-клетках.
протокол
Мыши содержались в среде, свободной от патогенов, и содержались в соответствии со стандартами и правилами Комитета по институциональному уходу за животными и их использованию.
1. Генерация и размножение CD8 Т-клеток с помощью антиген-специфической стимуляции
- В первый день собирают спленоциты, полученные от мышей OT-I; затем подготовьте и активируйте их in vitro с помощью пептида SIINFEKL (4).
- Очистите пространство вытяжки, приготовьте реактивы и соберите мышиную среду. Подогрейте мышиный материал в водном или бусинном инкубаторе.
- В 6-луночный планшет налейте 7 мл мышиной среды в одну лунку, а затем еще 3 мл мышиной среды в другую лунку. После этого вставьте ситечко в лунку, содержащую 7 мл среды.
- Принесите мышь в лабораторию из вивария в переносной клетке. Перенесите мышь в пустую новую корзину и установите адаптер CO2 сверху. Усыпьте мышь сCO2 до уровня потока 2,75.
- Внимательно наблюдайте за мышью и наблюдайте за любыми признаками стресса. После последнего вдоха следите за признаками дыхания и жизни в течение не менее 1 минуты. Выключите CO2 и выполните вывих шейки матки в качестве вторичного метода эвтаназии. Затем очистите столешницу, клетку и остальную рабочую зону и отнесите мышь к капюшону.
- Препарируйте селезенку у мыши.
- Используйте 70% этанол для стерилизации оборудования для вскрытия и, положив мышь левой стороной вниз, распылите на левую сторону мыши для дезинфекции.
- С помощью чистых инструментов рассекайте, чтобы удалить кожу и выявить брюшину. Сделайте небольшой разрез через брюшину, чтобы найти селезенку, а затем иссеките селезенку. Поместите селезенку в 6-луночную пластину на ситечко.
- Очистите участок, положите тушку мыши в пакет для утилизации, а затем поместите пакет в морозильную камеру для утилизации.
- Убедитесь, что вся область чиста, и переместите 6-луночный планшет в колпак для культуры тканей для следующих шагов.
- В капюшоне для культуры тканей гомогенизируйте селезенку и ресуспендируйте клетки в одноклеточную суспензию без комков.
- Протолкните селезенку через сетчатое фильтр в лунку с 7 мл среды с помощью поршня шприца объемом 5 мл.
- Промойте ситечко и остатки салфетки, используя 3 мл среды в дополнительной лунке.
- Перенесите клеточную суспензию с помощью серологической пипетки в новую коническую пробирку объемом 10 мл.
- Центрифугируйте в течение 5 мин при 500 × г и отсасывайте надосадочную жидкость с помощью стеклянной пипетки.
- Лиз эритроцитов.
- Начните процесс лизиса эритроцитов с использованием 1 мл буфера для лизиса ACK, суспендируя клетки в буфере для лизиса ACK и инкубируя при комнатной температуре в течение 1-5 минут.
ПРИМЕЧАНИЕ: Время инкубации должно быть оптимизировано в соответствии с конкретной партией буфера для лизиса ACK для достижения максимального лизиса эритроцитов с минимальной гибелью спленоцитов. - Добавьте 10 мл среды в коническую пробирку для нейтрализации и центрифугируйте в течение 5 мин при 500 × г.
- Ресуспендируйте клетки в 50 мл среды и перенесите их в колбу Т75.
- Начните процесс лизиса эритроцитов с использованием 1 мл буфера для лизиса ACK, суспендируя клетки в буфере для лизиса ACK и инкубируя при комнатной температуре в течение 1-5 минут.
- Стимулируйте клетки пептидом SIINFEKL (N4).
- Поместите пептид SIINFEKL в капюшон для культуры тканей. Пептид SIINFEKL хранить при температуре -20 °C.
- Добавляйте SIINFEKL непосредственно в среду для достижения конечной концентрации 2 мкг/мл. Добавьте 50 мкл SIINFEKL (2 мг/мл) в 50 мл среды для достижения конечной концентрации 2 мкг/мл.
- Инкубируйте клетки при температуре 37 °C в течение 72 часов.
- Продезинфицируйте вытяжку для культуры тканей с использованием 70% этанола.
- Очистите пространство вытяжки, приготовьте реактивы и соберите мышиную среду. Подогрейте мышиный материал в водном или бусинном инкубаторе.
- На четвертый день промойте клетки, чтобы удалить пептид. С помощью свежеприготовленных сред с добавлением ИЛ-2 провести ресуспендию клеток и затем вернуть колбу в инкубатор.
- Соберите клетки из колбы для культуры тканей Т75 в коническую пробирку объемом 50 мл. Центрифугируйте и гранулируйте Т-клетки OT-I CD8, а затем удалите излишки среды с помощью аспирации. Добавьте 50 мл новой мышиной среды, содержащей 1000 Ед/мл IL-2, и перенесите ресуспендию клеток в новую колбу T75.
- Для хранения аликвоты бульона ИЛ-2 хранят в морозильной камере при температуре -80 °С. Хранение при температуре -80 °C сведет к минимуму деградацию пептидов.
- Получение расширенных антиген-специфических цитотоксических CD8 Т-клеток для анализа митохондриальной функции
- На седьмой день проводится анализ митохондриальной функции. Подготовьте антиген-специфичную Т-клетку OT-I CD8 для анализа.
- Соберите живые CD8 Т-клетки.
- Перенесите клетки из колбы для культуры тканей Т-75 в новую коническую пробирку объемом 50 мл. Затем центрифугируйте коническую пробирку в течение 5 минут при 500 × г.
- В новую коническую пробирку объемом 50 мл пипетируйте 20 мл среды с градиентом плотности (плотность = 1,077 г/мл) во время вращения клеток.
- Как только центрифугирование будет завершено, возьмите коническую пробирку и, используя 10 мл среды, снова суспендируйте клетки. Затем, очень медленно пипетируя, наложите ресуспендированные клетки поверх градиента плотности. Не нарушая градиента, центрифугируйте коническую трубку при давлении 1 300 × g в течение 20 минут при комнатной температуре с настройкой, установленной на максимальное ускорение и минимальное замедление без тормоза.
- Когда центрифугирование будет завершено, используйте пипетку P1000 для сбора среднего слоя Т-клеток. Визуализируйте клеточный слой и убедитесь, что пипетка остается над ним и не нарушает его. Перенесите собранные клетки в свежую коническую пробирку объемом 50 мл, содержащую 30 мл полной мышиной среды. Затем центрифугируйте коническую пробирку объемом 50 мл при давлении 500 × г в течение 5 минут. Когда центрифугирование завершится, отасуньте избыток надосадочной жидкости из Т-клеток CD8 OT-I. С помощью 20 мл свежей мышиной среды ресуспендируйте клетки.
- С помощью гемоцитометра подсчитайте общее количество жизнеспособных клеток. Окрасьте небольшую аликвоту клеток трипановым синим в разведении 1:4, чтобы выявить мертвые клетки.
ПРИМЕЧАНИЕ: От одной мыши OT-I можно ожидать примерно 40-60 × 10-6 клеток. - При дополнительной ступени центрифугирования промойте оставшиеся клетки еще 20 мл свежей мышиной среды. Затем с помощью микропланшета пипетируйте клетки 200 000 клеток/лунку в полной мышиной среде.
2. Генерация и экспансия полиспецифических CD8 Т-клеток посредством анти-CD3/анти-CD28 стимуляции
- В день 0 покройте 24-луночный планшет CD3. Добавьте 1 мл анти-CD3-биотина в концентрации 5 мкг/мл, разведенного в PBS, в каждую лунку 24-луночного планшета. Поместите планшет во влажный инкубатор с содержаниемCO2 5% на ночь.
- На следующий день соберите мышь и соберите спленоциты. Активируйте спленоциты in vitro с помощью анти-CD3/анти-CD28, выполнив шаги 1.1.1-1.1.5.3.
- Используя протокол разделения магнитных шариков, выделите CD8 Т-клетки.
ПРИМЕЧАНИЕ: Следите за тем, чтобы клетки содержались в холоде. В предварительно охлажденных условиях работать быстро.- Используя 40 мкл буфера MACS, ресуспендируйте ячейки с 10 000 000 клеток на 40 мкл буфера MACS. К раствору тщательно смешать 10 мкл коктейля антител к биотину с клеточным раствором, а затем инкубировать в течение 5 мин при 4 °С.
- Пока ждете, пока клетка инкубируется в холодильнике, подготовьте колонку для положительного отбора. Используйте 3 мл буфера для промывки колонны, а затем выбросьте проточные отходы.
- Через 5 мин соберите раствор клеточного антитела из холодильника и добавьте 30 мкл буфера MACS на 10 000 000 клеток, 20 мкл антибиотина, а затем инкубируйте при 4 °C еще 10 минут.
- Приготовьте новую пробирку для сбора под колонкой положительного отбора с использованием свежей конической пробирки объемом 15 мл. После завершения 10-минутной инкубации перенесите клеточную суспензию в колонку положительного отбора. В свежую коническую пробирку объемом 15 мл соберите проточные. Используя 3 мл буфера MACS, промойте колонку для сбора остаточных клеток.
ПРИМЕЧАНИЕ: Убедитесь, что клеточная суспензия находится в минимальном объеме 0,5 мл. - Повторно поместите положительно отобранные CD8 Т-клетки в 24-луночный планшет для стимуляции анти-CD3/анти-CD28.
- Центрифугируйте проточный поток при 500 × г в течение 5 минут при 4 °C. Аспирируйте избыток надосадочной жидкости и пипетируйте клетки, чтобы повторно суспендировать их в растворе. С помощью гемацитометра и трипана синего подсчитывают клетки.
ПРИМЕЧАНИЕ: Пожалуйста, ожидайте, что на одну селезенку мыши будет подсчитано ~8-10 ×10 6 живых клеток. - После подсчета клеток ресуспендируйте CD8 Т-клетки в концентрации 500 000 клеток на мл. Затем осторожно отасуньте 1 мл PBS из 24-луночного планшета, повторно заплатите подсчитанные клетки в 24-луночном планшете и добавьте 106 клеток в лунку.
- Для стимуляции клеток пипетируйте анти-CD28 в 24-луночный планшет так, чтобы конечная концентрация анти-CD28 составляла 2 мкг/мл. Чтобы перемешать ячейки, осторожно постукивайте по тарелке. Держите клетки при температуре 37 °C в течение следующих 72 часов.
- Центрифугируйте проточный поток при 500 × г в течение 5 минут при 4 °C. Аспирируйте избыток надосадочной жидкости и пипетируйте клетки, чтобы повторно суспендировать их в растворе. С помощью гемацитометра и трипана синего подсчитывают клетки.
- Используя 70% этанол, очистите вытяжку для культуры тканей.
- На 4-й день (через 72 ч) удалите клетки из анти-CD3/анти-CD28 стимуляции. Промойте клетки центрифугированием поликлональных CD8 Т-клеток. Удалите избыток надосадочной жидкости путем аспирации, а затем повторно суспендируйте клетки свежей мышиной средой с концентрацией 1000 ЕД/мл IL-2 с 10 мл среды. Переложите ресуспендированные клетки в новую 6-луночную тарелку и поместите ее в инкубатор.
ПРИМЕЧАНИЕ: 1.2.2. Для хранения аликвоты запаса ИЛ-2 можно хранить в морозильной камере при температуре -80 °С. Хранение при температуре -80 °C сведет к минимуму деградацию пептидов. - Подготовьте расширенные поликлональные эффекторные CD8 Т-клетки для анализа митохондриальной функции.
- На седьмой день подготавливают и обрабатывают поликлональные CD8 Т-клетки для проведения анализа.
- Соберите живые CD8 Т-клетки.
- Перенесите клетки из 6-луночного планшета в чистую коническую пробирку с помощью пипетки, затем центрифугируйте клетки в течение 5 мин при концентрации 500 × г.
- Выполните шаги 1.3.3.2-1.3.4.
Примечание: Примерно 10-30 миллионов живых CD8 Т-клеток можно ожидать от одной мыши C57BL/6. - Сохраните аликвоту клеток для проточной цитометрии для оценки чистоты CD8. Для проточной цитометрии окрашивайте клетки на льду в течение 20 мин красителем на выбор9.
3. Сбор наивных CD8 Т-клеток
- На седьмой день соберите спленоциты у мыши, выполнив шаги 1.1.1-1.1.5.3.
- Проводят выделение CD8 Т-клеток с использованием протокола на основе магнитных шариков, описанного в шагах 2.3-2.3.5.1.
- Пластина CD8 Т-клеток в микропланшете со скоростью 200 000 клеток/лунку в полной среде.
4. Проведите анализ митохондриальной функции
- Подготовьте материалы за день до проведения анализа митохондриальной функции.
- Увлажните картридж датчика.
- Впрыскиваем 200 мкл дистиллированной воды в каждую скважину коммунальной плиты. Поместите сенсорный блок на верхнюю часть коммунальной пластины. Убедитесь, что концы сенсорного картриджа погружены в воду, чтобы обеспечить надлежащую гидратацию. Поместите картридж датчика и рабочую пластину в инкубатор без CO2 при температуре 37 °C минимум на 10 часов.
- Приготовьте коническую пробирку объемом 50 мл с 50 мл Calbrant, поместите ее в инкубатор безCO2 и инкубируйте в течение ночи.
- За день до проведения анализа подготовьте полную свежую среду для подготовки к анализу. Всего на 50 мл готовят раствор 1 мМ пирувата, 2 мМ глутамина и 10 мМ глюкозы в исследуемой среде.
- Увлажните картридж датчика.
- Проведите анализ митохондриальной функции на следующий день.
- Удалите дистиллированную воду с подсобной плиты, смахнув ее. Регидратируйте 200 μл калибранта. Используйте Calibrant, который хранился в инкубаторе безCO2 в течение ночи. После замена сенсорного картриджа сверху на коммунальную пластину. Поместите рабочую пластину с картриджем датчика обратно в инкубатор без CO2 .
ПРИМЕЧАНИЕ: Чтобы перевернуть тарелку, быстро и стремительно переверните тарелку одним плавным движением над раковиной, чтобы дистиллированная вода быстро выпала из тарелки.
- Удалите дистиллированную воду с подсобной плиты, смахнув ее. Регидратируйте 200 μл калибранта. Используйте Calibrant, который хранился в инкубаторе безCO2 в течение ночи. После замена сенсорного картриджа сверху на коммунальную пластину. Поместите рабочую пластину с картриджем датчика обратно в инкубатор без CO2 .
- Подготовьте CD8 Т-клетки, как описано выше в разделах 1-3.
- С помощью многоканального пипета наложить 200 000 клеток на лунку, ресуспендируя 10 × 106 клеток в 4,5 мл полной среды и осаждение 90 мкл на лунку. Затем добавьте еще 90 μл назначенного фильтрующего материала на лунку во время предварительной обработки.
ПРИМЕЧАНИЕ: Если предварительная обработка отсутствует, поместите ячейки в 180 μл на лунку с конечной концентрацией 200 000 клеток на лунку. Начиная с этого момента в протоколе, храните планшет при комнатной температуре окружающей среды или в инкубаторе безCO2 . Планшет не следует помещать в инкубатор с 5% содержаниемСО2 . Обратите внимание, что итоговый объем микропланшета составит 180 μл.
- С помощью многоканального пипета наложить 200 000 клеток на лунку, ресуспендируя 10 × 106 клеток в 4,5 мл полной среды и осаждение 90 мкл на лунку. Затем добавьте еще 90 μл назначенного фильтрующего материала на лунку во время предварительной обработки.
- Подготовьте предварительные процедуры (включая добавки с липидами или другими метаболитами).
- Приготовьте предварительную обработку липидами, раскручивая лиофилизированный липид из морозильной камеры с помощью мини-центрифуги быстрого отжима. Определите желаемые концентрации для предварительной обработки и подготовьте предварительную обработку липидами до этих концентраций. Разведенный липид обработать ультразвуком в течение 30 минут непосредственно перед использованием.
- Готовьте липидные коктейли.
- Определите желаемую концентрацию липидов, которая будет использоваться в анализе функции митохондрий.
- Приготовьте липиды в концентрации, которая в 2 раза превышает желаемую концентрацию. Затем добавьте липидный раствор к имеющемуся объему в микропланшете, чтобы добиться разведения 1:2. Для этого добавьте 90 μL липидного раствора непосредственно к уже существующим 90 μL. Итоговый объем составит 180 мкл (разведение 1:2) на лунку.
ПРИМЕЧАНИЕ: В таблице 1 приведен пример схемы возможной установки и конструкции пластины. Мы предлагаем проводить анализ с 5-6 техническими репликатами, включающими как наивные, так и антиген-специфические эффекторные CD8 Т-клетки с липидными добавками и без них. Примечательно, что этот протокол разработан таким образом, чтобы избежать центрифугирования и свести к минимуму клеточные нарушения. Поскольку анализ функции митохондрий очень чувствителен к количеству клеток, снижение потери клеток имеет решающее значение. Вместо центрифугирования клетки обрабатываются с помощью щелчков, чтобы сохранить их целостность. - Пипетируйте 180 мкл готовой среды в каждый угол пластины. Поместите микропланшет с CD8 Т-клетками в инкубатор, не содержащий CO2 .
ПРИМЕЧАНИЕ: Время инкубации будет варьироваться в зависимости от желаемой продолжительности предварительной обработки. Чтобы свести к минимуму гибель клеток, мы рекомендовали максимум 4-часовую предварительную обработку CD8 Т-клеток. Чрезмерное увеличение времени предварительной обработки может привести к чрезмерной гибели клеток, что повлияет на точность результатов.
- Готовят яды и растворы для острых инъекций.
- Используя стоковые растворы, готовят разведенную форму олигомицина. Создают разведение олигомицина в 3 мл готовой среды. В конических пробирках объемом 15 мл осторожно готовьте яды и острые инъекции. Поскольку яды светочувствительны, для защиты от воздействия света приготовьте эти растворы с помощью трубок, обернутых в оловянную фольгу.
- В одной конической трубке объемом 15 мл, завернутой в оловянную фольгу, разведите олигомицин в 3 мл готовой среды так, чтобы конечная концентрация составила 2,5 мкМ после инъекции.
- Во второй конической трубке объемом 15 мл, завернутой в оловянную фольгу, разведите FCCP в 3 мл готовой среды так, чтобы конечная концентрация составила 2,0 мкМ после впрыска.
- В третьей конической трубке объемом 15 мл, обернутой оловянной фольгой, создать растворы ротенона и антимицина А в 3 мл готовой среды для достижения концентраций 0,5 мкМ для обоих токсинов после инъекции.
- Если анализ проводится с использованием дополнительных метаболических модуляторов, лекарств или стимуляторов, разведите эти агенты в полной среде. Если вы планируете использовать этомоксир или другие метаболические модуляторы и препараты, сначала проведите анализ, чтобы проверить кривую титрования и определить оптимальную концентрацию для использования. При проведении стимуляции TCR путем острой инъекции анализ может быть выполнен с использованием либо анти-CD3/анти-CD28 магнитных шариков, либо комбинации анти-CD3-биотина с анти-CD28 стрептавидином.
ПРИМЕЧАНИЕ: Дополнительные описания см. в разделе 5, в котором описан протокол стимуляции TCR с помощью острой инъекции анти-CD3/CD28.
- Извлеките картридж датчика из инкубатора, не содержащего CO2 . С помощью пластинчатых адаптеров впрыскиваем яды в сенсорный картридж. Расположите пластинчатые адаптеры так, чтобы в каждую камеру можно было специально нагружать ядами или другими острыми инъекциями.
ПРИМЕЧАНИЕ: Соблюдайте осторожность при пипетировании ядов.- Загрузите яды в порты сенсорного картриджа. Если дополнительные инъекции не выполняются, порты A-C будут загружены ядами. Пипетируйте 20 мкл олигомицина в порт А, 22 мкл FCCP в порт В, 25 мкл ротенона в порт С и 25 мкл антимицина А в порт С.
- Используя стоковые растворы, готовят разведенную форму олигомицина. Создают разведение олигомицина в 3 мл готовой среды. В конических пробирках объемом 15 мл осторожно готовьте яды и острые инъекции. Поскольку яды светочувствительны, для защиты от воздействия света приготовьте эти растворы с помощью трубок, обернутых в оловянную фольгу.
- За час до начала анализа на приборе поместите микропланшет в инкубатор, не содержащийCO2 .
- Перед запуском прибора откройте программное обеспечение и откалибруйте прибор. Выполните эту задачу за 30 минут до загрузки микропланшета в прибор, чтобы обеспечить достаточное время для калибровки.
- В программном комплексе промаркируйте скважины и ознакомьтесь со схемой закачки.
- Во время калибровки загрузите картридж датчика в прибор. Программное обеспечение предложит вам завершить инициализацию и проверку качества. Калибровка оценит pH иO2 на каждой скважине, которые либо пройдут, либо не пройдут. Прибор сообщит о результатах на экране с галочкой или буквой «X».
5. Выполнение модифицированного варианта анализа митохондриальной функции со стимуляцией TCR в отдельном эксперименте с острой инъекцией анти-CD3/CD28
ПРИМЕЧАНИЕ: Анализ митохондриальной функции может быть выполнен с помощью моделирования острого TCR с помощью двух различных подходов: 1) с использованием биотинилированных анти-CD3 + анти-CD28 + стрептавидина, описанных на шаге 5.2, или 2) анти-CD3/CD28 магнитных шариков, описанных на шаге 5.3.
- При выполнении дополнительных инъекций подготовьте анализ, как описано в предыдущем разделе 4. Модифицируйте схемы впрыска с помощью дополнительной камеры для впрыска. В этом протоколе анти-CD3/анти-CD28 загружаются в порт А картриджа датчика. Затем аналогичным образом загрузите другие порты: олигомицин в порт B, FCCP в порт C и ротенон и антимицин A в порт D.
- Подготовьте и загрузите биотинилированные компоненты анти-CD3 + анти-CD28 + стрептавидин.
- Пипетируйте 20 мкл биотинилированного анти-CD3 в концентрации 10 мкг/мл в предназначенные для этого лунки в сенсорном картридже.
- Пипетируйте 20 мкл анти-CD28 в концентрации 2 мкг/мл + стрептавидин в концентрации 20 мкг/мл в предназначенные для этого лунки в сенсорном картридже.
- Пипетируйте 20 мкл биотинилированного анти-CD3 в концентрации 10 мкг/мл + анти-CD28 в концентрации 2 мкг/мл + стрептавидин в концентрации 20 мкг/мл в специально отведенные лунки в сенсорном картридже.
- Убедитесь, что контрольные скважины подготовлены. Убедитесь, что в специально отведенных скважинах закачиваются только фильтрующие среды, только биотинилированные анти-CD3, анти-CD28 + стрептавидин и биотинилированные анти-CD3 + анти-CD28 + стрептавидин.
- Используя соотношение гранул и ячеек 1:1, подготовьте и загрузите магнитные шарики, устойчивые к CD3/CD28.
- В планшет с 200 000 ячеек на лунку пипетируйте 5 мкл магнитных шариков в предназначенные для этого лунки в сенсорном картридже.
- Подготавливайте назначенные контрольные скважины со средой только к закачке.
- Отрегулируйте объем ядов таким образом, чтобы конечные постинъекционные концентрации после введения составляли: 2,5 мкМ для олигомицина, 2,0 мкМ для FCCP и 0,5 мкМ для ротенона и антимицина А.
- Убедитесь, что схема впрыска изменена в соответствии с обновленными временными точками перед загрузкой микропланшета на прибор.
- Запрограммируйте программное обеспечение на выполнение острой стимуляции TCR в общей сложности 140 минут. В течение этого периода времени измените схему таким образом, чтобы перед введением олигомицина было измерено x10 временных точек.
Результаты
Гликолитическая и окислительная метаболические способности могут быть измерены с помощью митохондриального функционального анализа, который оценивает способности путем нацеливания на компоненты электронно-транспортной цепи в определенные моменты времени (рис. 2A). Различные схемы впрыска могут быть загружены в порты картриджа датчика для модификации традиционного анализа и оценки острой стимуляции TCR (рис. 2B, C). Количество клеток и концентрация препарата для различных типов клеток должны быть оптимизированы перед интерпретацией результатов. В этом отчете описываются условия, которые были оптимизированы для CD8 Т-клеток (рис. 3A, B) с ингибиторами цепи переноса электронов, оптимизированными для измерения емкости как наивных, так и эффекторных клеток (рис. 4A, B). Важно отметить, что этот анализ может быть модифицирован для изучения стимуляции TCR на эффекторных CD8 Т-клетках, полученных в результате антиген-специфической стимуляции или анти-CD3/CD28 стимуляции. Далее мы исследуем реакцию CD8 Т-клеток на биоактивную липидную сигнализацию, особенно с помощью лизофосфатидной кислоты или ЛФА. Мы определили, что метаболические тренды в ответ на передачу сигналов ЛПА (за 30 мин, 2 ч или за 4 ч до загрузки микропланшета в анализатор) были сходными у обоих CD8 Т-клеток, активированных антиген-специфической или поликлональной стимуляцией TCR (рис. 5A-D). Тип стимуляции TCR и механизм активации привели к тонким различиям, при которых метаболически энергетические клетки первоначально генерировались с помощью антиген-специфической активации (рисунок 5E-L).
Острая инъекция анти-CD3/CD28 в эффекторные CD8 Т-клетки может остро стимулировать TCR с помощью измерений в реальном времени. Биотинилированные анти-CD3, анти-CD28 и стрептавидин могут быть использованы в совокупности для стимуляции TCR в модели острой инъекции. В качестве отдельного метода можно проводить острые инъекции с магнитными шариками, конъюгированными с анти-CD3 и анти-CD28 в этом биоэнергетическом анализе для стимуляции TCR в режиме реального времени. Мы адаптировали модель для введения либо среды, либо биотинилированных анти-CD3, анти-CD28 + стрептавидина, либо агрегата биотинилированных анти-CD3 + анти-CD28 + стрептавидина в эффекторные OT-I CD8 Т-клетки в середине времени во время анализа (рис. 6A, B). Мы наблюдали стимуляцию анти-CD3/CD28, что приводило к увеличению как OCR, так и ECAR. Сигналы OCR и ECAR также были повышены, но не до того же уровня, что и анти-CD3/CD28, с помощью только биотинилированного анти-CD3 сигнала. Важно отметить, что мы обнаружили схожие метаболические тенденции, которые сопоставимы с острой инъекцией анти-CD3/CD28 магнитными шариками (рисунок 6C-F). В целом, эти результаты показывают с помощью различных подходов и методологий, что анализ митохондриальной функции надежен и воспроизводим для изучения иммунометаболизма лимфоцитов и, в частности, CD8 Т-клеток.

Рисунок 1: Активация Т-клеточных рецепторов с помощью антиген-специфической и поликлональной стимуляции. (A) Схема антиген-специфической сигнализации с помощью главного комплекса гистосовместимости (MHC) класса I с пептидом, связанным с рецептором Т-клеток. (B) Изображение поликлональной активации CD8 Т-клеток путем связывания субъединиц CD3 и костимулирующей молекулы CD28 с антителами против CD3/28. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
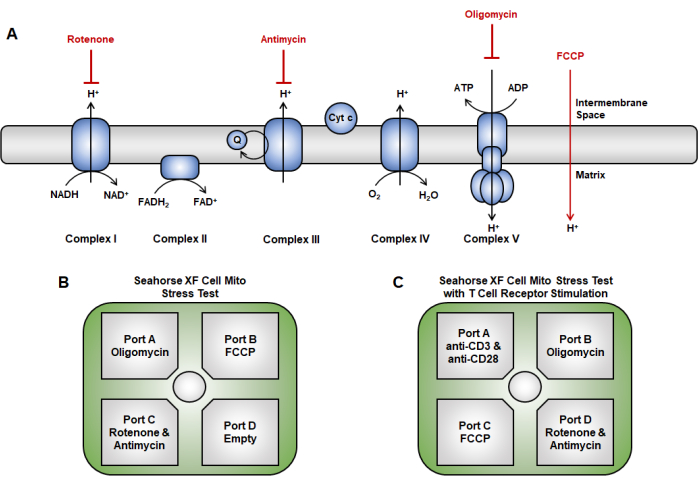
Рисунок 2: Лекарственное нацеливание на цепь переноса электронов в анализе митохондриальной функции. (A) Используемая здесь схема ингибиторов цепи переноса электронов (красная). (В,В) Для теста митохондриальной функции стратегии инъекции сенсорного картриджа следующие: (В) традиционный инъекционный подход, при котором олигомицин загружается в порт А, FCCP — в порт В, а ротенон и антимицин А — в порт С. (В) метод острой инъекции включает в себя размещение острой инъекции (анти-CD3/CD28) в порту А, олигомицина в порту В, FCCP в порту С, и ротенон и антимицин А в порту D. Сокращение: FCCP = 4-(трифторметокси) фенил) карбонгидразоноил дицианид. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Поверхностная экспрессия CD8 и CD44, жизнеспособность и метаболические различия в CD8 Т-клетках, полученные в результате анти-CD3 и анти-CD28 стимуляции после лечения ЛПА. (A) Эффекторные CD8 Т-клетки получены ex vivo путем стимуляции CD8 Т-клеток мышиного происхождения с помощью SIINFEKL (N4) и спленоцитов в качестве антигенпрезентирующих клеток или анти-CD3 и анти-CD28 на планшетах. На 4-й день IL-2 заменяет исходные стимулы, способствуя дифференцировке и пролиферации. Гомогенные эффекторные CD8 Т-клетки 7-го дня затем анализируются с помощью проточной цитометрии после культивирования in vitro . (B) Т-клетки идентифицируются путем гейтирования на основе статуса лимфоцитов и последующей экспрессии CD8+/CD44+ . Репрезентативное изображение показывает, что CD8 и CD44 не подвержены влиянию при лечении ЛПА. Эта цифра была изменена по материалам Turner et al.9. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
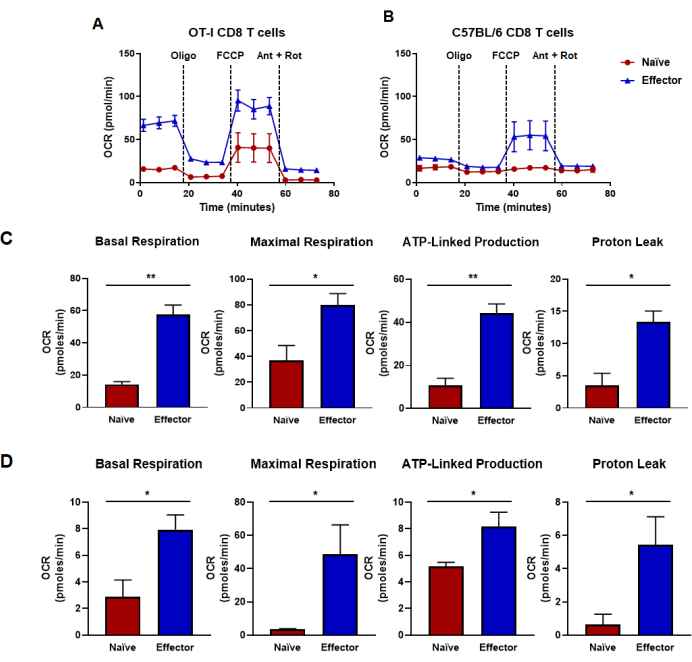
Рисунок 4: Окислительная способность определяется по норме потребления кислорода. (А,Б) Интенсивность потребления кислорода наивными и эффекторными CD8 Т-клетками, полученными в результате (A) антиген-специфической стимуляции и экспансии анти-CD8 Т-клеток OT-I или (B) анти-CD3/CD28 поликлональной стимуляции и экспансии CD8 Т-клеток у мышей дикого типа C57B/6. Олигомицин, ФКХП, антимицин А и ротенон вводили с интервалом 18 мин с 25 мМ глюкозной среды. Результаты представлены в виде репрезентативных данных и были получены с использованием n = 6 технических повторов. (К,Г) Метрики емкости, полученные на основе анализа метаболического потока, выполненного на панелях (A, B), и отображают рассчитанные базальное дыхание, максимальное дыхание, продукцию АТФ-сцепления и утечку протонов. (C) Метаболические способности были определены по CD8 Т-клеткам OT-I и соответствуют данным, представленным на панели (A). (D) Метаболические способности определены по C57BL/6 CD8 Т-клеткам и соответствуют данным, показанным на панели (B). Непарный t-критерий Стьюдента был проведен для всей фигуры, где *p < 0,05, **p < 0,005, ***p < 0,0005 и ****p < 0,0001. Сокращения: OCR = Норма потребления кислорода; Олиго = олигомицин; FCCP = 4-(трифторметокси) фенил) карбонгидразоноил дицианид; муравей = антимицин А; rot = ротенон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Сходные тенденции в ответе эффекторных CD8 Т-клеток на передачу сигналов рецептора LPA независимо от антиген-специфической или поликлональной активации. (A,B) Скорость потребления кислорода CD8 Т-клетками измеряется клетками, полученными в результате (A) стимуляции и экспансии анти-CD8 Т-клеток CD8 Т-клеток или (B) анти-CD3/CD28 поликлональной стимуляции и экспансии CD8 Т-клеток у мышей дикого типа C57B/6. (К,Г) Показаны измерения скорости внеклеточного закисления эффекторных CD8 Т-клеток для клеток, полученных в результате (C) антиген-специфической стимуляции и экспансии анти-CD8 Т-клеток OT-I или (D) анти-CD3/CD28 поликлональной стимуляции и экспансии CD8 Т-клеток у мышей дикого типа C57B/6. Метаболические возможности CD8 Т-клеток измеряли в средах с добавлением глутамина (красный) или 1 мкМ ЛПА в течение 30 мин (зеленый), 2 ч (синий) или 4 ч (зеленый). Олигомицин, ФКХП, антимицин А и ротенон вводили с интервалом 18 мин с 25 мМ глюкозной среды. Результаты представлены в виде репрезентативных данных и были получены с использованием n = 6 технических повторов. (Э-Х) Метрики емкости, полученные на основе анализов метаболического потока, выполненных на панелях (A,C), отображают рассчитанное базальное дыхание, максимальное дыхание, продукцию АТФ-сцепления и утечку протонов. (И-Л) Расчеты емкости на панелях (B,D), показывающие базальное дыхание, максимальное дыхание, выработку, связанную с АТФ, и утечку протонов. Весь рисунок был проанализирован статистически с использованием одностороннего ANOVA, где *p < 0,05. Сокращения: OCR = Норма потребления кислорода; ECAR = скорость внеклеточного закисления; Олиго = олигомицин; FCCP = 4-(трифторметокси) фенил) карбонгидразоноил дицианид; муравей = антимицин А; rot = ротенон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Стратегии стимуляции Т-клеточных рецепторов в режиме реального времени при острой инъекции анти-CD3/CD28. (А,Б) Стратегия острой инъекции с использованием биотинилированных анти-CD3, стрептавидина и анти-CD28 для оценки функции митохондрий. Панели отображают метаболические способности антиген-стимулированных эффекторов OT-I CD8 Т-клеток, в частности, показывая (А) скорость внеклеточного закисления и (В) скорость потребления кислорода. Для инъекций используются только среды (красный), биотинилированный анти-CD3 (зеленый), анти-CD28 + стрептавидин (синий) или комбинация биотинилированных анти-CD3 + анти-CD28 + стрептавидин (бирюзовый). (К,Г) Острое введение магнитных шариков, конъюгированных с анти-CD3/CD28, для оценки митохондриальной активности. Панели отображают метаболические способности стимулированных антигеном эффекторных CD8 Т-клеток OT-I, в частности, показывая (C) скорость внеклеточного закисления и (D) скорость потребления кислорода. Для инъекций используются только среды (красные) или анти-CD3/CD28 в гранулах (бирюзовые). Анализы проводили с инъекциями олигомицина, ФКХП, антимицина А и ротенона с интервалом 18 мин в среду с добавлением 25 мМ глюкозы. Результаты представлены в виде репрезентативных данных и были получены с использованием n = 6 технических повторов. (E) Расчеты емкости на панелях (A-D), показывающие основной метаболизм до инъекции (красный цвет), дыхание после инъекции (синий) и максимальную дыхательную способность (серый). Условия разделяются на основе внутрианалитического введения. (F) Расчеты емкости, показывающие базальное дыхание, максимальное дыхание, выработку АТФ-сцепленной продукции и утечку протонов. Статистика для всего этого показателя была выполнена с помощью одностороннего ANOVA, где *p < 0,05, **p < 0,005, ***p < 0,0005, а ****p < 0,0001. Сокращения: OCR = Норма потребления кислорода; ECAR = скорость внеклеточного закисления; Олиго = олигомицин; FCCP = 4-(трифторметокси) фенил) карбонгидразоноил дицианид; муравей = антимицин А; rot = ротенон. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В этой статье мы описываем протокол оценки митохондриальной функции наивных и эффекторных CD8 Т-клеток. Мы подробно описываем и сравниваем методы получения как антиген-специфических, так и поликлональных CD8 Т-клеток с использованием мышей OT-I и C57BL/6. Наши результаты показывают, что в CD8 Т-клетках наблюдаются схожие тенденции в метаболизме, несмотря на метод активации и предварительной обработки. Данные показывают, что антиген-специфическая активация приводит к образованию более метаболически активных Т-клеток OT-I CD8 по сравнению с их аналогами дикого типа C57BL/6, стимулируемыми анти-CD3 и анти-CD28. Описанный здесь протокол показывает, что митохондриальный функциональный анализ, стресс-тест Мито, является очень чувствительным и постоянно повторяемым анализом, который дает надежные результаты при различных условиях и типах клеток. Наши результаты и подробный протокол способствуют растущему признанию этого анализа в качестве основополагающей методологии для анализа метаболизма CD8 Т-клеток и биоэнергетики.
По мере того, как иммунотерапия и различные клеточные методы лечения продолжают развиваться, значение применения таргетной терапии Т-клетками также растет. Ответ на иммунотерапию и противоопухолевый иммунный ответ зависят от Т-клеточного метаболизма, передачи сигналов кальция и окислительного потока, вызванного восходящей активацией TCR42. Для оптимального ответа CD8 Т-клеток требуется как метаболическая эффективность, так и гибкость 5,6,7,15,17,26,43, в то время как повышенная утечка протонов и последующее окислительное повреждение ухудшают реакцию Т-клеток и способствуют дисфункции 9,44. Как пролиферация Т-клеток, так и продукция цитокинов могут быть спасены путем смягчения митохондриального окислительного стресса 5,13,20,24,25,29. В наших экспериментах мы использовали наивные CD8 Т-клетки, культивируемые в IL-2, который поддерживает жизнеспособность; однако эти CD8 Т-клетки, возможно, больше не эквивалентны добросовестно наивным CD8 Т-клеткам. Таким образом, мы решили использовать наивные CD8 Т-клетки непосредственно от мыши для получения более качественных данных и клеток, которые с меньшей вероятностью будут подвержены влиянию цитокинов. В целом, крайне важно оптимизировать методы изучения метаболизма в субпопуляциях Т-клеток.
Судьба CD8 Т-клеток частично управляется метаболическим программированием, которое влияет на адаптивные иммунные реакции 2,4,45. Наивные CD8 Т-клетки выходят из состояния покоя при стимуляции TCR 25,46,47,48,49,50. Тем не менее, непрерывная стимуляция TCR приводит к истощению CD8 Т-клеток, что приводит к заметно менее энергетическому фенотипу по сравнению с функциональными CD8 Т-клетками 3,20,51,52. Тем не менее, это влияние на метаболизм может быть уменьшено и потенциально оживить истощенные CD8 Т-клетки 2,3,20,46,51,52. В то время как точный механизм(ы), управляющий судьбой CD8 Т-клеток и исчерпывающей дифференцировкой, остается плохо изученным, дисфункциональные и/или истощенные CD8 Т-клетки характерны для дефектных митохондрий и избыточной продукции АФК, которые являются ключевыми факторами в регуляции эффекторной функции CD8 Т-клеток 9,15,53. Метаболизм CD8 Т-клеток, фенотипы и исчерпывающая дифференцировка были изучены с помощью стресс-теста Mito. Исторически сложилось так, что устойчивая стимуляция TCR, приводящая к прогрессирующей потере эффекторных функций, определяет истощение CD8 Т-клеток 11,13,16,17. Тем не менее, в последнее время были предприняты попытки лучше охарактеризовать истощенные CD8 Т-клетки и показать, что хроматин и транскрипционные ландшафты также определяют истощение и тесно связаны с метаболическим потоком 18,27,28. В целом, персистирующая стимуляция TCR и последующие фенотипы и метаболические последствия могут быть изучены с помощью стресс-теста Mito для потенциального выявления метаболических уязвимостей и событий, определяющих судьбу.
Стимуляция TCR инициирует нисходящую передачу сигналов кальция, необходимую для экзоцитоза гранул и направленного уничтожения Т-клеток 24,33. Примечательно, что предшествующие события, такие как активация инфламмасом и продукция IFNγ, зависят от стойкого и устойчивого АТФ54. Во время передачи сигналов кальция отмечается нарушение регуляции эффективности митохондрий, известное как феномен «митохондриальной вспышки» 55,56,57,58. Митохондриальная вспышка представляет собой процесс, при котором активно дышащие митохондрии на короткое время испытывают несвязанное дыхание, что приводит к снижению АТФ и увеличению увеличения АФК55,56. Исследования митохондриальной вспышки были ограничены, и ее значение для CD8 Т-клеток остается широко неизученным. Важно отметить, что методологии, изложенные в этом исследовании, могут быть использованы для изучения этих явлений, исчерпывающей дифференцировки в CD8 Т-клетках и других профилей иммунных клеток.
Таким образом, эти методологии и инструменты предлагают более комплексный подход к изучению как острого, так и хронического метаболизма. Стресс-тест Мито может быть применен для изучения метаболического программирования и того, как оно регулирует эффекторную дисфункцию и исчерпывающую дифференцировку в CD8 Т-клетках. Метаболическое перепрограммирование в лимфоцитах может быть фактором в понимании механизмов, лежащих в основе иммунной толерантности, дисфункции CD8 Т-клеток и истощенных иммунных реакций. Кроме того, медиаторы метаболизма и/или липидов играют ключевую роль в цитотоксичности и истощении CD8 Т-клетоки, таким образом, могут быть выбраны в качестве нового подхода для предотвращения истощения или потенциально обратимой вспять исчерпывающей дифференцировки для снижения противоопухолевого иммунитета. В целом, стресс-тест Cell Mito является надежным инструментом, который следует использовать для решения этих нерешенных вопросов иммунометаболизма.
Раскрытие информации
Авторы не имеют конкурирующих интересов для раскрытия информации.
Благодарности
Фонд Герца, Фонд Эми Дэвис, Фонд семьи Мур и Фонд Хайди Хорнер оказали неоценимую поддержку, за что мы благодарны. Эта работа также была частично поддержана грантами NIH для RMT (AI052157, AI136534), в то время как JAT была поддержана стипендией Hertz Graduate Fellowship.
Материалы
| Name | Company | Catalog Number | Comments |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Anti-CD28 | Biolegend | 102116 | |
| Anti-CD3/CD28 Dynabeads | ThermoFisher | 11456D | |
| Biotinylated anti-CD3 | Biolegend | 317320 | |
| Bovine Serum Albumin | Sigma-Aldrich | 108321-42-2 | |
| CD8a+ T cell isolation kit | Miltenyi Biotec | 130-104-075 | |
| Cell Strainers (100 µm) | CELL TREAT | 229485 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E8008 | |
| Ficoll | Sigma-Aldrich | 26873-85-8 | density gradient medium |
| FCCP ((4-(trifluoromethoxy) phenyl) carbonohydrazonoyl dicyanide) | Sigma-Aldrich | C2920 | |
| Glucose | Sigma-Aldrich | G-6152 | |
| Glutamine | Sigma-Aldrich | G7513 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | Positive selection columns |
| Magnetic cell separation column | Miltenyi Biotec | 130-042-301 | |
| Microplate | Agilent | 102601-100 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Pyruvate | Sigma-Aldrich | 113-24-6 | |
| Recobinant IL-2 | PeproTech | 200-02 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Seahorse media | Agilent | 103576-100 | |
| Sensor cartridge | Agilent | 102601-100 | |
| Streptavidin | Sigma-Aldrich | A9275 | |
| Sterile 6 well plate | CELL TREAT | 230601 | |
| Sterile 24 well plate | CELL TREAT | 229524 | |
| XF Calibrant | Agilent | 102601-100 |
Ссылки
- Patsoukis, N., et al. PD-1 alters T-cell metabolic reprogramming by inhibiting glycolysis and promoting lipolysis and fatty acid oxidation. Nat Commun. 6, 6692 (2015).
- Scharping, N. E., et al. Mitochondrial stress induced by continuous stimulation under hypoxia rapidly drives T cell exhaustion. Nat Immunol. 22, 205-215 (2021).
- Schurich, A., et al. Distinct Metabolic Requirements of Exhausted and Functional Virus-Specific CD8 T Cells in the Same Host. Cell Rep. 16 (5), 1243-1252 (2016).
- Zhang, L., Romero, P. Metabolic control of CD8(+) T cell fate decisions and antitumor immunity. Trends Mol Med. 24 (1), 30-48 (2018).
- Batabyal, R., et al. Metabolic dysfunction and immunometabolism in COVID-19 pathophysiology and therapeutics. Int J Obes (Lond). 45 (6), 1163-1169 (2021).
- Chavakis, T. Immunometabolism: Where immunology and metabolism meet. J Innate Immun. 14, 1-3 (2022).
- Frezza, C., Mauro, C. Editorial: The metabolic challenges of immune cells in health and disease. Front Immunol. 6, 293 (2015).
- Wang, X., Ping, F. F., Bakht, S., Ling, J., Hassan, W. Immunometabolism features of metabolic deregulation and cancer. J Cell Mol Med. 23 (2), 694-701 (2019).
- Turner, J. A., et al. Lysophosphatidic acid modulates CD8 T cell immunosurveillance, metabolism, and anti-tumor immunity. Nat Commun. 14, 3214 (2023).
- Coussens, L. M., Werb, Z. Inflammation and cancer. Nature. 420, 860-867 (2002).
- Jiang, Y., Li, Y., Zhu, B. T-cell exhaustion in the tumor microenvironment. Cell Death Dis. 6 (6), e1792 (2015).
- Krangel, M. S. Mechanics of T cell receptor gene rearrangement. Curr Opin Immunol. 21 (2), 133-139 (2009).
- Barber, D. L., et al. Restoring function in exhausted CD8 T cells during chronic viral infection. Nature. 439, 682-687 (2006).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Bengsch, B., et al. Bioenergetic insufficiencies due to metabolic alterations regulated by the inhibitory receptor PD-1 are an early driver of CD8(+) T cell exhaustion. Immunity. 45 (2), 358-373 (2016).
- Blank, C. U., et al. Defining 'T cell exhaustion'. Nat Rev Immunol. 19, 665-674 (2019).
- Dolina, J. S., Van Braeckel-Budimir, N., Thomas, G. D., Salek-Ardakani, S. CD8(+) T cell exhaustion in cancer. Front Immunol. 12, 715234 (2021).
- Mognol, G. P., et al. Exhaustion-associated regulatory regions in CD8(+) tumor-infiltrating T cells. Proc Natl Acad Sci U S A. 114 (13), E2776-E2785 (2017).
- Wang, D., et al. A comprehensive profile of TCF1(+) progenitor and TCF1(-) terminally exhausted PD-1(+)CD8(+) T cells in head and neck squamous cell carcinoma: implications for prognosis and immunotherapy. Int J Oral Sci. 14 (1), 8 (2022).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21, 1022-1033 (2020).
- Kang, S., Brown, H. M., Hwang, S. Direct antiviral mechanisms of interferon-gamma. Immune Netw. 18 (5), e33 (2018).
- Samuel, C. E. Antiviral actions of interferons. Clin Microbiol Rev. 14, 778-809 (2001).
- Schellekens, H., Weimar, W., Cantell, K., Stitz, L. Antiviral effect of interferon in vivo may be mediated by the host. Nature. 278, 742 (1979).
- Radoja, S., et al. CD8(+) tumor-infiltrating T cells are deficient in perforin-mediated cytolytic activity due to defective microtubule-organizing center mobilization and lytic granule exocytosis. J Immunol. 167 (9), 5042-5051 (2001).
- van der Windt, G. J., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Balmer, M. L., et al. Memory CD8(+) T cells require increased concentrations of acetate induced by stress for optimal function. Immunity. 44 (6), 1312-1324 (2016).
- Pereira, R. M., Hogan, P. G., Rao, A., Martinez, G. J. Transcriptional and epigenetic regulation of T cell hyporesponsiveness. J Leukoc Biol. 102, 601-615 (2017).
- Sen, D. R., et al. The epigenetic landscape of T cell exhaustion. Science. 354, 1165-1169 (2016).
- Quintana, A., et al. T cell activation requires mitochondrial translocation to the immunological synapse. Proc Natl Acad Sci U S A. 104 (36), 14418-14423 (2007).
- Brindley, D. N. Lysophosphatidic acid signaling in cancer. Cancers (Basel). 12 (12), 3791 (2020).
- Chae, C. S., et al. Tumor-derived lysophosphatidic acid blunts protective type I interferon responses in ovarian cancer. Cancer Discov. 12, 1904-1921 (2022).
- Kremer, K. N., et al. LPA suppresses T cell function by altering the cytoskeleton and disrupting immune synapse formation. Proc Natl Acad Sci U S A. 119 (15), e2118816119 (2022).
- Mathew, D., et al. LPA5 is an inhibitory receptor that suppresses CD8 T-cell cytotoxic function via disruption of early TCR signaling. Front Immunol. 10, 1159 (2019).
- Mathew, D., Torres, R. M. Lysophosphatidic acid is an inflammatory lipid exploited by cancers for immune evasion via mechanisms similar and distinct from CTLA-4 and PD-1. Front Immunol. 11, 531910 (2020).
- Oda, S. K., et al. Lysophosphatidic acid inhibits CD8 T cell activation and control of tumor progression. Cancer Immunol Res. 1 (4), 245-255 (2013).
- Lidgerwood, G. E., Pitson, S. M., Bonder, C., Pebay, A. Roles of lysophosphatidic acid and sphingosine-1-phosphate in stem cell biology. Prog Lipid Res. 72, 42-54 (2018).
- Torres, R. M., Turner, J. A., D'Antonio, M., Pelanda, R., Kremer, K. N. Regulation of CD8 T-cell signaling, metabolism, and cytotoxic activity by extracellular lysophosphatidic acid. Immunol Rev. 317 (1), 203-222 (2023).
- Turner, J. A., et al. BRAF modulates lipid use and accumulation. Cancers (Basel). 14 (9), 2110 (2022).
- Hogquist, K. A., et al. T cell receptor antagonist peptides induce positive selection. Cell. 76, 17-27 (1994).
- Li, Y., Kurlander, R. J. Comparison of anti-CD3 and anti-CD28-coated beads with soluble anti-CD3 for expanding human T cells: differing impact on CD8 T cell phenotype and responsiveness to restimulation. J Transl Med. 8, 104 (2010).
- Ralli, M., et al. Immunotherapy in the treatment of metastatic melanoma: current knowledge and future directions. J Immunol Res. 2020, 9235638 (2020).
- Philip, M., Schietinger, A. CD8(+) T cell differentiation and dysfunction in cancer. Nat Rev Immunol. 22, 209-223 (2022).
- Bajrai, L. H., et al. Understanding the role of potential pathways and its components including hypoxia and immune system in case of oral cancer. Sci Rep. 11, 19576 (2021).
- Nicholls, D. G. Mitochondrial proton leaks and uncoupling proteins. Biochim Biophys Acta Bioenerg. 1862, 148428 (2021).
- Tyrakis, P. A., et al. S-2-hydroxyglutarate regulates CD8(+) T-lymphocyte fate. Nature. 540, 236-241 (2016).
- Guo, Y., et al. Metabolic reprogramming of terminally exhausted CD8(+) T cells by IL-10 enhances anti-tumor immunity. Nat Immunol. 22, 746-756 (2021).
- Notarangelo, G., et al. Oncometabolite d-2HG alters T cell metabolism to impair CD8(+) T cell function. Science. 377 (6614), 1519-1529 (2022).
- Yang, K., et al. T cell exit from quiescence and differentiation into Th2 cells depend on Raptor-mTORC1-mediated metabolic reprogramming. Immunity. 39 (6), 1043-1056 (2013).
- Ricciardi, S., et al. The translational machinery of human CD4(+) T cells is poised for activation and controls the switch from quiescence to metabolic remodeling. Cell Metab. 28 (6), 895-906.e5 (2018).
- Moller, S. H., Hsueh, P. C., Yu, Y. R., Zhang, L., Ho, P. C. Metabolic programs tailor T cell immunity in viral infection, cancer, and aging. Cell Metab. 34 (3), 378-395 (2022).
- Alrubayyi, A., et al. Functional restoration of exhausted CD8 T cells in chronic HIV-1 infection by targeting mitochondrial dysfunction. Front Immunol. 13, 908697 (2022).
- Vignali, P. D. A., et al. Hypoxia drives CD39-dependent suppressor function in exhausted T cells to limit antitumor immunity. Nat Immunol. 24, 267-279 (2023).
- Ogando, J., et al. PD-1 signaling affects cristae morphology and leads to mitochondrial dysfunction in human CD8(+) T lymphocytes. J Immunother Cancer. 7 (1), 151 (2019).
- Billingham, L. K., et al. Mitochondrial electron transport chain is necessary for NLRP3 inflammasome activation. Nat Immunol. 23, 692-704 (2022).
- Eberhardt, D. R., et al. EFHD1 ablation inhibits cardiac mitoflash activation and protects cardiomyocytes from ischemia. J Mol Cell Cardiol. 167, 1-14 (2022).
- Hou, T., et al. Identification of EFHD1 as a novel Ca(2+) sensor for mitoflash activation. Cell Calcium. 59 (5), 262-270 (2016).
- Mun, S. A., et al. Structural and biochemical characterization of EFhd1/Swiprosin-2, an actin-binding protein in mitochondria. Front Cell Dev Biol. 8, 628222 (2020).
- Stein, M., et al. A defined metabolic state in pre B cells governs B-cell development and is counterbalanced by Swiprosin-2/EFhd1. Cell Death Differ. 24 (7), 1239-1252 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены