Method Article
Naive 및 Effector CD8 T 세포의 미토콘드리아 기능 측정
요약
CD8 T 세포 생체 에너지학은 Mito Stress Test를 사용하여 조사할 수 있습니다. 이 방법론은 급성 및 만성 대사 프로그래밍을 연구하는 데 사용할 수 있습니다. 이 프로토콜은 T 세포 수용체 생물학과 생체 에너지 분석 간의 관계를 조사하는 접근 방식을 설명합니다.
초록
면역대사가 림프구의 기능, 분화 및 운명에 어떤 영향을 미치는지에 대한 이해는 상당한 관심과 관심을 불러일으켰습니다. 림프구 생물학은 생체 에너지 분석을 사용하여 탐구되어 왔으며 이제 이 분야에서 매우 중요한 도구가 되었습니다. 따라서 우리는 수용체 자극을 위한 전처리 및 급성 주사로 조정할 수 있는 생체 에너지 분석 분석을 최적화하고자 했습니다. 여기에서는 미접촉 CD8 T 세포의 산소 소비율과 효과기 CD8 T 세포의 산소 소비율과 세포 외 산성화 속도를 평가하기 위해 Cell Mito Stress Test를 사용하여 CD8 T 세포의 체외 대사를 평가했습니다. 항원 특이적 효과기 CD8 T 세포는 생체 외 자극을 통해 유래되었으며, 비장 세포에서 수확하고 자기 비드 컬럼 분리로 분리한 naive CD8 T 세포를 획득했습니다.
전처리는 마이크로플레이트에서 수행되며 센서 카트리지를 준비하는 방법을 자세히 설명합니다. 우리는 주입 포트에 약물을 적재하여 대사 능력을 간접적으로 측정하고 대사 조절제를 사용하여 이 프로토콜을 사용하여 특정 효소 활성을 연구할 수 있는 방법을 보여줍니다. T 세포 수용체 자극은 급성 주사로 실시간으로 연구하고 주사 포트를 사용하여 anti-CD3/CD28을 자극할 수 있습니다. 기기 분석기는 측정 및 데이터 수집에 사용되며 데이터 시각화는 세포 대사를 해석하기 위해 소프트웨어 프로그램으로 수행됩니다. 이 전략은 면역 세포 생물학 및 미토콘드리아 생물 에너지학에 대한 광범위한 데이터를 생성하여 연구자들이 CD8 T 세포 대사를 탐구하기 위해 다양한 방법으로 프로토콜을 맞춤화할 수 있도록 합니다.
서문
면역세포의 운명과 기능은 신진대사, 산화적 소비, 혐기성 호흡에 의해 크게 영향을 받는다 1,2,3,4. 최근에는 CD8 T 세포의 운명 및 효과기 기능을 재프로그래밍하거나 활성화하고 바이러스 제거를 개선하거나 내인성 항종양 면역을 강화하기 위한 전략으로 대사 조절을 표적으로 하는 것에 대한 관심이 높아지고 있습니다 5,6,7,8,9. 특히, T 세포 수용체(TCR)를 통한 항원 수용체 신호전달은 CD8 T 세포 분화를 위한 핵심 요구 사항이며, 이로 인해 다운스트림 신호 전달 및 활성화가 이루어집니다 10,11,12(그림 1). 면역학적 모욕에 장기간 노출되면 TCR에 지속적인 항원 특이적 자극이 발생하여 결국 만성 염증 상태, T 세포 피로, 면역 미세환경의 리모델링, 면역 탈출로 이어집니다 11,13,14,15,16,17,18,19.
소진된 CD8 T 세포의 대사는 기능적 효과기 CD8 T 세포의 대사와 근본적으로 구별됩니다 2,3,14,15,18,20. T 세포 분화, 인터페론 γ(IFNγ) 분비 및 회상 능력은 부분적으로 미토콘드리아 기능과 β산화 분해 산물에 의해 결정됩니다. IFNγ+ CD8 T 세포는 항종양 및 항바이러스 면역 반응의 중요한 구성 요소입니다 21,22,23. 해당과정(glycolysis)과 전자전달계(electron transport chain)를 통한 특정 대사 플럭스(specific metabolic flux)는 CD8 T 세포 활성화, 사이토카인 분비 및 기억 반응에 중요하다 4,11,13,15,18,24,25,26,27,28 . T 세포 활성화 및 효과기 분화를 포함한 최적의 반응은 조정되고 특이적인 미토콘드리아 반응을 필요로 하는 반면, 미토콘드리아 결함 및 과도한 활성 산소 종(ROS)은 소진되거나 기능 장애가 있는 T 세포를 특성화합니다 9,29. 최근에는 시험관 내에서 CD8 T 세포의 지속적인 TCR 자극은 산화 스트레스를 유발하고 T 세포 증식에 필요한 산화 대사 및 대사 능력을 재프로그래밍함으로써 부분적으로 CD8 T 세포의 완전한 분화를 촉진합니다 1,2,13,20,24,29 . 전체적으로 대사 조절 축은 CD8 T 세포 분화와 effector, memory 또는 소진/기능 장애 표현형으로의 진행을 지시하는 데 중요한 구성 요소입니다.
대사 화합물은 또한 자가분비 또는 부분비 신호 분자로 기능하여 면역 세포 반응을 지시합니다 9,30,31,32,33,34,35. 스핑고신-1-포스페이트(S1P) 및 리소포스파티드산(LPA)은 G-단백질 결합 수용체(GPCR)를 통해 신호를 보내 CD8 T 세포에 의한 림프구 유출 및 세포 독성을 조절하는 생체 활성 및 염증성 지질입니다36. GPCR LPA 수용체를 통한 LPA 신호전달 CD8 T 세포의 LPA 수용체는 신진대사를 재프로그래밍하여 지방 분해, 지방산 산화 및 양성자 누출을 증가시킵니다9. 전체적으로 CD8 T 세포의 생체 에너지학과 대사는 주로 기질 가용성, 환경적 단서 및 에너지 요구 사항에 의해 주도됩니다.
CD8 T 세포 대사를 조사하는 방법론이 점점 더 중요해지고 있습니다. 세포 유사분 스트레스 검사는 생체 에너지학에 대한 포괄적인 평가를 제공하며 현재 면역 대사 및 CD8 T 세포 에너지 분야에서 특징적인 기술로 인정받고 있습니다 9,37. 부착 세포는 역사적으로 Mito Stress Test 분석에 사용되었다38; 그러나 현탁액에서 성장한 세포에 이 프로토콜을 적용하는 것에 대한 관심이 높아지고 있으며, 특히 세포 미토스트레스 테스트 분석에 면역 세포를 사용하는 것에 대한 관심이 높아지고 있습니다. 여기에서는 최근 간행된논문 9을 기반으로 CD8 T 세포의 대사 활성을 측정하기 위한 자세한 프로토콜을 제시합니다. CD8 T 세포의 확장, 미성숙한 CD8 T 세포 분리, 분석 준비 및 세포 미토스 스트레스 테스트 분석에서 전처리 및 급성 주사에 대한 프로토콜을 사용한 치료에 대한 자세한 설명을 제공합니다. 중요한 것은 다클론 및 항원 특이적 TCR 자극을 포함하여 TCR 자극 및 CD8 T 세포 활성화를 위한 여러 방법을 비교하고 대조한다는 것입니다.
이 프로토콜은 모든 마우스 T 세포가 동일한 Vα2 및 Vβ5 유전자를 발현하는 OT-I 형질전환 마우스(고전적인 형질전환 마우스 모델)를 사용한 항원 특이적 자극을 자세히 설명합니다39. OT-I 마우스 CD8 T 세포는 모두 오브알부민 옥타펩타이드(OVA257-264, 아미노산 서열 SIINFEKL 또는 널리 연구된 항원결정기인 N4, 주요 조직적합성 복합체(MHC) 클래스 I에 의해 제시되면 세포독성 CD8 T 세포를 활성화한다(그림 1A)). 전반적으로 OT-I 형질전환 마우스 모델은 면역학자들이 TCR 신호 전달 및 항원 특이적 T 세포 효과기 기능을 연구하는 데 널리 사용됩니다. OT-I 마우스 모델을 사용한 단클론 활성화와 반대로, 다클론 CD8 T 세포는 TCR CD3 소단위 및 CD28 공동 자극 분자40에 대한 항-CD3/CD28 항체와 함께 생성될 수 있습니다(그림 1B). 항-CD3/CD28 항체는 TCR 신호전달의 항원 특이적 성분을 우회하여 T 세포의 다클론 집단을 활성화한다40. 궁극적으로 이 보고서에 설명된 결과는 CD8 T 세포의 동적 대사 플럭스를 정량화하기 위해 세포 유사분 스트레스 테스트를 사용하는 여러 방법을 비교합니다.
프로토콜
마우스는 병원체가 없는 환경에서 보관되었으며 기관 동물 관리 및 사용 위원회(Institutional Animal Care and Use Committee) 표준 및 규정에 따라 유지되었습니다.
1. 항원 특이적 자극을 통한 CD8 T 세포의 생성 및 증식
- 첫날에는 OT-I 마우스에서 유래 한 비장 세포를 수확합니다. 그런 다음 SIINFEKL (4) 펩타이드로 시험관 내에서 준비하고 활성화합니다.
- 후드 공간을 청소하고, 시약을 준비하고, 마우스 배지를 수집합니다. 물 또는 비드 인큐베이터에서 마우스 미디어를 따뜻하게 합니다.
- 6-웰 플레이트에서 7mL의 마우스 배지를 하나의 웰에 넣은 다음 다른 3mL의 마우스 배지를 다른 웰에 넣습니다. 그런 다음 7mL의 매체가 들어 있는 웰에 스트레이너를 삽입합니다.
- 이송 케이지의 사육장에서 쥐를 실험실로 가져옵니다. 마우스를 빈 새 케이지로 옮기고 CO2 어댑터를 상단에 배치합니다. CO2 로 마우스를 최대 2.75의 유량 수준까지 안락사시킵니다.
- 마우스를 주의 깊게 관찰하고 고통의 징후가 있는지 관찰하십시오. 마지막 숨을 들이쉰 후 최소 1분 동안 호흡과 생명의 징후를 관찰하십시오. CO2 를 끄고 안락사의 2차 방법으로 자궁경부 탈구를 수행합니다. 그런 다음 벤치탑, 케이지 및 나머지 작업 영역을 청소하고 마우스를 해부 후드로 이동합니다.
- 쥐에서 비장을 절개합니다.
- 70% 에탄올을 사용하여 해부 장비를 살균하고 마우스를 왼쪽이 아래로 향하게 놓고 마우스의 왼쪽에 스프레이하여 소독합니다.
- 깨끗한 기구를 사용하여 절개하여 피부를 제거하고 복막을 확인합니다. 복막을 통해 작은 절개를 만들어 비장을 찾은 다음 비장을 절제합니다. 여과기 위에 있는 6웰 플레이트에 비장을 넣습니다.
- 해당 부위를 청소하고 쥐 사체를 폐기 봉투에 넣은 다음 봉투를 냉동실에 넣어 폐기하십시오.
- 전체 영역이 깨끗한지 확인하고 다음 단계를 위해 6웰 플레이트를 조직 배양 후드로 이동합니다.
- 조직 배양 후드에서 비장을 균질화하고 세포를 덩어리가 없는 단일 세포 현탁액으로 재현탁합니다.
- 5mL 주사기의 플런저를 사용하여 7mL 배지를 사용하여 스트레이너를 통해 비장을 웰로 밀어 넣습니다.
- 추가 웰에 3mL의 배지를 사용하여 스트레이너와 잔여 조직을 헹굽니다.
- 혈청학적 피펫을 사용하여 세포 현탁액을 새로운 10mL 원뿔형 튜브로 옮깁니다.
- 500 × g 에서 5분 동안 원심분리기를 하고 유리 피펫을 사용하여 상층액을 흡입합니다.
- 적혈구를 용해합니다.
- ACK 용해 완충액의 세포를 재현탁하고 실온에서 1-5분 동안 배양하여 1mL의 ACK 용해 완충액을 사용하여 적혈구 용해 프로세스를 시작합니다.
참고: 배양 시간은 비장 세포 사멸을 최소화하면서 최대 적혈구 용해를 달성하기 위해 ACK 용해 버퍼의 특정 배치에 맞게 최적화되어야 합니다. - 중화를 위해 원뿔형 튜브에 배지 10mL를 추가하고 500 × g에서 5분 동안 원심분리합니다.
- 50mL의 배지에 세포를 재현탁하고 T75 플라스크로 옮깁니다.
- ACK 용해 완충액의 세포를 재현탁하고 실온에서 1-5분 동안 배양하여 1mL의 ACK 용해 완충액을 사용하여 적혈구 용해 프로세스를 시작합니다.
- SIINFEKL (N4) 펩타이드로 세포를 자극합니다.
- SIINFEKL 펩타이드를 조직 배양 후드로 가져옵니다. SIINFEKL 펩타이드를 -20°C에서 보관하십시오.
- SIINFEKL을 배지에 직접 첨가하여 2μg/mL의 최종 농도를 달성합니다. 50μL의 SIINFEKL(2mg/mL)을 50mL의 배지에 첨가하여 2μg/mL의 최종 농도를 달성합니다.
- 세포를 37°C에서 72시간 동안 배양합니다.
- 70% 에탄올을 사용하여 조직 배양 후드를 살균합니다.
- 후드 공간을 청소하고, 시약을 준비하고, 마우스 배지를 수집합니다. 물 또는 비드 인큐베이터에서 마우스 미디어를 따뜻하게 합니다.
- 4일째에는 세포를 세척하여 펩타이드를 제거합니다. IL-2가 보충된 갓 준비된 배지를 사용하여 세포를 재현탁시킨 다음 플라스크를 인큐베이터로 되돌립니다.
- T75 조직 배양 플라스크에서 세포를 50mL 원뿔형 튜브에 모읍니다. OT-I CD8 T 세포를 원심분리기 및 펠릿화한 다음 흡인으로 여분의 매체를 제거합니다. 1,000U/mL의 IL-2가 포함된 새 마우스 배지 50mL를 추가하고 세포를 새 T75 플라스크로 옮깁니다.
- 보관을 위해 IL-2 스톡의 부분 표본을 -80°C의 냉동고에 보관하십시오. -80°C에서 보관하면 펩타이드 분해를 최소화할 수 있습니다.
- 미토콘드리아 기능 분석을 위해 확장된 항원 특이적 세포독성 CD8 T 세포 준비
- 7일째에는 미토콘드리아 기능 분석을 수행합니다. 분석을 위해 항원 특이적 OT-I CD8 T 세포를 준비합니다.
- 살아있는 CD8 T 세포를 수집합니다.
- T-75 조직 배양 플라스크의 세포를 새로운 50mL 코니컬 튜브로 옮깁니다. 그런 다음 원뿔형 튜브를 500 × g에서 5분 동안 원심분리합니다.
- 새로운 50mL 원뿔형 튜브에서 세포가 회전하는 동안 20mL의 밀도 구배 배지(밀도 = 1.077g/mL)를 피펫으로 주입합니다.
- 원심분리가 완료되면 원뿔형 튜브를 취하고 배지 10mL를 사용하여 세포를 재현탁합니다. 그런 다음 매우 천천히 피펫팅하여 밀도 구배 위에 재현탁 세포를 겹쳐 놓습니다. 기울기를 방해하지 않고 1,300 × g 의 원뿔형 튜브를 실온에서 20분 동안 원심분리하고 브레이크 없이 최대 가속 및 최소 감속으로 설정합니다.
- 원심분리가 완료되면 P1000 피펫을 사용하여 T 세포의 중간층을 수집합니다. 세포층을 시각화하고 피펫이 위에 남아 있고 층을 방해하지 않는지 확인합니다. 수집된 세포를 30mL의 완전한 마우스 배지가 들어 있는 새로운 50mL 코니컬 튜브로 옮깁니다. 그런 다음 50mL 코니컬 튜브를 500 × g 에서 5분 동안 원심분리합니다. 원심분리가 완료되면 OT-I CD8 T 세포에서 과량의 상등액을 흡인합니다. 20mL의 신선한 마우스 배지로 세포를 재현탁합니다.
- 혈구계를 사용하여 생존 가능한 세포의 총 수를 계산합니다. 작은 세포 분취액을 트리판 블루로 1:4 희석하여 염색하여 죽은 세포를 식별합니다.
참고: 하나의 OT-I 마우스에서 약 40-60 × 106 개의 셀을 예상할 수 있습니다. - 추가 원심분리 단계를 통해 20mL의 새로운 마우스 배지로 나머지 세포를 세척합니다. 그런 다음 마이크로플레이트를 사용하여 완전한 마우스 배지에서 200,000 cells/well을 피펫 셀로 만듭니다.
2. anti-CD3/anti-CD28 자극을 통한 poly-specific CD8 T cell의 생성 및 증식
- Day 0에서 24웰 플레이트를 CD3에 코팅합니다. PBS로 희석된 5μg/mL 농도의 항-CD3-비오틴 1mL를 24웰 플레이트의 각 웰에 추가합니다. 플레이트를 가습된 5% CO2 인큐베이터에 밤새 넣습니다.
- 다음 날, 쥐를 수확하고 비장 세포를 채취합니다. 1.1.1-1.1.5.3 단계에 따라 anti-CD3/anti-CD28로 in vitro 에서 비장세포를 활성화합니다.
- 마그네틱 비드 분리 프로토콜을 사용하여 CD8 T 세포를 분리합니다.
참고: 세포가 차갑게 유지되는지 확인하십시오. 사전 냉각된 조건에서 빠르게 작업하십시오.- 40μL의 MACS 버퍼를 사용하여 40μL의 MACS 버퍼당 10,000,000개의 셀로 셀을 재현탁합니다. 용액에 10μL의 비오틴 항체 칵테일을 세포 용액에 완전히 혼합한 다음 4°C에서 5분 동안 배양합니다.
- 세포가 냉장고에서 배양할 때까지 기다리는 동안 positive selection을 위한 column을 준비합니다. 3mL의 버퍼를 사용하여 컬럼을 세척한 다음 폐기물 흐름을 폐기합니다.
- 5분 후 냉장고에서 세포-항체 용액을 채취하여 세포 10,000,000개당 MACS 완충액 30μL, 항비오틴 20μL를 첨가한 후 4°C에서 추가로 10분 동안 배양합니다.
- 새로운 15mL 코니컬 튜브를 사용하여 포지티브 선택 컬럼 아래에 새 수집 튜브를 준비합니다. 10분 배양이 완료되면 세포 현탁액을 positive selection column으로 옮깁니다. 새 15mL 원뿔형 튜브에 플로우스루를 수집합니다. 3mL의 MACS 완충액을 사용하여 컬럼을 세척하여 잔류 세포를 수집합니다.
참고: 세포 현탁액이 최소 0.5mL 부피인지 확인하십시오. - 항-CD3/항-CD28 자극을 위해 양성으로 선택된 CD8 T 세포를 24-well 플레이트에 재플레이팅합니다.
- 500 × g 에서 4 °C에서 5분 동안 플로우스루를 원심분리합니다. 과량의 상등액을 흡인하고 세포를 피펫으로 하여 용액에 재현탁시킵니다. 혈구계와 트리판 블루를 사용하여 세포를 계수합니다.
참고: 마우스 비장당 ~8-10 ×10 6 살아있는 세포가 계수될 것으로 예상하십시오. - 세포를 계수한 후 CD8 T 세포를 mL당 500,000개의 세포로 재현탁합니다. 그런 다음 24-well 플레이트에서 1mL의 PBS를 조심스럽게 흡인하고, 24-well 플레이트에서 계수된 세포를 다시 플레이팅하고, well당 10개의6 세포를 추가합니다.
- 세포를 자극하기 위해 anti-CD28의 최종 농도가 2μg/mL가 되도록 24웰 플레이트에 anti-CD28을 피펫으로 주입합니다. 세포를 혼합하려면 플레이트를 조심스럽게 두드리십시오. 다음 72시간 동안 셀을 37°C로 유지합니다.
- 500 × g 에서 4 °C에서 5분 동안 플로우스루를 원심분리합니다. 과량의 상등액을 흡인하고 세포를 피펫으로 하여 용액에 재현탁시킵니다. 혈구계와 트리판 블루를 사용하여 세포를 계수합니다.
- 70% 에탄올을 사용하여 조직 배양 후드를 청소합니다.
- 4일차(72시간 후)에 항-CD3/항-CD28 자극에서 세포를 제거합니다. 다클론 CD8 T 세포를 원심분리하여 세포를 세척합니다. 흡인에 의해 과량의 상등액을 제거한 다음 10mL의 배지와 함께 1,000 units/mL의 IL-2를 가진 새로운 마우스 배지로 세포를 재현탁합니다. 재현탁된 세포를 새로운 6-well plate로 옮기고 incubator에 넣습니다.
참고: 1.2.2. 보관을 위해 IL-2 스톡의 부분 표본은 -80 °C의 냉동고에 보관할 수 있습니다. -80°C에서 보관하면 펩타이드 분해를 최소화할 수 있습니다. - 미토콘드리아 기능 분석을 위해 확장된 다클론 효과기 CD8 T 세포를 준비합니다.
- 7일째 되는 날에는 분석을 위해 다클론 CD8 T 세포를 준비하고 처리합니다.
- 살아있는 CD8 T 세포를 수집합니다.
- 피펫을 사용하여 6-well 플레이트의 세포를 깨끗한 원뿔형 튜브로 옮긴 다음 500 × g에서 5분 동안 세포를 원심분리합니다.
- 1.3.3.2-1.3.4 단계를 수행합니다.
참고: 단일 C57BL/6 마우스에서 약 1,000만-3,000만 개의 살아있는 CD8 T 세포를 기대할 수 있습니다. - CD8 순도를 평가하기 위해 유세포 분석을 위해 세포 분취량을 저장합니다. 유세포 분석을위해 얼음 위에서 9번 선택한 생존도 염료로 20분 동안 세포를 염색합니다.
3. 순진한 CD8 T 세포 채취
- 7일째 되는 날에는 1.1.1-1.1.5.3 단계에 따라 마우스에서 비장 세포를 채취합니다.
- 2.3-2.3.5.1 단계에 설명된 마그네틱 비드 기반 프로토콜을 사용하여 CD8 T 세포 분리를 수행합니다.
- 완전한 배지에서 웰당 200,000 cells/의 microplate에 CD8 T cell을 플레이트화합니다.
4. 미토콘드리아 기능 분석 수행
- 미토콘드리아 기능 분석을 실행하기 전날 자료를 준비합니다.
- 센서 카트리지에 수분을 공급합니다.
- 유틸리티 플레이트의 각 웰에 200μL의 증류수를 피펫으로 넣습니다. 센서 카트리지를 유틸리티 플레이트 위에 놓습니다. 적절한 수화를 위해 센서 카트리지의 끝이 물에 잠겨 있는지 확인하십시오. 센서 카트리지와 유틸리티 플레이트를 모두 최소 2시간 동안 37°C의non-CO 10 인큐베이터에 넣습니다.
- 50mL의 Calbrant가 함유된 50mL 원뿔형 튜브를 준비하고 non-CO2 인큐베이터에 넣고 밤새 배양합니다.
- 분석 전날, 분석을 준비하기 위해 완전한 신선한 배지를 준비합니다. 총 50mL에서 분석 배지에서 1mM 피루브산, 2mM 글루타민 및 10mM 포도당 용액을 준비합니다.
- 센서 카트리지에 수분을 공급합니다.
- 다음 날 미토콘드리아 기능 분석을 수행합니다.
- 유틸리티 플레이트에서 증류수를 튕겨서 제거합니다. 200 μL의 Calibrant로 재수화합니다. non-CO2 인큐베이터에 밤새 보관된 Calibrant를 사용하십시오. 유틸리티 플레이트 상단의 센서 카트리지를 교체한 후. 센서 카트리지가 있는 유틸리티 플레이트를 non-CO2 인큐베이터에 다시 넣습니다.
알림: 플레이트를 튕기려면 싱크대 위에서 한 번의 유체 동작으로 플레이트를 빠르고 신속하게 뒤집어 증류수가 플레이트에서 빠르게 떨어지도록 합니다.
- 유틸리티 플레이트에서 증류수를 튕겨서 제거합니다. 200 μL의 Calibrant로 재수화합니다. non-CO2 인큐베이터에 밤새 보관된 Calibrant를 사용하십시오. 유틸리티 플레이트 상단의 센서 카트리지를 교체한 후. 센서 카트리지가 있는 유틸리티 플레이트를 non-CO2 인큐베이터에 다시 넣습니다.
- CD8 T cell을 상기 섹션 1-3에 설명된 대로 준비합니다.
- 멀티채널 피펫을 사용하여 4.5mL의 완전한 배지에 10 × 106 개의 세포를 재현탁하고 웰당 90μL를 도금하여 웰당 200,000개의 세포를 플레이트링합니다. 그런 다음 전처리 중에 웰당 90μL의 지정된 배지를 추가로 추가합니다.
참고: 전처리가 없는 경우 웰당 200,000개의 세포를 최종 농도로 하여 웰당 180μL로 셀을 플레이트화합니다. 이 시점부터 프로토콜에서 플레이트를 주변 실온 또는 비 CO2 인큐베이터에 보관하십시오. 플레이트를 5% CO2 인큐베이터에 넣으면 안 됩니다. 마이크로플레이트의 최종 부피는 180μL입니다.
- 멀티채널 피펫을 사용하여 4.5mL의 완전한 배지에 10 × 106 개의 세포를 재현탁하고 웰당 90μL를 도금하여 웰당 200,000개의 세포를 플레이트링합니다. 그런 다음 전처리 중에 웰당 90μL의 지정된 배지를 추가로 추가합니다.
- 전처리제(지질 또는 다른 대사 산물 보충제 포함)를 준비합니다.
- 퀵 스핀 미니 원심분리기를 사용하여 냉동실에서 동결건조된 지질을 회전시켜 지질 전처리를 준비합니다. 전처리를 위해 원하는 농도를 결정하고 이러한 농도로 지질 전처리를 준비합니다. 사용 직전에 30분 동안 희석된 지질을 초음파 처리합니다.
- 지질 칵테일을 준비합니다.
- 미토콘드리아 기능 분석에 사용할 원하는 지질 농도를 결정합니다.
- 원하는 농도의 2배인 농도로 지질을 준비합니다. 그런 다음 마이크로플레이트의 기존 부피에 지질 용액을 추가하여 1:2 희석을 달성합니다. 90 μL의 지질 용액을 기존 90 μL에 직접 첨가하여 이를 완료할 수 있습니다. 최종 부피는 웰당 180μL(1:2 희석)입니다.
참고: 표 1 에는 가능한 플레이트 설정 및 설계의 다이어그램이 자세히 설명되어 있습니다. 지질 첨가제가 있거나 없는 naive 및 antigen-specific effector CD8 T 세포를 모두 통합하여 5-6개의 기술적 복제로 분석을 수행하는 것이 좋습니다. 특히 이 프로토콜은 세포 중단을 최소화하기 위해 원심분리를 피하도록 설계되었습니다. 미토콘드리아 기능 분석은 세포 수에 매우 민감하기 때문에 세포 손실을 줄이는 것이 중요합니다. 원심분리 대신, 세포는 무결성을 보존하기 위해 튕겨서 처리됩니다. - 플레이트의 각 모서리에 180μL의 완전한 배지를 피펫으로 분사합니다. CD8 T 세포가 있는 마이크로플레이트를 non-CO2 인큐베이터에 넣습니다.
참고: 배양 시간은 원하는 전처리 길이에 따라 달라집니다. 세포 사멸을 최소화하기 위해 CD8 T 세포에 대해 최대 4시간의 전처리를 권장했습니다. 전처리 시간을 과도하게 연장하면 과도한 세포 사멸을 유발하여 결과의 정확성에 영향을 미칠 수 있습니다.
- 급성 주사를 위한 독극물 및 용액을 준비합니다.
- 원액을 사용하여 희석된 형태의 올리고마이신을 준비합니다. 3mL의 완전한 배지에 올리고마이신을 희석합니다. 15mL 원뿔형 튜브에 독극물과 급성 주사를 조심스럽게 준비하십시오. 독은 빛에 민감하기 때문에 빛 노출로부터 보호하기 위해 은박지로 감싼 튜브를 사용하여 이러한 용액을 준비하십시오.
- 주석 호일로 감싼 15mL 원뿔형 튜브 1개에서 주입 후 최종 농도가 2.5μM가 되도록 3mL의 완전한 배지에 올리고마이신을 희석합니다.
- 주석 호일로 감싼 두 번째 15mL 원뿔형 튜브에서 주입 후 최종 농도가 2.0μM가 되도록 FCCP를 3mL의 완전한 배지에 희석합니다.
- 주석 호일로 감싼 세 번째 15mL 원뿔형 튜브에서 주입 후 두 독소에 대해 0.5μM의 농도를 달성하기 위해 3mL의 완전한 배지에 로테논 및 항마이신 A 용액을 만듭니다.
- 추가 대사 조절제, 약물 또는 자극으로 분석을 수행하는 경우 이러한 제제를 완전한 배지로 희석합니다. 에토목시르 또는 기타 대사 조절제 및 약물을 사용할 계획인 경우, 먼저 분석을 수행하여 적정 곡선을 테스트하고 최적의 사용 농도를 결정하십시오. 급성 주사를 통해 TCR 자극을 수행하는 경우, anti-CD3/anti-CD28 마그네틱 비드 또는 plate-bound anti-CD3-biotin과 anti-CD28 streptavidin의 조합을 사용하여 분석을 수행할 수 있습니다.
참고: 추가 설명은 급성 항-CD3/CD28 주사를 통한 TCR 자극 프로토콜을 설명하는 섹션 5를 참조하십시오.
- non-CO2 인큐베이터에서 센서 카트리지를 제거합니다. 플레이트 어댑터를 사용하여 독극물을 센서 카트리지에 피펫으로 주입합니다. 플레이트 어댑터를 배치하여 각 챔버에 독극물 또는 기타 급성 주사를 특별히 장전할 수 있습니다.
알림: 독극물을 피펫팅할 때 주의하십시오.- 센서 카트리지의 포트에 독을 넣으십시오. 추가 주입이 수행되지 않으면 포트 A-C에 독이 로드됩니다. 20μL의 올리고마이신을 포트 A에, 22μL의 FCCP를 포트 B에, 25μL의 로테논을 포트 C에, 25μL의 안티마이신 A를 포트 C에 피펫을 투입합니다.
- 원액을 사용하여 희석된 형태의 올리고마이신을 준비합니다. 3mL의 완전한 배지에 올리고마이신을 희석합니다. 15mL 원뿔형 튜브에 독극물과 급성 주사를 조심스럽게 준비하십시오. 독은 빛에 민감하기 때문에 빛 노출로부터 보호하기 위해 은박지로 감싼 튜브를 사용하여 이러한 용액을 준비하십시오.
- 기기에서 분석을 시작하기 1시간 전에 마이크로플레이트를 non-CO2 인큐베이터에 넣습니다.
- 기기를 시작하기 전에 소프트웨어를 열고 기기를 보정하십시오. 마이크로플레이트를 기기에 로드하기 30분 전에 이 작업을 수행하여 충분한 교정 시간을 확보하십시오.
- 소프트웨어 시스템에서 웰에 레이블을 지정하고 주입 계획을 검토합니다.
- 교정하는 동안 센서 카트리지를 기기에 로드합니다. 소프트웨어에서 초기화 및 품질 검사를 완료하라는 메시지가 표시됩니다. 교정은 각 웰에서 pH 및 O2 를 평가하며 통과 또는 실패합니다. 기기는 확인 표시 또는 'X'와 함께 화면에 결과를 보고합니다.
5. 급성 항-CD3/CD28 주사를 사용한 별도의 실험에서 TCR 자극을 사용한 미토콘드리아 기능 분석의 수정된 버전을 수행합니다.
참고: 미토콘드리아 기능 분석은 1) 5.2단계에서 설명한 비오틴화된 항-CD3 + 항-CD28 + 스트렙타비딘을 사용하거나 2) 5.3단계에서 설명한 항-CD3/CD28 마그네틱 비드를 사용하여 두 가지 접근 방식을 통해 급성 TCR 시뮬레이션으로 수행할 수 있습니다.
- 추가 주입을 수행하는 경우 이전 섹션 4에서 설명한 대로 분석을 준비합니다. 주입을 위한 추가 챔버를 사용하여 주입 방식을 수정합니다. 이 프로토콜에서 anti-CD3/anti-CD28은 센서 카트리지의 포트 A에 로드됩니다. 그런 다음 올리고마이신을 포트 B에, FCCP를 포트 C에, 로테논 및 안티마이신 A를 포트 D에 비슷하게 로드합니다.
- 비오틴화된 항-CD3 + 항-CD28 + 스트렙타비딘 성분을 준비하고 로드합니다.
- 10 μg/mL에서 20 μL의 비오틴화된 항-CD3를 센서 카트리지의 지정된 웰에 피펫으로 주입합니다.
- 2 μg/mL의 항-CD28 20 μL + 20 μg/mL의 스트렙타비딘을 센서 카트리지의 지정된 웰에 피펫 투여합니다.
- 10μg/mL에서 20μL의 비오틴화된 항-CD3 + 2μg/mL에서 항-CD28 + 20μg/mL에서 스트렙타비딘을 센서 카트리지의 지정된 웰에 피펫.
- 제어 우물이 준비되었는지 확인하십시오. 배지만 주입된 지정된 웰, 비오틴화된 항-CD3 단독, 항-CD28 + 스트렙타비딘 및 비오틴화된 항-CD3 + 항-CD28 + 스트렙타비딘이 있는지 확인합니다.
- 1:1 bead-to-cell 비율을 사용하여 anti-CD3/CD28 마그네틱 비드를 준비하고 로드합니다.
- 웰당 200,000개의 셀이 있는 플레이트에서 5μL의 마그네틱 비드를 센서 카트리지의 지정된 웰로 피펫팅합니다.
- 주입용 매체로만 지정된 제어 웰을 준비합니다.
- 마지막 주입 후 농도 포스트가 oligomycin를 위한 2.5 μM, FCCP를 위한 2.0 μM, 및 rotenone와 antimycin A를 위한 0.5 μM가 되다 그래야 독의 양을 조정하십시오.
- 기기에 마이크로플레이트를 로드하기 전에 업데이트된 시점을 반영하도록 주입 계획이 수정되었는지 확인하십시오.
- 총 140분 동안 급성 TCR 자극을 실행하도록 소프트웨어를 프로그래밍합니다. 이 기간 내에 올리고마이신 주입 전에 x10 시점 측정이 있도록 계획을 수정합니다.
결과
해당작용 및 산화 대사 능력은 특정 시점에서 전자 전달 사슬의 구성 요소를 표적으로 하여 용량을 평가하는 미토콘드리아 기능 분석을 사용하여 측정할 수 있습니다(그림 2A). 센서 카트리지 포트에 다양한 주입 방식을 로드하여 기존 분석을 수정하고 급성 TCR 자극을 평가할 수 있습니다(그림 2B,C). 결과를 해석하기 전에 다양한 세포 유형에 대한 세포 수와 약물 농도를 최적화해야 합니다. 여기에서 이 보고서는 비접촉 세포와 효과기 세포 모두에서 용량을 측정하도록 최적화된 전자 전달 사슬의 억제제와 함께 CD8 T 세포(그림 3A, B)에 최적화된 조건을 설명합니다(그림 4A, B). 중요한 것은 이 분석법을 수정하여 항원 특이적 자극 또는 항-CD3/CD28 자극으로 생성된 effector CD8 T 세포의 TCR 자극을 연구할 수 있다는 것입니다. 또한 특히 리소포스파티딕산 또는 LPA를 사용한 생체 활성 지질 신호에 대한 CD8 T 세포 반응을 조사합니다. LPA 신호전달에 대한 반응(마이크로플레이트를 분석기 기기에 로드하기 30분, 2시간 또는 4시간 전)에 대한 대사 경향이 항원 특이적 또는 다클론 TCR 자극으로 활성화된 두 CD8 T 세포에서 유사하다는 것을 확인했습니다(그림 5A-D). TCR 자극의 유형과 활성화 메커니즘은 미묘한 차이를 초래했는데, 대사 에너지가 높은 세포는 초기에 항원 특이적 활성화로 생성되었습니다(그림 5E-L).
effector CD8 T cell에 anti-CD3/CD28을 급성 주입하면 실시간 측정으로 TCR을 급성으로 자극할 수 있습니다. 비오틴화된 항-CD3, 항-CD28 및 스트렙타비딘은 급성 주사 모델에서 TCR을 자극하기 위해 응집체에 사용할 수 있습니다. 별도의 방법으로, 이 생체 에너지 분석법에서 anti-CD3 및 anti-CD28에 접합된 마그네틱 비드를 사용하여 급성 주사를 수행하여 실시간으로 TCR을 자극할 수 있습니다. 분석 중 중간 시점에 비오틴화된 항-CD3, 항-CD28 + 스트렙타비딘 또는 비오틴화된 항-CD3 + 항-CD28 + 스트렙타비딘 응집체를 이펙터 OT-I CD8 T 세포에 주입하도록 모델을 조정했습니다(그림 6A,B). 항-CD3/CD28로 인한 자극을 관찰한 결과, OCR과 ECAR이 모두 증가했다. OCR 및 ECAR 신호도 상승했지만, 비오틴화된 항-CD3 신호만으로는 anti-CD3/CD28과 동일한 수준은 아니었습니다. 중요한 것은 항-CD3/CD28 마그네틱 비드 급성 주사와 유사한 유사한 대사 경향을 발견했다는 것입니다(그림 6C-F). 요컨대, 이러한 결과는 여러 접근 방식과 방법론을 통해 미토콘드리아 기능 분석이 림프구 면역대사, 특히 CD8 T 세포를 연구하는 데 강력하고 재현 가능하다는 것을 보여줍니다.

그림 1: 항원 특이적 및 다클론 자극을 통한 T 세포 수용체 활성화. (A) T 세포 수용체에 결합된 펩타이드를 갖는 주요 조직적합성 복합체(MHC) 클래스 I을 사용한 항원 특이적 신호전달의 개략도. (B) CD3 소단위체와 CD28 공동자극 분자를 항-CD3/28 항체와 결합시켜 CD8 T 세포 다클론 활성화를 묘사한 것. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
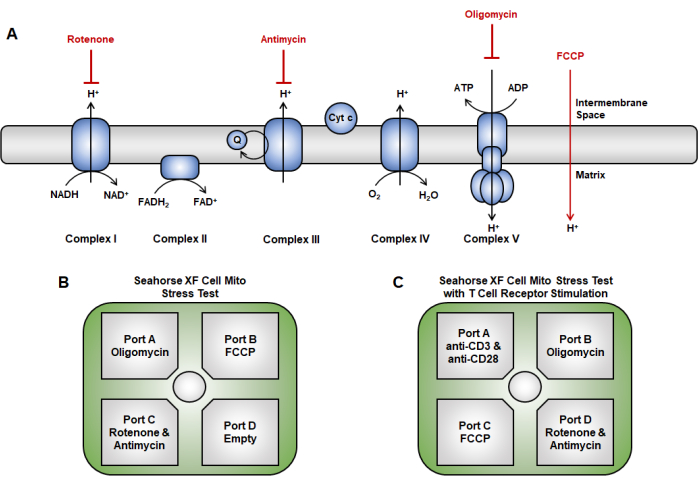
그림 2: 미토콘드리아 기능 분석에서 전자 전달 사슬의 약물 표적화. (A) 여기에 사용된 전자 전달 사슬 억제제(빨간색)의 개략도. (B,C) 미토콘드리아 기능 검사의 경우, 센서 카트리지의 주입 전략은 다음과 같습니다: (B) 올리고마이신을 포트 A에, FCCP를 포트 B에, 로테논 및 안티마이신 A를 포트 C에 로드하는 전통적인 주입 방식.(C) 급성 주입 방법은 급성 주사(anti-CD3/CD28)를 포트 A에, 올리고마이신을 포트 B에, FCCP를 포트 C에 배치하는 것입니다. 및 포트 D의 rotenone 및 antimycin A. 약어 : FCCP = 4- (trifluoromethoxy) phenyl) carbonohydrazonoyl dicyanide. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: LPA 처리 후 항-CD3 및 항-CD28 자극으로 생성된 CD8 T 세포의 CD8 및 CD44의 표면 발현, 생존력 및 대사 차이. (A) 효과기 CD8 T 세포는 마우스 유래 CD8 T 세포를 SIINFEKL (N4) 및 비장 세포로 자극하여 항원 제시 세포 또는 항원 제시 세포 또는 항 CD3 및 항 CD28 플레이트를 자극하여 생체 외 생성됩니다. 4일차에는 IL-2가 초기 자극을 대체하여 분화 및 증식을 지원합니다. 그런 다음 in vitro 배양 후 균일한 Day 7 effector CD8 T 세포를 유세포 분석을 통해 분석합니다. (B) T 세포는 림프구 상태에 대한 게이팅(gating)을 통해 CD8+/CD44+ 발현을 확인합니다. 대표적인 이미지는 CD8 및 CD44가 LPA 처리에 영향을 받지 않음을 보여줍니다. 이 그림은 Turner et al.9에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
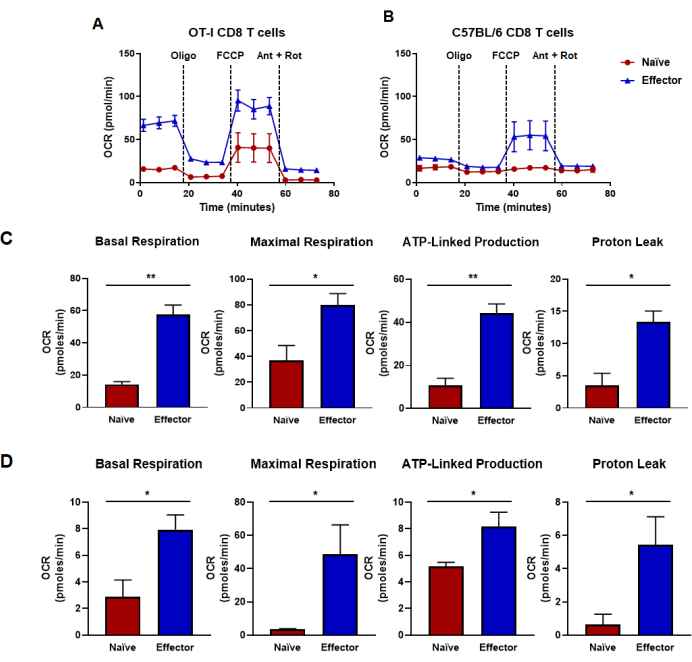
그림 4: 산소 소비율로 측정된 산화 능력. (A,B) (A) OT-I CD8 T 세포 항원 특이적 자극 및 증식 또는 (B) 야생형 C57B/6 마우스에서 CD8 T 세포의 항-CD3/CD28 다클론 자극 및 증식에 의해 생성된 미접촉 및 효과기 CD8 T 세포의 산소 소비율. 올리고마이신(Oligomycin), FCCP, 안티마이신 A 및 로테논(rotenone)을 18분 간격으로 25mM 포도당 배지를 주입하였다. 결과는 대표 데이터로 표시되며 n = 6 기술 반복을 사용하여 얻은 것입니다. (씨,디) 패널(A,B)에서 수행된 대사 플럭스 분석에서 파생된 용량 메트릭은 계산된 기저 호흡, 최대 호흡, ATP 관련 생산 및 양성자 누출을 표시합니다. (C) 대사 능력은 OT-I CD8 T 세포에서 결정되었으며 패널 (A)에 표시된 데이터와 일치합니다. (D) C57BL/6 CD8 T 세포에서 결정된 대사 능력으로 패널 (B)에 표시된 데이터와 일치합니다. 짝을 이루지 않은 학생의 t-검정 분석은 *p < 0.05, **p < 0.005, ***p < 0.0005, ****p < 0.0001인 전체 그림에 대해 수행되었습니다. 약어: OCR = 산소 소비율; 올리고 = 올리고마이신; FCCP = 4-(트리플루오로메톡시)페닐)카르보하이드라조노일 디시아나이드; 개미 = 안티마이신 A; rot = 로테논. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 항원 특이적 또는 다클론 활성화와 무관하게 LPA 수용체 신호전달에 대한 효과기 CD8 T 세포 반응의 유사한 경향.(A,B) CD8 T 세포 산소 소비율은 (A) OT-I CD8 T 세포 항원 특이적 자극 및 증식 또는 (B) 야생형 C57B/6 마우스에서 CD8 T 세포의 항-CD3/CD28 다클론 자극 및 증식에 의해 생성된 세포에서 측정됩니다. (씨,디) 이펙터 CD8 T 세포 세포 외 산성화 속도 측정은 (C) OT-I CD8 T 세포 항원 특이적 자극 및 증식 또는 (D) 야생형 C57B/6 마우스에서 CD8 T 세포의 항-CD3/CD28 다클론 자극 및 증식에 의해 생성된 세포에 대해 표시됩니다. CD8 T 세포의 대사 능력은 30분(녹색), 2시간(파란색) 또는 4시간(녹색) 동안 글루타민(빨간색) 또는 1μM LPA가 보충된 배지에서 측정되었습니다. 올리고마이신(Oligomycin), FCCP, 안티마이신 A 및 로테논(rotenone)을 18분 간격으로 25mM 포도당 배지를 주입하였다. 결과는 대표 데이터로 표시되며 n = 6 기술 반복을 사용하여 얻은 것입니다. (E-H) 패널(A,C)에서 수행된 대사 플럭스 분석에서 파생된 용량 메트릭은 계산된 기저 호흡, 최대 호흡, ATP 관련 생산 및 양성자 누출을 표시합니다. (I-L) 패널(B,D)에서 기저 호흡, 최대 호흡, ATP 관련 생산 및 양성자 누출을 보여주는 용량 계산. 전체 수치는 *p가 0.05인 일원 분산 분석< 사용하여 통계적으로 분석되었습니다. 약어: OCR = 산소 소비율; ECAR = 세포외 산성화 속도; 올리고 = 올리고마이신; FCCP = 4-(트리플루오로메톡시)페닐)카르보하이드라조노일 디시아나이드; 개미 = 안티마이신 A; rot = 로테논. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 항-CD3/CD28의 급성 주사를 통한 실시간 T 세포 수용체 자극 전략. (A,B) 미토콘드리아 기능 평가를 위한 비오틴화 항-CD3, 스트렙타비딘 및 항-CD28을 포함하는 급성 주사 전략. 패널은 항원 자극 OT-I effector CD8 T 세포의 대사 능력을 표시하며, 특히 (A) 세포 외 산성화 속도 및 (B) 산소 소비율을 보여줍니다. 주사는 배지(빨간색), 비오틴화 항-CD3(녹색), 항-CD28 + 스트렙타비딘(파란색) 또는 비오틴화 항-CD3 + 항-CD28 + 스트렙타비딘(청록색)의 조합을 사용합니다. (씨,디) 미토콘드리아 활성을 평가하기 위해 항-CD3/CD28과 접합된 자성 비드의 급성 주입. 패널은 항원 자극 OT-I effector CD8 T 세포의 대사 능력을 표시하며, 특히 (C) 세포 외 산성화 속도 및 (D) 산소 소비율을 보여줍니다. 주입은 매체(빨간색) 또는 anti-CD3/CD28 비드 주입(청록색)만 사용합니다. 분석은 25mM 포도당이 보충된 배지에서 18분 간격으로 올리고마이신, FCCP, 안티마이신 A 및 로테논을 주사하여 수행되었습니다. 결과는 대표 데이터로 표시되며 n = 6 기술 반복을 사용하여 얻은 것입니다. (E) 주사 전 시 기초 대사(빨간색), 주사 후 호흡(파란색) 및 최대 호흡 용량(회색)을 보여주는 패널(A-D)의 용량 계산. 조건은 intra-assay 주입을 기반으로 분리됩니다. (F) 기저 호흡, 최대 호흡, ATP 관련 생산 및 양성자 누출을 보여주는 용량 계산. 이 전체 수치에 대한 통계는 *p < 0.05, **p < 0.005, ***p < 0.0005, ****p < 0.0001인 일원 분산 분석을 사용하여 수행되었습니다. 약어: OCR = 산소 소비율; ECAR = 세포외 산성화 속도; 올리고 = 올리고마이신; FCCP = 4-(트리플루오로메톡시)페닐)카르보하이드라조노일 디시아나이드; 개미 = 안티마이신 A; rot = 로테논. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 기사에서는 미접촉 및 효과기 CD8 T 세포의 미토콘드리아 기능을 평가하기 위한 프로토콜에 대해 간략하게 설명합니다. OT-I 및 C57BL/6 마우스를 사용하여 항원 특이적 및 다클론 CD8 T 세포를 모두 준비하는 방법을 자세히 설명하고 비교합니다. 본 연구의 결과는 CD8 T 세포의 활성화 및 전처리 방법에도 불구하고 대사에 유사한 경향이 있음을 입증한다. 이 데이터는 항원 특이적 활성화가 항-CD3 및 항-CD28로 자극된 C57BL/6 야생형 세포에 비해 대사적으로 더 활발한 OT-I CD8 T 세포로 이어진다는 것을 밝혔습니다. 여기에 설명된 프로토콜은 미토콘드리아 기능 분석법인 Mito Stress Test가 매우 민감하고 일관되게 반복 가능한 분석법으로 다양한 조건과 세포 유형에 걸쳐 신뢰할 수 있는 결과를 생성한다는 것을 보여줍니다. 당사의 연구 결과와 상세한 프로토콜은 CD8 T 세포 대사 및 생체 에너지학을 분석하기 위한 기본 방법론으로서 이 분석법의 인식이 높아지는 데 기여합니다.
면역요법과 다양한 세포치료제가 계속 발전함에 따라 T세포 표적치료제의 적용의 중요성도 커지고 있다41. 면역요법 및 항종양 면역 반응에 대한 반응은 T 세포 매개 대사, 칼슘 신호 전달 및 업스트림 TCR 활성화에 의해 유발되는 산화 플럭스에 의존합니다42. 최적의 CD8 T 세포 반응을 위해서는 대사 효율과 유연성이 모두 필요하며 5,6,7,15,17,26,43 인 반면, 양성자 누출 증가와 그에 따른 산화 손상은 T 세포 반응을 손상시키고 기능 장애를 촉진합니다9, 44. T 세포 증식과 사이토카인 생산은 모두 미토콘드리아 산화 스트레스를 완화함으로써 구제될 수 있습니다 5,13,20,24,25,29. 우리의 실험에서 우리는 생존력을 유지하는 IL-2에서 배양된 미성숙한 CD8 T 세포를 사용했습니다. 그러나 이러한 CD8 T 세포는 더 이상 진정한 순진한 CD8 T 세포와 동일하지 않습니다. 따라서 우리는 더 나은 품질의 데이터와 사이토카인의 영향을 덜 받는 세포를 위해 마우스에서 직접 Naive CD8 T 세포를 사용하기로 결정했습니다. 전체적으로 T 세포 하위 집합 전반에 걸쳐 대사를 검사하기 위한 기술을 최적화하는 것이 중요합니다.
CD8 T 세포의 운명은 부분적으로 대사 프로그래밍에 의해 지시되며, 이는 적응 면역 반응에 영향을 미칩니다 2,4,45. 나이브 CD8 T 세포는 TCR 자극 25,46,47,48,49,50에 의해 정지 상태를 벗어납니다. 그럼에도 불구하고, 지속적인 TCR 자극은 CD8 T 세포 고갈을 초래하여 기능적 CD8 T 세포에 비해 현저히 덜 에너지 표현형을 초래합니다 3,20,51,52. 그러나 신진대사에 대한 이러한 영향은 개선될 수 있으며 잠재적으로 소진된 CD8 T 세포 2,3,20,46,51,52를 활성화할 수 있습니다. CD8 T 세포의 운명과 철저한 분화를 관장하는 정확한 메커니즘은 아직 잘 알려져 있지 않지만, 기능 장애 및/또는 소진된 CD8 T 세포는 특징적으로 CD8 T 세포 효과기 기능을 조절하는 핵심 요소인 미토콘드리아에 결함이 있고 ROS가 과잉 생산됩니다 9,15,53. CD8 T 세포 대사, 표현형 및 철저한 분화는 Mito Stress Test를 사용하여 연구되었습니다. 역사적으로 효과기 기능의 점진적인 상실을 초래하는 지속적인 TCR 자극은 CD8 T 세포 고갈을 정의합니다11 , 13 , 16 , 17. 그러나 소진된 CD8 T 세포를 더 잘 특성화하고 염색질 및 전사 풍경이 고갈을 정의하고 대사 플럭스와 밀접한 관련이 있음을 보여주기 위한 최근의 노력이 있었습니다 18,27,28. 전체적으로 지속적인 TCR 자극과 그에 따른 표현형 및 대사 후유증을 Mito Stress Test로 연구하여 대사 취약성과 운명을 결정하는 사건을 잠재적으로 식별할 수 있습니다.
TCR의 자극은 과립 엑소사이토시스(granule exocytosis)와 유도된 T 세포 사멸에 필요한 다운스트림 칼슘 신호를 시작한다24,33. 특히, 인플라마솜 활성화 및 IFNγ 생성과 같은 선행 사건은 지속적이고 지속적인 ATP54에 의존합니다. 칼슘 신호가 전달되는 동안, "미토콘드리아 섬광" 현상으로 알려진 미토콘드리아 효율의 조절 장애가 보고됩니다 55,56,57,58. 미토콘드리아 섬광은 활발하게 호흡하는 미토콘드리아가 잠시 동안 연결되지 않은 호흡을 경험하여 ATP가 감소하고 ROS55,56이 증가하는 과정을 나타냅니다. 미토콘드리아 섬광에 대한 연구는 제한적이었으며 CD8 T 세포에서의 관련성은 널리 연구되지 않은 상태로 남아 있습니다. 중요한 것은 이 연구에서 설명한 방법론을 활용하여 이러한 현상, CD8 T 세포의 철저한 분화 및 기타 면역 세포 프로파일을 조사할 수 있다는 것입니다.
요약하면, 이러한 방법론과 도구는 급성 및 만성 대사를 모두 연구하기 위한 보다 포괄적인 접근 방식을 제공합니다. Mito Stress Test는 대사 프로그래밍을 검사하고 CD8 T 세포에서 effector 기능 장애 및 완전한 분화를 조절하는 방법을 조사하는 데 적용할 수 있습니다. 림프구의 대사 재프로그래밍은 면역 관용, CD8 T 세포 기능 장애 및 소진된 면역 반응의 기전을 이해하는 데 중요한 요소가 될 수 있습니다. 또한, 대사 및/또는 지질 매개체는 CD8 T 세포의 세포독성 및 고갈9에 중요한 역할을 하므로 고갈을 예방하거나 잠재적으로 역으로 하여 항종양 면역을 감소시키기 위한 새로운 접근법으로 표적화될 수 있습니다. 전체적으로 Cell Mito Stress Test 분석법은 면역대사에 대한 이러한 해결되지 않은 질문을 해결하는 데 활용해야 하는 강력한 도구입니다.
공개
저자는 공개할 경쟁 이해관계가 없습니다.
감사의 말
Hertz 재단, Amy Davis 재단, Moore Family Foundation 및 Heidi Horner 재단은 귀중한 지원을 제공해 주었으며, 이에 대해 감사하고 있습니다. 이 작업은 RMT(AI052157, AI136534)에 대한 NIH 보조금의 일부 지원을 받았으며 JAT는 Hertz Graduate Fellowship의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Anti-CD28 | Biolegend | 102116 | |
| Anti-CD3/CD28 Dynabeads | ThermoFisher | 11456D | |
| Biotinylated anti-CD3 | Biolegend | 317320 | |
| Bovine Serum Albumin | Sigma-Aldrich | 108321-42-2 | |
| CD8a+ T cell isolation kit | Miltenyi Biotec | 130-104-075 | |
| Cell Strainers (100 µm) | CELL TREAT | 229485 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E8008 | |
| Ficoll | Sigma-Aldrich | 26873-85-8 | density gradient medium |
| FCCP ((4-(trifluoromethoxy) phenyl) carbonohydrazonoyl dicyanide) | Sigma-Aldrich | C2920 | |
| Glucose | Sigma-Aldrich | G-6152 | |
| Glutamine | Sigma-Aldrich | G7513 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | Positive selection columns |
| Magnetic cell separation column | Miltenyi Biotec | 130-042-301 | |
| Microplate | Agilent | 102601-100 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Pyruvate | Sigma-Aldrich | 113-24-6 | |
| Recobinant IL-2 | PeproTech | 200-02 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Seahorse media | Agilent | 103576-100 | |
| Sensor cartridge | Agilent | 102601-100 | |
| Streptavidin | Sigma-Aldrich | A9275 | |
| Sterile 6 well plate | CELL TREAT | 230601 | |
| Sterile 24 well plate | CELL TREAT | 229524 | |
| XF Calibrant | Agilent | 102601-100 |
참고문헌
- Patsoukis, N., et al. PD-1 alters T-cell metabolic reprogramming by inhibiting glycolysis and promoting lipolysis and fatty acid oxidation. Nat Commun. 6, 6692 (2015).
- Scharping, N. E., et al. Mitochondrial stress induced by continuous stimulation under hypoxia rapidly drives T cell exhaustion. Nat Immunol. 22, 205-215 (2021).
- Schurich, A., et al. Distinct Metabolic Requirements of Exhausted and Functional Virus-Specific CD8 T Cells in the Same Host. Cell Rep. 16 (5), 1243-1252 (2016).
- Zhang, L., Romero, P. Metabolic control of CD8(+) T cell fate decisions and antitumor immunity. Trends Mol Med. 24 (1), 30-48 (2018).
- Batabyal, R., et al. Metabolic dysfunction and immunometabolism in COVID-19 pathophysiology and therapeutics. Int J Obes (Lond). 45 (6), 1163-1169 (2021).
- Chavakis, T. Immunometabolism: Where immunology and metabolism meet. J Innate Immun. 14, 1-3 (2022).
- Frezza, C., Mauro, C. Editorial: The metabolic challenges of immune cells in health and disease. Front Immunol. 6, 293 (2015).
- Wang, X., Ping, F. F., Bakht, S., Ling, J., Hassan, W. Immunometabolism features of metabolic deregulation and cancer. J Cell Mol Med. 23 (2), 694-701 (2019).
- Turner, J. A., et al. Lysophosphatidic acid modulates CD8 T cell immunosurveillance, metabolism, and anti-tumor immunity. Nat Commun. 14, 3214 (2023).
- Coussens, L. M., Werb, Z. Inflammation and cancer. Nature. 420, 860-867 (2002).
- Jiang, Y., Li, Y., Zhu, B. T-cell exhaustion in the tumor microenvironment. Cell Death Dis. 6 (6), e1792 (2015).
- Krangel, M. S. Mechanics of T cell receptor gene rearrangement. Curr Opin Immunol. 21 (2), 133-139 (2009).
- Barber, D. L., et al. Restoring function in exhausted CD8 T cells during chronic viral infection. Nature. 439, 682-687 (2006).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Bengsch, B., et al. Bioenergetic insufficiencies due to metabolic alterations regulated by the inhibitory receptor PD-1 are an early driver of CD8(+) T cell exhaustion. Immunity. 45 (2), 358-373 (2016).
- Blank, C. U., et al. Defining 'T cell exhaustion'. Nat Rev Immunol. 19, 665-674 (2019).
- Dolina, J. S., Van Braeckel-Budimir, N., Thomas, G. D., Salek-Ardakani, S. CD8(+) T cell exhaustion in cancer. Front Immunol. 12, 715234 (2021).
- Mognol, G. P., et al. Exhaustion-associated regulatory regions in CD8(+) tumor-infiltrating T cells. Proc Natl Acad Sci U S A. 114 (13), E2776-E2785 (2017).
- Wang, D., et al. A comprehensive profile of TCF1(+) progenitor and TCF1(-) terminally exhausted PD-1(+)CD8(+) T cells in head and neck squamous cell carcinoma: implications for prognosis and immunotherapy. Int J Oral Sci. 14 (1), 8 (2022).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21, 1022-1033 (2020).
- Kang, S., Brown, H. M., Hwang, S. Direct antiviral mechanisms of interferon-gamma. Immune Netw. 18 (5), e33 (2018).
- Samuel, C. E. Antiviral actions of interferons. Clin Microbiol Rev. 14, 778-809 (2001).
- Schellekens, H., Weimar, W., Cantell, K., Stitz, L. Antiviral effect of interferon in vivo may be mediated by the host. Nature. 278, 742 (1979).
- Radoja, S., et al. CD8(+) tumor-infiltrating T cells are deficient in perforin-mediated cytolytic activity due to defective microtubule-organizing center mobilization and lytic granule exocytosis. J Immunol. 167 (9), 5042-5051 (2001).
- van der Windt, G. J., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Balmer, M. L., et al. Memory CD8(+) T cells require increased concentrations of acetate induced by stress for optimal function. Immunity. 44 (6), 1312-1324 (2016).
- Pereira, R. M., Hogan, P. G., Rao, A., Martinez, G. J. Transcriptional and epigenetic regulation of T cell hyporesponsiveness. J Leukoc Biol. 102, 601-615 (2017).
- Sen, D. R., et al. The epigenetic landscape of T cell exhaustion. Science. 354, 1165-1169 (2016).
- Quintana, A., et al. T cell activation requires mitochondrial translocation to the immunological synapse. Proc Natl Acad Sci U S A. 104 (36), 14418-14423 (2007).
- Brindley, D. N. Lysophosphatidic acid signaling in cancer. Cancers (Basel). 12 (12), 3791 (2020).
- Chae, C. S., et al. Tumor-derived lysophosphatidic acid blunts protective type I interferon responses in ovarian cancer. Cancer Discov. 12, 1904-1921 (2022).
- Kremer, K. N., et al. LPA suppresses T cell function by altering the cytoskeleton and disrupting immune synapse formation. Proc Natl Acad Sci U S A. 119 (15), e2118816119 (2022).
- Mathew, D., et al. LPA5 is an inhibitory receptor that suppresses CD8 T-cell cytotoxic function via disruption of early TCR signaling. Front Immunol. 10, 1159 (2019).
- Mathew, D., Torres, R. M. Lysophosphatidic acid is an inflammatory lipid exploited by cancers for immune evasion via mechanisms similar and distinct from CTLA-4 and PD-1. Front Immunol. 11, 531910 (2020).
- Oda, S. K., et al. Lysophosphatidic acid inhibits CD8 T cell activation and control of tumor progression. Cancer Immunol Res. 1 (4), 245-255 (2013).
- Lidgerwood, G. E., Pitson, S. M., Bonder, C., Pebay, A. Roles of lysophosphatidic acid and sphingosine-1-phosphate in stem cell biology. Prog Lipid Res. 72, 42-54 (2018).
- Torres, R. M., Turner, J. A., D'Antonio, M., Pelanda, R., Kremer, K. N. Regulation of CD8 T-cell signaling, metabolism, and cytotoxic activity by extracellular lysophosphatidic acid. Immunol Rev. 317 (1), 203-222 (2023).
- Turner, J. A., et al. BRAF modulates lipid use and accumulation. Cancers (Basel). 14 (9), 2110 (2022).
- Hogquist, K. A., et al. T cell receptor antagonist peptides induce positive selection. Cell. 76, 17-27 (1994).
- Li, Y., Kurlander, R. J. Comparison of anti-CD3 and anti-CD28-coated beads with soluble anti-CD3 for expanding human T cells: differing impact on CD8 T cell phenotype and responsiveness to restimulation. J Transl Med. 8, 104 (2010).
- Ralli, M., et al. Immunotherapy in the treatment of metastatic melanoma: current knowledge and future directions. J Immunol Res. 2020, 9235638 (2020).
- Philip, M., Schietinger, A. CD8(+) T cell differentiation and dysfunction in cancer. Nat Rev Immunol. 22, 209-223 (2022).
- Bajrai, L. H., et al. Understanding the role of potential pathways and its components including hypoxia and immune system in case of oral cancer. Sci Rep. 11, 19576 (2021).
- Nicholls, D. G. Mitochondrial proton leaks and uncoupling proteins. Biochim Biophys Acta Bioenerg. 1862, 148428 (2021).
- Tyrakis, P. A., et al. S-2-hydroxyglutarate regulates CD8(+) T-lymphocyte fate. Nature. 540, 236-241 (2016).
- Guo, Y., et al. Metabolic reprogramming of terminally exhausted CD8(+) T cells by IL-10 enhances anti-tumor immunity. Nat Immunol. 22, 746-756 (2021).
- Notarangelo, G., et al. Oncometabolite d-2HG alters T cell metabolism to impair CD8(+) T cell function. Science. 377 (6614), 1519-1529 (2022).
- Yang, K., et al. T cell exit from quiescence and differentiation into Th2 cells depend on Raptor-mTORC1-mediated metabolic reprogramming. Immunity. 39 (6), 1043-1056 (2013).
- Ricciardi, S., et al. The translational machinery of human CD4(+) T cells is poised for activation and controls the switch from quiescence to metabolic remodeling. Cell Metab. 28 (6), 895-906.e5 (2018).
- Moller, S. H., Hsueh, P. C., Yu, Y. R., Zhang, L., Ho, P. C. Metabolic programs tailor T cell immunity in viral infection, cancer, and aging. Cell Metab. 34 (3), 378-395 (2022).
- Alrubayyi, A., et al. Functional restoration of exhausted CD8 T cells in chronic HIV-1 infection by targeting mitochondrial dysfunction. Front Immunol. 13, 908697 (2022).
- Vignali, P. D. A., et al. Hypoxia drives CD39-dependent suppressor function in exhausted T cells to limit antitumor immunity. Nat Immunol. 24, 267-279 (2023).
- Ogando, J., et al. PD-1 signaling affects cristae morphology and leads to mitochondrial dysfunction in human CD8(+) T lymphocytes. J Immunother Cancer. 7 (1), 151 (2019).
- Billingham, L. K., et al. Mitochondrial electron transport chain is necessary for NLRP3 inflammasome activation. Nat Immunol. 23, 692-704 (2022).
- Eberhardt, D. R., et al. EFHD1 ablation inhibits cardiac mitoflash activation and protects cardiomyocytes from ischemia. J Mol Cell Cardiol. 167, 1-14 (2022).
- Hou, T., et al. Identification of EFHD1 as a novel Ca(2+) sensor for mitoflash activation. Cell Calcium. 59 (5), 262-270 (2016).
- Mun, S. A., et al. Structural and biochemical characterization of EFhd1/Swiprosin-2, an actin-binding protein in mitochondria. Front Cell Dev Biol. 8, 628222 (2020).
- Stein, M., et al. A defined metabolic state in pre B cells governs B-cell development and is counterbalanced by Swiprosin-2/EFhd1. Cell Death Differ. 24 (7), 1239-1252 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유