Method Article
Medición de la función mitocondrial de los linfocitos T CD8 vírgenes y efectores
En este artículo
Resumen
La bioenergética de las células T CD8 se puede interrogar mediante la prueba de esfuerzo de Mito. Esta metodología se puede utilizar para estudiar la programación metabólica aguda y crónica. Este protocolo describe enfoques para examinar las relaciones entre la biología de los receptores de células T y el análisis bioenergético.
Resumen
La comprensión de cómo el inmunometabolismo afecta la función, la diferenciación y el destino de los linfocitos ha atraído un gran interés y atención. La biología de los linfocitos se ha explorado mediante análisis bioenergético y ahora se ha convertido en una herramienta de importancia crítica en el campo. Por lo tanto, se buscó optimizar un ensayo de análisis bioenergético que pueda ser adaptado con pretratamientos e inyección aguda para la estimulación de receptores. Aquí, evaluamos el metabolismo ex vivo de las células T CD8 utilizando la prueba de estrés Cell Mito para evaluar las tasas de consumo de oxígeno y acidificación extracelular en células T CD8 naïve y efectoras. Los linfocitos T CD8 efectores específicos de antígenos se derivaron mediante estimulación ex vivo , y los linfocitos T CD8 naïve se recolectaron de esplenocitos y se aislaron con separación magnética en columna de perlas.
Los pretratamientos se realizan en microplacas y detallamos cómo preparar los cartuchos de sensores. Mostramos cómo los puertos de inyección pueden cargarse con fármacos para medir indirectamente las capacidades metabólicas y con moduladores metabólicos, este protocolo se puede utilizar para estudiar la actividad enzimática específica. Las estimulaciones de los receptores de células T se pueden estudiar en tiempo real con inyección aguda y la estimulación con anti-CD3/CD28 utilizando los puertos de inyección. Los analizadores de instrumentos se utilizan para las mediciones y la recopilación de datos, y la visualización de datos se realiza con programas de software para interpretar el metabolismo celular. Esta estrategia produce una gran cantidad de datos sobre la biología de las células inmunitarias y la bioenergética mitocondrial, lo que permite a los investigadores personalizar el protocolo de numerosas maneras para explorar el metabolismo de las células T CD8.
Introducción
El destino y la funcionalidad de las células inmunitarias se ven significativamente afectados por el metabolismo, el consumo oxidativo y la respiración anaeróbica 1,2,3,4. Recientemente, ha habido un creciente interés en dirigirse a la modulación metabólica como una estrategia para reprogramar o revitalizar el destino y la función efectora de las células T CD8 y mejorar el aclaramiento viral o mejorar la inmunidad antitumoral endógena 5,6,7,8,9. En particular, la señalización del receptor de antígeno a través del receptor de células T (TCR) es un requisito clave para la diferenciación de las células T CD8, lo que resulta en la señalización y activación posteriores 10,11,12 (Figura 1). La exposición prolongada a las agresiones inmunológicas provoca una estimulación persistente del antígeno específico en el TCR, lo que finalmente conduce a estados de inflamación crónica, fatiga de las células T, una remodelación del microambiente inmunitario y escape inmunitario 11,13,14,15,16,17,18,19.
El metabolismo de los linfocitos T CD8 agotados es fundamentalmente distinto del de los linfocitos T CD8 efectores funcionales 2,3,14,15,18,20. La diferenciación de las células T, la secreción de interferón γ (IFNγ) y la capacidad de recuerdo están, en parte, determinadas por la función mitocondrial y los productos de descomposición de la β oxidación. Los linfocitos T CD8 IFNγ+ son componentes críticos de las respuestas inmunitarias antitumorales y antivirales 21,22,23. El flujo metabólico específico a través de la glucólisis y la cadena de transporte de electrones es importante para la activación de las células T CD8, la secreción de citocinas y las respuestas de memoria 4,11,13,15,18,24,25,26,27,28 . Las respuestas óptimas, incluyendo la activación de los linfocitos T y la diferenciación de los efectores, requieren una respuesta mitocondrial coordinada y específica, mientras que los defectos mitocondriales y el exceso de especies reactivas de oxígeno (ROS) caracterizan a los linfocitos T agotados o disfuncionales 9,29. Recientemente, la estimulación persistente del TCR de las células T CD8 in vitro promueve la diferenciación exhaustiva de las células T CD8 en parte mediante la inducción del estrés oxidativo y la reprogramación del metabolismo oxidativo y las capacidades metabólicas necesarias para la proliferación de las células T 1,2,13,20,24,29. En conjunto, los ejes de control metabólico son componentes críticos para dirigir la diferenciación de las células T CD8 y su progresión a fenotipos efectores, de memoria o agotados/disfuncionales.
Los compuestos metabólicos también dirigen las respuestas de las células inmunitarias al funcionar como moléculas de señalización autocrinas o paracrinas 9,30,31,32,33,34,35. La esfingosina-1-fosfato (S1P) y el ácido lisofosfatídico (LPA) son lípidos bioactivos e inflamatorios que señalizan a través de receptores acoplados a proteínas G (GPCR) para modular la salida de linfocitos y la citotoxicidad de los linfocitos T CD836. La señalización de LPA a través de los receptores GPCR LPA en las células T CD8 reprograma el metabolismo para aumentar la lipólisis, la oxidación de ácidos grasos y la fuga de protones. En conjunto, la bioenergética y el metabolismo de las células T CD8 están impulsados en gran medida por la disponibilidad de sustrato, las señales ambientales y los requisitos energéticos.
Las metodologías para interrogar el metabolismo de las células T CD8 se han vuelto cada vez más importantes. La prueba de esfuerzo Cell Mito proporciona una evaluación integral de la bioenergética y ahora es reconocida como una técnica distintiva en el campo del inmunometabolismo y la energética de las células T CD8 9,37. Las células adherentes se utilizaron históricamente para el ensayo de la prueba de esfuerzo de Mito38; sin embargo, existe un interés creciente en la aplicación de este protocolo para células cultivadas en suspensión y, específicamente, en el uso de células inmunitarias para el ensayo Cell Mito Stress Test. Aquí, presentamos un protocolo detallado para medir la actividad metabólica de las células T CD8 basado en nuestra reciente publicación9. Proporcionamos una explicación detallada de la expansión de las células T CD8, el aislamiento previo de las células T CD8, la preparación del ensayo y el tratamiento con protocolos para pretratamientos e inyecciones agudas en el ensayo Cell Mito Stress Test. Es importante destacar que comparamos y contrastamos múltiples métodos para la estimulación del TCR y la activación de las células T CD8, incluida la estimulación del TCR policlonal y específica del antígeno.
Este protocolo detalla la estimulación específica del antígeno utilizando ratones transgénicos OT-I (un modelo clásico de ratón transgénico) para los que todas las células T de ratón expresan los mismos genes Vα2 y Vβ5 39. Todos los linfocitos T CD8 de ratón OT-I albergan el mismo TCR que es específico contra el octapéptido de ovoalbúmina (OVA257-264, también escrito como la secuencia de aminoácidos SIINFEKL o N4, un epítopo ampliamente estudiado que, al presentarse por un complejo mayor de histocompatibilidad (MHC) de clase I, activa los linfocitos T CD8 citotóxicos39 (Figura 1A). En general, el modelo de ratón transgénico OT-I es ampliamente utilizado por los inmunólogos para estudiar la señalización de TCR y la función efectora de las células T específicas del antígeno. A diferencia de la activación monoclonal con el modelo de ratón OT-I, los linfocitos T CD8 policlonales pueden generarse con anticuerpos anti-CD3/CD28 contra las subunidades CD3 de TCR y la molécula coestimuladora CD2840 (Figura 1B). Los anticuerpos anti-CD3/CD28 evitan el componente específico del antígeno de la señalización TCR para activar una población policlonal de células T40. En última instancia, los resultados descritos en este informe comparan múltiples métodos para utilizar la prueba de esfuerzo Cell Mito para cuantificar el flujo metabólico dinámico en las células T CD8.
Protocolo
Los ratones se mantuvieron en un ambiente libre de patógenos y se mantuvieron de acuerdo con las normas y regulaciones del Comité Institucional de Cuidado y Uso de Animales.
1. Generación y expansión de linfocitos T CD8 mediante estimulación específica de antígeno
- El primer día, cosecha esplenocitos derivados de ratones OT-I; a continuación, prepararlos y activarlos in vitro con el péptido SIINFEKL (4).
- Limpie el espacio de la campana, prepare los reactivos y recoja el medio para ratones. Caliente el medio del ratón en una incubadora de agua o de perlas.
- En una placa de 6 pocillos, coloque 7 ml de medio para ratones en un pocillo y luego otros 3 ml de medio para ratones en un pocillo diferente. Después, inserte un colador en el pocillo que contenga 7 mL de medio.
- Lleva un ratón al laboratorio desde el vivero en una jaula de transferencia. Transfiera el ratón a una jaula nueva vacía y coloque el adaptador de CO2 en la parte superior. Eutanasiar el ratón con CO2 hasta un nivel de flujo de 2,75.
- Observe cuidadosamente al ratón y observe si hay signos de angustia. Después de la última respiración, esté atento a los signos de respiración y vida durante al menos 1 minuto. Apague el CO2 y realice la luxación cervical como método secundario de eutanasia. Luego, limpie la mesa, la jaula y el resto del área de trabajo y lleve el mouse a la campana de disección.
- Disecciona el bazo del ratón.
- Use etanol al 70% para esterilizar el equipo de disección y, colocando el ratón con el lado izquierdo hacia abajo, rocíe el lado izquierdo del ratón para desinfectar.
- Con instrumentos limpios, diseccione para extraer la piel e identificar el peritoneo. Haga una pequeña incisión a través del peritoneo para encontrar el bazo y luego extirpar el bazo. Coloque el bazo en la placa de 6 pocillos encima del colador.
- Limpie el área, coloque la carcasa del ratón en una bolsa de desecho y luego coloque la bolsa en un congelador para su eliminación.
- Asegúrese de que toda el área esté limpia y mueva la placa de 6 pocillos a la campana de cultivo de tejidos para los siguientes pasos.
- En la campana de cultivo de tejidos, homogeneice el bazo y vuelva a suspender las células en una suspensión unicelular sin grumos.
- Empuje el bazo a través del colador hacia el pocillo con 7 mL de medio con el émbolo de una jeringa de 5 mL.
- Enjuague el colador y cualquier tejido residual con 3 mL de medio en el pocillo adicional.
- Transfiera la suspensión celular con una pipeta serológica a un nuevo tubo cónico de 10 mL.
- Centrifugar durante 5 min a 500 × g y aspirar el sobrenadante con una pipeta de vidrio.
- Lisar los glóbulos rojos.
- Comience el proceso de lisis de glóbulos rojos utilizando 1 mL de tampón de lisis ACK resuspendiendo las células en el tampón de lisis ACK e incubando a temperatura ambiente durante 1-5 minutos.
NOTA: El tiempo de incubación debe optimizarse para el lote específico de tampón de lisis ACK para lograr la máxima lisis de glóbulos rojos con una muerte mínima de los esplenocitos. - Añadir 10 mL de medio al tubo cónico para neutralizar y centrifugar durante 5 min a 500 × g.
- Vuelva a suspender las células en 50 mL de medio y transfiéralas a un matraz T75.
- Comience el proceso de lisis de glóbulos rojos utilizando 1 mL de tampón de lisis ACK resuspendiendo las células en el tampón de lisis ACK e incubando a temperatura ambiente durante 1-5 minutos.
- Estimula las células con el péptido SIINFEKL (N4).
- Lleve el péptido SIINFEKL a la campana de cultivo de tejidos. Almacene el péptido SIINFEKL a -20 °C.
- Añada SIINFEKL directamente al medio para lograr una concentración final de 2 μg/mL. Añadir 50 μL de SIINFEKL (2 mg/mL) a 50 mL de medio para lograr una concentración final de 2 μg/mL.
- Incubar las células a 37 °C durante 72 h.
- Desinfecte la campana de cultivo de tejidos con etanol al 70%.
- Limpie el espacio de la campana, prepare los reactivos y recoja el medio para ratones. Caliente el medio del ratón en una incubadora de agua o de perlas.
- Al cuarto día, lavar las células para eliminar el péptido. Utilizando medios recién preparados suplementados con IL-2, vuelva a suspender las células y luego devuelva el matraz a la incubadora.
- Recoja las células del matraz de cultivo de tejidos T75 en un tubo cónico de 50 mL. Centrifugar y pelletizar las células T CD8 OT-I y, a continuación, eliminar el exceso de medios con aspiración. Añada 50 mL de nuevo medio de ratón que contenga 1.000 U/mL de IL-2 y transfiera la resuspensión de las células a un nuevo matraz T75.
- Para el almacenamiento, mantenga las alícuotas de las existencias de IL-2 en un congelador a -80 °C. El almacenamiento a -80 °C minimizará la degradación de los péptidos.
- Preparación de linfocitos T CD8 citotóxicos específicos de antígeno expandido para el ensayo de función mitocondrial
- Al séptimo día, se realiza el ensayo de función mitocondrial. Prepare la célula T CD8 OT-I específica del antígeno para el ensayo.
- Recoja células T CD8 vivas.
- Transfiera las células del matraz de cultivo de tejidos T-75 a un nuevo tubo cónico de 50 mL. A continuación, centrifugar el tubo cónico durante 5 min a 500 × g.
- En un nuevo tubo cónico de 50 mL, pipete 20 mL de un medio de gradiente de densidad (densidad = 1,077 g/mL) mientras las células están girando.
- Una vez finalizada la centrifugación, tome el tubo cónico y utilizando 10 mL de medio, vuelva a suspender las células. Luego, pipeteando muy lentamente, coloque las células resuspendidas en capas sobre el gradiente de densidad. Sin alterar la pendiente, centrifugar el tubo cónico a 1.300 × g durante 20 minutos a temperatura ambiente con el ajuste ajustado a aceleración máxima y deceleración mínima sin freno.
- Cuando se complete la centrifugación, use una pipeta P1000 para recolectar la capa intermedia de células T. Visualice la capa celular y asegúrese de que la pipeta permanezca por encima y no moleste la capa. Transfiera las células recolectadas a un tubo cónico fresco de 50 mL que contenga 30 mL de medio de ratón completo. A continuación, centrifugar el tubo cónico de 50 ml a 500 × g durante 5 min. Cuando se complete la centrifugación, aspire el exceso de sobrenadante de las células T OT-I CD8. Con 20 mL de medio fresco para ratones, vuelva a suspender las células.
- Con un hemocitómetro, cuente el número total de células viables. Tiñe una pequeña alícuota de células con azul de tripán en una dilución 1:4 para identificar las células muertas.
NOTA: Se pueden esperar aproximadamente 40-60 × 106 celdas de un mouse OT-I. - Con un paso de centrifugación adicional, lave las células restantes con 20 ml adicionales de medio de ratón fresco. Luego, usando una microplaca, pipeteó las células 200.000 células/pocillo en medio completo de ratón.
2. Generación y expansión de células T CD8 poliespecíficas mediante estimulación anti-CD3/anti-CD28
- El día 0, cubra una placa de 24 pocillos con CD3. Agregue 1 mL de biotina anti-CD3 a una concentración de 5 μg/mL, diluido en PBS, a cada pocillo de una placa de 24 pocillos. Coloque la placa en una incubadora humidificada con 5% de CO2 durante la noche.
- Al día siguiente, cosecha un ratón y recoge los esplenocitos. Activar los esplenocitos in vitro con anti-CD3/anti-CD28 siguiendo los pasos 1.1.1-1.1.5.3.
- Utilizando el protocolo de separación magnética de perlas, aísle las células T CD8.
NOTA: Asegúrese de que las celdas se mantengan frías. En condiciones de preenfriamiento, trabaje rápidamente.- Usando 40 μL de tampón MACS, vuelva a suspender las celdas con 10.000.000 de células por cada 40 μL de tampón MACS. A la solución, mezcle bien 10 μL de cóctel de anticuerpos de biotina en la solución celular y luego incube durante 5 minutos a 4 °C.
- Mientras espera que la célula se incube en el refrigerador, prepare una columna para la selección positiva. Utilice 3 ml de tampón para lavar la columna y luego deseche el flujo de residuos.
- Después de 5 minutos, recoja la solución de célula y anticuerpo del refrigerador y agregue 30 μL de tampón MACS por cada 10.000.000 de células, 20 μL de antibiotina y luego incube a 4 °C durante 10 minutos adicionales.
- Prepare un nuevo tubo de recolección debajo de una columna de selección positiva utilizando un tubo cónico nuevo de 15 mL. Una vez completada la incubación de 10 minutos, transfiera la suspensión celular a la columna de selección positiva. En un tubo cónico nuevo de 15 mL, recoja el flujo. Con 3 ml de tampón MACS, lave la columna para recoger las células residuales.
NOTA: Asegúrese de que la suspensión celular tenga un volumen mínimo de 0,5 mL. - Vuelva a colocar las células T CD8 seleccionadas positivamente en la placa de 24 pocillos para la estimulación anti-CD3/anti-CD28.
- Centrifugar el caudal a 500 × g durante 5 min a 4 °C. Aspirar el exceso de sobrenadante y pipetear las células para volver a suspenderlas en solución. Con un hemacitómetro y azul de tripano, cuente las celdas.
NOTA: Espere ~ 8-10 × 106 células vivas que se contarán por bazo de ratón. - Después de contar las células, vuelva a suspender las células T CD8 a 500.000 células por ml. Luego, aspire cuidadosamente 1 ml de PBS de la placa de 24 pocillos, vuelva a colocar las celdas contadas en la placa de 24 pocillos y agregue de 10a 6 celdas por pocillo.
- Para estimular las células, pipetee anti-CD28 en la placa de 24 pocillos de modo que la concentración final de anti-CD28 sea de 2 μg/mL. Para mezclar las celdas, golpee con cuidado el plato. Mantenga las celdas a 37 °C durante las próximas 72 h.
- Centrifugar el caudal a 500 × g durante 5 min a 4 °C. Aspirar el exceso de sobrenadante y pipetear las células para volver a suspenderlas en solución. Con un hemacitómetro y azul de tripano, cuente las celdas.
- Con etanol al 70%, limpie la campana de cultivo de tejidos.
- El día 4 (72 h después), retire las células de la estimulación anti-CD3/anti-CD28. Lave las células centrifugando las células T CD8 policlonales. Eliminar el exceso de sobrenadante por aspiración y luego resuspender las células con medio de ratón fresco con 1.000 unidades/mL de IL-2 con 10 mL de medio. Transfiera las células resuspendidas a una nueva placa de 6 pocillos y colóquela en la incubadora.
NOTA: 1.2.2. Para el almacenamiento, las alícuotas de las existencias de IL-2 se pueden almacenar en un congelador a -80 °C. El almacenamiento a -80 °C minimizará la degradación de los péptidos. - Prepare los linfocitos T CD8 efectores policlonales expandidos para el ensayo de función mitocondrial.
- Al séptimo día, prepare y procese las células T CD8 policlonales para el ensayo.
- Recoja células T CD8 vivas.
- Transfiera las células de la placa de 6 pocillos a un tubo cónico limpio con una pipeta, luego centrifugue las celdas durante 5 minutos a 500 × g.
- Siga los pasos 1.3.3.2-1.3.4.
NOTA: Se pueden esperar aproximadamente 10-30 millones de células T CD8 vivas de un solo ratón C57BL/6. - Guarde una alícuota de células para la citometría de flujo para evaluar la pureza de CD8. Para la citometría de flujo, tiñir las células con hielo durante 20 min con un colorante de viabilidad de elección9.
3. Cosecha células T CD8 naïve
- Al séptimo día, recoja los esplenocitos de un ratón siguiendo los pasos 1.1.1-1.1.5.3.
- Llevar a cabo el aislamiento de linfocitos T CD8 utilizando el protocolo basado en perlas magnéticas descrito en los pasos 2.3-2.3.5.1.
- Placa de células T CD8 en la microplaca a 200.000 células/pocillo en medio completo.
4. Realizar el ensayo de función mitocondrial
- Prepare los materiales el día antes de realizar el ensayo de función mitocondrial.
- Hidrate el cartucho del sensor.
- Pipetear 200 μL de agua destilada en cada pocillo de la placa de utilidad. Coloque el cartucho del sensor en la parte superior de la placa multiusos. Compruebe que los extremos del cartucho del sensor estén sumergidos para garantizar una correcta hidratación. Coloque el cartucho del sensor y la placa multiusos en una incubadora que no sea de CO2 a 37 °C durante un mínimo de 10 h.
- Prepare un tubo cónico de 50 mL con 50 mL de Calbrant y colóquelo en una incubadora sin CO2 e incube durante la noche.
- El día antes del ensayo, prepare el medio fresco completo en preparación para el ensayo. En un total de 50 mL, prepare una solución de 1 mM de piruvato, 2 mM de glutamina y 10 mM de glucosa en el medio de ensayo.
- Hidrate el cartucho del sensor.
- Realice el ensayo de función mitocondrial al día siguiente.
- Retire el agua destilada de la placa utilitaria tirándola hacia afuera. Rehidratar con 200 μL de Calibrant. Utilice el calibrador que se almacenó en la incubadora sin CO2 durante la noche. Después de reemplazar el cartucho del sensor en la parte superior de la placa de utilidad. Vuelva a colocar la placa utilitaria con el cartucho del sensor en la incubadora sin CO2 .
NOTA: Para mover la placa, invierta rápida y rápidamente la placa con un movimiento fluido sobre el fregadero para que el agua destilada caiga rápidamente fuera de la placa.
- Retire el agua destilada de la placa utilitaria tirándola hacia afuera. Rehidratar con 200 μL de Calibrant. Utilice el calibrador que se almacenó en la incubadora sin CO2 durante la noche. Después de reemplazar el cartucho del sensor en la parte superior de la placa de utilidad. Vuelva a colocar la placa utilitaria con el cartucho del sensor en la incubadora sin CO2 .
- Prepare las células T CD8 como se describe anteriormente en las secciones 1 a 3.
- Utilizando una pipeta multicanal, redoble 200.000 células por pocillo resuspendiendo 10 × 106 células en 4,5 mL de medio completo y siembrando 90 μL por pocillo. A continuación, añada otros 90 μL de medio designado por pocillo durante el pretratamiento.
NOTA: Si no hay tratamientos previos, coloque las células en 180 μL por pocillo con una concentración final de 200.000 células por pocillo. A partir de este punto en el protocolo, mantenga la placa a temperatura ambiente o en la incubadora sin CO2 . La placa no debe colocarse en una incubadora con 5% de CO2 . Tenga en cuenta que el volumen final de la microplaca será de 180 μL.
- Utilizando una pipeta multicanal, redoble 200.000 células por pocillo resuspendiendo 10 × 106 células en 4,5 mL de medio completo y siembrando 90 μL por pocillo. A continuación, añada otros 90 μL de medio designado por pocillo durante el pretratamiento.
- Preparar pretratamientos (incluyendo suplementos de lípidos u otros metabolitos).
- Prepare el pretratamiento de lípidos girando el lípido liofilizado del congelador con una mini centrífuga de giro rápido. Determine las concentraciones deseadas para el pretratamiento y prepare el pretratamiento de lípidos a estas concentraciones. Sonicar el lípido diluido durante 30 minutos inmediatamente antes de su uso.
- Prepara cócteles de lípidos.
- Determinar la concentración de lípidos deseada que se utilizará en el ensayo de función mitocondrial.
- Prepare los lípidos a una concentración que sea 2 veces la concentración deseada. A continuación, añada la solución lipídica al volumen existente en la microplaca para conseguir una dilución 1:2. Completa esto añadiendo 90 μL de la solución lipídica directamente a los 90 μL preexistentes. El volumen final será de 180 μL (dilución 1:2) por pocillo.
NOTA: La Tabla 1 detalla un diagrama de ejemplo de una posible configuración y diseño de placas. Sugerimos realizar el ensayo con 5-6 réplicas técnicas, incorporando linfocitos T CD8 efectores naïve y específicos de antígeno con y sin aditivos lipídicos. En particular, este protocolo está diseñado para evitar la centrifugación y minimizar la interrupción celular. Dado que el ensayo de función mitocondrial es muy sensible al número de células, es fundamental reducir la pérdida de células. En lugar de centrifugación, las células se manipulan mediante movimientos para preservar su integridad. - Pipetear 180 μL de medio completo en cada esquina de la placa. Coloque la microplaca con células T CD8 en una incubadora sin CO2 .
NOTA: El tiempo de incubación variará en función de la duración deseada del pretratamiento. Para minimizar la muerte celular, recomendamos un máximo de 4 h de pretratamientos para los linfocitos T CD8. Prolongar demasiado el tiempo de pretratamiento puede causar una muerte celular excesiva, lo que afecta la precisión de los resultados.
- Preparar venenos y soluciones para inyecciones agudas.
- Usando soluciones madre, prepare una forma diluida de oligomicina. Cree una dilución de oligomicina en 3 mL de medio completo. En tubos cónicos de 15 mL, prepare con precaución los venenos y las inyecciones agudas. Dado que los venenos son sensibles a la luz, prepare estas soluciones usando tubos envueltos en papel de aluminio para protegerlos de la exposición a la luz.
- En un tubo cónico de 15 mL envuelto en papel de aluminio, diluya la oligomicina en 3 mL de medio completo para que la concentración final sea de 2,5 μM después de la inyección.
- En un segundo tubo cónico de 15 mL envuelto en papel de aluminio, diluir FCCP en 3 mL de medio completo para que la concentración final sea de 2,0 μM después de la inyección.
- En un tercer tubo cónico de 15 mL envuelto en papel de aluminio, cree soluciones de rotenona y antimicina A en 3 mL de medio completo para lograr concentraciones de 0,5 μM para ambas toxinas después de la inyección.
- Si el ensayo se realiza con moduladores metabólicos, fármacos o estimulaciones adicionales, diluya estos agentes en medio completo. Si planea usar etomoxir u otros moduladores metabólicos y medicamentos, primero realice un ensayo para probar la curva de titulación y determinar la concentración óptima para su uso. Si se lleva a cabo una estimulación de TCR mediante inyección aguda, el ensayo se puede realizar utilizando perlas magnéticas anti-CD3/anti-CD28 o una combinación de anti-biotina-CD3 unida a placas con estreptavidina anti-CD28.
NOTA: Para obtener descripciones adicionales, consulte la sección 5 que describe el protocolo para la estimulación de TCR con inyección aguda de anti-CD3/CD28.
- Retire el cartucho del sensor de la incubadora sin CO2 . Con los adaptadores de placa, pipetee los venenos en el cartucho del sensor. Coloque los adaptadores de placa de manera que cada cámara pueda cargarse especialmente con venenos u otras inyecciones agudas.
NOTA: Tenga cuidado al pipetear los venenos.- Cargue los venenos en los puertos del cartucho del sensor. Si no se realizan inyecciones adicionales, los puertos A-C se cargarán con venenos. Pipetear 20 μL de oligomicina en el puerto A, 22 μL de FCCP en el puerto B, 25 μL de rotenona en el puerto C y 25 μL de antimicina A en el puerto C.
- Usando soluciones madre, prepare una forma diluida de oligomicina. Cree una dilución de oligomicina en 3 mL de medio completo. En tubos cónicos de 15 mL, prepare con precaución los venenos y las inyecciones agudas. Dado que los venenos son sensibles a la luz, prepare estas soluciones usando tubos envueltos en papel de aluminio para protegerlos de la exposición a la luz.
- Una hora antes de comenzar el ensayo en el instrumento, coloque la microplaca en la incubadora sin CO2 .
- Antes de iniciar el instrumento, abra el software y calibre el instrumento. Realice esta tarea 30 minutos antes de cargar la microplaca en el instrumento para garantizar el tiempo suficiente para la calibración.
- En el sistema de software, etiquete los pozos y revise el esquema de inyección.
- Durante la calibración, cargue el cartucho del sensor en el instrumento. El software le pedirá que complete la inicialización y la verificación de calidad. La calibración evaluará el pH y elO2 en cada pozo, que pasará o fallará. El instrumento informará los resultados en la pantalla con una marca de verificación o una 'X'.
5. Realizar una versión modificada del ensayo de función mitocondrial con estimulación TCR en un experimento separado con una inyección aguda de anti-CD3/CD28
NOTA: El ensayo de función mitocondrial se puede realizar con una simulación de TCR agudo a través de dos enfoques diferentes: 1) utilizando biotinilados anti-CD3 + anti-CD28 + estreptavidina descritos en el paso 5.2 o 2) perlas magnéticas anti-CD3/CD28 descritas en el paso 5.3 Estos experimentos separados funcionan para estimular el TCR a través de una inyección aguda durante el ensayo.
- Si va a realizar inyecciones adicionales, prepare el ensayo como se describe en la sección 4 anterior. Modifique los esquemas de inyección utilizando la cámara adicional para la inyección. En este protocolo, los anti-CD3/anti-CD28 se cargan en el puerto A del cartucho del sensor. A continuación, cargue los otros puertos de forma similar, con oligomicina en el puerto B, FCCP en el puerto C y rotenona y antimicina A en el puerto D.
- Preparar y cargar componentes biotinilados anti-CD3 + anti-CD28 + estreptavidina.
- Pipetear 20 μL de anti-CD3 biotinilado a 10 μg/mL en los pocillos designados en el cartucho sensor.
- Pipetear 20 μL de anti-CD28 a 2 μg/mL + estreptavidina a 20 μg/mL en los pocillos designados en el cartucho sensor.
- Pipetear 20 μL de anti-CD3 biotinilado a 10 μg/mL + anti-CD28 a 2 μg/mL + estreptavidina a 20 μg/mL en los pocillos designados en el cartucho sensor.
- Asegúrese de que los pozos de control estén preparados. Asegúrese de que haya pocillos designados inyectados solo con medios, anti-CD3 biotinilado solo, anti-CD28 + estreptavidina y anti-CD3 + anti-CD28 + estreptavidina biotinilado.
- Usando una relación de cordón a celda de 1:1, prepare y cargue perlas magnéticas anti-CD3/CD28.
- En una placa con 200.000 células por pocillo, pipetee 5 μL de perlas magnéticas en los pocillos designados en el cartucho del sensor.
- Prepare los pozos de control designados con medios solo para inyección.
- Ajuste el volumen de los tóxicos de modo que las concentraciones finales posteriores a la inyección sean: 2,5 μM para la oligomicina, 2,0 μM para el FCCP y 0,5 μM para la rotenona y la antimicina A.
- Asegúrese de que el esquema de inyección se modifique para reflejar los puntos de tiempo actualizados antes de cargar la microplaca en el instrumento.
- Programe el software para ejecutar la estimulación aguda de TCR durante un total de 140 minutos. Dentro de este período de tiempo, modifique el esquema para que haya mediciones de puntos de tiempo x10 antes de la inyección de oligomicina.
Resultados
Las capacidades metabólicas glucolíticas y oxidativas se pueden medir utilizando un ensayo funcional mitocondrial que evalúa las capacidades dirigiéndose a los componentes de la cadena de transporte de electrones en puntos de tiempo particulares (Figura 2A). Se pueden cargar diferentes esquemas de inyección en los puertos del cartucho del sensor para modificar el ensayo tradicional y evaluar la estimulación aguda del TCR (Figura 2B, C). El número de células y la concentración del fármaco para varios tipos de células deben optimizarse antes de interpretar los resultados. Aquí, este informe describe las condiciones que se han optimizado para las células T CD8 (Figura 3A, B) con inhibidores de la cadena de transporte de electrones optimizados para medir las capacidades tanto en las células ingenuas como en las efectoras (Figura 4A, B). Es importante destacar que este ensayo puede modificarse para estudiar la estimulación del TCR en las células T CD8 efectoras generadas a partir de la estimulación específica del antígeno o la estimulación anti-CD3/CD28. Examinamos más a fondo la respuesta de las células T CD8 a la señalización lipídica bioactiva, especialmente con ácido lisofosfatídico o LPA. Determinamos que las tendencias metabólicas en respuesta a la señalización de LPA (a los 30 min, 2 h o 4 h antes de cargar la microplaca en el instrumento analizador) fueron similares en ambas células T CD8 activadas con estimulación TCR policlonal o específica de antígeno (Figura 5A-D). El tipo de estimulación del TCR y el mecanismo de activación dieron lugar a diferencias sutiles en las que inicialmente se generaron células metabólicamente energéticas con activación específica del antígeno (Figura 5E-L).
La inyección aguda de anti-CD3/CD28 en las células T CD8 efectoras puede estimular de forma aguda el TCR con mediciones en tiempo real. Los anti-CD3, anti-CD28 y estreptavidina biotinilados se pueden usar en conjunto para estimular el TCR en un modelo de inyección aguda. Como método separado, se pueden realizar inyecciones agudas con perlas magnéticas conjugadas con anti-CD3 y anti-CD28 en este ensayo bioenergético para estimular el TCR en tiempo real. Adaptamos el modelo para inyectar medios biotinilados anti-CD3, anti-CD28 + estreptavidina, o un agregado de anti-CD3 + anti-CD28 + estreptavidina biotinilada en las células T CD8 OT-I efectoras en la mitad del tiempo durante el ensayo (Figura 6A,B). Observamos estimulación con anti-CD3/CD28, lo que resultó en un aumento tanto en el OCR como en el ECAR. Las señales OCR y ECAR también estaban elevadas, pero no al mismo nivel que las de anti-CD3/CD28, con señal anti-CD3 biotinilada sola. Es importante destacar que encontramos tendencias metabólicas similares que son comparables a la inyección aguda de perlas magnéticas anti-CD3/CD28 (Figura 6C-F). En resumen, estos resultados muestran con múltiples enfoques y metodologías que el ensayo de función mitocondrial es robusto y reproducible para estudiar el inmunometabolismo de los linfocitos y, en concreto, de las células T CD8.

Figura 1: Activación del receptor de linfocitos T con estimulación policlonal y antígeno específica. (A) Esquema de señalización específica de antígeno con complejo mayor de histocompatibilidad (MHC) clase I con péptido unido al receptor de células T. (B) Representación de la activación policlonal de las células T CD8 mediante la unión de las subunidades CD3 y la molécula coestimuladora CD28 con anticuerpos anti-CD3/28. Haga clic aquí para ver una versión más grande de esta figura.
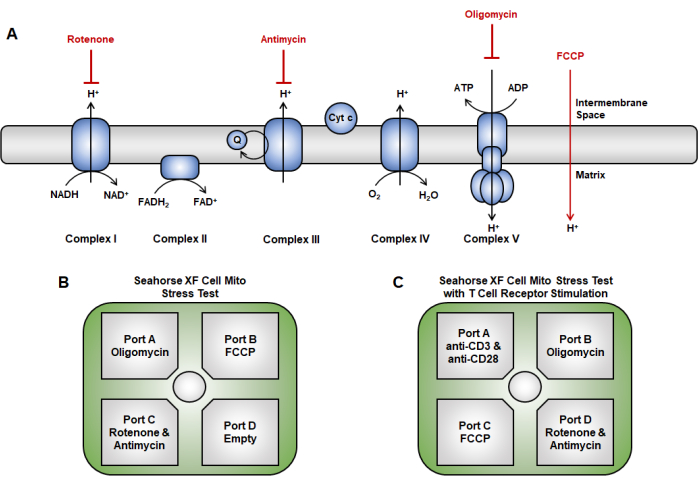
Figura 2: Focalización de fármacos de la cadena de transporte de electrones en el ensayo de función mitocondrial. (A) Esquema de los inhibidores de la cadena de transporte de electrones (rojo) utilizados aquí. (B,C) Para la prueba de función mitocondrial, las estrategias de inyección en el cartucho sensor son las siguientes: (B) enfoque de inyección tradicional en el que la oligomicina se carga en el puerto A, el FCCP en el puerto B y la rotenona y la antimicina A en el puerto C. (C) El método de inyección aguda consiste en colocar la inyección aguda (anti-CD3/CD28) en el puerto A, la oligomicina en el puerto B, el FCCP en el puerto C, y rotenona y antimicina A en el puerto D. Abreviatura: FCCP = 4-(trifluorometoxi) fenil) carbonohidrazonoil dicianuro. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Expresión superficial de CD8 y CD44, viabilidad y diferencias metabólicas en las células T CD8 generadas a partir de la estimulación anti-CD3 y anti-CD28 después del tratamiento con LPA. (A) Las células T CD8 efectoras se generan ex vivo estimulando las células T CD8 derivadas de ratones con SIINFEKL (N4) y los esplenocitos como células presentadoras de antígenos o anti-CD3 y anti-CD28 en placas. En el día 4, la IL-2 reemplaza los estímulos iniciales, favoreciendo la diferenciación y la proliferación. A continuación, se analizan los linfocitos T CD8 efectores homogéneos del día 7 mediante citometría de flujo después del cultivo in vitro . (B) Las células T se identifican mediante la activación del estado de los linfocitos y luego de la expresión de CD8+/CD44+ . Una imagen representativa muestra CD8 y CD44 no se ve afectado con el tratamiento con LPA. Esta figura fue modificada de Turner et al.9. Haga clic aquí para ver una versión más grande de esta figura.
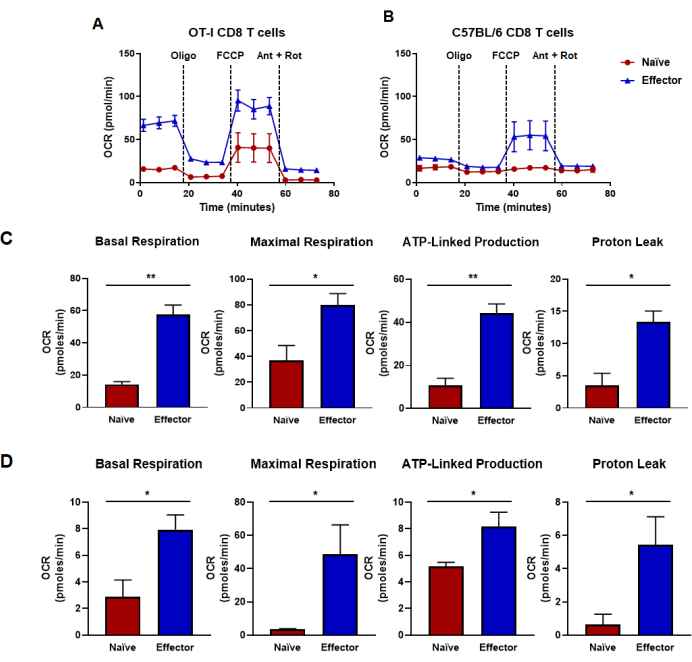
Figura 4: Capacidades oxidativas determinadas a partir de la tasa de consumo de oxígeno. (A,B) Tasas de consumo de oxígeno para linfocitos T CD8 naïve y efector generados por (A) estimulación y expansión específica del antígeno de linfocitos T CD8 OT-I o (B) estimulación policlonal anti-CD3/CD28 y expansión de linfocitos T CD8 de ratones C57B/6 de tipo salvaje. Se inyectaron oligomicina, FCCP, antimicina A y rotenona a intervalos de 18 min con medios de glucosa de 25 mM. Los resultados se muestran como datos representativos y se obtuvieron utilizando n = 6 réplicas técnicas. (C,D) Las métricas de capacidad derivadas de los ensayos de flujo metabólico realizados en paneles (A, B) muestran la respiración basal calculada, la respiración máxima, la producción ligada a ATP y la fuga de protones. (C) Las capacidades metabólicas se determinaron a partir de las células T CD8 OT-I y corresponden a los datos mostrados en el panel (A). (D) Las capacidades metabólicas se determinaron a partir de las células T C57BL/6 CD8 y corresponden a los datos mostrados en el panel (B). Se realizó un análisis de la prueba t de Student no pareada para toda la figura, donde *p < 0,05, **p < 0,005, ***p < 0,0005 y ****p < 0,0001. Abreviaturas: OCR = Tasa de consumo de oxígeno; Oligo = oligomicina; FCCP = 4-(trifluorometoxi) fenil) carbonohidrazonoil dicianuro; hormiga = antimicina A; podredumbre = rotenona. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Tendencias similares en las respuestas de los linfocitos T CD8 efectores a la señalización del receptor LPA, independientemente de la activación policlonal o específica del antígeno. La tasa de consumo de oxígeno de los linfocitos T CD8 (A,B) se mide a partir de células generadas por (A) estimulación y expansión específica del antígeno de los linfocitos T CD8 OT-I CD8 o (B) estimulación y expansión policlonal anti-CD3/CD28 de ratones C57B/6 de tipo salvaje. (C,D) Se muestran las mediciones de la tasa de acidificación extracelular de los linfocitos T CD8 efectores para las células generadas por (C) estimulación y expansión específica del antígeno de los linfocitos T CD8 OT-I o (D) estimulación policlonal anti-CD3/CD28 y expansión de los linfocitos T CD8 de ratones C57B/6 de tipo salvaje. Las capacidades metabólicas de los linfocitos T CD8 se midieron en medios suplementados con glutamina (rojo) o 1 μM de LPA durante 30 min (verde), 2 h (azul) o 4 h (verde). Se inyectaron oligomicina, FCCP, antimicina A y rotenona a intervalos de 18 min con medios de glucosa de 25 mM. Los resultados se muestran como datos representativos y se obtuvieron utilizando n = 6 réplicas técnicas. (E-H) Las métricas de capacidad derivadas de los ensayos de flujo metabólico realizados en paneles (A,C) muestran la respiración basal calculada, la respiración máxima, la producción ligada a ATP y la fuga de protones. (I-L) Cálculos de capacidad a partir de paneles (B,D) que muestran la respiración basal, la respiración máxima, la producción ligada a ATP y la fuga de protones. La cifra completa se analizó estadísticamente mediante el ANOVA de un factor, donde *p < 0,05. Abreviaturas: OCR = Tasa de consumo de oxígeno; ECAR = tasa de acidificación extracelular; Oligo = oligomicina; FCCP = 4-(trifluorometoxi) fenil) carbonohidrazonoil dicianuro; hormiga = antimicina A; podredumbre = rotenona. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Estrategias para la estimulación del receptor de linfocitos T en tiempo real con inyección aguda de anti-CD3/CD28. (A,B) Estrategia de inyección aguda que involucra anti-CD3, estreptavidina y anti-CD28 biotinilados para la evaluación de la función mitocondrial. Los paneles muestran las capacidades metabólicas de las células T CD8 efectoras de OT-I estimuladas por antígenos, mostrando específicamente (A) la tasa de acidificación extracelular y (B) la tasa de consumo de oxígeno. Las inyecciones usan solo medios (rojo), anti-CD3 biotinilado (verde), anti-CD28 + estreptavidina (azul) o una combinación de anti-CD3 + anti-CD28 + estreptavidina biotinilado (verde azulado). (C,D) Inyección aguda de perlas magnéticas conjugadas con anti-CD3/CD28 para evaluar la actividad mitocondrial. Los paneles muestran las capacidades metabólicas de las células T CD8 efectoras de OT-I estimuladas por antígenos, mostrando específicamente (C) la tasa de acidificación extracelular y (D) la tasa de consumo de oxígeno. Las inyecciones utilizan solo medios (rojos) o inyección de perlas anti-CD3/CD28 (verde azulado). Los ensayos se realizaron con inyecciones de oligomicina, FCCP, antimicina A y rotenona a intervalos de 18 min en medios suplementados con 25 mM de glucosa. Los resultados se muestran como datos representativos y se obtuvieron utilizando n = 6 réplicas técnicas. (E) Cálculos de capacidad a partir de paneles (A-D) que muestran el metabolismo basal antes de la inyección (rojo), la respiración después de la inyección (azul) y la capacidad respiratoria máxima (gris). Las condiciones se separan en función de la inyección intraensayo. (F) Cálculos de capacidad que muestren la respiración basal, la respiración máxima, la producción ligada a ATP y la fuga de protones. Los estadísticos para toda esta cifra se realizaron utilizando el ANOVA de un factor donde *p < 0.05, **p < 0.005, ***p < 0.0005 y ****p < 0.0001. Abreviaturas: OCR = Tasa de consumo de oxígeno; ECAR = tasa de acidificación extracelular; Oligo = oligomicina; FCCP = 4-(trifluorometoxi) fenil) carbonohidrazonoil dicianuro; hormiga = antimicina A; podredumbre = rotenona. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este artículo, describimos un protocolo para evaluar la función mitocondrial de los linfocitos T CD8 naïve y efectores. Detallamos y comparamos métodos para preparar linfocitos T CD8 policlonales y específicos de antígeno utilizando ratones OT-I y C57BL/6. Nuestros resultados demuestran que existen tendencias similares en el metabolismo a pesar del método de activación y pretratamiento en las células T CD8. Los datos revelan que la activación específica del antígeno conduce a más células T CD8 OT-I metabólicamente activas en comparación con sus contrapartes de tipo salvaje C57BL/6 estimuladas con anti-CD3 y anti-CD28. El protocolo descrito aquí muestra que el ensayo funcional mitocondrial, la prueba de esfuerzo de Mito, es un ensayo muy sensible y consistentemente repetible que produce resultados confiables en múltiples condiciones y tipos de células. Nuestros hallazgos y protocolo detallado contribuyen al creciente reconocimiento de este ensayo como una metodología fundamental para analizar el metabolismo y la bioenergética de las células T CD8.
A medida que la inmunoterapia y diversos tratamientos celulares continúan avanzando, la importancia de aplicar terapias dirigidas a células T también está creciendo41. La respuesta a la inmunoterapia y las respuestas inmunitarias antitumorales dependen del metabolismo mediado por células T, la señalización del calcio y el flujo oxidativo desencadenado por la activación del TCRaguas arriba 42. Tanto la eficiencia metabólica como la flexibilidad son necesarias para las respuestas óptimas de los linfocitos T CD8 5,6,7,15,17,26,43, mientras que el aumento de la fuga de protones y el daño oxidativo posterior perjudican las respuestas de los linfocitos T y promueven la disfunción 9,44. Tanto la proliferación de células T como la producción de citocinas pueden rescatarse mitigando el estrés oxidativo mitocondrial 5,13,20,24,25,29. Dentro de nuestros experimentos, hemos utilizado células T CD8 naïve que se cultivan en IL-2, lo que mantiene la viabilidad; sin embargo, podría decirse que estos linfocitos T CD8 ya no son equivalentes a los linfocitos T CD8 ingenuos de buena fe. Por lo tanto, elegimos utilizar células T CD8 vírgenes directamente del ratón para obtener datos de mejor calidad y células que tienen menos probabilidades de verse afectadas por las citocinas. En conjunto, es crucial optimizar las técnicas para examinar el metabolismo en todos los subconjuntos de células T.
El destino de las células T CD8 está dirigido en parte por la programación metabólica que afecta a las respuestas inmunitarias adaptativas 2,4,45. Los linfocitos T CD8 naïve salen de los estados de reposo tras la estimulación del TCR 25,46,47,48,49,50. Sin embargo, la estimulación continua del TCR conduce al agotamiento de los linfocitos T CD8, lo que resulta en un fenotipo notablemente menos energético en comparación con los linfocitos T CD8 funcionales 3,20,51,52. Sin embargo, este impacto en el metabolismo puede mejorarse y potencialmente revitalizar las células T CD8 agotadas 2,3,20,46,51,52. Si bien los mecanismos exactos que gobiernan el destino de las células T CD8 y la diferenciación exhaustiva siguen siendo poco conocidos, las células T CD8 disfuncionales y/o agotadas tienen característicamente mitocondrias defectuosas y sobreproducción de ROS, que son factores clave en la regulación de la función efectora de las células T CD8 9,15,53. El metabolismo, los fenotipos y la diferenciación exhaustiva de los linfocitos T CD8 se han estudiado mediante la prueba de esfuerzo de Mito. Históricamente, la estimulación persistente del TCR que resulta en una pérdida progresiva de las funciones efectoras define el agotamiento de los linfocitos T CD8 11,13,16,17. Sin embargo, ha habido esfuerzos recientes para caracterizar mejor las células T CD8 agotadas y mostrar que los paisajes de cromatina y transcripcional también definen el agotamiento y están estrechamente relacionados con el flujo metabólico 18,27,28. En conjunto, la estimulación persistente del TCR y los fenotipos y secuelas metabólicas posteriores se pueden estudiar con la prueba de esfuerzo de Mito para identificar potencialmente las vulnerabilidades metabólicas y los eventos determinantes del destino.
La estimulación de TCR inicia la señalización de calcio aguas abajo necesaria para la exocitosis de los gránulos y dirige la destrucción de las células T24,33. En particular, los eventos anteriores, como la activación del inflamasoma y la producción de IFNγ, dependen de un ATP54 persistente y sostenido. Durante la señalización del calcio, se ha reportado una desregulación en la eficiencia mitocondrial, conocida como el fenómeno del "destello mitocondrial" 55,56,57,58. El destello mitocondrial representa un proceso en el que las mitocondrias que respiran activamente experimentan brevemente una respiración desacoplada, lo que resulta en una reducción de ATP y un aumento de la ráfaga de ROS55,56. Ha habido poca investigación sobre el flash mitocondrial y su relevancia en las células T CD8 sigue siendo ampliamente inexplorada. Es importante destacar que las metodologías descritas en este estudio se pueden utilizar para investigar estos fenómenos, la diferenciación exhaustiva en las células T CD8 y otros perfiles de células inmunitarias.
En resumen, estas metodologías y herramientas ofrecen un enfoque más integral para estudiar el metabolismo agudo y crónico. La prueba de esfuerzo de Mito se puede aplicar para examinar la programación metabólica y cómo regula la disfunción efectora y la diferenciación exhaustiva en las células T CD8. La reprogramación metabólica en los linfocitos puede ser un factor para comprender los mecanismos subyacentes a la tolerancia inmunitaria, la disfunción de las células T CD8 y las respuestas inmunitarias agotadas. Además, el metabolismo y/o los mediadores lipídicos desempeñan un papel clave en la citotoxicidady el agotamiento de las células T CD8 9 y, por lo tanto, podrían ser un enfoque novedoso para prevenir el agotamiento o potencialmente revertir la diferenciación exhaustiva para reducir la inmunidad antitumoral. En conjunto, el ensayo Cell Mito Stress Test es una herramienta sólida que debe utilizarse para abordar estas preguntas no resueltas sobre el inmunometabolismo.
Divulgaciones
Los autores no tienen intereses contrapuestos que revelar.
Agradecimientos
La Fundación Hertz, la Fundación Amy Davis, la Fundación de la Familia Moore y la Fundación Heidi Horner han brindado un apoyo inestimable, por lo que estamos agradecidos. Este trabajo también fue apoyado en parte por subvenciones de los NIH a RMT (AI052157, AI136534), mientras que JAT fue apoyado por la Hertz Graduate Fellowship.
Materiales
| Name | Company | Catalog Number | Comments |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Anti-CD28 | Biolegend | 102116 | |
| Anti-CD3/CD28 Dynabeads | ThermoFisher | 11456D | |
| Biotinylated anti-CD3 | Biolegend | 317320 | |
| Bovine Serum Albumin | Sigma-Aldrich | 108321-42-2 | |
| CD8a+ T cell isolation kit | Miltenyi Biotec | 130-104-075 | |
| Cell Strainers (100 µm) | CELL TREAT | 229485 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E8008 | |
| Ficoll | Sigma-Aldrich | 26873-85-8 | density gradient medium |
| FCCP ((4-(trifluoromethoxy) phenyl) carbonohydrazonoyl dicyanide) | Sigma-Aldrich | C2920 | |
| Glucose | Sigma-Aldrich | G-6152 | |
| Glutamine | Sigma-Aldrich | G7513 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | Positive selection columns |
| Magnetic cell separation column | Miltenyi Biotec | 130-042-301 | |
| Microplate | Agilent | 102601-100 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Pyruvate | Sigma-Aldrich | 113-24-6 | |
| Recobinant IL-2 | PeproTech | 200-02 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Seahorse media | Agilent | 103576-100 | |
| Sensor cartridge | Agilent | 102601-100 | |
| Streptavidin | Sigma-Aldrich | A9275 | |
| Sterile 6 well plate | CELL TREAT | 230601 | |
| Sterile 24 well plate | CELL TREAT | 229524 | |
| XF Calibrant | Agilent | 102601-100 |
Referencias
- Patsoukis, N., et al. PD-1 alters T-cell metabolic reprogramming by inhibiting glycolysis and promoting lipolysis and fatty acid oxidation. Nat Commun. 6, 6692 (2015).
- Scharping, N. E., et al. Mitochondrial stress induced by continuous stimulation under hypoxia rapidly drives T cell exhaustion. Nat Immunol. 22, 205-215 (2021).
- Schurich, A., et al. Distinct Metabolic Requirements of Exhausted and Functional Virus-Specific CD8 T Cells in the Same Host. Cell Rep. 16 (5), 1243-1252 (2016).
- Zhang, L., Romero, P. Metabolic control of CD8(+) T cell fate decisions and antitumor immunity. Trends Mol Med. 24 (1), 30-48 (2018).
- Batabyal, R., et al. Metabolic dysfunction and immunometabolism in COVID-19 pathophysiology and therapeutics. Int J Obes (Lond). 45 (6), 1163-1169 (2021).
- Chavakis, T. Immunometabolism: Where immunology and metabolism meet. J Innate Immun. 14, 1-3 (2022).
- Frezza, C., Mauro, C. Editorial: The metabolic challenges of immune cells in health and disease. Front Immunol. 6, 293 (2015).
- Wang, X., Ping, F. F., Bakht, S., Ling, J., Hassan, W. Immunometabolism features of metabolic deregulation and cancer. J Cell Mol Med. 23 (2), 694-701 (2019).
- Turner, J. A., et al. Lysophosphatidic acid modulates CD8 T cell immunosurveillance, metabolism, and anti-tumor immunity. Nat Commun. 14, 3214 (2023).
- Coussens, L. M., Werb, Z. Inflammation and cancer. Nature. 420, 860-867 (2002).
- Jiang, Y., Li, Y., Zhu, B. T-cell exhaustion in the tumor microenvironment. Cell Death Dis. 6 (6), e1792 (2015).
- Krangel, M. S. Mechanics of T cell receptor gene rearrangement. Curr Opin Immunol. 21 (2), 133-139 (2009).
- Barber, D. L., et al. Restoring function in exhausted CD8 T cells during chronic viral infection. Nature. 439, 682-687 (2006).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Bengsch, B., et al. Bioenergetic insufficiencies due to metabolic alterations regulated by the inhibitory receptor PD-1 are an early driver of CD8(+) T cell exhaustion. Immunity. 45 (2), 358-373 (2016).
- Blank, C. U., et al. Defining 'T cell exhaustion'. Nat Rev Immunol. 19, 665-674 (2019).
- Dolina, J. S., Van Braeckel-Budimir, N., Thomas, G. D., Salek-Ardakani, S. CD8(+) T cell exhaustion in cancer. Front Immunol. 12, 715234 (2021).
- Mognol, G. P., et al. Exhaustion-associated regulatory regions in CD8(+) tumor-infiltrating T cells. Proc Natl Acad Sci U S A. 114 (13), E2776-E2785 (2017).
- Wang, D., et al. A comprehensive profile of TCF1(+) progenitor and TCF1(-) terminally exhausted PD-1(+)CD8(+) T cells in head and neck squamous cell carcinoma: implications for prognosis and immunotherapy. Int J Oral Sci. 14 (1), 8 (2022).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21, 1022-1033 (2020).
- Kang, S., Brown, H. M., Hwang, S. Direct antiviral mechanisms of interferon-gamma. Immune Netw. 18 (5), e33 (2018).
- Samuel, C. E. Antiviral actions of interferons. Clin Microbiol Rev. 14, 778-809 (2001).
- Schellekens, H., Weimar, W., Cantell, K., Stitz, L. Antiviral effect of interferon in vivo may be mediated by the host. Nature. 278, 742 (1979).
- Radoja, S., et al. CD8(+) tumor-infiltrating T cells are deficient in perforin-mediated cytolytic activity due to defective microtubule-organizing center mobilization and lytic granule exocytosis. J Immunol. 167 (9), 5042-5051 (2001).
- van der Windt, G. J., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Balmer, M. L., et al. Memory CD8(+) T cells require increased concentrations of acetate induced by stress for optimal function. Immunity. 44 (6), 1312-1324 (2016).
- Pereira, R. M., Hogan, P. G., Rao, A., Martinez, G. J. Transcriptional and epigenetic regulation of T cell hyporesponsiveness. J Leukoc Biol. 102, 601-615 (2017).
- Sen, D. R., et al. The epigenetic landscape of T cell exhaustion. Science. 354, 1165-1169 (2016).
- Quintana, A., et al. T cell activation requires mitochondrial translocation to the immunological synapse. Proc Natl Acad Sci U S A. 104 (36), 14418-14423 (2007).
- Brindley, D. N. Lysophosphatidic acid signaling in cancer. Cancers (Basel). 12 (12), 3791 (2020).
- Chae, C. S., et al. Tumor-derived lysophosphatidic acid blunts protective type I interferon responses in ovarian cancer. Cancer Discov. 12, 1904-1921 (2022).
- Kremer, K. N., et al. LPA suppresses T cell function by altering the cytoskeleton and disrupting immune synapse formation. Proc Natl Acad Sci U S A. 119 (15), e2118816119 (2022).
- Mathew, D., et al. LPA5 is an inhibitory receptor that suppresses CD8 T-cell cytotoxic function via disruption of early TCR signaling. Front Immunol. 10, 1159 (2019).
- Mathew, D., Torres, R. M. Lysophosphatidic acid is an inflammatory lipid exploited by cancers for immune evasion via mechanisms similar and distinct from CTLA-4 and PD-1. Front Immunol. 11, 531910 (2020).
- Oda, S. K., et al. Lysophosphatidic acid inhibits CD8 T cell activation and control of tumor progression. Cancer Immunol Res. 1 (4), 245-255 (2013).
- Lidgerwood, G. E., Pitson, S. M., Bonder, C., Pebay, A. Roles of lysophosphatidic acid and sphingosine-1-phosphate in stem cell biology. Prog Lipid Res. 72, 42-54 (2018).
- Torres, R. M., Turner, J. A., D'Antonio, M., Pelanda, R., Kremer, K. N. Regulation of CD8 T-cell signaling, metabolism, and cytotoxic activity by extracellular lysophosphatidic acid. Immunol Rev. 317 (1), 203-222 (2023).
- Turner, J. A., et al. BRAF modulates lipid use and accumulation. Cancers (Basel). 14 (9), 2110 (2022).
- Hogquist, K. A., et al. T cell receptor antagonist peptides induce positive selection. Cell. 76, 17-27 (1994).
- Li, Y., Kurlander, R. J. Comparison of anti-CD3 and anti-CD28-coated beads with soluble anti-CD3 for expanding human T cells: differing impact on CD8 T cell phenotype and responsiveness to restimulation. J Transl Med. 8, 104 (2010).
- Ralli, M., et al. Immunotherapy in the treatment of metastatic melanoma: current knowledge and future directions. J Immunol Res. 2020, 9235638 (2020).
- Philip, M., Schietinger, A. CD8(+) T cell differentiation and dysfunction in cancer. Nat Rev Immunol. 22, 209-223 (2022).
- Bajrai, L. H., et al. Understanding the role of potential pathways and its components including hypoxia and immune system in case of oral cancer. Sci Rep. 11, 19576 (2021).
- Nicholls, D. G. Mitochondrial proton leaks and uncoupling proteins. Biochim Biophys Acta Bioenerg. 1862, 148428 (2021).
- Tyrakis, P. A., et al. S-2-hydroxyglutarate regulates CD8(+) T-lymphocyte fate. Nature. 540, 236-241 (2016).
- Guo, Y., et al. Metabolic reprogramming of terminally exhausted CD8(+) T cells by IL-10 enhances anti-tumor immunity. Nat Immunol. 22, 746-756 (2021).
- Notarangelo, G., et al. Oncometabolite d-2HG alters T cell metabolism to impair CD8(+) T cell function. Science. 377 (6614), 1519-1529 (2022).
- Yang, K., et al. T cell exit from quiescence and differentiation into Th2 cells depend on Raptor-mTORC1-mediated metabolic reprogramming. Immunity. 39 (6), 1043-1056 (2013).
- Ricciardi, S., et al. The translational machinery of human CD4(+) T cells is poised for activation and controls the switch from quiescence to metabolic remodeling. Cell Metab. 28 (6), 895-906.e5 (2018).
- Moller, S. H., Hsueh, P. C., Yu, Y. R., Zhang, L., Ho, P. C. Metabolic programs tailor T cell immunity in viral infection, cancer, and aging. Cell Metab. 34 (3), 378-395 (2022).
- Alrubayyi, A., et al. Functional restoration of exhausted CD8 T cells in chronic HIV-1 infection by targeting mitochondrial dysfunction. Front Immunol. 13, 908697 (2022).
- Vignali, P. D. A., et al. Hypoxia drives CD39-dependent suppressor function in exhausted T cells to limit antitumor immunity. Nat Immunol. 24, 267-279 (2023).
- Ogando, J., et al. PD-1 signaling affects cristae morphology and leads to mitochondrial dysfunction in human CD8(+) T lymphocytes. J Immunother Cancer. 7 (1), 151 (2019).
- Billingham, L. K., et al. Mitochondrial electron transport chain is necessary for NLRP3 inflammasome activation. Nat Immunol. 23, 692-704 (2022).
- Eberhardt, D. R., et al. EFHD1 ablation inhibits cardiac mitoflash activation and protects cardiomyocytes from ischemia. J Mol Cell Cardiol. 167, 1-14 (2022).
- Hou, T., et al. Identification of EFHD1 as a novel Ca(2+) sensor for mitoflash activation. Cell Calcium. 59 (5), 262-270 (2016).
- Mun, S. A., et al. Structural and biochemical characterization of EFhd1/Swiprosin-2, an actin-binding protein in mitochondria. Front Cell Dev Biol. 8, 628222 (2020).
- Stein, M., et al. A defined metabolic state in pre B cells governs B-cell development and is counterbalanced by Swiprosin-2/EFhd1. Cell Death Differ. 24 (7), 1239-1252 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados