Method Article
测量初始和效应 CD8 T 细胞的线粒体功能
摘要
CD8 T 细胞生物能量学可以使用 Mito 压力测试进行询问。该方法可用于研究急性和慢性代谢编程。该协议描述了检查 T 细胞受体生物学和生物能量分析之间关系的方法。
摘要
了解免疫代谢如何影响淋巴细胞的功能、分化和命运已经引起了极大的兴趣和关注。淋巴细胞生物学已经使用生物能量分析进行了探索,现在已成为该领域的重要重要工具。因此,我们试图优化一种生物能量分析测定,该测定可以适应受体刺激的预处理和急性注射。在这里,我们使用细胞线粒体压力测试评估了 CD8 T 细胞 离体 代谢,以评估幼稚和效应 CD8 T 细胞的耗氧率和细胞外酸化率。抗原特异性效应 CD8 T 细胞通过 离体 刺激获得,幼稚 CD8 T 细胞从脾细胞中收获并用磁珠柱分离分离。
在微孔板中进行预处理,我们详细介绍了如何制备传感器探针板。我们展示了注射口如何加载药物以间接测量代谢能力和代谢调节剂,该方案可用于研究特定的酶活性。可以使用注射端口通过急性注射和抗 CD3/CD28 刺激实时研究 T 细胞受体刺激。仪器分析仪用于测量和数据收集,数据可视化是通过软件程序完成的,以解释细胞代谢。该策略产生了大量关于免疫细胞生物学和线粒体生物能量学的数据,使研究人员能够以多种方式定制方案以探索 CD8 T 细胞代谢。
引言
免疫细胞的命运和功能受新陈代谢、氧化消耗和无氧呼吸的显著影响 1,2,3,4。最近,人们越来越关注靶向代谢调节作为一种策略,以重新编程或恢复 CD8 T 细胞的命运和效应器功能,并改善病毒清除或增强内源性抗肿瘤免疫 5,6,7,8,9。值得注意的是,通过 T 细胞受体 (TCR) 的抗原受体信号转导是 CD8 T 细胞分化的关键要求,导致下游信号转导和激活 10,11,12(图 1)。长时间暴露于免疫损伤会导致 TCR 上持续的抗原特异性刺激,最终导致慢性炎症状态、T 细胞疲劳、免疫微环境重塑和免疫逃逸 11,13,14,15,16,17,18,19。
耗竭的 CD8 T 细胞的代谢与功能性效应 CD8 T 细胞的代谢有着根本的不同 2,3,14,15,18,20。T 细胞分化、干扰素γ (IFNγ) 分泌和召回能力部分由线粒体功能和 β 氧化分解产物决定。IFNγ+ CD8 T 细胞是抗肿瘤和抗病毒免疫反应的关键组成部分 21,22,23。通过糖酵解和电子传递链的特异性代谢通量对 CD8 T 细胞活化、细胞因子分泌和记忆反应很重要 4,11,13,15,18,24,25,26,27,28 .最佳反应,包括 T 细胞活化和效应子分化,需要协调和特异性的线粒体反应,而线粒体缺陷和过量的活性氧 (ROS) 是 T 细胞耗竭或功能失调的特征 9,29。最近,体外 CD8 T 细胞的持续 TCR 刺激部分通过诱导氧化应激和重编程 T 细胞增殖所需的氧化代谢和代谢能力来促进 CD8 T 细胞的穷尽分化 1,2,13,20,24,29 .总而言之,代谢控制轴是指导 CD8 T 细胞分化及其进展为效应子、记忆或耗竭/功能失调表型的关键组成部分。
代谢化合物还通过充当自分泌或旁分泌信号分子来指导免疫细胞反应 9,30,31,32,33,34,35。1-磷酸鞘氨醇 (S1P) 和溶血磷脂酸 (LPA) 是具有生物活性的炎性脂质,通过 G 蛋白偶联受体 (GPCR) 发出信号,以调节 CD8 T 细胞的淋巴细胞流出和细胞毒性36。通过 CD8 T 细胞上的 GPCR LPA 受体进行 LPA 信号转导,重编程代谢以增加脂肪分解、脂肪酸氧化和质子渗漏9。总而言之,CD8 T 细胞的生物能量学和代谢在很大程度上由底物可用性、环境线索和能量需求驱动。
研究 CD8 T 细胞代谢的方法变得越来越重要。细胞线粒体压力测试提供了对生物能量学的全面评估,现在被认为是免疫代谢和 CD8 T 细胞能量学领域的标志性技术 9,37。贴壁细胞历来用于 Mito 压力测试测定38;然而,人们越来越有兴趣将该方案应用于悬浮液中生长的细胞,特别是将免疫细胞用于细胞线粒体应激测试测定。在这里,我们根据我们最近的出版物9 提出了一个详细的方案来测量 CD8 T 细胞的代谢活性。我们详细解释了 CD8 T 细胞的扩增、初始 CD8 T 细胞分离、检测准备和治疗,以及细胞线粒体应激测试检测中的预处理和急性注射方案。重要的是,我们比较和对比了 TCR 刺激和 CD8 T 细胞活化的多种方法,包括多克隆和抗原特异性 TCR 刺激。
该方案详细介绍了使用 OT-I 转基因小鼠(一种经典的转基因小鼠模型)进行抗原特异性刺激,其中所有小鼠 T 细胞都表达相同的 Vα2 和 Vβ5 基因39。OT-I 小鼠 CD8 T 细胞都含有对卵清蛋白八肽(OVA257-264 ,也称为氨基酸序列 SIINFEKL 或 N4)具有特异性的相同 TCR,这是一种广泛研究的表位,在主要组织相容性复合体 (MHC) I 类呈递时,激活细胞毒性 CD8 T 细胞39 (图 1A)。总体而言,OT-I 转基因小鼠模型被免疫学家广泛用于研究 TCR 信号传导和抗原特异性 T 细胞效应器功能。与 OT-I 小鼠模型的单克隆激活相反,多克隆 CD8 T 细胞可以用针对 TCR CD3 亚基和 CD28 共刺激分子40 的抗 CD3/CD28 抗体产生(图 1B)。抗 CD3/CD28 抗体绕过 TCR 信号转导的抗原特异性组分,激活 T 细胞的多克隆群40。最终,本报告中描述的结果比较了使用细胞线粒体压力测试量化 CD8 T 细胞动态代谢通量的多种方法。
研究方案
将小鼠饲养在无病原体的环境中,并根据机构动物护理和使用委员会的标准和法规进行维护。
1. 通过抗原特异性刺激产生和扩增 CD8 T 细胞
- 第一天,收获来自 OT-I 小鼠的脾细胞;然后,用 SIINFEKL (4) 肽 在体外 制备和激活它们。
- 清洁通风橱空间,准备试剂,并收集小鼠培养基。在水或珠子培养箱中加热小鼠培养基。
- 在 6 孔板中,将 7 mL 小鼠培养基加入一个孔中,然后将另外 3 mL 小鼠培养基加入另一个孔中。然后,将过滤器插入含有 7 mL 培养基的孔中。
- 将小鼠从转移笼中的饲养箱带入实验室。将鼠标转移到空的新笼子上,并将 CO2 适配器放在顶部。用 CO2 对小鼠实施安乐死,直至流速为 2.75。
- 仔细观察老鼠并观察是否有任何痛苦的迹象。最后一次呼吸后,观察呼吸和生命迹象至少 1 分钟。关闭 CO2 并进行宫颈脱位作为安乐死的第二种方法。然后,清洁工作台、笼子和工作区域的其余部分,并将鼠标带到解剖罩上。
- 从小鼠身上解剖出脾脏。
- 用 70% 乙醇对解剖设备进行消毒,将鼠标左侧朝下,喷洒鼠标左侧消毒。
- 使用干净的器械,解剖以去除皮肤并确定腹膜。在腹膜上做一个小切口,找到脾脏,然后切除脾脏。将脾脏放入过滤器顶部的 6 孔板中。
- 清洁该区域,将老鼠尸体放入垃圾袋中,然后将袋子放入冰箱进行丢弃。
- 确保整个区域清洁,并将 6 孔板移至组织培养罩中进行下一步。
- 在组织培养罩中,匀浆脾并将细胞重悬到无团块的单细胞悬液中。
- 用 5 mL 注射器的柱塞将脾脏通过过滤器推入装有 7 mL 培养基的孔中。
- 在额外的孔中使用 3 mL 培养基冲洗过滤器和任何残留组织。
- 用血清移液管将细胞悬液转移到新的 10 mL 锥形管中。
- 以 500 × g 离心 5 分钟,并使用玻璃移液管吸出上清液。
- 裂解红细胞。
- 使用 1 mL ACK 裂解缓冲液开始红细胞裂解过程,方法是将细胞重悬于 ACK 裂解缓冲液中并在室温下孵育 1-5 分钟。
注:孵育时间应针对特定批次的 ACK 裂解缓冲液进行优化,以实现最大的红细胞裂解和最少的脾细胞死亡。 - 向锥形管中加入 10 mL 培养基进行中和,并以 500 × g 离心 5 分钟。
- 将细胞重悬于 50 mL 培养基中,并将其转移到 T75 培养瓶中。
- 使用 1 mL ACK 裂解缓冲液开始红细胞裂解过程,方法是将细胞重悬于 ACK 裂解缓冲液中并在室温下孵育 1-5 分钟。
- 用 SIINFEKL (N4) 肽刺激细胞。
- 将 SIINFEKL 肽带入组织培养罩中。将 SIINFEKL 肽储存在 -20 °C。
- 将 SIINFEKL 直接添加到培养基中,以达到 2 μg/mL 的最终浓度。向 50 mL 培养基中加入 50 μL SIINFEKL (2 mg/mL),以达到 2 μg/mL 的最终浓度。
- 将细胞在 37 °C 下孵育 72 小时。
- 使用 70% 乙醇对组织培养罩进行消毒。
- 清洁通风橱空间,准备试剂,并收集小鼠培养基。在水或珠子培养箱中加热小鼠培养基。
- 第四天,洗涤细胞以去除肽。使用补充有 IL-2 的新鲜制备培养基,重悬细胞,然后将培养瓶放回培养箱中。
- 在 50 mL 锥形管中收集 T75 组织培养瓶中的细胞。离心并沉淀 OT-I CD8 T 细胞,然后抽吸去除任何多余的培养基。加入 50 mL 含有 1,000 U/mL IL-2 的新小鼠培养基,并将细胞重悬转移到新的 T75 培养瓶中。
- 储存时,将 IL-2 原液的等分试样保存在 -80 °C 的冰箱中。 在 -80 °C 下储存将最大限度地减少肽降解。
- 准备扩增的抗原特异性细胞毒性 CD8 T 细胞用于线粒体功能测定
- 第 7 天,进行线粒体功能测定。准备抗原特异性 OT-I CD8 T 细胞进行检测。
- 收集活的 CD8 T 细胞。
- 将细胞从 T-75 组织培养瓶转移到新的 50 mL 锥形管中。然后,将锥形管以 500 × g 离心 5 分钟。
- 在新的 50 mL 锥形管中,当细胞旋转时,移液 20 mL 密度梯度培养基(密度 = 1.077 g/mL)。
- 离心完成后,取锥形管,使用 10 mL 培养基,重悬细胞。然后,非常缓慢地移液,将重悬的细胞分层在密度梯度的顶部。在不影响梯度的情况下,在室温下以 1,300 × g 离心锥形管 20 分钟,并将设置设置为最大加速度和最小减速度,无制动。
- 离心完成后,使用 P1000 移液器收集 T 细胞的中间层。可视化细胞层并确保移液管保持在上方并且不会干扰该层。将收集的细胞转移到含有 30 mL 完全小鼠培养基的新鲜 50 mL 锥形管中。然后,将 50 mL 锥形管以 500 × g 离心 5 分钟。离心完成后,从 OT-I CD8 T 细胞中吸出多余的上清液。用 20 mL 新鲜小鼠培养基重悬细胞。
- 使用血细胞计数器,计数活细胞的总数。用 1:4 稀释的台盼蓝对一小部分细胞进行染色,以鉴定死细胞。
注意:一只 OT-I 小鼠预计大约有 40-60 × 106 个细胞。 - 通过额外的离心步骤,用额外的 20 mL 新鲜小鼠培养基洗涤剩余的细胞。然后使用微孔板,在完全小鼠培养基中吸取 200,000 个细胞/孔的细胞。
2. 通过抗 CD3/抗 CD28 刺激产生和扩增多特异性 CD8 T 细胞
- 第 0 天,在 CD3 中包被 24 孔板。向 24 孔板的每个孔中加入 1 mL 浓度为 5 μg/mL 的抗 CD3-生物素,用 PBS 稀释。将板置于加湿的 5% CO2 培养箱中过夜。
- 第二天,收获一只小鼠并收集脾细胞。按照步骤 1.1.1-1.1.5.3 在体外 用抗 CD3/抗 CD28 激活脾细胞。
- 使用磁珠分离方案,分离 CD8 T 细胞。
注意:确保细胞保持低温。在预冷条件下,快速工作。- 使用 40 μL MACS 缓冲液,每 40 μL MACS 缓冲液中含有 10,000,000 个细胞,重悬细胞。对于溶液,将 10 μL 生物素抗体混合物彻底混合到细胞溶液中,然后在 4 °C 下孵育 5 分钟。
- 在等待细胞在冰箱中孵育的同时,准备一个用于阳性选择的色谱柱。使用 3 mL 缓冲液清洗色谱柱,然后丢弃废液流出液。
- 5 分钟后,从冰箱中收集细胞抗体溶液,每 10,000,000 个细胞添加 30 μL MACS 缓冲液、20 μL 抗生物素,然后在 4 °C 下再孵育 10 分钟。
- 使用新鲜的 15 mL 锥形管在阳性选择柱下制备新的收集管。10 分钟孵育完成后,将细胞悬液转移至阳性选择柱中。在新的 15 mL 锥形管中,收集流出液。使用 3 mL MACS 缓冲液,洗涤色谱柱以收集残留细胞。
注:确保细胞悬液的最小体积为 0.5 mL。 - 在 24 孔板中重新接种阳性选择的 CD8 T 细胞,用于抗 CD3/抗 CD28 刺激。
- 在 4 °C 下以 500 × g 离心流出液 5 分钟。 吸出多余的上清液并移液细胞以将其重悬于溶液中。使用血细胞计数器和台盼蓝,对细胞进行计数。
注意:请预期每个小鼠脾脏将计数 ~8-10 ×10 6 个活细胞。 - 细胞计数后,以 500,000 个细胞/mL 的浓度重悬 CD8 T 细胞。然后,从 24 孔板中小心吸出 1 mL PBS,将计数的细胞重新接种在 24 孔板中,每孔加入 106 个细胞。
- 为了刺激细胞,将抗 CD28 移液到 24 孔板中,使抗 CD28 的最终浓度为 2 μg/mL。要混合细胞,请小心敲击板。将细胞保持在 37 °C 接下来的 72 小时。
- 在 4 °C 下以 500 × g 离心流出液 5 分钟。 吸出多余的上清液并移液细胞以将其重悬于溶液中。使用血细胞计数器和台盼蓝,对细胞进行计数。
- 使用 70% 乙醇清洁组织培养罩。
- 在第 4 天(72 小时后),从抗 CD3/抗 CD28 刺激中取出细胞。通过离心多克隆 CD8 T 细胞来洗涤细胞。通过抽吸去除多余的上清液,然后用含有 1,000 单位/mL IL-2 和 10 mL 培养基的新鲜小鼠培养基重悬细胞。将重悬的细胞转移到新的 6 孔板中,并将其放入培养箱中。
注意: 1.2.2.储存时,等分试样的 IL-2 原液可以储存在 -80 °C 的冰箱中。 在 -80 °C 下储存将最大限度地减少肽降解。 - 准备扩增的多克隆效应子 CD8 T 细胞用于线粒体功能测定。
- 在第 7 天,准备并处理用于检测的多克隆 CD8 T 细胞。
- 收集活的 CD8 T 细胞。
- 使用移液管将细胞从 6 孔板转移到干净的锥形管中,然后以 500 × g 离心细胞 5 分钟。
- 按照步骤 1.3.3.2-1.3.4 进行作。
注:单只 C57BL/6 小鼠预计可产生约 10-3000 万活 CD8 T 细胞。 - 保存等分试样的细胞用于流式细胞术以评估 CD8 纯度。对于流式细胞术,使用所选活性染料 9 在冰上对细胞进行染色20 分钟。
3. 收获初始 CD8 T 细胞
- 在第七天,按照步骤 1.1.1-1.1.5.3 从小鼠中收获脾细胞。
- 使用步骤 2.3-2.3.5.1 中描述的基于磁珠的方案进行 CD8 T 细胞分离。
- 在完全培养基中以 200,000 个细胞/孔的密度将 CD8 T 细胞铺在微孔板中。
4. 进行线粒体功能检测
- 在运行线粒体功能测定前一天准备材料。
- 水合传感器探针板。
- 将 200 μL 蒸馏水移液到工具板的每个孔中。将传感器盒放在工具板的顶部。检查传感器盒的末端是否浸没在水中,以确保适当水合。将传感器盒和工具板放入 37 °C 的非 CO2 培养箱中至少 10 小时。
- 制备含有 50 mL Calbrant 的 50 mL 锥形管,并将其置于非 CO2 培养箱中并孵育过夜。
- 在检测前一天,准备完整的新鲜培养基以准备检测。在测定培养基中制备总共 50 mL 的 1 mM 丙酮酸、2 mM 谷氨酰胺和 10 mM 葡萄糖的溶液。
- 水合传感器探针板。
- 第二天进行线粒体功能测定。
- 轻弹工具板上的蒸馏水,将其取出。用 200 μL 校准液再水化。使用储存在非 CO2 培养箱中过夜的校准液。更换工具板顶部的传感器盒后。将带有传感器盒的工具板放回非 CO2 培养箱中。
注意:要轻弹板,请在水槽上以一种流体运动快速快速地倒置板,以便蒸馏水迅速从板中落出。
- 轻弹工具板上的蒸馏水,将其取出。用 200 μL 校准液再水化。使用储存在非 CO2 培养箱中过夜的校准液。更换工具板顶部的传感器盒后。将带有传感器盒的工具板放回非 CO2 培养箱中。
- 如上文第 1-3 节所述制备 CD8 T 细胞。
- 使用多通道移液器,将 10 ×10 6 个细胞重悬于 4.5 mL 完全培养基中,每孔接种 90 μL,每孔 200,000 个细胞。然后,在预处理过程中,每孔再添加 90 μL 指定培养基。
注:如果没有预处理,则用每孔 180 μL 的浓度接种细胞,每孔的终浓度为 200,000 个细胞。从实验方案中的这一点开始,将板保持在环境室温或非 CO2 培养箱中。板不应置于 5% CO2 培养箱中。请注意,微孔板的最终体积为 180 μL。
- 使用多通道移液器,将 10 ×10 6 个细胞重悬于 4.5 mL 完全培养基中,每孔接种 90 μL,每孔 200,000 个细胞。然后,在预处理过程中,每孔再添加 90 μL 指定培养基。
- 准备预处理(包括脂质或其他代谢物补充剂)。
- 通过使用快速离心机从冰箱中离心冻干脂质来制备脂质预处理。确定预处理所需的浓度,并将脂质预处理制备至这些浓度。使用前立即对稀释的脂质进行超声处理 30 分钟。
- 准备脂质鸡尾酒。
- 确定用于线粒体功能测定的所需脂质浓度。
- 以所需浓度的 2 倍制备脂质。然后,将脂质溶液添加到微孔板中的现有体积中,以实现 1:2 的稀释。通过将 90 μL 脂质溶液直接添加到预先存在的 90 μL 中来完成此作。最终体积为每孔 180 μL(1:2 稀释)。
注: 表 1 详细介绍了可能的板设置和设计的示例图。我们建议进行 5-6 次技术重复的检测,结合初始和抗原特异性效应 CD8 T 细胞,含和不含脂质添加剂。值得注意的是,该方案旨在避免离心以最大限度地减少细胞破坏。由于线粒体功能检测对细胞数量高度敏感,因此减少细胞损失至关重要。细胞不是离心,而是通过轻弹来处理细胞以保持其完整性。 - 将 180 μL 完全培养基移液到板的每个角落。将装有 CD8 T 细胞的微孔板放入非 CO2 培养箱中。
注:孵育时间将根据所需的预处理时间长度而变化。为了最大限度地减少细胞死亡,我们建议对 CD8 T 细胞进行最多 4 小时的预处理。过度的预处理时间可能会导致细胞过度死亡,从而影响结果的准确性。
- 准备急性注射的毒药和溶液。
- 使用储备溶液,制备稀释形式的寡霉素。在 3 mL 完全培养基中制备低聚霉素的稀释液。在 15 mL 锥形管中,小心准备毒药和急性注射剂。由于毒物对光敏感,因此请使用包裹在锡箔纸中的试管制备这些溶液,以防止光照。
- 在一根包裹在锡箔纸中的 15 mL 锥形管中,在 3 mL 完全培养基中稀释寡霉素,使注射后最终浓度为 2.5 μM。
- 在包裹在锡箔纸中的第二根 15 mL 锥形管中,在 3 mL 完全培养基中稀释 FCCP,使注射后最终浓度为 2.0 μM。
- 在包裹在锡箔纸中的第三个 15 mL 锥形管中,在 3 mL 完全培养基中制备鱼藤酮和抗霉素 A 的溶液,以在注射后达到两种毒素的浓度为 0.5 μM。
- 如果使用额外的代谢调节剂、药物或刺激剂进行检测,请在完全培养基中稀释这些药物。如果计划使用 etomoxir 或其他代谢调节剂和药物,请首先进行分析以测试滴定曲线并确定最佳使用浓度。如果通过急性注射进行 TCR 刺激,可以使用抗 CD3/抗 CD28 磁珠或板结合抗 CD3-生物素与抗 CD28 链霉亲和素的组合进行检测。
注:有关其他说明,请参阅第 5 节,其中描述了使用急性抗 CD3/CD28 注射刺激 TCR 的方案。
- 从非 CO2 培养箱中取出传感器柱。使用孔板适配器,将毒物移液到传感器探针板中。放置板适配器,以便每个腔室都可以专门加载毒药或其他急性注射剂。
注意:移液毒物时要小心。- 将毒物装入传感器盒的端口。如果没有进行额外的注射,端口 A-C 将加载毒物。将 20 μL 寡霉素移液到端口 A,将 22 μL FCCP 移液到端口 B,将 25 μL 鱼藤酮移液到端口 C,将 25 μL 抗霉素 A 移液到端口 C。
- 使用储备溶液,制备稀释形式的寡霉素。在 3 mL 完全培养基中制备低聚霉素的稀释液。在 15 mL 锥形管中,小心准备毒药和急性注射剂。由于毒物对光敏感,因此请使用包裹在锡箔纸中的试管制备这些溶液,以防止光照。
- 在仪器上开始检测前一小时,将微孔板放入非 CO2 培养箱中。
- 在启动仪器之前,请打开软件并校准仪器。在将微孔板装入仪器前 30 分钟执行此任务,以确保有足够的时间进行校准。
- 在软件系统上,标记孔并查看注入方案。
- 校准期间,将传感器探针板装入仪器中。软件将提示您完成初始化和质量检查。校准将评估每个孔的 pH 和 O2 ,这些孔要么通过,要么失败。仪器将在屏幕上报告结果,并带有复选标记或“X”。
5. 在急性抗 CD3/CD28 注射的单独实验中,使用 TCR 刺激进行线粒体功能测定的改良版本
注意:线粒体功能测定可以通过两种不同的方法通过急性 TCR 模拟进行,方法是 1) 使用步骤 5.2 中描述的生物素化抗 CD3 + 抗 CD28 + 链霉亲和素或 2) 步骤 5.3 中描述的抗 CD3/CD28 磁珠这些单独的实验都起到刺激 TCR 的功能在测定过程中通过急性注射。
- 如果进行额外注射,请按照上一节 4 中的说明准备检测。使用用于注射的附加腔室修改注射方案。在该协议中,抗 CD3/抗 CD28 被加载到传感器盒的端口 A 中。然后,以类似的方式加载其他端口,将寡霉素加载到端口 B 中,将 FCCP 加载到端口 C,将鱼藤酮和抗霉素 A 加载到端口 D 中。
- 制备并加载生物素化的抗 CD3 + 抗 CD28 + 链霉亲和素组分。
- 将 20 μL 10 μg/mL 的生物素化抗 CD3 移液到传感器柱中的指定孔中。
- 将 20 μL 2 μg/mL 的抗 CD28 + 20 μg/mL 的链霉亲和素移液到传感器柱中的指定孔中。
- 将 20 μL 10 μg/mL 的生物素化抗 CD3 + 2 μg/mL 的抗 CD28 + 20 μg/mL 的链霉亲和素移液到传感器柱的指定孔中。
- 确保准备好对照孔。确保有指定的孔仅注入培养基、单独的生物素化抗 CD3、抗 CD28 + 链霉亲和素和生物素化抗 CD3 + 抗 CD28 + 链霉亲和素。
- 使用 1:1 的磁珠与细胞比例,制备并加载抗 CD3/CD28 磁珠。
- 在每孔 200,000 个细胞的板中,将 5 μL 磁珠移液到传感器盒中的指定孔中。
- 用仅用于注射的培养基准备指定的对照孔。
- 调整毒物的体积,使注射后的最终注射后浓度为:寡霉素 2.5 μM,FCCP 2.0 μM,鱼藤酮和抗霉素 A 0.5 μM。
- 确保在将微孔板加载到仪器上之前修改进样方案以反映更新的时间点。
- 对软件进行编程以运行急性 TCR 刺激总共 140 分钟。在此时间范围内,修改方案,以便在寡霉素注射之前有 x10 个时间点测量。
结果
糖酵解和氧化代谢能力可以使用线粒体功能测定法进行测量,该线粒体功能测定法通过在特定时间点靶向电子传递链的组分来评估能力(图 2A)。可以将不同的注射方案加载到传感器盒端口上,以修改传统测定并评估急性 TCR 刺激(图 2B、C)。在解释结果之前,应优化各种细胞类型的细胞数量和药物浓度。在这里,本报告描述了针对 CD8 T 细胞优化的条件(图 3A、B),其中电子传递链抑制剂经过优化以测量幼稚细胞和效应细胞的容量(图 4A、B)。重要的是,该测定可以修改以研究抗原特异性刺激或抗 CD3/CD28 刺激产生的效应 CD8 T 细胞上的 TCR 刺激。我们进一步检查 CD8 T 细胞对生物活性脂质信号的反应,尤其是溶血磷脂酸或 LPA。我们确定响应 LPA 信号传导的代谢趋势(在将微孔板加载到分析仪仪器之前的 30 分钟、2 小时或 4 小时)在用抗原特异性或多克隆 TCR 刺激激活的两种 CD8 T 细胞中相似(图 5A-D)。TCR 刺激的类型和激活机制确实导致了细微的差异,其中代谢高能细胞最初是通过抗原特异性激活产生的(图 5E-L)。
将抗 CD3/CD28 急性注射到效应 CD8 T 细胞上可以通过实时测量急性刺激 TCR。生物素化的抗 CD3、抗 CD28 和链霉亲和素可以聚集用于刺激急性注射模型中的 TCR。作为一种单独的方法,可以在这种生物能量测定中使用与抗 CD3 和抗 CD28 偶联的磁珠进行急性注射,以实时刺激 TCR。我们调整了模型,在测定过程中将培养基、生物素化抗 CD3、抗 CD28 + 链霉亲和素或生物素化抗 CD3 + 抗 CD28 + 链霉亲和素的聚集体注射到效应 OT-I CD8 T 细胞上(图 6A、B)。我们观察到抗 CD3/CD28 刺激,导致 OCR 和 ECAR 增加。OCR 和 ECAR 信号也升高,但未达到与抗 CD3/CD28 相同的水平,仅存在生物素化的抗 CD3 信号。重要的是,我们发现了与抗 CD3/CD28 磁珠急性注射相当的相似代谢趋势(图 6C-F)。总之,这些结果表明,通过多种方法和方法,线粒体功能测定对于研究淋巴细胞免疫代谢,特别是 CD8 T 细胞是稳健且可重复的。

图 1:抗原特异性和多克隆刺激的 T 细胞受体激活。 (A) 具有主要组织相容性复合体 (MHC) I 类的抗原特异性信号转导示意图,肽与 T 细胞受体结合。 (B) 通过将 CD3 亚基和 CD28 共刺激分子与抗 CD3/28 抗体结合来描述 CD8 T 细胞多克隆激活。 请单击此处查看此图的较大版本。
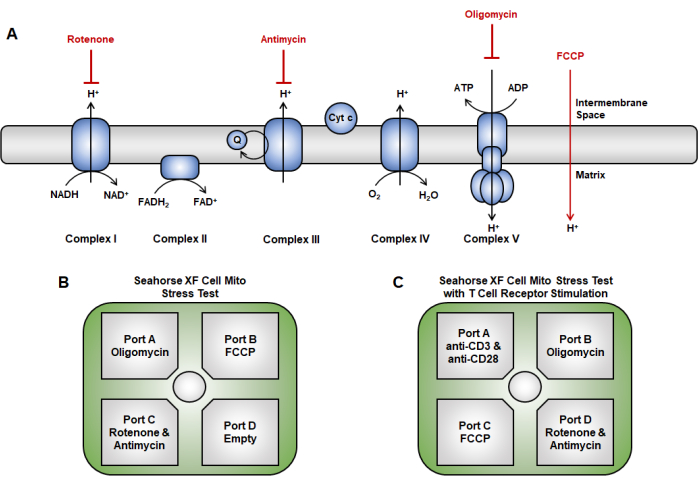
图 2:线粒体功能测定中电子传递链的药物靶向。 (A) 此处使用的电子传递链抑制剂(红色)示意图。(B,C)对于线粒体功能测试,传感器盒上的注射策略如下: (B) 传统的注射方法,其中寡霉素加载到端口 A,FCCP 加载到端口 B,鱼藤酮和抗霉素 A 加载到端口 C。(C) 急性注射方法包括将急性注射(抗 CD3/CD28)放置在端口 A,寡霉素放置在端口 B,FCCP 放置在端口 C, 以及 D 端口中的鱼藤酮和抗霉素 A。缩写:FCCP = 4-(三氟甲氧基)苯基)碳氧联酰二氰化物。 请单击此处查看此图的较大版本。

图 3:LPA 处理后抗 CD3 和抗 CD28 刺激产生的 CD8 T 细胞中 CD8 和 CD44 的表面表达、活力和代谢差异。(A) 效应 CD8 T 细胞是通过用 SIINFEKL (N4) 和脾细胞作为抗原呈递细胞或平板上的抗 CD3 和抗 CD28 刺激小鼠来源的 CD8 T 细胞在体外产生的。第 4 天,IL-2 取代初始刺激,支持分化和增殖。然后在体外培养后通过流式细胞术分析均一的第 7 天效应子 CD8 T 细胞。(B) 通过门控淋巴细胞状态,然后门控 CD8+/CD44+ 表达来识别 T 细胞。代表性图像显示 CD8 和 CD44 不受 LPA 治疗的影响。该图是从 Turner 等人 9 修改而来的。请单击此处查看此图的较大版本。
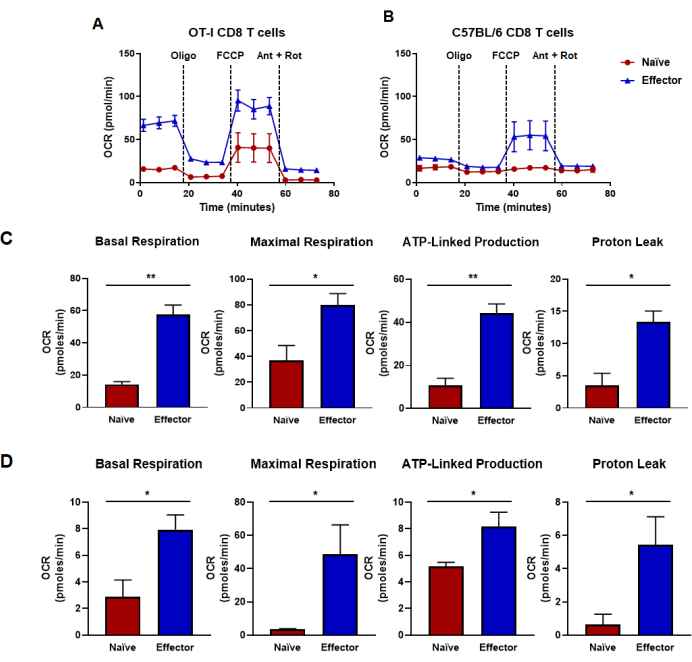
图 4:由耗氧率确定的氧化能力。 (A,B)(A) OT-I CD8 T 细胞抗原特异性刺激和扩增或 (B) 野生型 C57B/6 小鼠 CD8 T 细胞的抗 CD3/CD28 多克隆刺激和扩增产生的幼稚和效应 CD8 T 细胞的耗氧率。间隔 18 分钟注射寡霉素、 FCCP 、抗霉素 A 和鱼藤酮,加入 25 mM 葡萄糖培养基。结果显示为代表性数据,并使用 n = 6 个技术重复获得。(C,D)容量指标来自在图 (A,B) 中进行的代谢通量测定,并显示计算的基础呼吸、最大呼吸、ATP 相关产生和质子泄漏。(C) 代谢能力由 OT-I CD8 T 细胞测定,对应于图 (A) 中显示的数据。(D) 由 C57BL/6 CD8 T 细胞测定的代谢能力,对应于图 (B) 中显示的数据。对整个图进行了未配对学生 t 检验分析,其中 *p < 0.05,**p < 0.005,***p < 0.0005,****p < 0.0001。缩写:OCR = 耗氧率;寡核苷酸 = 寡霉素;FCCP = 4-(三氟甲氧基)苯基)碳氧基二氰化物;蚂蚁 = 抗霉素 A;rot = 鱼藤酮。 请单击此处查看此图的较大版本。

图 5:效应 CD8 T 细胞对 LPA 受体信号转导的反应的类似趋势,与抗原特异性或多克隆激活无关。(A,B) CD8 T 细胞耗氧率是从 (A) OT-I CD8 T 细胞抗原特异性刺激和扩增或 (B) 野生型 C57B/6 小鼠抗 CD3/CD28 多克隆刺激和扩增 CD8 T 细胞产生的细胞中测量的。(C,D)显示了由 (C) OT-I CD8 T 细胞抗原特异性刺激和扩增或 (D) 野生型 C57B/6 小鼠的 CD8 T 细胞的抗 CD3/CD28 多克隆刺激和扩增产生的细胞的效应 CD8 T 细胞细胞外酸化速率测量值。在补充谷氨酰胺(红色)或 1 μM LPA 的培养基中测量 CD8 T 细胞的代谢能力 30 分钟(绿色)、2 小时(蓝色)或 4 小时(绿色)。间隔 18 分钟注射寡霉素、 FCCP 、抗霉素 A 和鱼藤酮,加入 25 mM 葡萄糖培养基。结果显示为代表性数据,并使用 n = 6 个技术重复获得。(E-H)容量指标来自在面板 (A,C) 中进行的代谢通量测定,并显示计算的基础呼吸、最大呼吸、ATP 相关产生和质子泄漏。(I-L)面板 (B,D) 的容量计算显示基础呼吸、最大呼吸、ATP 相关产生和质子泄漏。使用单因素方差分析对整个图进行统计分析,其中 *p < 0.05。缩写:OCR = 耗氧率;ECAR = 细胞外酸化率;寡核苷酸 = 寡霉素;FCCP = 4-(三氟甲氧基)苯基)碳氧基二氰化物;蚂蚁 = 抗霉素 A;rot = 鱼藤酮。请单击此处查看此图的较大版本。

图 6:急性注射抗 CD3/CD28 实时刺激 T 细胞受体的策略。 (A,B)涉及生物素化抗 CD3、链霉亲和素和抗 CD28 的急性注射策略,用于线粒体功能评估。面板显示抗原刺激的 OT-I 效应 CD8 T 细胞的代谢能力,特别显示 (A) 细胞外酸化率和 (B) 耗氧率。注射仅使用培养基(红色)、生物素化抗 CD3(绿色)、抗 CD28 + 链霉亲和素(蓝色)或生物素化抗 CD3 + 抗 CD28 + 链霉亲和素(蓝绿色)的组合。(C,D)急性注射与抗 CD3/CD28 偶联的磁珠以评估线粒体活性。面板显示抗原刺激的 OT-I 效应 CD8 T 细胞的代谢能力,特别显示 (C) 细胞外酸化率和 (D) 耗氧率。注射仅使用培养基(红色)或抗 CD3/CD28 微珠注射(蓝绿色)。在补充有 25 mM 葡萄糖的培养基中,间隔 18 分钟注射寡霉素、 FCCP、抗霉素 A 和鱼藤酮进行测定。结果显示为代表性数据,并使用 n = 6 个技术重复获得。(E) 面板 (A-D) 的容量计算显示注射前的基础代谢(红色)、注射后呼吸(蓝色)和最大呼吸能力(灰色)。根据批内注射分离条件。(F) 显示基础呼吸、最大呼吸、ATP 相关产生和质子泄漏的容量计算。整个数字的统计是使用单因素方差分析进行的,其中 *p < 0.05,**p < 0.005,***p < 0.0005,****p < 0.0001。缩写:OCR = 耗氧率;ECAR = 细胞外酸化率;寡核苷酸 = 寡霉素;FCCP = 4-(三氟甲氧基)苯基)碳氧基二氰化物;蚂蚁 = 抗霉素 A;rot = 鱼藤酮。请单击此处查看此图的较大版本。
讨论
在本文中,我们概述了一种评估初始和效应 CD8 T 细胞线粒体功能的方案。我们详细介绍并比较了使用 OT-I 和 C57BL/6 小鼠制备抗原特异性和多克隆 CD8 T 细胞的方法。我们的结果表明,尽管 CD8 T 细胞采用活化和预处理方法,但代谢存在相似的趋势。数据显示,与用抗 CD3 和抗 CD28 刺激的 C57BL/6 野生型 T 细胞相比,抗原特异性激活导致代谢活性更高的 OT-I CD8 T 细胞。此处描述的方案表明,线粒体功能测定,即线粒体压力测试,是一种非常敏感且始终可重复的测定,可在多种不同条件和细胞类型中产生可靠的结果。我们的发现和详细的方案有助于人们越来越认识到该测定法是分析 CD8 T 细胞代谢和生物能量学的基础方法。
随着免疫疗法和各种细胞治疗的不断发展,应用 T 细胞靶向疗法的重要性也越来越大41。对免疫疗法和抗肿瘤免疫反应的反应依赖于 T 细胞介导的代谢、钙信号传导和上游 TCR 激活触发的氧化通量42。最佳 CD8 T 细胞反应需要代谢效率和灵活性 5,6,7,15,17,26,43,而质子泄漏增加和随后的氧化损伤会损害 T 细胞反应并促进功能障碍 9,44。T 细胞增殖和细胞因子产生都可以通过减轻线粒体氧化应激来挽救 5,13,20,24,25,29。在我们的实验中,我们使用了在 IL-2 中培养的幼稚 CD8 T 细胞,它维持了活力;然而,这些 CD8 T 细胞可以说不再等同于真正的幼稚 CD8 T 细胞。因此,我们选择直接使用来自小鼠的初始 CD8 T 细胞,以获得更高质量的数据和不太可能受细胞因子影响的细胞。总而言之,优化检查跨 T 细胞亚群代谢的技术至关重要。
CD8 T 细胞的命运部分由代谢编程指导,代谢编程会影响适应性免疫反应 2,4,45。初始 CD8 T 细胞在 TCR 刺激后退出静止状态 25,46,47,48,49,50。然而,持续的 TCR 刺激会导致 CD8 T 细胞耗竭,与功能性 CD8 T 细胞相比,导致能量表型明显降低 3,20,51,52。然而,这种对新陈代谢的影响可以得到改善,并可能使耗竭的 CD8 T 细胞恢复活力 2,3,20,46,51,52。虽然控制 CD8 T 细胞命运和穷尽分化的确切机制仍然知之甚少,但功能失调和/或耗竭的 CD8 T 细胞具有线粒体缺陷和 ROS 过量产生的特点,这是调节 CD8 T 细胞效应器功能的关键因素 9,15,53.CD8 T 细胞代谢、表型和穷举分化已使用 Mito 压力测试进行了研究。从历史上看,持续 TCR 刺激导致效应器功能进行性丧失定义了 CD8 T 细胞耗竭 11,13,16,17。然而,最近有人努力更好地表征耗竭的 CD8 T 细胞,并显示染色质和转录景观也定义了耗竭,并且与代谢通量密切相关 18,27,28。总而言之,持续的 TCR 刺激和随后的表型和代谢后遗症可以通过 Mito 压力测试进行研究,以潜在地识别代谢脆弱性和命运决定事件。
TCR 的刺激启动颗粒胞吐作用和定向 T 细胞杀伤所必需的下游钙信号传导24,33。值得注意的是,先前的事件(如炎性小体激活和 IFNγ 产生)依赖于持续和持续的 ATP54。在钙信号传导过程中,据报道线粒体效率失调,称为“线粒体闪光”现象 55,56,57,58。线粒体闪光代表一个过程,其中主动呼吸的线粒体短暂经历解耦呼吸,导致 ATP 降低和 ROS 增加55,56 增加。关于线粒体闪光的研究有限,其在 CD8 T 细胞中的相关性仍未得到广泛探索。重要的是,本研究中概述的方法可用于研究这些现象、CD8 T 细胞的详尽分化和其他免疫细胞谱。
总之,这些方法和工具为研究急性和慢性代谢提供了一种更全面的方法。线粒体压力测试可用于检查代谢编程以及它如何调节 CD8 T 细胞中的效应子功能障碍和穷举分化。淋巴细胞中的代谢重编程可能是理解免疫耐受、CD8 T 细胞功能障碍和免疫反应耗竭机制的一个因素。此外,代谢和/或脂质介质在 CD8 T 细胞的细胞毒性和耗竭中起关键作用9 ,因此可以作为防止耗竭或可能逆转穷举分化以降低抗肿瘤免疫力的新方法。总而言之,细胞线粒体压力测试检测是一种强大的工具,应该用于解决这些未解决的免疫代谢问题。
披露声明
作者没有需要披露的竞争利益。
致谢
赫兹基金会、艾米戴维斯基金会、摩尔家族基金会和海蒂霍纳基金会提供了宝贵的支持,我们对此表示感谢。这项工作还部分得到了 NIH 对 RMT (AI052157, AI136534) 的资助,而 JAT 则得到了赫兹研究生奖学金的支持。
材料
| Name | Company | Catalog Number | Comments |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Anti-CD28 | Biolegend | 102116 | |
| Anti-CD3/CD28 Dynabeads | ThermoFisher | 11456D | |
| Biotinylated anti-CD3 | Biolegend | 317320 | |
| Bovine Serum Albumin | Sigma-Aldrich | 108321-42-2 | |
| CD8a+ T cell isolation kit | Miltenyi Biotec | 130-104-075 | |
| Cell Strainers (100 µm) | CELL TREAT | 229485 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E8008 | |
| Ficoll | Sigma-Aldrich | 26873-85-8 | density gradient medium |
| FCCP ((4-(trifluoromethoxy) phenyl) carbonohydrazonoyl dicyanide) | Sigma-Aldrich | C2920 | |
| Glucose | Sigma-Aldrich | G-6152 | |
| Glutamine | Sigma-Aldrich | G7513 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | Positive selection columns |
| Magnetic cell separation column | Miltenyi Biotec | 130-042-301 | |
| Microplate | Agilent | 102601-100 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Pyruvate | Sigma-Aldrich | 113-24-6 | |
| Recobinant IL-2 | PeproTech | 200-02 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Seahorse media | Agilent | 103576-100 | |
| Sensor cartridge | Agilent | 102601-100 | |
| Streptavidin | Sigma-Aldrich | A9275 | |
| Sterile 6 well plate | CELL TREAT | 230601 | |
| Sterile 24 well plate | CELL TREAT | 229524 | |
| XF Calibrant | Agilent | 102601-100 |
参考文献
- Patsoukis, N., et al. PD-1 alters T-cell metabolic reprogramming by inhibiting glycolysis and promoting lipolysis and fatty acid oxidation. Nat Commun. 6, 6692 (2015).
- Scharping, N. E., et al. Mitochondrial stress induced by continuous stimulation under hypoxia rapidly drives T cell exhaustion. Nat Immunol. 22, 205-215 (2021).
- Schurich, A., et al. Distinct Metabolic Requirements of Exhausted and Functional Virus-Specific CD8 T Cells in the Same Host. Cell Rep. 16 (5), 1243-1252 (2016).
- Zhang, L., Romero, P. Metabolic control of CD8(+) T cell fate decisions and antitumor immunity. Trends Mol Med. 24 (1), 30-48 (2018).
- Batabyal, R., et al. Metabolic dysfunction and immunometabolism in COVID-19 pathophysiology and therapeutics. Int J Obes (Lond). 45 (6), 1163-1169 (2021).
- Chavakis, T. Immunometabolism: Where immunology and metabolism meet. J Innate Immun. 14, 1-3 (2022).
- Frezza, C., Mauro, C. Editorial: The metabolic challenges of immune cells in health and disease. Front Immunol. 6, 293 (2015).
- Wang, X., Ping, F. F., Bakht, S., Ling, J., Hassan, W. Immunometabolism features of metabolic deregulation and cancer. J Cell Mol Med. 23 (2), 694-701 (2019).
- Turner, J. A., et al. Lysophosphatidic acid modulates CD8 T cell immunosurveillance, metabolism, and anti-tumor immunity. Nat Commun. 14, 3214 (2023).
- Coussens, L. M., Werb, Z. Inflammation and cancer. Nature. 420, 860-867 (2002).
- Jiang, Y., Li, Y., Zhu, B. T-cell exhaustion in the tumor microenvironment. Cell Death Dis. 6 (6), e1792 (2015).
- Krangel, M. S. Mechanics of T cell receptor gene rearrangement. Curr Opin Immunol. 21 (2), 133-139 (2009).
- Barber, D. L., et al. Restoring function in exhausted CD8 T cells during chronic viral infection. Nature. 439, 682-687 (2006).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Bengsch, B., et al. Bioenergetic insufficiencies due to metabolic alterations regulated by the inhibitory receptor PD-1 are an early driver of CD8(+) T cell exhaustion. Immunity. 45 (2), 358-373 (2016).
- Blank, C. U., et al. Defining 'T cell exhaustion'. Nat Rev Immunol. 19, 665-674 (2019).
- Dolina, J. S., Van Braeckel-Budimir, N., Thomas, G. D., Salek-Ardakani, S. CD8(+) T cell exhaustion in cancer. Front Immunol. 12, 715234 (2021).
- Mognol, G. P., et al. Exhaustion-associated regulatory regions in CD8(+) tumor-infiltrating T cells. Proc Natl Acad Sci U S A. 114 (13), E2776-E2785 (2017).
- Wang, D., et al. A comprehensive profile of TCF1(+) progenitor and TCF1(-) terminally exhausted PD-1(+)CD8(+) T cells in head and neck squamous cell carcinoma: implications for prognosis and immunotherapy. Int J Oral Sci. 14 (1), 8 (2022).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21, 1022-1033 (2020).
- Kang, S., Brown, H. M., Hwang, S. Direct antiviral mechanisms of interferon-gamma. Immune Netw. 18 (5), e33 (2018).
- Samuel, C. E. Antiviral actions of interferons. Clin Microbiol Rev. 14, 778-809 (2001).
- Schellekens, H., Weimar, W., Cantell, K., Stitz, L. Antiviral effect of interferon in vivo may be mediated by the host. Nature. 278, 742 (1979).
- Radoja, S., et al. CD8(+) tumor-infiltrating T cells are deficient in perforin-mediated cytolytic activity due to defective microtubule-organizing center mobilization and lytic granule exocytosis. J Immunol. 167 (9), 5042-5051 (2001).
- van der Windt, G. J., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Balmer, M. L., et al. Memory CD8(+) T cells require increased concentrations of acetate induced by stress for optimal function. Immunity. 44 (6), 1312-1324 (2016).
- Pereira, R. M., Hogan, P. G., Rao, A., Martinez, G. J. Transcriptional and epigenetic regulation of T cell hyporesponsiveness. J Leukoc Biol. 102, 601-615 (2017).
- Sen, D. R., et al. The epigenetic landscape of T cell exhaustion. Science. 354, 1165-1169 (2016).
- Quintana, A., et al. T cell activation requires mitochondrial translocation to the immunological synapse. Proc Natl Acad Sci U S A. 104 (36), 14418-14423 (2007).
- Brindley, D. N. Lysophosphatidic acid signaling in cancer. Cancers (Basel). 12 (12), 3791 (2020).
- Chae, C. S., et al. Tumor-derived lysophosphatidic acid blunts protective type I interferon responses in ovarian cancer. Cancer Discov. 12, 1904-1921 (2022).
- Kremer, K. N., et al. LPA suppresses T cell function by altering the cytoskeleton and disrupting immune synapse formation. Proc Natl Acad Sci U S A. 119 (15), e2118816119 (2022).
- Mathew, D., et al. LPA5 is an inhibitory receptor that suppresses CD8 T-cell cytotoxic function via disruption of early TCR signaling. Front Immunol. 10, 1159 (2019).
- Mathew, D., Torres, R. M. Lysophosphatidic acid is an inflammatory lipid exploited by cancers for immune evasion via mechanisms similar and distinct from CTLA-4 and PD-1. Front Immunol. 11, 531910 (2020).
- Oda, S. K., et al. Lysophosphatidic acid inhibits CD8 T cell activation and control of tumor progression. Cancer Immunol Res. 1 (4), 245-255 (2013).
- Lidgerwood, G. E., Pitson, S. M., Bonder, C., Pebay, A. Roles of lysophosphatidic acid and sphingosine-1-phosphate in stem cell biology. Prog Lipid Res. 72, 42-54 (2018).
- Torres, R. M., Turner, J. A., D'Antonio, M., Pelanda, R., Kremer, K. N. Regulation of CD8 T-cell signaling, metabolism, and cytotoxic activity by extracellular lysophosphatidic acid. Immunol Rev. 317 (1), 203-222 (2023).
- Turner, J. A., et al. BRAF modulates lipid use and accumulation. Cancers (Basel). 14 (9), 2110 (2022).
- Hogquist, K. A., et al. T cell receptor antagonist peptides induce positive selection. Cell. 76, 17-27 (1994).
- Li, Y., Kurlander, R. J. Comparison of anti-CD3 and anti-CD28-coated beads with soluble anti-CD3 for expanding human T cells: differing impact on CD8 T cell phenotype and responsiveness to restimulation. J Transl Med. 8, 104 (2010).
- Ralli, M., et al. Immunotherapy in the treatment of metastatic melanoma: current knowledge and future directions. J Immunol Res. 2020, 9235638 (2020).
- Philip, M., Schietinger, A. CD8(+) T cell differentiation and dysfunction in cancer. Nat Rev Immunol. 22, 209-223 (2022).
- Bajrai, L. H., et al. Understanding the role of potential pathways and its components including hypoxia and immune system in case of oral cancer. Sci Rep. 11, 19576 (2021).
- Nicholls, D. G. Mitochondrial proton leaks and uncoupling proteins. Biochim Biophys Acta Bioenerg. 1862, 148428 (2021).
- Tyrakis, P. A., et al. S-2-hydroxyglutarate regulates CD8(+) T-lymphocyte fate. Nature. 540, 236-241 (2016).
- Guo, Y., et al. Metabolic reprogramming of terminally exhausted CD8(+) T cells by IL-10 enhances anti-tumor immunity. Nat Immunol. 22, 746-756 (2021).
- Notarangelo, G., et al. Oncometabolite d-2HG alters T cell metabolism to impair CD8(+) T cell function. Science. 377 (6614), 1519-1529 (2022).
- Yang, K., et al. T cell exit from quiescence and differentiation into Th2 cells depend on Raptor-mTORC1-mediated metabolic reprogramming. Immunity. 39 (6), 1043-1056 (2013).
- Ricciardi, S., et al. The translational machinery of human CD4(+) T cells is poised for activation and controls the switch from quiescence to metabolic remodeling. Cell Metab. 28 (6), 895-906.e5 (2018).
- Moller, S. H., Hsueh, P. C., Yu, Y. R., Zhang, L., Ho, P. C. Metabolic programs tailor T cell immunity in viral infection, cancer, and aging. Cell Metab. 34 (3), 378-395 (2022).
- Alrubayyi, A., et al. Functional restoration of exhausted CD8 T cells in chronic HIV-1 infection by targeting mitochondrial dysfunction. Front Immunol. 13, 908697 (2022).
- Vignali, P. D. A., et al. Hypoxia drives CD39-dependent suppressor function in exhausted T cells to limit antitumor immunity. Nat Immunol. 24, 267-279 (2023).
- Ogando, J., et al. PD-1 signaling affects cristae morphology and leads to mitochondrial dysfunction in human CD8(+) T lymphocytes. J Immunother Cancer. 7 (1), 151 (2019).
- Billingham, L. K., et al. Mitochondrial electron transport chain is necessary for NLRP3 inflammasome activation. Nat Immunol. 23, 692-704 (2022).
- Eberhardt, D. R., et al. EFHD1 ablation inhibits cardiac mitoflash activation and protects cardiomyocytes from ischemia. J Mol Cell Cardiol. 167, 1-14 (2022).
- Hou, T., et al. Identification of EFHD1 as a novel Ca(2+) sensor for mitoflash activation. Cell Calcium. 59 (5), 262-270 (2016).
- Mun, S. A., et al. Structural and biochemical characterization of EFhd1/Swiprosin-2, an actin-binding protein in mitochondria. Front Cell Dev Biol. 8, 628222 (2020).
- Stein, M., et al. A defined metabolic state in pre B cells governs B-cell development and is counterbalanced by Swiprosin-2/EFhd1. Cell Death Differ. 24 (7), 1239-1252 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。