Method Article
Medindo a função mitocondrial de células T CD8 virgens e efetoras
Neste Artigo
Resumo
A bioenergética de células T CD8 pode ser interrogada usando o Teste de Estresse Mito. Essa metodologia pode ser usada para estudar a programação metabólica aguda e crônica. Este protocolo descreve abordagens para examinar as relações entre a biologia do receptor de células T e a análise bioenergética.
Resumo
Compreender como o imunometabolismo afeta a função, diferenciação e destino dos linfócitos atraiu interesse e atenção significativos. A biologia de linfócitos tem sido explorada usando análise bioenergética e agora se tornou uma ferramenta de importância crítica no campo. Assim, buscamos otimizar um ensaio de análise bioenergética que possa ser adaptado com pré-tratamentos e injeção aguda para estímulos de receptores. Aqui, avaliamos o metabolismo ex vivo de células T CD8 usando o Cell Mito Stress Test para avaliar as taxas de consumo de oxigênio e acidificação extracelular em células T CD8 virgens e efetoras. As células T CD8 efetoras específicas do antígeno foram derivadas por estimulação ex vivo e as células T CD8 virgens foram colhidas de esplenócitos e isoladas com separação de coluna de esferas magnéticas.
Os pré-tratamentos são realizados em microplacas e detalhamos como preparar os cartuchos sensores. Mostramos como as portas de injeção podem ser carregadas com drogas para medir indiretamente as capacidades metabólicas e com moduladores metabólicos, este protocolo pode ser usado para estudar a atividade enzimática específica. As estimulações do receptor de células T podem ser estudadas em tempo real com injeção aguda e estimulação com anti-CD3/CD28 usando as portas de injeção. Os analisadores de instrumentos são usados para medições e coleta de dados e visualização de dados é feita com programas de software para interpretar o metabolismo celular. Essa estratégia produz uma extensa quantidade de dados sobre biologia de células imunes e bioenergética mitocondrial, permitindo que os pesquisadores personalizem o protocolo de várias maneiras para explorar o metabolismo das células T CD8.
Introdução
O destino e a funcionalidade das células imunes são significativamente afetados pelo metabolismo, consumo oxidativo e respiração anaeróbica 1,2,3,4. Recentemente, tem havido um interesse crescente em direcionar a modulação metabólica como uma estratégia para reprogramar ou revigorar o destino das células T CD8 e a função efetora e melhorar a depuração viral ou aumentar a imunidade antitumoral endógena 5,6,7,8,9. Notavelmente, a sinalização do receptor de antígeno através do receptor de células T (TCR) é um requisito fundamental para a diferenciação de células T CD8, resultando em sinalização e ativação a jusante10,11,12 (Figura 1). A exposição prolongada a insultos imunológicos causa estimulação persistente específica do antígeno no TCR, levando a estados cronicamente inflamados, fadiga de células T, remodelação do microambiente imunológico e escape imunológico 11,13,14,15,16,17,18,19.
O metabolismo das células T CD8 exaustas é fundamentalmente distinto daquele das células T CD8 efetoras funcionais 2,3,14,15,18,20. A diferenciação de células T, a secreção de interferon γ (IFNγ) e a capacidade de reconvocação são, em parte, determinadas pela função mitocondrial e pelos produtos de degradação da β-oxidação. As células T CD8 IFNγ+ são componentes críticos das respostas imunes antitumorais e antivirais 21,22,23. O fluxo metabólico específico via glicólise e a cadeia de transporte de elétrons é importante para a ativação de células T CD8, secreção de citocinas e respostas de memória 4,11,13,15,18,24,25,26,27,28 . Respostas ótimas, incluindo ativação de células T e diferenciação efetora, requerem uma resposta mitocondrial coordenada e específica, enquanto defeitos mitocondriais e espécies reativas de oxigênio (ROS) excessivas caracterizam células T exaustas ou disfuncionais 9,29. Recentemente, a estimulação persistente de TCR de células T CD8 in vitro promove a diferenciação exaustiva de células T CD8, em parte induzindo estresse oxidativo e reprogramando o metabolismo oxidativo e as capacidades metabólicas necessárias para a proliferação de células T1 , 2 , 13 , 20 , 24 , 29. Em conjunto, os eixos de controle metabólico são componentes críticos no direcionamento da diferenciação de células T CD8 e sua progressão para fenótipos efetores, de memória ou esgotados/disfuncionais.
Os compostos metabólicos também direcionam as respostas das células imunes, funcionando como moléculas de sinalização autócrinas ou parácrinas 9,30,31,32,33,34,35. A esfingosina-1-fosfato (S1P) e o ácido lisofosfatídico (LPA) são lipídios bioativos e inflamatórios que sinalizam via receptores acoplados à proteína G (GPCRs) para modular a saída de linfócitos e a citotoxicidade pelas células T CD836. A sinalização de LPA via receptores GPCR LPA em células T CD8 reprograma o metabolismo para aumentar a lipólise, a oxidação de ácidos graxos e o vazamento de prótons9. Ao todo, a bioenergética e o metabolismo das células T CD8 são amplamente impulsionados pela disponibilidade de substrato, pistas ambientais e requisitos energéticos.
Metodologias para interrogar o metabolismo das células T CD8 tornaram-se cada vez mais importantes. O Cell Mito Stress Test fornece uma avaliação abrangente da bioenergética e agora é reconhecido como uma técnica marcante no campo do imunometabolismo e da energética de células T CD8 9,37. As células aderentes foram historicamente usadas para o ensaio Mito StressTest 38; no entanto, há um interesse crescente em aplicar este protocolo para células cultivadas em suspensão e especificamente usando células imunes para o ensaio Cell Mito Stress Test. Aqui, apresentamos um protocolo detalhado para medir a atividade metabólica das células T CD8 com base em nossa recente publicação9. Fornecemos uma explicação detalhada da expansão das células T CD8, isolamento ingênuo de células T CD8, preparação do ensaio e tratamento com protocolos para pré-tratamentos e injeções agudas no ensaio Cell Mito Stress Test. É importante ressaltar que comparamos e contrastamos vários métodos para estimulação de TCR e ativação de células T CD8, incluindo estimulação de TCR policlonal e antígeno específico.
Este protocolo detalha a estimulação específica do antígeno usando camundongos transgênicos OT-I (um modelo clássico de camundongo transgênico) para o qual todas as células T de camundongo expressam os mesmos genes Vα2 e Vβ5 39. Todas as células T CD8 de camundongo OT-I abrigam o mesmo TCR que é específico contra ovalbumina octapeptídeo (OVA257-264, também escrito como a sequência de aminoácidos SIINFEKL ou N4, um epítopo amplamente estudado que, após apresentação pelo complexo principal de histocompatibilidade (MHC) classe I, ativa células T CD8 citotóxicas39 (Figura 1A). No geral, o modelo de camundongo transgênico OT-I é amplamente utilizado por imunologistas para estudar a sinalização TCR e a função efetora de células T específicas do antígeno. Ao contrário da ativação monoclonal com o modelo de camundongo OT-I, as células T CD8 policlonais podem ser geradas com anticorpos anti-CD3 / CD28 contra subunidades TCR CD3 e molécula co-estimuladora CD2840 (Figura 1B). Os anticorpos anti-CD3/CD28 ignoram o componente específico do antígeno da sinalização TCR para ativar uma população policlonal de células T40. Em última análise, os resultados descritos neste relatório comparam vários métodos para usar o Cell Mito Stress Test para quantificar o fluxo metabólico dinâmico em células T CD8.
Protocolo
Os camundongos foram mantidos em um ambiente livre de patógenos e mantidos de acordo com os padrões e regulamentos do Comitê Institucional de Cuidados e Uso de Animais.
1. Geração e expansão de células T CD8 por meio de estimulação antígeno-específica
- No primeiro dia, colher esplenócitos derivados de camundongos OT-I; em seguida, prepare-os e ative-os in vitro com o peptídeo SIINFEKL (4).
- Limpe o espaço do capô, prepare os reagentes e reúna o meio do rato. Aqueça a mídia do mouse em uma incubadora de água ou contas.
- Em uma placa de 6 poços, coloque 7 mL de meio de camundongo em um poço e depois outros 3 mL de meio de camundongo em um poço diferente. Em seguida, insira um filtro no poço contendo 7 mL de meio.
- Traga um camundongo do viveiro para o laboratório em uma gaiola de transferência. Transfira o mouse para uma nova gaiola vazia e posicione o adaptador CO2 na parte superior. Eutanasiar o camundongo com CO2 até um nível de fluxo de 2,75.
- Observe cuidadosamente o mouse e observe se há sinais de angústia. Após a última respiração, observe os sinais de respiração e vida por pelo menos 1 min. Desligue o CO2 e realize a luxação cervical como método secundário de eutanásia. Em seguida, limpe a bancada, a gaiola e o resto da área de trabalho e leve o mouse até a coifa.
- Disseque o baço do mouse.
- Use etanol 70% para esterilizar o equipamento de dissecação e, colocando o mouse com o lado esquerdo para baixo, borrife o lado esquerdo do mouse para desinfetar.
- Usando instrumentos limpos, disseque para remover a pele e identificar o peritônio. Faça uma pequena incisão no peritônio para encontrar o baço e, em seguida, excise o baço. Coloque o baço na placa de 6 poços em cima da peneira.
- Limpe a área, coloque a carcaça do rato em um saco de descarte e, em seguida, coloque o saco em um freezer para descarte.
- Certifique-se de que toda a área esteja limpa e mova a placa de 6 poços para a capa de cultura de tecidos para as próximas etapas.
- Na capa de cultura de tecidos, homogeneizar o baço e ressuspender as células em uma suspensão unicelular sem aglomerados.
- Empurre o baço através do filtro para o poço com 7 mL de meio com o êmbolo de uma seringa de 5 mL.
- Enxágue o filtro e qualquer tecido residual usando 3 mL de meio no poço adicional.
- Transferir a suspensão celular com uma pipeta serológica para um novo tubo cónico de 10 ml.
- Centrifugar durante 5 min a 500 × g e aspirar o sobrenadante com uma pipeta de vidro.
- Lise os glóbulos vermelhos.
- Inicie o processo de lise de glóbulos vermelhos usando 1 mL de tampão de lise ACK, ressuspendendo as células no tampão de lise ACK e incubando em temperatura ambiente por 1-5 min.
NOTA: O tempo de incubação deve ser otimizado para o lote específico de tampão de lise ACK para atingir a lise máxima de glóbulos vermelhos com morte mínima de esplenócitos. - Adicione 10 mL de meio ao tubo cônico para neutralização e centrifugue por 5 min a 500 × g.
- Ressuspender as células em 50 ml de meio e transferi-las para um balão T75.
- Inicie o processo de lise de glóbulos vermelhos usando 1 mL de tampão de lise ACK, ressuspendendo as células no tampão de lise ACK e incubando em temperatura ambiente por 1-5 min.
- Estimule as células com o peptídeo SIINFEKL (N4).
- Traga o peptídeo SIINFEKL para a capa de cultura de tecidos. Conservar o peptídeo SIINFEKL a -20 °C.
- Adicione SIINFEKL diretamente ao meio para obter uma concentração final de 2 μg/mL. Adicione 50 μL de SIINFEKL (2 mg/mL) a 50 mL de meio para atingir uma concentração final de 2 μg/mL.
- Incubar as células a 37 °C durante 72 h.
- Higienize a capa de cultura de tecidos usando etanol a 70%.
- Limpe o espaço do capô, prepare os reagentes e reúna o meio do rato. Aqueça a mídia do mouse em uma incubadora de água ou contas.
- No quarto dia, lave as células para remover o peptídeo. Usando meios recém-preparados suplementados com IL-2, ressuspenda as células e retorne o frasco à incubadora.
- Coletar as células do frasco de cultura de tecidos T75 em um tubo cônico de 50 mL. Centrifugue e pellet células T OT-I CD8 e, em seguida, remova qualquer excesso de meio com aspiração. Adicione 50 mL de novo meio de camundongo contendo 1.000 U / mL de IL-2 e transfira novamente as células para um novo frasco T75.
- Para armazenagem, manter alíquotas do estoque de IL-2 em um freezer a -80 °C. O armazenamento a -80 °C minimizará a degradação do peptídeo.
- Preparar células T CD8 citotóxicas específicas do antígeno expandido para o ensaio de função mitocondrial
- No sétimo dia, é realizado o ensaio da função mitocondrial. Preparar a célula T CD8 OT-I específica do antigénio para o ensaio.
- Colete células T CD8 vivas.
- Transferir as células do balão de cultura de tecidos T-75 para um novo tubo cónico de 50 ml. Em seguida, centrifugue o tubo cônico por 5 min a 500 × g.
- Em um novo tubo cônico de 50 mL, pipete 20 mL de um meio de gradiente de densidade (densidade = 1,077 g/mL) enquanto as células estão girando.
- Quando a centrifugação estiver concluída, pegue o tubo cônico e, usando 10 mL de meio, ressuspenda as células. Em seguida, pipetando muito lentamente, coloque as células ressuspensas em camadas no topo do gradiente de densidade. Sem perturbar o declive, centrifugue o tubo cônico a 1.300 × g por 20 min à temperatura ambiente com a configuração definida para aceleração máxima e desaceleração mínima sem freio.
- Quando a centrifugação estiver concluída, use uma pipeta P1000 para reunir a camada intermediária de células T. Visualize a camada celular e certifique-se de que a pipeta permaneça acima e não perturbe a camada. Transfira as células coletadas para um tubo cônico fresco de 50 mL contendo 30 mL de meio completo de camundongo. Em seguida, centrifugue o tubo cônico de 50 mL a 500 × g por 5 min. Quando a centrifugação estiver concluída, aspirar o sobrenadante excedente das células T OT-I CD8. Com 20 mL de meio fresco de camundongo, ressuspenda as células.
- Usando um hemocitômetro, conte o número total de células viáveis. Manchar uma pequena alíquota de células com azul de tripano em uma diluição de 1:4 para identificar células mortas.
NOTA: Aproximadamente 40-60 × 106 células podem ser esperadas de um mouse OT-I. - Com uma etapa adicional de centrifugação, lave as células restantes com mais 20 mL de meio fresco de camundongo. Em seguida, usando uma microplaca, pipetar células 200.000 células/poço em meio completo de camundongo.
2. Geração e expansão de células T CD8 poliespecíficas via estimulação anti-CD3/anti-CD28
- No dia 0, cubra uma placa de 24 poços com CD3. Adicione 1 mL de anti-CD3-biotina a uma concentração de 5 μg / mL, diluída em PBS, a cada poço de uma placa de 24 poços. Coloque a placa em uma incubadora umidificada de CO5 2 durante a noite.
- No dia seguinte, colha um camundongo e colete esplenócitos. Ative os esplenócitos in vitro com anti-CD3/anti-CD28 seguindo as etapas 1.1.1-1.1.5.3.
- Usando o protocolo de separação de esferas magnéticas, isole as células T CD8.
NOTA: Certifique-se de que as células sejam mantidas frias. Em condições pré-resfriadas, trabalhe rapidamente.- Usando 40 μL de tampão MACS, ressuspenda as células com 10.000.000 de células por 40 μL de tampão MACS. Para a solução, misture bem 10 μL de coquetel de anticorpos de biotina na solução celular e depois incube por 5 min a 4 ° C.
- Enquanto espera a célula incubar na geladeira, prepare uma coluna para seleção positiva. Use 3 mL de tampão para lavar a coluna e, em seguida, descarte o fluxo de resíduos.
- Após 5 minutos, colete a solução de anticorpo celular da geladeira e adicione 30 μL de tampão MACS por 10.000.000 de células, 20 μL de antibiotina e, em seguida, incube a 4 ° C por mais 10 minutos.
- Preparar um novo tubo de recolha sob uma coluna de selecção positiva utilizando um novo tubo cónico de 15 ml. Quando a incubação de 10 minutos estiver concluída, transfira a suspensão da célula para a coluna de seleção positiva. Em um novo tubo cônico de 15 mL, colete o fluxo. Usando 3 mL de tampão MACS, lave a coluna para coletar as células residuais.
NOTA: Certifique-se de que a suspensão celular esteja em um volume mínimo de 0.5 mL. - Recoloque as células T CD8 selecionadas positivamente na placa de 24 poços para estimulação anti-CD3 / anti-CD28.
- Centrifugar o fluxo a 500 × g durante 5 min a 4 °C. Aspirar o sobrenadante em excesso e pipetar as células para ressuspendê-las em solução. Usando um hemacitômetro e azul de tripano, conte as células.
NOTA: Por favor, espere ~ 8-10 × 106 células vivas a serem contadas por baço de camundongo. - Depois de contar as células, ressuspenda as células T CD8 a 500.000 células por mL. Em seguida, aspire cuidadosamente 1 mL de PBS da placa de 24 poços, recoloque as células contadas na placa de 24 poços e adicione 10 células de6 por poço.
- Para estimular as células, pipete o anti-CD28 na placa de 24 poços de modo que a concentração final de anti-CD28 seja de 2 μg/mL. Para misturar as células, bata cuidadosamente no prato. Manter as células a 37 °C durante as 72 h seguintes.
- Centrifugar o fluxo a 500 × g durante 5 min a 4 °C. Aspirar o sobrenadante em excesso e pipetar as células para ressuspendê-las em solução. Usando um hemacitômetro e azul de tripano, conte as células.
- Usando etanol a 70%, limpe a capa de cultura de tecidos.
- No dia 4 (72 h depois), remova as células da estimulação anti-CD3 / anti-CD28. Lave as células centrifugando células T CD8 policlonais. Remova o excesso de sobrenadante por aspiração e, em seguida, ressuspenda as células com meio fresco de camundongo com 1.000 unidades / mL de IL-2 com 10 mL de meio. Transfira as células ressuspensas para uma nova placa de 6 poços e coloque-a na incubadora.
NOTA: 1.2.2. Para armazenamento, alíquotas do estoque de IL-2 podem ser armazenadas em um freezer a -80 °C. O armazenamento a -80 °C minimizará a degradação do peptídeo. - Prepare as células T CD8 efetoras policlonais expandidas para o ensaio de função mitocondrial.
- No sétimo dia, prepare e processe as células T CD8 policlonais para o ensaio.
- Colete células T CD8 vivas.
- Transfira as células da placa de 6 poços para um tubo cônico limpo usando uma pipeta e, em seguida, centrifugue as células por 5 min a 500 × g.
- Siga as etapas 1.3.3.2-1.3.4.
NOTA: Aproximadamente 10-30 milhões de células T CD8 vivas podem ser esperadas de um único camundongo C57BL / 6. - Guarde uma alíquota de células para citometria de fluxo para avaliar a pureza do CD8. Para citometria de fluxo, core as células no gelo por 20 min com um corante de viabilidade de escolha9.
3. Colha células T CD8 ingênuas
- No sétimo dia, colha esplenócitos de um camundongo seguindo as etapas 1.1.1-1.1.5.3.
- Realize o isolamento de células T CD8 usando o protocolo baseado em esferas magnéticas descrito nas etapas 2.3-2.3.5.1.
- Células T CD8 em placa na microplaca a 200.000 células/por poço em meio completo.
4. Realize o ensaio de função mitocondrial
- Prepare os materiais um dia antes de executar o ensaio de função mitocondrial.
- Hidrate o cartucho do sensor.
- Pipetar 200 μL de água destilada em cada poço da placa de utilidades. Coloque o cartucho do sensor em cima da placa de utilidades. Verifique se as extremidades do cartucho do sensor estão submersas para garantir a hidratação adequada. Coloque o cartucho do sensor e a placa de utilidade em uma incubadora sem CO2 a 37 °C por um mínimo de 10 h.
- Prepare um tubo cônico de 50 mL com 50 mL de Calbrant e coloque-o em uma incubadora não-CO2 e incube durante a noite.
- No dia anterior ao ensaio, prepare o meio fresco completo em preparação para o ensaio. Em um total de 50 mL, prepare uma solução de 1 mM de piruvato, 2 mM de glutamina e 10 mM de glicose em meio de ensaio.
- Hidrate o cartucho do sensor.
- Realize o ensaio da função mitocondrial no dia seguinte.
- Remova a água destilada da placa de utilidades desligando-a. Reidrate com 200 μL de Calibrante. Use o Calibrante que foi armazenado na incubadora não-CO2 durante a noite. Depois de substituir o cartucho do sensor na parte superior da placa de utilidades. Coloque a placa de utilidade com o cartucho do sensor de volta na incubadora não-CO2 .
NOTA: Para sacudir a placa, inverta rápida e rapidamente a placa em um movimento fluido sobre a pia para que a água destilada caia rapidamente da placa.
- Remova a água destilada da placa de utilidades desligando-a. Reidrate com 200 μL de Calibrante. Use o Calibrante que foi armazenado na incubadora não-CO2 durante a noite. Depois de substituir o cartucho do sensor na parte superior da placa de utilidades. Coloque a placa de utilidade com o cartucho do sensor de volta na incubadora não-CO2 .
- Prepare as células T CD8 conforme descrito acima nas secções 1-3.
- Usando uma pipeta multicanal, coloque 200.000 células por poço, ressuspendendo 10 × 106 células em 4,5 mL de meio completo e plaqueando 90 μL por poço. Em seguida, adicione mais 90 μL de meio designado por poço durante o pré-tratamento.
NOTA: Se não houver pré-tratamentos, coloque as células em placas em 180 μL por poço com uma concentração final de 200.000 células por poço. Deste ponto em diante no protocolo, mantenha a placa em temperatura ambiente ou na incubadora não-CO2 . A placa não deve ser colocada em uma incubadora de CO5% 2 . Observe que o volume final da microplaca será de 180 μL.
- Usando uma pipeta multicanal, coloque 200.000 células por poço, ressuspendendo 10 × 106 células em 4,5 mL de meio completo e plaqueando 90 μL por poço. Em seguida, adicione mais 90 μL de meio designado por poço durante o pré-tratamento.
- Prepare pré-tratamentos (incluindo suplementação de lipídios ou outros metabólitos).
- Prepare o pré-tratamento lipídico girando o lipídio liofilizado do freezer usando uma minicentrífuga de centrifugação rápida. Determine as concentrações desejadas para o pré-tratamento e prepare o pré-tratamento lipídico para essas concentrações. Sonicar o lipídio diluído por 30 min imediatamente antes do uso.
- Prepare coquetéis lipídicos.
- Determine a concentração lipídica desejada a ser usada no ensaio de função mitocondrial.
- Prepare os lipídios em uma concentração 2x a concentração desejada. Em seguida, adicione a solução lipídica ao volume existente na microplaca para obter uma diluição de 1:2. Complete isso adicionando 90 μL da solução lipídica diretamente aos 90 μL preexistentes. O volume final será de 180 μL (diluição 1:2) por poço.
NOTA: A Tabela 1 detalha um diagrama de exemplo de uma possível configuração e design da placa. Sugerimos a realização do ensaio com 5-6 repetições técnicas, incorporando células T CD8 efetoras virgens e antígeno-específicas com e sem aditivos lipídicos. Notavelmente, este protocolo é projetado para evitar a centrifugação para minimizar a ruptura celular. Como o ensaio de função mitocondrial é altamente sensível ao número de células, a redução da perda celular é fundamental. Em vez de centrifugação, as células são manuseadas por movimento para preservar sua integridade. - Pipetar 180 μL de meio completo em cada canto da placa. Coloque a microplaca com células T CD8 em uma incubadora não-CO2 .
NOTA: O tempo de incubação varia de acordo com a duração desejada do pré-tratamento. Para minimizar a morte celular, recomendamos um máximo de pré-tratamentos de 4 h para células T CD8. O tempo de pré-tratamento excessivo pode causar morte celular excessiva, afetando a precisão dos resultados.
- Prepare venenos e soluções para injeções agudas.
- Usando soluções de estoque, prepare uma forma diluída de oligomicina. Crie uma diluição de oligomicina em 3 mL de meio completo. Em tubos cônicos de 15 mL, prepare cuidadosamente venenos e injeções agudas. Como os venenos são sensíveis à luz, prepare essas soluções usando tubos embrulhados em papel alumínio para proteger da exposição à luz.
- Em um tubo cônico de 15 mL envolto em papel alumínio, dilua a oligomicina em 3 mL de meio completo para que a concentração final seja de 2,5 μM após a injeção.
- Em um segundo tubo cônico de 15 mL envolto em papel alumínio, dilua o FCCP em 3 mL de meio completo de modo que a concentração final seja de 2,0 μM após a injeção.
- Em um terceiro tubo cônico de 15 mL envolto em papel alumínio, crie soluções de rotenona e antimicina A em 3 mL de meio completo para atingir concentrações de 0,5 μM para ambas as toxinas após a injeção.
- Se o ensaio estiver sendo realizado com moduladores metabólicos, drogas ou estímulos adicionais, dilua esses agentes em meio completo. Se estiver planejando usar etomoxir ou outros moduladores metabólicos e medicamentos, primeiro faça um ensaio para testar a curva de titulação e determinar a concentração ideal para uso. Se estiver conduzindo uma estimulação TCR por injeção aguda, o ensaio pode ser realizado usando esferas magnéticas anti-CD3/anti-CD28 ou uma combinação de anti-CD3-biotina ligada à placa com estreptavidina anti-CD28.
NOTA: Para descrições adicionais, consulte a seção 5 que descreve o protocolo para estimulação TCR com injeção aguda de anti-CD3 / CD28.
- Remova o cartucho do sensor da incubadora não-CO2 . Usando os adaptadores de placa, pipete os venenos no cartucho do sensor. Coloque os adaptadores de placa de forma que cada câmara possa ser especialmente carregada com venenos ou outras injeções agudas.
NOTA: Tenha cuidado ao pipetar os venenos.- Carregue venenos nas portas do cartucho do sensor. Se nenhuma injeção adicional estiver sendo realizada, as portas AC serão carregadas com venenos. Pipetar 20 μL de oligomicina na porta A, 22 μL de FCCP na porta B, 25 μL de rotenona na porta C e 25 μL de antimicina A na porta C.
- Usando soluções de estoque, prepare uma forma diluída de oligomicina. Crie uma diluição de oligomicina em 3 mL de meio completo. Em tubos cônicos de 15 mL, prepare cuidadosamente venenos e injeções agudas. Como os venenos são sensíveis à luz, prepare essas soluções usando tubos embrulhados em papel alumínio para proteger da exposição à luz.
- Uma hora antes de iniciar o ensaio no instrumento, coloque a microplaca na incubadora não-CO2 .
- Antes de iniciar o instrumento, abra o software e calibre o instrumento. Execute esta tarefa 30 minutos antes de carregar a microplaca no instrumento para garantir tempo suficiente para a calibração.
- No sistema de software, rotule os poços e revise o esquema de injeção.
- Durante a calibração, carregue o cartucho do sensor no instrumento. O software solicitará que você conclua a inicialização e a verificação de qualidade. A calibração avaliará o pH e o O2 em cada poço que passará ou falhará. O instrumento relatará os resultados na tela com uma marca de seleção ou um 'X'.
5. Realize uma versão modificada do ensaio de função mitocondrial com estimulação TCR em um experimento separado com uma injeção aguda de anti-CD3 / CD28
NOTA: O ensaio de função mitocondrial pode ser realizado com uma simulação de TCR aguda por meio de duas abordagens diferentes: 1) usando biotiniladas anti-CD3 + anti-CD28 + estreptavidina descritas na etapa 5.2 ou 2) esferas magnéticas anti-CD3 / CD28 descritas na etapa 5.3 Esses experimentos separados funcionam para estimular o TCR por meio de uma injeção aguda durante o ensaio.
- Se realizar injeções adicionais, prepare o ensaio conforme descrito na secção 4 anterior. Modificar os esquemas de injecção utilizando a câmara adicional para a injecção. Neste protocolo, anti-CD3/anti-CD28 são carregados na porta A do cartucho do sensor. Em seguida, carregue as outras portas de forma semelhante, com oligomicina na porta B, FCCP na porta C e rotenona e antimicina A na porta D.
- Prepare e carregue componentes biotinilados anti-CD3 + anti-CD28 + estreptavidina.
- Pipetar 20 μL de anti-CD3 biotinilado a 10 μg/mL nos poços designados no cartucho do sensor.
- Pipetar 20 μL de anti-CD28 a 2 μg/mL + estreptavidina a 20 μg/mL nos poços designados no cartucho do sensor.
- Pipetar 20 μL de anti-CD3 biotinilado a 10 μg/mL + anti-CD28 a 2 μg/mL + estreptavidina a 20 μg/mL nos poços designados no cartucho do sensor.
- Certifique-se de que os poços de controle estejam preparados. Certifique-se de que haja poços designados injetados apenas com meio, biotinilado anti-CD3 sozinho, anti-CD28 + estreptavidina e biotinilado anti-CD3 + anti-CD28 + estreptavidina.
- Usando uma proporção de 1:1 de cordão para célula, prepare e carregue grânulos magnéticos anti-CD3/CD28.
- Em uma placa com 200.000 células por poço, pipete 5 μL de esferas magnéticas para os poços designados no cartucho do sensor.
- Prepare os alvéolos de controlo designados com meios apenas para injecção.
- Ajuste o volume dos venenos para que as concentrações finais pós-injeção sejam: 2,5 μM para oligomicina, 2,0 μM para FCCP e 0,5 μM para rotenona e antimicina A.
- Certifique-se de que o esquema de injeção seja modificado para refletir os pontos de tempo atualizados antes de carregar a microplaca no instrumento.
- Programe o software para executar a estimulação aguda do TCR por um total de 140 min. Dentro desse período de tempo, modifique o esquema para que haja medições de ponto de tempo x10 antes da injeção de oligomicina.
Resultados
As capacidades metabólicas glicolíticas e oxidativas podem ser medidas usando um ensaio funcional mitocondrial que avalia as capacidades visando componentes da cadeia de transporte de elétrons em pontos de tempo específicos (Figura 2A). Diferentes esquemas de injeção podem ser carregados nas portas do cartucho do sensor para modificar o ensaio tradicional e avaliar a estimulação aguda do TCR (Figura 2B, C). O número de células e a concentração de medicamentos para vários tipos de células devem ser otimizados antes da interpretação dos resultados. Aqui, este relatório descreve as condições que foram otimizadas para células T CD8 (Figura 3A, B) com inibidores da cadeia de transporte de elétrons otimizados para medir as capacidades em células ingênuas e efetoras (Figura 4A, B). É importante ressaltar que este ensaio pode ser modificado para estudar a estimulação TCR em células T CD8 efetoras geradas a partir de estimulação específica do antígeno ou estimulação anti-CD3 / CD28. Examinamos ainda mais a resposta das células T CD8 à sinalização lipídica bioativa, especialmente com ácido lisofosfatídico ou LPA. Determinamos que as tendências metabólicas em resposta à sinalização LPA (30 min, 2 h ou 4 h antes de carregar a microplaca no instrumento analisador) foram semelhantes em ambas as células T CD8 ativadas com estimulação TCR específica do antígeno ou policlonal ( Figura 5A-D ). O tipo de estimulação do TCR e o mecanismo de ativação resultaram em diferenças sutis em que células metabolicamente energéticas foram inicialmente geradas com ativação específica do antígeno (Figura 5E-L).
A injeção aguda de anti-CD3/CD28 em células T CD8 efetoras pode estimular agudamente o TCR com medições em tempo real. Anti-CD3, anti-CD28 e estreptavidina biotinilados podem ser usados em conjunto para estimular o TCR em um modelo de injeção aguda. Como método separado, as injeções agudas podem ser realizadas com esferas magnéticas conjugadas a anti-CD3 e anti-CD28 neste ensaio bioenergético para estimular o TCR em tempo real. Adaptamos o modelo para injetar qualquer meio, anti-CD3 biotinilado, anti-CD28 + estreptavidina ou um agregado de anti-CD3 + anti-CD28 + estreptavidina biotinilada em células T OT-I CD8 efetoras no meio do tempo durante o ensaio ( Figura 6A , B ). Observamos estimulação com anti-CD3/CD28, o que resultou em aumento tanto do OCR quanto do ECAR. Os sinais OCR e ECAR também foram elevados, mas não para o mesmo nível que o anti-CD3/CD28, com sinal anti-CD3 biotinilado sozinho. É importante ressaltar que encontramos tendências metabólicas semelhantes que são comparáveis à injeção aguda de esferas magnéticas anti-CD3 / CD28 (Figura 6C-F). Em suma, esses resultados mostram com múltiplas abordagens e metodologias que o ensaio de função mitocondrial é robusto e reprodutível para estudar o imunometabolismo de linfócitos e, especificamente, células T CD8.

Figura 1: Ativação do receptor de células T com estimulação antígeno-específica e policlonal. (A) Esquema de sinalização específica do antígeno com complexo principal de histocompatibilidade (MHC) classe I com peptídeo ligado ao receptor de células T. (B) Representação da ativação policlonal de células T CD8 ligando as subunidades CD3 e a molécula coestimulatória CD28 com anticorpos anti-CD3/28. Clique aqui para ver uma versão maior desta figura.
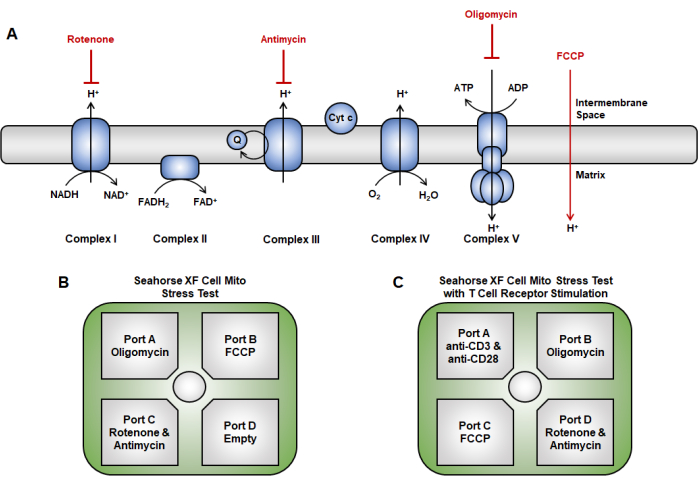
Figura 2: Direcionamento de drogas da cadeia de transporte de elétrons no ensaio de função mitocondrial. (A) Esquema dos inibidores da cadeia de transporte de elétrons (vermelho) usado aqui. (B, C) Para o teste de função mitocondrial, as estratégias de injeção no cartucho do sensor são as seguintes: (B) abordagem de injeção tradicional em que a oligomicina é carregada na porta A, FCCP na porta B e rotenona e antimicina A na porta C. (C) O método de injeção aguda envolve a colocação de injeção aguda (anti-CD3 / CD28) na porta A, oligomicina na porta B, FCCP na porta C, e rotenona e antimicina A na porta D. Abreviatura: FCCP = 4-(trifluorometoxi) fenil) carbonohidrazonoílo dicianeto. Clique aqui para ver uma versão maior desta figura.

Figura 3: Expressão superficial de CD8 e CD44, viabilidade e diferenças metabólicas em células T CD8 geradas a partir da estimulação anti-CD3 e anti-CD28 após o tratamento com LPA. (A) As células T CD8 efetoras são geradas ex vivo estimulando células T CD8 derivadas de camundongos com SIINFEKL (N4) e esplenócitos como células apresentadoras de antígenos ou anti-CD3 e anti-CD28 em placas. No dia 4, a IL-2 substitui os estímulos iniciais, apoiando a diferenciação e a proliferação. As células T CD8 efetoras homogêneas do dia 7 são então analisadas por citometria de fluxo após cultura in vitro . (B) As células T são identificadas por gating no status dos linfócitos e, em seguida, na expressão de CD8 + / CD44 + . Uma imagem representativa mostra que CD8 e CD44 não são afetados com o tratamento com LPA. Essa figura foi modificada de Turner et al.9. Clique aqui para ver uma versão maior desta figura.
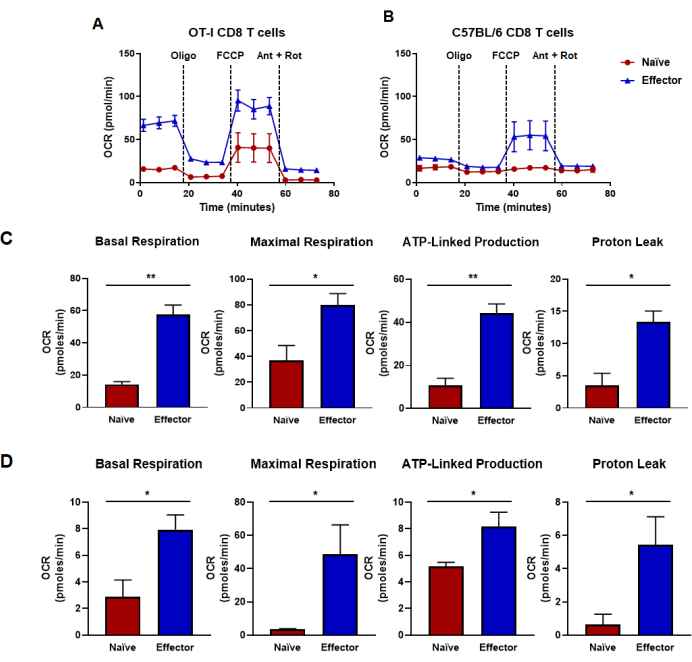
Figura 4: Capacidades oxidativas determinadas a partir da taxa de consumo de oxigênio. (A, B) Taxas de consumo de oxigênio para células T CD8 virgens e efetoras geradas por (A) estimulação e expansão específica do antígeno de células T OT-I CD8 ou (B) estimulação policlonal anti-CD3 / CD28 e expansão de células T CD8 de camundongos C57B / 6 do tipo selvagem. Oligomicina, FCCP, antimicina A e rotenona foram injetadas em intervalos de 18 min com meio de glicose 25 mM. Os resultados são apresentados como dados representativos e foram obtidos usando n = 6 réplicas técnicas. (C, D) As métricas de capacidade derivadas de ensaios de fluxo metabólico realizados em painéis (A, B) e exibem respiração basal calculada, respiração máxima, produção ligada a ATP e vazamento de prótons. (C) As capacidades metabólicas foram determinadas a partir de células T OT-I CD8 e correspondem aos dados mostrados no painel (A). (D) Capacidades metabólicas determinadas a partir de células T C57BL/6 CD8 e correspondem aos dados mostrados no painel (B). A análise do teste t de Student não pareado foi feita para toda a figura, onde *p < 0,05, **p < 0,005, *** p < 0,0005 e **** p < 0,0001. Abreviaturas: OCR = Taxa de consumo de oxigênio; Oligo = oligomicina; FCCP = 4-(trifluorometoxi) fenil) carbonohidrazonoílo dicianeto; formiga = antimicina A; podridão = rotenona. Clique aqui para ver uma versão maior desta figura.

Figura 5: Tendências semelhantes nas respostas das células T CD8 efetoras à sinalização do receptor LPA, independentemente da ativação específica do antígeno ou policlonal. (A, B) A taxa de consumo de oxigênio das células T CD8 é medida a partir de células geradas por (A) estimulação e expansão específica do antígeno de células T OT-I CD8 ou (B) estimulação policlonal anti-CD3 / CD28 e expansão de células T CD8 de camundongos C57B / 6 do tipo selvagem. (C, D) As medições da taxa de acidificação extracelular de células T CD8 efetoras são mostradas para células geradas por (C) estimulação e expansão específica do antígeno de células T OT-I CD8 ou (D) estimulação policlonal anti-CD3 / CD28 e expansão de células T CD8 de camundongos C57B / 6 do tipo selvagem. As capacidades metabólicas das células T CD8 foram medidas em meio suplementado com glutamina (vermelho) ou 1 μM de LPA por 30 min (verde), 2 h (azul) ou 4 h (verde). Oligomicina, FCCP, antimicina A e rotenona foram injetadas em intervalos de 18 min com meio de glicose 25 mM. Os resultados são apresentados como dados representativos e foram obtidos usando n = 6 réplicas técnicas. (E-H) As métricas de capacidade derivadas de ensaios de fluxo metabólico realizados em painéis (A,C) e exibem respiração basal calculada, respiração máxima, produção ligada a ATP e vazamento de prótons. (IL) Cálculos de capacidade de painéis (B,D) mostrando respiração basal, respiração máxima, produção ligada a ATP e vazamento de prótons. Todo o valor foi analisado estatisticamente usando a ANOVA de uma via, onde *p < 0,05. Abreviaturas: OCR = Taxa de consumo de oxigênio; ECAR = taxa de acidificação extracelular; Oligo = oligomicina; FCCP = 4-(trifluorometoxi) fenil) carbonohidrazonoílo dicianeto; formiga = antimicina A; podridão = rotenona. Clique aqui para ver uma versão maior desta figura.

Figura 6: Estratégias para estimulação do receptor de células T em tempo real com injeção aguda de anti-CD3/CD28. (A, B) Estratégia de injeção aguda envolvendo anti-CD3 biotinilado, estreptavidina e anti-CD28 para avaliação da função mitocondrial. Os painéis exibem as capacidades metabólicas das células T CD8 efetoras OT-I estimuladas por antígeno, mostrando especificamente (A) taxa de acidificação extracelular e (B) taxa de consumo de oxigênio. As injeções usam apenas meios (vermelho), anti-CD3 biotinilado (verde), anti-CD28 + estreptavidina (azul) ou uma combinação de anti-CD3 biotinilado + anti-CD28 + estreptavidina (azul-petróleo). (C, D) Injeção aguda de esferas magnéticas conjugadas com anti-CD3/CD28 para avaliar a atividade mitocondrial. Os painéis exibem as capacidades metabólicas das células T CD8 efetoras OT-I estimuladas por antígeno, mostrando especificamente (C) taxa de acidificação extracelular e (D) taxa de consumo de oxigênio. As injeções usam apenas mídia (vermelho) ou injeção de esferas anti-CD3 / CD28 (azul-petróleo). Os ensaios foram realizados com injeções de oligomicina, FCCP, antimicina A e rotenona em intervalos de 18 min em meio suplementado com 25 mM de glicose. Os resultados são apresentados como dados representativos e foram obtidos usando n = 6 réplicas técnicas. (E) Cálculos de capacidade de painéis (AD) mostrando o metabolismo basal na pré-injeção (vermelho), respiração na pós-injeção (azul) e capacidade respiratória máxima (cinza). As condições são separadas com base na injeção intra-ensaio. (F) Cálculos de capacidade mostrando respiração basal, respiração máxima, produção ligada a ATP e vazamento de prótons. As estatísticas para todo esse número foram realizadas usando a ANOVA de uma via, onde *p < 0,05, **p < 0,005, *** p < 0,0005 e ****p < 0,0001. Abreviaturas: OCR = Taxa de consumo de oxigênio; ECAR = taxa de acidificação extracelular; Oligo = oligomicina; FCCP = 4-(trifluorometoxi) fenil) carbonohidrazonoílo dicianeto; formiga = antimicina A; podridão = rotenona. Clique aqui para ver uma versão maior desta figura.
Discussão
Neste artigo, descrevemos um protocolo para avaliar a função mitocondrial de células T CD8 virgens e efetoras. Detalhamos e comparamos métodos para preparar células T CD8 específicas para antígenos e policlonais usando camundongos OT-I e C57BL/6. Nossos resultados demonstram que existem tendências semelhantes no metabolismo, apesar do método de ativação e pré-tratamento em células T CD8. Os dados revelam que a ativação específica do antígeno leva a células T OT-I CD8 mais metabolicamente ativas em comparação com suas contrapartes C57BL / 6 do tipo selvagem estimuladas com anti-CD3 e anti-CD28. O protocolo descrito aqui mostra que o ensaio funcional mitocondrial, o Mito Stress Test, é um ensaio muito sensível e consistentemente repetível que produz resultados confiáveis em várias condições e tipos de células. Nossas descobertas e protocolo detalhado contribuem para o crescente reconhecimento deste ensaio como uma metodologia fundamental para analisar o metabolismo e a bioenergética das células T CD8.
À medida que a imunoterapia e vários tratamentos celulares continuam avançando, a importância da aplicação de terapias direcionadas a células T também está crescendo41. A resposta à imunoterapia e as respostas imunes antitumorais dependem do metabolismo mediado por células T, sinalização de cálcio e fluxo oxidativo desencadeado pela ativação do TCRa montante 42. Tanto a eficiência metabólica quanto a flexibilidade são necessárias para respostas ideais de células T CD8 5,6,7,15,17,26,43 enquanto o aumento do vazamento de prótons e o subsequente dano oxidativo prejudicam as respostas das células T e promovem disfunção 9,44. Tanto a proliferação de células T quanto a produção de citocinas podem ser resgatadas pela mitigação do estresse oxidativo mitocondrial 5,13,20,24,25,29. Em nossos experimentos, usamos células T CD8 virgens que são cultivadas em IL-2, o que sustenta a viabilidade; no entanto, essas células T CD8 não são mais equivalentes às células T CD8 virgens de boa-fé. Assim, optamos por usar células T CD8 virgens diretamente do camundongo para dados de melhor qualidade e células com menor probabilidade de serem afetadas por citocinas. Ao todo, é crucial otimizar técnicas para examinar o metabolismo em subconjuntos de células T.
O destino das células T CD8 é em parte direcionado pela programação metabólica que afeta as respostas imunes adaptativas 2,4,45. As células T CD8 virgens saem de estados quiescentes após a estimulação do TCR 25,46,47,48,49,50. No entanto, a estimulação contínua do TCR leva à exaustão das células T CD8, resultando em um fenótipo notavelmente menos energético em comparação com as células T CD8 funcionais 3,20,51,52. No entanto, esse impacto no metabolismo pode ser melhorado e potencialmente revitalizar as células T CD8 exaustas 2,3,20,46,51,52. Embora o(s) mecanismo(s) exato(s) que governa(m) o destino das células T CD8 e a diferenciação exaustiva permaneçam pouco compreendidos, as células T CD8 disfuncionais e/ou exaustas caracteristicamente têm mitocôndrias defeituosas e superprodução de ROS, que são fatores-chave na regulação da função efetora das células T CD8 9,15,53. O metabolismo, os fenótipos e a diferenciação exaustiva das células T CD8 foram estudados usando o Mito Stress Test. Historicamente, a estimulação persistente do TCR, resultando em uma perda progressiva das funções efetoras, define a exaustão das células T CD8 11,13,16,17. No entanto, houve esforços recentes para caracterizar melhor as células T CD8 exaustas e mostrar que a cromatina e as paisagens transcricionais também definem a exaustão e estão intimamente relacionadas ao fluxo metabólico 18,27,28. Em conjunto, a estimulação persistente do TCR e os fenótipos e sequelas metabólicas subsequentes podem ser estudados com o Teste de Esforço Mito para identificar potencialmente vulnerabilidades metabólicas e eventos determinantes do destino.
A estimulação do TCR inicia a sinalização de cálcio a jusante necessária para a exocitose do grânulo e direciona a morte de células T24,33. Notavelmente, eventos anteriores, como ativação do inflamassoma e produção de IFNγ, dependem de um ATP54 persistente e sustentado. Durante a sinalização do cálcio, há uma desregulação relatada na eficiência mitocondrial, conhecida como fenômeno do "flash mitocondrial" 55,56,57,58. O flash mitocondrial representa um processo em que as mitocôndrias que respiram ativamente experimentam brevemente a respiração desacoplada, resultando em ATP reduzido e aumento da explosão de ROS aumentada55,56. Tem havido pesquisas limitadas sobre o flash mitocondrial e sua relevância nas células T CD8 permanece amplamente inexplorada. É importante ressaltar que as metodologias descritas neste estudo podem ser utilizadas para investigar esses fenômenos, diferenciação exaustiva em células T CD8 e outros perfis de células imunes.
Em resumo, essas metodologias e ferramentas oferecem uma abordagem mais abrangente para estudar o metabolismo agudo e crônico. O Mito Stress Test pode ser aplicado para examinar a programação metabólica e como ela regula a disfunção efetora e a diferenciação exaustiva em células T CD8. A reprogramação metabólica em linfócitos pode ser um fator na compreensão dos mecanismos subjacentes à tolerância imunológica, disfunção das células T CD8 e respostas imunes esgotadas. Além disso, o metabolismo e / ou mediadores lipídicos desempenham papéis importantes na citotoxicidade e exaustão das células T CD89 e, portanto, podem ser direcionados como uma nova abordagem para prevenir a exaustão ou potencialmente reverter a diferenciação exaustiva para reduzir a imunidade antitumoral. Ao todo, o ensaio Cell Mito Stress Test é uma ferramenta robusta que deve ser utilizada para abordar essas questões não resolvidas sobre o imunometabolismo.
Divulgações
Os autores não têm interesses conflitantes a divulgar.
Agradecimentos
A Fundação Hertz, a Fundação Amy Davis, a Fundação da Família Moore e a Fundação Heidi Horner forneceram um apoio inestimável, pelo qual somos gratos. Este trabalho também foi apoiado em parte por doações do NIH para RMT (AI052157, AI136534), enquanto o JAT foi apoiado pela Hertz Graduate Fellowship.
Materiais
| Name | Company | Catalog Number | Comments |
| Antimycin A | Sigma-Aldrich | A8674 | |
| Anti-CD28 | Biolegend | 102116 | |
| Anti-CD3/CD28 Dynabeads | ThermoFisher | 11456D | |
| Biotinylated anti-CD3 | Biolegend | 317320 | |
| Bovine Serum Albumin | Sigma-Aldrich | 108321-42-2 | |
| CD8a+ T cell isolation kit | Miltenyi Biotec | 130-104-075 | |
| Cell Strainers (100 µm) | CELL TREAT | 229485 | |
| Ethylenediaminetetraacetic acid | Sigma-Aldrich | E8008 | |
| Ficoll | Sigma-Aldrich | 26873-85-8 | density gradient medium |
| FCCP ((4-(trifluoromethoxy) phenyl) carbonohydrazonoyl dicyanide) | Sigma-Aldrich | C2920 | |
| Glucose | Sigma-Aldrich | G-6152 | |
| Glutamine | Sigma-Aldrich | G7513 | |
| LS Columns | Miltenyi Biotec | 130-042-401 | Positive selection columns |
| Magnetic cell separation column | Miltenyi Biotec | 130-042-301 | |
| Microplate | Agilent | 102601-100 | |
| Oligomycin | Sigma-Aldrich | 75351 | |
| Pyruvate | Sigma-Aldrich | 113-24-6 | |
| Recobinant IL-2 | PeproTech | 200-02 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Seahorse media | Agilent | 103576-100 | |
| Sensor cartridge | Agilent | 102601-100 | |
| Streptavidin | Sigma-Aldrich | A9275 | |
| Sterile 6 well plate | CELL TREAT | 230601 | |
| Sterile 24 well plate | CELL TREAT | 229524 | |
| XF Calibrant | Agilent | 102601-100 |
Referências
- Patsoukis, N., et al. PD-1 alters T-cell metabolic reprogramming by inhibiting glycolysis and promoting lipolysis and fatty acid oxidation. Nat Commun. 6, 6692 (2015).
- Scharping, N. E., et al. Mitochondrial stress induced by continuous stimulation under hypoxia rapidly drives T cell exhaustion. Nat Immunol. 22, 205-215 (2021).
- Schurich, A., et al. Distinct Metabolic Requirements of Exhausted and Functional Virus-Specific CD8 T Cells in the Same Host. Cell Rep. 16 (5), 1243-1252 (2016).
- Zhang, L., Romero, P. Metabolic control of CD8(+) T cell fate decisions and antitumor immunity. Trends Mol Med. 24 (1), 30-48 (2018).
- Batabyal, R., et al. Metabolic dysfunction and immunometabolism in COVID-19 pathophysiology and therapeutics. Int J Obes (Lond). 45 (6), 1163-1169 (2021).
- Chavakis, T. Immunometabolism: Where immunology and metabolism meet. J Innate Immun. 14, 1-3 (2022).
- Frezza, C., Mauro, C. Editorial: The metabolic challenges of immune cells in health and disease. Front Immunol. 6, 293 (2015).
- Wang, X., Ping, F. F., Bakht, S., Ling, J., Hassan, W. Immunometabolism features of metabolic deregulation and cancer. J Cell Mol Med. 23 (2), 694-701 (2019).
- Turner, J. A., et al. Lysophosphatidic acid modulates CD8 T cell immunosurveillance, metabolism, and anti-tumor immunity. Nat Commun. 14, 3214 (2023).
- Coussens, L. M., Werb, Z. Inflammation and cancer. Nature. 420, 860-867 (2002).
- Jiang, Y., Li, Y., Zhu, B. T-cell exhaustion in the tumor microenvironment. Cell Death Dis. 6 (6), e1792 (2015).
- Krangel, M. S. Mechanics of T cell receptor gene rearrangement. Curr Opin Immunol. 21 (2), 133-139 (2009).
- Barber, D. L., et al. Restoring function in exhausted CD8 T cells during chronic viral infection. Nature. 439, 682-687 (2006).
- Beltra, J. C., et al. Developmental relationships of four exhausted CD8(+) T cell subsets reveals underlying transcriptional and epigenetic landscape control mechanisms. Immunity. 52 (5), 825-841 (2020).
- Bengsch, B., et al. Bioenergetic insufficiencies due to metabolic alterations regulated by the inhibitory receptor PD-1 are an early driver of CD8(+) T cell exhaustion. Immunity. 45 (2), 358-373 (2016).
- Blank, C. U., et al. Defining 'T cell exhaustion'. Nat Rev Immunol. 19, 665-674 (2019).
- Dolina, J. S., Van Braeckel-Budimir, N., Thomas, G. D., Salek-Ardakani, S. CD8(+) T cell exhaustion in cancer. Front Immunol. 12, 715234 (2021).
- Mognol, G. P., et al. Exhaustion-associated regulatory regions in CD8(+) tumor-infiltrating T cells. Proc Natl Acad Sci U S A. 114 (13), E2776-E2785 (2017).
- Wang, D., et al. A comprehensive profile of TCF1(+) progenitor and TCF1(-) terminally exhausted PD-1(+)CD8(+) T cells in head and neck squamous cell carcinoma: implications for prognosis and immunotherapy. Int J Oral Sci. 14 (1), 8 (2022).
- Vardhana, S. A., et al. Impaired mitochondrial oxidative phosphorylation limits the self-renewal of T cells exposed to persistent antigen. Nat Immunol. 21, 1022-1033 (2020).
- Kang, S., Brown, H. M., Hwang, S. Direct antiviral mechanisms of interferon-gamma. Immune Netw. 18 (5), e33 (2018).
- Samuel, C. E. Antiviral actions of interferons. Clin Microbiol Rev. 14, 778-809 (2001).
- Schellekens, H., Weimar, W., Cantell, K., Stitz, L. Antiviral effect of interferon in vivo may be mediated by the host. Nature. 278, 742 (1979).
- Radoja, S., et al. CD8(+) tumor-infiltrating T cells are deficient in perforin-mediated cytolytic activity due to defective microtubule-organizing center mobilization and lytic granule exocytosis. J Immunol. 167 (9), 5042-5051 (2001).
- van der Windt, G. J., et al. Mitochondrial respiratory capacity is a critical regulator of CD8+ T cell memory development. Immunity. 36 (1), 68-78 (2012).
- Balmer, M. L., et al. Memory CD8(+) T cells require increased concentrations of acetate induced by stress for optimal function. Immunity. 44 (6), 1312-1324 (2016).
- Pereira, R. M., Hogan, P. G., Rao, A., Martinez, G. J. Transcriptional and epigenetic regulation of T cell hyporesponsiveness. J Leukoc Biol. 102, 601-615 (2017).
- Sen, D. R., et al. The epigenetic landscape of T cell exhaustion. Science. 354, 1165-1169 (2016).
- Quintana, A., et al. T cell activation requires mitochondrial translocation to the immunological synapse. Proc Natl Acad Sci U S A. 104 (36), 14418-14423 (2007).
- Brindley, D. N. Lysophosphatidic acid signaling in cancer. Cancers (Basel). 12 (12), 3791 (2020).
- Chae, C. S., et al. Tumor-derived lysophosphatidic acid blunts protective type I interferon responses in ovarian cancer. Cancer Discov. 12, 1904-1921 (2022).
- Kremer, K. N., et al. LPA suppresses T cell function by altering the cytoskeleton and disrupting immune synapse formation. Proc Natl Acad Sci U S A. 119 (15), e2118816119 (2022).
- Mathew, D., et al. LPA5 is an inhibitory receptor that suppresses CD8 T-cell cytotoxic function via disruption of early TCR signaling. Front Immunol. 10, 1159 (2019).
- Mathew, D., Torres, R. M. Lysophosphatidic acid is an inflammatory lipid exploited by cancers for immune evasion via mechanisms similar and distinct from CTLA-4 and PD-1. Front Immunol. 11, 531910 (2020).
- Oda, S. K., et al. Lysophosphatidic acid inhibits CD8 T cell activation and control of tumor progression. Cancer Immunol Res. 1 (4), 245-255 (2013).
- Lidgerwood, G. E., Pitson, S. M., Bonder, C., Pebay, A. Roles of lysophosphatidic acid and sphingosine-1-phosphate in stem cell biology. Prog Lipid Res. 72, 42-54 (2018).
- Torres, R. M., Turner, J. A., D'Antonio, M., Pelanda, R., Kremer, K. N. Regulation of CD8 T-cell signaling, metabolism, and cytotoxic activity by extracellular lysophosphatidic acid. Immunol Rev. 317 (1), 203-222 (2023).
- Turner, J. A., et al. BRAF modulates lipid use and accumulation. Cancers (Basel). 14 (9), 2110 (2022).
- Hogquist, K. A., et al. T cell receptor antagonist peptides induce positive selection. Cell. 76, 17-27 (1994).
- Li, Y., Kurlander, R. J. Comparison of anti-CD3 and anti-CD28-coated beads with soluble anti-CD3 for expanding human T cells: differing impact on CD8 T cell phenotype and responsiveness to restimulation. J Transl Med. 8, 104 (2010).
- Ralli, M., et al. Immunotherapy in the treatment of metastatic melanoma: current knowledge and future directions. J Immunol Res. 2020, 9235638 (2020).
- Philip, M., Schietinger, A. CD8(+) T cell differentiation and dysfunction in cancer. Nat Rev Immunol. 22, 209-223 (2022).
- Bajrai, L. H., et al. Understanding the role of potential pathways and its components including hypoxia and immune system in case of oral cancer. Sci Rep. 11, 19576 (2021).
- Nicholls, D. G. Mitochondrial proton leaks and uncoupling proteins. Biochim Biophys Acta Bioenerg. 1862, 148428 (2021).
- Tyrakis, P. A., et al. S-2-hydroxyglutarate regulates CD8(+) T-lymphocyte fate. Nature. 540, 236-241 (2016).
- Guo, Y., et al. Metabolic reprogramming of terminally exhausted CD8(+) T cells by IL-10 enhances anti-tumor immunity. Nat Immunol. 22, 746-756 (2021).
- Notarangelo, G., et al. Oncometabolite d-2HG alters T cell metabolism to impair CD8(+) T cell function. Science. 377 (6614), 1519-1529 (2022).
- Yang, K., et al. T cell exit from quiescence and differentiation into Th2 cells depend on Raptor-mTORC1-mediated metabolic reprogramming. Immunity. 39 (6), 1043-1056 (2013).
- Ricciardi, S., et al. The translational machinery of human CD4(+) T cells is poised for activation and controls the switch from quiescence to metabolic remodeling. Cell Metab. 28 (6), 895-906.e5 (2018).
- Moller, S. H., Hsueh, P. C., Yu, Y. R., Zhang, L., Ho, P. C. Metabolic programs tailor T cell immunity in viral infection, cancer, and aging. Cell Metab. 34 (3), 378-395 (2022).
- Alrubayyi, A., et al. Functional restoration of exhausted CD8 T cells in chronic HIV-1 infection by targeting mitochondrial dysfunction. Front Immunol. 13, 908697 (2022).
- Vignali, P. D. A., et al. Hypoxia drives CD39-dependent suppressor function in exhausted T cells to limit antitumor immunity. Nat Immunol. 24, 267-279 (2023).
- Ogando, J., et al. PD-1 signaling affects cristae morphology and leads to mitochondrial dysfunction in human CD8(+) T lymphocytes. J Immunother Cancer. 7 (1), 151 (2019).
- Billingham, L. K., et al. Mitochondrial electron transport chain is necessary for NLRP3 inflammasome activation. Nat Immunol. 23, 692-704 (2022).
- Eberhardt, D. R., et al. EFHD1 ablation inhibits cardiac mitoflash activation and protects cardiomyocytes from ischemia. J Mol Cell Cardiol. 167, 1-14 (2022).
- Hou, T., et al. Identification of EFHD1 as a novel Ca(2+) sensor for mitoflash activation. Cell Calcium. 59 (5), 262-270 (2016).
- Mun, S. A., et al. Structural and biochemical characterization of EFhd1/Swiprosin-2, an actin-binding protein in mitochondria. Front Cell Dev Biol. 8, 628222 (2020).
- Stein, M., et al. A defined metabolic state in pre B cells governs B-cell development and is counterbalanced by Swiprosin-2/EFhd1. Cell Death Differ. 24 (7), 1239-1252 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados