Method Article
Интраспинальная полостная инъекция мезенхимальных стволовых клеток человека и отслеживание их миграции в мозг крысы
В этой статье
Резюме
Для доставки мезенхимальных стволовых клеток (МСК) в мозг можно использовать несколько путей введения. В настоящем исследовании МСК доставлялись по всей нейрораксии и головному мозгу путем инъекции в спинномозговую полость. МСК вводили в спинномозговые полости крыс, а миграцию стволовых клеток отслеживали и количественно оценивали.
Аннотация
Мезенхимальные стволовые клетки (МСК) были изучены для лечения различных заболеваний. При нейродегенеративных заболеваниях, связанных с дефектами как головного, так и спинного мозга, путь введения очень важен, потому что МСК должны мигрировать как в головной, так и в спинной мозг. В данной статье описывается метод введения МСК в спинномозговой канал (инъекция в спинномозговую полость), который может быть нацелен на головной и спинной мозг на модели крысы. Один миллион МСК был введен в спинномозговые каналы крыс на уровне поясничных позвонков 2-3. После введения крыс усыпляли через 0, 6 и 12 ч после инъекции. Для отслеживания введенных МСК использовали оптическую визуализацию и количественную полимеразную цепную реакцию в реальном времени (кПЦР). Результаты настоящего исследования показали, что МСК, вводимые через спинномозговую полость, могут быть впоследствии обнаружены как в головном, так и в спинном мозге через 12 часов. Инъекция в спинномозговую полость имеет преимущество в том, что не требует общей анестезии и имеет мало побочных эффектов. Тем не менее, необходимо преодолеть недостаток, заключающийся в низкой скорости миграции МСК в мозг.
Введение
Мезенхимальные стволовые клетки
В условиях заболевания МСК выделяют специфические для болезни терапевтические вещества посредством паракринных действий1, которые, как сообщается, регулируют иммунные реакции, восстанавливают поврежденные ткани и выводят токсичные вещества2. Таким образом, терапия МСК считается более эффективной, чем терапия с одной мишенью, в лечении мультифакториальных заболеваний, таких как болезнь Альцгеймера и саркопения 3,4,5,6. Кроме того, в отличие от фармацевтических препаратов, МСК обладают хоуминговым эффектом, перемещаясь в область поврежденной ткани путем распознавания воспалительных цитокинов или хемокинов в организме 7,8. К сожалению, только часть клеток достигает поврежденного участка, и жизнеспособность МСК снижается во время миграции 9,10,11,12. Таким образом, для максимизации терапевтической эффективности МСК необходимо доставить жизнеспособные клетки к целевому участку. Поэтому при введении МСК важно выбрать правильный путь введения, исходя из характера целевого заболевания.
Путь впрыска
Существует множество путей введения терапевтических средств пациентам. Наиболее распространенными методами являются внутривенное введение в системный кровоток, пероральное введение, а также подкожное или внутримышечное введение. При нейродегенеративных заболеваниях основным препятствием в доставке терапевтических агентов в мозг является гематоэнцефалический барьер (ГЭБ). ГЭБ защищает мозг от внешних патогенов с помощью плотных соединений между кровеносными сосудами и паренхимой мозга13,14. Тем не менее, ГЭБ также парадоксальным образом препятствует проникновению терапевтических агентов в паренхиму мозга. Таким образом, прохождение через ГЭБ является основным препятствием в развитии методов лечения заболеваний головного мозга15,16. Для преодоления этого недостатка проводится внутримозговая инъекция путем введения целевых веществ непосредственно в мозг посредством хирургической операции 17,18,19. Тем не менее, следует учитывать побочные эффекты хирургических вмешательств, особенно потому, что игла повреждает нейронные клетки во время процедуры.
Внутриспинномозговое введение
Интратекальное введение - введение лекарств в спинномозговой канал или субарахноидальное пространство - доставляет лекарства в мозг или невраксис через спинномозговую жидкость (ликвор) и является жизнеспособной альтернативой внутримозговой инъекции. Интратекальные инъекции можно подразделить в зависимости от места инъекции: латеральный желудочек, большая цистерна и спинномозговая полость. Все три пути позволяют лекарствам или клеткам рассеиваться по всей спинномозговой жидкости в головной и спинной мозг. Доставка лекарств в мозг может быть более эффективной в случае внутримозговых инъекций и инъекций внутрь цистерны, поскольку агент вводится близко к мозгу. Тем не менее, инъекция в спинномозговую полость имеет преимущества, заключающиеся в том, что она не требует общей анестезии или хирургического вмешательства для введения внутрижелудочкового резервуара,является в целом безопасной и может быть выполнена повторно при необходимости.
Целью данного исследования было валидировать введение в спинномозговую полость в качестве средства доставки МСК как в головной, так и в спинной мозг. Во-первых, внутриспинальная полость была установлена на модели крысы. Затем МСК были помечены липофильным индикатором DiD (DiIC18(5); 1,1-диоктадецил-3,3,3,3-тетраметилиндодикарбоцианин, 4-хлорбензолсульфонат соль), чтобы оценить эффективность миграции стволовых клеток в спинной и головной мозг. Для оценки дисперсии клеток была проведена оптическая визуализация ex vivo. Этот простой протокол может быть выполнен без хирургического вмешательства и может быть использован с целью введения не только стволовых клеток, но и фармацевтических препаратов, антител, контрастных веществ и других веществ, предназначенных для доставки в спинной или головной мозг.
протокол
ПРИМЕЧАНИЕ: Данное исследование было одобрено Комитетом по уходу за животными и их использованию (номер одобрения: 20170125001, дата: 25 января 2017 г.) Института биомедицинских исследований Самсунг (SBRI) в Медицинском центре Самсунг. Являясь аккредитованным учреждением Международной ассоциации по оценке и аккредитации лабораторных животных, SBRI действует в соответствии с руководящими принципами, установленными Институтом ресурсов лабораторных животных.
1. Получение МСК человеческого желеобразного происхождения
- Культивирование мезенхимальных стволовых клеток Уортона, полученных из желе человека (WJ-MSCs)
- Быстро разморозьте флакон с человеческими WJ-MSC на водяной бане при температуре 37 °C. Перенесите WJ-MSCs в коническую пробирку объемом 50 мл и добавьте питательную среду в объеме, по крайней мере, в 10 раз превышающем объем клеток (v/v). Пипетируйте вверх и вниз, чтобы подвесить клетки.
- Центрифугируйте при 300 × г в течение 5 мин. Осторожно выбросьте надосадочную жидкость, и повторно суспендируйте клетки.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не выбросить гранулу клетки. - Засейте WJ-МСК в колбах T175 с плотностью 5000-6000 клеток/см2. Инкубируйте WJ-MSCs в инкубаторе с температурой ISO2 при температуре 37 °C. Меняйте питательную среду каждые 72 ч до тех пор, пока WJ-MSC не достигнет 80-90% слияния.
ПРИМЕЧАНИЕ: Как правило, требуется 3-4 дня, чтобы MSC достигли 80-90% конфлюенции.
- Субкультивирование человеческих WJ-MSC
- Выбросьте питательную среду и промойте клетки 10 мл фосфатно-солевого буфера (PBS). Удалите PBS и добавьте 5 мл 0,25% трипсин-динатрия этилендиаминтетрауксусной кислоты (ЭДТА) (см. Таблицу материалов). Инкубируйте клетки при 37 °C в инкубаторе сCO2 в течение 3 минут, пока WJ-MSCs не отделятся от колбы для культур.
- Добавьте 5 мл питательной среды, содержащей 10% фетальной бычьей сыворотки, чтобы нейтрализовать 0,25% трипсин-ЭДТА. Соберите клеточную смесь и перенесите ее в коническую пробирку объемом 50 мл. Промойте колбу для клеточных культур 10 мл питательной среды и соберите клетки в пробирку объемом 50 мл с помощью стерильной серологической пипетки.
- Центрифугируйте клеточную смесь при 300 × г в течение 5 мин. Выбросьте надосадочную жидкость, повторно суспендируйте клетки в 10 мл питательной среды и подсчитайте количество WJ-МСК.
ВНИМАНИЕ: Будьте осторожны и не выбрасывайте гранулу ячейки. - Засейте WJ-МСК с плотностью 4000-6000 клеток/см2, в зависимости от эксперимента.
- Мечение WJ-MSC красителем DiD и подготовка WJ-MSC для инъекции в спинномозговую полость
ПРИМЕЧАНИЕ: Процедура маркировки красителя DiD проводилась в соответствии с инструкциями производителя.- Отсоедините WJ-MSC, когда они достигнут 80% конфлюенции, используя процедуру, описанную выше. Суспендируйте WJ-MSCs плотностью от 1 × 106/мл в минимально необходимой эфирной среде (MEM), не содержащей фенола-красного, α без сыворотки.
- Добавить 5 мкл раствора для мечения DiD на 1 мл клеточной суспензии; Аккуратно перемешайте с помощью пипетки.
- Инкубировать в течение 15 минут при 37 °C; центрифугировать клеточную суспензию при 300 × г в течение 5 мин.
- Удалите надосадочную жидкость и повторно суспендируйте WJ-MSCs в МЭМ-α, не содержащем фенол-красного, с плотностью 1 × 106/0,2 мл.
2. Инъекции в спинномозговую полость WJ-MSCs
- Подготовка к инъекции в спинномозговую полость
- Обезболить 6-недельных крыс Sprague-Dawley 5% изофлураном; Затем поддерживайте анестезию 2% изофлураном на протяжении всей хирургической процедуры.
ПРИМЕЧАНИЕ: Оптимизируйте условия анестезии перед началом эксперимента. - Побрейте операционную область с помощью электробритвы для мелких животных.
ПРИМЕЧАНИЕ: Электрическую бритву можно заменить ручной бритвой и гелем для бритья. - Продезинфицируйте операционную область с помощью повидон-йода. Сделайте разрез на коже диаметром 3 см с помощью хирургического лезвия. Рассекайте оставшуюся кожу и мышечную ткань с помощью хирургического лезвия и ножниц. Выявить остистые отростки в поясничном отделе 2-3 (L2-3).
- Обезболить 6-недельных крыс Sprague-Dawley 5% изофлураном; Затем поддерживайте анестезию 2% изофлураном на протяжении всей хирургической процедуры.
- Инъекция меченых DiD WJ-MSC через интраспинальную полость
- Поместите крысу в положение лежа. Согните позвоночник крысы соответствующим образом, чтобы увеличить расстояние между соседними остистыми отростками, используя достаточное количество бумажной салфетки или других материалов, которые могут помочь в поддержании соответствующего положения.
- Наполните шприц объемом 1 мл 0,2 мл меченых DiD WJ-MSC. Поместите комбинацию шприца и иглы массой 23 г вертикально между остистыми отростками L2 и L3 и введите иглу до тех пор, пока она не коснется тела позвонка.
- Когда игла коснется тела позвонка, втяните его примерно на 0,5 см, поместив кончик иглы в спинномозговой канал. Наклоните шприц и поместите кончик иглы так, чтобы он был направлен в ростральном направлении. Вводите WJ-MSCs в полость позвоночника в течение 1 минуты.
ПРИМЕЧАНИЕ: Скорость впрыска должна быть заранее оптимизирована. - После инъекции полностью извлеките шприц из спинномозгового канала. Зашить разрез, а затем продезинфицировать место операции с помощью повидон-йода.
- Лечение после процедуры
- Стабилизируйте и удерживайте крысу, чтобы предотвратить любое движение, положите ее вниз головой под углом 45° на 15 минут, пока она еще находится под анестезией. Через 15 минут прекратите анестезию и подождите, пока крыса проснется.
3. Оценка инъекции в спинномозговую полость
- Эвтаназия крыс и изоляция головного и спинного мозга через 0, 6 и 12 ч после инъекции
- Обезболить подопытных животных 5% изофлураном; поддерживать анестезию 2% изофлураном во время перфузии PBS.
- Сделайте надрез ниже диафрагмы с помощью хирургических ножниц. Откройте разрез щипцами и разрежьте грудную клетку рострально, чтобы обнажить сердце.
- Сделайте небольшое отверстие в правом предсердии, а в левый желудочек вставьте иглу-бабочку. Перфузируйте 100 мл холодного PBS в левый желудочек в течение 4-5 минут, пока печень не очистится от крови.
- После перфузии сделайте длинный разрез на тыльной стороне от головы до хвоста с помощью хирургического лезвия по продольной плоскости. Изолируйте оставшийся мозг и весь позвоночник с помощью хирургических ножниц, щипцов и косторезовки. Удалите оставшиеся ребра, соединенные кости и мякоть.
- Флуоресцентная оптическая визуализация Ex vivo DiD
- Поместите изолированные ткани в камеру оптического устройства визуализации.
- Установите следующие параметры: излучение, 700 нм; возбуждение, 605 нм; и время экспозиции, 2 секунды, в пересчете на фотоны в секунду на квадратный сантиметр на стерадиан (p/s/cm2/sr). Захват оптических изображений.
ПРИМЕЧАНИЕ: Все изображения должны быть получены с идентичными настройками освещенности (напряжение лампы, фильтры, f/stop, поле зрения и биннинг). - С помощью инструмента рисования нарисуйте три прямоугольные области интереса (ROI) эквивалентного размера для спинного мозга и одну круглую область интереса для головного мозга. Измерьте интенсивность флуоресценции ROI.
- Экстракция геномной ДНК (гДНК) из спинного и головного мозга
- Осторожно удалите череп и позвоночник с помощью хирургических щипцов, ножниц и ронжера.
- Соберите головной и спинной мозг из черепа и позвоночника. Разрежьте спинной мозг на три части (шейную, грудную и поясничную).
ПРИМЕЧАНИЕ: Собранные ткани должны храниться при температуре -80 °C, если они не были немедленно проанализированы. - Измельчите салфетки с помощью предварительно охлажденной ступки, пестика и жидкого азота. Экстрагируйте гДНК с помощью коммерческих продуктов, следуя инструкциям производителя.
- Количественная полимеразная цепная реакция в реальном времени (кПЦР)
- Количественно оцените количество гДНК в каждом образце с помощью спектрофотометра.
- Проведите кПЦР с использованием 10 нг гДНК на образец и праймеров Arthrobacter luteus (ALU) человека12,21.
- Рассчитайте точное количество WJ-MSC в образцах с помощью метода ΔΔCT 22.
Результаты
Для оценки эффективности интраспинальной полости введения МСК в настоящей работе использовались МСК, меченные DiD. Перед введением МСК в спинномозговую полость эффективность мечения оценивали in vitro с помощью оптической визуализации и флуоресцентной микроскопии (рис. 1). После окрашивания МСК реагентом для мечения DiD с использованием процедуры, описанной в разделе 3.1 протокола, были получены оптические изображения культуральных планшетов, на которые были засеяны меченные DiD МСК (рис. 1A). МСК с меткой DiD (+DiD) показаны красным цветом; наивные МСК (-DiD), которые не были помечены красителем DiD, не показали положительного сигнала. Этот результат был подтвержден с помощью флуоресцентной микроскопии (рис. 1B). МСК также окрашивали 4',6-диамидино-2-фенилиндолом (DAPI) для визуализации их формы. Наивные МСК (-DiD) появлялись синим цветом, указывая на окрашивание DAPI или ядерным окрашиванием, но не показывали красный цвет, который связан с окрашиванием DiD. Напротив, меченные DiD МСК (+DiD) имели как синий, так и красный цвета, что указывает на то, что метод мечения DiD был успешным.

Рисунок 1: DiD-мечение МСК in vitro. (A) Меченные DiD МСК засеивали в 6-луночный культуральный планшет, и проводили оптическую визуализацию. (B) Изображения были получены с помощью флуоресцентной микроскопии. Ядра МСК обозначены синим цветом (DAPI), а инкорпорированный DiD локализован в цитозоле клеток +DiD (красный цвет). Масштабные линейки = 500 μм. Эта цифра была изменена по сравнению с Kim et al.12. Сокращения: -DiD = наивные МСК, +DiD = МСК, меченные реагентом DiD; MSC = мезенхимальная стволовая клетка; DiD = DiIC18(5); 1,1-диоктадецил-3,3,3,3-тетраметилиндодикарбоцианин, 4-хлорбензолсульфонат соль; DAPI = 4',6-диамидино-2-фенилиндол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Далее была оценена методика инъекции в спинномозговую полость. Для оценки и оптимизации процедуры инъекции в спинномозговую полость вместо меченых DiD МСК был использован трипановый синий краситель, как описано в разделе 2 протокола (Рисунок 2). Был введен трипановый синий краситель, и крыса была немедленно усыплена. Ткань спинного мозга, собранная у крысы, была разрезана на три части в поперечном направлении, а головной мозг был разрезан на корональные отделы. Было обнаружено, что введенный трипановый синий краситель окрашивал ткани спинного мозга (поясничный, грудной и шейный отделы). Более того, как низшая, так и верхняя стороны мозга были окрашены в синий цвет. Однако трипановый синий краситель не проникал в боковой желудочек мозга. Эти результаты свидетельствовали о том, что данный метод инъекции в спинномозговую полость был успешным.

Рисунок 2: Подтверждение инъекции в спинномозговую полость у модели крысы. Трипановый синий краситель был введен в спинномозговую полость подопытной крысы. После инъекции крысу усыпили, а также провели вскрытие. Трипановый синий краситель, введенный через спинномозговой канал, мигрировал и окрашивал как спинной мозг (поясничный, грудной и шейный), так и синий мозг. Масштабные линейки = 1 см. Эта цифра была изменена по сравнению с Kim et al.12. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Используя протокол, успешно оптимизированный, как описано выше, меченные DiD МСК были введены через интраспинальную полость крысам (рис. 3). Крыс усыпляли через 0, 6 и 12 ч после инъекции, а также проводили оптическую визуализацию ex vivo (рис. 3A). По сравнению с сигналами у животных контрольной группы (без инъекции), высокие и конденсированные положительные сигналы были обнаружены в поясничном отделе спинного мозга крыс, усыпленных сразу после инъекции (0 ч). Через 6 ч после инъекции положительный сигнал был рассеян по всему поясничному отделу спинного мозга. Наконец, высокие положительные сигналы наблюдались в поясничном и шейном отделах спинного мозга и даже в головном мозге через 12 ч после инъекции. Интенсивность сигнала оптических изображений количественно оценивалась в каждой временной точке с помощью программного обеспечения для анализа изображений (рис. 3B). Достоверное увеличение интенсивности сигнала выявлено в поясничном отделе спинного мозга через 0 ч после инъекции и в головном мозге через 12 ч после инъекции.

Рисунок 3: Анализ оптической визуализации для оценки эффективности инъекции в спинномозговую полость. (A) После введения МСК в спинномозговую полость крыс усыпляли в следующие временные моменты: через 0, 6 и 12 часов после инъекции, после чего проводилась оптическая визуализация ex vivo. Положительный сигнал отображается желто-красным цветом. (B) На основе изображений интенсивность сигнала была количественно определена с помощью программного обеспечения. Для каждой экспериментальной группы были нарисованы эквивалентные области интереса. Данные представлены в виде среднего ± стандартной погрешности среднего (SEM). *p < 0,05. Эта цифра была изменена по сравнению с Kim et al.12. Сокращения: МСК = мезенхимальные стволовые клетки; CTL = контроль. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
В предыдущем исследовании сообщалось, что последовательность ALU человека может быть использована в качестве количественного маркера для измерения количества клеток человеческого происхождения, таких как нейральные стволовые клетки и МСК, в контексте трансплантации ксенотрансплантатов 9,11,12. В соответствии с рекомендациями предыдущего исследования, в настоящем исследовании был использован анализ количественной ПЦР с использованием специфичного для человека праймера ALU для оценки распределения in vivo и миграции меченых DiD МСК (рис. 4). После амплификации последовательности ALU продукт ПЦР разделяли на агарозном геле и визуализировали (рис. 4А). По сравнению с контрольным образцом (гДНК, извлеченной из мозга крыс в группе без инъекции), последовательность ALU была сильно амплифицирована в 12-часовом образце (гДНК, извлеченная из мозга крыс через 12 часов после инъекции). Тем не менее, в обоих образцах мышиный Gapdh был сильно амплифицирован, что указывает на то, что клетки человеческого происхождения, особенно человеческие МСК, использованные в этом исследовании, присутствовали только в 12-часовой групповой выборке. Затем распределение МСК в головном мозге и других органах (сердце, легкие, печень, селезенка и почки) было подтверждено с помощью того же метода (рис. 4В). Как и в случае с результатами оптической визуализации, значительное количество МСК было обнаружено только в головном мозге через 12 ч после инъекции. Другие образцы показали дисперсию в соотношении ALU к Gapdh, но все сигналы от образцов, за исключением сигналов от мозга через 12 часов после инъекции, были ниже предела обнаружения, что означает, что существенного усиления не произошло.
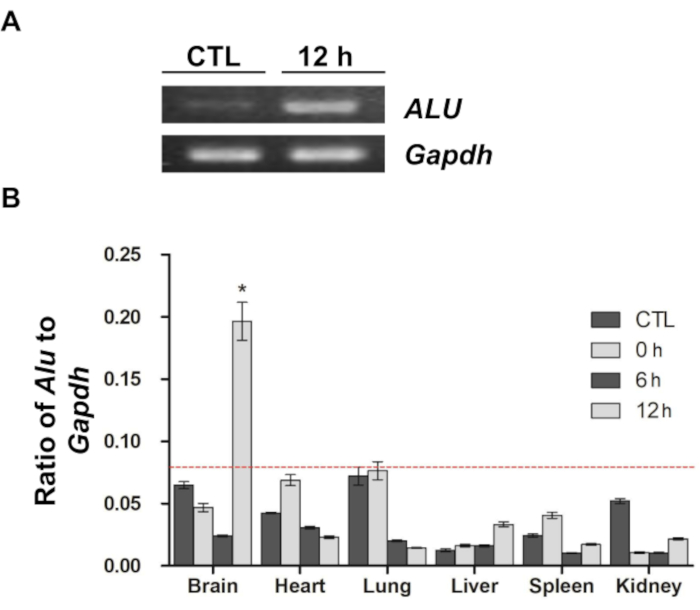
Рисунок 4: Количественная полимеразная цепная реакция в реальном времени для подтверждения распределения и миграции МСК. (A) Амплифицированные продукты ПЦР геномной ДНК мозга, выделенные из контрольной и 12-часовой групп, визуализировали на агарозном геле. ALU является специфичным для человека праймером, а для нормализации использовался мышиный праймер Gapdh . Продукты амплифицированной ПЦР отображаются в виде интенсивных белых полос. (B) Был проведен анализ количественной ПЦР и рассчитано соотношение ALU к Gapdh в каждом образце. Красной пунктирной линией обозначен предел обнаружения при ПЦР-анализе в реальном времени. Данные представлены в виде среднего ± стандартной погрешности среднего (SEM). *p < 0.05. Эта цифра была изменена по сравнению с Kim et al.12. Сокращения: ALU = Arthrobacter luteus; ПЦР = полимеразная цепная реакция; кПЦР = количественная ПЦР в реальном времени; МСК = мезенхимальные стволовые клетки; Gapdh = глицеральдегид-3-фосфатдегидрогеназа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты настоящего исследования показывают, что МСК, доставленные через интраспинальную полость, были распределены в поясничной области во все моменты времени и мигрировали в мозг через 12 ч после инъекции.
Обсуждение
Оптимальный путь введения для лечения МСК следует выбирать в зависимости от целевого заболевания, состояния пациента и типа доставляемого препарата. При клеточной терапии, включая терапию МСК, необходимо рассмотреть возможность прямого введения стволовых клеток в мозг или интратекально через СМЖ, поскольку клетки не могут пройти через ГЭБ19. Инъекция в спинномозговую полость является относительно неинвазивной и не вызывает повреждения нейронов в головном мозге, в отличие от внутримозговых инъекций, и связана с низким риском развитияпобочных эффектов. Доступ к спинномозговой жидкости с помощью люмбальной пункции — это процедура, которая может быть очень легко выполнена в клинических условиях. Таким образом, введение стволовых клеток, лекарств, контрастных веществ или других веществ пациентам с помощью инъекций в спинномозговую полость 23,24,25 не составляет труда. Напротив, внутримозговые инъекции, требующие хирургического вмешательства, являются более сложными. Однако для подопытных животных инъекция во внутриспинальную полость сложнее, чем введение агентов непосредственно в мозг. Это связано с тем, что грызуны, в том числе мыши и крысы, очень малы по сравнению с человеком26.
В случае введения в интраспинальную полость игла должна быть введена между остистыми отростками. По сравнению с промежутками у людей, промежутки между костями у крысы очень узкие, что затрудняет доступ. Чтобы преодолеть это, следует использовать самую маленькую иглу, в идеале иглу 23 G. Хотя можно использовать иглу 26 G, такая тонкая игла может легко гнуться. Размер иглы можно регулировать исходя из возраста подопытного животного. Кроме того, чтобы облегчить введение внутриспинной полости на модели крысы, необходимо сгибать позвоночник, расширяя зазор между остистыми отростками, облегчая доступ иглы к пространству между остистыми отростками. Место инъекции и направление иглы также могут быть скорректированы по мере необходимости. Промежутки между шейными остистыми отростками относительно шире, чем между поясничными остистыми отростками. Однако, если инъекция выполняется вблизи шейного или грудного отделов спинного мозга, неправильное размещение иглы может привести к серьезному повреждению спинного мозга, включая паралич нижних конечностей подопытного животного или пациента.
Поэтому при выборе верхнего отдела спинного мозга необходимо соблюдать осторожность, чтобы не допустить повреждения спинного мозга и нервов. У человека спинной мозг заканчивается в точке L1-2, где начинается конский хвост. Конский хвост представляет собой пучок поясничных и крестцовых нервов; Таким образом, поясничный отдел позвоночника является относительно более безопасным местом для инъекций, чем шейный или грудной отдел позвоночника. Таким образом, только поясничный отдел позвоночника, особенно область под L2, где начинается конский хвост, рекомендуется для инъекции в спинномозговую полость. Исходя из этого соображения, для настоящего исследования был выбран поясничный отдел позвоночника под L2, чтобы свести к минимуму повреждение спинномозговых нервов. Для отслеживания стволовых клеток, доставленных в спинной и головной мозг, был использован реагент DiD для маркировки WJ-МСК, которые были видны под флуоресцентным микроскопом и в экспериментах по оптической визуализации in vitro и ex vivo (рис. 1 и рис. 3). Немеченые WJ-MSC не показали положительной флуоресценции DiD in vivo в контрольной группе (без инъекции). Эти результаты указывают на то, что липофильный краситель DiD может быть использован в качестве отслеживающего агента для терапии стволовыми клетками. В настоящее время разработано множество различных агентов для отслеживания трансплантированных стволовых клеток 27,28,29. Эти отслеживающие реагенты могут быть скорректированы в зависимости от оборудования, используемого для оценки, такого как магнитно-резонансная томография, компьютерная томография и оптическая визуализация. В предыдущем исследовании сообщалось об использовании наночастиц железа для отслеживания МСК, доставляемых через внутримозговую инъекцию в мозг 9,29. Таким образом, различные металлические наночастицы и липофильные агенты, такие как DiD, могут быть использованы для отслеживания стволовых клеток in vivo и ex vivo.
Для оценки миграции и распределения WJ-МСК, доставляемых через интраспинальную полость, был проведен анализ количественной ПЦР с использованием праймера АЛУ. Основной целью настоящего исследования являлась оптимизация метода введения интраспинальной полости и оценка его эффективности. Поэтому были выбраны методы анализа для отслеживания и количественной оценки общего распределения и миграции WJ-MSC по всему головному и спинному мозгу в различные моменты времени. По этой причине оптическая визуализация проводилась с все еще соединенными головным и спинным мозгом. Весь головной или спинной мозг (шейный, грудной и поясничный) был измельчен, и точное количество WJ-MSCs в этих тканях было рассчитано с помощью анализа количественной ПЦР с праймером ALU . Сообщалось, что специфичный для человека праймер ALU обладает высокой чувствительностью и специфичностью для обнаружения клеток человеческого происхождения среди клетокгрызунов21. Кроме того, Министерство безопасности пищевых продуктов и медикаментов Кореи рекомендует использовать праймеры ALU человека для оценки биораспределения стволовых клеток в рамках доклинических данных, собранных для исследования нового препарата. Чтобы определить точное местоположение WJ-МСК, мигрирующих в сторону головного и спинного мозга в разные моменты времени, следует провести иммуногистохимическое окрашивание (ИГХ). Однако ИГХ здесь не проводилась, что является ограничением данного исследования.
Временные точки эвтаназии также должны быть выбраны соответствующим образом. Скорость миграции стволовых клеток в мозг и характер их распределения по всей нейроксии зависят от доставляемых веществ и состояния подопытных животных или пациентов. Важно определить физиологические и химические характеристики вводимых материалов. Различные факторы, такие как размер, масса, липофильность и период полувыведения, могут влиять на время, необходимое для миграции в мозг и рассеивания по всей центральной нервной системе (ЦНС). Следовательно, необходимо установить подходящий момент времени эвтаназии в соответствии со свойствами вводимого вещества. Более того, немаловажно и физическое состояние испытуемого. Как у пациентов, так и у больных животных моделей существует множество веществ, таких как воспалительные цитокины и эпитопы-мишени, которые могут привлекать терапевтические агенты (стволовые клетки, иммунные клетки и антитела) к местам поражения. Таким образом, WJ-MSC потребуется меньше времени, чтобы достичь мозга, если используется модель заболевания ЦНС. В настоящем исследовании с использованием модели дикого типа крысы были выбраны три различные временные точки (0, 6 и 12 часов). Экспериментальные животные в группе 0 ч были усыплены сразу после введения стволовых клеток, при этом WJ-МСК были обнаружены только в поясничном отделе спинного мозга вокруг места инъекции. Напротив, WJ-MSCs наблюдались в головном и шейном отделах спинного мозга крыс в группе 12 часов, что указывает на то, что WJ-MSC потребовалось минимум 12 часов, чтобы мигрировать в головной и шейный мозг в модели дикого типа крыс. Теоретически дополнительные WJ-MSC могут мигрировать в мозг с течением времени, но это не было оценено или доказано в настоящем исследовании.
Введение МСК в спинномозговую полость имеет недостаток в виде низкой эффективности доставки в мозг по сравнению с внутримозговым или внутрипаренхиматозным введением12. Первая причина этого заключается в расстоянии от места введения до мозга, а вторая причина относится к потоку спинномозговой жидкости. Поскольку ликвор вырабатывается в сосудистом сплетении, расположенном в латеральном желудочке головного мозга, ликвор течет из бокового желудочка в спинной мозг30. Поэтому в этом исследовании крыс помещали в перевернутое положение под углом 45° на 15 минут, чтобы способствовать миграции МСК в мозг. Больший угол или более длительное время ожидания может способствовать увеличению миграции МСК в мозг. Кроме того, объем, скорость и дозировка инъекции могут быть изменены для достижения более эффективной доставки в головной и спинной мозг. В настоящем исследовании представлен процесс, с помощью которого WJ-MSCs могут быть введены через интраспинальную полость в L2-3, а также оценены модели миграции и распределения стволовых клеток через 0, 6 и 12 ч после инъекции в модели крысы. Несмотря на то, что в настоящем исследовании в мозг крысы попало лишь небольшое количество WJ-МСК, доставленных через интраспинальную полость, это число может быть увеличено путем корректировки нескольких переменных. Доклинические данные, представленные в настоящем исследовании, можно рассматривать в качестве научной основы для клинического применения внутриспинального введения препаратов для терапии стволовыми клетками, иммунотерапии и других лечебных веществ.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано грантами Программы фундаментальных исследований Национального исследовательского фонда Южной Кореи (NRF), финансируемой Министерством образования (NRF-2017R1D1A1B03035940), и грантом Корейского проекта исследований и разработок в области технологий здравоохранения через Корейский институт развития индустрии здравоохранения (KHIDI), финансируемого Министерством здравоохранения и социального обеспечения Республики Корея (номера грантов: HI14C3484 и HI18C0560). Мы хотели бы поблагодарить Editage (www.editage.co.kr) за редактирование на английском языке.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco-invitrogen | 25200114 | Cell culture |
| Fetal bovine serum | biowest | S1520 | Culture medium supplement |
| gentamicin | Gibco-invitrogen | 15710-072 | Culture medium supplement |
| Gentra Puregene Tissue Kit | QIAGEN | 158689 | gDNA isolation |
| MEM, no glutamine, no phenol red | Gibco | 51200038 | WJ-MSC fomulation for injection |
| Miminum Essential Medium alpha | Gibco-invitrogen | 12571063 | WJ-MSC culture medium |
| Power SYBR Green PCR Master Mix | Applied Biosystems | 4368577 | quantitative real time PCR reagent |
| QuantStudio 6 Flex Real-Time PCR System | Thermo fisher | 4485694 | quantitative real time PCR |
| trypan blue | Gibco | 15250061 | Injection |
| Vybrant DiD Cell-Labeling Solution | invitrogen | V22887 | Stem cell labeling solution |
| Xenogen IVIS Spectrum system | Perkin Elmer | 124262 | Optical imaging device |
Ссылки
- Gnecchi, M., Danieli, P., Malpasso, G., Ciuffreda, M. C. Paracrine mechanisms of mesenchymal stem cells in tissue repair. Methods in Molecular Biology. 1416, 123-146 (2016).
- Liang, X., Ding, Y., Zhang, Y., Tse, H. F., Lian, Q. Paracrine mechanisms of mesenchymal stem cell-based therapy: current status and perspectives. Cell Transplantation. 23 (9), 1045-1059 (2014).
- Kang, J. M., Yeon, B. K., Cho, S. J., Suh, Y. H. Stem cell therapy for Alzheimer's disease: a review of recent clinical trials. Journal of Alzheimer's Disease. 54 (3), 879-889 (2016).
- Staff, N. P., Jones, D. T., Singer, W. Mesenchymal stromal cell therapies for neurodegenerative diseases. Mayo Clinic Proceedings. 94 (5), 892-905 (2019).
- Kim, J., et al. Mesenchymal stem cell therapy and Alzheimer's disease: current status and future perspectives. Journal of Alzheimer's Disease. 77 (1), 1-14 (2020).
- Florea, V., Bagno, L., Rieger, A. C., Hare, J. M. Attenuation of frailty in older adults with mesenchymal stem cells. Mechanisms of Ageing Development. 181, 47-58 (2019).
- Karp, J. M., Leng Teo, G. S. Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell. 4 (3), 206-216 (2009).
- Regmi, S., Pathak, S., Kim, J. O., Yong, C. S., Jeong, J. H. Mesenchymal stem cell therapy for the treatment of inflammatory diseases: Challenges, opportunities, and future perspectives. European Journal of Cell Biology. 98 (5-8), 151041(2019).
- Kim, H. S., et al. Lowering the concentration affects the migration and viability of intracerebroventricular-delivered human mesenchymal stem cells. Biochemical and Biophysical Research Communications. 493 (1), 751-757 (2017).
- Kim, D. H., et al. Effect of growth differentiation factor-15 secreted by human umbilical cord blood-derived mesenchymal stem cells on amyloid beta levels in in vitro and in vivo models of Alzheimer's disease. Biochemical and Biophysical Research Communications. 504 (4), 933-940 (2018).
- Park, S. E., et al. Distribution of human umbilical cord blood-derived mesenchymal stem cells (hUCB-MSCs) in canines after intracerebroventricular injection. Neurobiology of Aging. 47, 192-200 (2016).
- Kim, H., et al. Intrathecal injection in a rat model: a potential route to deliver human Wharton's jelly-derived mesenchymal stem cells into the brain. International Journal of Molecular Sciences. 21 (4), 1272(2020).
- Daneman, R., Prat, A. The blood-brain barrier. Cold Spring Harbor Perspectives Biology. 7 (1), 020412(2015).
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Banks, W. A. From blood-brain barrier to blood-brain interface: new opportunities for CNS drug delivery. Nature Reviews Drug Discovery. 15 (4), 275-292 (2016).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opinion on Drug Delivery. 13 (7), 963-975 (2016).
- Elia, C. A., et al. Intracerebral injection of extracellular vesicles from mesenchymal stem cells exerts reduced Aβ plaque burden in early stages of a preclinical model of Alzheimer's disease. Cells. 8 (9), 1059(2019).
- Kim, H. J., et al. Stereotactic brain injection of human umbilical cord blood mesenchymal stem cells in patients with Alzheimer's disease dementia: A phase 1 clinical trial. Alzheimer's & Dementia (N Y). 1 (2), 95-102 (2015).
- Park, S. E., Lee, N. K., Na, D. L., Chang, J. W. Optimal mesenchymal stem cell delivery routes to enhance neurogenesis for the treatment of Alzheimer's disease: optimal MSCs delivery routes for the treatment of AD. Histology & Histopathology. 33 (6), 533-541 (2018).
- Sandow, B. A., Donnal, J. F. Myelography complications and current practice patterns. American Journal of Roentgenology. 185 (3), 768-771 (2005).
- Funakoshi, K., et al. Highly sensitive and specific Alu-based quantification of human cells among rodent cells. Scientific Reports. 7 (1), 13202(2017).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Glass, J. D., et al. Lumbar intraspinal injection of neural stem cells in patients with amyotrophic lateral sclerosis: results of a phase I trial in 12 patients. Stem Cells. 30 (6), 1144-1151 (2012).
- Harris, V. K., et al. Clinical and pathological effects of intrathecal injection of mesenchymal stem cell-derived neural progenitors in an experimental model of multiple sclerosis. Journal of the Neurological Sciences. 313 (1-2), 167-177 (2012).
- Janson, C. G., Ramesh, T. M., During, M. J., Leone, P., Heywood, J. Human intrathecal transplantation of peripheral blood stem cells in amyotrophic lateral sclerosis. Journal of Hematotherapy and Stem Cell Research. 10 (6), 913-915 (2001).
- Chiu, C., et al. Temporal course of cerebrospinal fluid dynamics and amyloid accumulation in the aging rat brain from three to thirty months. Fluids Barriers CNS. 9 (1), 3(2012).
- Bull, E., et al. Stem cell tracking using iron oxide nanoparticles. International Journal of Nanomedicine. 9, 1641-1653 (2014).
- Chen, D., et al. Bright polymer dots tracking stem Cell engraftment and migration to injured mouse liver. Theranostics. 7 (7), 1820-1834 (2017).
- Lee, N. K., et al. Magnetic resonance imaging of ferumoxytol-labeled human mesenchymal stem cells in the mouse brain. Stem Cell Reviews and Reports. 13 (1), 127-138 (2017).
- Bradley, W. G., Haughton, V., Mardal, K. A. Cerebrospinal fluid flow in adults. Handbook Clinical Neurology. 135, 591-601 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены