Method Article
Inyección intraespinal de células madre mesenquimales humanas y seguimiento de su migración al cerebro de rata
En este artículo
Resumen
Se pueden utilizar varias vías de administración para administrar células madre mesenquimales (MSC) al cerebro. En el presente estudio, las MSC se administraron a través del eje neural y el cerebro a través de la inyección en la cavidad espinal. Las MSC se inyectaron en las cavidades espinales de ratas y se rastreó y cuantificó la migración de células madre.
Resumen
Las células madre mesenquimales (MSC) se han estudiado para el tratamiento de diversas enfermedades. En las enfermedades neurodegenerativas que implican defectos tanto en el cerebro como en la médula espinal, la vía de administración es muy importante, ya que las MSC deben migrar tanto al cerebro como a la médula espinal. Este artículo describe un método para administrar MSC en el canal espinal (inyección intraespinal en la cavidad espinal) que puede dirigirse al cerebro y la médula espinal en un modelo de rata. Se inyectaron un millón de MSC en los canales espinales de ratas a nivel de las vértebras lumbares 2-3. Después de la administración, las ratas fueron sacrificadas a las 0, 6 y 12 h después de la inyección. Se utilizaron imágenes ópticas y reacción en cadena de la polimerasa cuantitativa en tiempo real (qPCR) para rastrear las MSC inyectadas. Los resultados del presente estudio demostraron que las MSC administradas a través de la cavidad espinal pudieron detectarse posteriormente tanto en el cerebro como en la médula espinal a las 12 h. La inyección intraraquídea tiene la ventaja de no requerir anestesia general y tiene pocos efectos secundarios. Sin embargo, hay que superar el inconveniente de la baja tasa de migración de las MSC al cerebro.
Introducción
Células madre mesenquimales
En condiciones de enfermedad, las MSC secretan sustancias terapéuticas específicas de la enfermedad a través de acciones paracrinas1 que se ha informado que regulan las respuestas inmunitarias, restauran los tejidos dañados y eliminan las sustancias tóxicas2. Por lo tanto, la terapia MSC se considera más eficaz que la terapia de objetivo único en el tratamiento de enfermedades multifactoriales como la enfermedad de Alzheimer y la sarcopenia 3,4,5,6. Además, a diferencia de los productos farmacéuticos, las MSC tienen un efecto de referencia, moviéndose a la región del tejido dañado mediante el reconocimiento de citocinas inflamatorias o quimiocinas en el cuerpo 7,8. Desafortunadamente, solo un subconjunto de las células llega al área dañada y la viabilidad de las MSC disminuye durante la migración 9,10,11,12. Por lo tanto, para maximizar la eficacia terapéutica de las MSC, es necesario administrar células viables al sitio objetivo. Por lo tanto, al administrar MSC, es importante elegir la vía de administración adecuada, en función de la naturaleza de la enfermedad objetivo.
Vía de inyección
Existen numerosas vías por las que se administran los agentes terapéuticos a los pacientes. Los métodos más comunes son la inyección intravenosa en la circulación sistémica, la administración oral y la inyección subcutánea o intramuscular. En las enfermedades neurodegenerativas, el principal obstáculo para la administración de agentes terapéuticos al cerebro es la barrera hematoencefálica (BHE). La BHE protege el cerebro de patógenos externos por medio de uniones estrechas entre los vasos sanguíneos y el parénquima cerebral13,14. Sin embargo, paradójicamente, la BHE también impide que los agentes terapéuticos entren en el parénquima cerebral. Por lo tanto, el paso por la BHE es el principal obstáculo en el desarrollo de terapias para las enfermedades cerebrales15,16. La inyección intracerebral se realiza para superar este inconveniente mediante la inyección de sustancias diana directamente en el cerebro mediante una operación quirúrgica 17,18,19. Sin embargo, se deben tener en cuenta los efectos secundarios de las intervenciones quirúrgicas, especialmente porque la aguja daña las células neuronales durante el procedimiento.
Administración de la cavidad intraespinal
La administración intratecal, la administración de fármacos en el canal espinal o en el espacio subaracnoideo, lleva los fármacos al cerebro o al eje neural a través del líquido cefalorraquídeo (LCR) y es una alternativa viable a la inyección intracerebral. Las inyecciones intratecales se pueden subdividir según el lugar de la inyección: ventrículo lateral, cisterna magna y cavidad espinal. Las tres rutas permiten que los medicamentos o las células se dispersen por todo el líquido cefalorraquídeo hacia el cerebro y la médula espinal. La administración del fármaco al cerebro puede ser más eficiente en el caso de las inyecciones intracerebroventriculares e intra-cisterna magna porque el agente se inyecta cerca del cerebro. Sin embargo, la inyección intraraquídea tiene las ventajas de no requerir anestesia general ni cirugía para la inserción de un reservorio intraventricular, siendo generalmente segura20, y puede ser realizada repetidamente si es necesario.
El propósito de este estudio fue validar la administración intraespinal de la cavidad como un medio para administrar MSC tanto al cerebro como a la médula espinal. En primer lugar, se estableció la cavidad intraespinal en un modelo de rata. A continuación, las MSC se marcaron con un trazador lipofílico, DiD (DiIC18(5); 1,1-dioctadecil-3,3,3,3-tetrametilindodicarbocianina, sal de 4-clorobencenosulfonato), para evaluar la eficiencia de la migración de células madre a la médula espinal y al cerebro. Se realizaron imágenes ópticas ex vivo para evaluar la dispersión celular. Este sencillo protocolo se puede realizar sin intervención quirúrgica y se puede utilizar con el propósito no solo de administrar células madre, sino también productos farmacéuticos, anticuerpos, medios de contraste y otras sustancias destinadas a ser administradas a la médula espinal o al cerebro.
Protocolo
NOTA: Este estudio fue aprobado por el Comité Institucional de Cuidado y Uso de Animales (Número de aprobación: 20170125001, Fecha: 25 de enero de 2017) del Instituto de Investigación Biomédica de Samsung (SBRI) en el Centro Médico Samsung. Como centro acreditado de la Asociación para la Evaluación y Acreditación de Cuidado de Animales de Laboratorio International, el SBRI actúa de acuerdo con las pautas establecidas por el Instituto de Recursos para Animales de Laboratorio.
1. Preparación de MSCs derivadas de la gelatina humana de Wharton
- Cultivo de células madre mesenquimales derivadas de la gelatina humana de Wharton (WJ-MSCs)
- Descongele rápidamente un vial de WJ-MSC humanas en un baño de agua a 37 °C. Transfiera las WJ-MSC a un tubo cónico de 50 mL y agregue medio de crecimiento a un volumen de al menos 10 veces el de las células (v/v). Pipetear hacia arriba y hacia abajo para suspender las células.
- Centrifugar a 300 × g durante 5 min. Deseche con cuidado el sobrenadante y vuelva a suspender las células.
NOTA: Tenga cuidado de no desechar el pellet de celda. - Siembre WJ-MSCs en matraces T175 a una densidad de 5.000-6.000 células/cm2. Incubar las WJ-MSC en una incubadora de CO2 a 37 °C. Cambie el medio de crecimiento cada 72 h hasta que las WJ-MSC alcancen el 80-90% de confluencia.
NOTA: Por lo general, las MSC tardan entre 3 y 4 días en alcanzar el 80-90% de confluencia.
- Subcultivo de WJ-MSCs humanas
- Deseche el medio de crecimiento y lave las células con 10 ml de solución salina tamponada con fosfato (PBS). Retire el PBS y agregue 5 mL de ácido etilendiaminotetraacético disódico (EDTA) al 0,25% de tripsina (consulte la tabla de materiales). Incubar las células a 37 °C en una incubadora de CO2 durante 3 min hasta que las WJ-MSCs se desprendan del matraz de cultivo.
- Añadir 5 mL de medio de crecimiento que contenga un 10% de suero fetal bovino para neutralizar el 0,25% de tripsina-EDTA. Recoja la mezcla de células y transfiérala a un tubo cónico de 50 ml. Lave el matraz de cultivo celular con 10 mL de medio de crecimiento y recoja las células en un tubo de 50 mL utilizando una pipeta serológica estéril.
- Centrifugar la mezcla de células a 300 × g durante 5 min. Deseche el sobrenadante, vuelva a suspender las células en 10 ml de medio de crecimiento y cuente el número de WJ-MSC.
PRECAUCIÓN: Tenga cuidado de no desechar el pellet de celda. - Siembre WJ-MSCs a una densidad de 4.000-6.000 células/cm2, dependiendo del experimento.
- Marcaje de WJ-MSCs con colorante DiD y preparación de WJ-MSCs para inyección intraespinal
NOTA: El procedimiento de etiquetado de colorante DiD se realizó siguiendo las instrucciones del fabricante.- Desconecte las WJ-MSC cuando alcancen el 80% de confluencia, utilizando el procedimiento mencionado anteriormente. Suspender WJ-MSCs a una densidad de 1 × 106/mL en medio esencial mínimo (MEM) sin rojo fenol α sin suero.
- Agregue 5 μL de solución de etiquetado DiD por 1 mL de suspensión celular; Mezclar suavemente con el pipeteo.
- Incubar durante 15 min a 37 °C; Centrifugar la suspensión celular a 300 × g durante 5 min.
- Retire el sobrenadante y vuelva a suspender las WJ-MSC en α MEM sin rojo fenol a una densidad de 1 × 106/0,2 mL.
2. Inyección intraespinal de WJ-MSCs
- Preparación para la inyección en la cavidad intraespinal
- Anestesiar ratas Sprague-Dawley de 6 semanas de edad con isoflurano al 5%; Luego, mantener la anestesia con isoflurano al 2% durante todo el procedimiento quirúrgico.
NOTA: Optimice las condiciones anestésicas antes de iniciar el experimento. - Afeita el área quirúrgica con una afeitadora eléctrica para animales pequeños.
NOTA: La afeitadora eléctrica se puede reemplazar con una maquinilla de afeitar manual y gel de afeitar. - Desinfectar el área quirúrgica con povidona yodada. Realice una incisión de 3 cm en la piel con una cuchilla quirúrgica. Reseca el resto de la piel y el tejido muscular con una cuchilla quirúrgica y unas tijeras. Revelan las apófisis espinosas en la lumbar 2-3 (L2-3).
- Anestesiar ratas Sprague-Dawley de 6 semanas de edad con isoflurano al 5%; Luego, mantener la anestesia con isoflurano al 2% durante todo el procedimiento quirúrgico.
- Inyección de WJ-MSC marcadas con DiD a través de la cavidad intraespinal
- Coloca a la rata en posición prona. Flexiona la columna vertebral de la rata de manera apropiada para ampliar la distancia entre los procesos espinosos adyacentes, usando cantidades suficientes de papel u otros materiales que puedan ayudar a mantener la posición adecuada.
- Llene una jeringa de 1 mL con 0,2 mL de WJ-MSC marcadas con DiD. Coloque una combinación de jeringa y aguja de 23 G verticalmente entre las apófisis espinosas de L2 y L3, e inserte la aguja hasta que toque el cuerpo vertebral.
- Cuando la aguja toque el cuerpo vertebral, retírela aproximadamente 0,5 cm, colocando la punta de la aguja en el canal espinal. Incline la jeringa y coloque la punta de la aguja de manera que apunte hacia la dirección rostral. Inyecte WJ-MSC en la cavidad espinal durante un período de 1 minuto.
NOTA: La velocidad de inyección debe optimizarse con anticipación. - Después de la inyección, retire completamente la jeringa del canal espinal. Suturar la incisión y luego desinfectar el sitio quirúrgico con povidona yodada.
- Tratamiento posterior al procedimiento
- Estabilice y sujete a la rata para evitar cualquier movimiento, colocándola boca abajo en un ángulo de 45° durante 15 minutos, mientras aún está bajo anestesia. Después de 15 minutos, suspenda la anestesia y espere a que la rata se despierte.
3. Evaluación de la inyección en la cavidad intraespinal
- Eutanasia de las ratas y aislamiento del cerebro y la médula espinal a las 0, 6 y 12 h después de la inyección
- Anestesiar los animales de experimentación con isoflurano al 5%; mantener la anestesia con isoflurano al 2% durante la perfusión de PBS.
- Haga una incisión debajo del diafragma con unas tijeras quirúrgicas. Abra la incisión con fórceps y corte la caja torácica en sentido rostral para exponer el corazón.
- Haga un pequeño orificio en la aurícula derecha e inserte una aguja de mariposa en el ventrículo izquierdo. Perfundir 100 ml de PBS frío en el ventrículo izquierdo durante 4-5 minutos, hasta que el hígado esté limpio de sangre.
- Después de la perfusión, haga una incisión larga en la parte posterior desde la cabeza hasta la cola con una cuchilla quirúrgica a lo largo del plano longitudinal. Aísle el cerebro restante y toda la columna vertebral con tijeras quirúrgicas, fórceps y un cortador de huesos. Retire las costillas restantes, los huesos conectados y la carne.
- Imágenes ópticas fluorescentes DiD ex vivo
- Coloque los tejidos aislados en la cámara del dispositivo de imágenes ópticas.
- Ajuste los parámetros de la siguiente manera: emisión, 700 nm; excitación, 605 nm; y el tiempo de exposición, 2 segundos, como fotones por segundo por centímetro cuadrado por esteradián (p/s/cm2/sr). Captura las imágenes ópticas.
NOTA: Todas las imágenes deben adquirirse con los mismos ajustes de iluminación (voltaje de la lámpara, filtros, f/stop, campo de visión y agrupación). - Dibuja tres regiones rectangulares de interés (ROI) de tamaño equivalente para la médula espinal y un círculo ROI para el cerebro utilizando la herramienta de dibujo. Medir las intensidades fluorescentes de los ROIs.
- Extracción de ADN genómico (ADNg) de la médula espinal y el tejido cerebral
- Retire el cráneo y la columna vertebral con cuidado con pinzas quirúrgicas, tijeras y un rongeur.
- Extraiga el cerebro y la médula espinal del cráneo y la columna vertebral. Corta la médula espinal en tres pedazos (cervical, torácico y lumbar).
NOTA: Los tejidos recolectados deben almacenarse a -80 °C si no se analizan inmediatamente. - Muele los pañuelos con un mortero preenfriado, un mortero y nitrógeno líquido. Extraiga el ADNg utilizando productos comerciales, siguiendo las instrucciones del fabricante.
- Reacción en cadena de la polimerasa (qPCR) cuantitativa en tiempo real
- Cuantifique la cantidad de ADNg en cada muestra utilizando un espectrofotómetro.
- Realizar qPCR utilizando 10 ng de ADNg por muestra y cebadores humanos de Arthrobacter luteus (ALU) 12,21.
- Calcule el número exacto de WJ-MSC en las muestras utilizando el método ΔΔCT 22.
Resultados
Para evaluar la eficacia de la inyección intraespinal de MSCs en la cavidad espinal, en el presente estudio se utilizaron MSCs marcadas con DiD. Antes de inyectar MSCs en la cavidad espinal, se evaluó in vitro la eficacia del marcaje mediante imágenes ópticas y microscopía de fluorescencia (Figura 1). Después de teñir las MSC con el reactivo de marcaje DiD utilizando el procedimiento descrito en la sección 3.1 del protocolo, se tomaron imágenes ópticas de las placas de cultivo en las que se sembraron las MSC marcadas con DiD (Figura 1A). Las MSC marcadas con DiD (+DiD) se muestran en rojo; las MSC naïve (-DiD), que no se marcaron con colorante DiD, no mostraron una señal positiva. Este resultado se confirmó mediante microscopía de fluorescencia (Figura 1B). Las MSC también se tiñeron con 4′,6-diamidino-2-fenilindol (DAPI) para visualizar su forma. Las MSC vírgenes (-DiD) aparecieron de color azul, lo que indica tinción con DAPI o tinción nuclear, pero no mostraron color rojo, que se asocia con la tinción de DiD. Por el contrario, las MSC etiquetadas con DiD (+DiD) mostraron colores azul y rojo, lo que indica que el método de etiquetado de DiD había sido exitoso.

Figura 1: Marcaje DiD de MSCs in vitro. (A) Las MSCs marcadas con DiD se sembraron en una placa de cultivo de 6 pocillos y se realizaron imágenes ópticas. (B) Las imágenes se tomaron mediante microscopía de fluorescencia. Los núcleos de MSC se indican en azul (DAPI), y el DiD incorporado se localiza en el citosol de las células +DiD (rojo). Barras de escala = 500 μm. Esta figura ha sido modificada a partir de Kim et al.12. Abreviaturas: -DiD = MSC ingenuas, +DiD = MSC marcadas con el reactivo DiD; MSC = célula madre mesenquimatosa; DiD = DiIC18(5); 1,1-dioctadecil-3,3,3,3-tetrametilindodicarbocianina, sal de 4-clorobencenosulfonato; DAPI = 4′,6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.
A continuación, se evaluó el método de inyección intraraquídea. Para evaluar y optimizar el procedimiento de inyección en la cavidad intraespinal, se utilizó colorante azul de tripano en lugar de MSC marcadas con DiD, como se describe en la sección 2 del protocolo (Figura 2). Se inyectó un tinte azul de tripano y la rata fue sacrificada de inmediato. El tejido de la médula espinal extraído de la rata se cortó en tres pedazos transversalmente, y el cerebro se cortó en secciones coronales. Se encontró que el tinte azul de tripán inyectado había manchado los tejidos de la médula espinal (cordón lumbar, torácico y cervical). Además, tanto el lado inferior como el superior del cerebro estaban teñidos de azul. Sin embargo, el tinte azul tripano no penetró en el ventrículo lateral del cerebro. Estos resultados indicaron que este método de inyección intraraquídea fue exitoso.

Figura 2: Confirmación de la inyección de la cavidad intraespinal en un modelo de rata. El tinte azul tripano se inyectó en la cavidad espinal de una rata de prueba. Después de la inyección, la rata fue sacrificada y se realizó una necropsia. El tinte azul tripano inyectado a través del canal raquídeo migró y tiñó tanto la médula espinal (lumbar, torácica y cervical) como el azul cerebral. Barras de escala = 1 cm. Esta figura ha sido modificada a partir de Kim et al.12. Haga clic aquí para ver una versión más grande de esta figura.
Utilizando el protocolo optimizado con éxito como se describió anteriormente, se inyectaron MSC marcadas con DiD a través de la cavidad intraespinal en ratas (Figura 3). Las ratas fueron sacrificadas 0, 6 y 12 h después de la inyección, y se realizaron imágenes ópticas ex vivo (Figura 3A). En comparación con las señales en los animales de control (sin inyección), se detectaron señales positivas altas y condensadas en la médula espinal lumbar de ratas sacrificadas inmediatamente después de la inyección (0 h). A las 6 h después de la inyección, la señal positiva se dispersó por toda la médula espinal lumbar. Por último, se observaron señales positivas elevadas en las regiones de la médula lumbar y cervical e incluso en el cerebro a las 12 h después de la inyección. La intensidad de la señal de las imágenes ópticas se cuantificó en cada punto de tiempo utilizando un software de análisis de imágenes (Figura 3B). Se identificó un aumento significativo en la intensidad de la señal en la médula espinal lumbar a las 0 h después de la inyección y en el cerebro a las 12 h después de la inyección.

Figura 3: Análisis de imágenes ópticas para evaluar la eficacia de la inyección intraespinal en la cavidad espinal. (A) Después de inyectar las MSC en la cavidad espinal, las ratas fueron sacrificadas en los siguientes puntos de tiempo: 0, 6 y 12 h después de la inyección, después de lo cual se realizaron imágenes ópticas ex vivo. La señal positiva se muestra en color amarillo-rojo. (B) A partir de las imágenes, las intensidades de la señal se cuantificaron utilizando software. Se trazaron regiones de interés equivalentes para cada grupo experimental. Los datos se presentan como la media ± el error estándar de la media (SEM). *p < 0,05. Esta figura ha sido modificada a partir de Kim et al.12. Abreviaturas: MSCs= células madre mesenquimales; CTL = control. Haga clic aquí para ver una versión más grande de esta figura.
Un estudio previo informó que la secuencia de ALU humana puede ser utilizada como un marcador cuantitativo para medir el número de células de origen humano, como las células madre neurales y las MSCs, en el contexto del trasplante de xenoinjertos 9,11,12. Siguiendo las directrices del estudio anterior, en el presente estudio se utilizó el análisis de qPCR utilizando un cebador ALU específico para humanos para evaluar la distribución y migración in vivo de las MSC marcadas con DiD (Figura 4). Después de la amplificación de la secuencia ALU, el producto de PCR se separó en un gel de agarosa y se visualizó (Figura 4A). En comparación con la muestra de control (el ADNg extraído de los cerebros de las ratas en el grupo sin inyección), la secuencia de ALU se amplificó mucho en la muestra de 12 h (ADNg extraído de los cerebros de las ratas a las 12 horas después de la inyección). Sin embargo, en ambas muestras, el Gapdh de ratón estaba altamente amplificado, lo que indica que las células de origen humano, especialmente las MSC humanas utilizadas en este estudio, estaban presentes solo en la muestra del grupo de 12 horas. A continuación, se confirmó la distribución de las MSC en el cerebro y otros órganos (corazón, pulmón, hígado, bazo y riñón) utilizando el mismo método (Figura 4B). De manera similar a los resultados de las imágenes ópticas, solo se detectó un número significativo de MSC en el cerebro a las 12 horas posteriores a la inyección. Las otras muestras mostraron variación en la relación entre ALU y Gapdh, pero todas las señales de las muestras, excepto el cerebro a las 12 h después de la inyección, estaban todas por debajo del límite de detección, lo que implica que no se produjo una amplificación significativa.
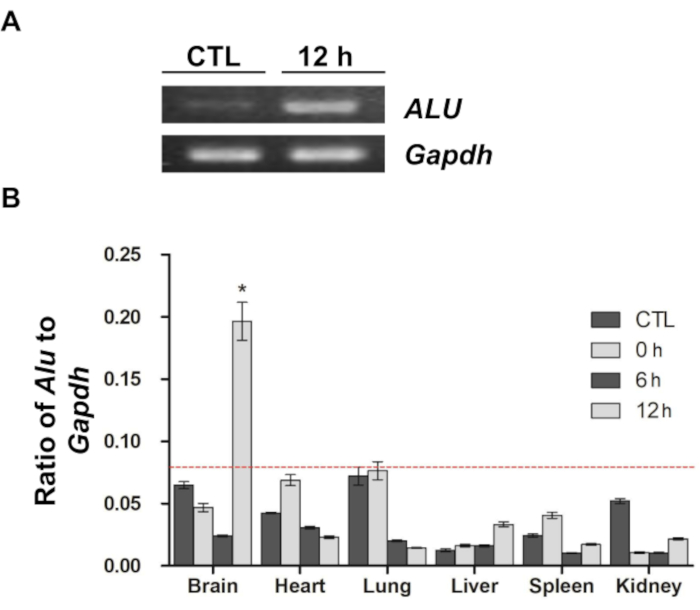
Figura 4: Reacción cuantitativa en cadena de la polimerasa en tiempo real para confirmar la distribución y migración de MSCs. (A) Los productos de PCR amplificados del ADN genómico cerebral extraído de los grupos de control y de 12 h se visualizaron en un gel de agarosa. ALU es un cebador específico para humanos, y se utilizó un cebador Gapdh de ratón para la normalización. Los productos de PCR amplificados se muestran como bandas blancas intensas. (B) se realizó un análisis de qPCR y se calculó la relación entre ALU y Gapdh en cada muestra. La línea discontinua roja indica el límite de detección en el análisis de PCR en tiempo real. Los datos se presentan como la media ± el error estándar de la media (SEM). *p < 0,05. Esta figura ha sido modificada a partir de Kim et al.12. Abreviaturas: ALU = Arthrobacter luteus; PCR = reacción en cadena de la polimerasa; qPCR = PCR cuantitativa en tiempo real; MSCs = células madre mesenquimales; Gapdh = gliceraldehído 3-fosfato deshidrogenasa. Haga clic aquí para ver una versión más grande de esta figura.
Los resultados del presente estudio demuestran que las MSC administradas a través de la inyección intraespinal se distribuyeron en la región lumbar en todos los puntos temporales y migraron al cerebro a las 12 horas posteriores a la inyección.
Discusión
La vía de administración óptima para el tratamiento de las MSC debe elegirse en función de la enfermedad objetivo, el estado del paciente y el tipo de fármaco que se va a administrar. En las terapias celulares, incluida la terapia MSC, se debe considerar la inyección directa de células madre en el cerebro o por vía intratecal a través del LCR, ya que las células no pueden pasar a través de la BBB19. La inyección intraespinal en la cavidad espinal es relativamente no invasiva y no causa daño neuronal en el cerebro, a diferencia de las inyecciones intracerebroventriculares, y se asocia con un bajo riesgo de efectos secundarios20. El acceso al líquido cefalorraquídeo a través de una punción lumbar es un procedimiento que se puede realizar muy fácilmente en los centros clínicos. Por lo tanto, no es difícil administrar células madre, fármacos, agentes de contraste u otras sustancias a los pacientes a través de inyecciones intraraquídeasen la cavidad espinal 23,24,25. Por el contrario, las inyecciones intracerebroventriculares, que requieren intervención quirúrgica, son más complicadas. Sin embargo, para los animales de experimentación, la inyección en la cavidad intraespinal es más difícil que la administración de agentes directamente en el cerebro. Esto se debe a que los roedores, incluidos ratones y ratas, son muy pequeños en comparación con los humanos26.
En el caso de la administración de la cavidad intraespinal, la aguja debe insertarse entre las apófisis espinosas. En comparación con los espacios en los humanos, los espacios entre los huesos de una rata son muy estrechos, lo que dificulta el acceso. Para superar esto, se debe utilizar la aguja más pequeña, idealmente una aguja de 23 G. Aunque se puede usar una aguja de 26 G, una aguja tan delgada puede doblarse fácilmente. El tamaño de la aguja se puede ajustar en función de la edad del animal de experimentación. Además, para facilitar la administración de la cavidad intraespinal en un modelo de rata, es necesario flexionar el lomo, ampliando el espacio entre las apófisis espinosas, lo que facilita que la aguja acceda al espacio entre las apófisis espinosas. El lugar de inyección y la dirección de la aguja también se pueden ajustar según sea necesario. Los espacios entre las apófisis espinosas cervicales son relativamente más anchos que los que existen entre las apófisis espinosas lumbares. Sin embargo, si la inyección se realiza cerca de las porciones cervical o torácica de la médula espinal, la colocación incorrecta de la aguja puede causar daños graves en la médula espinal, incluida la parálisis de las extremidades inferiores del animal o paciente de experimentación.
Por lo tanto, al seleccionar una región superior de la médula espinal, se debe tener cuidado para evitar daños en la médula espinal y los nervios. En los seres humanos, la médula espinal termina en L1-2, donde comienza la cola de caballo. La cola de caballo es un haz de nervios lumbares y sacros; Por lo tanto, la columna lumbar es un lugar relativamente más seguro para la inyección que la columna cervical o torácica. Por lo tanto, solo la columna lumbar, particularmente la región debajo de L2 donde comienza la cola de caballo, se recomienda para la inyección dentro de la cavidad espinal. Con base en esta consideración, se seleccionó la columna lumbar bajo L2 para el presente estudio para minimizar el daño al nervio espinal. Para rastrear las células madre entregadas a la médula espinal y al cerebro, se utilizó un reactivo DiD para marcar las WJ-MSC, que fueron visibles bajo un microscopio de fluorescencia y en experimentos de imágenes ópticas in vitro y ex vivo (Figura 1 y Figura 3). Las WJ-MSC no marcadas no mostraron ninguna fluorescencia DiD positiva in vivo en el grupo de control (sin inyección). Estos resultados indican que el colorante lipofílico DiD se puede utilizar como agente de seguimiento para la terapia con células madre. En la actualidad, se han desarrollado muchos agentes diferentes para rastrear las células madre trasplantadas 27,28,29. Estos reactivos de seguimiento se pueden ajustar en función del equipo utilizado para la evaluación, como imágenes por resonancia magnética, tomografía computarizada e imágenes ópticas. Un estudio previo reportó el uso de nanopartículas de hierro para rastrear las MSC administradas a través de la inyección intracerebroventricular en el cerebro 9,29. Por lo tanto, varias nanopartículas metálicas y agentes lipofílicos, como DiD, se pueden utilizar para el seguimiento de células madre in vivo y ex vivo.
Para evaluar la migración y distribución de las WJ-MSC administradas a través de la inyección intraespinal en la cavidad espinal, se realizó un análisis de qPCR con un cebador ALU . El objetivo principal del presente estudio fue optimizar el método de administración de la cavidad intraespinal y evaluar su eficacia. Por lo tanto, se seleccionaron métodos de análisis para rastrear y cuantificar la distribución general y la migración de WJ-MSC a través del cerebro y la médula espinal en varios puntos temporales. Por esta razón, se realizaron imágenes ópticas con el cerebro y la médula espinal aún conectados. Se trituró todo el cerebro o la médula espinal (cervical, torácica y lumbar) y se calculó el número exacto de WJ-MSC en esos tejidos mediante un análisis de qPCR con un cebador ALU . Se ha informado que el cebador específico para humanos ALU tiene una alta sensibilidad y especificidad para detectar células de origen humano entre células de roedores21. Además, el Ministerio de Seguridad de Alimentos y Medicamentos de Corea recomienda el uso de cebadores de ALU humanos para evaluar la biodistribución de las células madre como parte de los datos preclínicos recopilados para la aprobación de nuevos medicamentos en investigación. Para identificar la ubicación exacta de las WJ-MSC que migran hacia el cerebro y la médula espinal en diferentes puntos temporales, se debe realizar una tinción inmunohistoquímica (IHQ). Sin embargo, aquí no se realizó IHQ, lo cual es una limitación de este estudio.
Los puntos de tiempo de la eutanasia también deben seleccionarse adecuadamente. La velocidad de migración de las células madre hacia el cerebro y el patrón de distribución a través del eje neural dependen de las sustancias administradas y del estado de los animales de experimentación o pacientes. Es importante determinar las características fisiológicas y químicas de los materiales inyectados. Varios factores, como el tamaño, la masa, la lipofilia y la vida media, pueden afectar el tiempo necesario para migrar al cerebro y dispersarse por todo el sistema nervioso central (SNC). Por lo tanto, se debe establecer un punto de tiempo de eutanasia apropiado de acuerdo con las propiedades de la sustancia que se administra. Además, el estado físico del sujeto de prueba también es importante. Tanto en los pacientes como en los modelos animales enfermos, hay muchas sustancias, como las citocinas inflamatorias y los epítopos diana, que pueden atraer agentes terapéuticos (células madre, células inmunitarias y fármacos anticuerpos) hacia los sitios de las lesiones. Por lo tanto, tomará menos tiempo para que las WJ-MSC lleguen al cerebro si se utiliza un modelo de enfermedad del SNC. En el presente estudio, utilizando un modelo de rata de tipo salvaje, se seleccionaron tres puntos temporales diferentes (0, 6 y 12 h). Los animales experimentales en el grupo de 0 h fueron sacrificados inmediatamente después de la inyección de células madre, y las WJ-MSC se detectaron solo en la médula espinal lumbar alrededor del lugar de la inyección. Por el contrario, se observaron WJ-MSC en el cerebro y la médula espinal cervical de las ratas en el grupo de 12 horas, lo que indica que las WJ-MSC tardaron un mínimo de 12 horas en migrar al cerebro y la médula cervical en un modelo de rata de tipo salvaje. Teóricamente, las WJ-MSC adicionales pueden migrar al cerebro a medida que pasa el tiempo, pero esto no se evaluó ni demostró en el presente estudio.
La administración intraespinal de MSCs en la cavidad espinal tiene la desventaja de la baja eficiencia de la entrega al cerebro en comparación con la administración intracerebroventricular o intraparenquimatosa12. La primera razón para esto es la distancia desde el sitio de administración hasta el cerebro, y la segunda razón se relaciona con el flujo de LCR. Como el líquido cefalorraquídeo se produce en el plexo coroideo ubicado en el ventrículo lateral del cerebro, el líquido cefalorraquídeo fluye desde el ventrículo lateral hasta la médula espinal30. Por lo tanto, en este estudio, las ratas se colocaron en una posición invertida en un ángulo de 45° durante 15 minutos para ayudar a la migración de las MSC al cerebro. Un ángulo mayor o un tiempo de espera más largo pueden promover una mayor migración de las MSC al cerebro. Además, el volumen, la velocidad y la dosis de la inyección se pueden modificar para lograr una entrega más eficiente al cerebro y la médula espinal. El presente estudio presenta un proceso por el cual las WJ-MSC pueden administrarse a través de la cavidad intraespinal en L2-3 y evaluó los patrones de migración y distribución de las células madre a las 0, 6 y 12 h después de la inyección en un modelo de rata. Aunque en el presente estudio solo se trasladó al cerebro de rata un pequeño número de WJ-MSC administradas a través de la cavidad intraespinal, este número puede aumentarse ajustando varias variables. Los datos preclínicos proporcionados en el presente estudio pueden considerarse como base científica para el uso clínico de la inyección intraraquídea de terapia con células madre, inmunoterapia y otras sustancias curativas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este estudio fue apoyado por subvenciones del Programa de Investigación Básica a través de la Fundación Nacional de Investigación de Corea del Sur (NRF), financiado por el Ministerio de Educación (NRF-2017R1D1A1B03035940), y una subvención del Proyecto de Investigación y Desarrollo de Tecnología Sanitaria de Corea a través del Instituto de Desarrollo de la Industria de la Salud de Corea (KHIDI), financiado por el Ministerio de Salud y Bienestar de la República de Corea (números de subvención: HI14C3484 y HI18C0560). Nos gustaría agradecer a Editage (www.editage.co.kr) por la edición en inglés.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco-invitrogen | 25200114 | Cell culture |
| Fetal bovine serum | biowest | S1520 | Culture medium supplement |
| gentamicin | Gibco-invitrogen | 15710-072 | Culture medium supplement |
| Gentra Puregene Tissue Kit | QIAGEN | 158689 | gDNA isolation |
| MEM, no glutamine, no phenol red | Gibco | 51200038 | WJ-MSC fomulation for injection |
| Miminum Essential Medium alpha | Gibco-invitrogen | 12571063 | WJ-MSC culture medium |
| Power SYBR Green PCR Master Mix | Applied Biosystems | 4368577 | quantitative real time PCR reagent |
| QuantStudio 6 Flex Real-Time PCR System | Thermo fisher | 4485694 | quantitative real time PCR |
| trypan blue | Gibco | 15250061 | Injection |
| Vybrant DiD Cell-Labeling Solution | invitrogen | V22887 | Stem cell labeling solution |
| Xenogen IVIS Spectrum system | Perkin Elmer | 124262 | Optical imaging device |
Referencias
- Gnecchi, M., Danieli, P., Malpasso, G., Ciuffreda, M. C. Paracrine mechanisms of mesenchymal stem cells in tissue repair. Methods in Molecular Biology. 1416, 123-146 (2016).
- Liang, X., Ding, Y., Zhang, Y., Tse, H. F., Lian, Q. Paracrine mechanisms of mesenchymal stem cell-based therapy: current status and perspectives. Cell Transplantation. 23 (9), 1045-1059 (2014).
- Kang, J. M., Yeon, B. K., Cho, S. J., Suh, Y. H. Stem cell therapy for Alzheimer's disease: a review of recent clinical trials. Journal of Alzheimer's Disease. 54 (3), 879-889 (2016).
- Staff, N. P., Jones, D. T., Singer, W. Mesenchymal stromal cell therapies for neurodegenerative diseases. Mayo Clinic Proceedings. 94 (5), 892-905 (2019).
- Kim, J., et al. Mesenchymal stem cell therapy and Alzheimer's disease: current status and future perspectives. Journal of Alzheimer's Disease. 77 (1), 1-14 (2020).
- Florea, V., Bagno, L., Rieger, A. C., Hare, J. M. Attenuation of frailty in older adults with mesenchymal stem cells. Mechanisms of Ageing Development. 181, 47-58 (2019).
- Karp, J. M., Leng Teo, G. S. Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell. 4 (3), 206-216 (2009).
- Regmi, S., Pathak, S., Kim, J. O., Yong, C. S., Jeong, J. H. Mesenchymal stem cell therapy for the treatment of inflammatory diseases: Challenges, opportunities, and future perspectives. European Journal of Cell Biology. 98 (5-8), 151041 (2019).
- Kim, H. S., et al. Lowering the concentration affects the migration and viability of intracerebroventricular-delivered human mesenchymal stem cells. Biochemical and Biophysical Research Communications. 493 (1), 751-757 (2017).
- Kim, D. H., et al. Effect of growth differentiation factor-15 secreted by human umbilical cord blood-derived mesenchymal stem cells on amyloid beta levels in in vitro and in vivo models of Alzheimer's disease. Biochemical and Biophysical Research Communications. 504 (4), 933-940 (2018).
- Park, S. E., et al. Distribution of human umbilical cord blood-derived mesenchymal stem cells (hUCB-MSCs) in canines after intracerebroventricular injection. Neurobiology of Aging. 47, 192-200 (2016).
- Kim, H., et al. Intrathecal injection in a rat model: a potential route to deliver human Wharton's jelly-derived mesenchymal stem cells into the brain. International Journal of Molecular Sciences. 21 (4), 1272 (2020).
- Daneman, R., Prat, A. The blood-brain barrier. Cold Spring Harbor Perspectives Biology. 7 (1), 020412 (2015).
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Banks, W. A. From blood-brain barrier to blood-brain interface: new opportunities for CNS drug delivery. Nature Reviews Drug Discovery. 15 (4), 275-292 (2016).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opinion on Drug Delivery. 13 (7), 963-975 (2016).
- Elia, C. A., et al. Intracerebral injection of extracellular vesicles from mesenchymal stem cells exerts reduced Aβ plaque burden in early stages of a preclinical model of Alzheimer's disease. Cells. 8 (9), 1059 (2019).
- Kim, H. J., et al. Stereotactic brain injection of human umbilical cord blood mesenchymal stem cells in patients with Alzheimer's disease dementia: A phase 1 clinical trial. Alzheimer's & Dementia (N Y). 1 (2), 95-102 (2015).
- Park, S. E., Lee, N. K., Na, D. L., Chang, J. W. Optimal mesenchymal stem cell delivery routes to enhance neurogenesis for the treatment of Alzheimer's disease: optimal MSCs delivery routes for the treatment of AD. Histology & Histopathology. 33 (6), 533-541 (2018).
- Sandow, B. A., Donnal, J. F. Myelography complications and current practice patterns. American Journal of Roentgenology. 185 (3), 768-771 (2005).
- Funakoshi, K., et al. Highly sensitive and specific Alu-based quantification of human cells among rodent cells. Scientific Reports. 7 (1), 13202 (2017).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Glass, J. D., et al. Lumbar intraspinal injection of neural stem cells in patients with amyotrophic lateral sclerosis: results of a phase I trial in 12 patients. Stem Cells. 30 (6), 1144-1151 (2012).
- Harris, V. K., et al. Clinical and pathological effects of intrathecal injection of mesenchymal stem cell-derived neural progenitors in an experimental model of multiple sclerosis. Journal of the Neurological Sciences. 313 (1-2), 167-177 (2012).
- Janson, C. G., Ramesh, T. M., During, M. J., Leone, P., Heywood, J. Human intrathecal transplantation of peripheral blood stem cells in amyotrophic lateral sclerosis. Journal of Hematotherapy and Stem Cell Research. 10 (6), 913-915 (2001).
- Chiu, C., et al. Temporal course of cerebrospinal fluid dynamics and amyloid accumulation in the aging rat brain from three to thirty months. Fluids Barriers CNS. 9 (1), 3 (2012).
- Bull, E., et al. Stem cell tracking using iron oxide nanoparticles. International Journal of Nanomedicine. 9, 1641-1653 (2014).
- Chen, D., et al. Bright polymer dots tracking stem Cell engraftment and migration to injured mouse liver. Theranostics. 7 (7), 1820-1834 (2017).
- Lee, N. K., et al. Magnetic resonance imaging of ferumoxytol-labeled human mesenchymal stem cells in the mouse brain. Stem Cell Reviews and Reports. 13 (1), 127-138 (2017).
- Bradley, W. G., Haughton, V., Mardal, K. A. Cerebrospinal fluid flow in adults. Handbook Clinical Neurology. 135, 591-601 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados