Method Article
حقن الخلايا الجذعية الوسيطة البشرية في التجويف الشوكي وتتبع هجرتها إلى دماغ الفئران
In This Article
Summary
يمكن استخدام عدة طرق للإعطاء لتوصيل الخلايا الجذعية الوسيطة (MSCs) إلى الدماغ. في هذه الدراسة ، تم تسليم الخلايا الجذعية الجذعية في جميع أنحاء المحور العصبي والدماغ عن طريق الحقن داخل التجويف الشوكي. تم حقن الخلايا الجذعية الجذعية في تجاويف العمود الفقري للفئران ، وتم تتبع هجرة الخلايا الجذعية وقياسها كميا.
Abstract
تمت دراسة الخلايا الجذعية الوسيطة (MSCs) لعلاج الأمراض المختلفة. في الأمراض التنكسية العصبية التي تنطوي على عيوب في كل من الدماغ والحبل الشوكي ، يكون طريق الإعطاء مهما للغاية ، لأن الخلايا الجذعية الجذعية يجب أن تهاجر إلى كل من الدماغ والحبل الشوكي. تصف هذه الورقة طريقة لإعطاء الخلايا الجذعية الجذعية في القناة الشوكية (حقن التجويف الشوكي) التي يمكن أن تستهدف الدماغ والحبل الشوكي في نموذج الفئران. تم حقن مليون MSC في القنوات الشوكية للفئران على مستوى الفقرات القطنية 2-3. بعد الإعطاء ، تم القتل الرحيم للفئران في 0 و 6 و 12 ساعة بعد الحقن. تم استخدام التصوير البصري وتفاعل البوليميراز المتسلسل الكمي في الوقت الفعلي (qPCR) لتتبع الخلايا الجذعية الجذعية المحقونة. أظهرت نتائج الدراسة الحالية أن الخلايا الجذعية الجذعية التي يتم إعطاؤها عبر التجويف الشوكي يمكن اكتشافها لاحقا في كل من الدماغ والحبل الشوكي في 12 ساعة. يتميز الحقن داخل التجويف الشوكي بعدم الحاجة إلى تخدير عام وله آثار جانبية قليلة. ومع ذلك ، يجب التغلب على عيب معدل الهجرة المنخفض للخلايا الجذعية الجذعية إلى الدماغ.
Introduction
الخلايا الجذعية الوسيطة
في ظل الظروف المرضية ، تفرز الخلايا الجذعية الجذعية مواد علاجية خاصة بالمرض عن طريق إجراءات الباراكرين1 التي تم الإبلاغ عنها لتنظيم الاستجابات المناعية واستعادة الأنسجة التالفة وإزالة المواد السامة2. لذلك ، يعتبر علاج MSC أكثر فعالية من العلاج أحادي الهدف في علاج الأمراض متعددة العوامل مثل مرض الزهايمر والساركوبينيا3،4،5،6. بالإضافة إلى ذلك ، على عكس المستحضرات الصيدلانية ، فإن الخلايا الجذعية الجذعية لها تأثير موجه ، حيث تنتقل إلى منطقة الأنسجة التالفة من خلال التعرف على السيتوكينات الالتهابية أو الكيموكينات في الجسم7،8. لسوء الحظ ، تصل مجموعة فرعية فقط من الخلايا إلى المنطقة المتضررة ، وتقل صلاحية الخلايا الجذعية الجذعية أثناء الهجرة9،10،11،12. وبالتالي ، لتعظيم الفعالية العلاجية للخلايا الجذعية الجذعية ، من الضروري توصيل خلايا قابلة للحياة إلى الموقع المستهدف. لذلك ، عند إعطاء الخلايا الجذعية الجذعية ، من المهم اختيار الطريق المناسب للإعطاء ، بناء على طبيعة المرض المستهدف.
طريق الحقن
هناك العديد من الطرق التي يتم من خلالها إعطاء العوامل العلاجية للمرضى. الطرق الأكثر شيوعا هي الحقن الوريدي في الدورة الدموية الجهازية ، والإدارة الفموية ، والحقن تحت الجلد أو العضلي. في الأمراض التنكسية العصبية ، العقبة الرئيسية في توصيل العوامل العلاجية إلى الدماغ هي الحاجز الدموي الدماغي (BBB). يحمي BBB الدماغ من مسببات الأمراض الخارجية عن طريق الوصلات الضيقة بين الأوعية الدموية وحمة الدماغ13،14. ومع ذلك ، فإن BBB يمنع أيضا العوامل العلاجية من دخول حمة الدماغ. لذلك ، فإن المرور عبر BBB هو العقبة الرئيسية في تطوير علاجات أمراض الدماغ15،16. يتم إجراء الحقن داخل المخ للتغلب على هذا العيب عن طريق حقن المواد المستهدفة مباشرة في الدماغ من خلال العمليةالجراحية 17،18،19. ومع ذلك ، يجب مراعاة الآثار الجانبية للتدخلات الجراحية ، خاصة وأن الإبرة تلحق الضرر بالخلايا العصبية أثناء العملية.
إدارة التجويف الشوكي
الإعطاء داخل القراب - إعطاء الأدوية في القناة الشوكية أو الفضاء تحت العنكبوتية - يوصل الأدوية إلى الدماغ أو المحور العصبي من خلال السائل الدماغي النخاعي (CSF) وهو بديل قابل للتطبيق للحقن داخل المخ. يمكن تقسيم الحقن داخل القراب وفقا لموقع الحقن: البطين الجانبي ، وصهريج ماجنا ، والتجويف الشوكي. تسمح الطرق الثلاثة للأدوية أو الخلايا بالتشتت في جميع أنحاء السائل الدماغي النخاعي في الدماغ والحبل الشوكي. قد يكون توصيل الدواء إلى الدماغ أكثر كفاءة في حالة الحقن داخل البطين وداخل الصهريج لأن العامل يتم حقنه بالقرب من الدماغ. ومع ذلك ، فإن الحقن داخل التجويف الشوكي له مزايا عدم الحاجة إلى تخدير عام أو جراحة لإدخال خزان داخل البطين ، كونه آمنا بشكل عام20 ، ويمكن إجراؤه بشكل متكرر إذا لزم الأمر.
كان الغرض من هذه الدراسة هو التحقق من صحة إدارة التجويف داخل العمود الفقري كوسيلة لإيصال الخلايا الجذعية الجذعية إلى كل من الدماغ والحبل الشوكي. أولا ، تم إنشاء التجويف داخل العمود الفقري في نموذج الفئران. بعد ذلك ، تم تصنيف الخلايا الجذعية الجذعية بتتبع محب للدهون ، DiD (DiIC18 (5) ؛ 1،1-ديوكتاديسيل-3،3،3،3- رباعي ميثيل إندوديكاربوسيانين ، 4-ملح كلوروبنزين سلفونات) ، لتقييم كفاءة هجرة الخلايا الجذعية إلى النخاع الشوكي والدماغ. تم إجراء التصوير البصري خارج الجسم الحي لتقييم تشتت الخلايا. يمكن تنفيذ هذا البروتوكول البسيط دون تدخل جراحي ويمكن استخدامه ليس فقط لغرض إدارة الخلايا الجذعية ، ولكن أيضا المستحضرات الصيدلانية والأجسام المضادة ووسائط التباين وغيرها من المواد المعدة لتوصيلها إلى الحبل الشوكي أو الدماغ.
Protocol
ملاحظة: تمت الموافقة على هذه الدراسة من قبل اللجنة المؤسسية لرعاية واستخدامه (رقم الموافقة: 20170125001 ، التاريخ: 25 يناير 2017) لمعهد سامسونج للأبحاث الطبية الحيوية (SBRI) في مركز سامسونج الطبي. بصفتها مرفقا معتمدا من الرابطة الدولية لتقييم واعتماد رعاية المختبر ، تعمل الهيئة الفرعية للتنفيذ وفقا للمبادئ التوجيهية التي وضعها معهد الموارد الحيوانية المختبرية.
1. تحضير الخلايا الجذعية الجذعية المشتقة من الهلام من وارتون البشري
- زراعة الخلايا الجذعية الوسيطة المشتقة من الهلام البشري في وارتون (WJ-MSCs)
- قم بإذابة قارورة WJ-MSCs البشرية بسرعة في حمام مائي 37 درجة مئوية. انقل WJ-MSCs إلى أنبوب مخروطي سعة 50 مل ، وأضف وسط نمو بحجم لا يقل عن 10 × حجم الخلايا (v / v). Pipet لأعلى ولأسفل لتعليق الخلايا.
- جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق. تخلص بعناية من المادة الطافية ، وأعد تعليق الخلايا.
ملاحظة: احرص على عدم التخلص من حبيبات الخلية. - بذور WJ-MSCs في قوارير T175 بكثافة 5,000-6,000 خلية / سم2. احتضان WJ-MSCs في حاضنةCO2 37 درجة مئوية. قم بتغيير وسط النمو كل 72 ساعة حتى تصل WJ-MSCs إلى 80-90٪ من التقاء.
ملاحظة: بشكل عام ، يستغرق الأمر من 3 إلى 4 أيام حتى تصل MSCs إلى 80-90٪ من التقاء.
- زراعة فرعية من WJ-MSCs البشرية
- تخلص من وسط النمو ، واغسل الخلايا ب 10 مل من المحلول الملحي المخزن بالفوسفات (PBS). قم بإزالة PBS ، وأضف 5 مل من 0.25٪ حمض التريبسين ثنائي الصوديوم إيثيلين ديامين تترا أسيتيك (EDTA) (انظر جدول المواد). احتضان الخلايا عند 37 درجة مئوية في حاضنة ثاني أكسيد الكربون2 لمدة 3 دقائق حتى تنفصل WJ-MSCs عن قارورة الزراعة.
- أضف 5 مل من وسط النمو الذي يحتوي على 10٪ مصل بقري جنيني لتحييد 0.25٪ تريبسين-EDTA. اجمع خليط الخلية وانقله إلى أنبوب مخروطي سعة 50 مل. اغسل قارورة زراعة الخلايا ب 10 مل من وسط النمو ، واجمع الخلايا في أنبوب سعة 50 مل باستخدام ماصة مصلية معقمة.
- الطرد المركزي خليط الخلية على حرارة 300 × جم لمدة 5 دقائق. تخلص من المادة الطافية ، وأعد تعليق الخلايا في 10 مل من وسائط النمو ، واحسب عدد WJ-MSCs.
تنبيه: احرص على عدم التخلص من حبيبات الخلية. - بذور WJ-MSCs بكثافة 4,000-6,000 خلية / سم2 ، اعتمادا على التجربة.
- وضع العلامات على الخلايا الجذعية الجذعية WJ-بصبغة DiD وإعداد الخلايا الجذعية الجذعية WJ-لحقن التجويف الشوكي
ملاحظة: تم تنفيذ إجراء وضع العلامات على الصبغة DiD وفقا لتعليمات الشركة المصنعة.- افصل WJ-MSCs عندما تصل إلى 80٪ من التقاء ، باستخدام الإجراء المذكور أعلاه. قم بتعليق WJ-MSCs بكثافة 1 × 106 / مل في α الحد الأدنى من الوسط الأساسي الخالي من الفينول الأحمر (MEM) بدون مصل.
- أضف 5 ميكرولتر من محلول وضع العلامات DiD لكل 1 مل من تعليق الخلية ؛ تخلط بلطف مع سحب العينات.
- احتضان لمدة 15 دقيقة عند 37 درجة مئوية ؛ جهاز الطرد المركزي لتعليق الخلية عند 300 × جم لمدة 5 دقائق.
- قم بإزالة المادة الطافية ، وأعد تعليق WJ-MSCs في α MEM الخالية من الفينول الأحمر بكثافة 1 × 106 / 0.2 مل.
2. حقن التجويف الشوكي ل WJ-MSCs
- التحضير لحقن التجويف الشوكي
- تخدير فئران Sprague-Dawley البالغة من العمر 6 أسابيع مع 5٪ أيزوفلوران. ثم حافظ على التخدير بنسبة 2٪ من الأيزوفلوران طوال العملية الجراحية.
ملاحظة: تحسين ظروف التخدير قبل بدء التجربة. - حلق المنطقة الجراحية باستخدام ماكينة حلاقة كهربائية للحيوانات الصغيرة.
ملاحظة: يمكن استبدال ماكينة الحلاقة الكهربائية بشفرة حلاقة يدوية وجل حلاقة. - تطهير المنطقة الجراحية باستخدام بوفيدون اليود. قم بعمل شق 3 سم في الجلد بشفرة جراحية. استئصال الجلد المتبقي والأنسجة العضلية باستخدام شفرة جراحية ومقص. اكشف عن العمليات الشائكة في أسفل الظهر 2-3 (L2-3).
- تخدير فئران Sprague-Dawley البالغة من العمر 6 أسابيع مع 5٪ أيزوفلوران. ثم حافظ على التخدير بنسبة 2٪ من الأيزوفلوران طوال العملية الجراحية.
- حقن WJ-MSCs المسمى DiD عبر التجويف داخل العمود الفقري
- ضع الجرذ في وضع الانبطاح. ثني العمود الفقري للفأر بشكل مناسب لتوسيع المسافة بين العمليات الشائكة المجاورة ، باستخدام كميات كافية من المناديل الورقية أو غيرها من المواد التي يمكن أن تساعد في الحفاظ على الوضع المناسب.
- املأ حقنة سعة 1 مل ب 0.2 مل من WJ-MSCs المسمى DiD. ضع مجموعة إبرة حقنة 23 جم عموديا بين العمليات الشائكة ل L2 و L3 ، وأدخل الإبرة حتى تلامس جسم العمود الفقري.
- عندما تلامس الإبرة الجسم الفقري ، اسحبها بحوالي 0.5 سم ، مع وضع طرف الإبرة في القناة الشوكية. قم بإمالة المحقنة ، وضع طرف الإبرة بحيث يشير إلى الاتجاه المنقاري. حقن WJ-MSCs في التجويف الشوكي خلال فترة 1 دقيقة.
ملاحظة: يجب تحسين سرعة الحقن مسبقا. - بعد الحقن ، قم بإزالة المحقنة تماما من القناة الشوكية. خياطة الشق ، ثم تطهير موقع الجراحة باستخدام بوفيدون اليود.
- علاج ما بعد العملية
- قم بتثبيت الجرذ وكبحه لمنع أي حركة ، ووضعه رأسا على عقب بزاوية 45 درجة لمدة 15 دقيقة ، بينما لا يزال تحت التخدير. بعد 15 دقيقة ، توقف عن التخدير وانتظر حتى يستيقظ الفئران.
3. تقييم حقن التجويف الشوكي
- القتل الرحيم للفئران وعزل الدماغ والحبل الشوكي بعد 0 و 6 و 12 ساعة بعد الحقن
- تخدير التجارب بنسبة 5٪ من الأيزوفلوران ؛ الحفاظ على التخدير مع 2٪ الأيزوفلوران أثناء تروية PBS.
- قم بعمل شق أسفل الحجاب الحاجز باستخدام مقص جراحي. افتح الشق بالملقط ، واقطع القفص الصدري بشكل مؤخر لكشف القلب.
- قم بعمل ثقب صغير في الأذين الأيمن ، وأدخل إبرة فراشة في البطين الأيسر. ضع 100 مل من PBS البارد في البطين الأيسر لمدة 4-5 دقائق ، حتى يتم تطهير الكبد من الدم.
- بعد التروية ، قم بعمل شق طويل على الجانب الخلفي من الرأس إلى الذيل باستخدام شفرة جراحية على طول المستوى الطولي. اعزل الدماغ المتبقي والعمود الفقري بالكامل باستخدام مقص جراحي وملقط وقاطع عظام. قم بإزالة الضلوع المتبقية والعظام المتصلة واللحم.
- التصوير البصري الفلوري Ex vivo DiD
- ضع الأنسجة المعزولة في حجرة جهاز التصوير البصري.
- اضبط المعلمات على النحو التالي: الانبعاث ، 700 نانومتر ؛ الإثارة ، 605 نانومتر ؛ ووقت التعرض ، ثانيتان ، كفوتونات لكل ثانية في سنتيمتر مربع لكل ستيراديان (ف / ثانية / سم2 / sr). التقط الصور البصرية.
ملاحظة: يجب الحصول على جميع الصور بإعدادات إضاءة متطابقة (جهد المصباح والمرشحات وf/stop ومجال الرؤية وbinning). - ارسم ثلاث مناطق مستطيلة ذات أهمية (ROIs) بحجم مكافئ للحبل الشوكي وعائد استثمار دائرة واحدة للدماغ باستخدام أداة الرسم. قياس شدة الفلورسنت لعائد الاستثمار.
- استخراج الحمض النووي الجيني (gDNA) من الحبل الشوكي وأنسجة المخ
- قم بإزالة الجمجمة والعمود الفقري بعناية باستخدام ملقط جراحي ومقص وغمر.
- حصاد الدماغ والحبل الشوكي من الجمجمة والعمود الفقري. قطع الحبل الشوكي إلى ثلاث قطع (عنق الرحم والصدر وأسفل الظهر).
ملاحظة: يجب تخزين الأنسجة المحصودة عند -80 درجة مئوية إذا لم يتم تحليلها على الفور. - طحن الأنسجة باستخدام ملاط مبرد مسبقا ومدقة ونيتروجين سائل. استخراج gDNA باستخدام المنتجات التجارية ، باتباع تعليمات الشركة المصنعة.
- تفاعل البوليميراز المتسلسل الكمي في الوقت الحقيقي (qPCR)
- حدد كمية gDNA في كل عينة باستخدام مقياس الطيف الضوئي.
- قم بإجراء qPCR باستخدام 10 نانوغرام من gDNA لكل عينة وبادئات مفصليات الصفراء البشرية (ALU) 12،21.
- احسب العدد الدقيق ل WJ-MSCs في العينات باستخدام طريقة ΔΔCT 22.
النتائج
لتقييم فعالية حقن الخلايا الجذعية الجذعية داخل النخاع ، تم استخدام الخلايا الجذعية الجذعية المسماة DiD في هذه الدراسة. قبل حقن الخلايا الجذعية الجذعية في التجويف الشوكي ، تم تقييم فعالية وضع العلامات في المختبر باستخدام التصوير البصري والفحص المجهري الفلوري (الشكل 1). بعد تلطيخ الخلايا الجذعية الجذعية بكاشف وضع العلامات DiD باستخدام الإجراء الموضح في قسم البروتوكول 3.1 ، تم التقاط صور بصرية لألواح الاستزراع التي تم زرع الخلايا الجذعية الجذعية المسمى عليها DiD (الشكل 1 أ). تظهر الخلايا الجذعية الجذعية المسماة DiD (+ DiD) باللون الأحمر. لم تظهر الخلايا الجذعية الجذعية الساذجة (-DiD) ، التي لم يتم تصنيفها بصبغة DiD ، إشارة إيجابية. تم تأكيد هذه النتيجة باستخدام الفحص المجهري الفلوري (الشكل 1 ب). تم تلطيخ الخلايا الجذعية الجذعية أيضا ب 4 ′،6-diamidino-2-phenylindole (DAPI) لتصور شكلها. ظهرت الخلايا الجذعية الجذعية الساذجة (-DiD) باللون الأزرق ، مما يشير إلى تلطيخ DAPI أو تلطيخ نووي ، لكنها لم تظهر اللون الأحمر ، والذي يرتبط بتلطيخ DiD. في المقابل ، أظهرت MSCs المسمى DiD (+ DiD) كلا من اللونين الأزرق والأحمر ، مما يشير إلى أن طريقة وضع العلامات DiD كانت ناجحة.

الشكل 1: وضع العلامات DiD على الخلايا الجذعية الجذعية في المختبر. (أ) تم زرع الخلايا الجذعية الجذعية المسماة DiD في صفيحة ثقافة مكونة من 6 آبار ، وتم إجراء التصوير البصري. (ب) تم التقاط الصور باستخدام الفحص المجهري الفلوري. يشار إلى نوى MSC باللون الأزرق (DAPI) ، ويتم توطين DiD المدمج في العصارة الخلوية لخلايا + DiD (أحمر). أشرطة المقياس = 500 ميكرومتر. تم تعديل هذا الرقم من Kim et al.12. الاختصارات: -DiD = MSCs الساذجة ، + DiD = MSCs المسمى بكاشف DiD ؛ MSC = الخلايا الجذعية الوسيطة. DiD = DiIC18 (5) ؛ 1،1-ديوكتاديسيل-3،3،3،3- رباعي ميثيل إندوديكاربوسيانين ، 4-ملح كلوروبنزين سلفونات ؛ DAPI = 4′,6-diamidino-2-phenylindole. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
بعد ذلك ، تم تقييم طريقة الحقن داخل التجويف الشوكي. لتقييم وتحسين إجراء حقن التجويف الشوكي ، تم استخدام صبغة التريبان الزرقاء بدلا من الخلايا الجذعية الجذعية المسماة DiD ، كما هو موضح في قسم البروتوكول 2 (الشكل 2). تم حقن صبغة التريبان الزرقاء ، وتم قتل الجرذ على الفور. تم تقطيع أنسجة الحبل الشوكي التي تم حصادها من الفئران إلى ثلاث قطع عرضية ، وتم تقطيع الدماغ إلى أقسام إكليلية. وجد أن صبغة التريبان الزرقاء المحقونة قد لطخت أنسجة الحبل الشوكي (الحبال القطنية والصدرية وعنق الرحم). علاوة على ذلك ، كان كل من الجانبين السفلي والعلوي من الدماغ ملطخين باللون الأزرق. ومع ذلك ، فإن صبغة التريبان الزرقاء لم تخترق البطين الجانبي للدماغ. أشارت هذه النتائج إلى أن طريقة الحقن داخل التجويف الشوكي كانت ناجحة.

الشكل 2: تأكيد حقن التجويف الشوكي في نموذج الفئران. تم حقن صبغة التريبان الزرقاء في التجويف الشوكي لفأر الاختبار. بعد الحقن ، تم القتل الرحيم للفأر ، وتم إجراء تشريح. هاجرت صبغة التريبان الزرقاء التي تم حقنها عبر القناة الشوكية إلى كل من الحبل الشوكي (أسفل الظهر والصدر وعنق الرحم) والدماغ الأزرق وتلطخهما. أشرطة المقياس = 1 سم. تم تعديل هذا الرقم من Kim et al.12. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
باستخدام البروتوكول الذي تم تحسينه بنجاح كما هو موضح أعلاه ، تم حقن الخلايا الجذعية الجذعية المسماة DiD عبر التجويف داخل العمود الفقري في الفئران (الشكل 3). تم القتل الرحيم للفئران بعد 0 و 6 و 12 ساعة من الحقن ، وتم إجراء التصوير البصري خارج الجسم الحي (الشكل 3 أ). بالمقارنة مع الإشارات الموجودة في الضابطة (بدون حقن) ، تم الكشف عن إشارات إيجابية عالية ومكثفة في الحبل الشوكي القطني للفئران التي تم قتلها رحيما مباشرة بعد الحقن (0 ساعة). في 6 ساعات بعد الحقن ، تم تشتيت الإشارة الإيجابية في جميع أنحاء الحبل الشوكي القطني. أخيرا ، لوحظت إشارات إيجابية عالية في مناطق أسفل الظهر والحبل العنقي وحتى في الدماغ بعد 12 ساعة من الحقن. تم قياس شدة إشارة الصور البصرية في كل نقطة زمنية باستخدام برنامج تحليل الصور (الشكل 3 ب). تم تحديد زيادة معنوية في شدة الإشارة في الحبل الشوكي القطني بعد 0 ساعة من الحقن وفي الدماغ بعد 12 ساعة من الحقن.

الشكل 3: تحليل التصوير البصري لتقييم فعالية الحقن داخل التجويف الشوكي. (أ) بعد حقن الخلايا الجذعية الجذعية في التجويف الشوكي ، تم القتل الرحيم للجرذان في النقاط الزمنية التالية: 0 و 6 و 12 ساعة بعد الحقن ، وبعد ذلك تم إجراء التصوير البصري خارج الجسم الحي. تظهر الإشارة الإيجابية باللون الأصفر والأحمر. (ب) من الصور ، تم تحديد كثافة الإشارة باستخدام البرامجيات. تم رسم مناطق الاهتمام المكافئة لكل مجموعة تجريبية. يتم تقديم البيانات كمتوسط ± الخطأ المعياري للمتوسط (SEM). * ص < 0.05. تم تعديل هذا الرقم من Kim et al.12. الاختصارات: الخلايا الجذعية الوسيطة = الخلايا الجذعية الوسيطة. CTL = التحكم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
أفادت دراسة سابقة أنه يمكن استخدام تسلسل ALU البشري كعلامة كمية لقياس عدد الخلايا ذات الأصل البشري ، مثل الخلايا الجذعية العصبية و MSCs ، في سياق زرع الطعم الغريب9،11،12. باتباع الإرشادات الواردة في الدراسة السابقة ، تم استخدام تحليل qPCR باستخدام مادة ALU التمهيدي الخاصة بالإنسان في الدراسة الحالية لتقييم التوزيع في الجسم الحي وهجرة الخلايا الجذعية الجذعية المسماة DiD (الشكل 4). بعد تضخيم تسلسل ALU ، تم فصل منتج تفاعل البوليميراز المتسلسل على هلام الاغاروز وتصوره (الشكل 4أ). بالمقارنة مع عينة التحكم (gDNA المستخرج من أدمغة الفئران في مجموعة عدم الحقن) ، تم تضخيم تسلسل ALU بشكل كبير في عينة 12 ساعة (gDNA المستخرج من أدمغة الفئران بعد 12 ساعة من الحقن). ومع ذلك ، في كلتا العينتين ، تم تضخيم Gapdh للفأر بشكل كبير ، مما يشير إلى أن الخلايا ذات الأصل البشري ، وخاصة الخلايا الجذعية الجذعية البشرية المستخدمة في هذه الدراسة ، كانت موجودة فقط في عينة المجموعة التي استمرت 12 ساعة. بعد ذلك ، تم تأكيد توزيع الخلايا الجذعية الجذعية في الدماغ والأعضاء الأخرى (القلب والرئة والكبد والطحال والكلى) باستخدام نفس الطريقة (الشكل 4 ب). على غرار نتائج التصوير البصري ، تم اكتشاف عدد كبير من الخلايا الجذعية الجذعية فقط في الدماغ بعد 12 ساعة من الحقن. أظهرت العينات الأخرى تباينا في نسبة ALU إلى Gapdh ، لكن جميع الإشارات من العينات ، باستثناء الدماغ بعد 12 ساعة من الحقن ، كانت جميعها تحت حدود الكشف ، مما يعني أنه لم يحدث تضخيم كبير.
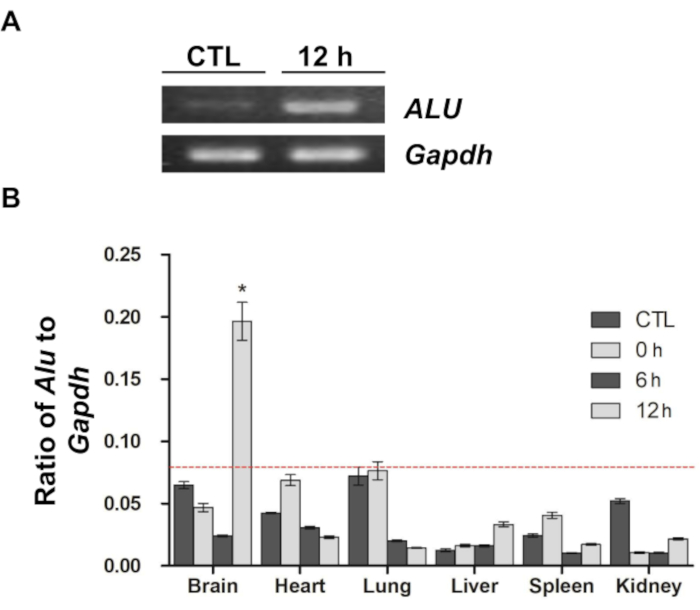
الشكل 4: تفاعل البوليميراز المتسلسل الكمي في الوقت الفعلي لتأكيد توزيع وهجرة الخلايا الجذعية الجذعية (أ) تم تصور منتجات تفاعل البوليميراز المتسلسل المضخمة للحمض النووي الجيني للدماغ المستخرج من مجموعات التحكم و 12 ساعة على هلام الاغاروز. ALU هو برايمر خاص بالإنسان ، وتم استخدام برايمر Gapdh للفأر للتطبيع. تظهر منتجات تفاعل البوليميراز المتسلسل المضخمة كأشرطة بيضاء مكثفة. (ب) تم إجراء تحليل qPCR ، وتم حساب نسبة ALU إلى Gapdh في كل عينة. يشير الخط الأحمر المتقطع إلى حد الكشف في تحليل PCR في الوقت الفعلي. يتم تقديم البيانات كمتوسط ± الخطأ المعياري للمتوسط (SEM). * ص < 0.05. تم تعديل هذا الرقم من Kim et al.12. الاختصارات: ALU = Arthrobacter luteus. تفاعل البوليميراز المتسلسل = تفاعل البوليميراز المتسلسل. qPCR = تفاعل البوليميراز المتسلسل الكمي في الوقت الفعلي؛ الخلايا الجذعية الوسيطة = الخلايا الجذعية الوسيطة. جابده = نازعة هيدروجين الجلسرالديهايد 3-الفوسفات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
توضح نتائج الدراسة الحالية أن الخلايا الجذعية الجذعية التي يتم تسليمها عن طريق الحقن داخل التجويف الشوكي تم توزيعها في منطقة أسفل الظهر في جميع النقاط الزمنية وهاجرت إلى الدماغ بعد 12 ساعة من الحقن.
Discussion
يجب اختيار الطريقة المثلى للإعطاء للعلاج باستخدام الخلايا الجذعية الجذعية اعتمادا على المرض المستهدف وحالة المريض ونوع الدواء المراد تسليمه. في العلاجات الخلوية ، بما في ذلك علاج MSC ، يجب مراعاة الحقن المباشر للخلايا الجذعية في الدماغ أو داخل القراب عبر السائل الدماغي النخاعي لأن الخلايا لا يمكن أن تمر عبر BBB19. الحقن داخل التجويف الشوكي غير جراحي نسبيا ولا يسبب تلفا في الخلايا العصبية في الدماغ ، على عكس الحقن داخل المخ البطيني ، ويرتبط بانخفاض خطر الآثار الجانبية20. الوصول إلى السائل الدماغي النخاعي عن طريق البزل القطني هو إجراء يمكن إجراؤه بسهولة شديدة في المواقع السريرية. لذلك ، ليس من الصعب إعطاء الخلايا الجذعية أو الأدوية أو عوامل التباين أو غيرها من المواد للمرضى عن طريق حقن التجويف الشوكي23،24،25. في المقابل ، فإن الحقن داخل المخ البطيني ، والتي تتطلب التدخل الجراحي ، أكثر تعقيدا. ومع ذلك ، بالنسبة لحيوانات التجارب ، يكون الحقن في التجويف الشوكي أكثر صعوبة من إعطاء العوامل مباشرة في الدماغ. وذلك لأن القوارض ، بما في ذلك الفئران والجرذان ، صغيرة جدا مقارنة بالبشر26.
في حالة إدارة التجويف الشوكي ، يجب إدخال الإبرة بين العمليات الشوكية. بالمقارنة مع الفجوات في البشر ، فإن الفجوات بين عظام الفئران ضيقة جدا ، مما يجعل الوصول صعبا. للتغلب على هذا ، يجب استخدام أصغر إبرة ، من الناحية المثالية إبرة 23 جرام. على الرغم من أنه يمكن استخدام إبرة 26 جم ، إلا أن هذه الإبرة الرفيعة يمكن أن تنحني بسهولة. يمكن تعديل حجم الإبرة بناء على عمر التجريبي. بالإضافة إلى ذلك ، لتسهيل إدارة التجويف داخل العمود الفقري في نموذج الفئران ، من الضروري ثني العمود الفقري ، وتوسيع الفجوة بين العمليات الشائكة ، مما يسهل على الإبرة الوصول إلى المسافة بين العمليات الشائكة. يمكن أيضا تعديل موقع الحقن واتجاه الإبرة حسب الحاجة. الفجوات بين العمليات الشائكة العنقية أوسع نسبيا من تلك الموجودة بين العمليات الشائكة القطنية. ومع ذلك ، إذا تم إجراء الحقن بالقرب من أجزاء عنق الرحم أو الصدر من الحبل الشوكي ، فقد يتسبب الوضع غير الصحيح للإبرة في تلف الحبل الشوكي بشكل خطير ، بما في ذلك شلل الأطراف السفلية للحيوان أو المريض التجريبي.
لذلك ، عند اختيار منطقة الحبل الشوكي العلوي ، يجب توخي الحذر لمنع تلف الحبل الشوكي والأعصاب. في البشر ، ينتهي الحبل الشوكي عند L1-2 ، حيث يبدأ ذيل الفرس. ذيل الفرس عبارة عن حزمة من الأعصاب القطنية والعجزية. لذلك ، يعد العمود الفقري القطني مكانا أكثر أمانا نسبيا للحقن من العمود الفقري العنقي أو الصدري. لذلك ، يوصى فقط بالعمود الفقري القطني ، وخاصة المنطقة الواقعة تحت L2 حيث يبدأ ذيل الفرس ، لحقن التجويف الشوكي. بناء على هذا الاعتبار ، تم اختيار العمود الفقري القطني تحت L2 للدراسة الحالية لتقليل تلف الأعصاب الشوكية. لتتبع الخلايا الجذعية التي يتم تسليمها إلى الحبل الشوكي والدماغ ، تم استخدام كاشف DiD لتسمية WJ-MSCs ، والتي كانت مرئية تحت المجهر الفلوري وفي المختبر وتجارب التصوير البصري خارج الجسم الحي (الشكل 1 والشكل 3). لم تظهر WJ-MSCs غير المسماة أي مضان DiD إيجابي في الجسم الحي في المجموعة الضابطة (بدون حقن). تشير هذه النتائج إلى أنه يمكن استخدام صبغة DiD المحبة للدهون كعامل تتبع للعلاج بالخلايا الجذعية. حاليا ، تم تطوير العديد من العوامل المختلفة لتتبع الخلايا الجذعية المزروعة27،28،29. يمكن تعديل كواشف التتبع هذه بناء على المعدات المستخدمة للتقييم ، مثل التصوير بالرنين المغناطيسي والتصوير المقطعي المحوسب والتصوير البصري. أفادت دراسة سابقة عن استخدام جزيئات الحديد النانوية لتتبع الخلايا الجذعية الجذعية التي يتم تسليمها عن طريق الحقن داخل المخ البطيني فيالدماغ 9،29. وبالتالي ، يمكن استخدام العديد من الجسيمات النانوية المعدنية والعوامل المحبة للدهون ، مثل DiD ، لتتبع الخلايا الجذعية في الجسم الحي وخارج الجسم الحي.
لتقييم هجرة وتوزيع WJ-MSCs التي يتم تسليمها عن طريق الحقن داخل التجويف الشوكي ، تم إجراء تحليل qPCR باستخدام برايمر ALU . كان الهدف الأساسي من هذه الدراسة هو تحسين طريقة إعطاء التجويف داخل العمود الفقري وتقييم فعاليته. لذلك ، تم اختيار طرق التحليل لتتبع وقياس التوزيع الكلي وهجرة WJ-MSCs في جميع أنحاء الدماغ والحبل الشوكي في نقاط زمنية مختلفة. لهذا السبب ، تم إجراء التصوير البصري مع الدماغ والحبل الشوكي اللذين لا يزالان متصلين. تم طحن الدماغ أو الحبل الشوكي بالكامل (عنق الرحم والصدر وأسفل الظهر) ، وتم حساب الأعداد الدقيقة ل WJ-MSCs في تلك الأنسجة عن طريق تحليل qPCR باستخدام برايمر ALU . تم الإبلاغ عن أن التمهيدي الخاص بالإنسان ALU يتمتع بحساسية وخصوصية عالية للكشف عن خلايا الأصل البشري بين خلايا القوارض21. بالإضافة إلى ذلك ، توصي وزارة سلامة الغذاء والدواء في كوريا باستخدام بادئات ALU البشرية لتقييم التوزيع الحيوي للخلايا الجذعية كجزء من البيانات قبل السريرية التي تم جمعها للموافقة على الأدوية الجديدة التجريبية. لتحديد الموقع الدقيق لخلايا WJ-MSCs التي تهاجر نحو الدماغ والحبل الشوكي في نقاط زمنية مختلفة ، يجب إجراء تلطيخ كيميائي مناعي (IHC). ومع ذلك ، لم يتم إجراء IHC هنا ، وهو قيد لهذه الدراسة.
يجب أيضا اختيار النقاط الزمنية للقتل الرحيم بشكل مناسب. تعتمد سرعة هجرة الخلايا الجذعية نحو الدماغ ونمط التوزيع في جميع أنحاء المحور العصبي على المواد التي يتم تسليمها وحالة التجربة أو المرضى. من المهم تحديد الخصائص الفسيولوجية والكيميائية للمواد المحقونة. يمكن أن تؤثر عوامل مختلفة مثل الحجم والكتلة والدهون ونصف العمر على الوقت اللازم للهجرة إلى الدماغ والتشتت في جميع أنحاء الجهاز العصبي المركزي بأكمله (الجهاز العصبي المركزي). لذلك ، يجب تحديد نقطة زمنية مناسبة للقتل الرحيم وفقا لخصائص المادة التي يتم تناولها. علاوة على ذلك ، فإن الحالة المادية لموضوع الاختبار مهمة أيضا. في كل من المرضى والنماذج الحيوانية المريضة ، هناك العديد من المواد ، مثل السيتوكينات الالتهابية والحواتم المستهدفة ، التي يمكن أن تجذب العوامل العلاجية (الخلايا الجذعية والخلايا المناعية وأدوية الأجسام المضادة) نحو مواقع الآفة. لذلك ، سيستغرق الأمر وقتا أقل حتى تصل WJ-MSCs إلى الدماغ إذا تم استخدام نموذج مرض الجهاز العصبي المركزي. في الدراسة الحالية باستخدام نموذج الفئران من النوع البري ، تم اختيار ثلاث نقاط زمنية مختلفة (0 و 6 و 12 ساعة). تم القتل الرحيم لحيوانات التجارب في مجموعة 0 ساعة مباشرة بعد حقن الخلايا الجذعية ، وتم اكتشاف WJ-MSCs فقط في النخاع الشوكي القطني حول موقع الحقن. في المقابل ، لوحظت WJ-MSCs في أدمغة والحبل الشوكي العنقي للفئران في مجموعة 12 ساعة ، مما يشير إلى أن الأمر استغرق ما لا يقل عن 12 ساعة حتى تهاجر WJ-MSCs إلى الدماغ والحبل العنقي في نموذج فئران من النوع البري. من الناحية النظرية ، يمكن أن تهاجر WJ-MSCs الإضافية إلى الدماغ مع تقدم الوقت ، ولكن لم يتم تقييم ذلك أو إثباته في هذه الدراسة.
إن إعطاء التجويف الشوكي للخلايا الجذعية الجذعية له عيب في انخفاض كفاءة التوصيل إلى الدماغ مقارنة بإعطاء داخل البطين أو داخل المتني12. السبب الأول لذلك هو المسافة من موقع الإدارة إلى الدماغ ، والسبب الثاني يتعلق بتدفق السائل الدماغي النخاعي. نظرا لأن السائل الدماغي النخاعي ينتج في الضفيرة المشيمية الموجودة في البطين الجانبي للدماغ ، يتدفق السائل الدماغي النخاعي من البطين الجانبي إلى الحبل الشوكي30. لذلك ، في هذه الدراسة ، تم وضع الفئران في وضع مقلوب بزاوية 45 درجة لمدة 15 دقيقة للمساعدة في هجرة الخلايا الجذعية الجذعية إلى الدماغ. قد تؤدي الزاوية الأكبر أو وقت الانتظار الأطول إلى زيادة هجرة الخلايا الجذعية الجذعية إلى الدماغ. بالإضافة إلى ذلك ، يمكن تعديل حجم الحقن وسرعته وجرعته لتحقيق توصيل أكثر كفاءة إلى الدماغ والحبل الشوكي. تقدم الدراسة الحالية عملية يمكن من خلالها إعطاء WJ-MSCs عبر التجويف داخل العمود الفقري في L2-3 وتقييم أنماط هجرة وتوزيع الخلايا الجذعية في 0 و 6 و 12 ساعة بعد الحقن في نموذج الفئران. على الرغم من أن عددا صغيرا فقط من WJ-MSCs التي تم تسليمها عبر مسار التجويف داخل العمود الفقري انتقل إلى دماغ الفئران في الدراسة الحالية ، إلا أنه يمكن زيادة هذا العدد عن طريق تعديل العديد من المتغيرات. يمكن اعتبار البيانات قبل السريرية المقدمة في هذه الدراسة أساسا علميا للاستخدام السريري لحقن التجويف الشوكي للعلاج بالخلايا الجذعية والعلاج المناعي والمواد العلاجية الأخرى.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذه الدراسة بمنح من برنامج البحوث الأساسية من خلال المؤسسة الوطنية للبحوث في كوريا الجنوبية (NRF) ، بتمويل من وزارة التعليم (NRF-2017R1D1A1B03035940) ، ومنحة من مشروع البحث والتطوير في مجال التكنولوجيا الصحية الكوري من خلال المعهد الكوري لتطوير الصناعة الصحية (KHIDI) ، بتمويل من وزارة الصحة والرعاية الاجتماعية ، جمهورية كوريا (أرقام المنح: HI14C3484 و HI18C0560). نود أن نشكر Editage (www.editage.co.kr) على التحرير باللغة الإنجليزية.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco-invitrogen | 25200114 | Cell culture |
| Fetal bovine serum | biowest | S1520 | Culture medium supplement |
| gentamicin | Gibco-invitrogen | 15710-072 | Culture medium supplement |
| Gentra Puregene Tissue Kit | QIAGEN | 158689 | gDNA isolation |
| MEM, no glutamine, no phenol red | Gibco | 51200038 | WJ-MSC fomulation for injection |
| Miminum Essential Medium alpha | Gibco-invitrogen | 12571063 | WJ-MSC culture medium |
| Power SYBR Green PCR Master Mix | Applied Biosystems | 4368577 | quantitative real time PCR reagent |
| QuantStudio 6 Flex Real-Time PCR System | Thermo fisher | 4485694 | quantitative real time PCR |
| trypan blue | Gibco | 15250061 | Injection |
| Vybrant DiD Cell-Labeling Solution | invitrogen | V22887 | Stem cell labeling solution |
| Xenogen IVIS Spectrum system | Perkin Elmer | 124262 | Optical imaging device |
References
- Gnecchi, M., Danieli, P., Malpasso, G., Ciuffreda, M. C. Paracrine mechanisms of mesenchymal stem cells in tissue repair. Methods in Molecular Biology. 1416, 123-146 (2016).
- Liang, X., Ding, Y., Zhang, Y., Tse, H. F., Lian, Q. Paracrine mechanisms of mesenchymal stem cell-based therapy: current status and perspectives. Cell Transplantation. 23 (9), 1045-1059 (2014).
- Kang, J. M., Yeon, B. K., Cho, S. J., Suh, Y. H. Stem cell therapy for Alzheimer's disease: a review of recent clinical trials. Journal of Alzheimer's Disease. 54 (3), 879-889 (2016).
- Staff, N. P., Jones, D. T., Singer, W. Mesenchymal stromal cell therapies for neurodegenerative diseases. Mayo Clinic Proceedings. 94 (5), 892-905 (2019).
- Kim, J., et al. Mesenchymal stem cell therapy and Alzheimer's disease: current status and future perspectives. Journal of Alzheimer's Disease. 77 (1), 1-14 (2020).
- Florea, V., Bagno, L., Rieger, A. C., Hare, J. M. Attenuation of frailty in older adults with mesenchymal stem cells. Mechanisms of Ageing Development. 181, 47-58 (2019).
- Karp, J. M., Leng Teo, G. S. Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell. 4 (3), 206-216 (2009).
- Regmi, S., Pathak, S., Kim, J. O., Yong, C. S., Jeong, J. H. Mesenchymal stem cell therapy for the treatment of inflammatory diseases: Challenges, opportunities, and future perspectives. European Journal of Cell Biology. 98 (5-8), 151041 (2019).
- Kim, H. S., et al. Lowering the concentration affects the migration and viability of intracerebroventricular-delivered human mesenchymal stem cells. Biochemical and Biophysical Research Communications. 493 (1), 751-757 (2017).
- Kim, D. H., et al. Effect of growth differentiation factor-15 secreted by human umbilical cord blood-derived mesenchymal stem cells on amyloid beta levels in in vitro and in vivo models of Alzheimer's disease. Biochemical and Biophysical Research Communications. 504 (4), 933-940 (2018).
- Park, S. E., et al. Distribution of human umbilical cord blood-derived mesenchymal stem cells (hUCB-MSCs) in canines after intracerebroventricular injection. Neurobiology of Aging. 47, 192-200 (2016).
- Kim, H., et al. Intrathecal injection in a rat model: a potential route to deliver human Wharton's jelly-derived mesenchymal stem cells into the brain. International Journal of Molecular Sciences. 21 (4), 1272 (2020).
- Daneman, R., Prat, A. The blood-brain barrier. Cold Spring Harbor Perspectives Biology. 7 (1), 020412 (2015).
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Banks, W. A. From blood-brain barrier to blood-brain interface: new opportunities for CNS drug delivery. Nature Reviews Drug Discovery. 15 (4), 275-292 (2016).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opinion on Drug Delivery. 13 (7), 963-975 (2016).
- Elia, C. A., et al. Intracerebral injection of extracellular vesicles from mesenchymal stem cells exerts reduced Aβ plaque burden in early stages of a preclinical model of Alzheimer's disease. Cells. 8 (9), 1059 (2019).
- Kim, H. J., et al. Stereotactic brain injection of human umbilical cord blood mesenchymal stem cells in patients with Alzheimer's disease dementia: A phase 1 clinical trial. Alzheimer's & Dementia (N Y). 1 (2), 95-102 (2015).
- Park, S. E., Lee, N. K., Na, D. L., Chang, J. W. Optimal mesenchymal stem cell delivery routes to enhance neurogenesis for the treatment of Alzheimer's disease: optimal MSCs delivery routes for the treatment of AD. Histology & Histopathology. 33 (6), 533-541 (2018).
- Sandow, B. A., Donnal, J. F. Myelography complications and current practice patterns. American Journal of Roentgenology. 185 (3), 768-771 (2005).
- Funakoshi, K., et al. Highly sensitive and specific Alu-based quantification of human cells among rodent cells. Scientific Reports. 7 (1), 13202 (2017).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Glass, J. D., et al. Lumbar intraspinal injection of neural stem cells in patients with amyotrophic lateral sclerosis: results of a phase I trial in 12 patients. Stem Cells. 30 (6), 1144-1151 (2012).
- Harris, V. K., et al. Clinical and pathological effects of intrathecal injection of mesenchymal stem cell-derived neural progenitors in an experimental model of multiple sclerosis. Journal of the Neurological Sciences. 313 (1-2), 167-177 (2012).
- Janson, C. G., Ramesh, T. M., During, M. J., Leone, P., Heywood, J. Human intrathecal transplantation of peripheral blood stem cells in amyotrophic lateral sclerosis. Journal of Hematotherapy and Stem Cell Research. 10 (6), 913-915 (2001).
- Chiu, C., et al. Temporal course of cerebrospinal fluid dynamics and amyloid accumulation in the aging rat brain from three to thirty months. Fluids Barriers CNS. 9 (1), 3 (2012).
- Bull, E., et al. Stem cell tracking using iron oxide nanoparticles. International Journal of Nanomedicine. 9, 1641-1653 (2014).
- Chen, D., et al. Bright polymer dots tracking stem Cell engraftment and migration to injured mouse liver. Theranostics. 7 (7), 1820-1834 (2017).
- Lee, N. K., et al. Magnetic resonance imaging of ferumoxytol-labeled human mesenchymal stem cells in the mouse brain. Stem Cell Reviews and Reports. 13 (1), 127-138 (2017).
- Bradley, W. G., Haughton, V., Mardal, K. A. Cerebrospinal fluid flow in adults. Handbook Clinical Neurology. 135, 591-601 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved