Method Article
Injection dans la cavité intraspinale de cellules souches mésenchymateuses humaines et suivi de leur migration dans le cerveau du rat
Dans cet article
Résumé
Plusieurs voies d’administration peuvent être utilisées pour délivrer des cellules souches mésenchymateuses (CSM) au cerveau. Dans la présente étude, les CSM ont été délivrées dans tout le neuraxisme et le cerveau par injection intra-cavité vertébrale. Des CSM ont été injectées dans les cavités vertébrales de rats, et la migration des cellules souches a été suivie et quantifiée.
Résumé
Les cellules souches mésenchymateuses (CSM) ont été étudiées pour le traitement de diverses maladies. Dans les maladies neurodégénératives impliquant des anomalies à la fois du cerveau et de la moelle épinière, la voie d’administration est très importante, car les CSM doivent migrer à la fois vers le cerveau et la moelle épinière. Cet article décrit une méthode d’administration de CSM dans le canal rachidien (injection intraspinale) qui peut cibler le cerveau et la moelle épinière dans un modèle de rat. Un million de CSM ont été injectées dans les canaux rachidiens de rats au niveau des vertèbres lombaires 2-3. Après l’administration, les rats ont été euthanasiés 0, 6 et 12 heures après l’injection. L’imagerie optique et la réaction en chaîne par polymérase quantitative en temps réel (qPCR) ont été utilisées pour suivre les CSM injectées. Les résultats de la présente étude ont démontré que les CSM administrées via la cavité vertébrale pouvaient être détectées ultérieurement dans le cerveau et la moelle épinière à 12 h. L’injection intraspinale dans la cavité a l’avantage de ne pas nécessiter d’anesthésie générale et a peu d’effets secondaires. Cependant, l’inconvénient du faible taux de migration des CSM vers le cerveau doit être surmonté.
Introduction
Cellules souches mésenchymateuses
Dans des conditions pathologiques, les CSM sécrètent des substances thérapeutiques spécifiques à la maladie par le biais d’actions paracrines1 qui régulent les réponses immunitaires, restaurent les tissus endommagés et éliminent les substances toxiques2. Par conséquent, la thérapie MSC est considérée comme plus efficace que la thérapie à cible unique dans le traitement des maladies multifactorielles telles que la maladie d’Alzheimer et la sarcopénie 3,4,5,6. De plus, contrairement aux produits pharmaceutiques, les CSM ont un effet de retour à la maison, se déplaçant vers la région du tissu endommagé en reconnaissant les cytokines inflammatoires ou les chimiokines dans le corps 7,8. Malheureusement, seul un sous-ensemble des cellules atteint la zone endommagée, et la viabilité des CSM diminue pendant la migration 9,10,11,12. Ainsi, pour maximiser l’efficacité thérapeutique des CSM, il est nécessaire de délivrer des cellules viables au site cible. Par conséquent, lors de l’administration de CSM, il est important de choisir la voie d’administration appropriée, en fonction de la nature de la maladie cible.
Voie d’injection
Il existe de nombreuses voies par lesquelles les agents thérapeutiques sont administrés aux patients. Les méthodes les plus courantes sont l’injection intraveineuse dans la circulation systémique, l’administration orale et l’injection sous-cutanée ou intramusculaire. Dans les maladies neurodégénératives, le principal obstacle à l’administration d’agents thérapeutiques au cerveau est la barrière hémato-encéphalique (BHE). La BHE protège le cerveau des agents pathogènes externes au moyen de jonctions serrées entre les vaisseaux sanguins et le parenchyme cérébral13,14. Cependant, la BHE empêche paradoxalement les agents thérapeutiques de pénétrer dans le parenchyme cérébral. Par conséquent, le passage par la BHE est le principal obstacle au développement de thérapies contre les maladies du cerveau15,16. L’injection intracérébrale est réalisée pour surmonter cet inconvénient en injectant des substances cibles directement dans le cerveau par opération chirurgicale 17,18,19. Cependant, les effets secondaires des interventions chirurgicales doivent être pris en compte, d’autant plus que l’aiguille endommage les cellules neuronales pendant la procédure.
Administration de la cavité intraspinale
L’administration intrathécale - l’administration de médicaments dans le canal rachidien ou l’espace sous-arachnoïdien - délivre des médicaments au cerveau ou au neuraxie par le biais du liquide céphalo-rachidien (LCR) et constitue une alternative viable à l’injection intracérébrale. Les injections intrathécales peuvent être subdivisées en fonction du site d’injection : ventricule latéral, citerne magna et cavité vertébrale. Les trois voies permettent aux médicaments ou aux cellules de se disperser dans tout le LCR dans le cerveau et la moelle épinière. L’administration du médicament au cerveau peut être plus efficace dans le cas des injections intra-ventriculaires et intra-citerne magna, car l’agent est injecté près du cerveau. Cependant, l’injection dans la cavité intraspinale présente l’avantage de ne pas nécessiter d’anesthésie générale ou de chirurgie pour l’insertion d’un réservoir intraventriculaire, étant généralement sûre20, et peut être effectuée à plusieurs reprises si nécessaire.
Le but de cette étude était de valider l’administration de CSM dans la cavité intraspinale comme moyen d’administrer des CSM au cerveau et à la moelle épinière. Tout d’abord, la cavité intraspinale a été établie dans un modèle de rat. Ensuite, les CSM ont été marquées à l’aide d’un traceur lipophile, DiD (DiIC18(5) ; sel de 1,1-dioctadécyl-3,3,3,3-tétraméthylindodicarbocyanine, 4-chlorobenzènesulfonate), afin d’évaluer l’efficacité de la migration des cellules souches vers la moelle épinière et le cerveau. Une imagerie optique ex vivo a été réalisée pour évaluer la dispersion cellulaire. Ce protocole simple peut être réalisé sans intervention chirurgicale et peut être utilisé dans le but non seulement d’administrer des cellules souches, mais également des produits pharmaceutiques, des anticorps, des produits de contraste et d’autres substances destinées à être administrées à la moelle épinière ou au cerveau.
Protocole
REMARQUE : Cette étude a été approuvée par le Comité institutionnel de protection et d’utilisation des animaux (numéro d’approbation : 20170125001, date : 25 janvier 2017) de l’Institut de recherche biomédicale Samsung (SBRI) du Samsung Medical Center. En tant qu’établissement accrédité par l’Association pour l’évaluation et l’accréditation de Laboratory Animal Care International, le SBRI agit conformément aux directives établies par l’Institute of Laboratory Animal Resources.
1. Préparation des CSM humaines dérivées de la gelée de Wharton
- Culture de cellules souches mésenchymateuses dérivées de la gelée de Wharton (WJ-MSCs)
- Décongelez rapidement un flacon de WJ-MSCs humains dans un bain d’eau à 37 °C. Transvasez les WJ-MSC dans un tube conique de 50 mL et ajoutez un milieu de croissance à un volume au moins 10 fois supérieur à celui des cellules (v/v). Pipette de haut en bas pour suspendre les cellules.
- Centrifuger à 300 × g pendant 5 min. Jetez soigneusement le surnageant et remettez les cellules en suspension.
REMARQUE : Veillez à ne pas jeter la pastille de cellule. - Semez les WJ-MSC dans des flacons T175 à une densité de 5 000 à 6 000 cellules/cm2. Incuber des WJ-MSC dans un incubateur à 37 °C de CO2 . Changez le milieu de culture toutes les 72 h jusqu’à ce que les WJ-MSC atteignent 80-90 % de confluence.
REMARQUE : En général, il faut 3 à 4 jours pour que les MSC atteignent 80 à 90 % de confluence.
- Sous-culture de WJ-MSC humaines
- Jetez le milieu de croissance et lavez les cellules avec 10 ml de solution saline tamponnée au phosphate (PBS). Retirer le PBS et ajouter 5 ml d’acide éthylènediaminetétraacétique (EDTA) trypsine-disodium à 0,25 % (voir le tableau des matières). Incuber les cellules à 37 °C dans un incubateur de CO2 pendant 3 min jusqu’à ce que les WJ-MSC se détachent du ballon de culture.
- Ajouter 5 mL de milieu de croissance contenant 10 % de sérum fœtal bovin pour neutraliser la trypsine-EDTA à 0,25 %. Prélevez le mélange de cellules et transférez-le dans un tube conique de 50 ml. Laver le ballon de culture cellulaire avec 10 ml de milieu de croissance et prélever les cellules dans un tube de 50 ml à l’aide d’une pipette sérologique stérile.
- Centrifuger le mélange cellulaire à 300 × g pendant 5 min. Jetez le surnageant, remettez les cellules en suspension dans 10 mL de milieu de croissance et comptez le nombre de WJ-MSC.
ATTENTION : Veillez à ne pas jeter la pastille de cellule. - Semez des WJ-MSC à une densité de 4 000 à 6 000 cellules/cm2, selon l’expérience.
- Marquage des WJ-MSCs avec le colorant DiD et préparation des WJ-MSCs pour l’injection dans la cavité intraspinale
REMARQUE : La procédure d’étiquetage par colorant DiD a été effectuée conformément aux instructions du fabricant.- Détachez les WJ-MSC lorsqu’ils atteignent 80 % de confluence, en utilisant la procédure mentionnée ci-dessus. Suspendre les WJ-MSC à une densité de 1 × 106/mL dans un milieu essentiel minimum (MEM) sans rouge de phénol α sans sérum.
- Ajouter 5 μL de solution de marquage DiD par 1 mL de suspension cellulaire ; Mélanger délicatement avec le pipetage.
- Incuber pendant 15 min à 37 °C ; Centrifuger la suspension cellulaire à 300 × g pendant 5 min.
- Retirer le surnageant et remettre en suspension les WJ-MSC dans des α MEM sans rouge de phénol à une densité de 1 × 106/0,2 mL.
2. Injection dans la cavité intraspinale des WJ-MSCs
- Préparation à l’injection dans la cavité intraspinale
- Anesthésier des rats Sprague-Dawley âgés de 6 semaines avec 5 % d’isoflurane ; Ensuite, maintenez l’anesthésie avec de l’isoflurane à 2 % tout au long de l’intervention chirurgicale.
REMARQUE : Optimisez les conditions d’anesthésie avant de commencer l’expérience. - Rasez la zone chirurgicale à l’aide d’un rasoir électrique pour petits animaux.
REMARQUE : Le rasoir électrique peut être remplacé par un rasoir manuel et du gel à raser. - Désinfectez la zone chirurgicale à l’aide de povidone iodée. Créez une incision de 3 cm dans la peau avec une lame chirurgicale. Réséquez la peau et les tissus musculaires restants à l’aide d’une lame chirurgicale et de ciseaux. Révéler les apophyses épineuses au niveau lombaire 2-3 (L2-3).
- Anesthésier des rats Sprague-Dawley âgés de 6 semaines avec 5 % d’isoflurane ; Ensuite, maintenez l’anesthésie avec de l’isoflurane à 2 % tout au long de l’intervention chirurgicale.
- Injection de WJ-MSCs marquées au DiD via la cavité intraspinale
- Placez le rat en position couchée. Fléchissez la colonne vertébrale du rat de manière appropriée pour élargir la distance entre les apophyses épineuses adjacentes, en utilisant des quantités suffisantes de tissu en papier ou d’autres matériaux qui peuvent aider à maintenir la position appropriée.
- Remplissez une seringue de 1 ml avec 0,2 ml de WJ-MSCs marqués au DiD. Placez une combinaison seringue-aiguille de 23 g verticalement entre les apophyses épineuses de L2 et L3, et insérez l’aiguille jusqu’à ce qu’elle touche le corps vertébral.
- Lorsque l’aiguille touche le corps vertébral, rétractez-la d’environ 0,5 cm, en plaçant la pointe de l’aiguille dans le canal rachidien. Inclinez la seringue et placez la pointe de l’aiguille de manière à ce qu’elle pointe vers la direction rostrale. Injectez des WJ-MSC dans la cavité vertébrale sur une période de 1 min.
REMARQUE : La vitesse d’injection doit être optimisée à l’avance. - Après l’injection, retirez complètement la seringue du canal rachidien. Suturez l’incision, puis désinfectez le site chirurgical à l’aide de povidone iodée.
- Traitement post-procédure
- Stabilisez et immobilisez le rat pour l’empêcher de bouger, en le plaçant à l’envers à un angle de 45° pendant 15 min, alors qu’il est encore sous anesthésie. Après 15 minutes, arrêtez l’anesthésie et attendez que le rat se réveille.
3. Évaluation de l’injection dans la cavité intraspinale
- Euthanasie des rats et isolement de l’encéphale et de la moelle épinière 0, 6 et 12 h après l’injection
- Anesthésier les animaux de laboratoire avec 5 % d’isoflurane ; maintenir l’anesthésie avec 2 % d’isoflurane pendant la perfusion PBS.
- Faites une incision sous le diaphragme à l’aide de ciseaux chirurgicaux. Ouvrez l’incision avec une pince et coupez la cage thoracique en rostralement pour exposer le cœur.
- Faites un petit trou dans l’oreillette droite et insérez une aiguille papillon dans le ventricule gauche. Perfuser 100 mL de PBS froid dans le ventricule gauche pendant 4 à 5 minutes, jusqu’à ce que le foie soit débarrassé du sang.
- Après la perfusion, faites une longue incision sur le dos de la tête à la queue à l’aide d’une lame chirurgicale le long du plan longitudinal. Isolez le cerveau restant et toute la colonne vertébrale à l’aide de ciseaux chirurgicaux, de pinces et d’un coupe-os. Retirez les côtes restantes, les os connectés et la chair.
- Imagerie optique fluorescente DiD ex vivo
- Placez les tissus isolés dans la chambre de l’appareil d’imagerie optique.
- Réglez les paramètres comme suit : émission, 700 nm ; excitation, 605 nm ; et le temps d’exposition, 2 secondes, en photons par seconde par centimètre carré par stéradian (p/s/cm2/sr). Capturez les images optiques.
REMARQUE : Toutes les images doivent être acquises avec des paramètres d’éclairage identiques (tension de la lampe, filtres, f/stop, champ de vision et binning). - Dessinez trois régions d’intérêt rectangulaires de taille équivalente pour la moelle épinière et un cercle ROI pour le cerveau à l’aide de l’outil de dessin. Mesurez les intensités fluorescentes des ROI.
- Extraction de l’ADN génomique (ADNg) de la moelle épinière et du tissu cérébral
- Retirez soigneusement le crâne et la colonne vertébrale à l’aide d’une pince chirurgicale, de ciseaux et d’un rongeur.
- Prélever le cerveau et la moelle épinière du crâne et de la colonne vertébrale. Coupez la moelle épinière en trois morceaux (cervical, thoracique et lombaire).
REMARQUE : Les tissus prélevés doivent être conservés à -80 °C s’ils ne sont pas analysés immédiatement. - Broyez les mouchoirs à l’aide d’un mortier pré-refroidi, d’un pilon et d’azote liquide. Extrayez l’ADNg à l’aide de produits commerciaux, en suivant les instructions du fabricant.
- Réaction en chaîne par polymérase quantitative en temps réel (qPCR)
- Quantifiez la quantité d’ADNg dans chaque échantillon à l’aide d’un spectrophotomètre.
- Effectuer une qPCR en utilisant 10 ng d’ADNg par échantillon et des amorces humaines d’Arthrobacter luteus (ALU) 12,21.
- Calculer le nombre exact de WJ-MSC dans les échantillons à l’aide de la méthode ΔΔCT 22.
Résultats
Pour évaluer l’efficacité de l’injection intraspinale de CSM, des CSM marquées au DiD ont été utilisées dans la présente étude. Avant d’injecter des CSM dans la cavité vertébrale, l’efficacité du marquage a été évaluée in vitro à l’aide de l’imagerie optique et de la microscopie à fluorescence (Figure 1). Après avoir coloré les CSM avec le réactif de marquage DiD à l’aide de la procédure décrite à la section 3.1 du protocole, des images optiques ont été prises des plaques de culture sur lesquelles les CSM marquées au DiD ont été ensemencées (figure 1A). Les CSM marquées au DiD (+DiD) sont indiquées en rouge ; les CSM naïves (-DiD), qui n’ont pas été marquées avec le colorant DiD, n’ont pas montré de signal positif. Ce résultat a été confirmé par microscopie à fluorescence (Figure 1B). Les CSM ont également été colorées avec du 4′,6-diamidino-2-phénylindole (DAPI) pour visualiser leur forme. Les CSM naïves (-DiD) sont apparues en bleu, indiquant une coloration au DAPI ou à la coloration nucléaire, mais n’ont pas montré de couleur rouge, associée à la coloration DiD. En revanche, les CSM marquées au DiD (+DiD) présentaient à la fois des couleurs bleue et rouge, indiquant que la méthode d’étiquetage DiD avait été couronnée de succès.

Figure 1 : Marquage au DiD des CSM in vitro. (A) Les CSM marquées au DiD ont été ensemencées dans une plaque de culture à 6 puits, et une imagerie optique a été réalisée. (B) Les images ont été prises à l’aide de la microscopie à fluorescence. Les noyaux MSC sont indiqués en bleu (DAPI), et le DiD incorporé est localisé dans le cytosol des cellules +DiD (rouge). Barres d’échelle = 500 μm. Cette figure a été modifiée de Kim et al.12. Abréviations : -DiD = CSM naïves, +DiD = CSM marquées avec le réactif DiD ; CSM = cellule souche mésenchymateuse ; DiD = DiIC18(5) ; sel de 1,1-dioctadécyl-3,3,3,3-tétraméthylindodicarbocyanine, 4-chlorobenzènesulfonate ; DAPI = 4′,6-diamidino-2-phénylindole. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Ensuite, la méthode d’injection dans la cavité intraspinale a été évaluée. Afin d’évaluer et d’optimiser la procédure d’injection dans la cavité intraspinale, un colorant bleu trypan a été utilisé à la place des CSM marquées au DiD, comme décrit dans la section 2 du protocole (figure 2). Un colorant bleu trypan a été injecté et le rat a été euthanasié immédiatement. Le tissu de la moelle épinière prélevé sur le rat a été coupé en trois morceaux transversalement et le cerveau a été coupé en sections coronales. Il a été constaté que le colorant bleu trypan injecté avait coloré les tissus de la moelle épinière (lombaire, thoracique et cervicale). De plus, les côtés inférieur et supérieur du cerveau étaient tachés de bleu. Cependant, le colorant bleu trypan n’a pas pénétré le ventricule latéral du cerveau. Ces résultats ont indiqué que cette méthode d’injection dans la cavité intraspinale était efficace.

Figure 2 : Confirmation de l’injection dans la cavité intraspinale dans un modèle de rat. Le colorant bleu trypan a été injecté dans la cavité vertébrale d’un rat d’essai. Après l’injection, le rat a été euthanasié et une nécropsie a été effectuée. Le colorant bleu trypan injecté par le canal rachidien a migré et coloré à la fois la moelle épinière (lombaire, thoracique et cervicale) et le cerveau bleu. Barres d’échelle = 1 cm. Cette figure a été modifiée de Kim et al.12. Veuillez cliquer ici pour voir une version agrandie de cette figure.
En utilisant le protocole optimisé avec succès comme décrit ci-dessus, des CSM marquées au DiD ont été injectées via la cavité intraspinale chez le rat (Figure 3). Les rats ont été euthanasiés 0, 6 et 12 heures après l’injection, et une imagerie optique ex vivo a été réalisée (figure 3A). Par rapport aux signaux chez les animaux témoins (sans injection), des signaux positifs élevés et condensés ont été détectés dans la moelle épinière lombaire de rats euthanasiés immédiatement après l’injection (0 h). 6 h après l’injection, le signal positif a été dispersé dans toute la moelle épinière lombaire. Enfin, des signaux positifs élevés ont été observés dans les régions de la moelle lombaire et cervicale et même dans le cerveau 12 h après l’injection. L’intensité du signal des images optiques a été quantifiée à chaque point temporel à l’aide d’un logiciel d’analyse d’images (Figure 3B). Une augmentation significative de l’intensité du signal a été identifiée dans la moelle épinière lombaire 0 h après l’injection et dans le cerveau 12 h après l’injection.

Figure 3 : Analyse d’imagerie optique pour évaluer l’efficacité de l’injection dans la cavité vertébrale. (A) Après avoir injecté les CSM dans la cavité vertébrale, les rats ont été euthanasiés aux points suivants : 0, 6 et 12 h après l’injection, après quoi une imagerie optique ex vivo a été effectuée. Le signal positif est de couleur jaune-rouge. (B) À partir des images, les intensités du signal ont été quantifiées à l’aide d’un logiciel. Des régions d’intérêt équivalentes ont été tirées pour chaque groupe expérimental. Les données sont présentées sous forme de moyenne ± d’erreur type de moyenne (SEM). *p < 0,05. Cette figure a été modifiée de Kim et al.12. Abréviations : CSM = cellules souches mésenchymateuses ; CTL = contrôle. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Une étude antérieure a rapporté que la séquence ALU humaine peut être utilisée comme marqueur quantitatif pour mesurer le nombre de cellules d’origine humaine, telles que les cellules souches neurales et les CSM, dans le contexte de la greffe de xénogreffe 9,11,12. Conformément aux lignes directrices de l’étude précédente, l’analyse qPCR à l’aide d’une amorce ALU spécifique à l’homme a été utilisée dans la présente étude pour évaluer la distribution et la migration in vivo des CSM marquées au DiD (Figure 4). Après amplification de la séquence ALU, le produit de PCR a été séparé sur un gel d’agarose et visualisé (Figure 4A). Comparativement à l’échantillon témoin (l’ADNg extrait du cerveau des rats dans le groupe sans injection), la séquence ALU était fortement amplifiée dans l’échantillon de 12 h (ADNg extrait du cerveau des rats 12 h après l’injection). Cependant, dans les deux échantillons, la Gapdh de souris était fortement amplifiée, ce qui indique que les cellules d’origine humaine, en particulier les CSM humaines utilisées dans cette étude, n’étaient présentes que dans l’échantillon du groupe de 12 heures. Ensuite, la distribution des CSM dans le cerveau et d’autres organes (cœur, poumon, foie, rate et rein) a été confirmée à l’aide de la même méthode (Figure 4B). À l’instar des résultats de l’imagerie optique, un nombre important de CSM n’ont été détectés que dans le cerveau 12 heures après l’injection. Les autres échantillons ont montré une variance dans le rapport entre l’ALU et le Gapdh, mais tous les signaux des échantillons, à l’exception du cerveau 12 h après l’injection, étaient tous inférieurs à la limite de détection, ce qui implique qu’aucune amplification significative ne s’est produite.
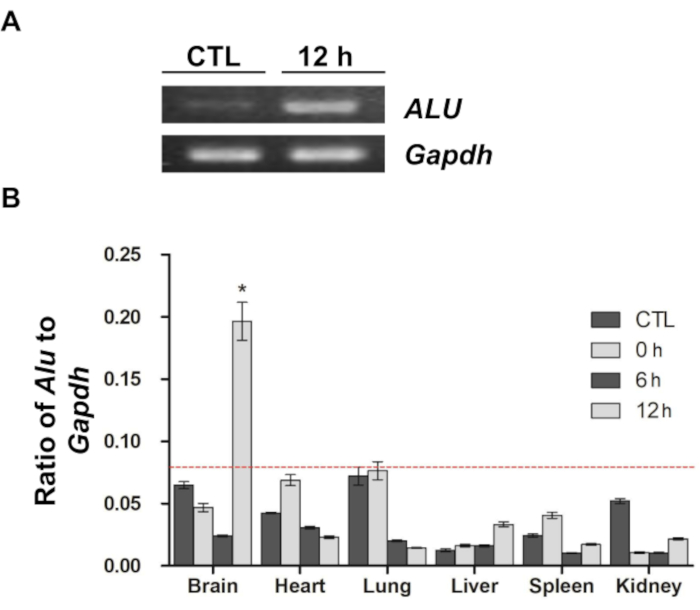
Figure 4 : Réaction en chaîne quantitative de la polymérase en temps réel pour confirmer la distribution et la migration des CSM. (A) Les produits PCR amplifiés de l’ADN génomique cérébral extrait des groupes témoins et 12 h ont été visualisés sur un gel d’agarose. ALU est une amorce spécifique à l’homme, et l’amorce Gapdh de souris a été utilisée pour la normalisation. Les produits PCR amplifiés sont représentés par des bandes blanches intenses. (B) Une analyse qPCR a été effectuée et le rapport entre l’ALU et le Gapdh dans chaque échantillon a été calculé. La ligne pointillée rouge indique la limite de détection dans l’analyse PCR en temps réel. Les données sont présentées sous forme de moyenne ± d’erreur type de moyenne (SEM). *p < 0,05. Cette figure a été modifiée de Kim et al.12. Abréviations : ALU = Arthrobacter luteus ; PCR = réaction en chaîne par polymérase ; qPCR = PCR quantitative en temps réel ; CSM = cellules souches mésenchymateuses ; Gapdh = glycéraldéhyde 3-phosphate déshydrogénase. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les résultats de la présente étude démontrent que les CSM administrées par injection intraspinale étaient distribuées dans la région lombaire à tous les points temporels et migraient vers le cerveau 12 heures après l’injection.
Discussion
La voie d’administration optimale pour le traitement par CSM doit être choisie en fonction de la maladie cible, de l’état du patient et du type de médicament à administrer. Dans les thérapies cellulaires, y compris la thérapie MSC, l’injection directe de cellules souches dans le cerveau ou par voie intrathécale via le LCR doit être envisagée car les cellules ne peuvent pas passer à travers la BHE19. L’injection intra-cavitaire est relativement non invasive et ne provoque pas de lésions neuronales dans le cerveau, contrairement aux injections intra-ventriculaires, et est associée à un faible risque d’effets secondaires20. L’accès au LCR via une ponction lombaire est une procédure qui peut être réalisée très facilement dans les sites cliniques. Par conséquent, il n’est pas difficile d’administrer des cellules souches, des médicaments, des agents de contraste ou d’autres substances aux patients par le biais d’injections dans la cavité vertébrale 23,24,25. En revanche, les injections intra-ventriculaires, qui nécessitent une intervention chirurgicale, sont plus compliquées. Cependant, pour les animaux de laboratoire, l’injection dans la cavité intraspinale est plus difficile que l’administration directe d’agents dans le cerveau. En effet, les rongeurs, y compris les souris et les rats, sont très petits par rapport aux humains26.
Dans le cas de l’administration d’une cavité intraspinale, l’aiguille doit être insérée entre les apophyses épineuses. Par rapport aux espaces chez l’homme, les espaces entre les os d’un rat sont très étroits, ce qui rend l’accès difficile. Pour surmonter cela, il faut utiliser la plus petite aiguille, idéalement une aiguille de 23 G. Bien qu’une aiguille de 26 G puisse être utilisée, une aiguille aussi fine peut se plier facilement. La taille de l’aiguille peut être ajustée en fonction de l’âge de l’animal de laboratoire. De plus, pour faciliter l’administration de la cavité intraspinale dans un modèle de rat, il est nécessaire de fléchir la colonne vertébrale, en élargissant l’espace entre les apophyses épineuses, ce qui facilite l’accès de l’aiguille à l’espace entre les apophyses épineuses. Le site d’injection et la direction de l’aiguille peuvent également être ajustés au besoin. Les espaces entre les apophyses épineuses cervicales sont relativement plus larges que ceux entre les apophyses épineuses lombaires. Cependant, si l’injection est effectuée près des parties cervicales ou thoraciques de la moelle épinière, un mauvais placement de l’aiguille peut causer de graves lésions à la moelle épinière, y compris la paralysie des membres inférieurs de l’animal de laboratoire ou du patient.
Par conséquent, lors de la sélection d’une région supérieure de la moelle épinière, il faut veiller à prévenir les dommages à la moelle épinière et aux nerfs. Chez l’homme, la moelle épinière se termine en L1-2, où commence la queue de cheval. La queue de cheval est un faisceau de nerfs lombaires et sacrés ; Par conséquent, la colonne lombaire est un endroit relativement plus sûr pour l’injection que la colonne cervicale ou thoracique. Par conséquent, seule la colonne lombaire, en particulier la région située sous L2 où commence la queue de cheval, est recommandée pour l’injection intraspinale. Sur la base de cette considération, la colonne lombaire sous L2 a été sélectionnée pour la présente étude afin de minimiser les lésions du nerf rachidien. Pour suivre les cellules souches délivrées à la moelle épinière et au cerveau, un réactif DiD a été utilisé pour marquer les WJ-MSC, qui étaient visibles au microscope à fluorescence et dans des expériences d’imagerie optique in vitro et ex vivo (figures 1 et 3). Les WJ-MSC non marquées n’ont montré aucune fluorescence DiD positive in vivo dans le groupe témoin (sans injection). Ces résultats indiquent que le colorant lipophile DiD peut être utilisé comme agent de suivi pour la thérapie par cellules souches. À l’heure actuelle, de nombreux agents différents ont été mis au point pour suivre les cellules souches transplantées 27,28,29. Ces réactifs de suivi peuvent être ajustés en fonction de l’équipement utilisé pour l’évaluation, tel que l’imagerie par résonance magnétique, la tomodensitométrie et l’imagerie optique. Une étude antérieure a rapporté l’utilisation de nanoparticules de fer pour suivre les CSM délivrées par injection intra-ventriculaire dans le cerveau 9,29. Ainsi, diverses nanoparticules métalliques et agents lipophiles, tels que le DiD, peuvent être utilisés pour le suivi in vivo et ex vivo des cellules souches.
Pour évaluer la migration et la distribution des CSM-WJ administrées par injection dans la cavité intraspinale, une analyse qPCR a été effectuée avec une amorce ALU . L’objectif principal de la présente étude était d’optimiser la méthode d’administration de la cavité intraspinale et d’évaluer son efficacité. Par conséquent, des méthodes d’analyse ont été choisies pour suivre et quantifier la distribution globale et la migration des CSM-WJ dans le cerveau et la moelle épinière à divers moments. Pour cette raison, l’imagerie optique a été réalisée avec le cerveau et la moelle épinière toujours connectés. L’ensemble du cerveau ou de la moelle épinière (cervicale, thoracique et lombaire) a été broyé, et le nombre exact de WJ-MSCs dans ces tissus a été calculé par analyse qPCR avec une amorce ALU . Il a été rapporté que l’amorce spécifique à l’homme ALU a une sensibilité et une spécificité élevées pour détecter les cellules d’origine humaine parmi les cellules de rongeurs21. De plus, le ministère coréen de la Sécurité des aliments et des médicaments recommande d’utiliser des amorces ALU humaines pour évaluer la biodistribution des cellules souches dans le cadre des données précliniques recueillies pour l’approbation de nouveaux médicaments expérimentaux. Pour identifier l’emplacement exact des CSM-WJ migrant vers le cerveau et la moelle épinière à différents moments, une coloration immunohistochimique (IHC) doit être effectuée. Cependant, l’IHC n’a pas été réalisée ici, ce qui constitue une limite de cette étude.
Les moments de l’euthanasie doivent également être choisis de manière appropriée. La vitesse de migration des cellules souches vers le cerveau et le modèle de distribution dans tout le neuraxe dépendent des substances délivrées et de l’état des animaux de laboratoire ou des patients. Il est important de déterminer les caractéristiques physiologiques et chimiques des matériaux injectés. Divers facteurs tels que la taille, la masse, la lipophilie et la demi-vie peuvent affecter le temps nécessaire pour migrer vers le cerveau et se disperser dans l’ensemble du système nerveux central (SNC). Par conséquent, un moment d’euthanasie approprié doit être établi en fonction des propriétés de la substance administrée. De plus, l’état physique du sujet de test est également important. Chez les patients et les modèles animaux malades, il existe de nombreuses substances, telles que les cytokines inflammatoires et les épitopes cibles, qui peuvent attirer des agents thérapeutiques (cellules souches, cellules immunitaires et anticorps) vers les sites de lésions. Par conséquent, il faudra moins de temps pour que les WJ-MSCs atteignent le cerveau si un modèle de maladie du SNC est utilisé. Dans la présente étude utilisant un modèle de rat de type sauvage, trois points temporels différents (0, 6 et 12 h) ont été sélectionnés. Les animaux de laboratoire du groupe 0 h ont été euthanasiés immédiatement après l’injection de cellules souches, et les WJ-MSCs n’ont été détectés que dans la moelle épinière lombaire autour du site d’injection. En revanche, des CSM-WJ ont été observées dans le cerveau et la moelle épinière cervicale de rats du groupe de 12 h, ce qui indique qu’il a fallu au moins 12 h pour que les CSM-WJ migrent vers le cerveau et la moelle cervicale dans un modèle de rat de type sauvage. Théoriquement, d’autres WJ-MSC peuvent migrer vers le cerveau au fil du temps, mais cela n’a pas été évalué ou prouvé dans la présente étude.
L’administration intraspinale de CSM présente l’inconvénient d’une faible efficacité de l’administration au cerveau par rapport à celle de l’administration intraparenchymateuse ou intraparenchymateuse12. La première raison est la distance entre le site d’administration et le cerveau, et la deuxième raison concerne le flux de LCR. Comme le LCR est produit dans le plexus choroïde situé dans le ventricule latéral du cerveau, le LCR s’écoule du ventricule latéral vers la moelle épinière30. Par conséquent, dans cette étude, les rats ont été placés en position renversée à un angle de 45° pendant 15 minutes pour faciliter la migration des CSM vers le cerveau. Un angle plus grand ou un temps d’attente plus long peut favoriser une migration accrue des CSM vers le cerveau. De plus, le volume, la vitesse et le dosage de l’injection peuvent être modifiés pour obtenir une administration plus efficace au cerveau et à la moelle épinière. La présente étude présente un processus par lequel les WJ-MSCs peuvent être administrées via la cavité intraspinale en L2-3 et a évalué les schémas de migration et de distribution des cellules souches à 0, 6 et 12 h après l’injection dans un modèle de rat. Bien que seul un petit nombre de WJ-MSC délivrés par la voie intravertébrale se soient déplacés vers le cerveau du rat dans la présente étude, ce nombre peut être augmenté en ajustant plusieurs variables. Les données précliniques fournies dans la présente étude peuvent être considérées comme une base scientifique pour l’utilisation clinique de l’injection intraspinale de la thérapie par cellules souches, de l’immunothérapie et d’autres substances curatives.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été financée par des subventions du Programme de recherche fondamentale par l’intermédiaire de la Fondation nationale pour la recherche de la Corée du Sud (NRF), financée par le ministère de l’Éducation (NRF-2017R1D1A1B03035940), et par une subvention du Projet coréen de recherche et développement en technologie de la santé par l’intermédiaire de l’Institut coréen de développement de l’industrie de la santé (KHIDI), financé par le ministère de la Santé et du Bien-être social de la République de Corée (numéros de subvention : HI14C3484 et HI18C0560). Nous tenons à remercier Editage (www.editage.co.kr) pour l’édition en anglais.
matériels
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco-invitrogen | 25200114 | Cell culture |
| Fetal bovine serum | biowest | S1520 | Culture medium supplement |
| gentamicin | Gibco-invitrogen | 15710-072 | Culture medium supplement |
| Gentra Puregene Tissue Kit | QIAGEN | 158689 | gDNA isolation |
| MEM, no glutamine, no phenol red | Gibco | 51200038 | WJ-MSC fomulation for injection |
| Miminum Essential Medium alpha | Gibco-invitrogen | 12571063 | WJ-MSC culture medium |
| Power SYBR Green PCR Master Mix | Applied Biosystems | 4368577 | quantitative real time PCR reagent |
| QuantStudio 6 Flex Real-Time PCR System | Thermo fisher | 4485694 | quantitative real time PCR |
| trypan blue | Gibco | 15250061 | Injection |
| Vybrant DiD Cell-Labeling Solution | invitrogen | V22887 | Stem cell labeling solution |
| Xenogen IVIS Spectrum system | Perkin Elmer | 124262 | Optical imaging device |
Références
- Gnecchi, M., Danieli, P., Malpasso, G., Ciuffreda, M. C. Paracrine mechanisms of mesenchymal stem cells in tissue repair. Methods in Molecular Biology. 1416, 123-146 (2016).
- Liang, X., Ding, Y., Zhang, Y., Tse, H. F., Lian, Q. Paracrine mechanisms of mesenchymal stem cell-based therapy: current status and perspectives. Cell Transplantation. 23 (9), 1045-1059 (2014).
- Kang, J. M., Yeon, B. K., Cho, S. J., Suh, Y. H. Stem cell therapy for Alzheimer's disease: a review of recent clinical trials. Journal of Alzheimer's Disease. 54 (3), 879-889 (2016).
- Staff, N. P., Jones, D. T., Singer, W. Mesenchymal stromal cell therapies for neurodegenerative diseases. Mayo Clinic Proceedings. 94 (5), 892-905 (2019).
- Kim, J., et al. Mesenchymal stem cell therapy and Alzheimer's disease: current status and future perspectives. Journal of Alzheimer's Disease. 77 (1), 1-14 (2020).
- Florea, V., Bagno, L., Rieger, A. C., Hare, J. M. Attenuation of frailty in older adults with mesenchymal stem cells. Mechanisms of Ageing Development. 181, 47-58 (2019).
- Karp, J. M., Leng Teo, G. S. Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell. 4 (3), 206-216 (2009).
- Regmi, S., Pathak, S., Kim, J. O., Yong, C. S., Jeong, J. H. Mesenchymal stem cell therapy for the treatment of inflammatory diseases: Challenges, opportunities, and future perspectives. European Journal of Cell Biology. 98 (5-8), 151041 (2019).
- Kim, H. S., et al. Lowering the concentration affects the migration and viability of intracerebroventricular-delivered human mesenchymal stem cells. Biochemical and Biophysical Research Communications. 493 (1), 751-757 (2017).
- Kim, D. H., et al. Effect of growth differentiation factor-15 secreted by human umbilical cord blood-derived mesenchymal stem cells on amyloid beta levels in in vitro and in vivo models of Alzheimer's disease. Biochemical and Biophysical Research Communications. 504 (4), 933-940 (2018).
- Park, S. E., et al. Distribution of human umbilical cord blood-derived mesenchymal stem cells (hUCB-MSCs) in canines after intracerebroventricular injection. Neurobiology of Aging. 47, 192-200 (2016).
- Kim, H., et al. Intrathecal injection in a rat model: a potential route to deliver human Wharton's jelly-derived mesenchymal stem cells into the brain. International Journal of Molecular Sciences. 21 (4), 1272 (2020).
- Daneman, R., Prat, A. The blood-brain barrier. Cold Spring Harbor Perspectives Biology. 7 (1), 020412 (2015).
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Banks, W. A. From blood-brain barrier to blood-brain interface: new opportunities for CNS drug delivery. Nature Reviews Drug Discovery. 15 (4), 275-292 (2016).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opinion on Drug Delivery. 13 (7), 963-975 (2016).
- Elia, C. A., et al. Intracerebral injection of extracellular vesicles from mesenchymal stem cells exerts reduced Aβ plaque burden in early stages of a preclinical model of Alzheimer's disease. Cells. 8 (9), 1059 (2019).
- Kim, H. J., et al. Stereotactic brain injection of human umbilical cord blood mesenchymal stem cells in patients with Alzheimer's disease dementia: A phase 1 clinical trial. Alzheimer's & Dementia (N Y). 1 (2), 95-102 (2015).
- Park, S. E., Lee, N. K., Na, D. L., Chang, J. W. Optimal mesenchymal stem cell delivery routes to enhance neurogenesis for the treatment of Alzheimer's disease: optimal MSCs delivery routes for the treatment of AD. Histology & Histopathology. 33 (6), 533-541 (2018).
- Sandow, B. A., Donnal, J. F. Myelography complications and current practice patterns. American Journal of Roentgenology. 185 (3), 768-771 (2005).
- Funakoshi, K., et al. Highly sensitive and specific Alu-based quantification of human cells among rodent cells. Scientific Reports. 7 (1), 13202 (2017).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Glass, J. D., et al. Lumbar intraspinal injection of neural stem cells in patients with amyotrophic lateral sclerosis: results of a phase I trial in 12 patients. Stem Cells. 30 (6), 1144-1151 (2012).
- Harris, V. K., et al. Clinical and pathological effects of intrathecal injection of mesenchymal stem cell-derived neural progenitors in an experimental model of multiple sclerosis. Journal of the Neurological Sciences. 313 (1-2), 167-177 (2012).
- Janson, C. G., Ramesh, T. M., During, M. J., Leone, P., Heywood, J. Human intrathecal transplantation of peripheral blood stem cells in amyotrophic lateral sclerosis. Journal of Hematotherapy and Stem Cell Research. 10 (6), 913-915 (2001).
- Chiu, C., et al. Temporal course of cerebrospinal fluid dynamics and amyloid accumulation in the aging rat brain from three to thirty months. Fluids Barriers CNS. 9 (1), 3 (2012).
- Bull, E., et al. Stem cell tracking using iron oxide nanoparticles. International Journal of Nanomedicine. 9, 1641-1653 (2014).
- Chen, D., et al. Bright polymer dots tracking stem Cell engraftment and migration to injured mouse liver. Theranostics. 7 (7), 1820-1834 (2017).
- Lee, N. K., et al. Magnetic resonance imaging of ferumoxytol-labeled human mesenchymal stem cells in the mouse brain. Stem Cell Reviews and Reports. 13 (1), 127-138 (2017).
- Bradley, W. G., Haughton, V., Mardal, K. A. Cerebrospinal fluid flow in adults. Handbook Clinical Neurology. 135, 591-601 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon