Method Article
Injeção intraespinhal de células-tronco mesenquimais humanas e rastreamento de sua migração para o cérebro de ratos
Neste Artigo
Resumo
Várias vias de administração podem ser usadas para fornecer células-tronco mesenquimais (MSCs) ao cérebro. No presente estudo, as CTMs foram administradas em todo o neuroeixo e cérebro por meio de injeção intra-cavitária espinhal. As CTMs foram injetadas nas cavidades espinhais de ratos e a migração de células-tronco foi rastreada e quantificada.
Resumo
As células-tronco mesenquimais (CTMs) têm sido estudadas para o tratamento de várias doenças. Em doenças neurodegenerativas envolvendo defeitos no cérebro e na medula espinhal, a via de administração é muito importante, porque as MSCs devem migrar para o cérebro e a medula espinhal. Este artigo descreve um método para administrar MSCs no canal espinhal (injeção intraespinhal cavidade) que pode atingir o cérebro e a medula espinhal em um modelo de rato. Um milhão de CTMs foram injetadas nos canais espinhais de ratos ao nível das vértebras lombares 2-3. Após a administração, os ratos foram eutanasiados 0, 6 e 12 h após a injeção. Imagens ópticas e reação em cadeia da polimerase quantitativa em tempo real (qPCR) foram usadas para rastrear as MSCs injetadas. Os resultados do presente estudo demonstraram que as CTMs administradas através da cavidade espinhal podem ser detectadas posteriormente no cérebro e na medula espinhal em 12 h. A injeção intraespinhal tem a vantagem de não necessitar de anestesia geral e tem poucos efeitos colaterais. No entanto, a desvantagem da baixa taxa de migração de MSCs para o cérebro deve ser superada.
Introdução
Células-tronco mesenquimais
Em condições de doença, as MSCs secretam substâncias terapêuticas específicas da doença por meio de ações parácrinas1 que foram relatadas para regular as respostas imunes, restaurar tecidos danificados e remover substâncias tóxicas2. Portanto, a terapia com CTM é considerada mais eficaz do que a terapia de alvo único no tratamento de doenças multifatoriais, como doença de Alzheimer e sarcopenia 3,4,5,6. Além disso, em contraste com os produtos farmacêuticos, as MSCs têm um efeito homing, movendo-se para a região do tecido danificado, reconhecendo citocinas inflamatórias ou quimiocinas no corpo 7,8. Infelizmente, apenas um subconjunto das células atinge a área danificada, e a viabilidade das MSCs diminui durante a migração 9,10,11,12. Assim, para maximizar a eficácia terapêutica das CTMs, é necessário entregar células viáveis ao local alvo. Portanto, ao administrar MSCs, é importante escolher a via de administração adequada, com base na natureza da doença-alvo.
Via de injeção
Existem inúmeras vias pelas quais os agentes terapêuticos são administrados aos pacientes. Os métodos mais comuns são injeção intravenosa na circulação sistêmica, administração oral e injeção subcutânea ou intramuscular. Nas doenças neurodegenerativas, o principal obstáculo na entrega de agentes terapêuticos ao cérebro é a barreira hematoencefálica (BHE). A BHE protege o cérebro de patógenos externos por meio de junções apertadas entre os vasos sanguíneos e o parênquima cerebral13,14. No entanto, a BHE também impede paradoxalmente a entrada de agentes terapêuticos no parênquima cerebral. Portanto, a passagem pela BHE é o principal obstáculo no desenvolvimento de terapias para doenças cerebrais 15,16. A injeção intracerebral é realizada para superar essa desvantagem, injetando substâncias-alvo diretamente no cérebro por meio de operação cirúrgica 17,18,19. No entanto, os efeitos colaterais das intervenções cirúrgicas devem ser considerados, especialmente porque a agulha danifica as células neuronais durante o procedimento.
Administração intraespinhal
A administração intratecal - a administração de medicamentos no canal espinhal ou no espaço subaracnóideo - fornece medicamentos ao cérebro ou ao neuroeixo através do líquido cefalorraquidiano (LCR) e é uma alternativa viável à injeção intracerebral. As injeções intratecais podem ser subdivididas de acordo com o local da injeção: ventrículo lateral, cisterna magna e cavidade espinhal. Todas as três rotas permitem que drogas ou células se dispersem por todo o LCR no cérebro e na medula espinhal. A administração do medicamento ao cérebro pode ser mais eficiente no caso de injeções intracerebroventriculares e intracisterna magna porque o agente é injetado próximo ao cérebro. No entanto, a injeção intraespinhal tem as vantagens de não necessitar de anestesia geral ou cirurgia para inserção de reservatório intraventricular, sendo geralmente segura20, podendo ser realizada repetidamente, se necessário.
O objetivo deste estudo foi validar a administração da cavidade intraespinhal como meio de fornecer MSCs ao cérebro e à medula espinhal. Primeiro, a cavidade intraespinhal foi estabelecida em um modelo de rato. Em seguida, as CTMs foram marcadas com um marcador lipofílico, DiD (DiIC18(5); 1,1-dioctadecil-3,3,3,3-tetrametilindodicarbocianina, sal de 4-clorobenzenossulfonato), para avaliar a eficiência da migração de células-tronco para a medula espinhal e cérebro. Imagens ópticas ex vivo foram realizadas para avaliar a dispersão celular. Este protocolo simples pode ser realizado sem intervenção cirúrgica e pode ser usado não apenas para administrar células-tronco, mas também produtos farmacêuticos, anticorpos, meios de contraste e outras substâncias destinadas a serem entregues à medula espinhal ou ao cérebro.
Protocolo
NOTA: Este estudo foi aprovado pelo Comitê Institucional de Cuidados e Uso de Animais (número de aprovação: 20170125001, data: 25 de janeiro de 2017) do Samsung Biomedical Research Institute (SBRI) no Samsung Medical Center. Como uma instalação credenciada pela Association for Assessment and Accreditation of Laboratory Animal Care International, o SBRI atua de acordo com as diretrizes estabelecidas pelo Institute of Laboratory Animal Resources.
1. Preparação de MSCs derivadas de geléia de Wharton humana
- Cultivo de células-tronco mesenquimais derivadas de gelatina de Wharton humana (WJ-MSCs)
- Descongele rapidamente um frasco de WJ-MSCs humanas em banho-maria a 37 °C. Transfira as WJ-MSCs para um tubo cônico de 50 mL e adicione meio de crescimento a um volume de pelo menos 10 vezes o das células (v / v). Pipet para cima e para baixo para suspender as células.
- Centrifugue a 300 × g por 5 min. Descarte cuidadosamente o sobrenadante e ressuspenda as células.
NOTA: Tenha cuidado para não descartar o pellet celular. - Semear WJ-MSCs em frascos T175 a uma densidade de 5.000-6.000 células/cm2. Incubar WJ-MSCs em uma incubadora de CO37 °C 2. Troque o meio de crescimento a cada 72 h até que as WJ-MSCs atinjam 80-90% de confluência.
NOTA: Geralmente, leva de 3 a 4 dias para que as MSCs atinjam 80-90% de confluência.
- Subcultivo de WJ-MSCs humanas
- Descarte o meio de crescimento e lave as células com 10 mL de solução salina tamponada com fosfato (PBS). Remova o PBS e adicione 5 mL de ácido etilenodiaminotetracético (EDTA) dissódico a 0,25% (consulte a Tabela de Materiais). Incubar as células a 37 °C numa incubadora de CO2 durante 3 minutos até que as WJ-MSC se desprendam do balão de cultura.
- Adicione 5 mL de meio de crescimento contendo 10% de soro fetal bovino para neutralizar a tripsina-EDTA a 0,25%. Recolha a mistura de células e transfira-a para um tubo cónico de 50 ml. Lavar o balão de cultura de células com 10 ml de meio de cultura e recolher as células num tubo de 50 ml utilizando uma pipeta serológica estéril.
- Centrifugue a mistura de células a 300 × g por 5 min. Descarte o sobrenadante, ressuspenda as células em 10 mL de meio de crescimento e conte o número de WJ-MSCs.
CUIDADO: Tenha cuidado para não descartar o pellet celular. - Semeie WJ-MSCs a uma densidade de 4.000-6.000 células/cm2, dependendo do experimento.
- Marcação de WJ-MSCs com corante DiD e a preparação de WJ-MSCs para injeção intraespinhal
NOTA: O procedimento de rotulagem do corante DiD foi realizado seguindo as instruções do fabricante.- Retire as WJ-MSCs quando atingirem 80% de confluência, usando o procedimento mencionado acima. Suspenda WJ-MSCs a uma densidade de 1 × 106 / mL em meio essencial mínimo (MEM) sem vermelho de fenol α sem soro.
- Adicione 5 μL de solução de marcação DiD por 1 mL de suspensão celular; misture delicadamente com pipetagem.
- Incubar durante 15 min a 37 °C; Centrifugar a suspensão celular a 300 × g durante 5 min.
- Remova o sobrenadante e ressuspenda as WJ-MSCs em α MEM sem vermelho de fenol a uma densidade de 1 × 106 / 0,2 mL.
2. Injeção intraespinhal de WJ-MSCs
- Preparação para injeção intraespinhal
- Anestesiar ratos Sprague-Dawley de 6 semanas de idade com isoflurano a 5%; Em seguida, manter a anestesia com isoflurano a 2% durante todo o procedimento cirúrgico.
NOTA: Otimize as condições anestésicas antes de iniciar o experimento. - Depile a área cirúrgica usando um barbeador elétrico para pequenos animais.
NOTA: O barbeador elétrico pode ser substituído por um barbeador manual e gel de barbear. - Desinfetar a área cirúrgica com iodopovidona. Faça uma incisão de 3 cm na pele com uma lâmina cirúrgica. Ressecção a pele e o tecido muscular restantes usando uma lâmina cirúrgica e uma tesoura. Revele os processos espinhosos na lombar 2-3 (L2-3).
- Anestesiar ratos Sprague-Dawley de 6 semanas de idade com isoflurano a 5%; Em seguida, manter a anestesia com isoflurano a 2% durante todo o procedimento cirúrgico.
- Injeção de WJ-MSCs marcadas com DiD através da cavidade intraespinhal
- Coloque o rato em decúbito ventral. Flexione a coluna do rato adequadamente para aumentar a distância entre os processos espinhosos adjacentes, usando quantidades suficientes de tecido de papel ou outros materiais que possam ajudar a manter a posição apropriada.
- Encha uma seringa de 1 mL com 0,2 mL de WJ-MSCs marcados com DiD. Coloque uma combinação de seringa-agulha de 23 G verticalmente entre os processos espinhosos de L2 e L3 e insira a agulha até que ela toque o corpo vertebral.
- Quando a agulha tocar o corpo vertebral, retraia-a em aproximadamente 0,5 cm, colocando a ponta da agulha no canal vertebral. Incline a seringa e coloque a ponta da agulha de forma que aponte para a direção rostral. Injete WJ-MSCs na cavidade espinhal durante um período de 1 minuto.
NOTA: A velocidade de injeção deve ser otimizada com antecedência. - Após a injeção, remova completamente a seringa do canal espinhal. Suturar a incisão e, em seguida, desinfetar o local cirúrgico com iodopovidona.
- Tratamento pós-procedimento
- Estabilize e contenha o rato para evitar qualquer movimento, colocando-o de cabeça para baixo em um ângulo de 45° por 15 min, enquanto ainda estiver sob anestesia. Após 15 minutos, interrompa a anestesia e espere o rato acordar.
3. Avaliação da injeção intraespinhal
- Eutanásia dos ratos e isolamento do cérebro e da medula espinhal 0, 6 e 12 h após a injeção
- Anestesiar os animais experimentais com isoflurano a 5%; manter a anestesia com isoflurano a 2% durante a perfusão da PBS.
- Faça uma incisão abaixo do diafragma usando uma tesoura cirúrgica. Abra a incisão com uma pinça e corte a caixa torácica rostralmente para expor o coração.
- Faça um pequeno orifício no átrio direito e insira uma agulha borboleta no ventrículo esquerdo. Perfunda 100 mL de PBS frio no ventrículo esquerdo por 4-5 min, até que o fígado esteja livre de sangue.
- Após a perfusão, faça uma longa incisão na parte de trás da cabeça à cauda usando uma lâmina cirúrgica ao longo do plano longitudinal. Isole o cérebro restante e toda a coluna usando uma tesoura cirúrgica, fórceps e um cortador de ossos. Remova as costelas restantes, os ossos conectados e a carne.
- Imagem óptica fluorescente DiD ex vivo
- Coloque os tecidos isolados na câmara do dispositivo de imagem óptica.
- Defina os parâmetros da seguinte forma: emissão, 700 nm; excitação, 605 nm; e tempo de exposição, 2 segundos, como fótons por segundo por centímetro quadrado por esterradiano (p / s / cm2 / sr). Capture as imagens ópticas.
NOTA: Todas as imagens devem ser adquiridas com configurações de iluminação idênticas (lamp voltage, filtros, f/stop, campo de view e binning). - Desenhe três regiões retangulares de interesse (ROIs) de tamanho equivalente para a medula espinhal e uma ROI circular para o cérebro usando a ferramenta de desenho. Meça as intensidades fluorescentes dos ROIs.
- Extração de DNA genômico (gDNA) da medula espinhal e do tecido cerebral
- Remova o crânio e a coluna cuidadosamente usando pinças cirúrgicas, tesouras e um rongeur.
- Colha o cérebro e a medula espinhal do crânio e da coluna. Corte a medula espinhal em três partes (cervical, torácica e lombar).
NOTA: Os tecidos colhidos devem ser armazenados a -80 °C se não forem analisados imediatamente. - Triture os lenços usando um almofariz pré-resfriado, pilão e nitrogênio líquido. Extraia gDNA usando produtos comerciais, seguindo as instruções do fabricante.
- Reação em cadeia da polimerase quantitativa em tempo real (qPCR)
- Quantificar a quantidade de gDNA em cada amostra usando um espectrofotômetro.
- Realize qPCR usando 10 ng de gDNA por amostra e primers humanos para Arthrobacter luteus (ALU)12,21.
- Calcular o número exacto de WJ-MSC nas amostras utilizando o método ΔΔCT 22.
Resultados
Para avaliar a eficácia da injeção intraespinhal de MSCs, MSCs marcadas com DiD foram usadas no presente estudo. Antes de injetar MSCs na cavidade espinhal, a eficácia da marcação foi avaliada in vitro usando imagens ópticas e microscopia de fluorescência (Figura 1). Após a coloração das MSCs com o reagente de marcação DiD usando o procedimento descrito na seção 3.1 do protocolo, foram obtidas imagens ópticas das placas de cultura nas quais as MSCs marcadas com DiD foram semeadas (Figura 1A). As MSCs marcadas com DiD (+DiD) são mostradas em vermelho; MSCs virgens (-DiD), que não foram marcadas com corante DiD, não mostraram um sinal positivo. Esse resultado foi confirmado por microscopia de fluorescência (Figura 1B). As MSCs também foram coradas com 4′,6-diamidino-2-fenilindol (DAPI) para visualizar sua forma. As MSCs virgens (-DiD) apareceram em azul, indicando coloração com DAPI ou coloração nuclear, mas não mostraram cor vermelha, que está associada à coloração DiD. Em contraste, as MSCs marcadas com DiD (+DiD) mostraram as cores azul e vermelha, indicando que o método de marcação DiD foi bem-sucedido.

Figura 1: Marcação DiD de MSCs in vitro. (A) As MSCs marcadas com DiD foram semeadas em uma placa de cultura de 6 poços e imagens ópticas foram realizadas. (B) As imagens foram tiradas por microscopia de fluorescência. Os núcleos das CTM são indicados em azul (DAPI), e o DiD incorporado está localizado no citosol das células +DiD (vermelho). Barras de escala = 500 μm. Essa figura foi modificada de Kim et al.12. Abreviaturas: -DiD = MSCs virgens, +DiD = MSCs marcadas com o reagente DiD; CTM = célula-tronco mesenquimal; DiD = DiIC18(5); sal de 4-clorobenzenossulfonato de 1,1-dioctadecil-3,3,3,3-tetrametilindodicarbocianina; DAPI = 4′,6-diamidino-2-fenilindo. Clique aqui para ver uma versão maior desta figura.
Em seguida, foi avaliado o método de injeção intraespinhal. Para avaliar e otimizar o procedimento de injeção intraespinhal, foi utilizado corante azul de tripano em vez de CTMs marcadas com DiD, conforme descrito na seção 2 do protocolo (Figura 2). O corante azul de tripano foi injetado e o rato foi sacrificado imediatamente. O tecido da medula espinhal colhido do rato foi cortado em três pedaços transversalmente e o cérebro foi cortado em cortes coronais. Verificou-se que o corante azul de tripano injetado havia manchado os tecidos da medula espinhal (medula lombar, torácica e cervical). Além disso, os lados inferior e superior do cérebro estavam manchados de azul. No entanto, o corante azul de tripano não penetrou no ventrículo lateral do cérebro. Esses resultados indicaram que esse método de injeção intraespinhal foi bem-sucedido.

Figura 2: Confirmação da injeção de cavidade intraespinhal em um modelo de rato. O corante azul de tripano foi injetado na cavidade espinhal de um rato de teste. Após a injeção, o rato foi sacrificado e uma necropsia foi realizada. O corante azul de tripano injetado através do canal espinhal migrou e corou a medula espinhal (lombar, torácica e cervical) e o cérebro azul. Barras de escala = 1 cm. Essa figura foi modificada de Kim et al.12. Clique aqui para ver uma versão maior desta figura.
Usando o protocolo otimizado com sucesso conforme descrito acima, as MSCs marcadas com DiD foram injetadas através da cavidade intraespinhal em ratos (Figura 3). Os ratos foram eutanasiados 0, 6 e 12 h após a injeção, e imagens ópticas ex vivo foram realizadas (Figura 3A). Em comparação com os sinais nos animais controle (sem injeção), sinais positivos altos e condensados foram detectados na medula espinhal lombar de ratos eutanasiados imediatamente após a injeção (0 h). Às 6 h após a injeção, o sinal positivo foi disperso por toda a medula espinhal lombar. Finalmente, sinais altamente positivos foram observados nas regiões da medula lombar e cervical e até mesmo no cérebro 12 h após a injeção. A intensidade do sinal das imagens ópticas foi quantificada em cada ponto de tempo usando um software de análise de imagem (Figura 3B). Um aumento significativo na intensidade do sinal foi identificado na medula espinhal lombar 0 h após a injeção e no cérebro 12 h após a injeção.

Figura 3: Análise de imagem óptica para avaliar a eficácia da injeção intraespinhal. (A) Após a injeção das MSCs na cavidade espinhal, os ratos foram eutanasiados nos seguintes momentos: 0, 6 e 12 h após a injeção, após o que a imagem óptica ex vivo foi realizada. O sinal positivo é mostrado na cor amarelo-vermelho. (B) A partir das imagens, as intensidades de sinal foram quantificadas por meio de software. Regiões de interesse equivalentes foram desenhadas para cada grupo experimental. Os dados são apresentados como a média ± erro padrão da média (EPM). *p < 0,05. Essa figura foi modificada de Kim et al.12. Abreviaturas: MSCs= células-tronco mesenquimais; CTL = controle. Clique aqui para ver uma versão maior desta figura.
Um estudo anterior relatou que a sequência de ALU humana pode ser usada como um marcador quantitativo para medir o número de células de origem humana, como células-tronco neurais e MSCs, no contexto do transplante de xenoenxerto 9,11,12. Seguindo as diretrizes do estudo anterior, a análise de qPCR usando um primer ALU específico para humanos foi usada no presente estudo para avaliar a distribuição in vivo e a migração de MSCs marcadas com DiD (Figura 4). Após a amplificação da sequência ULA, o produto da PCR foi separado em gel de agarose e visualizado (Figura 4A). Em comparação com a amostra de controle (o gDNA extraído do cérebro de ratos no grupo sem injeção), a sequência ALU foi altamente amplificada na amostra de 12 h (gDNA extraído do cérebro de ratos 12 h após a injeção). No entanto, em ambas as amostras, o Gapdh de camundongo foi altamente amplificado, indicando que as células de origem humana, especialmente as MSCs humanas usadas neste estudo, estavam presentes apenas na amostra do grupo de 12 horas. Em seguida, a distribuição das CTMs no cérebro e em outros órgãos (coração, pulmão, fígado, baço e rim) foi confirmada pelo mesmo método (Figura 4B). Semelhante aos resultados da imagem óptica, um número significativo de MSCs foi detectado apenas no cérebro 12 h após a injeção. As outras amostras mostraram variação na proporção de ALU para Gapdh, mas todos os sinais das amostras, exceto o cérebro 12 h após a injeção, estavam todos abaixo do limite de detecção, o que implica que nenhuma amplificação significativa ocorreu.
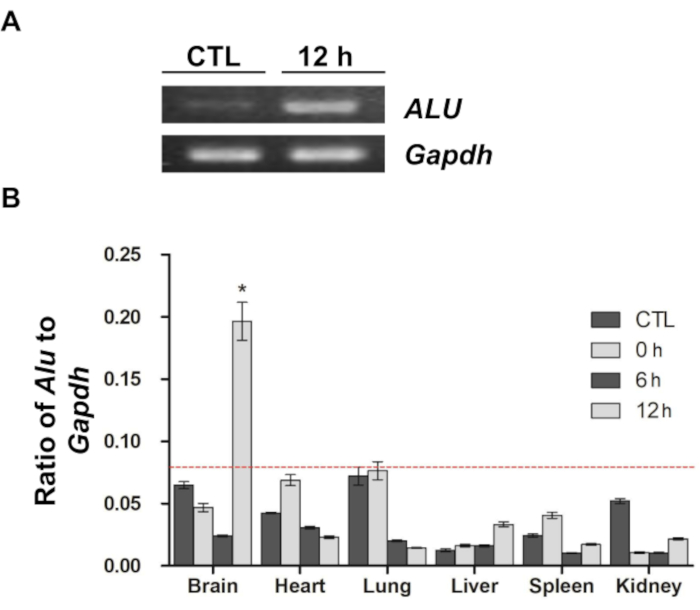
Figura 4: Reação em cadeia da polimerase quantitativa em tempo real para confirmar a distribuição e migração de MSCs. (A) Os produtos de PCR amplificados do DNA genômico cerebral extraído dos grupos controle e 12 h foram visualizados em um gel de agarose. ALU é um primer específico para humanos, e o primer Gapdh de camundongo foi usado para normalização. Os produtos de PCR amplificados são mostrados como faixas brancas intensas. (B) foi realizada análise de qPCR e calculada a proporção de ALU para Gapdh em cada amostra. A linha tracejada vermelha indica o limite de detecção na análise de PCR em tempo real. Os dados são apresentados como a média ± erro padrão da média (EPM). *p < 0,05. Essa figura foi modificada de Kim et al.12. Abreviaturas: ALU = Arthrobacter luteus; PCR = reação em cadeia da polimerase; qPCR = PCR quantitativo em tempo real; CTMs = células-tronco mesenquimais; Gapdh = gliceraldeído 3-fosfato desidrogenase. Clique aqui para ver uma versão maior desta figura.
Os resultados do presente estudo demonstram que as CTMs administradas por injeção intraespinhal foram distribuídas na região lombar em todos os momentos e migraram para o cérebro 12 h após a injeção.
Discussão
A via ideal de administração para o tratamento com MSCs deve ser escolhida dependendo da doença-alvo, da condição do paciente e do tipo de medicamento a ser administrado. Em terapias celulares, incluindo a terapia com MSC, a injeção direta de células-tronco no cérebro ou por via intratecal através do LCR deve ser considerada, pois as células não podem passar pela BHE19. A injeção intraespinhal é relativamente não invasiva e não causa danos neuronais no cérebro, ao contrário das injeções intracerebroventriculares, e está associada a um baixo risco de efeitos colaterais20. O acesso ao LCR por meio de uma punção lombar é um procedimento que pode ser realizado com muita facilidade em locais clínicos. Portanto, não é difícil administrar células-tronco, drogas, agentes de contraste ou outras substâncias aos pacientes por meio de injeções intraespinhais 23,24,25. Em contraste, as injeções intracerebroventriculares, que requerem intervenção cirúrgica, são mais complicadas. No entanto, para animais experimentais, a injeção na cavidade intraespinhal é mais difícil do que administrar agentes diretamente no cérebro. Isso ocorre porque os roedores, incluindo camundongos e ratos, são muito pequenos em comparação com os humanos26.
No caso de administração intraespinhal, a agulha deve ser inserida entre os processos espinhosos. Em comparação com as lacunas em humanos, as lacunas entre os ossos de um rato são muito estreitas, dificultando o acesso. Para superar isso, a agulha menor, idealmente uma agulha de 23 G, deve ser usada. Embora uma agulha de 26 G possa ser usada, uma agulha tão fina pode dobrar facilmente. O tamanho da agulha pode ser ajustado com base na idade do animal experimental. Além disso, para facilitar a administração da cavidade intraespinhal em um modelo de rato, é necessário flexionar a coluna, ampliando o espaço entre os processos espinhosos, facilitando o acesso da agulha ao espaço entre os processos espinhosos. O local da injeção e a direção da agulha também podem ser ajustados conforme necessário. As lacunas entre os processos espinhosos cervicais são relativamente maiores do que aquelas entre os processos espinhosos lombares. No entanto, se a injeção for realizada perto das porções cervical ou torácica da medula espinhal, a colocação incorreta da agulha pode causar sérios danos à medula espinhal, incluindo paralisia dos membros inferiores do animal ou paciente experimental.
Portanto, ao selecionar uma região superior da medula espinhal, deve-se tomar cuidado para evitar danos à medula espinhal e aos nervos. Nos humanos, a medula espinhal termina em L1-2, onde começa a cauda equina. A cauda equina é um feixe de nervos lombares e sacrais; portanto, a coluna lombar é um local relativamente mais seguro para injeção do que a coluna cervical ou torácica. Portanto, apenas a coluna lombar, particularmente a região sob L2 onde começa a cauda equina, é recomendada para injeção intraespinhal. Com base nessa consideração, a coluna lombar sob L2 foi selecionada para o presente estudo para minimizar o dano ao nervo espinhal. Para rastrear as células-tronco entregues à medula espinhal e ao cérebro, um reagente DiD foi usado para rotular as WJ-MSCs, que eram visíveis sob um microscópio de fluorescência e em experimentos de imagem óptica in vitro e ex vivo (Figura 1 e Figura 3). WJ-MSCs não marcadas não mostraram nenhuma fluorescência DiD positiva in vivo no grupo controle (sem injeção). Esses resultados indicam que o corante DiD lipofílico pode ser usado como agente de rastreamento para terapia com células-tronco. Atualmente, muitos agentes diferentes foram desenvolvidos para rastrear células-tronco transplantadas 27,28,29. Esses reagentes de rastreamento podem ser ajustados com base no equipamento usado para avaliação, como ressonância magnética, tomografia computadorizada e imagem óptica. Um estudo anterior relatou o uso de nanopartículas de ferro para rastrear MSCs entregues por injeção intracerebroventricular no cérebro 9,29. Assim, várias nanopartículas metálicas e agentes lipofílicos, como DiD, podem ser usados para rastreamento de células-tronco in vivo e ex vivo.
Para avaliar a migração e distribuição de WJ-MSCs administradas por injeção intraespinhal, a análise de qPCR foi realizada com um primer ALU . O objetivo primário do presente estudo foi otimizar o método de administração da cavidade intraespinhal e avaliar sua eficácia. Portanto, métodos de análise foram selecionados para rastrear e quantificar a distribuição geral e a migração de WJ-MSCs em todo o cérebro e medula espinhal em vários pontos de tempo. Por esse motivo, a imagem óptica foi realizada com o cérebro e a medula espinhal ainda conectados. Todo o cérebro ou medula espinhal (cervical, torácica e lombar) foi triturado, e o número exato de WJ-MSCs nesses tecidos foi calculado por meio de análise de qPCR com um primer ALU . Foi relatado que o primer específico para humanos ALU tem alta sensibilidade e especificidade para detectar células de origem humana entre células de roedores21. Além disso, o Ministério de Segurança de Alimentos e Medicamentos da Coréia recomenda o uso de primers de ALU humanos para avaliar a biodistribuição de células-tronco como parte dos dados pré-clínicos coletados para aprovação de novos medicamentos em investigação. Para identificar a localização exata das WJ-MSCs migrando em direção ao cérebro e à medula espinhal em diferentes momentos, a coloração imuno-histoquímica (IHQ) deve ser realizada. No entanto, a IHQ não foi realizada aqui, o que é uma limitação deste estudo.
Os pontos de tempo da eutanásia também devem ser selecionados adequadamente. A velocidade de migração das células-tronco em direção ao cérebro e o padrão de distribuição ao longo do neuroeixo dependem das substâncias liberadas e do estado dos animais ou pacientes experimentais. É importante determinar as características fisiológicas e químicas dos materiais injetados. Vários fatores, como tamanho, massa, lipofilicidade e meia-vida, podem afetar o tempo necessário para migrar para o cérebro e se dispersar por todo o sistema nervoso central (SNC). Por conseguinte, deve ser estabelecido um momento adequado para a eutanásia, de acordo com as propriedades da substância a administrar. Além disso, o estado físico do sujeito do teste também é importante. Tanto em pacientes quanto em modelos animais doentes, existem muitas substâncias, como citocinas inflamatórias e epítopos alvo, que podem atrair agentes terapêuticos (células-tronco, células imunológicas e anticorpos) para os locais das lesões. Portanto, levará menos tempo para que as WJ-MSCs cheguem ao cérebro se um modelo de doença do SNC for usado. No presente estudo, usando um modelo de rato selvagem, três pontos de tempo diferentes (0, 6 e 12 h) foram selecionados. Os animais experimentais no grupo 0 h foram sacrificados imediatamente após a injeção de células-tronco, e as WJ-MSCs foram detectadas apenas na medula espinhal lombar ao redor do local da injeção. Em contraste, WJ-MSCs foram observadas no cérebro e na medula espinhal cervical de ratos no grupo de 12 h, indicando que demorou no mínimo 12 h para que as WJ-MSCs migrassem para o cérebro e a medula cervical em um modelo de rato do tipo selvagem. Teoricamente, WJ-MSCs adicionais podem migrar para o cérebro com o passar do tempo, mas isso não foi avaliado ou comprovado no presente estudo.
A administração intraespinhal de CTMs tem a desvantagem de baixa eficiência de entrega ao cérebro em comparação com a administração intracerebroventricular ou intraparenquimatosa12. A primeira razão para isso é a distância do local de administração ao cérebro, e a segunda razão diz respeito ao fluxo liquórico. Como o LCR é produzido no plexo coróide localizado no ventrículo lateral do cérebro, o LCR flui do ventrículo lateral para a medula espinhal30. Portanto, neste estudo, os ratos foram colocados de cabeça para baixo em um ângulo de 45° por 15 min para auxiliar na migração de MSCs para o cérebro. Um ângulo maior ou um tempo de espera mais longo podem promover o aumento da migração de MSCs para o cérebro. Além disso, o volume, a velocidade e a dosagem da injeção podem ser modificados para obter uma entrega mais eficiente ao cérebro e à medula espinhal. O presente estudo apresenta um processo pelo qual as WJ-MSCs podem ser administradas através da cavidade intraespinhal em L2-3 e avaliou os padrões de migração e distribuição das células-tronco em 0, 6 e 12 h após a injeção em um modelo de rato. Embora apenas um pequeno número de WJ-MSCs entregues pela via da cavidade intraespinhal tenha se movido para o cérebro do rato no presente estudo, esse número pode ser aumentado ajustando várias variáveis. Os dados pré-clínicos fornecidos no presente estudo podem ser considerados como base científica para o uso clínico da injeção intraespinhal de terapia com células-tronco, imunoterapia e outras substâncias curativas.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este estudo foi apoiado por doações do Programa de Pesquisa Básica por meio da Fundação Nacional de Pesquisa da Coreia do Sul (NRF), financiada pelo Ministério da Educação (NRF-2017R1D1A1B03035940), e uma doação do Projeto de Pesquisa e Desenvolvimento de Tecnologia de Saúde da Coreia por meio do Instituto de Desenvolvimento da Indústria de Saúde da Coreia (KHIDI), financiado pelo Ministério da Saúde e Bem-Estar da República da Coreia (números de concessão: HI14C3484 e HI18C0560). Gostaríamos de agradecer à Editage (www.editage.co.kr) pela edição em inglês.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA | Gibco-invitrogen | 25200114 | Cell culture |
| Fetal bovine serum | biowest | S1520 | Culture medium supplement |
| gentamicin | Gibco-invitrogen | 15710-072 | Culture medium supplement |
| Gentra Puregene Tissue Kit | QIAGEN | 158689 | gDNA isolation |
| MEM, no glutamine, no phenol red | Gibco | 51200038 | WJ-MSC fomulation for injection |
| Miminum Essential Medium alpha | Gibco-invitrogen | 12571063 | WJ-MSC culture medium |
| Power SYBR Green PCR Master Mix | Applied Biosystems | 4368577 | quantitative real time PCR reagent |
| QuantStudio 6 Flex Real-Time PCR System | Thermo fisher | 4485694 | quantitative real time PCR |
| trypan blue | Gibco | 15250061 | Injection |
| Vybrant DiD Cell-Labeling Solution | invitrogen | V22887 | Stem cell labeling solution |
| Xenogen IVIS Spectrum system | Perkin Elmer | 124262 | Optical imaging device |
Referências
- Gnecchi, M., Danieli, P., Malpasso, G., Ciuffreda, M. C. Paracrine mechanisms of mesenchymal stem cells in tissue repair. Methods in Molecular Biology. 1416, 123-146 (2016).
- Liang, X., Ding, Y., Zhang, Y., Tse, H. F., Lian, Q. Paracrine mechanisms of mesenchymal stem cell-based therapy: current status and perspectives. Cell Transplantation. 23 (9), 1045-1059 (2014).
- Kang, J. M., Yeon, B. K., Cho, S. J., Suh, Y. H. Stem cell therapy for Alzheimer's disease: a review of recent clinical trials. Journal of Alzheimer's Disease. 54 (3), 879-889 (2016).
- Staff, N. P., Jones, D. T., Singer, W. Mesenchymal stromal cell therapies for neurodegenerative diseases. Mayo Clinic Proceedings. 94 (5), 892-905 (2019).
- Kim, J., et al. Mesenchymal stem cell therapy and Alzheimer's disease: current status and future perspectives. Journal of Alzheimer's Disease. 77 (1), 1-14 (2020).
- Florea, V., Bagno, L., Rieger, A. C., Hare, J. M. Attenuation of frailty in older adults with mesenchymal stem cells. Mechanisms of Ageing Development. 181, 47-58 (2019).
- Karp, J. M., Leng Teo, G. S. Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell. 4 (3), 206-216 (2009).
- Regmi, S., Pathak, S., Kim, J. O., Yong, C. S., Jeong, J. H. Mesenchymal stem cell therapy for the treatment of inflammatory diseases: Challenges, opportunities, and future perspectives. European Journal of Cell Biology. 98 (5-8), 151041(2019).
- Kim, H. S., et al. Lowering the concentration affects the migration and viability of intracerebroventricular-delivered human mesenchymal stem cells. Biochemical and Biophysical Research Communications. 493 (1), 751-757 (2017).
- Kim, D. H., et al. Effect of growth differentiation factor-15 secreted by human umbilical cord blood-derived mesenchymal stem cells on amyloid beta levels in in vitro and in vivo models of Alzheimer's disease. Biochemical and Biophysical Research Communications. 504 (4), 933-940 (2018).
- Park, S. E., et al. Distribution of human umbilical cord blood-derived mesenchymal stem cells (hUCB-MSCs) in canines after intracerebroventricular injection. Neurobiology of Aging. 47, 192-200 (2016).
- Kim, H., et al. Intrathecal injection in a rat model: a potential route to deliver human Wharton's jelly-derived mesenchymal stem cells into the brain. International Journal of Molecular Sciences. 21 (4), 1272(2020).
- Daneman, R., Prat, A. The blood-brain barrier. Cold Spring Harbor Perspectives Biology. 7 (1), 020412(2015).
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Banks, W. A. From blood-brain barrier to blood-brain interface: new opportunities for CNS drug delivery. Nature Reviews Drug Discovery. 15 (4), 275-292 (2016).
- Pardridge, W. M. CSF, blood-brain barrier, and brain drug delivery. Expert Opinion on Drug Delivery. 13 (7), 963-975 (2016).
- Elia, C. A., et al. Intracerebral injection of extracellular vesicles from mesenchymal stem cells exerts reduced Aβ plaque burden in early stages of a preclinical model of Alzheimer's disease. Cells. 8 (9), 1059(2019).
- Kim, H. J., et al. Stereotactic brain injection of human umbilical cord blood mesenchymal stem cells in patients with Alzheimer's disease dementia: A phase 1 clinical trial. Alzheimer's & Dementia (N Y). 1 (2), 95-102 (2015).
- Park, S. E., Lee, N. K., Na, D. L., Chang, J. W. Optimal mesenchymal stem cell delivery routes to enhance neurogenesis for the treatment of Alzheimer's disease: optimal MSCs delivery routes for the treatment of AD. Histology & Histopathology. 33 (6), 533-541 (2018).
- Sandow, B. A., Donnal, J. F. Myelography complications and current practice patterns. American Journal of Roentgenology. 185 (3), 768-771 (2005).
- Funakoshi, K., et al. Highly sensitive and specific Alu-based quantification of human cells among rodent cells. Scientific Reports. 7 (1), 13202(2017).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Glass, J. D., et al. Lumbar intraspinal injection of neural stem cells in patients with amyotrophic lateral sclerosis: results of a phase I trial in 12 patients. Stem Cells. 30 (6), 1144-1151 (2012).
- Harris, V. K., et al. Clinical and pathological effects of intrathecal injection of mesenchymal stem cell-derived neural progenitors in an experimental model of multiple sclerosis. Journal of the Neurological Sciences. 313 (1-2), 167-177 (2012).
- Janson, C. G., Ramesh, T. M., During, M. J., Leone, P., Heywood, J. Human intrathecal transplantation of peripheral blood stem cells in amyotrophic lateral sclerosis. Journal of Hematotherapy and Stem Cell Research. 10 (6), 913-915 (2001).
- Chiu, C., et al. Temporal course of cerebrospinal fluid dynamics and amyloid accumulation in the aging rat brain from three to thirty months. Fluids Barriers CNS. 9 (1), 3(2012).
- Bull, E., et al. Stem cell tracking using iron oxide nanoparticles. International Journal of Nanomedicine. 9, 1641-1653 (2014).
- Chen, D., et al. Bright polymer dots tracking stem Cell engraftment and migration to injured mouse liver. Theranostics. 7 (7), 1820-1834 (2017).
- Lee, N. K., et al. Magnetic resonance imaging of ferumoxytol-labeled human mesenchymal stem cells in the mouse brain. Stem Cell Reviews and Reports. 13 (1), 127-138 (2017).
- Bradley, W. G., Haughton, V., Mardal, K. A. Cerebrospinal fluid flow in adults. Handbook Clinical Neurology. 135, 591-601 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados