Method Article
Отличие внутрилегочных иммунных клеток от внутрисосудистых иммунных клеточных популяций: внутрияремный доступ
В этой статье
Резюме
Целью настоящего исследования является описание протокола дифференциации внутрисосудистых и интрапаренхиматозных иммунных клеток в исследованиях воспаления легких. Мы используем внутрияремную инъекцию флуоресцентного меченого антитела перед забором легких. Кроме того, мы используем процесс переваривания легких, основанный на инфляции, для улучшения выхода лейкоцитов из легких.
Аннотация
Циркадные ритмы относятся к колебаниям в различных биологических процессах, которые происходят с периодом в 24 часа. На молекулярном уровне такие ритмы состоят из сети транскрипционно-трансляционных петель обратной связи (TTFL) генов основных часов. Отдельные ткани и системы органов, в том числе и иммунная система, имеют свои часы. В системном кровообращении различные члены популяции CD45+ колеблются в течение дня; однако многие из этих ритмов не идентичны или даже не сходны в популяции CD45+ лейкоцитов, резидентных в тканях. При изучении роли циркадной регуляции воспаления легких, может потребоваться исследование CD45+ в легких. Однако, несмотря на оптимизированные методы перфузии, лейкоциты, захваченные из кровообращения, сохраняются в легких. Целью разработки этого протокола было различие между внутрисосудистыми и внутрипаренхиматозными лейкоцитами. С этой целью мышам вводят флуоресцентное меченое антитело к CD45 внутрияремное незадолго до забора легких. После этого легкое переваривается с использованием специальной техники разложения легких для получения суспензии из одной клетки. Образец окрашивают на обычную панель антител к интрапаренхиматозным иммунным клеткам (включая другое антитело к CD45). Проточно-цитометрический анализ показывает четкое выяснение популяций. Таким образом, метод маркировки и определения внутрилегочных CD45+ клеток будет особенно важен в тех случаях, когда поведение внутрилегочных и циркулирующих иммунных клеток численно и функционально различается.
Введение
Здесь описаны эффективные и достоверные методы дифференциации внутрисосудистых лейкоцитов от легочных лейкоцитов. Исследования показали, что даже при использовании самых лучших методов перфузии остаточный CD45+ от циркуляции сохраняется в легких. Это ухудшает способность различать ритмы в кровообращении и легких. Этот эффект еще больше усиливается в случаях воспаления легких. Это особенно актуально для изучения циркадной регуляции воспаления.
Циркадные ритмы относятся к суточным колебаниям в различных биологических процессах, происходящих с периодом 24 ч. Циркадная система является эволюционно консервативным упреждающим механизмом, который обеспечивает защиту хозяина, когда он сталкивается с изменениями в окружающей среде, такими как угроза инфекций. На клеточном уровне часы организованы в самоподдерживающиеся транскрипционно-трансляционные петли обратной связи, содержащие основные гены часов1. Иммунная система имеет свои собственные часы, которые влияют на ее реакцию на патогенные микроорганизмы и воспалительные процессы 2,3. Поскольку циркадные ритмы постоянно подвергаются воздействию окружающей среды, циркадные ритмы особенно важны в легких4. Различные иммунные процессы в легких находятся под круглосуточным контролем 5,6,7. Однако фаза различных биологических процессов в легких и системном кровотокене является одним и тем же8, что, в свою очередь, также предполагает, что колебания лейкоцитов в легких и циркуляции могут быть неидентичными. Таким образом, наличие метода эффективного различения легочных и внутрисосудистых лейкоцитов будет иметь решающее значение в циркадном контексте.
Целью данного исследования было разработать метод, который мог бы надежно дифференцировать внутрисосудистые и внутрипаренхиматозные лейкоциты. Для этого мы использовали мечение внутрисосудистых лейкоцитов и метод переваривания легких. Для мечения внутрисосудистых лейкоцитов мы используем внутрияремную инъекцию, которая нацелена на крупный кровеносный сосуд и может быть воспроизведена у мышей всех штаммов и размеров. Во многих других методах использовалась инъекция в хвостовую вену 9,10, которая, как известно, сложнее выполнить у мышей Bl611. Внутрияремная инъекция требует использования анестезии и лучше всего проводится под прямой визуализацией с помощью препарирующего микроскопа или увеличительной лупы. Таким образом, легкость и надежность внутрияремной инъекции следует сопоставлять с необходимостью анестезии и специального оборудования. Однако, учитывая доступность этого оборудования в большинстве исследовательских лабораторий, мы не считаем это ограничивающим фактором. Тем не менее, рассмотрение каждого конкретного случая кажется разумным.
протокол
Все исследования на животных были одобрены Комитетом по уходу за животными и их использованию Пенсильванского университета и соответствовали положениям Руководства по уходу и использованию лабораторных животных.
Примечание: Общий процесс может быть разделен на 1) внутривенное мечение CD45, 2) забор, 3) переваривание и 4) окрашивание и проточную цитометрию. Эти шаги кратко изложены на рисунке 1.
1. Приготовление растворов/реагентов
- Приготовьте диссоциативную среду, добавив 5 мл 2 мМ L-глутамина, 20 мл фетальной сыворотки крупного рогатого скота (FBS), 1 мл 2-меркаптоэтанола и 10 мл Pen/Strep к 500 мл DMEM.
ПРИМЕЧАНИЕ: Диссоциативные среды стабильны до 2 месяцев при хранении при температуре 2-4 °C. - Приготовьте буфер для сортировки флуоресцентных активированных клеток (FACS), добавив 10 мл FBS и 500 мг азида натрия к 500 мл PBS без магния или кальция.
ПРИМЕЧАНИЕ: С добавлением азида натрия буфер FACS можно хранить при температуре 2-4 °C в течение нескольких месяцев. - В день сбора образца добавьте растворы ДНКазы и Либеразы в среду диссоциации в соотношении 1:100 (т. е. добавьте 10 мкл ДНКазы и Либеразы на каждый 1 мл диссоциационной среды).
ПРИМЕЧАНИЕ: Для каждой мыши для переваривания всего легкого требуется 10 мл/мышь, а для половины легкого требуется 5 мл/мышь.
2. Внутривенное мечение CD45
- Для этого эксперимента использовали взрослых мышей C57Bl6 в возрасте 8-12 недель.
- Обезболивайте мышей средствами по выбору. Для этой цели использовалась комбинация ксилазина и кетамина, но приемлемы и другие препараты. Цель состоит в том, чтобы получить умеренный или глубокий уровень анестезии, который длится около 5-10 минут.
ПРИМЕЧАНИЕ: Смесь для анестезии ксилазина и кетамина вводится внутрибрюшинно. Используйте 10-15 мг/кг ксилазина и 120-150 мг/кг кетамина. - Как только педальный рефлекс станет отрицательным, положите животное на спину и аккуратно обмотайте его конечности скотчем, чтобы голова была как можно ближе к центру.
- Обнажите яремную вену и грудную мышцу, приподняв кожу щипцами и отрезав острыми хирургическими ножницами.
- Введите 200 мкл антитела против CD45 (антитело класса проточной цитометрии; разведенное в соотношении 1:300 в PBS) в яремную вену с помощью иглы 28 G. Подождите 2-4 минуты, чтобы антитело могло циркулировать по всей сосудистой сети.
ПРИМЕЧАНИЕ: Введение через грудную мышцу в яремную вену под небольшим углом предотвращает значительное кровотечение. - После этого усыпьте животное путем воздействия CO2 в течение 10 минут. Приступайте к перфузии легких и забору легких и других тканей.
ПРИМЕЧАНИЕ: Любой другой метод гуманной эвтаназии, который соответствует рекомендациям AVMA по эвтаназии животных, также приемлем.
3. Вскрытие/сбор урожая (Рисунок 1)
- Расположите животное на спине на плоской доске и прижмите лапы вниз, держа голову в центре.
- Опрыскайте тело 70% этанолом. Откройте грудную полость с помощью щипцов и ножниц, чтобы обнажить легкое, сердце и трахею.
- Перфузируйте легкое, сделав небольшой разрез в левом желудочке сердца и введя 10 мл холодного PBS через правый желудочек.
- Отрежьте отверстие в трахее и введите внутривенную канюлю. Как только канюля будет вставлена, проденьте шовный шов длиной около 6-8 см под трахею и дважды завяжите его к канюле.
- Вставьте хирургический нить в канюлю и присоедините шприц, содержащий диссоциативные среды (5 мл для половины легкого или 10 мл для всего легкого), как показано на рисунке 1B.
- Аккуратно отрежьте легкое от остальной части тела и поместите шприц с прикрепленным легким в коническую трубку объемом 50 мл.
4. Разложение до одноклеточной суспензии
- Инкубируйте легкое при температуре 37 °C в течение 30-40 минут, вводя 1 мл (на половину легкого) или 2 мл (на все легкое) диссоциативной среды каждые 5 минут.
- После того, как вся среда будет введена, извлеките шприц и канюлю и поместите коническую трубку объемом 50 мл в водяную баню со скоростью 180 об/мин на оставшуюся часть инкубации для лучшего выхода.
ПРИМЕЧАНИЕ: В качестве альтернативы, пробирки можно вручную встряхивать каждые 5 минут. - Добавьте 10 мл PBS и энергично встряхивайте в течение 1 минуты, чтобы остановить реакцию.
- Пропустите раствор через сетчатое фильтр (70 мкм) в новую коническую пробирку объемом 50 мл. Используйте резиновую пробку шприца объемом 5 мл, чтобы пропустить любые комки ткани через ситечко. Добавьте PBS так, чтобы итоговый объем составил 30 мл.
- Центрифугируйте образцы в течение 10 минут при 1 200 x g и 4 °C. Выбросьте надосадочную жидкость, не потревожив гранулы. Отпишите остатки раствора.
- Добавьте 1 мл буфера для лизиса эритроцитов (RBC) и смешайте с клеточной гранулой с помощью пипетирования.
- Выдерживать при комнатной температуре в течение 60-90 с. Добавьте PBS так, чтобы итоговый объем составил 30 мл, чтобы остановить реакцию.
ПРИМЕЧАНИЕ: Время инкубации зависит от количества крови в клеточной грануле; Чем краснее клеточная гранула, тем дольше время инкубации. - Центрифугируйте образцы в течение 10 минут при 1 200 x g и 4 °C. Выбросьте надосадочную жидкость, не потревожив гранулы. Отпишите остатки раствора.
- Добавьте 1 мл буфера FACs в клеточную гранулу и перемешайте с помощью пипетирования.
5. Окрашивание клеток для проточной цитометрии
- Используйте счетчик клеток для определения общего количества клеток в клеточной суспензии.
- Перенесите клеточную суспензию в каждую меченую пробирку FACS так, чтобы всего в образце было 3 x 106 клеток.
- Добавьте Fc Block (разбавленный 1:100) и выдержите 15 минут на льду.
- Центрифугируйте пробирки в течение 5 минут при температуре 1 200 x g и 4 °C. Выбросьте надосадочную жидкость, не потревожив гранулы.
- Окрасить образцы указанной смесью антител и инкубировать в течение 20 минут на защищенном от света льду (т.е. накрыв алюминиевой фольгой). Перемешивайте, прижимая пробирки к держателю пробирок в середине инкубации.
- Добавьте 1 мл буфера FACS для промывки и перемешайте с помощью пипетирования.
- Перенесите клеточную суспензию в другую пробирку FACS, медленно пипетируя суспензию через сетчатый фильтр 35 мкм.
- Центрифугируйте пробирки в течение 5 минут при температуре 1 200 x g и 4 °C. Выбросьте надосадочную жидкость, не потревожив гранулы.
- Добавьте 150 мкл буфера FACS и перемешайте с помощью пипетирования.
- Добавьте 10 μL DAPI (1:100) в каждую пробирку непосредственно перед запуском проб.
ПРИМЕЧАНИЕ: Теперь образцы готовы к запуску на проточном цитометре.
Результаты
Используя эту методику, общее количество клеток наивных диссоциированных легких (для репрезентативных данных использовались только левые доли) составило от 27,3 x 106 до 71,1 x 106 клеток/мл. После калибровки по размеру и удаления дублетов и мертвых клеток (схема стробирования на рисунке 2) количество лейкоцитов варьировалось от 6,9 x 106 до 13,5 x 106 клеток/мл. Циркулирующие лейкоциты, которые остаются в ловушке даже после перфузии для очистки легких, составляли примерно от 4% до 13% живых клеток в эксперименте. В то время как все лейкоциты в диссоциированных легких окрашивают CD45 на PE-Cy7, только циркулирующие лейкоциты подвергаются двойному окрашиванию антителом CD45 на обоих флуорофорах, PE-Cy7 и Pac blue. Несмотря на стандартизацию процесса перфузии, мы обнаружили, что от 24% до 70% от общего количества лейкоцитов в диссоциированном легком относятся к циркулирующему пулу лейкоцитов. Среднее количество лейкоцитов без учета внутрисосудистой маркировки составило 10,2 x 106 клеток/мл, в то время как скорректированное значение составило 4,93 x 106 клеток/мл (рис. 3A). Таким образом, неспособность дифференцировать остаточные внутрисосудистые лейкоциты, сохраняющиеся после перфузии, приводит к значительному завышению количества легочных лейкоцитов. Для этого эксперимента животные были в возрасте 8-12 недель и весили 25-30 г на момент вскрытия. Может потребоваться коррекция дозы для экстремальных возрастов и веса. Другие полезные меры контроля включают использование внутрисосудистого образца для демонстрации хорошего мечения внутрисосудистых лейкоцитов и образца из немеченой ткани (например, лимфатического узла) для исключения возможности диффузного мечения всех тканей путем трансмиграции меченых лейкоцитов из крови.
Поскольку исследовательские вопросы часто включают в себя циркадный отбор проб, мы далее разбили данные по времени суток (для животного), в которое был проведен забор легких. Согласно циркадному соглашению, ZT0 относится к времени, когда включается свет. Мы использовали рассвет (ZT23: начало фазы покоя) и сумерки (ZT11; начало активной фазы) в качестве двух временных точек. Мы отмечаем, что соотношение внутрипаренхиматозных и остаточных внутрисосудистых лейкоцитов варьировало в зависимости от времени суток при диссекции (рис. 3В). В этом эксперименте мышей поддерживали в обратных циклах свет-темнота (LD) с использованием циркадных коробок, контролируемых светом, так что мыши ZT11 и ZT23 находились в обратных фазах в одно и то же обычное время и могли быть собраны одновременно. Таким образом, легкие из обеих групп были помечены, собраны и переварены в одно и то же время суток, и поэтому эти различия на рисунке 3 не могут быть отнесены к различиям в обработке.

Рисунок 1: Схема раздувания легких и пищеварения. (А) Общий план эксперимента, начиная с обезболивания мышей и заканчивая этапом окрашивания антителами. (B) Изображение стадии введения канюли во время забора легких. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
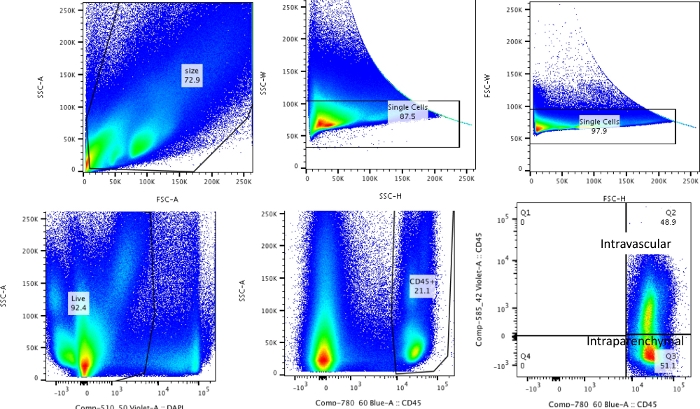
Рисунок 2: Стратегия стробирования. Стратегия стробирования используется для дифференциации внутрисосудистых лейкоцитов от лейкоцитов, которые действительно находятся в легких. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
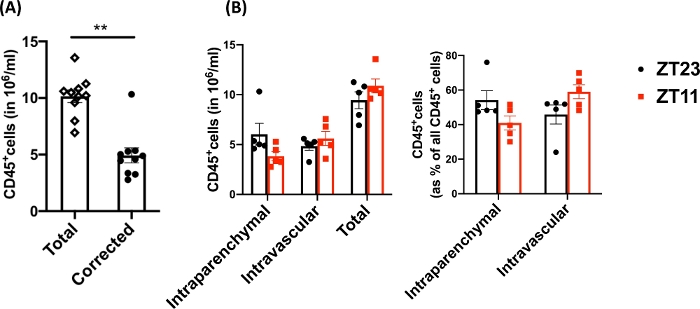
Рисунок 3: Сравнение внутрипаренхиматозных и внутрисосудистых лейкоцитов. (А) Количество лейкоцитов (в 10,6 клеток/мл) с использованием традиционного пищеварения и мечения по сравнению с количеством, скорректированным на остаточные внутрисосудистые лейкоциты, которые не были выведены из легких. P<0,0001 по t-критерию Стьюдента. ±(B) Количество лейкоцитов и процент лейкоцитов из легких, собранных на рассвете (ZT23) или в сумерках (ZT11). (правая панель) 2-way ANOVA, p >0,05 как для времени сбора урожая, так и для маркировки отсеков, но p<0,05 для взаимодействия. Данные представлены в виде среднего±SEM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Тщательные исследования воспаления легких и легочных иммунных реакций имеют решающее значение для понимания многих заболеваний. Проточная цитометрия обычно используется для подсчета и приписывания функциональной значимости легочным лейкоцитам. Функция лейкоцитов зависит, по крайней мере частично, от того, где они обнаружены. Несмотря на то, что накапливаются доказательства того, что даже после идеальных протоколов перфузии многие внутрисосудистые лейкоциты сохраняются в легких, большинство исследований не проводят дифференциации между внутрилегочными и внутрисосудистыми лейкоцитами. Кроме того, остаточные внутрисосудистые лейкоциты, которые остаются после перфузии в легких, вероятно, будут случайным образом распределены по образцам в зависимости от препарата, так что предсказать, как это повлияет на результаты, невозможно. Это затрудняет обобщение результатов и представляет угрозу для точности и воспроизводимости исследований, включающих проточную цитометрию12.
Здесь мы описали метод определения остаточных лейкоцитов из сосудистой сети и дифференциации их от истинно внутрилегочных лейкоцитов. Хотя такие методы использовались в прошлом 9,13,14, мы усовершенствовали маркировку, а также разложение, чтобы сделать его наиболее эффективным приготовлением. В других сообщениях описывается использование инъекций в ретроорбитальную или хвостовую вену для внутрисосудистого мечения10. Ретроорбитальные инъекции причиняют животному больше боли и, таким образом, требуют более высокого уровня контроля со стороны регулирующих органов. Хотя инъекция в хвостовую вену не требует анестезии, она технически болеесложна11, особенно у животных C57bl6. Этот внутрияремный подход преодолевает оба этих недостатка, делая процедуру относительно безболезненной и простой для выполнения под микроскопией. Несмотря на то, что мы описали здесь процедуру для молодых взрослых мышей, учитывая больший размер внутрияремной кости, этот протокол может быть использован для более мелких животных. Простота процедуры делает маркировку одинаковой для всех животных и, таким образом, повышает точность и воспроизводимость результатов.
Важнейшими этапами этого протокола являются воспроизводимость внутрисосудистой инъекции и забора легких. Некоторые дополнительные соображения, которые необходимы для внутрияремной инъекции, включают необходимость анестезии и увеличительного оборудования (увеличительные лупы или препарирующий микроскоп). Оба эти шага требуют практики для освоения и могут добавить вариативности, если не освоить их хорошо. При внутрияремной инъекции неправильная техника может привести к чрезмерному кровотечению и ускорить смерть. Таким образом, акцент делается на оборудовании, помогающем визуализации. В случае забора легких плохая техника может привести к разрыву трахеи. Несмотря на то, что можно использовать и другие методы переваривания легких (например, использовать скальпель для разрезания легкого и т.д.), по нашему опыту, это дает гораздо меньшее количество клеток и имеет тенденцию увеличивать вариабельность между образцами.
Еще одна важная проблема, возникающая в связи с любыми дополнительными шагами, заключается в том, что это увеличивает общее время обработки и может снизить жизнеспособность образцов и, следовательно, качество данных. Мечая внутрисосудистые лейкоциты перед перевариванием, мы гарантируем, что жизнеспособность приготовленного образца не будет негативно затронута в протоколе. Кроме того, используя технику надувания для распределения пищеварительных ферментов по всему легкому, мы гарантируем, что пищеварение равномерно и дает надежно больше клеток, чем другие методы диссоциации легочнойткани. Некоторые дополнительные проблемы, которые могут быть учтены, являются общими для этого метода мечения независимо от пути введения внутрисосудистого антитела. Это включает в себя возможное конкурентное связывание между двумя антителами к CD45. Это может быть частично смягчено путем использования различных клонов антитела к CD45, хотя необходимо позаботиться о том, чтобы два используемых антитела имели очень сходное сродство связывания. Другой аспект, который следует учитывать, заключается в том, достаточно ли времени от инъекции до забора (в данном случае 2-4 минуты) для мечения большинства внутрисосудистых лейкоцитов. Учитывая, что внутрисосудистое мечение предшествует общему мечению CD45, а также при частоте сердечных сокращений 300-700 ударов в минуту у мышей16, весьма вероятно, что имеет место полное мечение внутрисосудистого компартмента CD45. Этот метод был адаптирован у других, которые использовали очень похожие концентрации и время от введения до сбора урожая 9,10,13. Наконец, еще один вопрос, который следует рассмотреть, — это возможная миграция полученных лейкоцитов, технически в любом направлении во время от инъекции до сбора урожая. Это также может варьироваться в зависимости от исходных экспериментальных условий. Хотя здесь это не используется, одним из способов преодолеть это, по крайней мере, частично, было бы использование других стандартных методов эвтаназии, которые сокращают время от инъекции до забора, таких как вывих шейки матки.
Эта работа вращается вокруг выяснения циркадной регуляции повреждения легких, восстановления и регенерации. Хотя весь организм находится под циркадной регуляцией, фазы такой регуляции варьируются в зависимости от типа органа и клетки. Таким образом, фаза ритмов лейкоцитов или их функциональные подтипы могут быть разными в зависимости от органа или участка кровообращения. Отсутствие дифференциации этих двух популяций может фактически привести к ложноотрицательным результатам при анализе различных субпопуляций лейкоцитов (если циркулирующая и легочная популяции находятся в противоположной фазе, средние значения могут не сильно отличаться). Таким образом, дифференциация циркулирующих лейкоцитов, которые остаются в легких даже после перфузии, от тех, которые уже мигрировали в легкие и активно участвуют в воспалительном каскаде, имеет важное значение для открытия биологии циркадной регуляции. Описанный здесь протокол помогает этой дифференциации. Хотя мы сделали это в легких, этот метод можно адаптировать и для других органов. Тем не менее, добавление этих этапов продлевает время сбора урожая и может не подходить для всех циркадных экспериментов. Таким образом, это повлечет за собой индивидуальное рассмотрение вопроса о том, где дифференциация между внутрисосудистыми и внутрипаренхиматозными лейкоцитами является наиболее актуальной.
В заключение мы подробно описали метод дифференциации остаточных внутрисосудистых лейкоцитов от внутрилегочных и инфляционного переваривания легких. Эти методы повысят выход суспензии одиночных клеток из легких и улучшат точность и воспроизводимость исследований в области проточной цитометрии. Наконец, это особенно актуально для тех, кто изучает циркадные ритмы.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана NHLBI-K08HL132053 (SS). Авторы благодарят доктора Г. А. Фитцджеральда за доступ к препарирующему микроскопу и встряхивающей водяной бане.
Материалы
| Name | Company | Catalog Number | Comments |
| Boekel Scientific Medium Water Bath | Boekel Grant Scientific | 290200 | |
| 10 mL BD Syringes with BD Luer-Lok Tip | BD Biosciences | 309604 | |
| 5 mL BD Syringes with BD Luer-Lok Tip | BD Biosciences | 309646 | |
| Anti-CD45- Pac Blue | Biolegend | 103114 | |
| Anti-CD45- Pe/Cy7 | Biolegend | 103114 | |
| Cell strainer 70 µm Nylon | Fisher | 352350 | |
| Corning Conical-Bottom Centrifuge Tube 50 mL | Avantor | 21008-714 | |
| Corning Falcon Test Tube with Cell Strainer Snap Cap | EMSCO | 10004637 | |
| Dissection Microscope | Olympus | SZX-SDO2 | |
| DMEM, high glucose | Life Technologies | 11965084 | |
| Dnase | Roche | 10104159001 | |
| DPBS without Ca++ & Mg++ | 14190136 | ||
| Fc Block | Biolegend | 101320 | |
| HyClone Fetal Bovine Serum | GE Healthcare | SH30071.03 | |
| L-Glutamine (200 mM) | Life Technologies | 25030-081 | |
| Liberase Research Grade | Sigma | 5401127001 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140-122 | |
| Precision Shaking Water Bath | Thermo Fisher | TSSWB15 | |
| Red Blood Cell Lysing Buffer | Sigma | R7757 | |
| Suture Silk 4-0 | Roboz | SUT-15-2 |
Ссылки
- Partch, C. L., Green, C. B., Takahashi, J. S. Molecular architecture of the mammalian circadian clock. Trends in Cell Biology. 24, 90-99 (2014).
- Man, K., Loudon, A., Chawla, A. Immunity around the clock. Science. 354, 999-1003 (2016).
- Haspel, J. A., et al. Perfect timing: circadian rhythms, sleep, and immunity - an NIH workshop summary. JCI Insight. 5, (2020).
- Nosal, C., Ehlers, A., Haspel, J. A. Why Lungs Keep Time: Circadian Rhythms and Lung Immunity. Annual Review of Physiology. 82, 391-412 (2020).
- Gibbs, J., et al. An epithelial circadian clock controls pulmonary inflammation and glucocorticoid action. Nature Medicine. 20, 919-926 (2014).
- Ehlers, A., et al. BMAL1 links the circadian clock to viral airway pathology and asthma phenotypes. Mucosal Immunology. 11, 97-111 (2018).
- Sengupta, S., et al. Circadian control of lung inflammation in influenza infection. Nature Communications. 10, 4107 (2019).
- Zhang, R., Lahens, N. F., Ballance, H. I., Hughes, M. E., Hogenesch, J. B. A circadian gene expression atlas in mammals: implications for biology and medicine. Proceedings of the National Academy of Sciences of the United States of America. 111, 16219-16224 (2014).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nature Protocols. 9, 209-222 (2014).
- Gibbings, S. L., Jakubzick, C. V. Isolation and Characterization of Mononuclear Phagocytes in the Mouse Lung and Lymph Nodes. Methods in Molecular Biology. 1809, 33-44 (2018).
- Vines, D. C., Green, D. E., Kudo, G., Keller, H. Evaluation of mouse tail-vein injections both qualitatively and quantitatively on small-animal PET tail scans. Journal of Nuclear Medicine Technology. 39, 264-270 (2011).
- Tighe, R. M., et al. Improving the Quality and Reproducibility of Flow Cytometry in the Lung. An Official American Thoracic Society Workshop Report. American Journal of Respiratory Cell and Molecular Biology. 61, 150-161 (2019).
- Anderson, K. G., et al. Cutting edge: intravascular staining redefines lung CD8 T cell responses. Journal of Immunology. 189, 2702-2706 (2012).
- Gibbings, S. L., et al. Three Unique Interstitial Macrophages in the Murine Lung at Steady State. American Journal of Respiratory Cell and Molecular Biology. 57, 66-76 (2017).
- Steel, C. D., Stephens, A. L., Hahto, S. M., Singletary, S. J., Ciavarra, R. P. Comparison of the lateral tail vein and the retro-orbital venous sinus as routes of intravenous drug delivery in a transgenic mouse model. Lab Animals (NY). 37, 26-32 (2008).
- Ho, D., et al. Heart Rate and Electrocardiography Monitoring in Mice. Current Protocols in Mouse Biology. 1, 123-139 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены