Method Article
폐내 면역 세포와 혈관 내 면역 세포 집단의 구별: 경정맥 내 접근법
요약
현재 연구의 목적은 폐 염증 연구에서 혈관 내 면역 세포와 실질 내 면역 세포를 구별하기 위한 프로토콜을 설명하는 것입니다. 우리는 폐 적출 전에 형광 태그가 붙은 항체를 경정맥 내 주사합니다. 또한, 우리는 인플레이션에 기반한 폐 소화 과정을 사용하여 폐에서 백혈구의 수율을 개선합니다.
초록
일주기 리듬은 24시간 주기로 발생하는 다양한 생물학적 과정의 진동을 나타냅니다. 분자 수준에서 이러한 리듬은 핵심 시계 유전자의 TTFL(transcriptional-translational feedback loops)의 웹으로 구성됩니다. 면역계를 포함한 개별 조직과 장기 시스템에는 자체 시계가 있습니다. 전신 순환에서 CD45+ 개체군의 다양한 구성원은 하루 종일 진동합니다. 그러나 이러한 리듬의 대부분은 조직에 상주하는 CD45+ 백혈구 집단에서 동일하지 않거나 유사하지 않습니다. 폐 염증의 일주기 조절의 역할을 연구할 때 폐 내 CD45+ 를 조사해야 할 수 있습니다. 그러나 최적화된 관류 방법에도 불구하고 순환에서 갇힌 백혈구는 폐에 남아 있습니다. 이 프로토콜을 설계하는 목적은 혈관 내 백혈구와 실질 내 백혈구를 구별하는 것이었습니다. 이를 위해 쥐는 폐 채취 직전에 형광 태그가 지정된 CD45 항체를 주정맥 주사합니다. 그 후, 폐는 맞춤형 폐 소화 기술을 사용하여 소화되어 단일 세포 현탁액을 얻습니다. 샘플은 실질내 면역 세포(다른 CD45 항체 포함)에 대한 일반 항체 패널에 대해 염색됩니다. 유세포 분석은 개체군에 대한 명확한 설명을 보여줍니다. 따라서 폐내 CD45+ 세포를 라벨링하고 정의하는 방법은 폐내 및 순환 면역 세포의 거동이 수치적으로나 기능적으로 구별되는 경우 특히 중요합니다.
서문
여기에서는 혈관 내 백혈구와 폐 백혈구를 구별하는 효율적이고 신뢰할 수 있는 방법을 설명합니다. 최고의 관류 기술을 사용하더라도 연구에 따르면 혈액 순환으로 인한 잔류 CD45+ 가 폐에 남아 있는 것으로 나타났습니다. 이것은 순환계와 폐의 리듬을 구별하는 능력을 손상시킵니다. 이 효과는 폐 염증의 경우 더욱 증폭됩니다. 이것은 특히 염증의 일주기 조절에 대한 연구와 관련이 있습니다.
일주기 리듬은 24시간 동안 발생하는 다양한 생물학적 과정의 일주일 진동을 나타냅니다. 일주기 시스템은 감염 위협과 같은 환경 변화에 직면할 때 숙주를 보호하는 진화적으로 보존된 예측 메커니즘입니다. 세포 수준에서 시계는 핵심 시계 유전자1을 구성하는 자체 유지 전사-번역 피드백 루프로 구성됩니다. 면역 체계는 병원체와 염증성 모욕에 대한 반응에 영향을 미치는 자체 시계를 가지고 있습니다 2,3. 환경에 지속적으로 노출되는 기관으로서 일주기 리듬은 폐에서 특히 중요합니다4. 폐의 다양한 면역 과정은 시계의 통제를 받습니다 5,6,7. 그러나 폐의 다양한 생물학적 과정과 전신 순환의 단계는 동일하지 않으며,8 이는 더 나아가 폐에서 백혈구의 진동과 순환이 동일하지 않을 수 있음을 시사합니다. 따라서 폐 백혈구와 혈관 내 백혈구를 효율적으로 구별할 수 있는 방법을 갖는 것은 일주기 맥락에서 매우 중요합니다.
이 연구의 목적은 혈관내 백혈구와 실질내 백혈구를 안정적으로 구별할 수 있는 방법을 고안하는 것이었습니다. 이를 위해 혈관 내 백혈구 라벨링과 폐 소화 방법을 사용했습니다. 혈관 내 백혈구 표지를 위해 우리는 큰 혈관을 표적으로 하고 모든 균주와 크기의 마우스에서 재현 가능하게 사용할 수 있는 경정맥 내 주사를 사용합니다. 다른 많은 방법들은 꼬리 정맥 주사 9,10을 사용했는데, 이는 Bl6 마우스에서 수행하기 어려운 것으로 악명이 높습니다11. 경정맥내 주사는 마취를 필요로 하며 해부 현미경 또는 확대경을 사용한 직접 시각화 하에서 가장 잘 수행됩니다. 따라서, 경정맥 내 주사의 용이성과 신뢰성은 마취 및 특수 장비의 필요성과 비교되어야 합니다. 그러나 대부분의 연구실에서 이러한 장비를 즉시 사용할 수 있다는 점을 감안할 때 이것이 제한 요인으로 간주되지 않습니다. 그러나 사례별로 고려하는 것이 현명해 보입니다.
프로토콜
모든 동물 연구는 펜실베니아 대학교 기관 동물 관리 및 사용 위원회의 승인을 받았으며 실험실 동물의 관리 및 사용 가이드의 규정을 충족했습니다.
참고: 전체 과정은 1) CD45 정맥 내 라벨링, 2) 수확, 3) 분해, 4) 염색 및 유세포 분석으로 나눌 수 있습니다. 이러한 단계는 그림 1에 요약되어 있습니다.
1. 용액/시약 준비
- 500mL의 DMEM에 2mM L-글루타민 5mL, 소 태아 혈청(FBS) 20mL, 2-메르캅토에탄올 1mL, 펜/스트렙 10mL를 첨가하여 해리 배지를 준비합니다.
참고: 해리 매체는 2-4°C에서 보관할 때 최대 2개월 동안 안정적입니다. - 마그네슘이나 칼슘이 없는 PBS 500mL에 FBS 10mL와 아지드화나트륨 500mg을 첨가하여 FACS(Fluorescence Activated Cell Sorting) 완충액을 준비합니다.
참고 : 아지드 나트륨을 첨가하면 FACS 버퍼를 2-4 °C에서 몇 달 동안 보관할 수 있습니다. - 시료 채취 당일에 DNase 및 Liberase 용액을 1:100 희석으로 Dissociation Media에 추가합니다(즉, Dissociation Media 1mL당 10μL의 DNase 및 Liverase 추가).
참고: 각 마우스에 대해 전체 폐를 소화하려면 10mL/마우스가 필요하고 폐의 절반을 소화하려면 5mL가 필요합니다.
2. CD45 정맥 주사 라벨링
- 이 실험에는 8-12주 된 성체 C57Bl6 마우스를 사용합니다.
- 선택한 약제로 마우스를 마취합니다. 이러한 목적으로 자일라진과 케타민의 조합이 사용되었지만, 다른 제제도 사용할 수 있습니다. 목표는 약 5-10분 동안 지속되는 중간 수준에서 깊은 수준의 마취를 받는 것입니다.
참고: 자일라진과 케타민 마취 혼합물은 복강내로 투여됩니다. 자일라진 10-15mg/kg과 케타민 120-150mg/kg을 사용하십시오. - 페달 반사가 음수가 되면 동물을 등에 눕히고 팔다리를 부드럽게 테이프로 감아 머리가 가능한 한 중앙에 있도록 합니다.
- 집게로 피부를 들어 올리고 날카로운 수술 용 가위로 잘라 경정맥과 가슴 근육을 노출시킵니다.
- 28G 바늘을 사용하여 200μL의 항-CD45 항체(유세포 분석 등급 항체, PBS에서 1:300으로 희석)를 경정맥에 주입합니다. 항체가 혈관 구조 전체를 순환할 수 있도록 2-4분 정도 기다립니다.
참고: 얕은 각도에서 가슴 근육을 통해 경정맥으로 들어가면 상당한 출혈이 발생하는 것을 방지할 수 있습니다. - 그 후 10분 동안 CO2 에 노출되어 동물을 안락사시킵니다. 폐 관류를 진행하고 폐 및 기타 조직을 채취합니다.
참고: 동물 안락사에 대한 AVMA 지침을 준수하는 다른 인도적 안락사 방법도 허용됩니다.
3. 해부/수확(그림 1)
- 동물을 평평한 보드에 등을 대고 놓고 머리를 중앙에 유지하면서 발을 아래로 고정합니다.
- 몸에 70% 에탄올을 뿌립니다. 집게와 가위로 흉강을 열어 폐, 심장, 기관을 노출시킵니다.
- 심장의 좌심실을 작게 절개하고 우심실을 통해 10mL의 차가운 PBS를 주입하여 폐를 관류합니다.
- 기관의 구멍을 잘라내고 정맥 캐뉼라를 삽입합니다. 캐뉼라가 들어가면 기관 아래에 약 6-8cm 길이의 봉합사 줄을 통과시키고 캐뉼라에 두 번 묶습니다.
- 수술용 끈을 캐뉼라에 밀어 넣고 그림 1B와 같이 해리 매체(폐 절반의 경우 5mL 또는 폐 전체의 경우 10mL)가 들어 있는 주사기를 부착합니다.
- 몸의 나머지 부분에서 폐를 부드럽게 잘라내고 폐가 부착된 주사기를 50mL 원뿔형 튜브에 넣습니다.
4. 단일 세포 현탁액에 대한 소화
- 37°C에서 30-40분 동안 폐를 배양하고 5분마다 1mL(폐의 절반) 또는 2mL(폐 전체)의 해리 매체를 주입합니다.
- 모든 배지가 주입되면 주사기와 캐뉼라를 제거하고 50mL 원뿔형 튜브를 180rpm의 진탕 수조에 넣어 나머지 배양 기간 동안 더 나은 수율을 얻습니다.
참고: 또는 5분마다 튜브를 수동으로 흔들 수 있습니다. - PBS 10mL를 넣고 1분 동안 세게 흔들어 반응을 멈춥니다.
- 용액을 셀 스트레이너(70μm)를 통해 새로운 50mL 코니컬 튜브에 넣습니다. 5mL 주사기 고무 마개를 사용하여 조직 덩어리를 여과기로 통과시킵니다. 최종 부피가 30mL가 되도록 PBS를 추가합니다.
- 1,200 x g 및 4 °C에서 10분 동안 샘플을 원심분리합니다. 펠릿을 방해하지 않고 상등액을 버리십시오. 남아 있는 용액을 피펫으로 빼냅니다.
- 적혈구(RBC) 용해 완충액 1mL를 추가하고 피펫팅으로 세포 펠릿과 혼합합니다.
- 실온에서 60-90초 동안 배양합니다. 반응을 중지하기 위해 최종 부피가 30mL가 되도록 PBS를 추가합니다.
알림: 배양 시간은 세포 펠릿에 있는 혈액의 양에 따라 다릅니다. 세포 펠릿이 붉을수록 배양 시간이 길어집니다. - 1,200 x g 및 4 °C에서 10분 동안 샘플을 원심분리합니다. 펠릿을 방해하지 않고 상등액을 버리십시오. 남아 있는 용액을 피펫으로 빼냅니다.
- 세포 펠렛에 1mL의 FAC 완충액을 추가하고 피펫팅으로 혼합합니다.
5. 유세포 분석을 위한 염색 세포
- 세포 계수기를 사용하여 세포 현탁액의 총 세포 수를 확인합니다.
- 세포 현탁액을 라벨링된 각 FACS 튜브로 옮겨 샘플당 총 3 x 106 개의 세포가 있도록 합니다.
- Fc 블록(1:100 희석)을 넣고 얼음에서 15분 동안 배양합니다.
- 튜브를 1,200 x g 및 4°C에서 5분 동안 원심분리합니다. 펠릿을 방해하지 않고 상등액을 버리십시오.
- 지정된 항체 혼합물로 샘플을 염색하고 빛으로부터 보호된 얼음 위에서 20분 동안 배양합니다(즉, 알루미늄 호일로 덮어). 배양 중간에 튜브 홀더에 튜브를 랙에 올려 혼합합니다.
- FACS 완충액 1mL를 추가하여 세척하고 피펫팅으로 혼합합니다.
- 35μm 스트레이너를 통해 현탁액을 천천히 피펫팅하여 세포 현탁액을 다른 FACS 튜브로 옮깁니다.
- 튜브를 1,200 x g 및 4°C에서 5분 동안 원심분리합니다. 펠릿을 방해하지 않고 상등액을 버리십시오.
- 150μL의 FACS 완충액을 추가하고 피펫팅으로 혼합합니다.
- 샘플을 실행하기 직전에 각 튜브에 10μL의 DAPI(1:100)를 추가합니다.
참고: 이제 샘플을 유세포 분석기에서 실행할 준비가 되었습니다.
결과
이 기술을 사용하여 나이브 해리된 폐의 총 세포 수(대표 데이터에는 왼쪽 엽만 사용됨)는 27.3 x 106 에서 71.1 x 106 cells/mL 사이였습니다. 크기에 대한 게이팅과 이중선과 사세포를 게이팅한 후( 그림 2의 게이팅 방식) 백혈구 수는 6.9 x 106 에서 13.5 x 106 cells/mL 사이였습니다. 폐를 청소하기 위해 관류한 후에도 갇혀 있는 순환 백혈구는 실험에서 살아있는 세포의 약 4%에서 13%를 구성했습니다. PE-Cy7에서 CD45로 해리된 폐의 모든 백혈구는 PE-Cy7에서 CD45로 염색되는 반면, 순환하는 백혈구만 형광단, PE-Cy7 및 Pac blue 모두에서 CD45 항체로 이중 염색됩니다. 관류 과정을 표준화했음에도 불구하고, 우리는 해리된 폐에 있는 전체 백혈구의 약 24%에서 70%가 순환하는 백혈구 풀에 속한다는 것을 발견했다. 혈관 내 표지를 고려하지 않은 평균 백혈구 수는 10.2 x 106 cells/mL였으며, 보정된 값은 4.93 x 106 cells/mL였습니다(그림 3A). 따라서 관류 후에도 남아 있는 잔류 혈관 내 백혈구를 구별하지 못하면 폐 백혈구 수를 현저히 과대평가하는 결과를 초래할 수 있습니다. 이 실험을 위해 동물은 생후 8-12주였고 해부 당시 체중은 25-30g이었습니다. 극단적인 연령과 체중에 따라 복용량 조정이 필요할 수 있습니다. 다른 유용한 대조군으로는 혈관 내 백혈구의 양호한 표지를 입증하기 위해 혈관 내 검체를 사용하는 것과 표지되지 않은 조직(예: 림프절)의 검체를 사용하여 혈액에서 표지된 백혈구의 이식에 의한 모든 조직의 확산 표지 가능성을 배제하는 것이 있습니다.
연구 질문은 종종 일주기 샘플링과 관련이 있기 때문에 폐 적출이 수행된 시간(동물의 경우)별로 데이터를 더 세분화했습니다. 일주기 규칙에 따라 ZT0은 조명이 켜지는 시간을 나타냅니다. 우리는 새벽(ZT23: 휴식 단계의 시작)과 황혼(ZT11, 활성 단계의 시작)을 두 개의 시점으로 사용했습니다. 우리는 실질내 백혈구와 잔류 혈관내 백혈구의 비율이 박리 시간에 따라 다르다는 점에 주목합니다(그림 3B). 이 실험에서 마우스는 빛으로 제어되는 일주기 상자를 사용하여 역-암흑(LD) 주기로 유지되어 ZT11 및 ZT23 마우스가 동일한 기존 시간에 역상에 있고 동시에 수확할 수 있었습니다. 따라서 두 그룹의 폐는 하루 중 동시에 라벨링, 수확 및 소화되었기 때문에 그림 3 의 이러한 차이는 가공의 차이에 기인할 수 없습니다.

그림 1: 폐 팽창 및 소화의 개략도. (A) 마우스의 마취부터 항체 염색 단계까지 전반적인 실험 설계. (B) 폐 수확물의 캐뉼라 삽입 단계 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
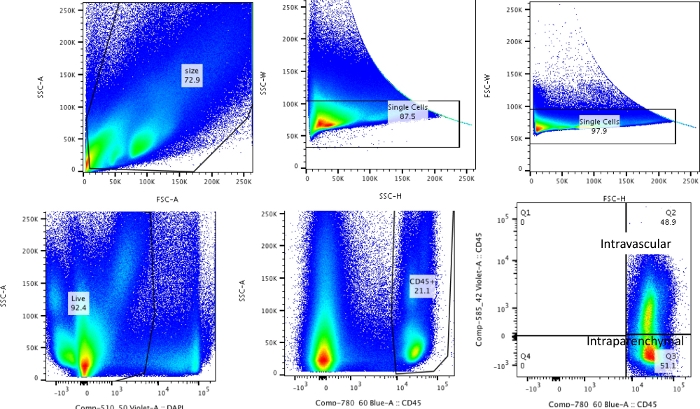
그림 2: 게이팅 전략. 혈관 내 백혈구와 실제로 폐에 거주하는 백혈구를 구별하는 데 사용되는 게이팅 전략. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
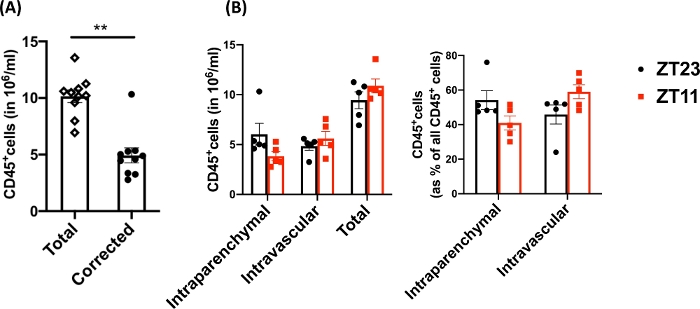
그림 3: 실질내 백혈구와 혈관내 백혈구 비교. (A) 폐에서 제거되지 않은 잔류 혈관 내 백혈구에 대해 보정된 수와 비교하여 전통적인 소화 및 라벨링을 사용한 백혈구 수(10,6 cell/mL 내). P<0.0001 스튜던트 t-검정에 의해. mean±SEM으로 표시되는 데이터. (B) 새벽(ZT23) 또는 황혼(ZT11)에 수확한 폐의 백혈구 수 및 비율. (오른쪽 패널) 2-way ANOVA, 수확 시기와 구획 라벨링 모두에 대해 p >0.05, 상호 작용에 대해 p<0.05. mean±SEM으로 표시되는 데이터. 이 수치의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
폐 염증 및 폐 면역 반응에 대한 신중한 연구는 많은 질병 상태를 이해하는 데 매우 중요합니다. 유세포 분석은 폐 백혈구에 대한 기능적 관련성을 열거하고 부여하는 데 일상적으로 사용됩니다. 백혈구의 기능은 적어도 부분적으로는 백혈구가 발견되는 위치에 달려 있습니다. 완벽한 관류 프로토콜 후에도 많은 혈관 내 백혈구가 폐에 잔존한다는 것을 뒷받침하는 축적된 증거가 있지만, 대부분의 연구에서는 폐내 백혈구와 혈관 내 백혈구를 구별하지 않습니다. 또한, 폐에 관류 후 남아 있는 잔류 혈관 내 백혈구는 제제에 따라 샘플 전체에 무작위로 분포될 가능성이 높기 때문에 결과에 어떤 영향을 미치는지 예측하는 것은 불가능합니다. 이는 결과의 일반화 가능성을 저해하고 유세포분석법(flowcytometry)12과 관련된 연구의 엄격성과 재현성에 위협이 됩니다.
우리는 여기에서 혈관 구조에서 잔류 백혈구를 측정하고 이를 실제 폐내 백혈구와 구별하는 방법을 설명했습니다. 이러한 방법은 과거 9,13,14년에 사용되었지만, 가장 효율적인 제제를 만들기 위해 라벨링과 분해를 개선했습니다. 다른 보고서에서는 혈관 내 표지를 위해 후궤도 또는 꼬리 정맥 주사를 사용하는 방법을 설명합니다10. 역안와 주사는 동물에게 더 많은 고통을 주므로 더 높은 수준의 규제 조사가 필요합니다. 꼬리 정맥 주사는 마취가 필요하지 않지만, 특히 C57bl6 동물에서 기술적으로 더 까다롭다11. 이 경정맥 내 접근법은 시술을 상대적으로 고통스럽지 않고 현미경 검사로 쉽게 수행할 수 있도록 함으로써 이러한 두 가지 단점을 모두 극복합니다. 여기서는 어린 성체 마우스에 대한 절차를 설명했지만, 경정맥내 마우스의 크기가 더 크기 때문에 이 프로토콜은 더 작은 동물에 사용될 수 있습니다15. 절차가 쉽기 때문에 동물 전체에 걸쳐 라벨링이 일관되게 유지되므로 결과의 엄격함과 재현성이 향상됩니다.
이 프로토콜의 중요한 단계에는 혈관 내 주사 및 폐 적출의 재현성이 포함됩니다. 경정맥내 주사에 필요한 몇 가지 추가 고려 사항은 마취 및 확대 장비(확대 또는 해부 현미경)의 필요성입니다. 이 두 단계 모두 마스터하려면 연습이 필요하며 잘 마스터하지 않으면 변동성이 추가될 수 있습니다. 경정맥 주사의 경우, 잘못된 기술로 인해 과도한 출혈이 발생하여 사망에 이를 수 있습니다. 따라서 시각화를 지원하는 장비에 중점을 둡니다. 폐 적출의 경우, 잘못된 기술로 인해 기관이 파열될 수 있습니다. 다른 폐 소화 방법(예: 메스를 사용하여 폐를 자르는 등)을 계속 진행할 수 있지만, 우리의 경험에 따르면 세포 수가 훨씬 적고 샘플 간의 변동성을 증가시키는 경향이 있습니다.
추가 단계에서 발생하는 또 다른 중요한 우려 사항은 총 처리 시간이 증가하고 샘플의 생존 능력과 데이터 품질이 저하될 수 있다는 것입니다. 분해 전에 혈관 내 백혈구를 라벨링함으로써 준비된 샘플의 생존력이 프로토콜에서 부정적인 영향을 받지 않도록 합니다. 또한, 소화 효소를 폐 전체에 분배하는 인플레이션 기법을 사용하여 소화가 균일하고 폐 조직을 해리하는 다른 방법보다 안정적으로 더 많은 세포를 산출하도록 합니다7. 고려될 수 있는 몇 가지 추가 우려 사항은 혈관 내 항체의 투여 경로와 무관하게 이 표지 방법에 공통적입니다. 여기에는 두 CD45 항체 간의 가능한 경쟁 결합이 포함됩니다. 이는 CD45 항체의 상이한 클론을 사용함으로써 부분적으로 완화될 수 있지만, 사용된 두 항체가 매우 유사한 결합 친화성을 갖도록 주의해야 합니다. 고려해야 할 또 다른 측면은 주입부터 채취까지의 시간(여기서는 2-4분)이 대부분의 혈관 내 백혈구를 라벨링하기에 충분한지 여부입니다. 혈관 내 표지가 전체 CD45 표지보다 선행하고 마우스16에서 분당 300-700 박동이라는 점을 감안할 때, 혈관 내 CD45 구획의 완전한 표지가 있을 가능성이 매우 높습니다. 이 방법은 9,10,13을 수확하기 위해 투여에서 매우 유사한 농도와 시간을 사용한 다른 사람들로부터 적용되었습니다. 마지막으로, 고려해야 할 또 다른 문제는 주입에서 수확까지의 시간에서 기술적으로 어느 방향으로든 생성된 백혈구의 전이 가능성입니다. 이는 기본 실험 조건에 따라 달라질 수도 있습니다. 여기서는 사용되지 않았지만, 적어도 부분적으로나마 이를 극복할 수 있는 한 가지 방법은 자궁경부 탈구와 같이 주사에서 적출까지의 시간을 단축하는 다른 표준 안락사 방법을 사용하는 것입니다.
이 연구는 폐 손상, 복구 및 재생의 일주기 조절에 대한 설명을 중심으로 진행됩니다. 몸 전체가 일주기 조절을 받지만, 이러한 조절의 단계는 장기와 세포 유형에 따라 다릅니다. 따라서, 백혈구의 리듬 단계 또는 기능적 아형은 순환 기관 또는 부위에 따라 다를 수 있습니다. 이 두 집단을 구별하지 않으면 실제로 다양한 백혈구 하위 집단의 분석에서 위음성 결과가 발생할 수 있습니다(순환 집단과 폐 집단이 반대 단계에 있는 경우 평균은 크게 다르지 않을 수 있음). 따라서 관류 후에도 폐에 남아 있는 순환 백혈구와 이미 폐로 이동하여 염증 폭포에 적극적으로 참여하는 백혈구를 구별하는 것은 일주기 조절의 생물학을 발견하는 데 필수적입니다. 여기에 설명된 프로토콜은 이러한 차별화에 도움이 됩니다. 우리는 폐에서 이 작업을 수행했지만 이 방법은 다른 기관에도 적용할 수 있습니다. 그러나 이러한 단계를 추가하면 수확 시간이 길어지며 모든 생체 주기 실험에 적합하지 않을 수 있습니다. 따라서 이를 위해서는 혈관내 백혈구와 실질내 백혈구를 구별하는 것이 가장 적절한 위치에 대한 맞춤형 고려가 수반됩니다.
결론적으로, 우리는 잔류 혈관 내 백혈구 및 폐 내 백혈구와 인플레이션 기반 폐 소화를 구별하는 방법을 자세히 설명했습니다. 이러한 기술은 폐에서 단세포 현탁액의 수율을 높이고 유세포 측정 연구의 엄격성과 재현성을 향상시킬 것입니다. 마지막으로, 이것은 일주기 리듬을 연구하는 사람들과 특히 관련이 있습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 작업은 NHLBI-K08HL132053(SS)의 지원을 받았습니다. 저자들은 G. A. FitzGerald 박사에게 해부 현미경과 흔들리는 수조를 사용할 수 있게 해준 것에 대해 감사를 표합니다.
자료
| Name | Company | Catalog Number | Comments |
| Boekel Scientific Medium Water Bath | Boekel Grant Scientific | 290200 | |
| 10 mL BD Syringes with BD Luer-Lok Tip | BD Biosciences | 309604 | |
| 5 mL BD Syringes with BD Luer-Lok Tip | BD Biosciences | 309646 | |
| Anti-CD45- Pac Blue | Biolegend | 103114 | |
| Anti-CD45- Pe/Cy7 | Biolegend | 103114 | |
| Cell strainer 70 µm Nylon | Fisher | 352350 | |
| Corning Conical-Bottom Centrifuge Tube 50 mL | Avantor | 21008-714 | |
| Corning Falcon Test Tube with Cell Strainer Snap Cap | EMSCO | 10004637 | |
| Dissection Microscope | Olympus | SZX-SDO2 | |
| DMEM, high glucose | Life Technologies | 11965084 | |
| Dnase | Roche | 10104159001 | |
| DPBS without Ca++ & Mg++ | 14190136 | ||
| Fc Block | Biolegend | 101320 | |
| HyClone Fetal Bovine Serum | GE Healthcare | SH30071.03 | |
| L-Glutamine (200 mM) | Life Technologies | 25030-081 | |
| Liberase Research Grade | Sigma | 5401127001 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140-122 | |
| Precision Shaking Water Bath | Thermo Fisher | TSSWB15 | |
| Red Blood Cell Lysing Buffer | Sigma | R7757 | |
| Suture Silk 4-0 | Roboz | SUT-15-2 |
참고문헌
- Partch, C. L., Green, C. B., Takahashi, J. S. Molecular architecture of the mammalian circadian clock. Trends in Cell Biology. 24, 90-99 (2014).
- Man, K., Loudon, A., Chawla, A. Immunity around the clock. Science. 354, 999-1003 (2016).
- Haspel, J. A., et al. Perfect timing: circadian rhythms, sleep, and immunity - an NIH workshop summary. JCI Insight. 5, (2020).
- Nosal, C., Ehlers, A., Haspel, J. A. Why Lungs Keep Time: Circadian Rhythms and Lung Immunity. Annual Review of Physiology. 82, 391-412 (2020).
- Gibbs, J., et al. An epithelial circadian clock controls pulmonary inflammation and glucocorticoid action. Nature Medicine. 20, 919-926 (2014).
- Ehlers, A., et al. BMAL1 links the circadian clock to viral airway pathology and asthma phenotypes. Mucosal Immunology. 11, 97-111 (2018).
- Sengupta, S., et al. Circadian control of lung inflammation in influenza infection. Nature Communications. 10, 4107(2019).
- Zhang, R., Lahens, N. F., Ballance, H. I., Hughes, M. E., Hogenesch, J. B. A circadian gene expression atlas in mammals: implications for biology and medicine. Proceedings of the National Academy of Sciences of the United States of America. 111, 16219-16224 (2014).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nature Protocols. 9, 209-222 (2014).
- Gibbings, S. L., Jakubzick, C. V. Isolation and Characterization of Mononuclear Phagocytes in the Mouse Lung and Lymph Nodes. Methods in Molecular Biology. 1809, 33-44 (2018).
- Vines, D. C., Green, D. E., Kudo, G., Keller, H. Evaluation of mouse tail-vein injections both qualitatively and quantitatively on small-animal PET tail scans. Journal of Nuclear Medicine Technology. 39, 264-270 (2011).
- Tighe, R. M., et al. Improving the Quality and Reproducibility of Flow Cytometry in the Lung. An Official American Thoracic Society Workshop Report. American Journal of Respiratory Cell and Molecular Biology. 61, 150-161 (2019).
- Anderson, K. G., et al. Cutting edge: intravascular staining redefines lung CD8 T cell responses. Journal of Immunology. 189, 2702-2706 (2012).
- Gibbings, S. L., et al. Three Unique Interstitial Macrophages in the Murine Lung at Steady State. American Journal of Respiratory Cell and Molecular Biology. 57, 66-76 (2017).
- Steel, C. D., Stephens, A. L., Hahto, S. M., Singletary, S. J., Ciavarra, R. P. Comparison of the lateral tail vein and the retro-orbital venous sinus as routes of intravenous drug delivery in a transgenic mouse model. Lab Animals (NY). 37, 26-32 (2008).
- Ho, D., et al. Heart Rate and Electrocardiography Monitoring in Mice. Current Protocols in Mouse Biology. 1, 123-139 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유