Method Article
Distinguere le cellule immunitarie intrapolmonari dalle popolazioni di cellule immunitarie intravascolari: l'approccio intragiugulare
In questo articolo
Riepilogo
Lo scopo del presente studio è quello di descrivere un protocollo per la differenziazione tra cellule immunitarie intravascolari e intraparenchimali negli studi sull'infiammazione polmonare. Usiamo un'iniezione intragiugulare di un anticorpo marcato con fluorescenza prima del prelievo polmonare. Inoltre, utilizziamo un processo di digestione polmonare basato sull'inflazione per migliorare la resa dei leucociti dal polmone.
Abstract
I ritmi circadiani si riferiscono a oscillazioni in vari processi biologici che si verificano con un periodo di 24 ore. A livello molecolare, tali ritmi sono costituiti da una rete di cicli di feedback trascrizionale-traduzionale (TTFL) di geni core clock. I singoli tessuti e sistemi di organi, compreso il sistema immunitario, hanno il proprio orologio. Nella circolazione sistemica, vari membri della popolazione CD45+ oscillano durante il giorno; tuttavia, molti di questi ritmi non sono identici o addirittura simili nella popolazione leucocitaria CD45+ residente nei tessuti. Quando si studia il ruolo della regolazione circadiana dell'infiammazione polmonare, potrebbe essere necessario studiare il CD45+ all'interno del polmone. Tuttavia, nonostante i metodi di perfusione ottimizzati, i leucociti intrappolati dalla circolazione persistono nei polmoni. L'obiettivo nella progettazione di questo protocollo è stato quello di distinguere tra leucociti intravascolari e intraparenchimali. A tal fine, ai topi viene iniettato un anticorpo CD45 marcato in fluorescenza per via intragiugulare poco prima del prelievo polmonare. Successivamente, il polmone viene digerito utilizzando una tecnica di digestione polmonare personalizzata per ottenere una sospensione di una singola cellula. Il campione viene colorato per il normale pannello di anticorpi per le cellule immunitarie intraparenchimali (incluso un altro anticorpo CD45). Le analisi flussocitometriche mostrano una chiara delucidazione delle popolazioni. Pertanto, il metodo di marcatura e definizione delle cellule CD45+ intrapolmonari sarà particolarmente importante laddove il comportamento delle cellule immunitarie intrapolmonari e circolanti è numericamente e funzionalmente distinto.
Introduzione
Descriviamo qui metodi efficienti e affidabili per differenziare i leucociti intravascolari dai leucociti polmonari. Anche con le migliori tecniche di perfusione, gli studi hanno rivelato che il CD45+ residuo dalla circolazione persiste nel polmone. Ciò compromette la capacità di distinguere tra i ritmi in circolo e nel polmone. Questo effetto è ulteriormente amplificato in caso di infiammazione polmonare. Ciò è particolarmente rilevante per lo studio della regolazione circadiana dell'infiammazione.
I ritmi circadiani si riferiscono alle oscillazioni diurne in vari processi biologici che si verificano con un periodo di 24 ore. Il sistema circadiano è un meccanismo anticipatorio evolutivamente conservato che conferisce protezione all'ospite mentre affronta cambiamenti nel suo ambiente come la minaccia di infezioni. A livello cellulare, l'orologio è organizzato in cicli di feedback trascrizionale-traduzionali autosufficienti che comprendono i geni dell'orologio centrale1. Il sistema immunitario ha un proprio orologio che influisce sulla sua risposta agli agenti patogeni e agli insulti infiammatori 2,3. Essendo un organo costantemente esposto all'ambiente, i ritmi circadiani sono particolarmente importanti nel polmone4. Vari processi immunitari nel polmone sono sotto controllo 5,6,7. Tuttavia, la fase dei vari processi biologici nel polmone e la circolazione sistemica non sono le stesse8, il che, per estensione, suggerisce anche che le oscillazioni dei leucociti nel polmone e la circolazione potrebbero non essere identiche. Pertanto, disporre di un metodo per distinguere in modo efficiente tra leucociti polmonari e intravascolari sarà fondamentale nel contesto circadiano.
Lo scopo di questo studio è stato quello di ideare un metodo in grado di differenziare in modo affidabile tra leucociti intravascolari e intraparenchimali. Per questo, abbiamo utilizzato una marcatura dei leucociti intravascolari e un metodo di digestione polmonare. Per la marcatura dei leucociti intravascolari, utilizziamo l'iniezione intragiugulare, che prende di mira un grande vaso sanguigno e può essere utilizzata in modo riproducibile in topi di tutti i ceppi e dimensioni. Molti altri metodi hanno utilizzato l'iniezione della vena caudale 9,10, che è notoriamente più difficile da eseguire nei topi Bl611. L'iniezione intragiugulare richiede l'uso dell'anestesia ed è meglio eseguirla sotto la visualizzazione diretta con microscopio da dissezione o lenti d'ingrandimento. Pertanto, la facilità e l'affidabilità dell'iniezione intragiugulare dovrebbero essere valutate rispetto alla necessità di anestesia e attrezzature speciali. Tuttavia, data la pronta disponibilità di queste apparecchiature nella maggior parte dei laboratori di ricerca, non riteniamo che questo sia un fattore limitante. Tuttavia, una considerazione caso per caso sembra prudente.
Protocollo
Tutti gli studi sugli animali sono stati approvati dal Comitato Istituzionale per la Cura e l'Uso degli Animali dell'Università della Pennsylvania e hanno soddisfatto le disposizioni della Guida per la cura e l'uso degli animali da laboratorio.
NOTA: L'intero processo può essere suddiviso in 1) marcatura endovenosa del CD45, 2) raccolta, 3) digestione e 4) colorazione e citometria a flusso. Questi passaggi sono stati riassunti nella Figura 1.
1. Soluzioni/Preparazione del reagente
- Preparare i terreni di dissociazione aggiungendo 5 ml di 2 mM di L-glutammina, 20 ml di siero fetale bovino (FBS), 1 ml di 2-mercaptoetanolo e 10 ml di penna/streptococco a 500 ml di DMEM.
NOTA: Il terreno di dissociazione è stabile fino a 2 mesi se conservato a 2-4 °C. - Preparare il tampone FACS (Fluorescence Activated Cell Sorting) aggiungendo 10 mL di FBS e 500 mg di sodio azide a 500 mL di PBS senza magnesio o calcio.
NOTA: Con l'aggiunta di sodio azide, il tampone FACS può essere conservato a 2-4 °C per mesi. - Il giorno della raccolta del campione, aggiungere le soluzioni DNase e Liberase ai mezzi di dissociazione a una diluizione di 1:100 (ad esempio, aggiungere 10 μL di DNase e Liberase per ogni 1 mL di terreno di dissociazione).
NOTA: Per ogni topo, la digestione dell'intero polmone richiede 10 ml/topo e metà del polmone richiede 5 ml/topo.
2. Marcatura endovenosa del CD45
- Per questo esperimento, utilizzare topi adulti C57Bl6 di età compresa tra 8 e 12 settimane.
- Anestetizzare i topi con agenti di scelta. A questo scopo è stata utilizzata una combinazione di xilazina e ketamina, ma sono accettabili anche altri agenti. L'obiettivo è ottenere un livello di anestesia da moderato a profondo che duri circa 5-10 minuti.
NOTA: La miscela per anestesia xilazina e ketamina viene somministrata per via intraperitoneale. Utilizzare 10-15 mg/kg di xilazina e 120-150 mg/kg di ketamina. - Una volta che il riflesso del pedale è negativo, posiziona l'animale sulla schiena e fissa delicatamente gli arti con del nastro adesivo per mantenere la testa il più centrale possibile.
- Esporre la vena giugulare e il muscolo pettorale sollevando la pelle con una pinza e tagliando con forbici chirurgiche affilate.
- Iniettare 200 μL di anticorpo anti-CD45 (anticorpo di grado per citometria a flusso; diluito 1:300 in PBS) nella vena giugulare utilizzando un ago da 28 G. Attendere 2-4 minuti in modo che l'anticorpo possa circolare in tutto il sistema vascolare.
NOTA: L'ingresso attraverso il muscolo pettorale nella vena giugulare da un angolo poco profondo impedisce il verificarsi di un notevole sanguinamento. - Successivamente, sopprimere l'animale mediante esposizione a CO2 per 10 minuti. Procedere alla perfusione polmonare e prelevare i polmoni e altri tessuti.
NOTA: È accettabile anche qualsiasi altro metodo di eutanasia umana che aderisca alle linee guida AVMA per l'eutanasia degli animali.
3. Dissezione/Raccolta (Figura 1)
- Posiziona l'animale sulla schiena su una tavola piatta e fissa le zampe verso il basso, mantenendo la testa centrale.
- Spruzzare il corpo con etanolo al 70%. Apri la cavità toracica con pinze e forbici per esporre il polmone, il cuore e la trachea.
- Perfondere il polmone praticando una piccola incisione nel ventricolo sinistro del cuore e iniettando 10 ml di PBS freddo attraverso il ventricolo destro.
- Tagliare un'apertura nella trachea e inserire una cannula endovenosa. Una volta inserita la cannula, passare una corda di sutura lunga circa 6-8 cm sotto la trachea e legarla due volte alla cannula.
- Infilare la corda chirurgica nella cannula e inserire una siringa contenente il terreno di dissociazione (5 ml per mezzo polmone o 10 ml per un polmone intero) come illustrato nella Figura 1B.
- Tagliare delicatamente il polmone dal resto del corpo e posizionare la siringa con il polmone inserito in una provetta conica da 50 mL.
4. Digestione in sospensione a singola cellula
- Incubare il polmone a 37 °C per 30-40 minuti, instillando 1 mL (per metà del polmone) o 2 mL (per l'intero polmone) di Terreno di Dissociazione ogni 5 minuti.
- Una volta instillato tutto il terreno, rimuovere la siringa e la cannula e posizionare la provetta conica da 50 ml in un bagno d'acqua agitante a 180 giri/min per il resto dell'incubazione per una migliore resa.
NOTA: In alternativa, i tubi possono essere agitati manualmente ogni 5 minuti. - Aggiungere 10 ml di PBS e agitare energicamente per 1 minuto per fermare la reazione.
- Passare la soluzione attraverso un filtro cellulare (70 μm) in una nuova provetta conica da 50 mL. Utilizzare un tappo di gomma per siringa da 5 ml per far passare eventuali grumi di tessuto attraverso il colino. Aggiungere PBS in modo che il volume finale sia di 30 ml.
- Centrifugare i campioni per 10 minuti a 1.200 x g e 4 °C. Scartare il surnatante senza disturbare il pellet. Elimina qualsiasi soluzione rimanente.
- Aggiungere 1 mL di tampone per lisi dei globuli rossi (RBC) e miscelare con il pellet cellulare mediante pipettaggio.
- Incubare a temperatura ambiente per 60-90 s. Aggiungere PBS in modo che il volume finale sia di 30 ml per fermare la reazione.
NOTA: Il tempo di incubazione dipende dalla quantità di sangue nel pellet cellulare; Più rosso è il pellet cellulare, più lungo è il tempo di incubazione. - Centrifugare i campioni per 10 minuti a 1.200 x g e 4 °C. Scartare il surnatante senza disturbare il pellet. Elimina qualsiasi soluzione rimanente.
- Aggiungere 1 mL di tampone FACs al pellet cellulare e miscelare mediante pipettaggio.
5. Colorazione delle cellule per la citometria a flusso
- Utilizzare un contatore di celle per determinare il numero totale di celle nella sospensione cellulare.
- Trasferire la sospensione cellulare in ciascuna provetta FACS etichettata in modo che ci siano 3 x 106 cellule in totale per campione.
- Aggiungere il blocco Fc (diluito 1:100) e incubare per 15 minuti sul ghiaccio.
- Centrifugare le provette per 5 minuti a 1.200 x g e 4 °C. Scartare il surnatante senza disturbare il pellet.
- Colorare i campioni con una specifica miscela di anticorpi e incubare per 20 minuti su ghiaccio al riparo dalla luce (cioè coprendo con un foglio di alluminio). Mescolare travasando le provette contro il supporto delle provette a metà dell'incubazione.
- Aggiungere 1 mL di tampone FACS per lavare e miscelare mediante pipettaggio.
- Trasferire la sospensione cellulare in un'altra provetta FACS pipettando lentamente la sospensione attraverso un colino da 35 μm.
- Centrifugare le provette per 5 minuti a 1.200 x g e 4 °C. Scartare il surnatante senza disturbare il pellet.
- Aggiungere 150 μl di tampone FACS e miscelare mediante pipettaggio.
- Aggiungere 10 μl di DAPI (1:100) a ciascuna provetta immediatamente prima di eseguire i campioni.
NOTA: I campioni sono ora pronti per essere analizzati sul citometro a flusso.
Risultati
Utilizzando questa tecnica, la conta totale delle cellule dei polmoni dissociati naïve (solo i lobi sinistri sono stati utilizzati per i dati rappresentativi) era compresa tra 27,3 x 106 e 71,1 x 106 cellule/mL. Dopo aver controllato le dimensioni e le doppiette e le cellule morte (schema di gating nella Figura 2), la conta leucocitaria variava da 6,9 x 106 a 13,5 x 106 cellule/mL. I leucociti circolanti che rimangono intrappolati anche dopo la perfusione per liberare i polmoni costituivano circa il 4-13% delle cellule vive nell'esperimento. Mentre tutti i leucociti nel polmone dissociato colorano per CD45 sul PE-Cy7, solo i leucociti circolanti sono doppiamente colorati con l'anticorpo CD45 su entrambi i fluorofori, PE-Cy7 e Pac blue. Nonostante la standardizzazione del processo di perfusione, abbiamo scoperto che circa il 24-70% del totale dei leucociti nel polmone dissociato apparteneva al pool di leucociti circolanti. La conta media dei leucociti senza tenere conto della marcatura intravascolare era di 10,2 x 106 cellule/mL, mentre il valore corretto era di 4,93 x 106 cellule/mL (Figura 3A). Pertanto, l'incapacità di differenziare i leucociti intravascolari residui che persistono dopo la perfusione comporta una significativa sovrastima del numero di leucociti polmonari. Per questo esperimento, gli animali avevano un'età compresa tra 8 e 12 settimane e pesavano 25-30 g al momento della dissezione. Potrebbe essere necessario apportare aggiustamenti della dose in caso di età e peso estremi. Altri controlli utili includono l'utilizzo di un campione intravascolare per dimostrare una buona marcatura dei leucociti intravascolari e un campione da un tessuto non marcato (come un linfonodo) per escludere la possibilità di diffondere la marcatura di tutti i tessuti mediante trasmigrazione di leucociti marcati dal sangue.
Poiché le domande di ricerca spesso coinvolgono il campionamento circadiano, abbiamo ulteriormente suddiviso i dati in base all'ora del giorno (per l'animale) in cui è stato eseguito il prelievo polmonare. Per convenzione circadiana, ZT0 si riferisce al momento in cui le luci si accendono. Abbiamo usato l'alba (ZT23: inizio della fase di riposo) e il crepuscolo (ZT11; inizio della fase attiva) come due punti temporali. Notiamo che la proporzione dei leucociti intravascolari intraparenchimale e residui variava in base all'ora del giorno alla dissezione (Figura 3B). In questo esperimento, i topi sono stati mantenuti in cicli inversi luce-buio (LD) utilizzando scatole circadiane controllate dalla luce, in modo che i topi ZT11 e ZT23 fossero in fasi inverse allo stesso tempo convenzionale e potessero essere raccolti contemporaneamente. Pertanto, i polmoni di entrambi i gruppi sono stati etichettati, raccolti e digeriti alla stessa ora del giorno e quindi queste differenze nella Figura 3 non possono essere attribuite a differenze nell'elaborazione.

Figura 1: Schema del gonfiaggio polmonare e della digestione. (A) Disegno sperimentale complessivo a partire dall'anestetizzazione dei topi fino alla fase di colorazione degli anticorpi. (B) Immagine della fase di inserimento della cannula del prelievo polmonare. Clicca qui per visualizzare una versione più grande di questa figura.
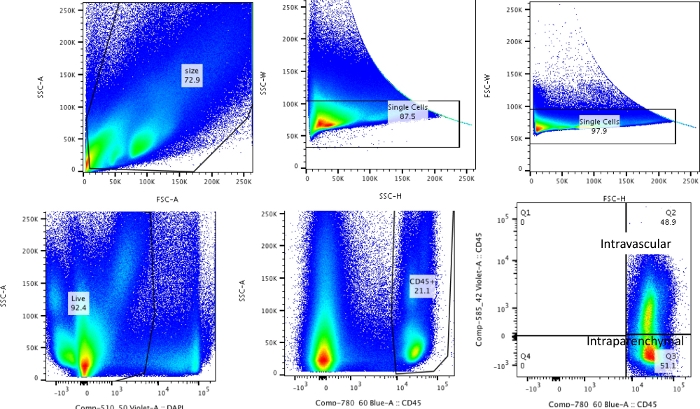
Figura 2: Strategia di gating. Strategia di gating utilizzata per differenziare i leucociti intravascolari dai leucociti che sono veramente residenti nei polmoni. Clicca qui per visualizzare una versione più grande di questa figura.
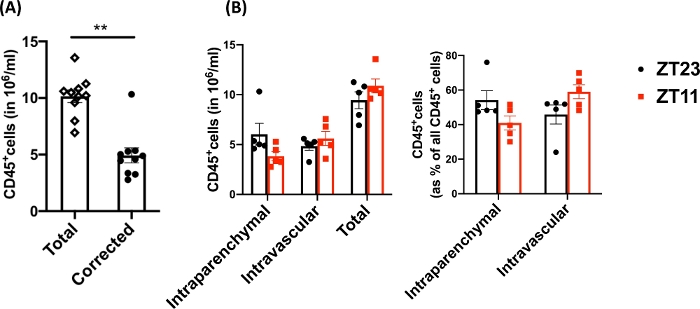
Figura 3: Confronto tra leucociti intraparenchimali e intravascolari. (A) Conta dei leucociti (in 10-6 cellule/mL) utilizzando la digestione tradizionale e l'etichettatura rispetto alla conta corretta per i leucociti intravascolari residui che non sono stati eliminati dai polmoni. P<0.0001 con il test t di Student. Dati rappresentati come media±SEM. (B) Numero di leucociti e percentuale dai polmoni prelevati all'alba (ZT23) o al tramonto (ZT11). (pannello di destra) ANOVA a 2 vie, p >0,05 sia per il momento del raccolto che per il compartimento etichettato, ma p<0,05 per l'interazione. Dati rappresentati come media±SEM. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Studi accurati sull'infiammazione polmonare e sulle risposte immunitarie polmonari sono fondamentali per la comprensione di molte condizioni patologiche. La citometria a flusso viene utilizzata di routine per enumerare e attribuire rilevanza funzionale ai leucociti polmonari. La funzione dei leucociti dipende almeno in parte dal luogo in cui si trovano. Sebbene vi siano prove crescenti a sostegno del fatto che, anche dopo protocolli di perfusione perfetti, molti leucociti intravascolari persistono nei polmoni, la maggior parte degli studi non distingue tra leucociti intrapolmonari e intravascolari. Inoltre, è probabile che i leucociti intravascolari residui che rimangono dopo la perfusione nel polmone siano distribuiti in modo casuale tra i campioni a seconda della preparazione, in modo tale che sia impossibile prevedere come influisce sui risultati. Ciò ostacola la generalizzabilità dei risultati ed è una minaccia per il rigore e la riproducibilità di quegli studi che coinvolgono la citometria a flusso12.
Abbiamo descritto qui un metodo per determinare i leucociti residui dal sistema vascolare e per differenziarli dai leucociti veramente intrapolmonari. Sebbene tali metodi siano stati utilizzati in passato 9,13,14, abbiamo perfezionato l'etichettatura, così come la digestione, per renderla la preparazione più efficiente. Altri rapporti descrivono l'utilizzo delle iniezioni retro-orbitali o della vena caudale per la marcatura intravascolare10. Le iniezioni retro-orbitali infliggono più dolore all'animale e quindi richiedono un livello più elevato di controllo normativo. Sebbene l'iniezione della vena caudale non richieda anestesia, è tecnicamente più impegnativa11 soprattutto negli animali C57bl6. Questo approccio intragiugulare supera entrambi questi svantaggi rendendo la procedura relativamente indolore e facile da eseguire al microscopio. Sebbene abbiamo descritto qui la procedura per i topi giovani adulti, date le dimensioni maggiori dell'intragiugulare, questo protocollo può essere utilizzato per animali più piccoli15. La facilità della procedura rende l'etichettatura coerente tra gli animali e quindi aumenterebbe il rigore e la riproducibilità dei risultati.
Le fasi critiche di questo protocollo includono la riproducibilità dell'iniezione intravascolare e il prelievo polmonare. Alcune considerazioni aggiuntive necessarie per l'iniezione intragiugulare sono la necessità di apparecchiature per l'anestesia e l'ingrandimento (lenti d'ingrandimento o microscopio da dissezione). Entrambi questi passaggi richiedono pratica per essere padroneggiati e possono aumentare la variabilità se non ben padroneggiati. Con l'iniezione intragiugulare, una tecnica difettosa può portare a sanguinamento eccessivo e precipitare la morte. Pertanto, c'è un'enfasi sulle apparecchiature per aiutare la visualizzazione. Nel caso del prelievo polmonare, una tecnica scadente può provocare la rottura della trachea. Sebbene si possa ancora procedere con altri metodi di digestione polmonare (come l'uso di un bisturi per tagliare il polmone, ecc.), nella nostra esperienza produce una conta cellulare molto più bassa e tende ad aumentare la variabilità tra i campioni.
Un'altra preoccupazione importante che emerge da qualsiasi passaggio aggiuntivo è che aumenta il tempo totale di elaborazione e può ridurre la vitalità dei campioni e quindi la qualità dei dati. Etichettando i leucociti intravascolari prima della digestione, ci assicuriamo che la vitalità del campione preparato non sia influenzata negativamente nel protocollo. Inoltre, utilizzando la tecnica del gonfiaggio per distribuire gli enzimi digestivi in tutto il polmone, ci assicuriamo che la digestione sia uniforme e produca in modo affidabile più cellule rispetto ad altri metodi per dissociare il tessuto polmonare7. Poche altre preoccupazioni che possono essere prese in considerazione sono comuni a questo metodo di marcatura, indipendentemente dalla via di somministrazione dell'anticorpo intravascolare. Ciò include il possibile legame competitivo tra i due anticorpi CD45. Questo può essere parzialmente mitigato utilizzando diversi cloni dell'anticorpo CD45, anche se è necessario prestare attenzione per garantire che i due anticorpi utilizzati abbiano affinità di legame molto simili. L'altro aspetto da considerare è se il tempo che intercorre tra l'iniezione e il prelievo (in questo caso, 2-4 minuti) è sufficiente per marcare la maggior parte dei leucociti intravascolari. Dato che la marcatura intravascolare precede la marcatura complessiva del CD45 e ad una frequenza cardiaca di 300-700 battiti al minuto nei topi16, è molto probabile che ci sia una marcatura completa del compartimento intravascolare del CD45. Questo metodo è stato adattato da altri che hanno utilizzato concentrazioni e tempi molto simili dalla somministrazione al raccolto 9,10,13. Infine, un'altra questione da considerare è la possibile trasmigrazione dei leucociti risultanti, tecnicamente in entrambe le direzioni nel tempo che intercorre tra l'iniezione e il prelievo. Questo può anche variare in base alla condizione sperimentale sottostante. Anche se, non usato qui, un modo per superare questo problema almeno in parte sarebbe quello di utilizzare altri metodi standard di eutanasia che riducono il tempo dall'iniezione al prelievo, come la lussazione cervicale.
Questo lavoro ruota attorno alla delucidazione della regolazione circadiana del danno polmonare, della riparazione e della rigenerazione. Sebbene l'intero corpo sia sottoposto a regolazione circadiana, le fasi di tale regolazione variano a seconda dell'organo e del tipo di cellula. Pertanto, la fase dei ritmi dei leucociti o dei loro sottotipi funzionali può essere diversa in base all'organo o al sito di circolazione. La mancata differenziazione di queste due popolazioni può infatti portare a risultati falsi negativi nell'analisi di varie sottopopolazioni leucocitarie (se le popolazioni circolanti e polmonari sono in fase opposta, le medie potrebbero non essere molto diverse). Pertanto, differenziare tra i leucociti circolanti che rimangono nel polmone anche dopo la perfusione da quelli che sono già migrati nel polmone e partecipano attivamente alla cascata infiammatoria è essenziale per scoprire la biologia della regolazione circadiana. Il protocollo qui descritto aiuta questa differenziazione. Sebbene lo abbiamo fatto nel polmone, questo metodo si presta ad essere adattato anche per altri organi. Tuttavia, l'aggiunta di questi passaggi allunga il tempo di raccolta e potrebbe non essere adatto a tutti gli esperimenti circadiani. Ciò comporterebbe quindi una considerazione personalizzata su dove la differenziazione tra leucociti intravascolari e intraparenchimali è più rilevante.
In conclusione, abbiamo descritto in dettaglio un metodo per distinguere i leucociti intravascolari residui da quelli intrapolmonari e la digestione polmonare basata sull'inflazione. Queste tecniche miglioreranno la resa della sospensione di una singola cellula dal polmone e miglioreranno il rigore e la riproducibilità degli studi di citometria a flusso. Infine, questo è di particolare rilevanza per coloro che studiano i ritmi circadiani.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla NHLBI-K08HL132053 (SS). Gli autori ringraziano il Dr. G. A. FitzGerald per l'accesso a un microscopio da dissezione e a un bagno d'acqua agitante.
Materiali
| Name | Company | Catalog Number | Comments |
| Boekel Scientific Medium Water Bath | Boekel Grant Scientific | 290200 | |
| 10 mL BD Syringes with BD Luer-Lok Tip | BD Biosciences | 309604 | |
| 5 mL BD Syringes with BD Luer-Lok Tip | BD Biosciences | 309646 | |
| Anti-CD45- Pac Blue | Biolegend | 103114 | |
| Anti-CD45- Pe/Cy7 | Biolegend | 103114 | |
| Cell strainer 70 µm Nylon | Fisher | 352350 | |
| Corning Conical-Bottom Centrifuge Tube 50 mL | Avantor | 21008-714 | |
| Corning Falcon Test Tube with Cell Strainer Snap Cap | EMSCO | 10004637 | |
| Dissection Microscope | Olympus | SZX-SDO2 | |
| DMEM, high glucose | Life Technologies | 11965084 | |
| Dnase | Roche | 10104159001 | |
| DPBS without Ca++ & Mg++ | 14190136 | ||
| Fc Block | Biolegend | 101320 | |
| HyClone Fetal Bovine Serum | GE Healthcare | SH30071.03 | |
| L-Glutamine (200 mM) | Life Technologies | 25030-081 | |
| Liberase Research Grade | Sigma | 5401127001 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140-122 | |
| Precision Shaking Water Bath | Thermo Fisher | TSSWB15 | |
| Red Blood Cell Lysing Buffer | Sigma | R7757 | |
| Suture Silk 4-0 | Roboz | SUT-15-2 |
Riferimenti
- Partch, C. L., Green, C. B., Takahashi, J. S. Molecular architecture of the mammalian circadian clock. Trends in Cell Biology. 24, 90-99 (2014).
- Man, K., Loudon, A., Chawla, A. Immunity around the clock. Science. 354, 999-1003 (2016).
- Haspel, J. A., et al. Perfect timing: circadian rhythms, sleep, and immunity - an NIH workshop summary. JCI Insight. 5, (2020).
- Nosal, C., Ehlers, A., Haspel, J. A. Why Lungs Keep Time: Circadian Rhythms and Lung Immunity. Annual Review of Physiology. 82, 391-412 (2020).
- Gibbs, J., et al. An epithelial circadian clock controls pulmonary inflammation and glucocorticoid action. Nature Medicine. 20, 919-926 (2014).
- Ehlers, A., et al. BMAL1 links the circadian clock to viral airway pathology and asthma phenotypes. Mucosal Immunology. 11, 97-111 (2018).
- Sengupta, S., et al. Circadian control of lung inflammation in influenza infection. Nature Communications. 10, 4107 (2019).
- Zhang, R., Lahens, N. F., Ballance, H. I., Hughes, M. E., Hogenesch, J. B. A circadian gene expression atlas in mammals: implications for biology and medicine. Proceedings of the National Academy of Sciences of the United States of America. 111, 16219-16224 (2014).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nature Protocols. 9, 209-222 (2014).
- Gibbings, S. L., Jakubzick, C. V. Isolation and Characterization of Mononuclear Phagocytes in the Mouse Lung and Lymph Nodes. Methods in Molecular Biology. 1809, 33-44 (2018).
- Vines, D. C., Green, D. E., Kudo, G., Keller, H. Evaluation of mouse tail-vein injections both qualitatively and quantitatively on small-animal PET tail scans. Journal of Nuclear Medicine Technology. 39, 264-270 (2011).
- Tighe, R. M., et al. Improving the Quality and Reproducibility of Flow Cytometry in the Lung. An Official American Thoracic Society Workshop Report. American Journal of Respiratory Cell and Molecular Biology. 61, 150-161 (2019).
- Anderson, K. G., et al. Cutting edge: intravascular staining redefines lung CD8 T cell responses. Journal of Immunology. 189, 2702-2706 (2012).
- Gibbings, S. L., et al. Three Unique Interstitial Macrophages in the Murine Lung at Steady State. American Journal of Respiratory Cell and Molecular Biology. 57, 66-76 (2017).
- Steel, C. D., Stephens, A. L., Hahto, S. M., Singletary, S. J., Ciavarra, R. P. Comparison of the lateral tail vein and the retro-orbital venous sinus as routes of intravenous drug delivery in a transgenic mouse model. Lab Animals (NY). 37, 26-32 (2008).
- Ho, D., et al. Heart Rate and Electrocardiography Monitoring in Mice. Current Protocols in Mouse Biology. 1, 123-139 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon