Method Article
التمييز بين الخلايا المناعية داخل الرئة وخلايا المناعة داخل الأوعية الدموية: النهج داخل الوداجي
In This Article
Summary
الهدف من الدراسة الحالية هو وصف بروتوكول للتمييز بين الخلايا المناعية داخل الأوعية الدموية وداخل المتني في دراسات التهاب الرئة. نستخدم حقنة داخل الوداج لجسم مضاد يحمل علامة الفلورسنت قبل حصاد الرئة. علاوة على ذلك ، نستخدم عملية هضم الرئة القائمة على التضخم لتحسين محصول الكريات البيض من الرئة.
Abstract
تشير إيقاعات الساعة البيولوجية إلى التذبذبات في العمليات البيولوجية المختلفة التي تحدث مع فترة 24 ساعة. على المستوى الجزيئي ، تتكون هذه الإيقاعات من شبكة من حلقات التغذية الراجعة النسخية الانتقالية (TTFL) لجينات الساعة الأساسية. الأنسجة الفردية وأجهزة الأعضاء ، بما في ذلك الجهاز المناعي ، لها ساعتها الخاصة. في الدورة الدموية النظامية ، يتأرجح العديد من أعضاء CD45 + على مدار اليوم. ومع ذلك ، فإن العديد من هذه الإيقاعات ليست متطابقة أو حتى متشابهة في مجموعة الكريات البيض CD45 + المقيمة. عند دراسة دور تنظيم الساعة البيولوجية لالتهاب الرئة ، قد يحتاج CD45 + داخل الرئة إلى التحقيق. ومع ذلك ، على الرغم من طرق التروية المحسنة ، فإن الكريات البيض المحاصرة من الدورة الدموية تستمر في الرئتين. كان الهدف من تصميم هذا البروتوكول هو التمييز بين الكريات البيض داخل الأوعية الدموية وداخل المتني. تحقيقا لهذه الغاية ، يتم حقن الفئران بجسم مضاد CD45 الموسوم بالفلورسنت داخل الوداج قبل وقت قصير من حصاد الرئة. بعد ذلك ، يتم هضم الرئة باستخدام تقنية هضم الرئة المخصصة للحصول على تعليق خلية واحدة. العينة ملطخة للوحة الأجسام المضادة العادية للخلايا المناعية داخل المتني (بما في ذلك الجسم المضاد CD45 آخر). تظهر تحليلات قياس التدفق الخلوي توضيحا واضحا للسكان. وبالتالي ، فإن طريقة وضع العلامات على خلايا CD45 + داخل الرئة وتعريفها ستكون مهمة بشكل خاص عندما يكون سلوك الخلايا المناعية داخل الرئة والدورة متميزة عدديا ووظيفيا.
Introduction
نصف هنا طرقا فعالة وموثوقة للتمييز بين الكريات البيض داخل الأوعية الدموية وبيضاء الرئة. حتى مع أفضل تقنيات التروية ، كشفت الدراسات أن بقايا CD45 + من الدورة الدموية لا تزال موجودة في الرئة. هذا يضعف القدرة على التمييز بين إيقاعات الدورة الدموية والرئة. يتم تضخيم هذا التأثير بشكل أكبر في حالات التهاب الرئة. هذا مهم بشكل خاص لدراسة تنظيم الساعة البيولوجية للالتهاب.
تشير إيقاعات الساعة البيولوجية إلى التذبذبات النهارية في العمليات البيولوجية المختلفة التي تحدث بفترة 24 ساعة. نظام الساعة البيولوجية هو آلية استباقية محفوظة تطوريا تمنح الحماية للمضيف لأنه يواجه تغيرات في بيئته مثل خطر العدوى. على المستوى الخلوي ، يتم تنظيم الساعة في حلقات تغذية مرتدة نسخية انتقالية ذاتية الاستدامة تشتمل على جينات الساعة الأساسية1. الجهاز المناعي له ساعته الخاصة التي تؤثر على استجابته لمسببات الأمراض والإهانات الالتهابية2،3. كعضو يتعرض للبيئة باستمرار ، تعتبر إيقاعات الساعة البيولوجية مهمة بشكل خاص في الرئة4. تخضع العمليات المناعية المختلفة في الرئة للسيطرة على مدار الساعة5،6،7. ومع ذلك ، فإن مرحلة العمليات البيولوجية المختلفة في الرئة والدورة الدموية الجهازية ليست هينفسها 8 ، والتي تشير أيضا إلى أن تذبذبات الكريات البيض في الرئة والدورة الدموية قد لا تكون متطابقة. وبالتالي ، فإن وجود طريقة للتمييز بكفاءة بين الكريات البيض الرئوية وداخل الأوعية الدموية سيكون أمرا بالغ الأهمية في سياق الساعة البيولوجية.
كان الهدف من هذه الدراسة هو ابتكار طريقة يمكنها التمييز بين الكريات البيض داخل الأوعية الدموية وداخل المتني بشكل موثوق. لهذا ، استخدمنا وضع العلامات على الكريات البيض داخل الأوعية الدموية وطريقة هضم الرئة. لوضع العلامات على الكريات البيض داخل الأوعية الدموية ، نستخدم الحقن داخل الوداج ، والذي يستهدف وعاء دموي كبير ويمكن استخدامه بشكل متكرر في الفئران من جميع السلالات والأحجام. استخدمت العديد من الطرق الأخرى حقن وريد الذيل9،10 ، والتي من المعروف أنها أصعب في أداء الفئران Bl611. يتطلب الحقن داخل الوداج استخدام التخدير ومن الأفضل القيام به تحت التصور المباشر باستخدام مجهر تشريح أو مكبرات مكبرة. وبالتالي ، يجب موازنة سهولة وموثوقية الحقن داخل الوداج مقابل الحاجة إلى التخدير والمعدات الخاصة. ومع ذلك ، نظرا للتوافر الجاهز لهذه المعدات في معظم مختبرات الأبحاث ، فإننا لا نعتبر هذا عاملا مقيدا. ومع ذلك ، يبدو من الحكمة النظر في كل حالة على حدة.
Protocol
تمت الموافقة على جميع الدراسات التي أجريت على من قبل اللجنة المؤسسية لرعاية واستخدامه بجامعة بنسلفانيا واستوفت شروط دليل رعاية واستخدام المختبر.
ملاحظة: يمكن تقسيم العملية الإجمالية إلى 1) وضع العلامات على CD45 في الوريد ، 2) الحصاد ، 3) الهضم ، و 4) تلطيخ وقياس التدفق الخلوي. تم تلخيص هذه الخطوات في الشكل 1.
1. تحضير الحلول / الكاشف
- تحضير وسائط التفكك عن طريق إضافة 5 مل من 2 ملي ل-جلوتامين ، و 20 مل من مصل الأبقار الجنينية (FBS) ، و 1 مل من 2-mercaptoethanol ، و 10 مل من Pen / Strep إلى 500 مل من DMEM.
ملاحظة: تكون وسائط التفكك مستقرة لمدة تصل إلى شهرين عند تخزينها عند 2-4 درجة مئوية. - قم بإعداد المخزن المؤقت لفرز الخلايا المنشطة بالفلورة (FACS) عن طريق إضافة 10 مل من FBS و 500 مجم من أزيد الصوديوم إلى 500 مل من PBS بدون المغنيسيوم أو الكالسيوم.
ملاحظة: مع إضافة أزيد الصوديوم ، يمكن تخزين FACS Buffer عند 2-4 درجات مئوية لعدة أشهر. - في يوم جمع العينة ، أضف محاليل DNase و Liberase إلى وسائط التفكك عند تخفيف 1: 100 (أي أضف 10 ميكرولتر من DNase و Liberase لكل 1 مل من وسائط التفكك).
ملاحظة: لكل فأر ، يتطلب هضم الرئة بأكملها 10 مل / فأر ونصف الرئة يتطلب 5 مل / فأر.
2. وضع العلامات على CD45 في الوريد
- في هذه التجربة ، استخدم الفئران البالغة C57Bl6 التي تتراوح أعمارها بين 8 و 12 أسبوعا.
- تخدير الفئران بعوامل من اختيارك. تم استخدام مزيج من الزيلازين والكيتامين لهذا الغرض ، لكن العوامل الأخرى مقبولة أيضا. الهدف هو الحصول على مستوى متوسط إلى عميق من التخدير يستمر حوالي 5-10 دقائق.
ملاحظة: يتم إعطاء خليط التخدير الزيلازين والكيتامين داخل الصفاق. استخدم 10-15 مجم / كجم من الزيلازين و 120-150 مجم / كجم من الكيتامين. - بمجرد أن يصبح منعكس الدواسة سالبا ، ضع على ظهره وقم بلصق أطرافه برفق للحفاظ على الرأس مركزيا قدر الإمكان.
- كشف الوريد الوداجي والعضلة الصدرية عن طريق رفع الجلد بالملقط والقص بمقص جراحي حاد.
- حقن 200 ميكرولتر من الجسم المضاد المضاد ل CD45 (الجسم المضاد من درجة قياس التدفق الخلوي ؛ مخفف 1: 300 في PBS) في الوريد الوداجي باستخدام إبرة 28 G. انتظر 2-4 دقائق حتى يتمكن الجسم المضاد من الدوران في جميع أنحاء الأوعية الدموية.
ملاحظة: الدخول من خلال العضلة الصدرية إلى الوريد الوداجي من زاوية ضحلة يمنع حدوث نزيف كبير. - بعد ذلك ، قتل عن طريق التعرض لثاني أكسيد الكربون2 لمدة 10 دقائق. انتقل إلى نضح الرئة وحصاد الرئتين والأنسجة الأخرى.
ملاحظة: أي طريقة أخرى للقتل الرحيم الإنساني تلتزم بإرشادات AVMA للقتل الرحيم للحيوانات مقبولة أيضا.
3. التشريح / الحصاد (الشكل 1)
- ضع على ظهره على لوح مسطح وقم بتثبيت الكفوف لأسفل ، مع الحفاظ على الرأس في المركز.
- رش الجسم ب 70٪ إيثانول. افتح التجويف الصدري بالملقط والمقص لكشف الرئة والقلب والقصبة الهوائية.
- قم بنشر الرئة عن طريق عمل شق صغير في البطين الأيسر للقلب وحقن 10 مل من PBS البارد عبر البطين الأيمن.
- قص فتحة في القصبة الهوائية وأدخل قنية في الوريد. بمجرد دخول القنية ، مرر خيطا بطول 6-8 سم تحت القصبة الهوائية واربطه مرتين بالقنية.
- دس الخيط الجراحي في القنية وقم بإرفاق حقنة تحتوي على وسائط التفكك (5 مل لنصف رئة أو 10 مل للرئة بأكملها) كما هو موضح في الشكل 1 ب.
- اقطع الرئة برفق عن باقي الجسم وضع المحقنة مع الرئة متصلة بأنبوب مخروطي سعة 50 مل.
4. الهضم إلى تعليق خلية واحدة
- احتضان الرئة عند 37 درجة مئوية لمدة 30-40 دقيقة ، مع غرس 1 مل (لنصف الرئة) أو 2 مل (للرئة بأكملها) من وسائط التفكك كل 5 دقائق.
- بمجرد غرس جميع الوسائط ، قم بإزالة المحقنة والقنية ، وضع الأنبوب المخروطي سعة 50 مل في حمام مائي مهتز عند 180 دورة في الدقيقة لبقية فترة الحضانة للحصول على عائد أفضل.
ملاحظة: بدلا من ذلك ، يمكن هز الأنابيب يدويا كل 5 دقائق. - أضف 10 مل من PBS ورجه بقوة لمدة 1 دقيقة لإيقاف التفاعل.
- مرر المحلول عبر مصفاة خلوية (70 ميكرومتر) إلى أنبوب مخروطي جديد سعة 50 مل. استخدم سدادة مطاطية من المحقنة سعة 5 مل لتمرير أي كتل من الأنسجة عبر المصفاة. أضف PBS بحيث يكون الحجم النهائي 30 مل.
- الطرد المركزي للعينات لمدة 10 دقائق عند 1,200 × جم و 4 درجات مئوية. تخلص من المادة الطافية دون إزعاج الحبيبات. Pipet أي حل متبقي.
- أضف 1 مل من محلول تحلل خلايا الدم الحمراء (RBC) واخلطه مع حبيبات الخلية عن طريق سحب العينات.
- احتضن في درجة حرارة الغرفة لمدة 60-90 ثانية. أضف PBS بحيث يكون الحجم النهائي 30 مل لإيقاف التفاعل.
ملاحظة: يعتمد وقت الحضانة على كمية الدم في حبيبات الخلية. كلما كانت حبيبات الخلية أكثر احمرارا ، كلما طالت مدة الحضانة. - الطرد المركزي للعينات لمدة 10 دقائق عند 1,200 × جم و 4 درجات مئوية. تخلص من المادة الطافية دون إزعاج الحبيبات. Pipet أي حل متبقي.
- أضف 1 مل من المخزن المؤقت ل FACs إلى حبيبات الخلية واخلطها عن طريق سحب العينات.
5. تلطيخ الخلايا لقياس التدفق الخلوي
- استخدم عداد الخلايا لتحديد العدد الإجمالي للخلايا في معلق الخلية.
- انقل تعليق الخلية إلى كل أنبوب FACS مسمى بحيث يكون هناك 3 × 106 خلايا إجمالا لكل عينة.
- أضف Fc Block (مخفف 1: 100) واحتضنه لمدة 15 دقيقة على الثلج.
- الطرد المركزي الأنابيب لمدة 5 دقائق عند 1,200 × جم و 4 درجات مئوية. تخلص من المادة الطافية دون إزعاج الحبيبات.
- قم بتلطيخ العينات بخليط محدد من الأجسام المضادة واحتضانها لمدة 20 دقيقة على ثلج محمي من الضوء (أي عن طريق تغطيتها بورق الألمنيوم). امزج عن طريق أنابيب الأرفف مقابل حامل الأنبوب في منتصف فترة الحضانة.
- أضف 1 مل من المخزن المؤقت FACS للغسيل والخلط عن طريق سحب العينات.
- انقل تعليق الخلية إلى أنبوب FACS آخر عن طريق سحب التعليق ببطء من خلال مصفاة 35 ميكرومتر.
- الطرد المركزي الأنابيب لمدة 5 دقائق عند 1,200 × جم و 4 درجات مئوية. تخلص من المادة الطافية دون إزعاج الحبيبات.
- أضف 150 ميكرولتر من المخزن المؤقت FACS واخلطه عن طريق سحب العينات.
- أضف 10 ميكرولتر من DAPI (1: 100) إلى كل أنبوب مباشرة قبل تشغيل العينات.
ملاحظة: العينات جاهزة الآن للتشغيل على مقياس التدفق الخلوي.
النتائج
باستخدام هذه التقنية ، كان إجمالي عدد الخلايا للرئتين الساذجة المنفصلتين (تم استخدام الفص الأيسر فقط للبيانات التمثيلية) بين 27.3 × 106 إلى 71.1 × 106 خلايا / مل. بعد تحديد الحجم وإخراج الثنائيات والخلايا الميتة (مخطط البوابات في الشكل 2) ، تراوحت أعداد الكريات البيض من 6.9 × 106 إلى 13.5 × 106 خلايا / مل. شكلت الكريات البيض المنتشرة التي تظل محاصرة حتى بعد التروية لتنظيف الرئتين ما يقرب من 4٪ إلى 13٪ من الخلايا الحية في التجربة. في حين أن جميع الكريات البيض في صبغة الرئة المنفصلة ل CD45 على PE-Cy7 ، فإن الكريات البيض المنتشرة فقط ملطخة بالجسم المضاد CD45 على كل من الفلوروفورات ، PE-Cy7 و Pac blue. على الرغم من توحيد عملية التروية ، وجدنا أن حوالي 24٪ إلى 70٪ من إجمالي الكريات البيض في الرئة المنفصلة تنتمي إلى تجمع الكريات البيض المنتشرة. كان متوسط عدد الكريات البيض دون حساب الملصقات داخل الأوعية الدموية 10.2 × 106 خلايا / مل ، بينما كانت القيمة المصححة 4.93 × 106 خلايا / مل (الشكل 3 أ). لذلك ، فإن الفشل في التفريق بين الكريات البيض المتبقية داخل الأوعية الدموية التي تستمر بعد التروية يؤدي إلى مبالغة كبيرة في تقدير عدد الكريات البيض الرئوية. في هذه التجربة ، كان عمر من 8 إلى 12 أسبوعا ووزنها 25-30 جراما في وقت التشريح. قد يلزم إجراء تعديلات على الجرعة لأقصى درجات الأعمار والوزن. تشمل الضوابط المفيدة الأخرى استخدام عينة داخل الأوعية الدموية لإثبات وضع العلامات الجيدة للكريات البيض داخل الأوعية الدموية وعينة من نسيج غير مصنف (مثل العقدة الليمفاوية) لاستبعاد إمكانية نشر الملصقات لجميع الأنسجة عن طريق نقل الكريات البيض المصنفة من الدم.
نظرا لأن أسئلة البحث غالبا ما تتضمن أخذ عينات يومية ، فقد قمنا بتقسيم البيانات حسب الوقت من اليوم (للحيوان) الذي تم فيه حصاد الرئة. وفقا للاتفاقية البيولوجية ، يشير ZT0 إلى الوقت الذي تضيء فيه الأضواء. استخدمنا الفجر (ZT23: بداية مرحلة الراحة) والغسق (ZT11 ؛ بداية المرحلة النشطة) كنقطتين زمنيتين. نلاحظ أن نسبة الكريات البيض داخل المتني والمتبقية داخل الأوعية الدموية تختلف حسب الوقت من اليوم عند التشريح (الشكل 3 ب). في هذه التجربة ، تم الحفاظ على الفئران في دورات عكسية للضوء والظلام (LD) باستخدام صناديق الساعة البيولوجية التي يتم التحكم فيها بالضوء ، بحيث كانت الفئران ZT11 و ZT23 في مراحل عكسية في نفس الوقت التقليدي ويمكن حصادها في وقت واحد. وبالتالي ، تم تصنيف الرئتين من كلتا المجموعتين وحصادها وهضمها في نفس الوقت من اليوم ، وبالتالي لا يمكن أن تعزى هذه الاختلافات في الشكل 3 إلى الاختلافات في المعالجة.

الشكل 1: تخطيطي لتضخم الرئة والهضم. (أ) التصميم التجريبي العام بدءا من تخدير الفئران إلى خطوة تلطيخ الجسم المضاد. (ب) صورة لخطوة إدخال القنية لحصاد الرئة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
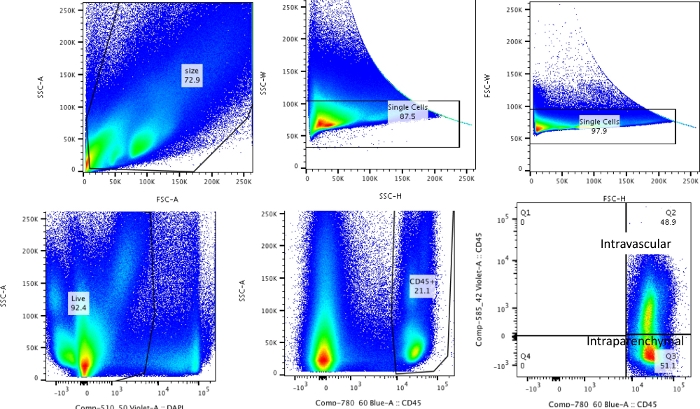
الشكل 2: استراتيجية البوابات. تستخدم استراتيجية البوابات للتمييز بين الكريات البيض داخل الأوعية الدموية وكريات البيض الموجودة حقا في الرئتين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
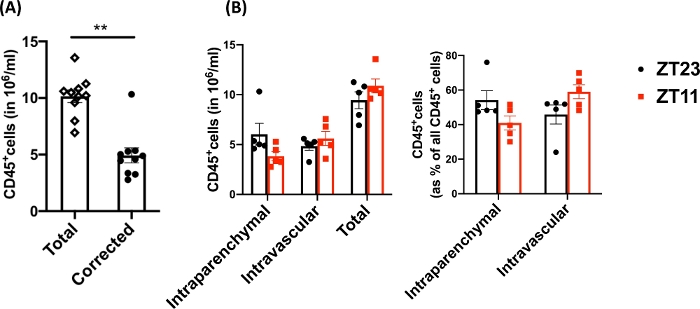
الشكل 3: مقارنة بين الكريات البيض داخل المتني وداخل الأوعية الدموية. (أ) تعداد الكريات البيض (في 106 خلايا / مل) باستخدام الهضم التقليدي ووضع العلامات مقارنة بالأعداد المصححة للكريات البيض المتبقية داخل الأوعية الدموية التي لم يتم إزالتها من الرئتين. P<0.0001 عن طريق اختبار t للطالب. البيانات الممثلة على أنها متوسط±SEM. (ب) أعداد الكريات البيض والنسبة المئوية من الرئتين التي تم حصادها عند الفجر (ZT23) أو الغسق (ZT11). (اللوحة اليمنى) 2-اتجاهين ANOVA ، ص >0.05 لكل من وقت الحصاد والمقصورة المسمى ، ولكن p<0.05 للتفاعل. البيانات الممثلة في المتوسط ±SEM. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تعد الدراسات الدقيقة لالتهاب الرئة والاستجابات المناعية الرئوية ضرورية لفهم العديد من الحالات المرضية. يستخدم قياس التدفق الخلوي بشكل روتيني لتعداد وإسناد الأهمية الوظيفية للكريات البيض الرئوية. تعتمد وظيفة الكريات البيض جزئيا على الأقل على مكان وجودها. على الرغم من وجود أدلة متراكمة تدعم أنه حتى بعد بروتوكولات التروية المثالية ، فإن العديد من الكريات البيض داخل الأوعية الدموية تستمر في الرئتين ، إلا أن معظم الدراسات لا تفرق بين الكريات البيض داخل الرئة وداخل الأوعية الدموية. علاوة على ذلك ، من المحتمل أن يتم توزيع الكريات البيض المتبقية داخل الأوعية الدموية التي تبقى بعد التروية في الرئة بشكل عشوائي عبر العينات اعتمادا على المستحضر ، بحيث يكون التنبؤ بكيفية تأثيرها على النتائج أمرا مستحيلا. هذا يعيق قابلية تعميم النتائج ويشكل تهديدا لصرامة وقابلية استنساخ تلك الدراسات التي تنطوي على قياس التدفقالخلوي 12.
لقد وصفنا هنا طريقة لتحديد الكريات البيض المتبقية من الأوعية الدموية وتمييزها عن الكريات البيض داخل الرئة حقا. على الرغم من استخدام هذه الأساليب فيالماضي 9،13،14 ، فقد قمنا بتحسين الملصقات ، وكذلك الهضم ، لجعلها التحضير الأكثر كفاءة. تصف تقارير أخرى استخدام حقن الوريد الرجعي أو الوريد الذيل لوضع العلامات داخل الأوعيةالدموية 10. تسبب الحقن المدارية الرجعية مزيدا من الألم للحيوان وبالتالي تتطلب مستوى أعلى من التدقيق التنظيمي. على الرغم من أن حقن وريد الذيل لا يحتاج إلى تخدير ، إلا أنه يمثل تحديا أكبر من الناحية الفنية11 خاصة في C57bl6. يتغلب هذا النهج داخل الوداج على هذين العيوب من خلال جعل الإجراء غير مؤلم نسبيا وسهل التنفيذ تحت الفحص المجهري. على الرغم من أننا وصفنا الإجراء هنا للفئران البالغة الصغيرة ، نظرا للحجم الأكبر للفئران داخل الوداج ، يمكن استخدام هذا البروتوكول للحيوانات الصغيرة15. تجعل سهولة الإجراء وضع العلامات متسقة عبر ، وبالتالي من شأنها أن تضيف إلى صرامة النتائج وقابليتها للتكرار.
تشمل الخطوات الحاسمة في هذا البروتوكول قابلية استنساخ الحقن داخل الأوعية الدموية وحصاد الرئة. بعض الاعتبارات الإضافية اللازمة للحقن داخل الوداج هي الحاجة إلى معدات التخدير والتكبير (العدسات المكبرة أو المجهر التشريح). تتطلب كلتا الخطوتين ممارسة لإتقانها وقد تضيف إلى التباين إذا لم يتم إتقانها جيدا. مع الحقن داخل الوداجي ، قد تؤدي التقنية الخاطئة إلى نزيف مفرط وتسبب الموت المتسارع. وبالتالي ، هناك تركيز على المعدات للمساعدة في التصور. في حالة حصاد الرئة ، قد تؤدي التقنية السيئة إلى تمزق القصبة الهوائية. في حين أنه لا يزال بإمكان المرء المضي قدما في طرق أخرى لهضم الرئة (مثل استخدام مشرط لتقطيع الرئة ، وما إلى ذلك) ، في تجربتنا ، فإنه ينتج عنه عدد أقل بكثير من الخلايا ويميل إلى زيادة التباين بين العينات.
مصدر قلق مهم آخر ناشئ عن أي خطوات إضافية هو أنه يزيد من إجمالي وقت المعالجة وقد يقلل من صلاحية العينات ، وبالتالي جودة البيانات. من خلال وضع العلامات على الكريات البيض داخل الأوعية الدموية قبل الهضم ، نضمن عدم تأثر صلاحية العينة المحضرة سلبا في البروتوكول. علاوة على ذلك ، باستخدام تقنية التضخم لتوزيع الإنزيمات الهاضمة في جميع أنحاء الرئة ، نضمن أن يكون الهضم موحدا وينتج خلايا أكثر بشكل موثوق من الطرق الأخرى لفصل أنسجة الرئة7. هناك عدد قليل من المخاوف الإضافية التي يمكن أخذها في الاعتبار شائعة في طريقة الوسم هذه المستقلة عن طريق إعطاء الجسم المضاد داخل الأوعية الدموية. وهذا يشمل الارتباط التنافسي المحتمل بين الأجسام المضادة CD45. يمكن التخفيف من ذلك جزئيا باستخدام نسخ مختلفة من الجسم المضاد CD45 ، على الرغم من أنه يجب توخي الحذر للتأكد من أن الجسمين المضادين المستخدمين لهما تقاربات ربط متشابهة جدا. الجانب الآخر الذي يجب مراعاته هو ما إذا كان الوقت من الحقن إلى الحصاد (هنا ، 2-4 دقائق) كافيا لوضع العلامات على غالبية الكريات البيض داخل الأوعية الدموية. بالنظر إلى أن وضع العلامات داخل الأوعية الدموية يسبق وضع العلامات الشاملة ل CD45 ، وبمعدل ضربات قلب يتراوح بين 300 و 700 نبضة في الدقيقة في الفئران16 ، فمن المحتمل جدا أن يكون هناك وضع علامات كاملة على حجرة CD45 داخل الأوعية الدموية. تم تكييف هذه الطريقة من الآخرين الذين استخدموا تركيزات وأوقات متشابهة جدا من الإدارة إلى الحصاد9،10،13. أخيرا ، هناك مسألة أخرى يجب مراعاتها وهي التهجير المحتمل للكريات البيض الناتجة ، من الناحية الفنية في أي من الاتجاهين في الوقت من الحقن إلى الحصاد. قد يختلف هذا أيضا حسب الحالة التجريبية الأساسية. على الرغم من عدم استخدامه هنا ، إلا أن إحدى طرق التغلب على هذا جزئيا على الأقل هي استخدام طرق قياسية أخرى للقتل الرحيم تقلل من الوقت من الحقن إلى الحصاد ، مثل خلع عنق الرحم.
يدور هذا العمل حول توضيح التنظيم اليومي لإصابة الرئة وإصلاحها وتجديدها. على الرغم من أن الجسم بأكمله يخضع لتنظيم الساعة البيولوجية ، إلا أن مراحل هذا التنظيم تختلف حسب نوع العضو والخلية. وبالتالي ، قد تختلف مرحلة إيقاعات الكريات البيض أو أنواعها الفرعية الوظيفية بناء على العضو أو موقع الدورة الدموية. قد يؤدي عدم التمييز بين هاتين المجموعتين في الواقع إلى نتائج سلبية خاطئة في تحليلات مجموعات سكانية فرعية مختلفة من الكريات البيض (إذا كانت المجموعات المنتشرة والرئوية في مرحلة معاكسة ، فقد لا تكون المتوسطات مختلفة بشكل كبير). وبالتالي ، فإن التمييز بين الكريات البيض المنتشرة التي تبقى في الرئة حتى بعد التروية من تلك التي هاجرت بالفعل إلى الرئة وتشارك بنشاط في الشلال الالتهابي أمر ضروري لاكتشاف بيولوجيا تنظيم الساعة البيولوجية. يساعد البروتوكول الموصوف هنا في هذا التمايز. بينما فعلنا ذلك في الرئة ، فإن هذه الطريقة تفسح المجال للتكيف مع الأعضاء الأخرى أيضا. ومع ذلك ، فإن إضافة هذه الخطوات تطيل وقت الحصاد وقد لا تكون مناسبة لجميع التجارب اليومية. وبالتالي ، فإن هذا يستلزم اعتبارا مخصصا حول المكان الذي يكون فيه التمييز بين الكريات البيض داخل الأوعية الدموية وداخل المتني أكثر صلة.
في الختام ، وصفنا بالتفصيل طريقة للتمييز بين الكريات البيض داخل الأوعية الدموية المتبقية والكريات البيض داخل الرئة وهضم الرئة القائم على التضخم. ستعمل هذه التقنيات على تعزيز إنتاجية تعليق الخلية المفردة من الرئة وتحسين صرامة وقابلية تكرار دراسات قياس التدفق. أخيرا ، هذا له أهمية خاصة لأولئك الذين يدرسون إيقاعات الساعة البيولوجية.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل NHLBI-K08HL132053 (SS). يشكر المؤلفون الدكتور جي إيه فيتزجيرالد على الوصول إلى مجهر تشريح وحمام مائي مهتز.
Materials
| Name | Company | Catalog Number | Comments |
| Boekel Scientific Medium Water Bath | Boekel Grant Scientific | 290200 | |
| 10 mL BD Syringes with BD Luer-Lok Tip | BD Biosciences | 309604 | |
| 5 mL BD Syringes with BD Luer-Lok Tip | BD Biosciences | 309646 | |
| Anti-CD45- Pac Blue | Biolegend | 103114 | |
| Anti-CD45- Pe/Cy7 | Biolegend | 103114 | |
| Cell strainer 70 µm Nylon | Fisher | 352350 | |
| Corning Conical-Bottom Centrifuge Tube 50 mL | Avantor | 21008-714 | |
| Corning Falcon Test Tube with Cell Strainer Snap Cap | EMSCO | 10004637 | |
| Dissection Microscope | Olympus | SZX-SDO2 | |
| DMEM, high glucose | Life Technologies | 11965084 | |
| Dnase | Roche | 10104159001 | |
| DPBS without Ca++ & Mg++ | 14190136 | ||
| Fc Block | Biolegend | 101320 | |
| HyClone Fetal Bovine Serum | GE Healthcare | SH30071.03 | |
| L-Glutamine (200 mM) | Life Technologies | 25030-081 | |
| Liberase Research Grade | Sigma | 5401127001 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140-122 | |
| Precision Shaking Water Bath | Thermo Fisher | TSSWB15 | |
| Red Blood Cell Lysing Buffer | Sigma | R7757 | |
| Suture Silk 4-0 | Roboz | SUT-15-2 |
References
- Partch, C. L., Green, C. B., Takahashi, J. S. Molecular architecture of the mammalian circadian clock. Trends in Cell Biology. 24, 90-99 (2014).
- Man, K., Loudon, A., Chawla, A. Immunity around the clock. Science. 354, 999-1003 (2016).
- Haspel, J. A., et al. Perfect timing: circadian rhythms, sleep, and immunity - an NIH workshop summary. JCI Insight. 5, (2020).
- Nosal, C., Ehlers, A., Haspel, J. A. Why Lungs Keep Time: Circadian Rhythms and Lung Immunity. Annual Review of Physiology. 82, 391-412 (2020).
- Gibbs, J., et al. An epithelial circadian clock controls pulmonary inflammation and glucocorticoid action. Nature Medicine. 20, 919-926 (2014).
- Ehlers, A., et al. BMAL1 links the circadian clock to viral airway pathology and asthma phenotypes. Mucosal Immunology. 11, 97-111 (2018).
- Sengupta, S., et al. Circadian control of lung inflammation in influenza infection. Nature Communications. 10, 4107 (2019).
- Zhang, R., Lahens, N. F., Ballance, H. I., Hughes, M. E., Hogenesch, J. B. A circadian gene expression atlas in mammals: implications for biology and medicine. Proceedings of the National Academy of Sciences of the United States of America. 111, 16219-16224 (2014).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nature Protocols. 9, 209-222 (2014).
- Gibbings, S. L., Jakubzick, C. V. Isolation and Characterization of Mononuclear Phagocytes in the Mouse Lung and Lymph Nodes. Methods in Molecular Biology. 1809, 33-44 (2018).
- Vines, D. C., Green, D. E., Kudo, G., Keller, H. Evaluation of mouse tail-vein injections both qualitatively and quantitatively on small-animal PET tail scans. Journal of Nuclear Medicine Technology. 39, 264-270 (2011).
- Tighe, R. M., et al. Improving the Quality and Reproducibility of Flow Cytometry in the Lung. An Official American Thoracic Society Workshop Report. American Journal of Respiratory Cell and Molecular Biology. 61, 150-161 (2019).
- Anderson, K. G., et al. Cutting edge: intravascular staining redefines lung CD8 T cell responses. Journal of Immunology. 189, 2702-2706 (2012).
- Gibbings, S. L., et al. Three Unique Interstitial Macrophages in the Murine Lung at Steady State. American Journal of Respiratory Cell and Molecular Biology. 57, 66-76 (2017).
- Steel, C. D., Stephens, A. L., Hahto, S. M., Singletary, S. J., Ciavarra, R. P. Comparison of the lateral tail vein and the retro-orbital venous sinus as routes of intravenous drug delivery in a transgenic mouse model. Lab Animals (NY). 37, 26-32 (2008).
- Ho, D., et al. Heart Rate and Electrocardiography Monitoring in Mice. Current Protocols in Mouse Biology. 1, 123-139 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved