Method Article
肺内免疫細胞と血管内免疫細胞集団の区別:頸静脈内アプローチ
要約
現在の研究の目的は、肺の炎症の研究において血管内免疫細胞と実質内免疫細胞を区別するためのプロトコルを説明することです。肺摘出前に蛍光タグ付き抗体の頸静脈内注射を使用します。さらに、インフレーションベースの肺消化プロセスを使用して、肺からの白血球の収量を改善します。
要約
概日リズムとは、24時間の周期で発生するさまざまな生物学的プロセスの振動を指します。分子レベルでは、このようなリズムは、コアクロック遺伝子の転写-翻訳フィードバックループ(TTFL)の網で構成されています。免疫系を含む個々の組織や臓器系には、独自の時計があります。体循環では、CD45+ 集団のさまざまなメンバーが一日中振動します。しかし、これらのリズムの多くは、組織に常在するCD45+ 白血球集団では同一ではなく、類似しているわけでもありません。肺の炎症の概日調節の役割を研究する場合、肺内のCD45+ を調査する必要があるかもしれません。しかし、最適化された灌流法にもかかわらず、循環から捕捉された白血球は肺に残ります。このプロトコルを設計する際の目標は、血管内白血球と実質内白血球を区別することでした。この目的のために、マウスに蛍光タグ付きCD45抗体を肺採取の直前に頸静脈内に注射します。その後、カスタマイズされた肺消化技術を用いて肺を消化し、単一細胞懸濁液を得る。サンプルは、実質内免疫細胞(別のCD45抗体を含む)の抗体の通常のパネルについて染色されます。フローサイトメトリー解析により、集団の明確な解明が示されています。したがって、肺内免疫細胞と循環免疫細胞の挙動が数値的および機能的に異なる場合、肺内CD45+ 細胞を標識および定義する方法が特に重要になります。
概要
ここでは、血管内白血球と肺白血球を区別する効率的で信頼性の高い方法について説明します。最高の灌流技術を使用しても、研究により、循環からの残留CD45+ が肺に持続することが明らかになりました。これにより、循環と肺のリズムを区別する能力が損なわれます。この影響は、肺の炎症の場合にさらに増幅されます。これは、炎症の概日調節の研究に特に関連しています。
概日リズムとは、24時間の周期で発生するさまざまな生物学的プロセスにおける日周振動を指します。概日システムは、進化的に保存された予測メカニズムであり、感染の脅威などの環境の変化に直面したときに宿主に保護を与えます。細胞レベルでは、時計はコアクロック遺伝子1を含む自立した転写翻訳フィードバックループに編成されています。免疫系には、病原体や炎症性侮辱に対する反応に影響を与える独自の時計があります2,3。常に環境にさらされる器官として、概日リズムは肺において特に重要である4。肺のさまざまな免疫プロセスは、時計の制御下にあります5,6,7。しかし、肺内のさまざまな生物学的プロセスの位相と体循環は同じではなく8、ひいては、肺の白血球の振動と循環が同一ではない可能性があることも示唆しています。したがって、肺白血球と血管内白血球を効率的に区別する方法を持つことは、概日リズムの文脈で重要になります。
本研究の目的は、血管内白血球と実質内白血球を確実に鑑別できる方法を考案することでした。このために、血管内白血球の標識と肺消化法を使用しました。血管内白血球の標識には、大血管を標的とする頸静脈内注射法を使用し、あらゆる系統やサイズのマウスで再現性よく使用することができます。他の多くの方法で尾静脈注射9,10が使用されており、これはBl6マウス11で実施するのが難しいことで有名です。頸静脈内注射は麻酔の使用を必要とし、解剖顕微鏡または拡大ルーペによる直接視覚化の下で行うのが最適です。したがって、頸静脈内注射の容易さと信頼性は、麻酔と特別な機器の必要性と比較検討する必要があります。しかし、これらの機器がほとんどの研究室ですぐに利用できることを考えると、これが制限要因になるとは考えていません。ただし、ケースバイケースで検討することが賢明であるように思われます。
プロトコル
すべての動物実験は、ペンシルバニア大学の施設動物管理および使用委員会によって承認され、実験動物の世話および使用に関するガイドの規定を満たしています。
注:全体的なプロセスは、1)静脈内CD45標識、2)収穫、3)消化、および4)染色およびフローサイトメトリーに分けることができます。これらの手順を 図 1 にまとめました。
1. 溶液/試薬調製
- 5 mLの2 mM L-グルタミン、20 mLのウシ胎児血清(FBS)、1 mLの2-メルカプトエタノール、および10 mLのPen/Strepを500 mLのDMEMに加えて、解離培地を調製します。
注:解離培地は、2〜4°Cで保存した場合、最大2ヶ月間安定です。 - マグネシウムまたはカルシウムを含まないPBS500 mLに、10 mLのFBSと500 mgのアジ化ナトリウムを加えて、蛍光活性化セルソーティング(FACS)バッファーを調製します。
注:アジ化ナトリウムを添加すると、FACSバッファーは2〜4°Cで数ヶ月間保存できます。 - サンプル採取当日に、DNase溶液とLiberase 溶液を 1:100 希釈で解離培地に添加します (つまり、解離培地 1 mL ごとに 10 μL の DNase とリベラーゼを添加します)。
注:各マウスについて、肺全体の消化にはマウスあたり10 mL、肺の半分にはマウスあたり5 mLが必要です。
2. CD45の静脈内標識
- この実験では、8〜12週齢の成体C57Bl6マウスを使用します。
- 選択した薬剤でマウスを麻酔します。この目的のためにキシラジンとケタミンの組み合わせが使用されましたが、他の薬剤も許容されます。目的は、約5〜10分続く中等度から深部の麻酔を受けることです。
注:キシラジンとケタミンの麻酔混合物は腹腔内に投与されます。.キシラジン10〜15 mg / kgとケタミン120〜150 mg / kgを使用してください。. - ペダル反射が陰性になったら、動物を仰向けに置き、手足を優しくテープで留めて、頭をできるだけ中央に保ちます。
- 鉗子で皮膚を持ち上げ、鋭利な手術用ハサミで切り取ることにより、頸静脈と胸筋を露出させます。
- 200 μL の抗 CD45 抗体 (フローサイトメトリーグレードの抗体、PBS で 1:300 に希釈) を 28 G の針を使用して頸静脈に注入します。抗体が血管系全体に循環できるように、2〜4分待ちます。
注:浅い角度から胸筋を通って頸静脈に入ると、かなりの出血が発生するのを防ぎます。 - その後、CO2 に10分間さらして動物を安楽死させます。肺灌流に進み、肺や他の組織を採取します。
注:動物の安楽死に関するAVMAガイドラインに準拠した人道的な安楽死の他の方法も受け入れられます。
3. 解剖/採取(図1)
- 動物を平らな板の上に仰向けに置き、頭を中央に保ちながら前足を固定します。
- 70%エタノールをボディにスプレーします。鉗子とハサミで胸腔を開き、肺、心臓、気管を露出させます。
- 心臓の左心室に小さな切開を行い、右心室から10mLの冷たいPBSを注入することにより、肺を灌流します。
- 気管の開口部を切り取り、静脈カニューレを挿入します。カニューレが挿入されたら、気管の下に長さ約6〜8cmの縫合糸を通し、カニューレに2回結びます。
- 手術用弦をカニューレに押し込み、 図1Bに示すように、解離媒体(肺の半分に5 mL、肺全体に10 mL)が入ったシリンジを取り付けます。
- 肺を体の他の部分からそっと切り取り、肺を取り付けたシリンジを50mLの円錐形チューブに入れます。
4. 単一細胞懸濁液への消化
- 肺を37°Cで30〜40分間インキュベートし、5分ごとに1 mL(肺の半分)または2 mL(肺全体)の解離培地を点眼します。
- すべての培地が点眼されたら、シリンジとカニューレを取り外し、50 mLのコニカルチューブを180 rpmの振とう水浴に入れ、インキュベーションの残りの期間、収量を向上させます。
注:または、チューブを5分ごとに手動で振ることもできます。 - PBS10mLを加え、1分間激しく振とうして反応を止めます。
- 溶液をセルストレーナー(70 μm)に通し、新しい50 mLコニカルチューブに入れます。5 mLシリンジゴム栓を使用して、組織の塊をストレーナーに通します。.最終容量が30mLになるようにPBSを添加します。
- サンプルを1,200 x g 、4°Cで10分間遠心分離します。 ペレットを乱さずに上清を捨てます。残りの溶液をピペットで取り出します。
- 赤血球(RBC)Lysis Buffer 1 mLを添加し、ピペッティングで細胞ペレットと混合します。
- 室温で60〜90秒間インキュベートします。反応を停止するために、最終容量が30mLになるようにPBSを添加します。
注:インキュベーション時間は、細胞ペレット中の血液量によって異なります。細胞ペレットが赤くなるほど、インキュベーション時間は長くなります。 - サンプルを1,200 x g 、4°Cで10分間遠心分離します。 ペレットを乱さずに上清を捨てます。残りの溶液をピペットで取り出します。
- 1 mLのFACバッファーを細胞ペレットに加え、ピペッティングで混合します。
5. フローサイトメトリーのための細胞染色
- セルカウンターを使用して、細胞懸濁液中の細胞の総数を決定します。
- 細胞懸濁液を各標識FACSチューブに移し、サンプルあたり合計3 x 106 個の細胞が存在するようにします。
- Fc Block(1:100に希釈)を加え、氷上で15分間インキュベートします。
- チューブを1,200 x g 、4°Cで5分間遠心分離します。 ペレットを乱さずに上清を捨てます。
- サンプルを所定の抗体混合物で染色し、光から保護された氷上で20分間インキュベートします(すなわち、アルミホイルで覆います)。インキュベーションの途中でチューブホルダーに対してチューブをラッキングして混合します。
- 1 mLのFACSバッファーを加えて洗浄し、ピペッティングで混合します。
- 細胞懸濁液を別のFACSチューブに移し、懸濁液を35μmのストレーナーでゆっくりとピペッティングします。
- チューブを1,200 x g 、4°Cで5分間遠心分離します。 ペレットを乱さずに上清を捨てます。
- 150 μLのFACSバッファーを加え、ピペッティングで混合します。
- サンプルを泳動する直前に、各チューブに10 μLのDAPI(1:100)を加えます。
注:これで、サンプルをフローサイトメーターで分析する準備が整いました。
結果
この手法を用いて、ナイーブ解離肺(代表データには左葉のみを使用)の総細胞数は、27.3 x 106 〜71.1 x 106 細胞/mLであった。サイズでゲーティングし、ダブレットと死細胞をゲーティングアウトした後( 図2のゲーティングスキーム)、白血球数は6.9 x 106 から13.5 x 106 細胞/mLの範囲でした。灌流後も閉じ込められたままの循環白血球が肺をきれいにすることは、実験の生細胞の約4%から13%を占めていました。解離した肺のすべての白血球はPE-Cy7上のCD45に染色されますが、循環する白血球のみがPE-Cy7とPac blueの両方の蛍光色素でCD45抗体で二重染色されます。灌流のプロセスを標準化したにもかかわらず、解離した肺の全白血球の約24%から70%が循環白血球プールに属していることがわかりました。血管内標識を考慮しない場合の平均白血球数は 10.2 x 106 細胞/mL でしたが、補正値は 4.93 x 106 細胞/mL でした(図 3A)。したがって、灌流後も持続する残存血管内白血球を区別できないと、肺白血球の数が大幅に過大評価されます。この実験では、動物は8-12週齢で、解剖時の体重は25-30gでした。極端な年齢と体重に対しては、用量の調整が必要になる場合があります。.他の有用なコントロールには、血管内白血球の良好な標識を示すための血管内サンプルの使用、および血液からの標識白血球のトランスマイグレーションによるすべての組織の拡散標識の可能性を排除するための非標識組織(リンパ節など)からのサンプルを使用することが含まれます。
研究課題には概日サンプリングが含まれることが多いため、肺採取が行われた時刻(動物)ごとにデータをさらに分類しました。概日規則により、ZT0は照明が点灯する時間を指します。夜明け(ZT23:休息期の開始)と夕暮れ(ZT11:活動期の開始)の2つの時点として用いた。我々は、実質内白血球と残存血管内白血球の割合が解剖時の時間帯によって異なることに注目する(図3B)。この実験では、光制御された概日ボックスを使用してマウスを逆の明暗(LD)サイクルに維持したため、ZT11マウスとZT23マウスは従来の同じ時間に逆相になり、同時に収穫することができました。したがって、両方のグループの肺は、1日のうちの同じ時間に標識、採取、消化されたため、 図3 のこれらの違いは、処理の違いに起因するものではありません。

図1:肺の膨張と消化の概略図。 (A)マウスの麻酔から抗体染色ステップまでの全体的な実験デザイン。(B)肺採取のカニューレ挿入ステップの画像。 この図の拡大版を表示するには、ここをクリックしてください。
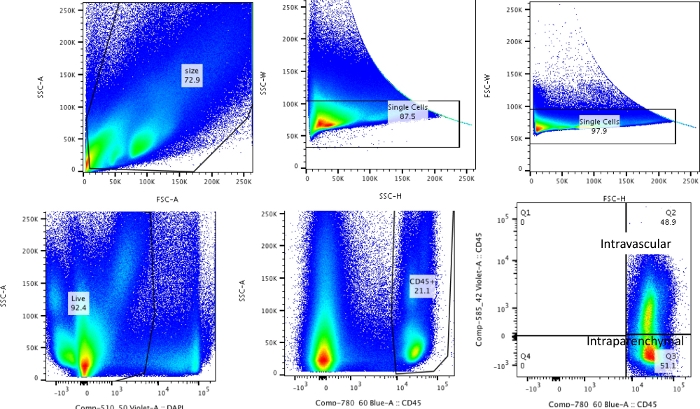
図 2: ゲーティング戦略。 血管内白血球と肺に真に存在する白血球を区別するために使用されるゲーティング戦略。 この図の拡大版を表示するには、ここをクリックしてください。
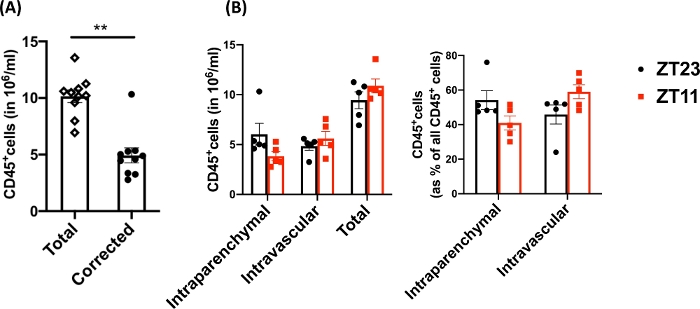
図3:実質内白血球と血管内白血球の比較。 (A)従来の消化および標識を使用した白血球数(106 細胞/ mL)と、肺から除去されなかった残存血管内白血球を補正した数を比較しました。スチューデントのt検定によるP<0.0001。±(B)夜明け(ZT23)または夕暮れ(ZT11)に採取された肺からの白血球数と割合。(右パネル)2元配置分散分析、収穫時とラベル付けされたコンパートメントの両方でp >0.05、ただし相互作用の場合はp<0.05。データは平均±SEMで表されます。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
肺の炎症と肺の免疫応答に関する慎重な研究は、多くの疾患状態を理解するために重要です。フローサイトメトリーは、肺白血球の機能的関連性を列挙し、帰属させるために日常的に使用されています。白血球の機能は、少なくとも部分的には白血球がどこにあるかに依存します。完全な灌流プロトコルの後でも、多くの血管内白血球が肺に持続することを裏付ける証拠が蓄積されていますが、ほとんどの研究では肺内白血球と血管内白血球を区別していません。さらに、灌流後も肺に残存する残存血管内白血球は、調製物に応じてサンプル全体にランダムに分布する可能性が高いため、結果にどのように影響するかを予測することは不可能です。これは、結果の一般化可能性を妨げ、フローサイトメトリー12を含む研究の厳密性と再現性に対する脅威となります。
ここでは、血管系から残存する白血球を決定し、それらを真の肺内白血球と区別する方法について説明しました。このような方法は過去9,13,14でも使用されてきましたが、最も効率的な調製にするために、ラベリングと消化を改良しました。他の報告では、血管内標識10に眼窩後静脈注射または尾静脈注射を使用することが記載されている。眼窩後注射は動物により多くの痛みを与えるため、より高いレベルの規制当局による精査が必要です。尾静脈注射は麻酔を必要としませんが、特にC57bl6動物では技術的により困難です11。この頸静脈内アプローチは、顕微鏡下での施術を比較的無痛で容易にすることで、これらの欠点を克服します。我々は、ここで若年成人マウスのための手順を説明したが、頸静脈内マウスのサイズが大きいことを考えると、このプロトコルは小動物15に対して使用され得る。手順の容易さにより、ラベリングは動物間で一貫性が保たれ、結果の厳密さと再現性が向上します。
このプロトコルの重要なステップには、血管内注射と肺採取の再現性が含まれます。頸静脈内注射に必要な追加の考慮事項は、麻酔と拡大装置(拡大ルーペまたは解剖顕微鏡)の必要性です。これらのステップはどちらも習得するには練習が必要であり、十分に習得しないとばらつきが増す可能性があります。頸静脈内注射では、誤った技術が過度の出血を引き起こし、死に至る可能性があります。そのため、視覚化を支援する機器に重点が置かれています。肺の収穫の場合、技術が不十分な場合、気管の破裂につながる可能性があります。肺消化の他の方法(メスを使って肺を切り刻むなど)を進めることもできますが、私たちの経験では、細胞数がはるかに少なくなり、サンプル間のばらつきが大きくなる傾向があります。
追加のステップから生じるもう1つの重要な懸念は、総処理時間が長くなり、サンプルの生存率が低下し、したがってデータの品質が低下する可能性があることです。消化前に血管内白血球を標識することにより、調製したサンプルの生存率がプロトコールで悪影響を受けないようにします。さらに、インフレーション技術を使用して消化酵素を肺全体に分配することで、消化が均一であり、肺組織を解離する他の方法よりも確実に多くの細胞を生成することが保証されます7。この標識法には、血管内抗体の投与経路とは無関係に共通する、考慮すべき追加の懸念事項はほとんどありません。これには、2つのCD45抗体間の競合的結合の可能性が含まれます。これは、CD45抗体の異なるクローンを使用することで部分的に軽減できますが、使用する2つの抗体が非常に類似した結合親和性を持つように注意する必要があります。考慮すべき他の側面は、注入から採取までの時間(ここでは2〜4分)が血管内白血球の大部分を標識するのに十分であるかどうかです。血管内標識が全体のCD45標識に先行し、マウス16における心拍数が毎分300〜700拍であることを考えると、血管内CD45コンパートメントの完全な標識が存在する可能性が非常に高い。この方法は、投与から収穫まで非常に類似した濃度と時間を使用した他の方法から適応されました9,10,13。最後に、考慮すべき別の問題は、結果として生じる白血球が、注入から収穫までの時間において、技術的にはどちらの方向にも移行する可能性があることです。これは、基礎となる実験条件によっても異なる場合があります。ここでは使用しませんが、これを少なくとも部分的に克服する1つの方法は、子宮頸部脱臼など、注射から採取までの時間を短縮する他の標準的な安楽死方法を使用することです。
この研究は、肺の損傷、修復、再生の概日調節の解明を中心に展開しています。全身は概日リズムの調節下にありますが、その調節の段階は臓器や細胞の種類によって異なります。したがって、白血球のリズムの位相またはその機能的サブタイプは、器官または循環部位に基づいて異なる可能性があります。これら 2 つの集団を区別しないと、実際には、さまざまな白血球亜集団の分析で偽陰性の結果が生じる可能性があります (循環集団と肺集団が反対の位相にある場合、平均は大きく異なるとは限りません)。したがって、灌流後も肺に残っている循環白血球と、すでに肺に移動し、炎症カスケードに積極的に関与している白血球を区別することは、概日調節の生物学を発見するために不可欠です。ここで説明するプロトコルは、この区別に役立ちます。これは肺で行いましたが、この方法は他の臓器にも適応させるのに適しています。ただし、これらのステップを追加すると、収穫までの時間が長くなり、すべての概日実験に適しているとは限りません。したがって、これには、血管内白血球と実質内白血球の鑑別が最も関連性のある場所について、カスタマイズされた考慮事項が必要になります。
結論として、残存血管内白血球と肺内白血球を区別する方法と、膨張に基づく肺消化について詳細に説明しました。これらの技術により、肺からの単一細胞懸濁液の収量が向上し、フローサイトメトリー研究の厳密性と再現性が向上します。最後に、これは概日リズムを研究する人々にとって特に関連性があります。
開示事項
著者は何も開示していません。
謝辞
この作業は、NHLBI-K08HL132053(SS)の支援を受けました。著者らは、解剖顕微鏡と振とう水槽へのアクセスを提供してくれたG.A.フィッツジェラルド博士に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Boekel Scientific Medium Water Bath | Boekel Grant Scientific | 290200 | |
| 10 mL BD Syringes with BD Luer-Lok Tip | BD Biosciences | 309604 | |
| 5 mL BD Syringes with BD Luer-Lok Tip | BD Biosciences | 309646 | |
| Anti-CD45- Pac Blue | Biolegend | 103114 | |
| Anti-CD45- Pe/Cy7 | Biolegend | 103114 | |
| Cell strainer 70 µm Nylon | Fisher | 352350 | |
| Corning Conical-Bottom Centrifuge Tube 50 mL | Avantor | 21008-714 | |
| Corning Falcon Test Tube with Cell Strainer Snap Cap | EMSCO | 10004637 | |
| Dissection Microscope | Olympus | SZX-SDO2 | |
| DMEM, high glucose | Life Technologies | 11965084 | |
| Dnase | Roche | 10104159001 | |
| DPBS without Ca++ & Mg++ | 14190136 | ||
| Fc Block | Biolegend | 101320 | |
| HyClone Fetal Bovine Serum | GE Healthcare | SH30071.03 | |
| L-Glutamine (200 mM) | Life Technologies | 25030-081 | |
| Liberase Research Grade | Sigma | 5401127001 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140-122 | |
| Precision Shaking Water Bath | Thermo Fisher | TSSWB15 | |
| Red Blood Cell Lysing Buffer | Sigma | R7757 | |
| Suture Silk 4-0 | Roboz | SUT-15-2 |
参考文献
- Partch, C. L., Green, C. B., Takahashi, J. S. Molecular architecture of the mammalian circadian clock. Trends in Cell Biology. 24, 90-99 (2014).
- Man, K., Loudon, A., Chawla, A. Immunity around the clock. Science. 354, 999-1003 (2016).
- Haspel, J. A., et al. Perfect timing: circadian rhythms, sleep, and immunity - an NIH workshop summary. JCI Insight. 5, (2020).
- Nosal, C., Ehlers, A., Haspel, J. A. Why Lungs Keep Time: Circadian Rhythms and Lung Immunity. Annual Review of Physiology. 82, 391-412 (2020).
- Gibbs, J., et al. An epithelial circadian clock controls pulmonary inflammation and glucocorticoid action. Nature Medicine. 20, 919-926 (2014).
- Ehlers, A., et al. BMAL1 links the circadian clock to viral airway pathology and asthma phenotypes. Mucosal Immunology. 11, 97-111 (2018).
- Sengupta, S., et al. Circadian control of lung inflammation in influenza infection. Nature Communications. 10, 4107 (2019).
- Zhang, R., Lahens, N. F., Ballance, H. I., Hughes, M. E., Hogenesch, J. B. A circadian gene expression atlas in mammals: implications for biology and medicine. Proceedings of the National Academy of Sciences of the United States of America. 111, 16219-16224 (2014).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nature Protocols. 9, 209-222 (2014).
- Gibbings, S. L., Jakubzick, C. V. Isolation and Characterization of Mononuclear Phagocytes in the Mouse Lung and Lymph Nodes. Methods in Molecular Biology. 1809, 33-44 (2018).
- Vines, D. C., Green, D. E., Kudo, G., Keller, H. Evaluation of mouse tail-vein injections both qualitatively and quantitatively on small-animal PET tail scans. Journal of Nuclear Medicine Technology. 39, 264-270 (2011).
- Tighe, R. M., et al. Improving the Quality and Reproducibility of Flow Cytometry in the Lung. An Official American Thoracic Society Workshop Report. American Journal of Respiratory Cell and Molecular Biology. 61, 150-161 (2019).
- Anderson, K. G., et al. Cutting edge: intravascular staining redefines lung CD8 T cell responses. Journal of Immunology. 189, 2702-2706 (2012).
- Gibbings, S. L., et al. Three Unique Interstitial Macrophages in the Murine Lung at Steady State. American Journal of Respiratory Cell and Molecular Biology. 57, 66-76 (2017).
- Steel, C. D., Stephens, A. L., Hahto, S. M., Singletary, S. J., Ciavarra, R. P. Comparison of the lateral tail vein and the retro-orbital venous sinus as routes of intravenous drug delivery in a transgenic mouse model. Lab Animals (NY). 37, 26-32 (2008).
- Ho, D., et al. Heart Rate and Electrocardiography Monitoring in Mice. Current Protocols in Mouse Biology. 1, 123-139 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved