Method Article
Люблинский протокол эмболизации маточных артерий в лечении симптоматической миомы матки
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем метод эмболизации маточных артерий для лечения симптоматической миомы матки, разделенный на пять разделов: квалификация, подготовка, проведение, послепроцедурный уход и последующие визиты. Этот протокол требует тесного сотрудничества между гинекологами и интервенционными радиологами, что позволяет правильно выполнить вышеуказанную процедуру.
Аннотация
Миома матки – это доброкачественная опухоль, происходящая из гладкой мышечной ткани, составляющая строму мышц матки. Миома матки является наиболее распространенным доброкачественным образованием, встречающимся у женщин. У 20–50% женщин миома протекает бессимптомно и не требует лечения. Основными симптомами миомы матки являются обильные менструальные кровотечения, аномальные маточные кровотечения и симптомы давления. Симптомы давления могут вызывать синдром тазовой боли, нарушения мочеиспускания и запоры.
Методы лечения, которые используются в настоящее время, включают хирургическое лечение, фармакологическую терапию и минимально инвазивные процедуры. Наиболее часто применяемым малоинвазивным методом является эмболизация маточных артерий. Эта процедура в настоящее время является широко признанным методом лечения симптоматической миомы матки и была признана таковой Национальным институтом здоровья и клинического мастерства в рекомендациях по обильным менструальным кровотечениям.
Это сложная процедура, которая требует тесного сотрудничества между гинекологами и интервенционными радиологами. Мы представляем протокол, применимый к эмболизации маточных артерий при лечении симптоматической миомы матки. Протокол разделен на пять разделов. Первые два раздела предназначены для гинекологов и интервенционных радиологов, в них объясняется, как квалифицировать и подготовить пациента к эмболизации в поэтапном порядке. В третьем разделе, предназначенном для интервенционных радиологов, объясняется, как следует проводить эмболизацию. Четвертый раздел предназначен для гинекологов или врачей больничных палат, которые наблюдают за пациентками после эмболизации. В этом разделе протокола предлагается метод лечения боли после эмболизации с использованием помпы для контролируемой пациентом анальгезии (PCA). Пятая секция завершает процедуру оценкой последствий и отдаленных осложнений эмболизации маточных артерий.
Все пять разделов создают единый протокол, предназначенный для клиницистов, экспертов и исследователей, новичков в этой области.
Введение
Миома матки – это доброкачественная опухоль, происходящая из гладкой мышечной ткани, составляющая строму мышц матки. Они представляют собой моноклональные опухоли, состоящие из большого количества внеклеточного вещества, содержащего коллаген, фибронектин и протеогликаны. Миома окружена тонкой псевдокапсулой, состоящей из сжатых мышечных волокон, коллагеновых волокон, нейроволокон и кровеносных сосудов 1,2. Патофизиология миом до конца не изучена, но, по-видимому, опирается в основном на моноклональную пролиферацию, вызванную селективными и тканеспецифичными эпигенетическимиизменениями. Не было обнаружено ни одного гена, вызывающего миому матки. Тем не менее, наличие редких синдромов миомы матки, таких как множественный кожный и маточный лейомиоматоз, было приписано гену, который кодирует фумаратгидратазу, митохондриальный фермент, участвующий в циклеКребса 4. Наличие делеций и транслокаций хромосомы 7 в хромосомах 7, 12 и 14, которые встречаются у 50% миом, по-видимому, является вторичным, а не первичным 5,6,7.
Регуляторами роста миомы матки являются стероидные гормоны, вырабатываемые яичниками (эстрогены и прогестерон), факторы роста, ангиогенеза и апоптоза. Также были выявлены факторы риска развития миомы матки, включая возраст, раннее менархе, афроамериканскую расу, наследственность, нерожание, ожирение, синдром поликистозных яичников, диабет, гипертонию, дефицит витамина D, употребление соевого молока, алкоголяи кофеина.
Миома матки является наиболее распространенным доброкачественным образованием репродуктивных органов у женщин. Эти опухоли были впервые описаны в 1793 году Мэтью Бэйли в больнице Святого Георгия в Лондоне. Имеющиеся эпидемиологические данные не позволяют точно определить частоту возникновения миомы матки, так как большая их доля остается недиагностированной. По оценкам, миома матки встречается у 5,4–77% всех пациенток. Их распространенность в Соединенных Штатах выше, чем в Европе, вероятной причиной являются расовые различия8.
Среди женщин детородного возраста примерно у 30% миом могут проявляться клинические симптомы в виде аномальных маточных кровотечений, что приводит к недостаточному кровоснабжению у пациенток9. В большинстве случаев у пациенток наблюдается более одной миомы, которая представляет собой сферические очаги поражения, расположенные в матке. Их размеры и расположение могут отличаться. В 90% случаев они располагаются в теле матки. Их диаметр может составлять от нескольких миллиметров до 20 см10.
Классификация FIGO (Fédération Internationale de Gynécologie et d'Obstétrique) делит их на группы от 0 до 8 в зависимости от близости эндометрия (чем меньше число, тем ближе будет эндометрий) (Рисунок 1)11. Примерно в 50–75% случаев миома протекает бессимптомно. Наиболее распространенными симптомами миомы матки являются обильные менструальные кровотечения, аномальные маточные кровотечения и симптомы давления. Миомы связаны примерно с 10% случаев бесплодия, а в 1–3% они являются единственной причиной12. Бессимптомная миома матки обычно проходит только регулярный врачебный контроль, тогда как симптоматическая миома является показанием к лечению13.
Методы лечения миомы матки, которые в настоящее время используются, включают хирургическое лечение, фармакологическую терапию и минимально инвазивные процедуры 13,14,15,16,17,18. Хирургическое лечение включает миомэктомию (абдоминальную и гистероскопическую) и гистерэктомию. Как миомэктомия, так и гистерэктомия оказывают положительное влияние на качество жизни19. Гистерэктомия связана с необратимой потерей фертильности; Таким образом, многие женщины ищут другие варианты лечения20.
Абдоминальная миомэктомия позволяет сохранить фертильность. В зависимости от размера и количества миомы, а также опыта хирурга, эта процедура может быть выполнена с помощью лапаротомии или лапароскопии. Хотя кровоизлияния встречаются реже, чем при гистерэктомии, общая заболеваемость аналогична. Гистероскопическая миомэктомия является более безопасным и менее инвазивным методом, чем абдоминальная миомэктомия, и позволяет лечить субмукозную миому (FIGO 0). Последующие гистероскопические процедуры могут потребоваться для полного удаления более крупных миом 2-го типа21.
Внутриматочные спирали, высвобождающие левоноргестрел, являются эффективным средством для лечения обильных менструальных кровотечений, но они не уменьшают размер миомы. Их применение ограничено у пациенток с деформированной полостью матки. Аналоги ГнРГ в основном используются в качестве предоперационного средства для уменьшения размеров миомы и периоперационной кровопотери. Они также уменьшают процент вертикальных разрезов во время гистерэктомии и миомэктомии, увеличивая при этом возможность проведения вагинальной процедуры20.
В краткосрочной перспективе селективные модуляторы рецепторов прогестерона уменьшают объем миомы и индуцируют аменорею. Тем не менее, долгосрочная эффективность и безопасность требуют дальнейших исследований. Наряду с ингибиторами ароматазы могут существовать и другие варианты предоперационного лечения анемии и уменьшения объема миомы22. Некоторые исследования показывают, что витамин D может замедлять или предотвращать рост миомы ипоявление симптомов.
Также разрабатываются новые методы с использованием 2-метоксиэстрадиола в сочетании с наночастицами24. Минимально инвазивные методы, используемые в лечении миомы, включают эмболизацию маточных артерий (ЭМА), фокусированную ультразвуковую хирургию под контролем магнитно-резонансного томография (MRgFUS), лапароскопическую окклюзию маточных артерий (LUAO) и радиочастотный миолиз14,25. Высокоинтенсивный сфокусированный ультразвук под ультразвуковым контролем (US-HIFU) является новым, все еще экспериментальным, минимально инвазивным методом26,27.
О методах лечебной окклюзии сосудов и блокирования кровоснабжения матки говорилось более 120 лет назад. В 1894 году Келли представил лигирование внутренних подвздошных артерий во время онкологической гистерэктомии для контроля трудноизлечимого тазового кровотечения, которое в то время было распространенным осложнением послехирургической процедуры. Затем Сак (1973) описал эффективное использование той же техники в лечении массивного послеродового кровотечения после родов с помощью щипцов. В обоих случаях гемостаз был достигнут без гистерэктомии29. В 1979 году Heaston et al. и Brown et al. независимо друг от друга описали эмболизацию тазовых артерий с использованием абсорбируемых желатиновых губок для контроля послеродового кровотечения 30,31.
ЭМА впервые была использована в качестве метода лечения симптоматической миомы матки в 1991 году во Франции32. Первоначально он использовался для уменьшения кровопотери после миомэктомии. В 1995 году Ravina et al. предложили эту процедуру в качестве основного метода лечения симптоматической миомы матки33. В США эмболизация маточных артерий была успешно проведена в 1997 году34 года.
Растущий интерес к сохранению матки у женщин с симптоматической миомой поставил ЭМА на передний край минимально инвазивного лечения миомы 14,18,35,36,37. В 2000 году была создана Совместная рабочая группа Королевского колледжа акушеров и гинекологов и Королевского колледжа радиологов для выпуска рекомендаций по ОАЭ. В то время ОАЭ считался экспериментальным методом (менее 7 000 процедур, проведенных во всем мире). С момента публикации рекомендаций по всему миру было проведено более 100 000 процедур в ОАЭ. Кроме того, было проведено пять рандомизированных контролируемых исследований, в которых сравнивали ОАЭ с другими хирургическими процедурами. Результаты исследований показывают, что ЭМА обладает высокой эффективностью в краткосрочной и среднесрочной перспективе (до нескольких лет) с низким риском средних (например, инфекции матки) и серьезных (угрожающих жизни) осложнений38,39. В рандомизированных исследованиях более короткое время госпитализации, более быстрое выздоровление и возвращение к повседневной деятельности говорят в пользу ОАЭ. Хирургические процедуры оказались более дешевыми и реже требовали повторного вмешательства при сохранении статистической значимости32. Эта процедура в настоящее время является широко распространенным методом лечения симптоматической миомы матки и была признана таковой Национальным институтом здоровья и клинического мастерства (NICE) в рекомендациях по обильным менструальным кровотечениям.
В настоящее время существует 11 рекомендаций относительно использования ЭМА в лечении симптоматической миомы матки, созданных научными обществами из Европы, Северной Америки и Австралии. В большинстве случаев рекомендации согласуются друг с другом, в то время как расхождение касается двух расхождений. Первый заключается в том, являются ли противопоказаниями для ЭМА подслизистая (FIGO 0) и субсерозная (FIGO 7) миома. Второй вопрос заключается в том, должны ли женщины, заявляющие о будущей беременности, иметь право на эту процедуру41. Американский колледж акушеров и гинекологов (ACOG) (2008) представил интересное руководство по лечению миомы матки. Основываясь на последовательных научных данных (уровень А), ACOG определил ЭМА как эффективный и безопасный метод для женщин с соответствующей квалификацией, которые хотят сохранить матку с типичными показаниями к лечению миомы. В то же время в рекомендациях ACOG подчеркивалась необходимость тесного сотрудничества между гинекологами и интервенционными радиологами. В опубликованных рекомендациях ACOG признал желание сохранить фертильность единственным противопоказанием (относительным)42.
Одна из последних рекомендаций была выпущена в 2013 году Королевским колледжем акушеров и гинекологов (RCOG) и в 2015 году Обществом акушеров и гинекологов Канады (SOGC)41. В оставшейся части этой статьи авторы будут использовать вышеуказанные рекомендации. Согласно рекомендациям RCOG и SOGC, любой пациент с симптоматическими миомами может быть кандидатом на эмболизацию при условии отсутствия противопоказаний и пользы от процедуры (разрешение симптомов) перевешивает риск осложнений. Следует отметить, что эмболизация миомы матки как малоинвазивная процедура несет в себе ничтожно малое количество серьезных осложнений. Следовательно, польза в большинстве случаев перевешивает риск осложнений 14,32,43.
Соответствующая квалификация пациента имеет решающее значение для высокой клинической эффективности и профилактики осложнений после ЭМА. Основным показанием при ЭМА является симптоматическая миома матки, приводящая к обильным менструальным кровотечениям, дисменорее, боли, диспареунии и другим неблагоприятным воздействиям на мочевыводящий или желудочно-кишечный тракт. Необходимо дифференцировать миому от аденомиоза или сосуществующей с аденомиозом миомы, поскольку в такой ситуации ЭМА менее эффективна и требует модификации методикипроцедуры 14,32,43,44,45,46,47. К специфическим показаниям к проведению процедуры ЭМА у женщин с симптоматической миомой матки относятся отказ от операции, отсутствие согласия на переливание крови, а также ранее неудачная операция по поводу миомы матки.
При вышеуказанных показаниях ЭМА следует рассматривать как альтернативу хирургическому лечению. Тем не менее, пациенты должны быть предупреждены о том, что в небольшом количестве случаев осложнения после процедуры могут привести к необходимости хирургического вмешательства 14,32,43. Согласно рекомендациям RCOG, применение ОАЭ в ситуации, при которой миома является вероятной причиной бесплодия, требует особой осторожности и надлежащей оценки гинеколога, специализирующегося на лечении бесплодия и вспомогательной репродукции. Бесплодие из-за наличия миомы не является абсолютным, и многие женщины забеременеют без какого-либо вмешательства. Поэтому целесообразно исключить и другие возможные причины бесплодия, в том числе обследование партнера-мужчины 14,32,43.
Таким образом, согласно рекомендациям RCOG и SOGC, кандидатами должны быть женщины с симптоматической миомой матки, у которых исключены патологии в малом тазу с миомоподобными клиническими симптомами41,43.
Абсолютными противопоказаниями к этой процедуре являются текущая или недавняя генитальная инфекция, диагностические сомнения из-за клинических факторов или неадекватной визуализации, бессимптомная миома, жизнеспособная беременность и противопоказания к применению радиологических контрастных веществ.
Относительными противопоказаниями являются подслизистая миома на ножке (FIGO 0) и субсерозная (FIGO 7), которая теоретически может отделяться от эндометрия из-за некроза ножки, что в редких случаях приводит к сепсису. В этих случаях ЭМА следует рассматривать только в случае гистероскопического или лапароскопического удаления миомы на ножке до того, как планируется процедура.
Несмотря на то, что в современной литературе высказывается мнение, что размер миомы сам по себе не является противопоказанием, опыт показывает, что требуется крайняя осторожность при квалификации пациентов с большими миомами (особенно связанными с симптомами компрессии) для ЭМА, так как уменьшение объема может быть недостаточным для облегчения симптомов и удовлетворения ожиданий пациента14,32, 43,48.
Есть много сообщений об успешной беременности после ЭМА, но существующие данные не полностью поддерживают его использование в качестве альтернативы фармакологическому или хирургическому лечению (миомэктомии) у молодых женщин49. Таким образом, эту процедуру следует применять с большой осторожностью у женщин, которые заявляют о желании забеременеть (поскольку наблюдается более низкая частота наступления беременности, более высокая частота выкидышей, разрывов матки, прирастания плаценты и неблагоприятные исходы беременности после ЭМА, чем после миомэктомии)32,50,51,52,53,54,55. Как гинекологи, мы не рекомендуем ОАЭ женщинам, желающим забеременеть. Для нас это относительное противопоказание, при условии наличия дополнительных показаний к ЭМА, таких как отказ от операции или переливания крови, где отсутствие лечения может быть опасным для жизни.
Согласно рекомендациям RCOG, желание сохранить или улучшить фертильность у молодых женщин с симптоматической миомой матки является относительным противопоказанием к ЭМА32. В отличие от этого, в рекомендациях SOGC рекомендуется, чтобы в подобных случаях ЭМА не предлагалась в качестве варианта лечения миомы, поскольку безопасность и эффективность у таких женщин не были установлены14,43. Аналогичную точку зрения представляют и другие научные общества, в том числе Американское общество репродуктивной медицины (ASRM), Американский колледж акушеров и гинекологов (ACOG), Американский колледж радиологии (ACR), Королевский австралийский и новозеландский колледж акушеров и гинекологов (RANZCOG) и другие, ссылаясь на улучшение исходов фертильности после миомэктомии 41,43,56 . ОАЭ рекомендован NICE только женщинам, стремящимся сохранить или улучшить фертильность, особенно с особенностями, неблагоприятными для миомэктомии (множественной миомы)57.
Как правило, процедуры ОАЭ можно проводить на любой стадии менструального цикла32. Однако, если предположить, что идеального метода исключения беременности на этапе оплодотворения или имплантации не существует, чтобы исключить беременность на ранних сроках, то в нашем центре его проводят до 10-го дня цикла. В большинстве случаев пациентки поступают в гинекологическое отделение в день проведения процедуры. Госпитализация пациента в отделение сосудистой хирургии допустима при условии проведения соответствующих обследований и консультации гинеколога. Гинеколог и интервенционный радиолог проводят квалификацию для эмболизации миомы. Гинекологическая квалификация включает в себя сбор анамнеза, осмотр, ультразвуковую оценку репродуктивного органа и тип миомы. Кроме того, для исключения злокачественных новообразований в матке необходимы мазок из шейки матки (ПАП) и биопсия эндометрия. В случаях, когда ультразвуковое сканирование яичников вызывает сомнения, необходим тест ROMA (алгоритм риска злокачественного новообразования яичников).
Отдельным вопросом, требующим обсуждения, является саркома матки, в частности лейомиосаркома (ЛМС), на долю которой приходится 70% этих опухолей матки. Распространенность ЛМС у пациентов, оперированных по поводу миомы, низка и оценивается в 0,13–0,29%58,59. Увеличение заболеваемости ЛМС наблюдается у женщин старше 40 лет. LMS трудно диагностировать до начала лечения, так как она может напоминать доброкачественнуюмиому. Большинство LMS не связаны с ранее существовавшими миомами, и нет никаких доказательств связи LMS с миомой матки61. Как миома матки, так и ЛМС имеют тенденцию к быстрому росту. Таким образом, размер или скорость роста не являются фактором риска развития злокачественной опухоли матки60.
В настоящее время не существует надежных лабораторных или визуализирующих тестов, которые позволили бы нам четко идентифицировать лейомиосаркому и дифференцировать ее от лейомиомы60,62. Чувствительность биопсии эндометрия в диагностике лейомиосаркомы составляет 86%. Таким образом, отрицательный результат биопсии не исключает существования злокачественной опухоли матки. МРТ с контрастированием в настоящее время является оптимальным методом диагностики опухолей матки. Чувствительность этого теста в диагностике LMS составляет 94%60.
Как уже было сказано, вышеперечисленные тесты не исключают 100% злокачественных опухолей матки. Таким образом, существует небольшой риск продления диагноза ЛМС после лечения, без возможности гистопатологической верификации опухоли матки. Пациент должен быть проинформирован об этом во время квалификации в ОАЭ.
Проведение общего анализа крови (ОАК) и тестов на свертываемость крови (МНО, АЧТВ), почечной панели (креатинин, мочевина), тиреотропного гормона (ТТГ), концентрации антимюллерова гормона (АМГ) (рекомендуется) или фолликулостимулирующего гормона (ФСГ) в фолликулярной фазе, С-реактивного белка (СРБ), общего анализа мочи и мазка из влагалища (аэробная вагинальная культура) позволяют оценить и избежать потенциальных осложнений после эмболизации (инфекции, ятрогенное повреждение яичников, усиление предшествующей почечной недостаточности после применения контрастных веществ на основе гадолиния, тиреотоксикоз при гипертиреозе после применения контрастного вещества на основе йода)63,64. Обратите внимание, что тестирование на ФСГ не рекомендуется проводить моложе 40 лет, так как ФСГ не является чувствительным индикатором изменения овариального резерва у молодых женщин50,65.
Интервенционный радиолог квалифицирует пациентов для проведения процедуры на основании истории болезни и магнитно-резонансной томографии (МРТ). При сборе анамнеза следует обсудить с пациентом преимущества и возможные осложнения, а также саму процедуру. Также следует обсудить ожидания пациента в отношении ОАЭ. МРТ направлена на исключение других патологий репродуктивного органа и прилегающих структур, а также на оценку морфологии и расположения миомы и анатомии для технической возможности процедуры 35,36,37,57.
ЭМА стремится полностью заблокировать сосудистую сеть всех миом, сохраняя при этом кровоснабжение матки, яичников и окружающих тканей в области таза. Технические аспекты ОАЭ все еще в некоторой степени развиваются.
Эмболизация маточных артерий проводится интервенционными радиологами, обладающими соответствующей компетенцией в области внутрисосудистой эмболизации. Процедура проводится под контролем рентгеноскопии. Он предполагает чрескожное введение сосудистого катетера от прокола в паховой области в бедренную артерию, аорту, внутреннюю подвздошную артерию, вплоть до маточной артерии. После помещения катетера глубоко в маточную артерию и достижения стабильного положения, средство эмболизации, смешанное с контрастом, вводится под рентгеноскопическим контролем таким образом, чтобы избежать рефлюкса и «нецелевой» эмболизации. Сосудистое русло миомы закрывают с помощью частиц размером 500–900 мкм в зависимости от типа эмболизирующего материала — обычные размеры составляют 700 мкм. Эмболизацию продолжают до тех пор, пока не будет достигнут стазисный кровоток. В конце процедуры катетер удаляется, а место сосудистого доступа фиксируется с помощью ручного давления и повязки или механического закрывателя. Процедура длится примерно 0,5–1,0 ч. Средняя доза ионизирующего излучения, поглощенная яичником во время ЭМА, колеблется от 0,04–0,22 (Гр: серый) и средняя расчетная эффективная доза – от 22 до 34 (мЗв: миллизиверт). Среднее рентгеноскопическое время составляет около 22 мин66,67.
Сосудистая сеть большинства миом исходит от маточных артерий. Только около 5–10% миомы дополнительно снабжаются артериями яичников. Артериальные маточные анастомозы встречаются примерно в 10% случаев, в то время как маточно-яичниковые — в 10–30%. Прекращение кровоснабжения эмболизированных тканей вызывает ишемический некроз с последующей гиалиновой дегенерацией или коагуляционным некрозом. Этот процесс занимает несколько месяцев 68,69.
Эффективность ЭМА зависит от разрешения симптомов или степени их уменьшения. Для лечения чрезмерных менструальных кровотечений, тазовых болей и симптомов давления индекс клинической эффективности для ЭМА составляет 81–96%, 70–100% и 46–100% соответственно. В течение 3–6 месяцев после процедуры наблюдалось уменьшение объема миомы на 25–60%33,70,71,72. Среднее уменьшение диаметра миомы составило 2,2 см57.
Уменьшение объема миомы не всегда коррелирует с разрешением или уменьшением клинических симптомов. При долгосрочном наблюдении после ЭМА более 70% пациентов сообщили об исчезновении или значительном уменьшении клинических симптомов в течение 5 лет после процедуры, в то время как 16–23% из них потребовали повторного вмешательства73,74.
Для оценки раннего эффекта ЭМА авторы данной публикации предлагают использовать трехмерный (3D) ультразвук с использованием виртуального органа Computer-aided AnaLysis (VOCAL), выполняя измерения сосудистых индексов: индекса васкуляризации (VI), индекса кровотока (FI) и индекса кровотока васкуляризации (VFI)75.
Боль после эмболизации является ранним (продолжительностью около 24 ч) ожидаемым последствием успешного ЭМА (не путать с осложнением) и требует активного лечения. Этот клинический симптом обусловлен высвобождением продуктов распада тканей ишемической миомы. Лечение включает в себя адекватное обезболивание, гидратацию и возможную антибиотикотерапию32,43. Эпидуральная анестезия (ЭА), поддерживаемая в течение 24 ч после процедуры, значительно снижает боль до вполне приемлемого уровня, но при более высокой стоимости и повышенном риске осложнений по сравнению с контролируемой пациентом анальгезией (РПЖ)76.
Другие подходы также доступны в обзорах лечения боли после эмболизации. Стоит упомянуть о применении смесей обезболивающих препаратов с молекулами поливинилового спирта и электроакупунктурной анестезии во время ЭМА. Оба метода были предназначены для ограничения количества процедур ЭМА, выполняемых в условиях больницы77,78. Мы не используем эти методы в наших и сотрудничающих центрах.
Ранние осложнения ЭМА обычно являются местными осложнениями, связанными с процедурой ангиографии. Эта группа нежелательных явлений встречается редко (они возникают менее чем в 1% случаев) и относится в основном к гематоме паха, артериальному тромбозу, артериальному расслоению и псевдоаневризме, аллергическим реакциям на контрастные вещества, спазму в маточной артерии, вызванному манипуляциями с катетером в сосуде во время процедуры (рассматривается как временное событие по прошествии нескольких минут и процедуру можно продолжать); если спазм не проходит, можно вводить Верапамил (2,5–5 мг) или нитрат (100–150 мкг) внутриартериально) и «нецелевой» эмболизацией 32,37,38.
Также было несколько сообщений о «нецелевой» эмболизации других органов малого таза и их последующей ишемии. Данное осложнение может возникнуть в результате некачественного выполнения процедуры, а также из-за наличия анастомозов и анатомических вариантов сосудистой сети малого таза. Частным случаем нецелевой эмболизации является повреждение яичников в результате анастомозов между сосудами матки и яичниками у некоторых пациенток79,80.
Последствием некроза миомы является постэмболизационный синдром, возникающий в течение 30 дней после процедуры примерно у 10–15% пациентов. Симптомы этого синдрома, которые могут проявляться вместе или по отдельности, включают тошноту, рвоту, недомогание, субфебрильную температуру, боль в нижней части живота и повышенный уровень лейкоцитов. Обычно это самоограничивающийся синдром, который обычно исчезает в течение 10–14 дней. Для лечения этого осложнения используются анальгетики и противовоспалительные препараты32. Важно дифференцировать симптомы постэмболизационного синдрома с более серьезными осложнениями, такими как сепсис. Особенно это актуально в тех случаях, когда упомянутые симптомы длятся дольше двух недель 32,37,38.
Инфекция является потенциально самым серьезным осложнением после ЭМА, и встречается она примерно в 0,5% случаев32,38. В случае стойкой высокой температуры (38,5 °C и выше) в течение 24–48 часов, а также твердого и болезненного живота следует заподозрить сепсис. В этом случае лечение может потребовать не только применения антибиотикотерапии, но и необходимости удаления матки. В последнем случае менее чем в 1% случаев он может представлять угрозу для жизни пациента. Сепсис чаще встречается при проведении ЭМА на крупной матке (более 20 см или когда диаметр одной миомы превышает 9 см, а также в случае сосуществования крупных субмукозных миом)37,38.
Поздним осложнением после ЭМА (более 30 дней после процедуры), возникающим после эмболизации субмукозной миомы, является выведение маркированных, некротических фрагментов миомы через цервикальный канал. Это происходит примерно в 10% случаев 32,81,82. Примерно у 16% женщин после ЭМА могут наблюдаться обильные выделения из влагалища в течение от нескольких недель до многих месяцев в результате выделения некротической миомы из матки83. После процедуры ОАЭ наблюдается значительное укорочение менструации и уменьшение ее обильности, что считается благотворным эффектом данной процедуры. Тем не менее, полная аменорея трактуется как следствие постэмболизационной недостаточности яичников50,84.
Аменорея после ЭМА обычно преходящая и ограничена несколькими циклами. Постоянная аменорея возникает примерно у 15% женщин старше 40 лет и примерно у 1% женщин младше этого возраста, вызывая симптомы преждевременной менопаузы. В наших собственных исследованиях было обнаружено снижение фертильности у молодых женщин (33–40 лет) в результате уменьшения овариального резерва65. Подсчитано, что около 85% женщин, которые сообщают об аменорее после ЭМА, старше 45 лет (85 лет). Было высказано мнение, что причина увеличения частоты аменореи у пожилых женщин связана со сниженным овариальным резервом и большей чувствительностью ткани яичников к ишемии, вызванной «нецелевой» эмболизацией86.
Процедура в ОАЭ также влияет на сексуальную функцию женщин, проходящих процедуру. Об улучшении сексуальной функции после ЭМА сообщили 26% женщин, ухудшение было обнаружено у 10%, а неизменное – у остальных 64% женщин. Возможной причиной сексуальной дисфункции является аномальная сосудистая сеть клитора, шейки матки и тела матки в результате процедуры ЭМА74.
протокол
Авторы заявляют, что протокол соответствует рекомендациям местного Этического комитета Люблинского медицинского университета.
1. Квалификация для процедуры в ОАЭ
ПРИМЕЧАНИЕ: Это адресовано гинекологам и интервенционным радиологам.
- Проинформируйте пациента о деталях процедуры в ОАЭ.
- Обсудите показания и противопоказания к процедуре в ОАЭ.
- Обсудите с пациенткой предпосылки ЭМА и альтернативные методы (описанные во Введении) в лечении миомы матки.
- ПРЕДУПРЕЖДЕНИЕ! Сообщите пациенту, что ЭМА не является радикальной процедурой (миома не будет удалена).
- ПРЕДУПРЕЖДЕНИЕ! Сообщите пациентке, что она не получит гистологическое заключение о миоме матки после ЭМА.
- ПРЕДУПРЕЖДЕНИЕ! Сообщите пациентке, что 1–3 случая из 1000 опухолей матки могут быть злокачественными (НМС). Обсудите с пациенткой, что биопсия эндометрия и МРТ, выполненные во время квалификации ОАЭ, являются высокочувствительными в диагностике лейомиосаркомы, но не на 100%. Сообщите пациенту, что проведение ЭМА при лейомиосаркоме может задержать диагностику и надлежащее лечение. Обратите внимание на этот факт в медицинской карте.
- Если пациент сознательно хочет, чтобы ЭМА была выполнена, продолжайте действие этого протокола.
- Сообщите пациенту, что квалификация проходит в два этапа. Квалификация гинеколога включает в себя анализ показаний и противопоказаний, в то время как интервенционный радиолог оценивает технические возможности ОАЭ.
- Запланируйте или проведите гинекологическую консультацию и запланируйте консультацию с интервенционным радиологом до ЭМА.
- По возможности выполняйте как можно больше квалификационных процедур в поликлинике.
- Убедиться в наличии у пациентки показаний к ЭМА: симптоматическая миома матки (менометроррагия, метроррагия, дисменорея, диспареуния, хроническая тазовая боль); отказ от хирургического лечения; отсутствие согласия на переливание крови; Ранее неудачная операция по поводу миомы матки. Отметьте их в истории болезни.
- Спросите пациента о симптомах миомы.
- Обсудите эффективность ЭМА и ожидания пациента (в разделе «Репрезентативные результаты»).
- Спросите, лечилась ли пациентка ранее по поводу миомы матки. Убедитесь, какой метод использовался.
- Если пациент отказывается от хирургического лечения или переливания крови, возьмите письменное заявление.
- Убедиться в том, что у пациента, прошедшего отбор на процедуру ОАЭ, нет абсолютных противопоказаний: бессимптомной миомы; жизнеспособная беременность; текущая или недавняя генитальная инфекция; диагностические сомнения из-за клинических факторов или неадекватной визуализации; противопоказания к применению радиологических контрастных веществ; особенности лейомиосаркомы на МРТ; злокачественная опухоль матки или яичников, если она не выполняется в качестве паллиативной помощи или в качестве дополнения к хирургическому вмешательству87. Отметьте их в истории болезни.
- Если пациенту требуется ЭМА, несмотря на бессимптомную миому, объясните, что такие случаи не подходят для процедуры. Объясните пациентке, что бессимптомная миома требует только регулярного гинекологического контроля.
- Если есть относительные противопоказания к ЭМА (большая миома и репродуктивные планы), обсудите их с пациентом и отметьте этот факт в медицинской карте.
- Сосредоточьтесь на возможных осложнениях, связанных с относительными противопоказаниями, описанными во введении, убедитесь, что пациент понимает и согласен на процедуру.
- Обсудите с пациенткой последствия и осложнения эмболизации маточных артерий (см. введение) и отметьте этот факт в медицинской карте.
- При разговоре с пациентом обратите особое внимание на боль после эмболизации.
- Обсудите методы лечения боли после эмболизации.
- Выполнить гинекологическую квалификацию.
- Сбор анамнеза и проведение гинекологического осмотра.
- Проведение ультразвуковой оценки репродуктивных органов для оценки размера и типа миомы (классификация FIGO)88.
- Используйте вагинальный зонд для оценки размера и расположения миомы (рисунок 2). Миома матки, которую лечат с помощью ЭМА, должна быть 2–5 (в идеале 3–4) по классификации FIGO, а диаметр не должен превышать 10 см.
- Включите протокол УЗИ малого таза в медицинскую карту.
- Убедитесь, что результат ультразвукового исследования дает показания к квалификации для процедуры в ОАЭ.
- Исключить злокачественные процессы в малом тазу.
- Убедитесь, что у пациентки были текущие (желательно выполненные в течение 6 месяцев) результаты мазка из шейки матки (ПАП) и биопсии эндометрия.
- Во время УЗИ органов малого таза используйте вагинальный зонд, чтобы оценить яичники и подтвердить правильность их структуры. Если вы сомневаетесь, проверьте предыдущее ультразвуковое исследование или проведите тест ROMA.
- Закажите МРТ для оценки опухоли матки на предмет особенностей LMS и технических возможностей ОАЭ.
- Обратите внимание на результаты мазка из шейки матки (ПАП), биопсии эндометрия, ультразвукового исследования (возможно, теста ROMA) и МРТ в медицинской карте.
- Если результаты неверны, дисквалифицируйте пациента от процедуры.
- Информируйте пациенток о результатах гинекологической квалификации.
- Обратите внимание на этот факт в медицинской карте. Направьте пациента в больницу.
- Запишитесь на процедуру ОАЭ и помните, что пациент должен быть до 10 дня цикла.
- Спросите у пациентки, отказывается ли она от операции. В случае отказа отметьте этот факт в информированном согласии пациента или в медицинской карте.
- Пациенты с симптоматической миомой, которые отказываются от операции, имеют право на участие в ЭМА.
- Проведите следующие тесты не менее чем за 7 дней до ЭМА, чтобы оценить и избежать потенциальных осложнений: микробиологический тест мазка из влагалища (аэробный посев влагалища); анализ мочи; выбранные анализы крови: общий анализ крови, анализы на свертываемость крови (МНО, АППТ), почечная панель (креатин, мочевина), ТТГ, СРБ.
- Опишите результаты в медицинской карте.
- Сообщите пациентке, что неправильные результаты дисквалифицируют ее к процедуре.
- Проверьте овариальный резерв пациентки, санализировав уровень АМГ (рекомендуется) или ФСГ (не рекомендуется до 40 лет) в сыворотке крови на фолликулярной фазе. Обсудите с пациенткой, что вышеуказанный тест будет полезен для оценки повреждения яичников в результате нецелевой эмболизации. Обратите внимание на этот факт в медицинской карте.
- Пациентки, которые имеют право на участие в ОАЭ, не должны заявлять о желании забеременеть из-за повышенного риска осложнений беременности 14,32,38,50,51,52,89,90,91.
- Сообщите пациентке о повышенном риске осложнений беременности после ЭМА.
- Обратите внимание на тот факт, что пациентка не заявляет о своем желании забеременеть в информированном согласии пациентки или в медицинской карте.
- Если пациентка все же не исключает беременность в будущем, но нуждается в ЭМА, возьмите письменное заявление о том, что она была проинформирована о возможных осложнениях беременности после ОАЭ.
- Проведение радиологической квалификации.
- Убедитесь, что было проведено МРТ органов малого таза. Обследование МРТ позволяет исключить другие патологии репродуктивного органа и прилегающих структур (шаг 1.6.3.3. процедуры «Квалификация для ЭМА»), оценить морфологию и локализацию миомы, а также анатомию на техническую целесообразность эмболизации (рис. 3, рис. 4). Если нет, договоритесь о проведении МРТ-обследования и консультации с интервенционным радиологом.
- Проанализируйте результаты визуализационных исследований и оцените тип и размер миомы.
- При обнаружении подслизистой миомы (FIGO 0–1) сообщите пациентке о риске отшелушивания в полость матки. Полное выделение может вызвать сепсис, в то время как экскреция фрагментами обычно протекает бессимптомно50.
- При обнаружении субсерозной узкостебельчатой, черешковой (FIGO 7) миомы следует сообщить пациенту о риске постэмболизационной отслойки миомы в брюшную полость. Это может привести к острому воспалению, и может потребоваться лапароскопическая повторная операция92.
- При обнаружении больших размеров миомы сообщите пациенту, что риск осложнений остается неизменным, но исход процедуры лучше при малых миомах93.
- Отметьте этот факт в информированном согласии пациента или в медицинской карте.
2. Подготовка к процедуре в ОАЭ
ПРИМЕЧАНИЕ: Это адресовано гинекологам или сосудистым хирургам и интервенционным радиологам.
- Госпиталь пациента в стационар (отделение гинекологической или сосудистой хирургии).
- Убедитесь, что она находится до 10-го дня цикла при поступлении.
- Выполните или назначьте гинекологический осмотр и ультразвуковое исследование малого таза.
- Убедитесь, что диагноз и квалификация для процедуры в ОАЭ верны.
- Убедитесь, что с момента квалификации в ОАЭ не появилось никаких новых противопоказаний. Если да, предложите другие варианты лечения и измените дату процедуры.
- Проведите 3D трансвагинальное ультразвуковое сканирование (TVUS) и рассчитайте объем и индексы васкуляризации миомы (VI, FI и VFI) с помощью программного исследования VOCAL (которое используется для оценки эффективности процедуры UAE72,75) (описано во введении) (Рисунок 5 и Рисунок 6).
- Обратите внимание на этот факт в медицинской карте.
- Убедитесь, что пациент, отвечающий требованиям для участия в программе ОАЭ, прошел тесты, проведенные во время квалификации для ОАЭ (описаны в пунктах 1.6.2, 1.6.3, 1.6.5 и 1.6.6 Квалификации для ОАЭ).
- Если пациентка прошла предварительную квалификацию у гинеколога и у нее нет анализов крови, мочи и МРТ, запишитесь на анализы и договоритесь о консультации с интервенционным радиологом (шаг 1.7 Квалификации для ОАЭ).
- Оцените или назначьте уровень АМГ (рекомендуется) или ФСГ (не рекомендуется в возрасте до 40 лет) перед ЭМА, чтобы можно было оценить повреждение яичников в результате «нецелевой» эмболизации.
- Сообщите пациенту, что результаты теста будут доступны примерно через сутки и процедура в ОАЭ будет возможна только после получения этих результатов.
- Сообщите пациентке, что неправильные результаты дисквалифицируют ее к процедуре.
- ПРЕДУПРЕЖДЕНИЕ! В случае отсутствия или неправильных результатов мазка ПАП, биопсии эндометрия; микробиологическое исследование мазка из влагалища, дисквалифицирует пациентку из ОАЭ (слишком долгое время для получения этих результатов). Повторная квалификация после получения правильных результатов.
- Обратите внимание на этот факт в медицинской карте.
- Получить информированное согласие на выполнение ЭМА.
- Предоставьте пациенту всю информацию об ОАЭ.
- Обсудите возможные осложнения ЭМА (описаны во введении).
- Оставьте пациенту время подумать и задать вопросы; позволить пациенту дать информированное согласие на проведение процедуры ОАЭ.
- Сообщите пациентке, что она имеет право изменить свое решение до начала действия ОАЭ.
- Если пациентка меняет свое решение относительно ЭМА, то предлагает другие варианты лечения миомы матки (описаны во введении).
- Отметьте этот факт в информированном согласии пациента или в медицинской карте.
- Непосредственно перед процедурой в ОАЭ проверьте и убедитесь, что тесты, описанные в разделах 1.6.2, 1.6.3, 1.6.5 и 1.6.6 Квалификации для ОАЭ, а также 3D TVUS, МРТ и консультация интервенционного радиолога были проведены, и результаты верны.
- Дисквалифицировать пациента из ОАЭ, если тесты отсутствуют или результаты неверны.
- Обратите внимание на этот факт в медицинской карте.
- Сообщите об этом пациенту и соблюдайте запрет на прием пищи и жидкости с утра до процедуры. Исключение составляет небольшое количество жидкости, необходимое для приема утренней дозы лекарства.
- Утром (до ОАЭ) убедитесь, что пациент голодает.
- Следите за тем, чтобы пациент принимал лекарства от собственных хронических заболеваний.
- Обратите внимание на этот факт в медицинской карте.
- Назначьте пациенту следующие лекарственные препараты: 1 таблетка анксиолитика (например, Эстазолама) перорально, 1 доза антибиотиков внутривенно, 1 глобула Метронидазола интравагинально, Диклофенак 100 мг ректальный суппозиторий.
- Давайте вышеуказанные лекарства примерно за 30–40 минут до вылета из ОАЭ.
- Обратите внимание на этот факт в медицинской карте.
- Подготовьте операционное поле, убедившись, что левая подмышка и правый пах выбриты.
- Если вышеуказанные участки кожи не выбриты, аккуратно сбрейте их.
- Обратите внимание на этот факт в медицинской карте.
- Убедитесь, что у пациента нет внутриматочной спирали (ВМС).
- Если у пациентки обнаружена ВМС в матке, сообщите ей о повышенном риске инфицирования в полости матки и предложите удалить ее до начала ЭМА.
- Если пациент не согласен на удаление ВМС, отметьте этот факт в информированном согласии пациента или в медицинской карте.
- Убедитесь, что пациент сообщает о любых аллергических реакциях на лекарства, контрастные вещества и дезинфицирующие средства и отмечает этот факт и результаты в медицинской карте.
3. Проведение процедуры в ОАЭ
ПРИМЕЧАНИЕ: Это адресовано интервенционным радиологам и анестезиологам.
- Выполняют процедуру в стерильных условиях.
- Положите пациента на операционный стол и широко продезинфицируйте правую паховую область с помощью больничного дезинфицирующего средства (с соответствующим разрешением).
- Приклейте операционную простыню вокруг места операции (правый пах).
- Выберите вид анестезии: местная или эпидуральная анестезия (ЭА) и отметьте выбор пациента в медицинской карте.
- ОАЭ под местной анестезией.
- Обезболить (подкожное введение) 2% раствором лигнокаина в месте операции.
- При необходимости введите 5 мг морфина внутривенно.
- Перед началом процедуры в ОАЭ убедитесь, что местная анестезия является оперативной.
- ОАЭ под эгидой EA
- Правильно подготовьте пациента к ЭА.
- Выполните ЭА перед приклеиванием хирургической простыни.
- Убедитесь, что пациент, квалифицированный для проведения процедуры ЭА, не имеет следующих противопоказаний к процедуре: отказ от процедуры, коагулопатия, тромбоцитопения, гемолитическая болезнь, прием антикоагулянтов, шок, инфекция в месте эпидуральной инъекции, бактериемия, аллергия на местные анестетики, анатомические деформации позвоночника, повышенное внутричерепное давление, неврологические заболевания, тяжелый аортальный или митральный стеноз94. Обратите внимание на этот факт в медицинской карте.
- Позвоните анестезиологу и попросите ЭА.
- Поместите тонкий катетер в эпидуральное пространство в поясничной области и дайте обезболивающее средство (процедура, адресованная анестезиологам).
- Прежде чем начать процедуру в ОАЭ, убедитесь, что советник работоспособен.
- Процедура в ОАЭ
- Проведите процедуру ОАЭ в ангиокостюме под контролем рентгеноскопии.
- Получить доступ к сосудистой системе можно с помощью методики Сельдингера95,96 (рис. 7, рис. 8 и рис. 9).
- Вставьте катетер с косичкой в брюшную аорту чуть ниже почечных артерий.
- Проведите ангиографию для визуализации сосудов.
- Проведите аортонефрографию, чтобы оценить анатомию сосудов, снабжающих миому, и спланировать процедуру (Рисунок 10).
- Проводят ангиографию внутренней подвздошной артерии в передне-задней и косой проекции для выявления устья маточной артерии.
- Начинают с левой стороны, затем с правой, из-за места прокола и специфической формы катетера. В зависимости от калибра сосуда в маточную артерию избирательно вводится основной катетер или микрокатетер (рисунок 11).
- Поместите катетер глубоко в маточную артерию. Эмболизируйте сосуд гидрогелевыми частицами. В связи с наличием маточно-яичникового анастомоза, размер которого оценивается примерно в 500 мкм, рекомендуемый размер частиц для эмболизации составляет 700 мкм для снижения риска «нецелевой эмболизации».
- Продолжайте эмболизацию до тех пор, пока кровоток в сосуде полностью не будет заблокирован. Конечной точкой лечения является контрастный стаз в сосуде, что доказывает его эффективное закрытие.
- Выполняют эмболизацию маточной артерии с противоположной стороны таким же доступом. Лечение длится от 0,5 до 1,0 ч66,67 (рис. 12).
- Оцените эффективность эмболизации из катетера, размещенного во внутренней подвздошной артерии, во время контрольной ангиографии. Отсутствие активного притока затеняющей крови (к маточным артериям) свидетельствует о том, что процедура считается технически правильной (рисунок 13).
- Осторожно извлеките катетер.
- Закройте место прокола с помощью ручной компрессии с давящей повязкой, которую следует сохранять в течение следующих 6 ч или закрывающего устройства (Рисунок 14).
- Опишите течение ОАЭ в медицинской карте.
4. Уход за пациентом после процедуры в ОАЭ
ПРИМЕЧАНИЕ: Это адресовано гинекологам или сосудистым хирургам и анестезиологам.
- Начните лечение анальгезитом: контролируемая пациентом анальгезия (PCA) с помощью помпы или EA.
- Проинформируйте и обсудите с пациентом варианты обезболивающего лечения.
- Сообщите пациенту, что ЭА обеспечивает лучший контроль боли и более быструю реабилитацию по сравнению с помпой PCA76.
- Обратите внимание на этот факт и выбор пациента в медицинской карте.
- Обезболивающее лечение боли после эмболизации с помощью помпы PCA.
- Подготовьте шприц для насоса PCA с раствором морфина.
- Наполните шприц объемом 50 мл для помпы PCA 50 мг морфина и раствор 0,9% NaCl (концентрация 1 мг/мл).
- Подготовьте насос PCA к внутривенному применению.
- Соедините слив со шприцем.
- Введите венепункцию с помощью канюли.
- Вставьте шприц в насос PCA.
- Наполните слив, запустите насос PCA.
- Включите кнопку СТАРТ.
- Заблокируйте насос PCA.
- Установите параметры насоса PCA (перечислены ниже) (Рисунок 15).
ПРЕДУПРЕЖДЕНИЕ! Более высокие дозы морфина могут вызвать угнетение дыхания.- Используйте концентрацию морфина 1 мг/мл. Используйте дозу инфузии морфина по требованию (внутривенное болюсное введение) (Bolus p.) в 0,5 мг с интервалом во времени, после которого может быть проведена следующая инфузия по требованию (Lockout interval/[Karencja]) в 5 минут (во избежание угнетения дыхания). Используйте время внутривенного введения морфина во время инфузии по требованию в течение 10 с.
- Убедитесь, что все вышеперечисленные шаги выполнены.
- Закажите морфин в насосе PCA на срок до 24 ч.
- Контролируйте боль в соответствии с числовой шкалой оценки (NRS). Обратите внимание на значение NRS в медицинской карте.
- Используйте карточку для оценки боли (PAC).
- Сообщите пациентке, что при появлении болевых симптомов она должна сама нажать на «джойстик», тем самым получив лекарство по требованию.
- Убедитесь, что пациент понимает инструкции.
- Наблюдайте за количеством «внутривенного болюса» по требованию до «пустого болюса» (запускаемого во время интервала блокировки - раздел 4.2.3 Протокола по уходу за пациентами после ОАЭ) (Рисунок 16).
- Если соотношение «пустого болюса» к «внутривенному болюсу» по требованию достигает значения выше 2/1 (67% / 33%), воспользуйтесь приведенной ниже процедурой (Рисунок 17, Рисунок 18).
- Чтобы повысить эффективность обезболивающей терапии с помощью помпы PCA и снизить риск побочных эффектов морфина, рассмотрите возможность использования парацетамола или нестероидных противовоспалительных препаратов во внутривенных инъекциях и стандартных дозах.
- Позаботьтесь о ситуациях, когда больному необходимо встать с постели.
- Не выключайте насос.
- Отсоедините слив и закрепите его пробкой.
- Когда пациент вернется, снова подсоедините дренаж.
- Подготовьте шприц для насоса PCA с раствором морфина.
- Обезболивающее лечение боли после эмболизации с помощью ЭА.
- Продолжите работу EA, если она использовалась для процедуры в ОАЭ.
- Если для процедуры ЭМА использовалась местная анестезия и пациент назначает ЭА, перед установкой эпидурального катетера убедитесь, что общий анализ крови и коагуляционные тесты верны.
- Убедитесь, что пациент, квалифицированный для процедуры ЭА, не имеет противоречий, описанных в разделе 3.4.3 Выполнения процедуры ОАЭ. Обратите внимание на этот факт в медицинской карте.
- Позвоните анестезиологу и попросите ЭА.
- Убедитесь, что советник работоспособен.
- Определите режим работы ЭА (болюсный или непрерывный) с врачом анестезиологом. Обратите внимание на этот факт в медицинской карте.
- В непрерывном режиме (CEA) проконсультируйтесь с анестезиологом и проверьте настройки инфузионного насоса.
- В болюсном режиме (БЭА) обсудите с анестезиологом временные интервалы между введением местного анестетика.
- Поддерживайте катетер в течение 24–48 часов, в зависимости от потребностей.
- Контролируйте боль с помощью шкалы NRS. Обратите внимание на значение NRS в медицинской карте.
- Используйте PAC.
- Продолжайте прием CEA/BEA до тех пор, пока это не понадобится, но не более 48 часов.
- При необходимости продолжайте лечение обезболивающими препаратами после PCA или EA.
- Закажите парацетамол 3 х 1,0 г внутривенно.
- Заказывайте диклофенак 2 x 50 мг ректальные суппозитории.
- Если вышеуказанного обезболивающего лечения недостаточно, включите поддерживающие анальгетики.
- Закажите кетопрофен 2 х 100 мг внутривенно.
- Лечите симптомы со стороны мочевыводящих путей, назначая Фуразидин 3 x 100 мг перорально.
5. Контрольный визит после процедуры в ОАЭ
ПРИМЕЧАНИЕ: Это адресовано гинекологам.
- Проведите первый контрольный осмотр в первый день после ОАЭ.
- Оцените общее состояние пациента.
- Измерьте температуру тела пациента.
- Оцените боль после ОАЭ по шкале NRS. Используйте PAC.
- Оцените рану, в которую был введен сосудистый катетер.
- Проведите анализы общего анализа крови и коагулограммы.
- Проводят ТУЗИ для оценки состояния органов малого таза после ЭМА.
- Выполните 3D TVUS с помощью объемного зонда для оценки показателей объема и васкуляризации миомы (VI, FI и VFI).
- Если осложнений нет, а боль после эмболизации купирована пероральными анальгетиками, пациента выписывают домой.
- Сообщите пациентке, что если после госпитализации возникают лихорадка, боли в животе и гнойные выделения из влагалища, пациентка должна немедленно обратиться за медицинской помощью.
- Следующий контрольный визит должен быть проведен через 3 месяца после ОАЭ.
- Проведите гинекологический осмотр, общий анализ крови и уровень АМГ или ФСГ в сыворотке крови.
- Проведите МРТ или ТУЗИ для оценки состояния органов малого таза после ЭМА (Рисунок 19).
- Проводят 3D ТУЗИ с помощью объемного зонда для оценки объемов и показателей васкуляризации миомы (VI, FI и VFI).
- Выполните последний контрольный визит через 6 месяцев после ОАЭ.
- Проведите гинекологический осмотр, общий анализ крови и уровень АМГ или ФСГ в сыворотке крови.
- Проводят ТУЗИ для оценки состояния органов малого таза после ЭМА.
- Проводят 3D ТУЗИ с помощью объемного зонда для оценки объемов и показателей васкуляризации миомы (VI, FI и VFI).
- Оцените эффективность ОАЭ.
- Сравните результаты теста CBC до и после ОАЭ.
- Сравните объемы и индексы васкуляризации миомы (VI, FI и VFI) до и после ЭМА.
- Сравните уровни АМГ или ФСГ в сыворотке крови до и после ЭМА, чтобы оценить возможность ятрогенного повреждения яичников во время ЭМА в результате «нецелевой» эмболизации.
- Сообщите пациентке, что после эмболизации маточных артерий она должна проходить регулярные гинекологические осмотры.
- В отдельных случаях (отсутствие уменьшения симптомов миомы, подозрение на демаркацию тканей или сомнения в других дополнительных обследованиях) проведите МРТ через год после ЭМА (Рисунок 20).
Результаты
В период с 2009 по 2019 год в ОАЭ было проведено 557 процедур. Средний возраст пациентов составил 38 лет (31–53 года). Технический успех был достигнут у 547 пациентов (98,2%).
Среднее уменьшение объема миомы (оценка объема МРТ) через 3 месяца после процедуры ЭМА, выполненной в период с 2009 по 2013 год в группе из 206 пациентов в возрасте от 32 до 52 лет (средний возраст: 39 лет) составило 62%. Наименьшее снижение составило 9% (пациент с гиалинизированной миомой). Полное уменьшение (100%) было достигнуто у пациентов с отделенной подслизистой миомой (FIGO 0). 90% пациентов сообщили об удовлетворенности после процедуры в ОАЭ64.
Среднее уменьшение объема миомы через 3 месяца после ЭМА (ультразвуковая оценка громкого объема) в группе из 65 пациентов в возрасте 29–52 лет (средний возраст: 43,1 года) составило 50,1% (2,7–93,5%). До процедуры ЭМА медиана объема миомы составляла 101см3 (диапазон от 23,6 до 610,0см3), тогда как через 3 месяца наблюдалось уменьшение медианы объема миомы до 50,4см3 (диапазон от 6,9 до 193,9см3). Корреляционный тест Спирмена показал статистически значимую, но относительно слабую положительную корреляцию (R = 0,33; p = 0,006) между исходным объемом доминирующей миомы и процентным уменьшением объема. Интересно, что миомы меньшего размера показали большую вариабельность уменьшения объема миомы через 3 месяца после ЭМА, в то время как более крупные миомы показали стабильную, предсказуемую реакцию на ЭМА72.
Наблюдалось снижение допплеровских сосудистых индексов (VI, FI и VFI) в группе из 17 пациентов через 3 месяца после ЭМА. Процентное снижение по VI и VFI составило 95,4%, тогда как по FI снижение составило 58,3%75.
Оценка овариального резерва была проведена у 30 пациенток в возрасте 33–40 лет (средний возраст: 35 лет) через 3 месяца после ЭМА. Средний объем доминантной миомы составил 107,75см3 (диапазон от 87,4 до 131,1см3). Исследовали следующие маркеры овариального резерва: количество антральных фолликулов (АФК), АМГ, ингибин В (INHB), ФСГ и эстрадиол (Е2). Отмечено достоверное снижение AFC (56,7%; p < 0,001), AHM (36,7%; p < 0,001), INHB (46,7%; p < 0,001) и E2 (43,3%; p < 0,001). Одновременно наблюдалось достоверное повышение уровня ФСГ в сыворотке крови (43,4%; p < 0,001) у65.
Через три месяца после процедуры ЭМА у двух пациенток с подслизистой миомой (FIGO 0) (диаметрами 6 см и 8 см) наблюдалась инверсия матки при выведении через цервикальный канал маркированных, некротических фрагментов миомы, что привело к экстренной гистерэктомии.
Уменьшение боли после эмболизации (по PAC) с использованием PCA (процедура 4.2 протокола «Уход за пациентом после ОАЭ») оценивалось у 60 пациентов по шкале NRS на следующий день после процедуры ОАЭ. Медиана NRS сразу после ЭМА составила 10 (диапазон 5–10), в то время как после лечения медиана NRS составила 4 (диапазон 1–5). Корреляционный тест Спирмена между исходным объемом миомы (медиана 194,5 см3, диапазон 79–411 см3) и ЯРД сразу после ЭМА показал статистически значимую сильную положительную корреляцию (R = 0,6; p < 0,001), тогда как корреляция между исходным объемом миомы и NRS после лечения показала статистически значимую, слабую положительную корреляцию (R = 0,34; p < 0,001). Анализируя вышеуказанные взаимосвязи, можно сделать вывод, что основные миомы после ЭМБА вызывают более сильную боль после эмболизации. Тем не менее, лечение постэмболизационных болей после ЭМА меньших миом массивов с использованием РПЖ дает лучшие результаты.
Обобщенные данные по репрезентативным результатам представлены в таблице 1.

Рисунок 1: Классификация миомы матки по FIGO. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Гинекологическое обследование с помощью трансвагинального ультразвукового сканирования.
Видна миома матки (FIGO 5) размером 73 x 50 x 55 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: МРТ органов малого таза в рамках предварительной квалификации для ОАЭ.
Видна в сагиттальном отделе большая миома матки (FIGO 2–5) с масс-эффектом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
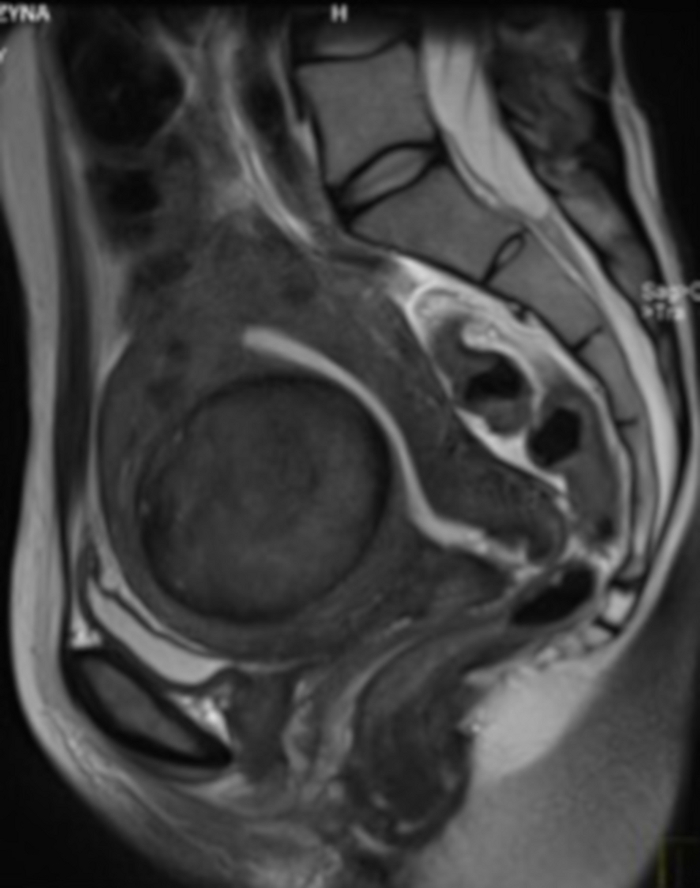
Рисунок 4: МРТ органов малого таза в рамках предварительной квалификации для ОАЭ.
Видна в сагиттальном отделе миома матки (FIGO 2–5). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
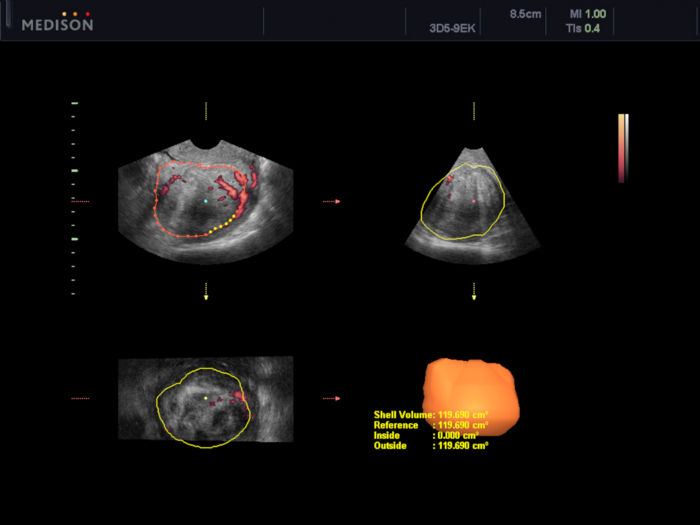
Рисунок 5: Оценка объема миомы матки с помощью программного обеспечения VOCAL.
В этом случае объем оценивается в 119,7 см3 . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Оценка васкуляризации миомы матки с помощью программного обеспечения VOCAL.
В этом случае рассчитывали индексы васкуляризации (VI 4,85, FI 25,38 и VFI 1,23). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: На снимке показан фрагмент ангиографической лаборатории.
В левом нижнем углу пациент с открытым пахом, через который вводится больше инструментов. В верхнем левом углу можно увидеть С-дугу ангиографа. В правом верхнем углу видны мониторы, на которых оператор отслеживает инструмент ввода. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 8: Набор для артериальных пункций.
Снизу: игла, сосудистый замок с интродьюсером, и направляющая. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
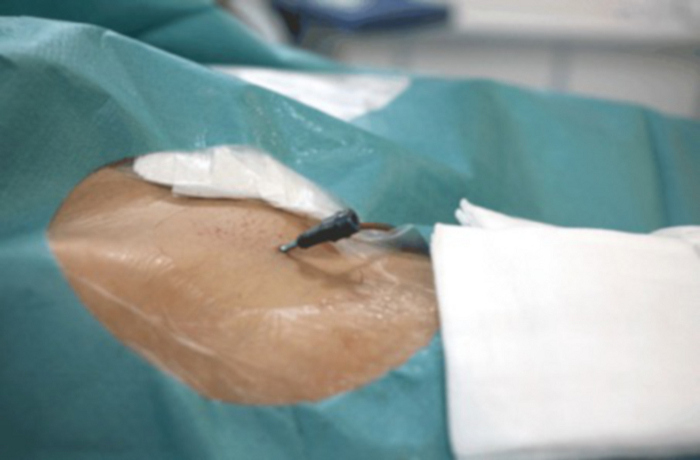
Рисунок 9: Крупный план паха с видимым сосудистым замком, вставленным в бедренную артерию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 10: Слева ангиография из катетера, помещенного в брюшную аорту.
Видимое сосудистое направление миомы матки. Для сравнения (справа) контрольный тест, проведенный после ОАЭ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 11: Селективная ангиография с использованием катетера RUC, размещенного в проксимальных отделах маточных артерий.
Видимое сосудистое русло миомы матки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
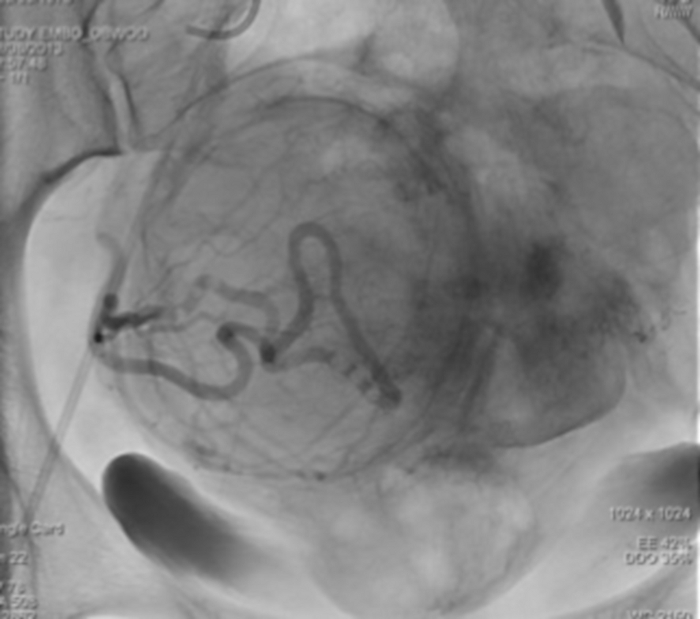
Рисунок 12: Единственное рентгеновское изображение, показывающее застой контрастного вещества в правой маточной артерии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
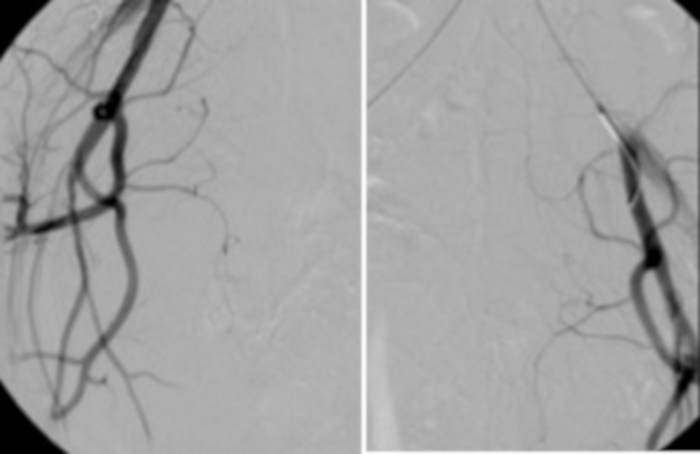
Рисунок 13: Контрольная ангиография, выполненная из основного катетера, расположенного, соответственно, в левой и правой подвздошной артерии, подтверждает отсутствие притока свежей крови (затенение) в маточные артерии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Рисунок 14: Место сосудистого доступа после завершения ЭМА.
Виден разрез 2 мм возле правого паха. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 15: Настройки параметров помпы PCA для боли после эмболизации после лечения ЭМА (раздел 4.2.3 Протокола «Уход за пациентом после ЭМА»). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 16: Насос PCA в работе.
Соотношение внутривенного болюсного ввода по требованию к «пустому болюсу» (раздел 4.2.6.2. Протокола «Уход за пациентом после ОАЭ») 1:1 (50%:50%). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 17: Насос PCA в работе.
Соотношение внутривенного болюса по требованию к «пустому болюсу» (раздел 4.2.6.3. Протокола «Уход за пациентом после ОАЭ») 1:2 (33%:67%). Это требует дополнительного обезболивающего лечения (порядок 4.2.6.4. Уход за пациентом после ПРОТОКОЛА ОАЭ). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 18: Насос PCA в работе.
Соотношение внутривенного болюсного введения по требованию и «пустого болюса» (раздел 4.2.6.3. Протокола «Уход за пациентом после ОАЭ») 1:3 (25%:75%). Это требует продолжения дополнительного обезболивающего лечения (порядок 4.2.6.4. Уход за пациентом после ПРОТОКОЛА ОАЭ). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 19: МРТ органов малого таза через 3 месяца после процедуры ОАЭ (тот же случай, что и на рисунке 3).
В сагиттальном отделе видна миома матки (FIGO 5), значительно меньшего размера, чем до процедуры, разной плотности ткани миомы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
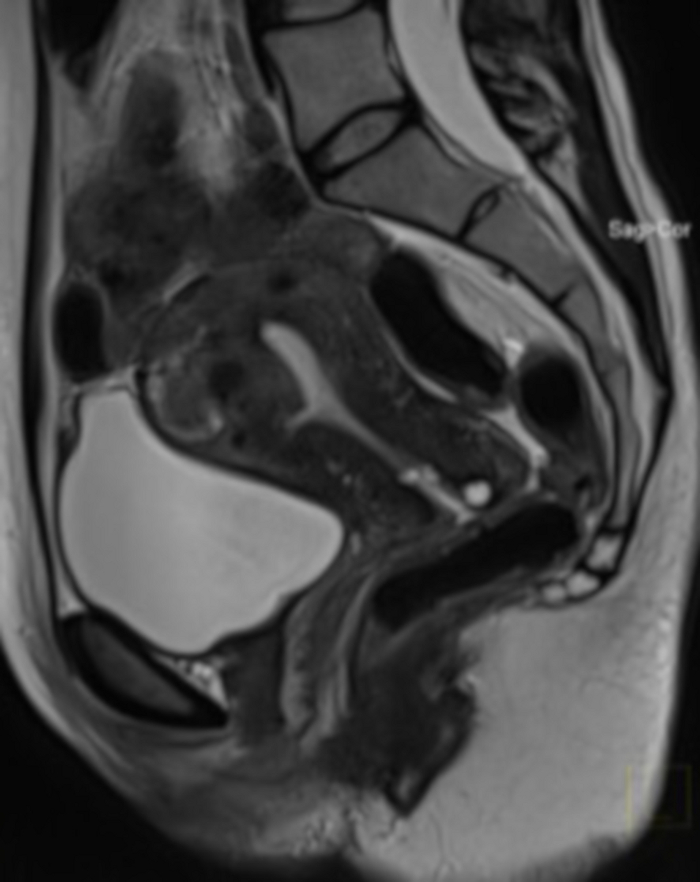
Рисунок 20: МРТ органов малого таза через 1 год после процедуры ЭМА (тот же случай, что и на рисунке 4).
В сагиттальном отделе видна миома матки (FIGO 2–5) с очень большим уменьшением объема после ЭМА. МРТ была выполнена в связи с подозрением на демаркацию тканей после процедуры (отсутствие возможности оценить структуру миомы при бимануальном исследовании). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| РЕПРЕЗЕНТАТИВНЫЕ РЕЗУЛЬТАТЫ / ЛЮБЛИНСКИЙ ПРОТОКОЛ 64,65,72 | ||
| Количество проведенных процедур в ОАЭ в период с 2009 по 2019 год | 557 | |
| Технический успех | Достигнуто у 547 пациентов (98,2%) | |
| Среднее уменьшение объема миомы (оценка объема МРТ) через 3 месяца после ЭМА в группе из 206 пациентов в возрасте от 32 до 52 лет (средний возраст - 39 лет) | 62.0% (9.0-100.0%) | |
| Среднее уменьшение объема миомы (ультразвуковая оценка громкого объема) через 3 месяца после ЭМА в группе из 65 пациентов в возрасте 29-52 лет (средний возраст – 43,1 года) | 50.1% (2.7-93.5%) | |
| Оценка овариального резерва | Снижение AFC | 56,7% (<0,001) |
| Снижение АМГ | 36,7% (р<0,001) | |
| Снижение INHB | 46,7% (р<0,001) | |
| Снижение E2 | 43,3% (р<0,001) | |
| Увеличение ФСГ | 43,4% (<0,001) | |
| Уменьшение боли после эмболизации (по PAC) с использованием PCA (процедура 2. Протокола «Уход за пациентом после ОАЭ») оценено в группе из 60 пациентов | Медиана NRS сразу после ОАЭ | 10 (диапазон 5-10) |
| Медианный NRS на следующий день после ОАЭ | 4 (диапазон 1-5) | |
Таблица 1: Репрезентативные результаты методики ЭМА в лечении симптоматической миомы матки, выполненном в соответствии с Люблинским протоколом.
Обсуждение
Из-за различий в структуре, размерах, локализации и симптомах миомы матки создание единого протокола ОАЭ оказалось непростой задачей. Существует много расхождений относительно предположений об этом терапевтическом методе с ожиданиями пациентов, как на этапе квалификации, так и в отношении результатов лечения. Более одного раза пациентки, направленные в ЭМА, не сообщали о каких-либо клинических признаках миомы и не знали, что эти опухоли матки не будут удалены радикально. Единственным явным ожиданием было избавление от миомы без хирургического вмешательства.
Поэтому важно, чтобы пациентка понимала предположения данного метода, принимала его и знала различия относительно альтернативных методов лечения миомы матки. Ее осознанный выбор (раздел 1.1. Qualification for UAE Protocol) является критически важным моментом, и его правильное выполнение позволит продолжить работу протокола.
Во время выполнения протокола некоторые процедуры повторяются. Это подразумевается и вытекает из формулы, принятой в этом журнале, в которой отдельные команды записываются в императивном режиме и адресованы одному человеку. Тем не менее, к квалификации, подготовке и другим этапам в ОАЭ часто привлекаются несколько врачей. Это также критические моменты протокола; их пропуск может привести к ЭМА при неоптимальных условиях или при наличии противопоказаний. Отсюда и разделение протокола на 5 глав. Это позволяет проводить его у различных специалистов, а повторяющиеся пункты протокола затем независимо проверяются.
Дополнительной сложностью в создании единого протокола эмболизации маточных артерий при лечении миомы матки является большое количество рекомендаций (целых 11), которые относятся к одной и той же процедуре41. Хотя их предположения схожи, как всегда, «дьявол кроется в деталях», какие детали требовали унификации. Относительные противопоказания относительно расположения миомы или репродуктивных планов пациентов, проходящих ЭМА, являются наиболее спорными во время квалификации. Применяя более строгие критерии, предложенные SOGC, пациенты должны быть исключены из этой процедуры, в то время как более либеральные рекомендации RCOG позволяют квалифицироваться для UAE 14,32,43. Вопрос в том, что делать. При создании протокола мы основывали решение (помимо обширной литературы) на анализе наших кейсов и полученного опыта, что требует индивидуального подхода к каждому пациенту. Таким образом, протокол не исключает выполнения ЭМА у пациентов с относительными противопоказаниями (разделы 1.4 квалификации по протоколу ОАЭ). Правильная квалификация и подготовка к ОАЭ, по-видимому, являются ключом к терапевтическому успеху. Очень важна и сама методика, а также уход ОАЭ, который обеспечивает не только терапевтический успех или удовлетворенность пациента, но и отсутствие осложнений, описанных выше.
Независимо от количества миом, все очаги эмболизируются в течение одной процедуры. Как правило, чем больше миомы, тем больше будет эмболизирующего материала, который будет вводиться. Это продлевает продолжительность эмболизации, но не меняет процедуру. ЭМА может быть модифицирована, если мы видим очевидную связь с яичниковой артерией, что может привести к повышенному риску нецелевой эмболизации. Затем мы можем замкнуть такое соединение (например, с помощью спиралей), разделив таким образом снабжение яичников и матки, а затем продолжить эмболизацию с использованием частиц размером 700 мкм. Если нет возможности вживить катушки, то увеличиваем диаметр частицы до 900 мкм.
Также бывают случаи, когда миома может снабжаться со стороны артерий яичников; Кроме того, маточные артерии подвергаются гипоплигезию. В этих случаях для успешного проведения эмболизации следует ввести микрокатетер в артерию яичника и за яичник, депонируя эмболизирующий материал в сосудистое русло матки, сохраняя при этом надлежащее снабжение яичников.
Несомненным плюсом эмболизации является тот факт, что она не является технически сложной процедурой и не требует сложного оборудования.
Сильными сторонами протокола являются моменты, касающиеся лечения боли после эмболизации, о которых не слышала как минимум половина пациентов, имея право на участие в ОАЭ. Стандартной процедурой, которую мы предлагаем, является использование помпы PCA (раздел 4.2 Протокола «Уход за пациентом после ОАЭ»), а полученные результаты подтверждают высокую эффективность такого лечения.
Что касается будущих изменений в протоколе ОАЭ, представляется возможным изменить раздел 10 «Подготовки к протоколу ОАЭ», который требует удаления ВМС из матки перед процедурой из-за риска воспаления и сепсиса. В крупных последующих исследованиях риск развития инфекции в области малого таза в сочетании с наличием ВМС составляет менее 1 к 130049.
ЭМА рассматривалась как экспериментальный метод с момента его первого использования, потому что он требовал оценки эффективности и изучения осложнений, которые эта процедура может дать в краткосрочном и долгосрочном периодах. За эти годы показания и противопоказания были модифицированы на основании результатов новых тестов и клинических наблюдений. Современные данные, в том числе несколько рандомизированных контролируемых исследований, признают ЭМА ценным методом лечения симптоматической миомы матки, эффективность и безопасность которого хорошо известны.
Создание вышеуказанного протокола обусловлено тщательным анализом актуальной литературы, актуальных рекомендаций и опыта, полученного в результате тесного сотрудничества гинекологов и хирургических радиологов в течение десятилетия.
Раскрытие информации
Авторам нечего раскрывать.
УТВЕРЖДЕНИЕ:
Петр Шкодзяк как автор рисунка 1, иллюстрирующего классификацию миомы матки FIGO, позволяет свободно использовать рисунок в научных и образовательных целях без каких-либо изменений. Намерение изменить рисунок должно быть принято автором (piotr.szkodziak@gmail.com).
Благодарности
Авторы хотели бы поблагодарить всю команду 3-й кафедры и отделения гинекологии и отделения интервенционной радиологии и нейрорадиологии Люблинского медицинского университета за их помощь во внедрении протокола эмболизации маточных артерий в Люблине.
Материалы
| Name | Company | Catalog Number | Comments |
| 2% lignocaine in an ampoule | Intended for interventional radiologist (section 3) | ||
| Access to Angio Suite for Minimally Invasive Vascular Surgery | Intended for interventional radiologist (section 3) | ||
| Angiogarfic set | Balton | INT5F | (5 Fr sheath, needle, guidewire) Intended for interventional radiologist (section 3) |
| Angiografic kit | Panep | 44000291 | (Sterile Disposable Angiography DRAPE) Intended for interventional radiologist (section 3) |
| Cervical (PAP) smear kit | Intended only for the gynecologist (section 1) | ||
| Diagnostic lab (possibility to use) | Necessary to perform laboratory tests (section 1, 2 and 5) | ||
| Disinfectant | Intended for interventional radiologist (section 3) | ||
| Dressings | Intended for interventional radiologist (section 3) | ||
| Embozene 700 μm | Varian Medical | 17020-SI | (Particles) Intended for interventional radiologist (section 3) |
| Epidural anesthesia kit | Intended only for the anesthesiologist (section 3 and 4) | ||
| Equipment for gynecological examination | Intended only for the gynecologist (section 1 and 2) | ||
| Intravaginal antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Morphine in ampoules | Intended for interventional radiologist and gynecologist or vascular surgeons (section 3, 4) | ||
| MRI lab (possibility to use) | Intended for interventional radiologist (section 1 and 2) | ||
| Oral anxiolytic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Oral Furazidin | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Oral Paracetamol or nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Pain Assessment Card | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Patient Controlled Analgesia Pump | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Progreate Microcathete PROGREA 2.7 Fr x 130 cm STR w/Marker + GW 100 mm x 2.7 Fr | Terumo | MC-PE27131 | (Microcatheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS GUIDE WIRE M Standard Angled 0.032”/0.81 mm 180 cm 30 mm flex | Terumo | RF-GA32183M | (Guidewire) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm Cobra 2 Middle SH0 | Terumo | RH-AB55108M | (Catheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm UFE Type 1 19 SH0 | Terumo | RH-AUB5108M | (Catheter) Intended for interventional radiologist (section 3) |
| Rectal nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 2, 4) | ||
| Shaving kit | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Single-use Endometrial Biopsy Kit | Intended only for the gynecologist (section 1) | ||
| Solution of 0,9% NaCl | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Ultrasound machine with 3D-transvaginal probe | Intended only for the gynecologist (section 2 and 5) | ||
| Ultrasound machine with transvaginal probe | Intended only for the gynecologist (section 1 and 2) |
Ссылки
- Tinelli, A., et al. Myoma pseudocapsule: A distinct endocrino-anatomical entity in gynecological surgery. Gynecological Endocrinology. 25 (10), 661-667 (2009).
- Tinelli, A., et al. Myomas: anatomy and related issues. Minerva Ginecologica. 68 (3), 261-273 (2016).
- Laganà, A. S., et al. Epigenetic and genetic landscape of uterine leiomyomas: a current view over a common gynecological disease. Archives of Gynecology and Obstetrics. 296 (5), 855-867 (2017).
- Vanharanta, S., et al. Distinct expression profile in fumarate-hydratase-deficient uterine fibroids. Human Molecular Genetics. 15 (1), 97-103 (2006).
- Hug, K., et al. Physical mapping of the uterine leiomyoma t(12;14)(q13-15;q24.1) breakpoint on chromosome 14 between SPTB and D14S77. Genes, Chromosomes & Cancer. 11 (4), 263-266 (1994).
- Ozisik, Y. Y., et al. Cytogenetic findings in a symplastic leiomyoma. Cancer Genetics and Cytogenetics. 67 (1), 79-80 (1993).
- Ozisik, Y. Y., Meloni, A. M., Surti, U., Sandberg, A. A. Deletion 7q22 in uterine leiomyoma. A cytogenetic review. Cancer Genetics and Cytogenetics. 71 (1), 1-6 (1993).
- Sparic, R., Mirkovic, L., Malvasi, A., Tinelli, A. Epidemiology of uterine myomas: A review. International Journal of Fertility and Sterility. 9 (4), 424-435 (2016).
- Stewart, E. A. Uterine fibroids. Lancet. 357 (9252), 293-298 (2001).
- Williams, A. R. W. Uterine fibroids - what's new. F1000Research. 6, 2109(2017).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Al-Hendy, A., Myers, E. R., Stewart, E. Uterine fibroids: burden and unmet medical need. Seminars in Reproductive Medicine. 35 (6), 473-480 (2017).
- de la Cruz, M. S. D., Buchanan, E. M. Uterine fibroids: Diagnosis and treatment. American Family Physician. 95 (2), 100-107 (2017).
- Vilos, G. A., et al. The management of uterine leiomyomas. Journal of Obstetrics and Gynaecology Canada. 37 (2), 157-178 (2015).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Sabry, M., Al-Hendy, A. Medical treatment of uterine leiomyoma. Reproductive sciences (Thousand Oaks, Calif.). 19 (4), 339-353 (2012).
- Istre, O. Management of symptomatic fibroids: conservative surgical treatment modalities other than abdominal or laparoscopic myomectomy. Best Practice & Research. Clinical Obstetrics & Gynaecology. 22 (4), 735-747 (2008).
- Donnez, J., Dolmans, M. M. Uterine fibroid management: from the present to the future. Human Reproduction Update. 22 (6), 665-686 (2016).
- Rogers, T. S., Bieck, A. M. Management of Uterine Fibroids. American Family Physician. 99 (5), (2019).
- Chwalisz, K., Taylor, H. Current and Emerging Medical Treatments for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 510-522 (2017).
- Saridogan, E. Surgical treatment of fibroids in heavy menstrual bleeding. Women's Health. 12 (1), London, England. 53-62 (2016).
- Fritton, K., Borahay, M. A. New and Emerging Therapies for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 549-559 (2017).
- Ciavattini, A., et al. Hypovitaminosis D and "small burden" uterine fibroids: Opportunity for a Vitamin D supplementation. Medicine (Baltimore). 95 (52), (2016).
- Friend, D. R. Drug delivery for the treatment of endometriosis and uterine fibroids. Drug Delivery and Translational Research. 7 (6), 829-839 (2017).
- Donnez, J., Courtoy, G. E., Dolmans, M. M. Fibroid management in premenopausal women. Climacteric: The Journal of the International Menopause Society. 22 (1), 27-33 (2019).
- Maksym, R. B., Wierzba, W., Baranowski, W. E. P23.06: The feasibility of uterine fibroid treatment with advanced ultrasound-guided HIFU system: preliminary report. Ultrasound in Obstetrics & Gynecology. 48, 242(2016).
- Lee, J. S., Hong, G. Y., Lee, K. H., Song, J. H., Kim, T. E. Safety and efficacy of ultrasound-guided high-intensity focused ultrasound treatment for uterine fibroids and adenomyosis. Ultrasound in Medicine and Biology. 45 (12), 3214-3221 (2019).
- Burbank, F. History of uterine artery occlusion and subsequent pregnancy. American Journal of Roentgenology. 192 (6), 1593-1600 (2009).
- Sack, R. A. Bilateral internal iliac (hypogastric) artery ligation to control obstetric and gynecologic hemorrhage. A ten-year review at the community hospital level. American Journal of Obstetrics and Gynecology. 116 (4), 493-497 (1973).
- Brown, B. J., Heaston, D. K., Poulson, A. M., Gabert, H. A., Mineau, D. E., Miller, F. J. Uncontrollable postpartum bleeding: A new approach to hemostasis through angiographic arterial embolization. Obstetrics and Gynecology. 54 (3), 361-365 (1979).
- Heaston, D. K., Mineau, D. E., Brown, B. J., Miller, F. J. Transcatheter arterial embolization for control of persistent massive puerperal hemorrhage after bilateral surgical hypogastric artery ligation. American Journal of Roentgenology. 133 (1), 152-154 (1979).
- Royal College of Obstetricians and Gynaecologists Clinical recommendations on the use of uterine artery embolization (UAE) in the management of fibroids. Royal College of Radiologists. , Available from: https://www.rcog.org.uk/globalassets/documents/guidelines/23-12-2013_rcog_rcr_uae.pdf (2013).
- Ravina, J. H., et al. Arterial embolization to treat uterine myomata. The Lancet. 346 (8976), 671-672 (1995).
- Goodwin, S. C., Vedantham, S., McLucas, B., Forno, A. E., Perrella, R. Preliminary experience with uterine artery embolization for uterine fibroids. Journal of Vascular and Interventional Radiology. 8 (4), 517-526 (1997).
- Kohi, M. P., Spies, J. B. Updates on uterine artery embolization. Seminars in Interventional Radiology. 35 (1), 48-55 (2018).
- Gupta, J. K., et al. Cochrane Database of Systematic Reviews Uterine artery embolization for symptomatic uterine fibroids (Review). Cochrane Database of Systematic Reviews. (12), (2014).
- Naredi, N., Bhattacharyya, T. K. Uterine Artery Embolization: A Nonsurgical Cure for Fibroids. South Asian Federation of Obstetrics and Gynecology. 1 (3), (2009).
- Memtsa, M., Homer, H. Complications associated with uterine artery embolization for fibroids. Obstetrics and Gynecology International. 2012 (290542), 1-5 (2012).
- Dutton, S., Hirst, A., McPherson, K., Nicholson, T., Maresh, M. A UK multicentre retrospective cohort study comparing hysterectomy and uterine artery embolization for the treatment of symptomatic uterine fibroids (HOPEFUL study): Main results on medium-term safety and efficacy. BJOG: An International Journal of Obstetrics and Gynaecology. 114 (11), 1340-1351 (2007).
- Heavy menstrual bleeding: assessment and management (CG44). Nice guidelines. National Collaborating Centre for Women's and Children's Health (UK). , Available from: https://www.nice.org.uk/guidance/cg44 (2007).
- Chen, H. T., Athreya, S. Systematic review of uterine artery embolization practice guidelines: are all the guidelines on the same page. Clinical Radiology. 73 (5), 507(2018).
- American College of Obstetricians and Gynecologists. American College of Obstetricians and Gynecologists ACOG practice bulletin. Alternatives to hysterectomy in the management of leiomyomas. Obstetrics and Gynecology. 112 (2), 387-400 (2008).
- Carranza-Mamane, B., et al. The Management of Uterine Fibroids in Women With Otherwise Unexplained Infertility. Journal of Obstetrics and Gynaecology Canada. 37 (3), 277-285 (2015).
- Wozniak, S., Czuczwar, P., Szkodziak, P. R., Pyra, K., Paszkowski, T. EP26.01: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of adenomyosis: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 381(2017).
- Szkodziak, P. R., Wozniak, S., Czuczwar, P., Wrona, W., Trzeciak, K., Paszkowski, T. OP24.04: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of intramural uterine fibroids: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 126(2017).
- Popovic, M., Puchner, S., Berzaczy, D., Lammer, J., Bucek, R. A. Uterine artery embolization for the treatment of adenomyosis: A review. Journal of Vascular and Interventional Radiology. 22 (7), 901-909 (2011).
- de Bruijn, A. M., et al. Uterine Artery Embolization for the Treatment of Adenomyosis: A Systematic Review and Meta-Analysis. Journal of Vascular and Interventional Radiology. 28 (12), (2017).
- Bérczi, V., et al. Safety and Effectiveness of UFE in Fibroids Larger than 10 cm. CardioVascular and Interventional Radiology. 38 (5), 1152-1156 (2015).
- Stępniak, A. Uterine artery embolization in the treatment of symptomatic fibroids - State of the art 2018. Przeglad Menopauzalny. 17 (4), 141-143 (2018).
- Czuczwar, P., et al. The influence of uterine artery embolization on ovarian reserve, fertility, and pregnancy outcomes - A review of literature. Przeglad Menopauzalny. 15 (4), 205-209 (2016).
- Firouznia, K., Ghanaati, H., Sanaati, M., Jalali, A. H., Shakiba, M. Pregnancy after uterine artery embolization for symptomatic fibroids: A series of 15 pregnancies. American Journal of Roentgenology. 192 (6), 1588-1592 (2009).
- Bonduki, C. E., et al. Pregnancy after uterine arterial embolization. Clinics. 66 (5), 807-810 (2011).
- Yeaton-Massey, A., Loring, M., Chetty, S., Druzin, M. Uterine rupture after uterine artery embolization for symptomatic leiomyomas. Obstetrics and Gynecology. 123 (2), Part 2 418-420 (2014).
- Takahashi, H., Hayashi, S., Matsuoka, K., Kitagawa, M. Placenta accreta following uterine artery embolization. Taiwanese Journal of Obstetrics and Gynecology. 49 (2), 197-198 (2010).
- Takeda, J., et al. Spontaneous uterine rupture at 32 weeks of gestation after previous uterine artery embolization. Journal of Obstetrics and Gynaecology Research. 40 (1), 243-246 (2014).
- Practice Committee of American Society for Reproductive Medicine in collaboration with Society of Reproductive Surgeons. Myomas and reproductive function. Fertility and Sterility. 90 (5), 125-130 (2008).
- Uterine artery embolization for fibroids (Interventional procedures guidance [IPG367]). Nice Guidelines. National Institute for Health and Clinical Excellence (NICE). , Available from: http://publications.nice.org.uk/uterine-artery-embolization-for-fibroids-ipg367 (2010).
- Leibsohn, S., d'Ablaing, G., Mishell, D. R., Schlaerth, J. B. Leiomyosarcoma in a series of hysterectomies performed for presumed uterine leiomyomas. American Journal of Obstetrics and Gynecology. 162 (4), 968-976 (1990).
- Parker, W. H., Fu, Y. S., Berek, J. S. Uterine sarcoma in patients operated on for presumed leiomyoma and rapidly growing leiomyoma. Obstetrics and Gynecology. 83 (3), 414-418 (1994).
- Ricci, S., Stone, R. L., Fader, A. N. Uterine leiomyosarcoma: Epidemiology, contemporary treatment strategies and the impact of uterine morcellation. Gynecologic Oncology. 145 (1), 208-216 (2017).
- Felix, A. S., et al. The etiology of uterine sarcomas: A pooled analysis of the epidemiology of endometrial cancer consortium. British Journal of Cancer. 108 (3), 727-734 (2013).
- Roberts, M. E., Aynardi, J. T., Chu, C. S. Uterine leiomyosarcoma: A review of the literature and update on management options. Gynecologic Oncology. 151 (3), 562-572 (2018).
- Schieda, N., et al. Gadolinium-Based Contrast Agents in Kidney Disease: A Comprehensive Review and Clinical Practice Guideline Issued by the Canadian Association of Radiologists. Canadian Journal of Kidney Health and Disease. 5, 1-17 (2018).
- Pyra, K., et al. Uterine artery embolization for the treatment of symptomatic uterine fibroids. (Embolizacja tętnic macicznych w leczeniu objawowych mięśniaków macicy). Postępy Nauk Medycznych. 28 (2), 88-94 (2015).
- Czuczwar, P., Stepniak, A., Milart, P., Paszkowski, T., Wozniak, S. Comparison of the influence of three fibroid treatment options: Supracervical hysterectomy, ulipristal acetate and uterine artery embolization on ovarian reserve - An observational study. Journal of Ovarian Research. 11 (1), (2018).
- Nocum, D. J., Robinson, J., Liang, E., Thompson, N., Reed, W. The factors contributing to the total radiation exposure of patients during uterine artery embolization. Journal of Medical Radiation Sciences. 66 (3), 200-211 (2019).
- Nikolic, B., Spies, J. B., Lundsten, M. J., Abbara, S. Patient radiation dose associated with uterine artery embolization. Radiology. 214 (1), 121-125 (2000).
- Colgan, T. J., et al. Pathologic features of uteri and leiomyomas following uterine artery embolization for leiomyomas. The American Journal of Surgical Pathology. 27 (2), 167-177 (2003).
- Weichert, W., et al. Uterine arterial embolization with tris-acryl gelatin microspheres: a histopathologic evaluation. The American Journal of Surgical Pathology. 29 (7), 955-961 (2005).
- Walker, W. J., Pelage, J. P. Uterine artery embolization for symptomatic fibroids: clinical results in 400 women with imaging follow up. BJOG An International Journal of Obstetrics and Gynaecology. 109 (11), 1262-1272 (2002).
- Ravina, J. H., Aymard, A., Ciraru-Vigneron, N., Clerissi, J., Merland, J. J. Uterine fibroids embolization: results about 454 cases. Gynécologie, Obstétrique & Fertilité. 31 (7-8), 597-605 (2003).
- Czuczwar, P., et al. Predicting the results of uterine artery embolization: Correlation between initial intramural fibroid volume and percentage volume decrease. Przeglad Menopauzalny. 13 (4), 247-252 (2014).
- Lohle, P. N. M., et al. Long-term Outcome of Uterine Artery Embolization for Symptomatic Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (3), 319-326 (2008).
- Walker, W. J., Barton-Smith, P. Long-term follow up of uterine artery embolization - An effective alternative in the treatment of fibroids. BJOG: An International Journal of Obstetrics and Gynaecology. 113 (4), 464-468 (2006).
- Czuczwar, P., et al. Influence of ulipristal acetate therapy compared with uterine artery embolization on fibroid volume and vascularity indices assessed by three-dimensional ultrasound: Prospective observational study. Ultrasound in Obstetrics and Gynecology. 45 (6), 744-750 (2015).
- Van Der Kooij, S. M., et al. Epidural analgesia versus patient-controlled analgesia for pain relief in uterine artery embolization for uterine fibroids: A decision analysis. CardioVascular and Interventional Radiology. 36 (6), 1514-1520 (2013).
- Pisco, J. M., et al. Pelvic Pain after Uterine Artery Embolization: A Prospective Randomized Study of Polyvinyl Alcohol Particles Mixed with Ketoprofen versus Bland Polyvinyl Alcohol Particles. Journal of Vascular and Interventional Radiology. 19 (11), 1537-1542 (2008).
- Pisco, J. M., et al. Uterine Artery Embolization under Electroacupuncture for Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 20 (7), 863-870 (2009).
- Pelage, J. P., et al. Uterine embolization. Journal de Radiologie. 81 (12), 1873-1874 (2000).
- Pelage, J. P., et al. Uterine Fibroid Vascularization and Clinical Relevance to Uterine Fibroid Embolization. RadioGraphics. 25, suppl 1 99-117 (2005).
- Siskin, G. P., et al. Outpatient uterine artery embolization for symptomatic uterine fibroids: Experience in 49 patients. Journal of Vascular and Interventional Radiology. 11 (3), 305-311 (2000).
- Salehi, M., Jalilian, N., Salehi, A., Ayazi, M. Clinical Efficacy and Complications of Uterine Artery Embolization in Symptomatic Uterine Fibroids. Global Journal of Health Science. 8 (7), (2015).
- Worthington-Kirsch, R., et al. The Fibroid Registry for outcomes data (FIBROID) for uterine embolization: Short-term outcomes. Obstetrics and Gynecology. 106 (1), 52-59 (2005).
- Paszkowski, T., et al. Uterine artery embolization - clinical problems. Polish Gynaecology. 84 (12), (2013).
- Spies, J. B., et al. Fibroid Registry Investigators. The FIBROID Registry: symptom and quality-of-life status 1 year after therapy. Obstetrics & Gynecology. 106 (6), 1309-1318 (2005).
- Chrisman, H. B., et al. The impact of uterine fibroid embolization on resumption of menses and ovarian function. Journal of Vascular and Interventional Radiology. 11 (6), 699-703 (2000).
- Maciel, C., Tang, Y. Z., Sahdev, A., Madureira, A. M., Vilares-Morgado, P. Preprocedural MRI and MRA in planning fibroid embolization. Diagnostic and Interventional Radiology. 23 (2), 163-171 (2017).
- Laughlin-Tommaso, S. K., et al. Clinical limitations of the International Federation of Gynecology and Obstetrics (FIGO) classification of uterine fibroids. International Journal of Gynecology and Obstetrics. 139 (2), 143-148 (2017).
- Vilos, G. A. Uterine fibroids: relationships to reproduction. Minerva Ginecologica. 55 (5), 417-423 (2003).
- McLucas, B. Pregnancy following uterine artery embolization: An update. Minimally Invasive Therapy and Allied Technologies. 22 (1), 39-44 (2013).
- Karlsen, K., Hrobjartsson, A., Korsholm, M., Mogensen, O., Humaidan, P., Ravn, P. Fertility after uterine artery embolization of fibroids: a systematic review. Archives of Gynecology and Obstetrics. 297 (1), 13-25 (2018).
- Margau, R., et al. Outcomes after Uterine Artery Embolization for Pedunculated Subserosal Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (5), 657-661 (2008).
- Spies, J. B., et al. The FIBROID registry: Symptom and quality-of-life status 1 year after therapy. Obstetrics and Gynecology. 106 (6), 1309-1318 (2005).
- Avilla-Hernandez, A., Singh, P. Epidural Anesthesia - StatPearls - NCBI Bookshelf. Statpearls. , 1(2019).
- Higgs, Z. C. J., Macafee, D. A. L., Braithwaite, B. D., Maxwell-Armstrong, C. A. The Seldinger technique: 50 Years on. Lancet. 366 (9494), 1407-1409 (2005).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography: A new technique. Acta Radiologica. 39 (5), 368-376 (1953).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены